Method Article
ウェル プレート用システムを挿入測定および透過性と膜の 3次元組織モデルにおける拡散のシミュレーションの方法
要約
膜の透磁率の定量方法挿入ウェル プレート用システム、インシリコパラメーターの最適化シミュレーションを用いた拡散係数の計算が表示されます。
要約
皮膚モデルの in vitro栽培ますます関連、製薬および化粧品用となっている物質のテストし同様、医薬品の開発にも使われて.これらのモデルは主に不可欠な要因別の物質への透過性の膜挿入システムで耕されます。通常、これらのパラメーターを決定するための応用法は、通常大規模なサンプル サイズ (例えば、フランツ ・拡散セル) または骨の折れる機器 (例えば、(FRAP) 退色後蛍光回復) が必要です。本研究は 4.26 〜 12.2 mm (栽培面積) の直径サイズの膜挿入システムに直接透水係数を決定する方法を示します。メソッドは、アガロース、コラーゲン ・ ゲル、皮膚モデルを表すコラーゲン細胞モデルと検証されました。さまざまな分子サイズと異なる細胞モデル (HaCaT、線維芽細胞は、コラーゲン ・ ゲルから成る) の透過特性を持つ物質の浸透プロセスは、正確に記述されていた。
また、上記の実験的方法をサポートするため、シミュレーションが設立されました。ストークス半径 m 14 × 10-10に分子サイズが小さい物質についても実験データにフィットまでシミュレーション (4,000 MW)、されるため、システムを記述するための有望なツール。また、シミュレーション実験努力をかなり減らすことができます、拡張またはより複雑なセットアップに適合する十分な堅牢です。
概要
オルガノ典型的な 3 D 培養医薬品開発とテスト1の物質の強力なツールとなっています。この点で、ヒト皮膚モデルなど、化粧品業界の規制要件により特別な関心です。彼らはその後として独自の単一器官培養ウェル プレート、または追加臓器モデル、例えば、肝2との組み合わせで多 organ チップのいずれかの使用のための多数の 3 D 皮膚モデルの開発につながっています。
肌と同等の栽培に関して気液界面 (ALI) は、適切な表皮分化3の重要な要素です。下部に液体透過性膜で容器から成る細胞文化挿入は、アリを確立する通常使用されます。ALIs は、12 ウェル (径 12.2 mm) まで表皮4Phenion5Episkin6、96 ウェル (4.26 直径 mm) からサイズの皮膚モデルの文化など市販の皮膚モデルに広く使用されています。ここで説明したメソッドは、膜挿入における物質の透過を決定します。
透水係数、培養皮膚モデルは、ネイティブの皮膚5と比較しての品質を評価する重要なパラメーターであるし、どのように迅速に評価するために使用される活性物質が皮膚を通して移行します。薬や化粧品の製品は、皮膚に適用する必要があります、特に場合は、このパラメーターは正確に活性剤がそれを通過するときに理解しておく必要。シミュレーション システムの挙動を予測し、必要な時間のかかる実験努力を減らすに助けることができるさらに、物質が関与している大口の場合は特に。
フランツ ・拡散セルは、透過実験皮膚および皮膚モデル5,6,7,8,9に芸術の状態です。このデバイスは、固定サンプル (拡散障壁) と 2 つのコンパートメントの間で構成されます。テストする物質がサンプル (ドナー コンパートメント) の上部に直接適用され、反対 (受容体) のコンパートメントに浸透の化合物の濃度を検出できます。アクセプタ側では、一定の温度と同種の物質濃度は温度チャンバー、マグネチックスターラーを保障されます。サンプルは、アクセプタ側でフランツ ・ セルのサンプリング アームから撮影することができます。179 cm と 19 cm の高さ範囲でこのシステムは比較的大きい10,11です。ゲル状物質や組織の拡散係数測定のための別の方法は、縛る。この手法の原理を使用漂白蛍光粒子ゲルと、漂白の領域の回復時間を決定するラベルの付いた拡散係数12,13,14を計算します。
さらに、皮膚15,16物質の浸透過程を決定するために、赤外光の吸光度と粒子の動きを検出するフーリエ変換赤外線 (FTIR) 分光法を使用できます。ただし、これらやその他のイメージングの方法 (例えば、2 光子蛍光相関分光法17) 集中的な楽器の費用必要があります。
この記事で手法を提案直接測定する膜挿入システム内の障壁の透過性皮膚モデルが栽培することができます。このメソッドは、小さなサンプル (よく 4.26 mm までサイズ) の数が多いとコンパクトなシステムで実行される透過性実験できます。これはフランツ ・拡散セル、別のデバイスが、デバイスにマウントするには、それぞれのプローブが必要し、小さなサンプル (4.26 mm サイズ) を実現することは困難ですのとは対照的です。さらに、メソッドは、主要なインストルメンテーション (例えば、共焦点または多光子顕微鏡) を必要としない、時間とコストの削減が達成されました。
多孔膜の実験を行ったすべては agarose のゲルまたは膜上確立されたコラーゲン細胞モデルから成るシステム サンプル (バリア) を挿入します。分子サイズが異なる蛍光物質 (ドナー) は、サンプルの上部に適用され、蛍光プレート リーダーを使用して下部 (受容体) に浸透物質の濃度が検出されました (図 1参照)。メソッドを検証し、このシミュレーションの精度をテストするために agarose のゲルが生成され、障壁として使用します。ヒドロゲルは、一般的に生物科学13多孔質媒質中の拡散と浸透のプロセスの調査のために使用されます。簡略化された皮膚モデル18,19 である一次繊維芽細胞とひと成人低カルシウム高温ケラチノ サイト (HaCaT) 細胞 (細胞マトリックス モデル)、コラーゲン マトリックスから成るセル シード システムの試験方法.
さらに、浸透プロセス フロー数値流体力学シミュレーションによるシミュレートしました。パラメーター最適化による拡散係数が実験データから計算することが分かった。一般に、このシミュレーションは、異なるアプリケーションを提供しています例えば、短い実験に基づく透過過程を予測することが可能だし、シミュレーションが実験の数を大幅に削減できます。
具体的には、2 ・ オルガン ・ チップ (2 OC) が開発市販1,22、実験とシミュレーションがオルガン オンチップ システム1,20,21にアプリケーションの設計されていた 23,24,25。原則として、膜挿入システムに基づく任意の臓器モデルの浸透プロセスはこの方法で記述することができます。
プロトコル
1. 透水性研究サンプルの準備
注: 透過計測とシミュレーションを確認するために agarose のゲルまたは皮膚モデルの栽培に基づく細胞マトリックス モデルで構成されるサンプルが使用されました。
- Agarose のゲル
- (二重蒸留水) H2O の 10 mL の agarose 高分解能粉末の 0.2 g を溶解します。
- ソリューションをミックスし、80 ° C に加熱8 分間温度を維持します。
- 96 ウェル膜挿入システム (4.26 mm 径) の膜に 28.6 μ L agarose のゲルを適用または使用 226 μ 12 よく膜挿入システム (直径 12 mm) (例えば、Transwell システム)。
- ゲルが固化するまでに 10 分を待ちます。
- コラーゲン ゲル
注: 無菌条件の下ですべての手順を実行、ソリューションがコラーゲン ・ ゲルの重合を遅く氷の上に保持されます。- 1 ml の 0.4% コラーゲン R ソリューション (ラット尾コラーゲン) のミックス 125 μ のハンクス平衡塩ソリューション (HBSS)。
- 黄色から赤色に変わり、フェノールレッドの色まで 1 M NaOH (水酸化ナトリウム) (〜 6 μ L) でソリューションを滴定しなさい。
- コラーゲン ・ ゲルをダルベッコ変更イーグル培地 (DMEM) + 10% 牛胎児血清 (FCS) の 125 μ L を加え、ピペット チップを慎重に混ぜます。
- 96 ウェル膜挿入システムまたは 12 ウェル膜挿入システムの 226 μ の膜にコラーゲン ・ ゲルの 28.6 μ L を適用します。
- 30 分 (37 ° C、5% CO2) インキュベーターでゲルを残します。
- 線維芽細胞とコラーゲン細胞モデル
注: すべての手順は、無菌条件の下で実行されます。- 実験の前に 5-7 日一次繊維芽細胞を準備します。DMEM + 細胞培養フラスコ (75 cm2) で 10 %fcs と線維芽細胞を育成し、2-3 日毎に媒体を変更します。
注: 実験のセットアップによって細胞の多数使用できます。 - 細胞培養用フラスコ (80% 合流) からメディアを取り出して、リン酸緩衝生理食塩水 (PBS) 10 mL (培養フラスコ 75 cm2) で 2 回洗います。0.05% の 3 mL を加えてトリプシン/エチレンジアミン四酢酸 (EDTA)、37 ° C で 3 分間インキュベート
- 表面から細胞をデタッチする培養用フラスコを軽くタップします。DMEM + 10 %fcs の 3 mL の追加によって反作用を停止します。遠心管にソリューションを転送します。
- (120 g) x 細胞懸濁液を遠心、上清を除去、DMEM + 10 %fcs の 0.5 mL で細胞を再懸濁します。
- セルをカウントし、0.5 × 106セル/mL の濃度に調整します。
注: 次の手順は、コラーゲン ・ ゲルの重合を遅く氷で実行されます。 - ミックス 125 μ HBSS 0.4% コラーゲン R 溶液 1 mL とします。
- 1 M NaOH でソリューションを滴定しなさい (〜 6 μ L) まで、フェノールレッドの色が黄色から赤に変化します。
- 細胞懸濁液を 125 μ l 添加 (DMEM 10 %fcs + 0.5 × 106セル/mL) コラーゲン ゲルし、ピペットを慎重に混ぜて。
- 96 ウェル膜挿入システムまたは 12 ウェル膜挿入システムの 226 μ の膜にコラーゲン ・ ゲルの 28.6 μ L を適用します。
- 30 分 (37 ° C、5% CO2) インキュベーターでゲルを残します。
- DMEM + 10 %fcs の 75 μ L をゲルの表面適用、96 ウェル膜の受信機のプレートに 300 μ L がシステムを挿入します。12 ウェル膜挿入システム、受信板の表面と 1,846 μ L 590 μ L のボリュームを使用します。
- 細胞マトリックス モデル (空輸) の面からメディアを削除し、7 日間インキュベート細胞マトリックス モデルをさらに。下に 100 μ l の培地を使用し、毎日媒体を変更します。
- 実験の前に 5-7 日一次繊維芽細胞を準備します。DMEM + 細胞培養フラスコ (75 cm2) で 10 %fcs と線維芽細胞を育成し、2-3 日毎に媒体を変更します。
- コラーゲン HaCaT 細胞モデル
注: すべての手順は、無菌条件の下で実行されます。- HaCaT を準備する前に、次の手順 5-7 日。DMEM + 細胞培養用フラスコ (75 mm2) で 5% の FCS HaCaT を育成し、2-3 日毎に媒体を変更します。
注: 実験のセットアップによって細胞の多数使用できます。 - フラスコからメディアを取り出して、10 mL (培養フラスコ 75 cm2) の PBS で 2 回洗います。0.05% の 3 mL を加えてトリプシン EDTA/37 ° C で 10 分間インキュベートし、DMEM + 10 %fcs の 3 mL で反応を停止します。遠心管にソリューションを転送します。
- (120 g) x 細胞懸濁液を遠心上清を削除し、DMEM + 10 %fcs の 0.5 mL で細胞を再懸濁します。
- セルをカウントし、0.5 × 106セル/mL の濃度に調整します。
注: 次の手順は、コラーゲン ・ ゲルの重合を遅く氷で実行されます。 - ミックス 125 μ HBSS 0.4% コラーゲン R 溶液 1 mL とします。
- 1 M NaOH でソリューションを滴定しなさい (〜 6 μ L) まで、フェノールレッドの色が黄色から赤に変化します。
- コラーゲン ・ ゲルに DMEM + 10 %fcs の 125 μ L を追加し、ピペット慎重に混ぜます。
- 96 ウェル膜挿入システムまたは 12 ウェル膜挿入システムの 226 μ の膜に細胞懸濁液の 28.6 μ L を適用します。
- 30 分 (37 ° C、5% CO2) インキュベーターでゲルを残します。
- 細胞懸濁液の 75 μ L をゲルの表面に適用し、300 μ L DMEM + 96 ウェル膜の受信機のプレートに 10 %fcs の挿入システムを追加します。12 ウェル膜システムを挿入、DMEM + 受信機板 10 %fcs の表面と 1,846 μ L 590 μ L 細胞懸濁液の量を使用します。
- 3 日間インキュベート細胞マトリックス モデル2 日後、媒体を交換します。
- セル行列模型の表面からメディアを削除し、さらに 7 日間インキュベート細胞マトリックス モデル。下に 100 μ l の培地を使用し、毎日媒体を変更します。
- HaCaT を準備する前に、次の手順 5-7 日。DMEM + 細胞培養用フラスコ (75 mm2) で 5% の FCS HaCaT を育成し、2-3 日毎に媒体を変更します。
- 線維芽細胞と HaCaT コラーゲン細胞モデル
注: すべての手順は、コラーゲン ・ ゲルの重合を遅く氷の無菌条件の下で実行されます。1.3.5、ステップまで手順 1.3 で説明するように、線維芽細胞を準備し、後 HaCaT に従ってステップ 1.4 1.4.4 のステップまで日を準備します。- ミックス 125 μ HBSS 0.4% コラーゲン R 溶液 1 mL に。
- 1 M NaOH でソリューションを中和する (〜 6 μ L) フェノールレッドの色が黄色から赤紫に変わるまで。
- DMEM から成る一次線維芽細胞細胞懸濁液を 125 μ l 添加 + 10 %fcs + 0.5 × 106セル/mL コラーゲンにゲルし慎重に混ぜます。
- 96 ウェル膜挿入システムまたは 12 ウェル膜挿入システムの 226 μ の膜に細胞懸濁液の 28.6 μ L を適用します。
- 30 分 (37 ° C、5% CO2) インキュベーターでゲルを残します。
- 次に、ゲルの表面や 96 ウェルの膜挿入システムの受信機のプレート上に 300 μ L に DMEM + 10 %fcs の 75 μ L を適用します。12 ウェル膜挿入システム、受信機板の表面と 1,846 μ L の体積 590 μ L を使用します。
- 37 ° C、5% CO2で 1 日間インキュベートします。
- 表面からメディアを削除し、0.5 × 106セル/mL と HaCaT 細胞懸濁液を追加します。ボリュームは、1.5.6 のステップの下で前に説明したと同じです。
- 3 日間インキュベート細胞マトリックス モデル2 日後、媒体を交換します。
- セル行列模型の表面からメディアを削除し、さらに 7 日間インキュベート細胞マトリックス モデル。下に 100 μ l の培地を使用し、毎日媒体を変更します。
注: この調査 3 ゲル/セル ・ モデルのサンプルは 12 ウェル膜挿入システムの作製した.96 ウェル膜システムを挿入、ゲル/細胞モデルの 6 サンプルを使いました。統計的手段 3 サンプルが一般的です。しかし、障害や細胞培養のための偏差はコラーゲン マトリックス モデル 96 ウェル膜挿入システムの実験のために期待されます。したがって、我々 はサンプルの大きい番号を選んだ。
2. 透水性膜研究挿入システム
-
ドナー物質
注: 2 つのフルオレセイン ナトリウム塩 (NaFl) が生成されます。- NaFl を H2O の 0.1 mg/mL と 0.01 mg/mL の濃度に溶かしてください。異なるフルオレセイン イソチオ シアン酸-メンブラン (FD) 4,000、10,000、20,000、40,000 g/mol の分子量は H2O 2 mg/mL の濃度に分解しました。Agarose のゲルと透過性実験 (図 1参照) のためのドナー物質としてこれらのソリューションを使用します。
- コラーゲン細胞のモデルでは、セットアップ、DMEM + 水の代わりに 10 %fcs とすべてのソリューションを準備します。
注: は、ドナー物質の貯蔵液 (高濃度 x 10) を準備します。ドナー濃度のわずかな変化は透過性実験の結果に影響を与えます。
-
実験方法
注: 透過性実験は 37 ° C、湿度 > 90% で実行されます。このパラメーターは、細胞の生存率を保証します。温度は拡散プロセスの影響を与える agarose のゲル、コラーゲン ・ ゲル、コラーゲン細胞モデルと実験で同じパラメーターを使用します。ブラケットのボリュームの情報は、12 ウェル膜挿入システムを指します。- 96 - (または 12) よく膜を準備 agarose から成るバリア挿入システム (プロトコルの 1.1 を参照してください) をゲルまたはセルのモデル (1.2 〜 1.5 のプロトコルを見なさい) および蛍光ドナー物質。
- 準備の 1:10、1:20、希釈標準曲線を確立するためにドナー物質の 1:320、1: 160、ホームキット 1:40。300 μ L (1,846 μ L) 受信機板の 3 つ井戸におけるすべての希釈ピペットします。12 ウェル膜システム用受信機別プレートを挿入します。シリアルの希薄を使用同等濃度 [mg/mL] に測定された蛍光 [RFU] を変換します。
- 75 μ L (590 μ L) サンプル (agarose のゲルまたは細胞モデル) の上にドナーの物質と受容体物質の 300 μ L (1,846 μ L) を追加 (H2O または DMEM + 10 %fcs) 受信機の板で (図 1参照)。
注: は、膜内の液体の表面システムを挿入レシーバー プレートで静水圧を避けるために同じレベルを持っていることを確認します。 - インキュベーターのシェーカーにシステム全体を転送します。均一な混合を達成するために振動を調整 (合計ストローク軌道が 1.5 mm、速度の調整の回転に関連しているレベル 3.5 で 〜 480 1/min) 拡散プロセスに影響を与える濃度勾配を避けるために。
- 蛍光定期的にすべての時間を決定します。蛍光を測定するには、空板膜挿入システムに転送し、蛍光プレート リーダーを使用して受信機を測定します。励起波長 485 nm と 535 の放出を使用して蛍光の nm。
- 5 時間の実験を実行します。
注: 実験中に液体はシステム全体から蒸発します。蒸発はドナーとアクセプタ濃度を変更し、結果に影響を与えます。この効果は、5 h ですが考慮すべき実行時間の長い実行時間の場合無視されます。
-
透水係数の計算
- 標準曲線を確立するには、濃度とシリアルの希薄の蛍光をプロットし、データを線形回帰を実行します。
- 透過実験の蛍光データ濃度に変換するのに線形回帰直線の傾きを使用します。シミュレーションを目的として mol/m3の単位に変換します。
- 時間をかけて機能として濃度をプロットし、(図 2参照) データの線形セグメントを確立します。
- この直線部分の傾きを決定し、次の式によると透水係数を計算 (図 2の例を参照してください)。
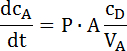
ここ dcA/dt はアクセプタ側では、含まれる化学物質の濃度の経年変化 (斜面)。CDはドナー側の濃度P は透水係数;A は透過面と VAは受容体のボリューム。この同等化は Fick の最初の法律から派生したときのみ適用できます、CD » CA6,22。 - 注: ドナー濃度は、受容体の検出濃度よりはるかに高いする必要があります。これは実験のセットアップで確認されました。
3. シミュレーション
注: シミュレーションは COMSOL Multiphysics 5.1 で行われました。この基本的な知識を想定しています。拡散シミュレーションの次の前提条件を作られています: (a) H2O の物質の拡散係数はゲルと比較するとはるかに高い。この差を補うためには、シミュレーションは、2% アガロースゲル NaFl の拡散係数と比較して 100 に 10 の要因によってより高いですが 1 × 10-9 m2/s の値を使用します。(b) 実験では、物質は障壁を通って拡散し、膜の膜を通してシステムを挿入します。実験のセットアップと対照をなして仮想 agarose のゲルまたはセルのマトリックスと膜は 1 つの均質な相であることと見なされます。(c) 境界に及ぼす壁は「スリップ」壁すべての滑り効果に設定されます (液体とゲルや液体、細胞間ではなくモデル) の膜挿入システム無視し、拡散過程の重要ではないです。
- 拡散シミュレーションの設定
注: これらの手順は、透過性実験のシミュレーションのセットアップを示してください。96 ウェルおよび 12 膜挿入システムのシミュレーションが個別にセットアップされました。「化学種輸送」モジュールは、拡散のフィックの第 2 法則に基づく数式を使用してください。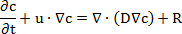
c は物質の濃度、t は時間、u は速度、D は拡散係数、R は反応速度。拡散過程の化学反応が発生しなかったために、反応速度がなおざりにされていた。- プログラムを開くし、新しいモデルを開始します。選んだ選択 3 D モデル「モデル ウィザード」は、トランスポート希釈種」プルダウン ・ メニューで物理インターフェイスに「研究」をクリックして、「時間依存」のスタディを選択、"Done"をクリックしていますを追加します。
- 「グローバル定義」に移動し、右クリックで「パラメーター」を追加。グリッドで幾何学的および物理的なパラメーターを入力してください (表 1表 2、および図 3 eを参照)。
注: 96 ウェル膜挿入システムに agarose のゲルの凹面の表面は、浸漬ボールで近似されました。 - 実験から膜挿入システムのジオメトリを設定します。ステップ 3.2 で 96 ウェル膜挿入システムの幾何学を構築する方法の例です。長さの単位を設定するメーター。
注: 計算時間を節約する全体のジオメトリを作成しないこと。代わりに、ジオメトリはジオメトリの四分の一の中心線を使用して減らすことが (図 3aおよび図 3 bを参照)。 - 「定義」(右「定義」をクリックし「プローブ」を検索) に 2 つの「ドメイン プローブ」を追加しドナー ドメインとして他のアクセプター ドメインと 1 つのプローブを選択します。両方の「平均的」とユニット「mol/m3」式"c"タイプを選択します。
注: この手順はオプションであり、シミュレーション中にアクセプタとドナーの濃度を示しています。 - トランスポート プロパティ 1」で"希薄化後種""Dif_w"の輸送における拡散係数 (Dc) を設定.
メモ:「トランスポート プロパティ 1」は、アクセプタとドナーの両方のドメインに対して使用されます。次の手順でバリア ドメインが上書きされます。 - 「希釈種の輸送」の 2 番目の「トランスポート プロパティ 2」を右クリックを追加し、「ドメインの選択」でバリア (2) を選択します。シミュレーションの目的に応じて障壁の値またはダミー変数"D"として、拡散係数を設定できます。最初のテストの実行の 2E 10 m2/s の値を設定します。
注:"D"は、ステップ 3.3 に後で宣言されます。 - 「トランスポートの希釈種」の「1「初期値ゼロとしての濃度の定義。
注:「初期値 1」バリアとアクセプタのドメインに対して使用されます。次の手順では、ドナー ドメインが上書きされます。 - 「希釈種の輸送」の 2 番目の"初期値 2"を右クリックを追加し、ドメインとしてドナー (3) を選択します。ドナーの物質 (例えば表 2 から C_fl) の初期濃度濃度を設定します。
- 「希釈の種の輸送」の上で右クリックで「対称 1」を追加追加、全体の形状を反映した「境界選択」のすべての表面を選択 (3.2 でジオメトリの例、それは境界番号 1、2、4、5、7、8)。
注: 全体の形状が設定されている場合は、この点を無視できます。 - 「メッシュ」上で右クリック 2 つ"無料四面体」を追加します。ドメイン (「ドメイン」に変更ジオメトリ エンティティ レベル)、バリア (2) を選択します。上の右クリックで「サイズ」を追加「無料四面体 1"と定義済みのメッシュの"細かい"12 ウェル膜挿入システムまたは「極細」96 ウェル膜挿入システム。
- 挿入システムのドメインと 12 ウェル膜の定義済みメッシュ「普通」または「細かい」96 ウェル膜挿入システムはアクセプターと提供者にで、2 回目「無料四面体」選択 (図 3 の cと3 d の図を参照)。
注: 計算時間を節約する粗いメッシュを選択することが可能ですも。これは、結果の精度を削減可能性があります。ジオメトリをメッシュに「メッシュ設定」で「すべてビルド」をクリックします。 - 「計算」でシミュレーションを開始、「研究 1」。
- ジオメトリの設定例
注: ここで例が (凹面関門) 96 ウェル膜挿入系のジオメトリを設定する方法のあります。すべての手順は、プログラムのジオメトリのモジュールで実行されます。長さの単位を設定するメーター。- D_w/2 と h_a + 硬度 h_sp の高さの半径を持つシリンダー 1 (「幾何学 1」上で右クリック) を生成します。
- D_tran/2、h_sp の硬度 + h_a、および z 位置の高さの半径を持つシリンダー 2 を生成します。
- 「違い」オプションを使用して (上で右クリック「ジオメトリ 1"、「ブール値、パーティション」を検索) シリンダー シリンダー 1 から 2 を減算します。「オブジェクトを追加する」を選択"cyl1"は、「オブジェクトを減算する」をアクティブにし、、"cyl2"を選んだ。新しいボリュームは、受容体のジオメトリです。
- D_a/2 の半径は、硬度の高さ、h_sp の位置の z のシリンダー 3 を生成します。
- 半径 r および z 位置のヘイズの球 1 を生成します。
- シリンダー 3 (cyl3) から球 1 (sph1) を減算するのに「違い」オプションを使用します。新しいボリュームが違い 2 と呼ばれます。
- D_a/2 の半径、ホブ切歯車 + h_a の高さの 4 シリンダーを生成し、h_sp の z を配置します。
- 「違い」オプションを使用して、違い 2 からシリンダー 4 (cyl4) を減算。新しいボリュームは、受容体のジオメトリです。
- バリア (agarose ゲルまたはセルのモデル実験) を構築する手順 3.2.4-3.2.6 を繰り返します。
- (右の「幾何学 1」をクリックして検索「ブール値、パーティション」) すべてのジオメトリ要素の連合 1 を作る。
- 1 d_tran の長さに設定すべてのエッジを持つブロックを生成 * 2 の位置の - d_tran と d_tran の y x * 2。
- D_tran のすべてのエッジの長さと 2 ブロックを生成 * 2、位置 x - d_tran * 2 と d_tran の y。
- 連合 1 ブロック 1 からを減算し、2 をブロックする「違い」オプションを使用します。
- パラメーター最適化をシミュレーションに追加します。
注: パラメーター最適化の助けを借りて、拡散係数は前回作成した実験的データに装着可能します。拡散シミュレーションに最適化の一部を統合する方法を次に説明します。拡散シミュレーションは、次の手順を開始する前に動作確認します。- 「最適化」「下剤を追加"を使用しての物理モジュールを追加 (最適化については、カテゴリ「最適化と感性」で「数学」で見つけることが) シミュレーション。「コンポーネントの追加」をクリックします。
- 「変数」との「定義」(コンポーネントのローカル) を右クリックして、表 3から変数の型を追加します。
注: パラメーターの最適化を使用して、実数値、すなわち、拡散係数の要因 1-10を別個に定義する必要があります。 - オペレーター名「アクセプタ」で「定義」「結合コンポーネント」セクションでの種類を右クリックで「平均 1」を追加。
- 実験データを含む別のテキスト ドキュメントを生成します。
メモ: セミコロンで区切ります列;改行は行を分離します。時間宣言は秒単位 mol/m3の濃度で測定されます。最初を削除し、2 番目のデータ ポイント遅れ位相で (図 2を参照) できるエラーを回避する実験。ここでは、テキスト ドキュメントのようになりますどのように例です。
3540; 0.00216
7140; 0.00724
12240; 0.01707
15180; 0.02230
18660; 0.02697
21540; 0.02931
この例は、シミュレーションをテストする使用できます。 - 「グローバル最小二乗目的」右クリックで「最適化」を追加、「実験データ」にステップ 3.3.4 からテキスト ドキュメントを添付として最初の列を定義する"時間列 1" を右クリックして"世界最小二乗目的"ととして 2 番目の列「列 1 の値」と「世界最小二乗目的」右クリックします。「列の値」の中の「表現」は、変数の"C"を入力します。
- 「グローバル コントロール変数 1」と「最適化」を右クリックし、初期値"1"、下限値「0」上限「1000」と変数として宣言して"D_search"を追加します。
- 追加右クリックで「最適化」「研究 1」と最適化ソルバーのメソッドとして"SNOPT"を選んだ。1E 9 に最適性許容値を設定します。
注: シミュレーションが収束しなかった場合は、最適性トレランスを向上します。シミュレーションは最適性許容値が大きすぎる場合は正確なことに注意してください。 - 「研究」で「計算」とパラメーターの最適化を開始します。"D"として障壁の拡散係数を設定することを忘れないでください。
結果
シミュレーションの精度を評価するために障壁を行った 96 ウェル膜透過実験 2% アガロースゲル システムを挿入します。フルオレセイン ナトリウム塩 (NaFl) とフルオレセイン イソチオ シアン酸メンブラン (FD) は、45 × 10-10 m ストークス半径 (376.27 40,000 mol wt) を 5 × 10-10 m から拡散物質の分子の大きさの影響を確認する使用されました。シミュレーションのネイティブのパラメーター最適化シミュレーションを実験データに合うように使用されました。
そのために、シミュレートされた透磁率の線形部分だけの斜面は実験結果と比較しました。小さい分子サイズのシミュレーションと実験データよく一致した NaFl の 99.2% と FD 4,000 80.2% (図 4 aと4 b を図参照)。大きな分子サイズには、FD の 10,000 の 50.5%、FD 20,000 の 79.7%、FD 40,000 53.6% の相関を示す高い偏差が生成されます。シミュレーションでカーブ進行を示した (図 4 c-4e参照) グラフの一層のコースの強力な上昇そして初めに遅延。
透水係数とシミュレートされた拡散係数が表示されます表 4.透過係数は分子サイズの増加と共に減少します。標準偏差は 10-8 m/s × 0.47 0.08 × 10-8 m/s とあった (N = 7)、4.18% 46.15% の間の絶対的な誤差に対応しました。大きい分子の実験は誤差の絶対値の大きいを示した。シミュレートされた拡散係数は実験的透水係数に非常に同じように振る舞った。大きなストークス半径をもつ物質減少の拡散係数と 9.09%、18.46% の間であった絶対誤差を示した (N = 3)。
追加透過実験 12 ウェルの膜でバリア挿入システム、4 つの異なるコラーゲン細胞モデル タイプが使用されました。これらのモデルは、携帯無料モデルと表面にコラーゲン ・ ゲルと HaCaT 主線維芽細胞の異なる組み合わせで細胞モデルを構成します。次の組み合わせが使用された: 携帯無料モデル コラーゲン + 線維芽細胞 (大佐 + f.) として (大佐) コラーゲン コラーゲン HaCaT (大佐 + h.) やコラーゲン + 線維芽細胞 + HaCaT (大佐 + F. + 時間)。フルオレセイン ナトリウム塩 DMEM + 10 %fcs とは、ドナーの物質として使用されました。イメージのヘマトキシリンとエオシン (HE) 染色コラーゲン細胞モデルの解析が使用されました。この染色を行ったメーカーのプロトコルを使用しています。図 5代表的な大佐 + F. + H. モデルが付いているそのような汚れが表示されます。彼は、コラーゲン マトリックスの組織構造を若干汚れ。マトリックスで、繊維芽細胞がある、濃い紫の線維芽細胞と細胞の核が染色します。コラーゲン マトリックス上に HaCaTs は、モデルの上にそれを囲む層を構築の核となるべき多くの核を含む層があります。
テーブル 5、実験的透過係数とシミュレートされた拡散係数が記載されています。HaCaT なしモデルと比較してより低い浸透・拡散係数を有する HaCaT、モデルのほとんどのための傾向を見ることができます。透過係数の絶対誤差は 10.9 24.4% との拡散係数 5.2% 12.9%。
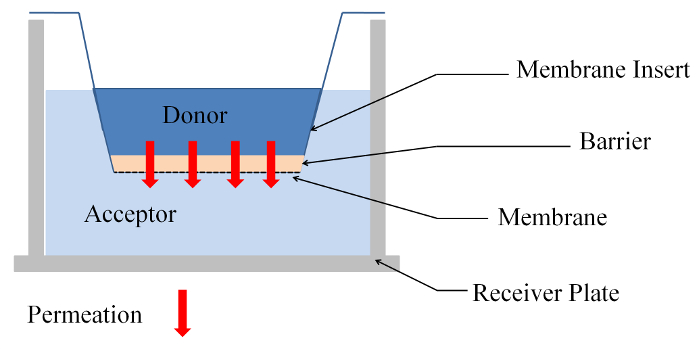
図 1: 膜透過性実験の側面がシステムを挿入します。この図の拡大版を表示するのにはここをクリックしてください。
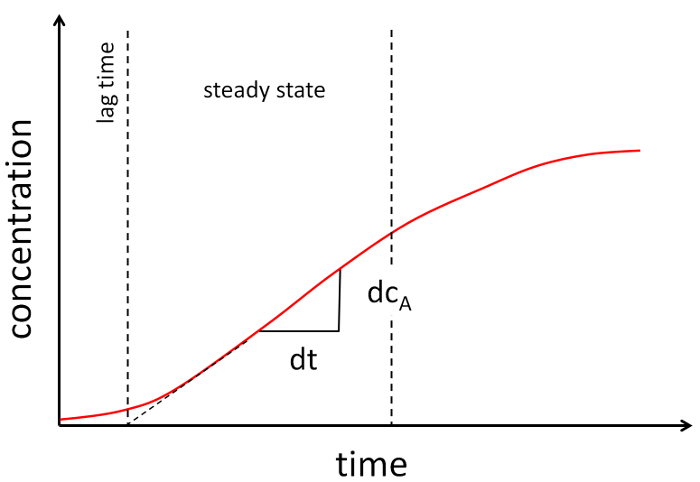
図 2: 透過性実験の模範的なグラフ。受容体の濃度は、時間をかけて印刷されます。2 本の破線は、ほぼ線形グラフ部をブラケットします。直線部分の傾きは、透水係数を決定するために使用されます。この図の拡大版を表示するのにはここをクリックしてください。
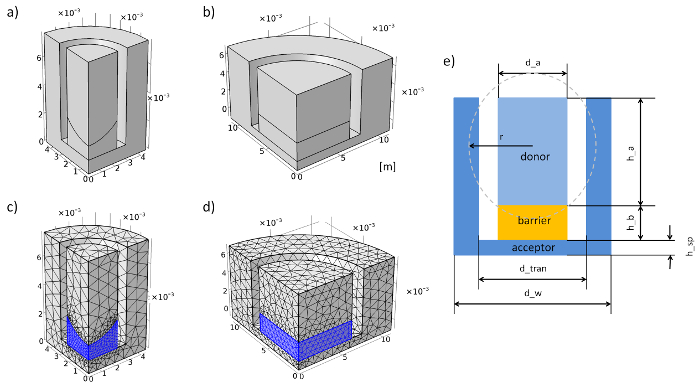
図 3: ジオメトリおよびメッシュ膜のシミュレーション システムを挿入します。(、) 96 ウェル膜のジオメトリの挿入システム。12 ウェル膜の幾何学 (b) 挿入システム。(c) 96 ウェル膜のメッシュ挿入システム。(d) 12 ウェル膜のメッシュ挿入システム。(e) 断面と膜のパラメーター挿入システム。この図の拡大版を表示するのにはここをクリックしてください。
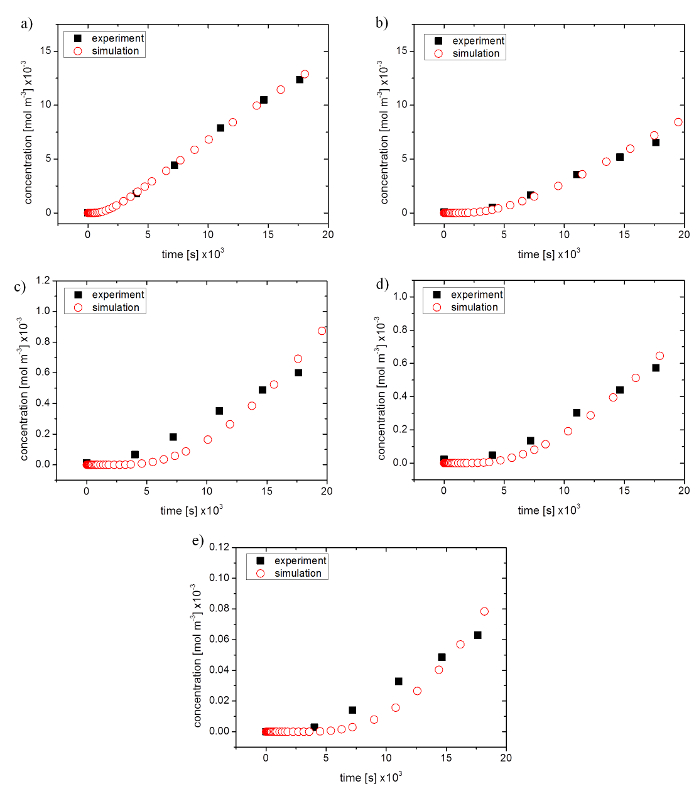
図 4: 透過実験から最適化シミュレーションの実験データの比較します。(e) 40,000 モル重量、(d) 20,000 モル重量 10,000 (c) mol の重量 (b) フルオレセイン イソチオ シアン酸デキストラン 4,000 モル重量 (、) フルオレセイン ナトリウム塩この図の拡大版を表示するのにはここをクリックしてください。
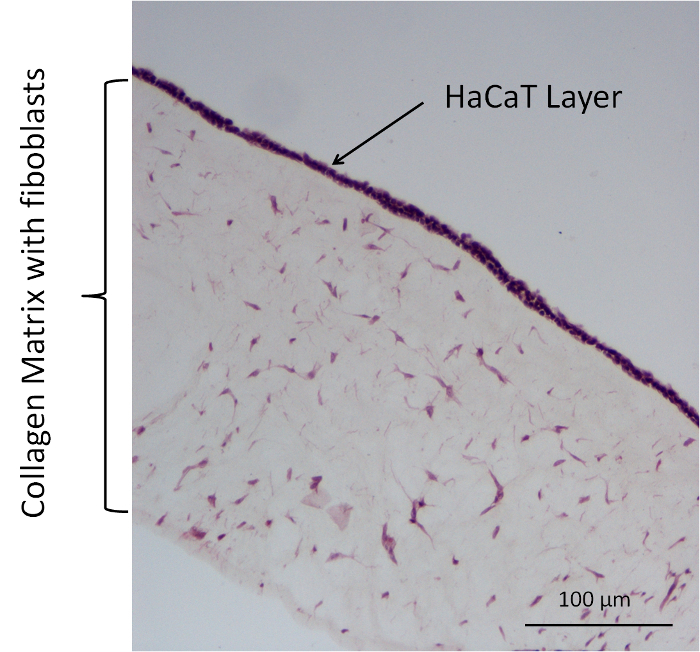
図 5: 代表者彼のコラーゲン細胞モデル (コラーゲン + 線維芽細胞 + HaCaT) 染色します。この図の拡大版を表示するのにはここをクリックしてください。
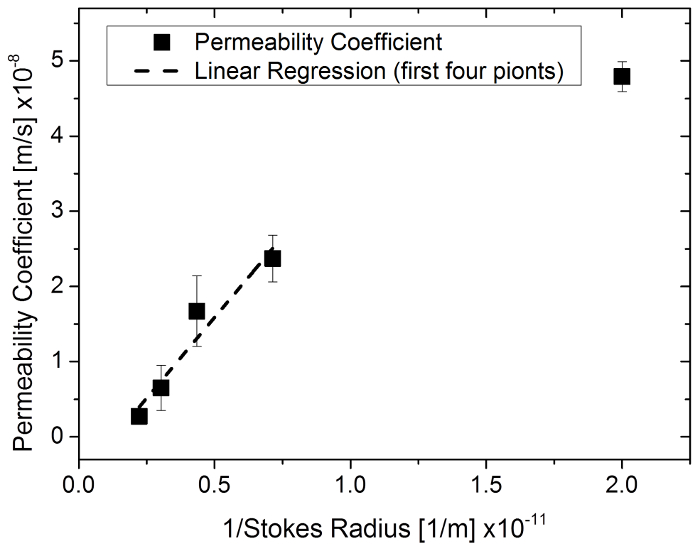
図 6: 96 ウェル膜でフルオレセイン ナトリウム塩とフルオレセイン イソチオ シアン酸デキストランの使用 1/ストークス半径の関数としての透水係数は、システムを挿入します。この図の拡大版を表示するのにはここをクリックしてください。
| 名 | Mm 96 よくシステムの表現 | 12 ウェル用 mm で発現 | 説明 |
| d_tran | 5.65 [mm] | 14.7 [mm] | 井戸の直径 |
| d_a | 4.26 [mm] | 12.1 [mm] | 膜の直径 |
| d_w | 8.79 [mm] | 21.97 [mm] | 受容体の直径 |
| ホブ | 2 [mm] | 2 [mm] | 障壁の高さ |
| h_sp | 1 [mm] | 1 [mm] | 距離間も上下 |
| h_a | 4.73 [mm] | 5.24 [mm] | 受容体の高 |
| b | 硬度/2 | - | 浸漬深さ |
| r | ((d_a)^2+4*b^2)/(8*b) | - | 浸漬ボール+の半径 |
| ヘイズ | r + 硬度 | - | 浸漬ボール+の z 位置 |
表 1:「化学種輸送」シミュレーションの幾何学パラメーター 。+アガロースのシミュレーション用にのみ 96 よく膜のゲルはシステムを挿入します。
| 名 | 式 | 値 | 説明 |
| C_fl | 0.1 [mg/ml]/376.28 [g/mol] | 0.26576 mol/m2 | Fl.So の濃度です。 |
| C_4 植物 | 2 [mg/ml]/4000 [g/mol] | 0.5 mol/m 2 | FD 4.000 の濃度 |
| C_10 | 2 [mg/ml]/10000 [g/mol] | 0.2 mol/m 2 | FD 10.000 の濃度 |
| C_20 | 2 [mg/ml]/[g/mol] 20000 | 0.1 mol/m 2 | FD 20.000 の濃度 |
| C_40 | 2 [mg/ml]/[g/mol] 40000 | 0.05 mol/m 2 | FD 40.000 の濃度 |
| Dif_w | 1e-9 [m ^2/s] | 1E-9 m2/s | 混合水の拡散係数 |
表 2:「化学種輸送」シミュレーションの物理パラメーター。
| 名 | 式 | 説明 |
| C | Acceptor(c) | アクセプタ濃度の定義 |
| D | D_search * 1e 10 | D のためのフォームファクターの変更 |
テーブル 3:「最適化」シミュレーションのパラメーター。
| 浸透 | 透水係数 (m/s) 10-8 x | 拡散係数 (m/s2) x 10-10 | 透過 (m) x 10 の-10のストークス半径 |
| Fl.So。 | 4.79 ± 0.20 | 1.94 ± 0.34 | 5 |
| FD 4,000 | 2.37 ± 0.31 | 0.65 ± 0.12 | 14 |
| FD10, 000 | 1.67 ± 0.47 | 0.22 ± 0.02 | 23 |
| FD 20,000 | 0.65 ± 0.30 | 0.29 ± 0.04 | 33 |
| FD 40,000 | 0.27 ± 0.08 | 0.14 ± 0.02 | 45 |
表 4: 別のストークス半径 2% アガロースゲル + 96 ウェル膜の膜を介して物質の透磁率と拡散係数システムを挿入します。(フルオレセイン ナトリウム塩階そう、fitc デキストランを = = FD)。
| モデル | 透水係数 (m/s) 10-8 x | 拡散係数 (m/s2) x 10-10 |
| 大佐 | 2.18 ± 0.29 | 1.22 ± 0.06 |
| 大佐 + F。 | 1.77 ± 0.38 | 0.93 ± 0.12 |
| 大佐 + H。 | 1.64 ± 0.40 | 0.96 ± 0.05 |
| 大佐 + F. + H。 | 1.65 ± 0.18 | 0.88 ± 0.11 |
テーブル 5: 12 でコラーゲン細胞モデルによるフルオレセイン ナトリウムの透磁率と拡散係数-よく膜挿入システム (大佐 = コラーゲン、f. h. 線維芽細胞を = = HaCaT).
ディスカッション
本研究は、組織構造の膜でエンジニア リングの透過特性を定量化する手法を説明します。Agarose のゲルを分子サイズが異なる物質の透過をテストおよび検証メソッドと対応するシミュレーション最初検討した.小さい分子浸透 (透過クロマトグラフィーによるゲル濾過の効果) を除いてマトリックス メッシュを速くことが知られています。似たような観測は、強膜26、ひと表皮膜27、人間の皮膚の17、およびラット皮膚28物質のサイズ排除実験で作られました。透水係数と対応するストークス半径 (説明、通常分子の有効な半径よりも小さい分子として同じ拡散速度を持つ移動剛体球の半径) の間の負の相関関係が示されています。26,28日と同様の関係は、分子サイズの異なる物質を用いた実験で観察されました。1/ストークス半径以上透水係数をプロットすることによって最小の分子サイズを 4 つのグループに線形相関が認められた (R2 = 0.93) (図 6)。これは提案法によるシミュレーションの透水係数は、現実的な範囲を示します。
実験では 46.15% のエラーはフランツ ・拡散セル システム10透水性実験の報告よりもやや大きい。1 つの可能な説明は、フルオレセイン-イソチオ シアン酸-デキストラン、後述のサイズ分布で可能性があります。
説明メソッドは利点フランツ拡散細胞システムを用いた方法と比較して重要であります。まず、セットアップがよりコンパクトです。実験は、商業のウェル プレート (∼ 13 cm × 8.5 cm) のスケールを持つ膜挿入システムで直接実行されます。別のフランツ ・拡散セルは各サンプルに必要なに対し、これにより、同時に実行する複数のサンプルです。第二に、栽培が行われる膜挿入皮膚モデルの透磁率を直接測定できます。フランツ ・拡散セルを使用して、サンプルにある撮影しは小さいサンプルのため手間がかかります、また時間がかかるシステムにマウントされています。
コラーゲン細胞マトリックスの透過実験セル シード システムにこのメソッドを正常に適用できることを示した。皮膚モデルにここに提示されたモデルを検証しましたただし、メソッドは、有機細胞培養、例えば腎臓や肝臓の他のタイプに適用できます。
本研究ではコラーゲン細胞モデルを用いて HaCaT 細胞が完全にモデルの表面をカバー (図 5参照)。これは、メソッドが HaCaT の層とコラーゲン細胞モデルと透水係数を区別するために十分に敏感であることを示す透水係数の削減につながった。理想的には、皮膚モデルは29の本当の皮膚の表皮に近づくと、バリアを構築する必要があります、したがって、実際に使用する前に皮膚モデルの質 (例えば真皮、表皮の建物) を検証する重要です。皮膚モデルの開発は、染色技術を可視化し、皮膚タンパク質とコラーゲン30,31,32の検出から定量化できます。透水係数は、皮膚モデルの開発を評価するための重要な要素もありますが、さらに、実験はこれを確認するために必要な。前述したように、このメソッドは、複数のサンプルを同時に実行できます。また、透磁率を測定し、それによって皮膚モデルのこのパラメーターの開発を観察する栽培中にサンプルを取ることが可能です。
それは、透磁率が同時にゲル/コラーゲン-セル-モデル、膜を通して測定されること注意してください。検出された透水係数は、システム固有という異なる皮膚モデルの結果のみ比較できます同じ膜挿入を使用する場合です。さらに、皮膚モデルは、モデルを介してのみ被験物質に浸透し、それに隣接していないと誘導するエラー測定透水性を確保するために全体の栽培面積をカバーする必要があります。今後の実験で考慮するべきもう一つの側面は、皮膚を取り巻く自然環境です。通常、皮膚表面の温度は透過条件に影響を与えることができます内側の地域と比較して低いです。
計算機シミュレーションと実験を配置するために応用シミュレーションにおけるパラメーター最適化を可能にする方法が発表されました。シミュレーションは、分子サイズの小さい物質の実験データとよく一致するように発見されました。ただし、シミュレーションと実験データの偏差は分子サイズの大きな物質の観察されました。大規模な多糖類分子は、摩擦を高めるし、ゲル内拡散プロセスを遅くできます。この効果により、実験間の偏差の原因である異常拡散とシミュレーション値33,34。別の説明は、フルオレセイン イソチオ シアン酸デキストランの小さいまたは大きい粒子の存在可能性があります。メーカーは、特定の範囲に存在するより小さくより大きい粒子を可能にすると平均サイズとして物質の分子量を指定します。ないもどれほど分散してこれらの物質は、小さい粒子浸透ゲルと流体チャネルを介してより速くです。これらの拡散と摩擦の影響を考慮するシミュレーションを拡張することが可能です。
透過性実験とシミュレーション 2 OC で使用するため開発されました。シミュレーションの助けを借りて、この実験法より洗練された実験的設定に直接転送することができます。たとえば、膜挿入システム シミュレーションは、2 OC のジオメトリまたは同様のセットアップで他のシステムに簡単に転送できます。今後の実験の設計をサポートする変調シミュレーションのこのオプションを使用できます。また、蒸発、異常拡散膜効果などの副作用は、シミュレーションの精度を向上させる統合できます。シミュレーション プログラムは、変更または皮膚モデルの開発の他の側面を調査するために他の物理モジュールを統合するシミュレーション式を改良する機会を与えます。1 つの例は、コラーゲン細胞モデルにおけるブドウ糖の消費量と乳酸の生産のシミュレーションです。
特に興味深い医療物質のテストでは、チップ上の器官システムで物質を分散する方法です。私の助けに答える質問物質がシステムに浸透する速さなどシミュレーションと透磁率のパラメーター多 organ チップで他の組織の濃度になりますだけでなく。このメソッドは、サポートし、そのような器官のオンチップ システムを開発およびテストを強化できます。
開示事項
Uwe マルクスは社長や株主と逆流性食道炎リンドナー TissUse gmbh 社は、製造・建設技術を商業化会社の株主であります。他の著者は本稿の出版物に関する利益相反を宣言しません。
謝辞
この作品は no. グラント ドイツ研究振興協会 (DFG) からの財政支援で作成されましたPO413/12-1 とラ 1028/7-1。
資料
| Name | Company | Catalog Number | Comments |
| Agarose | Carl Roth | K297.2 | High Resolution Powder |
| Collagen | Serva | 47256.01 | Collagen R solution 0.4 % |
| DMEM | Lonza (Biozym Scientific GmbH) | 880010-12 | High Glucose with L-Glutamine |
| FCS | Biochrom GmbH | S0615 0114F | Fetal Calf Serum |
| Fluorescein Sodium Salt | Sigma-Aldrich | 46960-25G-F | |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | 46944-500MG | 4000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD10S-250MG | 10 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD20S-250MG | 20 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD40S-250MG | 40 000 g/mol |
| HBSS | ThermoFisher Scientific | 14170120 | no calcium, no magnesium , with phenol red |
| NaOH | Merck | 1.06467.9010 | granulated |
| PBS | Gibco | 18912-014 | tablets |
| Transwell Cell Culture Inserts | Corning | 3391 | 96 well, 0.4 µm pore size |
| Transwell Cell Culture Inserts | Corning (VWR) | 734-1563 | 12 well, 0.4 µm pore size |
| Trypsin | Biochrom GmbH | L2143 | with EDTA |
参考文献
- Marx, U., et al. Human-on-a-chip developments: a translational cutting-edge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man?. ATLA. 40 (5), 235-257 (2012).
- Maschmeyer, I., et al. Chip-based human liver-intestine and liver-skin co-cultures - A first step toward systemic repeated dose substance testing in vitro. Eur J Pharm Biopharm. 95, 77-87 (2015).
- Prunieras, M., Regnier, M., Woodley, D. Methods for Cultivation of Keratinocytes with an Air-Liquid Interface. J Invest Dermatol. 81 (1), 28-33 (1983).
- Cannon, C. L., et al. New epidermal model for dermal irritancy testing. Toxicol In Vitro. 8 (4), 889-891 (1994).
- Ackermann, K., et al. The Phenion Full-Thickness Skin Model for Percutaneous Absorption Testing. Skin Pharmacol Physiol. 23 (2), 105-112 (2010).
- Netzlaff, F., et al. Permeability of the reconstructed human epidermis model Episkin in comparison to various human skin preparations. Eur J Pharm Biopharm. 66 (1), 127-134 (2007).
- Bran, B., et al. A New Discriminative Criterion for the Development of Franz Diffusion Tests for Transdermal Pharmaceuticals. J Pharm Sci. 13 (2), 218-230 (2010).
- Pineau, A., et al. In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J Inorg Biochem. 110, 21-26 (2012).
- Filon, F. L., et al. In vitro percutaneous absorption of cobalt. Int Arch Occup Environ Health. 77 (2), 85-89 (2004).
- Ng, S. -. F., et al. Validation of a Static Franz Diffusion Cell System for In Vitro Permeation Studies. AAPS PharmSciTech. 11 (3), 1432-1441 (2010).
- Bonferoni, M. C., et al. A Modified Franz Diffusion Cell for Simultaneous Assessment of Drug Release and Washability of Mucoadhesive Gels. Pharm Dev Tecnol. 4 (1), 45-53 (1999).
- Seiffer, S., Oppermann, W. Systematic evaluation of FRAP experiments performed in a confocal laser scanning microscope. J Microsc. 220 (1), 20-30 (2005).
- Pluen, A., et al. Diffusion of Macromolecules in Agarose Gels: Comparison of Linear and Globular Configurations. Biophys J. 77, 542-552 (1999).
- Cornelissen, L. H., et al. Diffusion measurements in epidermal tissues with fluorescent recovery after photobleaching. Skin Res Technol. 14 (4), 462-467 (2008).
- Pirot, F., et al. Characterization of the permeability barrier of human skin in vivo. PNAS. 94 (4), 1562-1567 (1997).
- Tetteh, J., et al. Local examination of skin diffusion using FTIR spectroscopic imaging and multivariate target factor analysis. Anal Chim Acta. 642 (1-2), 246-256 (2009).
- Guldbrand, S., et al. Two-photon fluorescence correlation spectroscopy as a tool for measuring molecular diffusion within human skin. Eur J Pharm Biopharm. 84 (2), 430-436 (2013).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Rech. 291 (11), 600-605 (1999).
- Veronike, M., et al. Epidermal Organization and Differentiation of HaCaT Keratinocytes in Organotypic Coculture with Human Dermal Fibroblasts. J Invest Dermatol. 112 (3), 343-353 (1999).
- Moraes, C., et al. Organs-on-a-chip: a focus on compartmentalized microdevices. Ann Biomed Eng. 40 (6), 1211-1227 (2012).
- Huh, D., et al. From Three-Dimensional Cell Culture to Organs-on-Chips. Trends Cell Biol. 21 (12), 745-754 (2011).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab Chip. 13 (18), 3588 (2013).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), (2015).
- Materne, E. -. M., et al. A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing. J Biotechnology. 205, 36-46 (2015).
- Materne, E. -. M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing - organotypicalness versus cost-efficient high throughput. Lab Chip. 13 (18), 3481 (2013).
- Jayakrishna, A., et al. Diffusion of High Molecular Weight Compounds through Sclera. IOVS. 41 (5), 1181-1185 (2000).
- Peck, K., et al. Hindered Diffusion of Polar Molecules Through and Effective Pore Radii Estimate of Intact and Ethanol. Pharm Res. 11 (9), 1309-1314 (1994).
- Ogiso, T., et al. Mechanism of the Enhancement Effect of n-Octyl-β-D-thioglucoside on the Transdermal Penetration of Fluorescein Isothiocyanate-Labeled Dextrans and the Molecular Weight Dependence of Water-Soluble Penetrants through Stripped Skin. J Pharm Sci. 83 (12), 1676-1681 (1994).
- Hadgraft, J. Skin, the final frontier. Int J Pharm. 224 (1-2), 1-18 (2001).
- Asselineau, D., et al. Human Epidermis Reconstructed by Culture: Is It "Normal"?. J Invest Dermatol. 86 (2), 181-186 (1986).
- Casasco, A., et al. Cell proliferation and differentiation in a model of human skin equivalent. Anat Rec. 264 (3), 261-272 (2001).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Res. 291 (11), 600-605 (1999).
- Laurent, T. C., et al. Diffusion of Dextran in Concentrated Solutions. Eur J Biochem. 68, 95-102 (1976).
- Metzler, R., Klafter, J. The random walk's guide to anomalous diffusion: A fractional dynamics approach. Phys Rep. 339 (1), 1-77 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved