Method Article
Un metodo per la determinazione e la simulazione di permeabilità e la diffusione in un modello 3D del tessuto in una membrana inserire sistema per piastre multi-pozzetto
In questo articolo
Riepilogo
Un metodo per la determinazione della permeabilità in una membrana inserire sistema per piastre multi-pozzetto e sono presentati in silico ottimizzazione dei parametri per il calcolo dei coefficenti di diffusione mediante simulazione.
Abstract
In vitro coltivati della pelle modelli sono diventati sempre più rilevanti per le applicazioni farmaceutiche e cosmetiche e sono utilizzati anche nello sviluppo di farmaci, nonché la sostanza test. Questi modelli sono per lo più coltivati in sistemi di membrana-inserti, loro permeabilità verso sostanze differenti, essendo un fattore essenziale. Metodi applicati per la determinazione di questi parametri in genere, di solito richiedono campioni di grandi dimensioni (ad es., Franz diffusione cell) o laboriosa attrezzature (ad es., recupero di fluorescenza dopo photobleaching (FRAP)). Questo studio presenta un metodo per determinare i coefficienti di permeabilità direttamente in sistemi di membrana-inserti con diametri di 4,26 e 12,2 mm (zona di coltura). Il metodo è stato convalidato con agarosio e gel del collagene come pure un modello cellulare di collagene che rappresentano modelli di pelle. I processi di permeazione di sostanze con diverse dimensioni molecolari e permeazione attraverso modelli differenti delle cellule (costituiti da gel di collagene, fibroblasti e HaCaT) sono stati accuratamente descritti.
Inoltre, per supportare il metodo sperimentale di cui sopra, è stata stabilita una simulazione. La simulazione si inserisce i dati sperimentali bene per sostanze con piccole dimensioni molecolari, fino a 14 x 10-10 m raggio di Stokes (4.000 MW), ed è quindi uno strumento promettente per descrivere il sistema. Inoltre, la simulazione può ridurre considerevolmente gli sforzi sperimentali ed è abbastanza robusta per essere esteso o adattato alle configurazioni più complesse.
Introduzione
Organo-tipiche culture 3D sono diventati potenti strumenti per lo sviluppo di farmaci e sostanza test1. A questo proposito, modelli di pelle umana sono di particolare interesse a causa di requisiti normativi, come quelli nel settore della cosmetica. Successivamente hanno portato allo sviluppo di numerosi modelli 3D della pelle, per uso sia su loro come culture di singolo-organo in piastre multi-pozzetto o in multi-organ-friggere, in combinazione con organo ulteriori modelli, ad esempio, il fegato2.
Per quanto riguarda la coltivazione di un equivalente di pelle, l'interfaccia aria-liquido (ALI) è un elemento essenziale per differenziazione epidermica corretta3. Inserti di cultura cellulare composti da un vaso con una membrana permeabile liquido nella parte inferiore vengono in genere utilizzate per stabilire un ALI. ALIs sono ampiamente utilizzati nei modelli di pelle disponibile nel commercio come EpiDerm4, Phenion5ed Episkin6, per la cultura di modelli di pelle con dimensioni da 96 pozzetti (4,26 mm di diametro) fino a 12-pozzetti (12,2 mm di diametro). Il metodo qui descritto determina la permeazione delle sostanze in un sistema di inserimento della membrana.
Il coefficiente di permeabilità è un parametro significativo per valutare la qualità di qualsiasi modello di pelle coltivata rispetto alla pelle nativo5e viene utilizzato per valutare quanto rapidamente la migrazione di sostanze attive attraverso la pelle. Soprattutto se farmaci o cosmetici prodotti devono essere applicati alla pelle, questo parametro è essenziale per capire quando precisamente gli agenti attivi passano attraverso di essa. Una simulazione può aiutare ulteriormente per prevedere il comportamento del sistema e successivamente ridurre il necessario sforzo sperimentale che richiede tempo, soprattutto quando un grande insieme di sostanze è coinvolto.
La cella di diffusione di Franz è stato-of-the-art per permeazione esperimenti con la pelle e pelle modelli5,6,7,8,9. Questo dispositivo è costituito da due vani con un campione fisso (barriera di diffusione) in mezzo. La sostanza da saggiare viene applicata direttamente alla parte superiore del campione (compartimento donatore) e la concentrazione del composto che permea può essere rilevata sul vano opposto (accettore). Sul versante acceptor, temperatura costante e la concentrazione di sostanza omogenea sono garantiti attraverso una camera a temperatura e un agitatore magnetico. Campioni possono essere prelevati da un braccio di campionamento sul lato accettore della cella Franz. Con una gamma di altezza tra 19 e 179 cm, questo sistema è relativamente grande10,11. Un altro metodo per la determinazione dei coefficienti di diffusione nei tessuti e sostanze in gel è FRAP. Questa tecnica utilizza il principio di sbiancamento fluorescente etichettati particelle in gel e quindi determinare il tempo di recupero della zona sbiancato per calcolare il coefficiente di diffusione12,13,14.
Inoltre, Fourier transform-spettroscopia all'infrarosso (FTIR) può essere utilizzata per rilevare il movimento delle particelle con assorbanza della luce a raggi infrarossi al fine di determinare il processo di permeazione delle sostanze in pelle15,16. Tuttavia, questi o altri metodi di imaging (ad es., spettroscopia di fluorescenza del due-fotone correlazione17) deve necessariamente costare strumenti intensivi.
In questo articolo, un metodo è presentato direttamente misurare la permeabilità di una barriera all'interno di un sistema di inserimento della membrana, dove un modello di pelle può essere coltivato. Questo metodo consente esperimenti di permeabilità deve essere eseguito con un gran numero di piccoli campioni (ben dimensioni fino a mm 4,26) in un sistema compatto. Questo è in contrasto con la cella di diffusione di Franz, dove un dispositivo separato è necessaria per ogni sonda, che deve essere montato sul dispositivo ed è difficile da realizzare per i piccoli campioni (dimensioni mm 4,26). Inoltre, poiché il metodo non richiede strumentazione principali (ad es., un microscopio confocale o multifotonica), si ottiene una riduzione di tempo e costo.
Tutti gli esperimenti sono stati effettuati in membrana microporosa inserire sistemi con un campione (barriera) costituiti da gel di agarosio o un modello di cellulare di collagene stabilito sulla membrana. Sostanze fluorescenti (donatore) con diverse dimensioni molecolari sono state applicate alla parte superiore del campione, e la concentrazione della sostanza permeata è stata rilevata sul fondo (accettore) utilizzando un lettore di fluorescenza (Vedi Figura 1). Al fine di validare il metodo e verificare l'esattezza di questa simulazione, gel dell'agarosi erano prodotto e utilizzati come una barriera. Idrogeli sono generalmente utilizzati per lo studio dei processi di diffusione e permeazione in mezzo poroso a scienze biologiche13. Il metodo è stato poi testato in un sistema cellulare-seminato costituito da una matrice di collagene dei fibroblasti primari e cellule adulte umane basse calcio alte temperatura cheratinociti (HaCaT) (modello di cellula-matrice), che è una pelle semplificata modello18,19 .
Inoltre, il processo di permeazione è stato simulato mediante simulazioni di flusso con fluidodinamica computazionale. Si è constatato che, per mezzo di ottimizzazione dei parametri, il coefficente di diffusione potrebbe essere calcolato dai dati sperimentali. In generale, questa simulazione offre diverse applicazioni; per esempio, è possibile prevedere un processo di permeazione basato su esperimenti di brevi e la simulazione può ridurre significativamente il numero di esperimenti.
Metodo sperimentale e simulazione sono state progettate per l'applicazione a un organo-on-a-chip sistema1,20,21, specificamente il 2-organo-chip (2-OC) sviluppato commercialmente1,22, 23,24,25. In linea di principio, il processo di permeazione di qualsiasi modello di organo basato su sistemi di membrana inserti può essere descritto in questo modo.
Protocollo
1. preparazione del campione per gli studi di permeabilità
Nota: Al fine di verificare le misurazioni di permeazione e simulazioni, è stato utilizzato un campione costituito da gel di agarosio o un modello di matrice cellulare basata sulla coltivazione del modello della pelle.
- Gel di agarosio
- Sciogliere 0,2 g di agarosio in polvere ad alta risoluzione in 10 mL di H2O (acqua bidistillata).
- Miscelare la soluzione e scaldarlo fino a 80 ° C. Mantenere la temperatura per 8 min.
- Applicare gel di agarosio 28,6 µ l sulla membrana del sistema di inserimento membrana 96 pozzetti (4,26 mm di diametro) o µ l uso 226 per la membrana ben 12 inserire sistema (12 mm di diametro) (ad es., sistema di Transwell).
- Attendere 10 minuti fino a quando il gel è solidificato.
- Gel di collagene
Nota: Tutti i passaggi sono eseguiti in condizioni sterili e le soluzioni sono tenute sul ghiaccio per rallentare la polimerizzazione del gel di collagene.- Mix 125 µ l di Hanks' bilanciato sale soluzione (HBSS) con 1 mL di soluzione di 0,4% collagene R (collagene di coda di ratto).
- Titolare la soluzione con 1 M NaOH (sodio idrossido) (~ 6 µ l) finché il colore del rosso fenolo passa dal giallo al rosso.
- Aggiungere 125 µ l di Dulbecco per volta Eagle Medium (DMEM) + 10% di siero fetale di vitello (FCS) direttamente sul gel di collagene e mescolare accuratamente con un puntale.
- Applicare 28,6 µ l di collagene gel alla membrana del sistema di inserimento membrana 96 pozzetti o 226 µ l per il sistema di inserimento della membrana 12-pozzetti.
- Lasciare agire il gel in un incubatore (37 ° C, 5% CO2) per 30 min.
- Modello di cellulare di collagene con del fibroblasto
Nota: Tutti i passaggi vengono eseguiti in condizioni di sterilità.- Preparare i fibroblasti primari 5-7 giorni prima dell'esperimento. Coltivare i fibroblasti con DMEM + 10% FCS in matracci di cultura cellulare (75 cm2) e cambiare il mezzo ogni 2-3 giorni.
Nota: A seconda dell'impostazione sperimentale, può essere utilizzato un numero maggiore di cellule. - Rimuovere il supporto dal pallone di coltura delle cellule (80% confluenti) e lavare due volte con (cultura pallone 75 cm2) da 10 mL di tampone fosfato salino (PBS). Aggiungere 3 mL di 0.05% tripsina / acido etilendiamminotetraacetico (EDTA) e incubare per 3 min a 37 ° C.
- Toccare delicatamente il matraccio di cultura per staccare le cellule dalla superficie. Fermare la reazione aggiungendo 3 mL di DMEM + 10% FCS. Trasferire la soluzione in una provetta da centrifuga.
- Centrifugare la sospensione cellulare a 120 x g, rimuovere il supernatante e risospendere le cellule con 0,5 mL di DMEM + 10% FCS.
- Contare le celle e regolare a una concentrazione di 0,5 x 106 cellule/mL.
Nota: Le seguenti operazioni vengono eseguite sul ghiaccio per rallentare la polimerizzazione del gel di collagene. - Mix 125 µ l di HBSS con 1 mL di soluzione di collagene R 0,4%.
- Titolare la soluzione con 1 M NaOH (~ 6 µ l) fino a quando il colore del rosso fenolo cambia da giallo a rosso.
- Aggiungere 125 µ l di sospensione cellulare (DMEM + 10% FCS + 0,5 x 106 cellule/mL) nel collagene gel e mescolare accuratamente con una pipetta.
- Applicare 28,6 µ l di collagene gel sulla membrana del sistema di inserimento membrana 96 pozzetti o 226 µ l per il sistema di inserimento della membrana 12-pozzetti.
- Lasciare agire il gel in un incubatore (37 ° C, 5% CO2) per 30 min.
- Applicare 75 µ l di DMEM + 10% FCS sulla superficie del gel e 300 µ l alla piastra ricevitore della membrana 96 pozzetti inserire sistema. Per la membrana 12-pozzetti inserire il sistema, utilizzare un volume di 590 µ l per la superficie e 1.846 µ l per la piastra del ricevitore.
- Rimuovere il supporto dalla superficie del modello matrice cellulare (aria compressa) e incubare ulteriormente il modello a matrice cellulare per 7 giorni. Utilizzare 100 μl medio sul fondo e cambiare il mezzo ogni giorno.
- Preparare i fibroblasti primari 5-7 giorni prima dell'esperimento. Coltivare i fibroblasti con DMEM + 10% FCS in matracci di cultura cellulare (75 cm2) e cambiare il mezzo ogni 2-3 giorni.
- Modello di cellulare di collagene con HaCaT
Nota: Tutti i passaggi vengono eseguiti in condizioni di sterilità.- Preparare le HaCaT 5-7 giorni prima i passaggi seguenti. Coltivare le HaCaT con DMEM + 5% FCS in un matraccio di cultura cellulare (75 mm2) e cambiare il mezzo ogni 2-3 giorni.
Nota: A seconda dell'impostazione sperimentale, può essere utilizzato un numero maggiore di cellule. - Rimuovere il supporto dal pallone e lavare due volte con (cultura pallone 75 cm2) da 10 mL di PBS. Aggiungere 3 mL di 0.05% tripsina/EDTA e incubare per 10 min a 37 ° C. Fermare la reazione con 3ml di DMEM + 10% FCS. Trasferire la soluzione in una provetta da centrifuga.
- Centrifugare la sospensione cellulare a 120 x g, rimuovere il supernatante e risospendere le cellule con 0,5 mL di DMEM + 10% FCS.
- Contare le celle e regolare a una concentrazione di 0,5 x 106 cellule/mL.
Nota: Le seguenti operazioni vengono eseguite sul ghiaccio per rallentare la polimerizzazione del gel di collagene. - Mix 125 µ l di HBSS con 1 mL di soluzione di collagene R 0,4%.
- Titolare la soluzione con 1 M NaOH (~ 6 µ l) fino a quando il colore del rosso fenolo cambia da giallo a rosso.
- Aggiungere 125 µ l di DMEM + 10% FCS per il gel di collagene e mescolare accuratamente con una pipetta.
- Applicare 28,6 µ l di sospensione cellulare sulla membrana del sistema di inserimento membrana 96 pozzetti o 226 µ l per il sistema di inserimento della membrana 12-pozzetti.
- Lasciare agire il gel in un incubatore (37 ° C, 5% CO2) per 30 min.
- Applicare sulla superficie di gel 75 µ l di sospensione cellulare e aggiungere 300 µ l di DMEM + 10% FCS alla piastra ricevitore della membrana 96 pozzetti inserire sistema. Per la membrana 12-pozzetti inserire sistema, usare un volume della sospensione di cellule µ l 590 per la superficie e 1.846 µ l di DMEM + 10% FCS per la piastra del ricevitore.
- Incubare il modello a matrice cellulare per 3 giorni; scambiare il mezzo dopo 2 giorni.
- Rimuovere il supporto dalla superficie del modello matrice cellulare ed incubare il modello a matrice cellulare per ulteriori 7 giorni. Utilizzare 100 µ l medio sul fondo e cambiare il mezzo ogni giorno.
- Preparare le HaCaT 5-7 giorni prima i passaggi seguenti. Coltivare le HaCaT con DMEM + 5% FCS in un matraccio di cultura cellulare (75 mm2) e cambiare il mezzo ogni 2-3 giorni.
- Modello di cellulare di collagene con fibroblasti e HaCaT
Nota: Tutti i passaggi vengono eseguiti in condizioni sterili sul ghiaccio per rallentare la polimerizzazione del gel di collagene. Preparare i fibroblasti come descritto al punto 1.3, fino al punto 1.3.5 e preparare un giorno più tardi HaCaT come descritto nel passo 1.4 fino al punto 1.4.4.- Mix 125 µ l di HBSS in 1 mL di soluzione di collagene R 0,4%.
- Neutralizzare la soluzione con 1 M NaOH (~ 6 µ l) fino a quando il colore di rosso fenolo cambia da giallo a un rosso viola.
- Aggiungere 125 µ l di sospensione cellulare dei fibroblasti primari costituiti DMEM + 10% FCS + 0.5 x 106 cellule/mL per il collagene gel e mescolate con cura.
- Applicare 28,6 µ l di sospensione cellulare alla membrana del sistema di inserimento membrana 96 pozzetti o 226 µ l per il sistema di inserimento della membrana 12-pozzetti.
- Lasciare agire il gel in un incubatore (37 ° C, 5% CO2) per 30 min.
- Successivamente, applicare 75 µ l di DMEM + 10% FCS sulla superficie del gel e 300 µ l per la piastra di ricevitore della membrana 96 pozzetti inserire sistema. Per la membrana 12-pozzetti inserire sistema, un volume di 590 µ l viene utilizzato per la superficie e 1.846 µ l per la piastra del ricevitore.
- Incubare per 1 giorno a 37 ° C e 5% CO2.
- Rimuovere il supporto dalla superficie e aggiungere una sospensione di cellule HaCaT con 0,5 x 106 cellule/mL. Il volume è lo stesso come descritto in precedenza in passaggio 1.5.6.
- Incubare il modello a matrice cellulare per 3 giorni; scambiare il mezzo dopo 2 giorni.
- Rimuovere il supporto dalla superficie del modello matrice cellulare ed incubare il modello a matrice cellulare per ulteriori 7 giorni. Utilizzare 100 µ l medio sul fondo e cambiare il mezzo ogni giorno.
Nota: Per questa indagine, 3 gel/cella-modello campioni sono stati preparati per il sistema di inserimento della membrana 12-pozzetti. Per la membrana di 96 pozzetti inserire sistema, abbiamo usato 6 campioni per il modello gel/cella. Per mezzi statistici, 3 campioni sono comuni. Ma per gli esperimenti del sistema di inserimento membrana 96 pozzetti con modello a matrice del collagene ci aspettavamo gli errori e le deviazioni per la coltura delle cellule. Pertanto, abbiamo scelto un numero maggiore di campioni.
2. permeabilità studi nella membrana inserire sistema
-
Sostanza di donatore
Nota: Due sali di sodio di fluorescina (NaFl) sono prodotti.- Sciogliere NaFl in H2O ad una concentrazione di 0,1 mg/mL e 0,01 mg/mL. Diverso della fluorescina isotiocianato-destrani (FD) con un peso molecolare di 4.000, 10.000, 20.000 e 40.000 g/mol sono dissolti in H2O ad una concentrazione di 2 mg/mL. Utilizzare queste soluzioni come sostanza donatrice per gli esperimenti di permeabilità (Vedi Figura 1) con gel di agarosio.
- Per l'installazione con il modello di cellulare di collagene, preparare tutte le soluzioni con DMEM + 10% FCS invece dell'acqua.
Nota: Preparare soluzioni di riserva (10 volte più alta concentrazione) della sostanza donatrice. Piccole variazioni della concentrazione dei donatori possono influenzare i risultati dell'esperimento permeabilità.
-
Metodo sperimentale
Nota: L'esperimento di permeabilità viene eseguito a 37 ° C e un'umidità di > 90%. Questo parametro garantisce la vitalità delle cellule. La temperatura influenza il processo di diffusione, pertanto gli stessi parametri vengono utilizzati per gli esperimenti con il gel dell'agarosi, gel di collagene e collagene cella modello. Le informazioni sul volume della staffa si intende il sistema di inserimento della membrana 12-pozzetti.- Preparare una membrana ben 96 - (o 12-) sistema di inserimento con una barriera costituita dell'agarosi gel (Vedi protocollo 1.1) o modello di cella (Vedi protocollo 1.2-1.5) e la sostanza di donatore di fluorescenza.
- Preparare diluizioni di 01:10, 01:20, 01:40, 1: 80, 1: 160 e 1: 320 della sostanza donatrice per l'istituzione di una curva standard. Dispensare 300 µ l (1.846 µ l) di ogni diluizione in tre pozzi della piastra ricevitore. Per la membrana 12-pozzetti inserto sistema uso una piastra ricevitore separato. Le diluizioni seriali sono utilizzate per convertire la fluorescenza misurata [RFU] nella concentrazione equivalente [mg/mL].
- Aggiungere 75 µ l (590 µ l) della sostanza del donatore in cima il campione (agarosio gel o cella modello) e 300 µ l (1.846 µ l) di sostanza accettore (H2O o DMEM + 10% FCS) nella piastra di ricevitore (Vedi Figura 1).
Nota: Assicurarsi che le superfici del liquido nella membrana inserire sistema e nella piastra ricevitore hanno lo stesso livello per evitare pressione idrostatica. - Trasferire l'intero sistema in uno shaker in incubatrice. Regolare l'agitazione per ottenere una miscelazione omogenea (orbita di corsa totale è 1,5 mm, la velocità viene regolata a livello 3.5, che è legato ad una rotazione di ~ 480 1/min) per evitare un gradiente di concentrazione, che influenza il processo di diffusione.
- Determinare la fluorescenza periodicamente ogni ora. Misurare la fluorescenza, trasferire il sistema di inserimento della membrana in un piatto vuoto e misurare la fluorescenza all'interno del ricevitore utilizzando un lettore di piastra. Utilizzare una lunghezza d'onda di eccitazione di 485 nm e l'emissione di 535 nm per fluorescina.
- Eseguire l'esperimento per 5 h.
Nota: Durante gli esperimenti, il liquido evapora da tutto il sistema. L'evaporazione cambia la concentrazione nel donatore e accettore e influisce sui risultati. Questo effetto è trascurato nel caso di un tempo di esecuzione di 5 h, ma per tempi più lunghi di esecuzione che dovrebbe essere considerato.
-
Calcolo del coefficiente di permeabilità
- Per stabilire la curva standard, tracciare la fluorescenza delle diluizioni seriali contro concentrazione ed eseguire una regressione lineare dei dati.
- Utilizzare la pendenza della regressione lineare per convertire i dati di fluorescenza dell'esperimento permeazione in concentrazione. Ai fini della simulazione, è possibile convertire unità in mol/m3.
- Tracciare la concentrazione in funzione nel corso del tempo e stabilire il segmento lineare dei dati (Vedi Figura 2).
- Determinare la pendenza di questa parte lineare e calcolare il coefficiente di permeabilità secondo la seguente equazione (vedere l'esempio nella Figura 2):
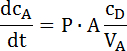
dove dcA/ dt è la variazione della concentrazione della sostanza all'interno della parte di accettore nel tempo (la pendenza); CD è la concentrazione sul lato donatore; P è il coefficiente di permeabilità; A è la superficie di permeazione, e VA è il volume di acceptor. Questa equazione è derivata dalla prima legge di Fick e può essere applicata solo quando CD » CA6,22. - Nota: Le concentrazioni del donatore devono essere molto superiore la concentrazione rilevata nell'accettore. Questo è stato verificato nel setup sperimentale.
3. simulazione
Nota: La simulazione è stato fatto con COMSOL Multiphysics 5.1. Presuppone una conoscenza di base di questo. Per la simulazione di diffusione, sono apportate le seguenti ipotesi: (a) il coefficiente di diffusione delle sostanze in H2O è molto più alto rispetto a quella nel gel. Per compensare questa differenza, la simulazione utilizza un valore di 1 x 10-9 m2/s che è maggiore di un fattore 10 per 100 rispetto al coefficiente di diffusione di NaFl tramite gel di agarosio al 2%. (b) nell'esperimento, la sostanza si diffonde attraverso la barriera e quindi inserire sistema attraverso la membrana della membrana. In contrasto con la messa a punto sperimentale, la matrice di gel o cella di agarosio virtuale e membrana sono considerati una fase omogenea. (c) limite gli effetti sulle pareti sono impostato su "nessuno slittamento", tutti effetto slittamento sulle pareti (non tra liquido e gel o liquido e cellulare modello) del sistema di inserimento della membrana sono trascurati e non sono significative per il processo di diffusione.
- Installazione della simulazione di diffusione
Nota: Questa procedura viene illustrato il programma di installazione della simulazione dell'esperimento permeabilità. Le simulazioni per i sistemi di inserimento membrana 96 - e 12-pozzetti sono state istituite separatamente. Il modulo di "Trasporto di specie chimiche" utilizza un'equazione basata sulla seconda legge di Fick della diffusione: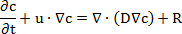
dove c è la concentrazione della sostanza, t è il tempo, u è la velocità, D è il coefficiente di diffusione e R è il tasso di reazione. Il tasso di reazione è stato trascurato perché nessuna reazione chimica durante il processo di diffusione.- Aprire il programma e avviare un nuovo modello. Abbiamo scelto il "modello Wizard", seleziona il 3D modello, aggiungere "Trasporto di diluito specie" interfaccia fisica nel menu pull-down, fare clic su "Studio", selezionare lo studio di "Tempo dipendenti" e fare clic su "Fatto".
- Vai alle definizioni di"globale" e aggiungere "Parametri" con il tasto destro del mouse. Immettere i parametri geometrici e fisici nella griglia (Vedi tabella 1, tabella 2e Figura 3e).
Nota: La superficie concava del gel dell'agarosi in un sistema di inserimento della membrana 96 pozzetti è stata approssimata con una palla di immersione. - Impostare la geometria del sistema di inserimento della membrana dagli esperimenti. Passo 3.2, è riportato un esempio di come costruire la geometria del sistema di inserimento membrana 96 pozzetti. L'unità di lunghezza è impostata a metro.
Nota: Non costruire l'intera geometria per risparmiare tempo di calcolo. Invece, la geometria può essere ridotto utilizzando linee d'asse di un quarto della geometria (Vedi Figura 3a e 3b di figura). - Aggiungere due "dominio sonde" nelle "Definizioni" (diritto fare clic su "Definizioni" e individuare "Sonda") e selezionare una sonda come il dominio di accettore e l'altro come il dominio di donatore. Scegli per entrambi di tipo "Medio" e l'espressione "c" con l'unità "mol/m3".
Nota: Questo passaggio è opzionale e indica la concentrazione del accettore e donatore durante la simulazione. - Imposta il coefficiente di diffusione (Dc) in "Proprietà di trasporto 1" in "trasporto di specie diluito"come "Dif_w".
Nota: "Proprietà di trasporto 1" viene utilizzato per dominio sia accettore e donatore. Nel passaggio successivo, verrà sovrascritto il dominio di barriera. - Aggiungere un secondo clic "Proprietà del trasporto 2" con diritto "Trasporto delle specie diluito" e selezionare la barriera (2) nella selezione"dominio". In funzione dell'obiettivo della simulazione il coefficente di diffusione può essere impostato come valore della barriera o come una variabile fittizia "D". Per la prima esecuzione del test, è necessario impostare un valore di 2E-10 m2/s.
Nota: "D" sarà dichiarato più tardi nel punto 3.3. - In "Trasporto di diluito specie" per "valori iniziali 1" definiscono la concentrazione come zero.
Nota: "Valori iniziali 1" viene utilizzati per dominio di barriera e accettore. Nel passaggio successivo, verrà sovrascritto il dominio di donatore. - Aggiungere un secondo clic "Iniziale valori 2" con diritto "Trasporto delle specie diluito" e selezionare il donatore (3) come il dominio. Impostare la concentrazione come la concentrazione iniziale della sostanza donatore (ad es., C_fl da tabella 2).
- Aggiungere "Simmetria 1" con il tasto destro su "Trasporto di specie diluito", aggiungere e scegliere tutte le superfici della "Selezione limite", che rispecchiano l'intera geometria (per l'esempio di geometria al punto 3.2, è il limite di numero 1, 2, 4, 5, 7, 8).
Nota: Questo punto può essere trascurato se è stata configurata l'intera geometria. - Con un click destro su "Mesh" aggiungere due "Free tetraedrico". Selezionare la barriera (2) come dominio (cambia il livello di entità geometrica nel "Dominio"). Aggiungere "Dimensione" con il tasto destro su "Free Tetrahedral 1" e per la mesh predefinita «Finer» per la membrana 12-pozzetti inserire sistema o sistema inserire "extra Fine" per una membrana di 96 pozzetti.
- Nella seconda "Free tetraedrico" selezionare l'accettore e donatore come dominio e la mesh predefinita "Normale" per una membrana 12-pozzetti Inserisci sistema o «Finer» per una membrana di 96 pozzetti sistema (Vedi Figura 3 c e figura 3d).
Nota: È anche possibile scegliere una maglia più grossa per risparmiare tempo di calcolo. Questo potrebbe ridurre la precisione dei risultati. Fare clic su "Build All" in "Impostazioni Mesh" per la geometria di maglia. - Avviare la simulazione con "compute" nella "Studio 1".
- Esempio di configurazione per una geometria
Nota: Qui un esempio è dato di come impostare la geometria del sistema inserimento membrana 96 pozzetti (con barriera concavo). Tutti i passaggi vengono eseguiti nel modulo geometria del programma. L'unità di lunghezza è impostata a metro.- Generare un cilindro 1 (click destro sul "Geometria 1") con raggio di d_w/2 e altezza di h_sp + h_b + Limouni.
- Generare un cilindro 2 con raggio di d_tran/2, altezza della posizione z + Limouni e h_b di h_sp.
- Utilizzare l'opzione di "Differenza" (fare clic con il pulsante destro su "geometria 1", individuare "Valori booleani e partizione") per sottrarre il cilindro 2 dal cilindro 1. Abbiamo scelto "cyl1" in "Oggetti da aggiungere," attivare "Oggetto per sottrarre" e ha scelto di "cyl2". Il nuovo volume è la geometria di acceptor.
- Generare un cilindro 3 con raggio di d_a/2, altezza di h_b e la posizione z di h_sp.
- Generare una sfera 1 con raggio r e z posizione r_z.
- Utilizzare l'opzione di "Differenza" per sottrarre la sfera 1 (sph1) dal cilindro 3 (cyl3). Il nuovo volume è chiamato differenza 2.
- Generare un 4 cilindro con raggio di d_a/2, altezza h_b + Limouni e posizione z di h_sp.
- Utilizzare l'opzione di "Differenza" per sottrarre cilindro 4 (cyl4) da differenza 2. Il nuovo volume è la geometria di acceptor.
- Ripetere i passaggi 3.2.4-3.2.6 per costruire la barriera (l'agarosio gel o cella modello nell'esperimento).
- Fare una 1 Unione di tutti gli elementi di geometria (a destra fare clic su "Geometria 1", individuare "Valori booleani e partizione").
- Generare un blocco 1 con tutti i bordi impostata su una lunghezza di d_tran * 2, posizione x di - d_tran e y di d_tran * 2.
- Generare un blocco 2 con tutte le lunghezza del bordo di d_tran * 2, posizione x di - d_tran * 2 e y di - d_tran.
- Utilizzare l'opzione di "Differenza" per sottrarre Unione 1 dal blocco 1 e blocco 2.
- Aggiunta l'ottimizzazione dei parametri per la simulazione
Nota: Con l'aiuto di ottimizzazione dei parametri il coefficente di diffusione può essere montato ai dati sperimentali generati in precedenza. Le istruzioni seguenti mostrano come integrare la parte di ottimizzazione la simulazione di diffusione. Assicurarsi che la simulazione di diffusione sta lavorando prima di iniziare la procedura.- Aggiungere il modulo di fisica "Ottimizzazione" utilizzando "Aggiungere Physic" (ottimizzazione può essere trovato in "Matematica" nella categoria "Ottimizzazione e sensibilità") per la simulazione. Fare clic su "Aggiungi al componente".
- Aggiungere "Variabili" con fare clic con il pulsante destro sotto "Definizioni" (local nel componente) e digitare nelle variabili di Tabella3.
Nota: L'ottimizzazione dei parametri utilizza numeri reali, vale a dire, il fattore 1-10 di coefficente di diffusione devono essere definiti separatamente. - Aggiungere una "media 1" con il tasto destro su "Definizioni" nella sezione "Componenti di accoppiamento" e digitare il nome di operatore "Ricettore".
- Generare un documento di testo separato contenente i dati sperimentali.
Nota: Un punto e virgola separa le colonne; un'interruzione di riga separa righe. Dichiarazione tempo viene misurato in secondi, la concentrazione in mol/m3. Rimuovere il primo e secondo dati punto nella fase di ritardo (Vedi Figura 2) degli esperimenti per evitare errori di montaggio possibile. Ecco un esempio di come potrebbe apparire il documento di testo:
3540; 0.00216
7140; 0.00724
12240; 0.01707
15180; 0.02230
18660; 0.02697
21540; 0.02931
Questo esempio può essere utilizzato per testare la simulazione. - Aggiungere "Least-Squares obiettivo globale" con il tasto destro su "Ottimizzazione", allegare il documento di testo dal punto 3.3.4 ai "dati sperimentali" e definire la prima colonna come "colonna Time 1" con diritto fare clic su "Obiettivo globale di minimi quadrati" e la seconda colonna come "Valore colonna 1" con click destro su "Obiettivo globale di minimi quadrati". Nella "espressione" di "Valore colonna" tipo la variabile "C".
- Aggiungere "Controllo variabili globali 1" con clic destro su "Ottimizzazione" e dichiarano "D_search" come una variabile con il valore iniziale "1", il limite inferiore "0" e il limite superiore "1000".
- Aggiungere "Ottimizzazione" con il tasto destro su "Studio 1" e ha scelto di "SNOPT" come metodo di Risolutore di ottimizzazione. Impostare la tolleranza di ottimalità a 1E-9.
Nota: Se la simulazione non ha fatto convergere, aumentare la tolleranza di ottimalità. Tenete a mente che la simulazione sarà imprecisa se la tolleranza di ottimalità è troppo grande. - Avviare l'ottimizzazione dei parametri con "compute" in "studio". Non dimenticate di impostare il coefficiente di diffusione sulla barriera come "D".
Risultati
Esperimenti di permeabilità in una membrana di 96 pozzetti inserire sistema con gel di agarosio al 2% come una barriera sono stati condotti al fine di valutare l'accuratezza di una simulazione. Sale sodico della fluorescina (NaFl) e della fluorescina isotiocianato-destrani (FD) sono stati utilizzati per verificare l'impatto della dimensione molecolare della sostanza diffondente da 5 x 10-10 m fino a 45 x 10-10 m raggio di Stokes (376.27-40.000 mol wt). Ottimizzazione dei parametri nativo della simulazione è stato utilizzato per la simulazione di dati sperimentali in forma.
A tal fine, alle pendici del solo le parti lineari della permeabilità simulate sono state confrontate con i risultati sperimentali. Per piccole dimensioni molecolari, simulazione e dati sperimentali erano in buon accordo con 99,2% per NaFl e 80,2% per FD 4.000 (Vedi Figura 4a e Figura 4b). Dimensione molecolare maggiore generato deviazioni più alte risultati correlazioni di 50,5% per 10.000 FD, 79,7% per 20.000 FD e 53,6% per FD 40.000. Progressione della curva nelle simulazioni hanno mostrato un ritardo all'inizio e un aumento più forte nel corso dei grafici (Vedi Figura 4 c–4e).
Coefficienti di permeabilità e i coefficenti di diffusione simulato sono mostrati in tabella 4. Il coefficiente di permeazione diminuisce con l'aumento di dimensioni molecolari. Deviazione standard era tra 0,08 x 10-8 m/s e 0,47 x 10-8 m/s (N = 7), che ha corrisposto ad un errore assoluto di tra 4,18% e 46.15%. Esperimenti con le più grandi molecole hanno mostrato un maggiore errore assoluto. I coefficenti di diffusione simulato si comportavano molto similmente ai coefficienti di permeabilità sperimentale. Sostanze con raggi più grandi di Stokes ha mostrato i coefficenti di diffusione decrescente e l'errore assoluto ha variato fra 9,09% e 18,46% (N = 3).
Negli esperimenti ulteriori permeazione, quattro tipi di modello delle cellule di collagene differenti sono stati utilizzati come barriere in una membrana 12-pozzetti inserire sistema. Questi modelli comprendono un modello senza cellula e un modello di cellulare con diverse combinazioni di fibroblasti primari nel gel di collagene e HaCaT sulla superficie. Sono state utilizzate le seguenti combinazioni: collagene (col.) come un modello senza cellula, collagene + fibroblasti (col. + F.), HaCaT (col. + H.), + fibroblasti e collagene, collagene + HaCaT (col. + F. + H.). Sale di sodio di fluoresceina con DMEM + 10% FCS è stato utilizzato come sostanza donatrice. Per immagine analisi del modello di cella del collagene, colorazione con ematossilina ed eosina (lui) è stato usato. Questa colorazione è stato fatto utilizzando il protocollo del produttore. In Figura 5, è indicata tale una macchia con un modello rappresentativo di col. + F. + h... L'HE macchie leggermente la struttura del tessuto della matrice del collagene. I fibroblasti si trovano nella matrice e i nuclei dei fibroblasti e cellule HaCaT sono colorati in viola scuro. Sulla parte superiore della matrice di collagene, c'è un livello contenente molti nuclei, che dovrebbero essere i nuclei di HaCaTs, creazione di un livello di inclusione nella parte superiore del modello.
In tabella 5, coefficienti di permeazione sperimentale e i coefficenti di diffusione simulato sono elencati. Una tendenza può essere visto per la maggior parte dei modelli con HaCaT, che hanno coefficienti di permeazione/diffusione inferiori rispetto ai modelli senza HaCaT. L'errore assoluto dei coefficienti di permeazione è 10,9-24,4% e per la diffusione coefficienti 5,2% - 12,9%.
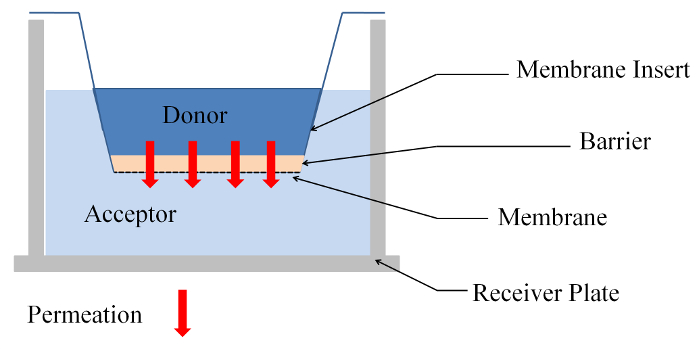
Figura 1: Vista laterale dell'esperimento in una membrana permeabilità inserire sistema. Clicca qui per visualizzare una versione più grande di questa figura.
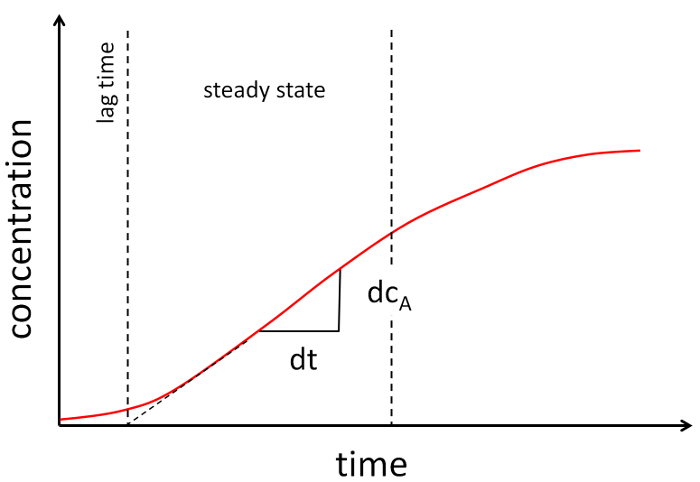
Figura 2: grafico esemplare di un esperimento di permeabilità. La concentrazione di acceptor viene tracciata nel corso del tempo. Due linee tratteggiate staffa parte quasi lineare del grafico. La pendenza della parte lineare viene utilizzata per determinare il coefficiente di permeabilità. Clicca qui per visualizzare una versione più grande di questa figura.
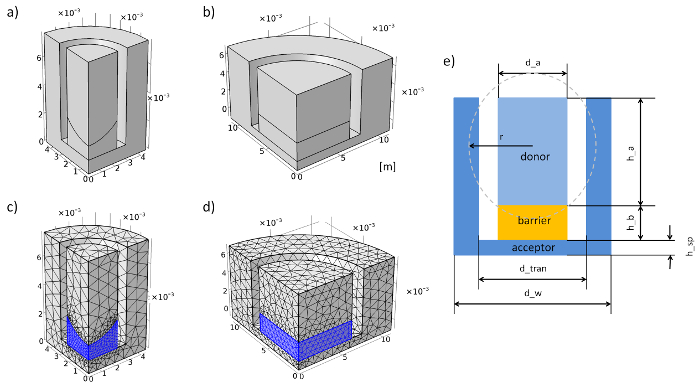
Figura 3: geometria e mesh della membrana inserire il sistema nella simulazione. (un) geometria della membrana 96 pozzetti sistema di inserimento. sistema di fissaggio (b) geometria della membrana 12-pozzetti. sistema di fissaggio (c), maglia della membrana 96 pozzetti. sistema di fissaggio (d), maglia della membrana 12-pozzetti. (e) sistema di inserti di sezione trasversale e parametri della membrana. Clicca qui per visualizzare una versione più grande di questa figura.
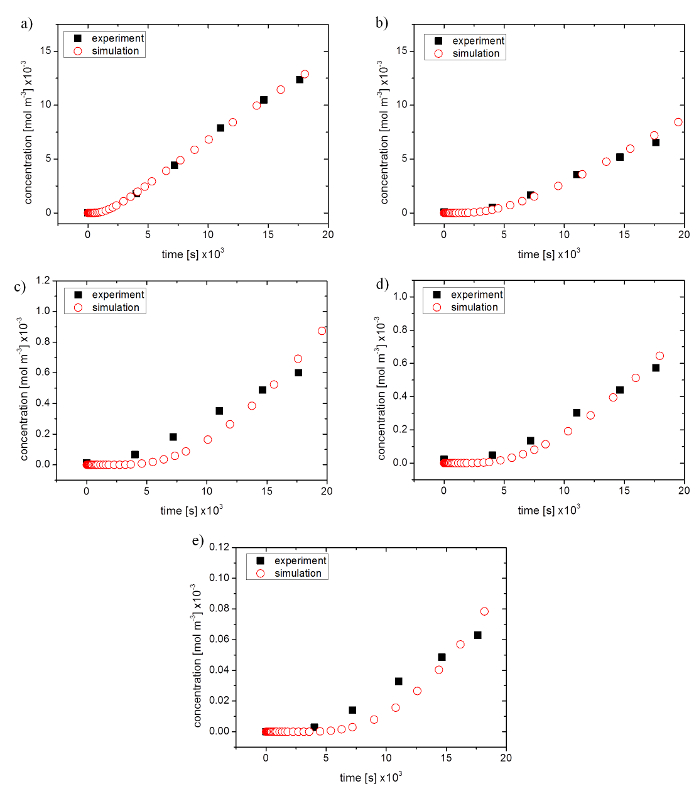
Figura 4: confronto tra i dati sperimentali da un esperimento di permeazione per la simulazione ottimizzata. sale di sodio (un) della fluorescina, (b) della fluorescina isotiocianato-destrano 4.000 mol WT, (c), 10.000 mol WT, (d), 20.000 mol WT e (e) 40.000 mol WT Clicca qui per visualizzare una versione più grande di questa figura.
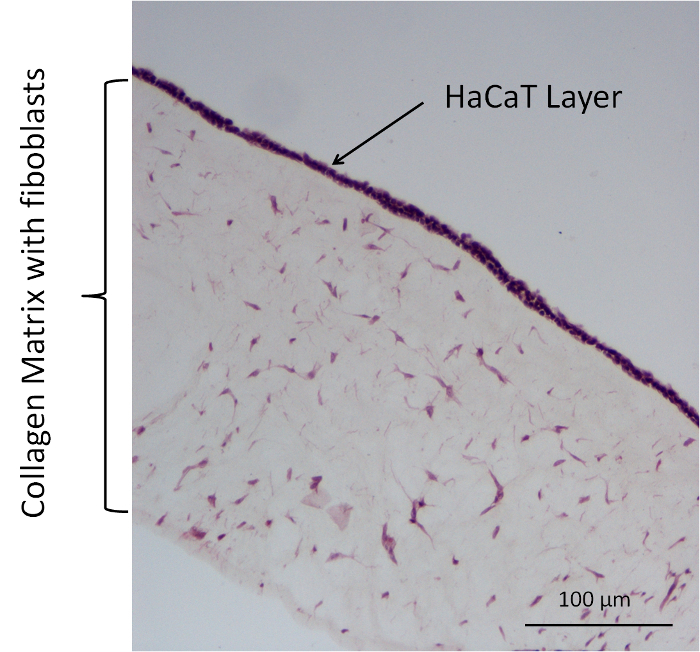
Figura 5: rappresentante HE colorazione di un modello di cella di collagene (collagene, fibroblasti + HaCaT). Clicca qui per visualizzare una versione più grande di questa figura.
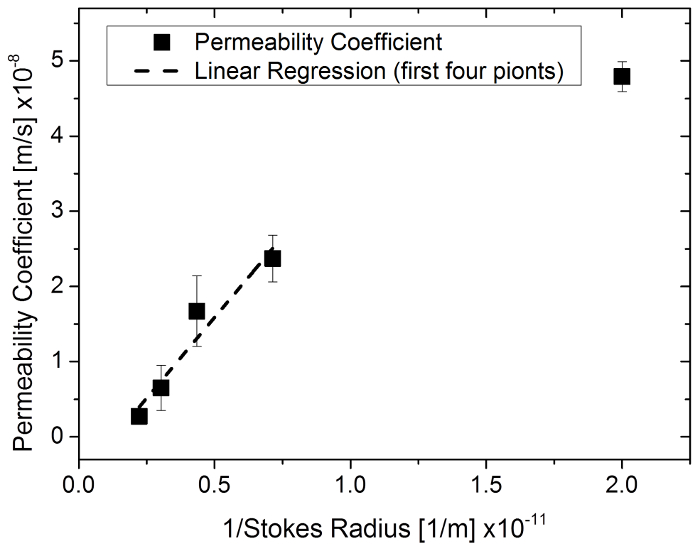
Figura 6: coefficiente di permeabilità in funzione del raggio 1/Stokes utilizzando sale sodico della fluorescina e della fluorescina isotiocianato-destrano in una membrana di 96 pozzetti inserire sistema. Clicca qui per visualizzare una versione più grande di questa figura.
| Nome | Experession per sistema ben 96 mm | Experssion per sistema 12-pozzetti in mm | Descrizione |
| d_tran | 5,65 [mm] | 14,7 [mm] | Diametro del pozzo |
| d_a | 4,26 [mm] | 12.1 [mm] | Diametro della membrana |
| d_w | 8.79 [mm] | 21,97 [mm] | Diametro di Acceptor |
| h_b | 2 [mm] | 2 [mm] | Heigh della barriera |
| h_sp | 1 [mm] | 1 [mm] | Distanza tra bene e inferiore |
| olly | 4.73 [mm] | 5,24 [mm] | Alta: l'accettore |
| b | h_b/2 | - | Profondità di immersione |
| r | ((d_a)^2+4*b^2)/(8*b) | - | Raggio della sfera di immersione+ |
| R_Z | r + h_b | - | z-posizione della palla immersione+ |
Tabella 1: parametri di geometria per la simulazione di "Trasporto di specie chimiche". + Solo per essere usato per la simulazione di agarose gel nella membrana ben 96 inserire sistema.
| Nome | Espressione | Valore | Descrizione |
| C_fl | 0,1 [mg/ml]/376.28 [g/mol] | 0.26576 mol/m2 | Concentrazione di Fl.So. |
| C_4 | 2 [mg/ml] / 4000 [g/mol] | 0,5 mol/m2 | Concentrazione di FD 4.000 |
| C_10 | 2 [mg/ml] / 10000 [g/mol] | 0,2 mol/m2 | Concentrazione di FD 10.000 |
| C_20 | 2 [mg/ml] / 20000 [g/mol] | 0,1 mol/m2 | Concentrazione di FD 20.000 |
| C_40 | 2 [mg/ml] / 40000 [g/mol] | 0,05 mol/m2 | Concentrazione di FD 40.000 |
| Dif_w | 1E-9 [m ^ 2/s] | 1E - 9m/s2 | Coefficente di diffusione d'acqua d'impasto |
Tabella 2: Parametri fisici per la simulazione di "Trasporto di specie chimiche".
| Nome | Espressione | Descrizione |
| C | Acceptor(c) | Definizione della concentrazione accettore |
| D | D_search * 1e-10 | Cambiamento di fattore d |
Tabella 3: Parametri per la simulazione di "Ottimizzazione".
| Permeare | Coefficiente di permeabilità (m/s) x 10-8 | Coefficente di diffusione (m/s2) x 10-10 | Raggio di Stokes di permeato (m) x 10-10 |
| Fl.So. | 4.79 ± 0,20 | 1,94 ± 0.34 | 5 |
| FD 4.000 | 2.37 ± 0,31 | 0.65 ± 0,12 | 14 |
| FD10, 000 | 1,67 ± 0,47 | 0.22 ± 0.02 | 23 |
| FD 20.000 | 0.65 ± 0,30 | 0,29 ± 0,04 | 33 |
| FD 40.000 | 0,27 ± 0,08 | 0,14 ± 0.02 | 45 |
Tabella 4: coefficiente di permeabilità e la diffusione di sostanze con diverso raggio di Stokes tramite gel di agarosio al 2% + membrana in una membrana di 96 pozzetti inserire sistema. (sale di sodio di fluorescina = FL. So., fitc destrano = FD).
| Modello | Coefficiente di permeabilità (m/s) x 10-8 | Coefficente di diffusione (m/s2) x 10-10 |
| Col. | 2.18 ± 0.29 | 1.22 ± 0,06 |
| Col. + F. | 1.77 ± 0,38 | 0.93 ± 0,12 |
| Col. + H. | 1.64 ± 0,40 | 0.96 ± 0.05 |
| Col. + F. + H. | 1,65 ± 0.18 | 0.88 ± 0,11 |
Tabella 5: coefficiente di permeabilità e la diffusione di sale sodico della fluorescina attraverso un modello di cellulare di collagene in un 12-membrana ben inserire sistema (col. = collagene, F. = fibroblasto, H. = HaCaT).
Discussione
Questo studio documenta un metodo sviluppato per quantificare la permeazione attraverso un tessuto-costrutto ingegnerizzato su una membrana. Permeazione di sostanze con diverse dimensioni molecolari attraverso gel dell'agarosi in primo luogo è stato esaminato per testare e convalidare il metodo e la simulazione corrispondente. È noto che più piccole molecole permeano più velocemente attraverso una maglia di matrice (fatta eccezione per l'effetto in gel filtrazione mediante cromatografia di permeabilità). Osservazioni simili sono state fatte con gli esperimenti di esclusione dimensionale delle sostanze attraverso la sclera26, membrana epidermica umana27, pelle umana17e ratto pelle28. Una correlazione inversa tra coefficienti di permeabilità e il corrispondente raggio di Stokes (il raggio di una sfera duro che si muove con lo stesso tasso di diffusione come le molecole descritte, solitamente più piccole rispetto al raggio efficace della molecola) ha dimostrato 26 , 28e una relazione simile è stato osservato negli esperimenti con sostanze di diverse dimensioni molecolari. Tracciando i coefficienti di permeabilità nel raggio di 1/Stokes, è stata trovata una correlazione lineare sopra i quattro gruppi con la più piccola dimensione molecolare (R2 = 0.93) (Figura 6). Ciò indica che i coefficienti di permeabilità simulato con il metodo suggerito sono in un intervallo realistico.
L'errore di 46.15% negli esperimenti è leggermente più grande rispetto a quanto indicato per gli esperimenti di permeabilità con Franz diffusione cellulare sistema10. Una possibile spiegazione potrebbe essere la distribuzione di dimensione di fluorescina-isotiocianato-destrano, che è discussa più avanti.
Il metodo descritto presenta importanti vantaggi rispetto ai metodi che utilizzano il sistema di celle di diffusione di Franz. In primo luogo, l'installazione è più compatto; gli esperimenti vengono eseguiti direttamente in un sistema di fissaggio della membrana, che ha la scala di una piastra commerciale ben (∼ 13 cm x 8,5 cm). In questo modo più campioni essere eseguiti contemporaneamente, considerando che una cella di diffusione di Franz separata è necessaria per ogni campione. In secondo luogo, la permeabilità di un modello di pelle può essere misurata direttamente nell'inserto della membrana, dove avviene la coltivazione. Utilizzando celle di diffusione di Franz, i campioni devono essere portati fuori e montati sul sistema, che è più ingombrante per i piccoli campioni ed è anche più che richiede tempo.
Esperimenti di permeazione con matrici di collagene delle cellule ha mostrato che questo metodo può essere applicato con successo ai sistemi delle cellule-seminato. Il modello qui presentato è stato verificato per i modelli di pelle; Tuttavia, il metodo può essere applicato ad altri tipi di colture di cellule organiche, per esempio, malattie renali o epatiche.
In questo studio, è stato utilizzato un modello di collagene-cellula in cui le cellule HaCaT coperto completamente la superficie del modello (vedere Figura 5). Ciò ha condotto ad una riduzione del coefficiente di permeabilità, dimostrando che il metodo è abbastanza sensibile per distinguere il coefficiente di permeabilità tra un modello di collagene-cellulare con e senza uno strato di HaCaT. Idealmente, un modello della pelle dovrebbe costituire una barriera, che si avvicina l'epidermide di una vera e propria pelle29, ed è quindi importante verificare la qualità (ad es., edificio del derma, epidermide) del modello della pelle prima dell'uso effettivo. Lo sviluppo di un modello di pelle possa essere visualizzato con tecniche di colorazione e quantificato dal rilevamento di pelle collagene e proteine30,31,32. Il coefficiente di permeabilità può anche essere un fattore importante per valutare lo sviluppo del modello della pelle, ma sono necessari ulteriori esperimenti per confermare questo. Come accennato in precedenza, questo metodo consente l'esecuzione di campioni multipli in parallelo. È anche possibile prelevare campioni durante la coltivazione per misurare la permeabilità e quindi osservare lo sviluppo di questo parametro del modello della pelle.
Si deve osservare che la permeabilità è misurata attraverso un gel/collagene-cella-modello e una membrana contemporaneamente. Il coefficiente di permeabilità rilevati è specifico del sistema, per cui i risultati dei modelli differenti della pelle possono essere paragonati soltanto quando si utilizza l'inserto della membrana stessa. Inoltre, il modello di pelle ha bisogno coprire l'area intera coltivazione al fine di garantire che la sostanza in esame permei solo attraverso il modello e non adiacente ad esso, che potrebbero indurre errori nella permeabilità misurata. Un altro aspetto che dovrebbe essere considerato in futuro esperimenti è l'ambiente naturale che circonda la pelle. Normalmente, la temperatura della superficie della pelle è inferiore rispetto la regione interna, che può influenzare le condizioni di permeazione.
Al fine di allineare gli esperimenti di laboratorio con simulazioni al computer, è stato presentato un metodo che consente l'ottimizzazione dei parametri per la simulazione applicata. Simulazioni sono state trovate in concomitanza anche con i dati sperimentali per sostanze con piccole dimensioni molecolari. Tuttavia, sono stati osservati scostamenti tra dati sperimentali e simulazione per sostanze con dimensioni molecolari. Polisaccaride grandi molecole possono aumentare l'attrito e rallentare il processo di diffusione in un gel. Questo effetto provoca diffusione anomala, che è un motivo possibile per la deviazione fra sperimentale e simulazione valori33,34. Un'altra spiegazione potrebbe essere la presenza di particelle più piccole o più grandi in fluorescina-isotiocianato-destrano. Il produttore specifica il peso molecolare della sostanza come la dimensione media con un determinato intervallo, che permette grandi e piccole particelle di essere presenti. È anche poco chiaro come disperse queste sostanze sono, come le più piccole particelle permeano più velocemente attraverso il gel e il canale di fluido. È possibile estendere la simulazione per considerare questi diffusione e gli effetti di attrito.
L'esperimento di permeabilità e la simulazione sono stati sviluppati per l'uso in un 2-oC. Con l'aiuto della simulazione, questo metodo sperimentale possa essere trasferito direttamente ai più sofisticate messe a punto sperimentali. Ad esempio, la simulazione di sistema inserto di membrana possa essere facilmente trasferita alla geometria di un 2-OC o ad altri sistemi con configurazioni simili. Questa opzione di modulare la simulazione può essere utilizzata per supportare la progettazione di futuri esperimenti. Inoltre, gli effetti collaterali come evaporazione, anormale diffusione e gli effetti della membrana può essere integrati per migliorare la simulazione, migliorando così la precisione. Il programma di simulazione dà l'opportunità di modificare o migliorare l'equazione di simulazione, nonché a integrare altri moduli fisici al fine di indagare altri aspetti dello sviluppo del modello di pelle. Un esempio è la simulazione della produzione di lattato e consumo di glucosio in un modello cellulare di collagene.
Un aspetto particolarmente interessante nella sperimentazione delle sostanze mediche è come le sostanze sono distribuite in un sistema di organo-on-a-chip. Il parametro di simulazione e permeabilità mio aiuto per rispondere a domande quali quanto velocemente una sostanza permea nel sistema e che la concentrazione sarà disponibile per altri tessuti in un chip multi-organ. Questo metodo può sostenere e promuovere lo sviluppo e la sperimentazione di tali sistemi organo-on-chip.
Divulgazioni
Uwe Marx è l'amministratore delegato e azionista e Gerd Lindner è un azionista di TissUse GmbH, società di produzione e commercializzazione della tecnologia MOC. Altri autori non dichiarano alcun conflitto di interessi per quanto riguarda la pubblicazione di questo libro.
Riconoscimenti
Questo lavoro è stato creato con il sostegno finanziario dalla Deutsche Forschungsgemeinschaft (DFG) sotto grant No. PO413/12-1 e LA 1028/7-1.
Materiali
| Name | Company | Catalog Number | Comments |
| Agarose | Carl Roth | K297.2 | High Resolution Powder |
| Collagen | Serva | 47256.01 | Collagen R solution 0.4 % |
| DMEM | Lonza (Biozym Scientific GmbH) | 880010-12 | High Glucose with L-Glutamine |
| FCS | Biochrom GmbH | S0615 0114F | Fetal Calf Serum |
| Fluorescein Sodium Salt | Sigma-Aldrich | 46960-25G-F | |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | 46944-500MG | 4000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD10S-250MG | 10 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD20S-250MG | 20 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD40S-250MG | 40 000 g/mol |
| HBSS | ThermoFisher Scientific | 14170120 | no calcium, no magnesium , with phenol red |
| NaOH | Merck | 1.06467.9010 | granulated |
| PBS | Gibco | 18912-014 | tablets |
| Transwell Cell Culture Inserts | Corning | 3391 | 96 well, 0.4 µm pore size |
| Transwell Cell Culture Inserts | Corning (VWR) | 734-1563 | 12 well, 0.4 µm pore size |
| Trypsin | Biochrom GmbH | L2143 | with EDTA |
Riferimenti
- Marx, U., et al. Human-on-a-chip developments: a translational cutting-edge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man?. ATLA. 40 (5), 235-257 (2012).
- Maschmeyer, I., et al. Chip-based human liver-intestine and liver-skin co-cultures - A first step toward systemic repeated dose substance testing in vitro. Eur J Pharm Biopharm. 95, 77-87 (2015).
- Prunieras, M., Regnier, M., Woodley, D. Methods for Cultivation of Keratinocytes with an Air-Liquid Interface. J Invest Dermatol. 81 (1), 28-33 (1983).
- Cannon, C. L., et al. New epidermal model for dermal irritancy testing. Toxicol In Vitro. 8 (4), 889-891 (1994).
- Ackermann, K., et al. The Phenion Full-Thickness Skin Model for Percutaneous Absorption Testing. Skin Pharmacol Physiol. 23 (2), 105-112 (2010).
- Netzlaff, F., et al. Permeability of the reconstructed human epidermis model Episkin in comparison to various human skin preparations. Eur J Pharm Biopharm. 66 (1), 127-134 (2007).
- Bran, B., et al. A New Discriminative Criterion for the Development of Franz Diffusion Tests for Transdermal Pharmaceuticals. J Pharm Sci. 13 (2), 218-230 (2010).
- Pineau, A., et al. In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J Inorg Biochem. 110, 21-26 (2012).
- Filon, F. L., et al. In vitro percutaneous absorption of cobalt. Int Arch Occup Environ Health. 77 (2), 85-89 (2004).
- Ng, S. -. F., et al. Validation of a Static Franz Diffusion Cell System for In Vitro Permeation Studies. AAPS PharmSciTech. 11 (3), 1432-1441 (2010).
- Bonferoni, M. C., et al. A Modified Franz Diffusion Cell for Simultaneous Assessment of Drug Release and Washability of Mucoadhesive Gels. Pharm Dev Tecnol. 4 (1), 45-53 (1999).
- Seiffer, S., Oppermann, W. Systematic evaluation of FRAP experiments performed in a confocal laser scanning microscope. J Microsc. 220 (1), 20-30 (2005).
- Pluen, A., et al. Diffusion of Macromolecules in Agarose Gels: Comparison of Linear and Globular Configurations. Biophys J. 77, 542-552 (1999).
- Cornelissen, L. H., et al. Diffusion measurements in epidermal tissues with fluorescent recovery after photobleaching. Skin Res Technol. 14 (4), 462-467 (2008).
- Pirot, F., et al. Characterization of the permeability barrier of human skin in vivo. PNAS. 94 (4), 1562-1567 (1997).
- Tetteh, J., et al. Local examination of skin diffusion using FTIR spectroscopic imaging and multivariate target factor analysis. Anal Chim Acta. 642 (1-2), 246-256 (2009).
- Guldbrand, S., et al. Two-photon fluorescence correlation spectroscopy as a tool for measuring molecular diffusion within human skin. Eur J Pharm Biopharm. 84 (2), 430-436 (2013).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Rech. 291 (11), 600-605 (1999).
- Veronike, M., et al. Epidermal Organization and Differentiation of HaCaT Keratinocytes in Organotypic Coculture with Human Dermal Fibroblasts. J Invest Dermatol. 112 (3), 343-353 (1999).
- Moraes, C., et al. Organs-on-a-chip: a focus on compartmentalized microdevices. Ann Biomed Eng. 40 (6), 1211-1227 (2012).
- Huh, D., et al. From Three-Dimensional Cell Culture to Organs-on-Chips. Trends Cell Biol. 21 (12), 745-754 (2011).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab Chip. 13 (18), 3588 (2013).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), (2015).
- Materne, E. -. M., et al. A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing. J Biotechnology. 205, 36-46 (2015).
- Materne, E. -. M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing - organotypicalness versus cost-efficient high throughput. Lab Chip. 13 (18), 3481 (2013).
- Jayakrishna, A., et al. Diffusion of High Molecular Weight Compounds through Sclera. IOVS. 41 (5), 1181-1185 (2000).
- Peck, K., et al. Hindered Diffusion of Polar Molecules Through and Effective Pore Radii Estimate of Intact and Ethanol. Pharm Res. 11 (9), 1309-1314 (1994).
- Ogiso, T., et al. Mechanism of the Enhancement Effect of n-Octyl-β-D-thioglucoside on the Transdermal Penetration of Fluorescein Isothiocyanate-Labeled Dextrans and the Molecular Weight Dependence of Water-Soluble Penetrants through Stripped Skin. J Pharm Sci. 83 (12), 1676-1681 (1994).
- Hadgraft, J. Skin, the final frontier. Int J Pharm. 224 (1-2), 1-18 (2001).
- Asselineau, D., et al. Human Epidermis Reconstructed by Culture: Is It "Normal"?. J Invest Dermatol. 86 (2), 181-186 (1986).
- Casasco, A., et al. Cell proliferation and differentiation in a model of human skin equivalent. Anat Rec. 264 (3), 261-272 (2001).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Res. 291 (11), 600-605 (1999).
- Laurent, T. C., et al. Diffusion of Dextran in Concentrated Solutions. Eur J Biochem. 68, 95-102 (1976).
- Metzler, R., Klafter, J. The random walk's guide to anomalous diffusion: A fractional dynamics approach. Phys Rep. 339 (1), 1-77 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon