Method Article
Eine Methode zur Bestimmung und Simulation von Durchlässigkeit und Diffusion in einem 3D Gewebe-Modell in einer Membran einfügen System für Multi-well-Platten
In diesem Artikel
Zusammenfassung
Eine Methode zur Bestimmung der Durchlässigkeit in einer Membran einfügen System für Multi-well-Platten und in Silico Parameteroptimierung für die Berechnung des Diffusionskoeffizienten mittels Simulation werden vorgestellt.
Zusammenfassung
In Vitro kultiviert Hautmodelle für pharmazeutische und kosmetische Anwendungen zunehmend relevant geworden und auch in der Medikamentenentwicklung sowie Substanz Tests eingesetzt. Diese Modelle werden meist in Membran-Insert-Systeme, deren Durchlässigkeit gegenüber verschiedenen Substanzen wird ein wesentlicher Faktor kultiviert. Angewandte Methoden zur Bestimmung dieser Parameter erfordern in der Regel in der Regel große Stichproben (z.B. Franz Diffusion Zelle) oder aufwändige Ausrüstung (z.B. Fluoreszenz Erholung nach Immunofluoreszenz (FRAP)). Diese Studie stellt eine Methode zur Bestimmung der Durchlässigkeit Koeffizienten direkt in Membran-Insert-Systeme mit Durchmessern von 4,26 und 12,2 mm (Anbaufläche). Die Methode wurde mit Agarose und Kollagen Gele sowie ein Kollagen Zellmodell Vertretung Hautmodelle validiert. Die Permeation Prozesse von Stoffen mit verschiedenen molekularen Größen und Permeation durch verschiedene Handy-Modelle (bestehend aus Kollagen Gel, Fibroblasten und HaCaT) wurden genau beschrieben.
Um die oben genannten experimentellen Methode zu unterstützen, wurde darüber hinaus eine Simulation gegründet. Die Simulation passt die experimentellen Daten gut für Stoffe mit kleinen Molekülgröße, bis zu 14 x 10-10 m Stokes Radius (4.000 MW), und ist somit ein viel versprechendes Instrument, um das System zu beschreiben. Darüber hinaus ist die Simulation experimentelle Anstrengungen erheblich reduzieren kann und robust genug ist, erweitert oder komplexere Setups angepasst werden.
Einleitung
Organo-typische 3D Kulturen sind leistungsfähige Werkzeuge für Medikamentenentwicklung und Substanz Test1geworden. In dieser Hinsicht sind menschliche Hautmodelle von besonderem Interesse aufgrund gesetzlicher Vorschriften, wie Sie in der Kosmetikindustrie. Sie führten später zur Entwicklung von zahlreichen 3D Hautmodelle für den Einsatz entweder auf eigenen als Einzel-Orgel-Kultur im Multi-well-Platten oder multi-organ-Chips in Kombination mit zusätzlichen Orgel Modelle, z.B., die Leber2.
In Bezug auf Anbau eines Haut-Äquivalent ist die Luft-Flüssigkeit-Schnittstelle (ALI) ein wesentliches Element für richtige epidermalen Differenzierung3. Zelle Kultur Einsätze bestehend aus einem Gefäß mit einer Flüssigkeit-durchlässige Membran an der Unterseite dienen in der Regel ein ALI zu etablieren. ALIs sind weit verbreitet in handelsüblichen Hautmodelle z. B. EpiDerm4und Phenion5Episkin6, für die Kultur der Hautmodelle mit Größen von 96-Well (4,26 mm im Durchmesser) bis zu 12-Well (12,2 mm im Durchmesser) Platten genutzt. Die hier beschriebene Methode bestimmt die Durchdringung von Stoffen in einem Membran-Insert-System.
Die Durchlässigkeit Koeffizienten ist ein wichtige Parameter zur Beurteilung der Qualität von jedem kultivierten Haut-Modell im Vergleich zu nativen Haut5und wird verwendet, um zu beurteilen, wie schnell Wirkstoffe durch die Haut wandern. Vor allem, wenn Drogen oder Kosmetik Produkte auf die Haut aufgetragen werden müssen, ist dieser Parameter wichtig zu verstehen, wenn genau die Wirkstoffe passieren. Eine Simulation kann weiter helfen, um das Verhalten des Systems und anschließend die erforderliche zeitaufwändige experimentelle Anstrengungen zu reduzieren, vor allem, wenn eine große Anzahl von Substanzen beteiligt ist.
Die Franz-Diffusion-Zelle ist State-of-the-Art für Permeation mit Haut experimentiert und Haut-5,6,7,8,9 Modelle. Dieses Gerät besteht aus zwei Kammern mit einer festen Probe (Diffusionssperre) dazwischen. Die zu testende Substanz wird direkt an die Spitze der Stichprobe (Spender Fach) angewendet und die Konzentration der permeierenden Verbindung detektiert werden, auf der gegenüberliegenden (Akzeptor) Fach. Auf der Seite Akzeptor sind konstante Temperatur und Konzentration homogene Substanz durch eine Temperatur-Kammer und ein Magnetrührer sichergestellt. Proben können auf der Akzeptor-Seite der Franz-Zelle eine Probenahme Arm entnommen. Dieses System ist mit einem Höhenbereich zwischen 19 cm und 179 cm relativ große10,11. Eine weitere Methode zur Bestimmung des Diffusionskoeffizienten in Gel-artige Substanzen und Geweben ist FRAP. Diese Technik nutzt das Prinzip der bleichen Eindringmittel gekennzeichnet Partikel in das Gel und dann bestimmen die Regenerationszeit des gebleichten Bereich zur Berechnung der Diffusion Koeffizient12,13,14.
Darüber hinaus (FTIR) Fourier-Transform-Infrarot-Spektroskopie lässt sich Partikelbewegung mit Infrarot-Licht Absorption zu erkennen um die Permeation von Stoffen in Haut15,16bestimmen. Jedoch müssen diese oder andere bildgebenden Verfahren (z.B. zwei-Photonen-Fluoreszenz Korrelation Spektroskopie17) intensive Instrumente Kosten.
In diesem Artikel wird eine Methode direkt messen vorgestellt die Durchlässigkeit einer Barriere innerhalb einer Membrananlage einfügen wo ein Hautmodell angebaut werden. Diese Methode ermöglicht Durchlässigkeit Experimente mit einer großen Anzahl von kleinen Proben (gut bis 4,26 mm Größe) in einem kompakten System ausgeführt werden. Dies steht im Gegensatz zu Franz Diffusion Zelle, wo ein separates Gerät braucht man für jede Sonde, die auf dem Gerät montiert werden und ist schwer, für kleine Proben (4,26 mm Größe) zu realisieren. Da die Methode keine Großgeräte (z.B. ein multiphoton oder confocal Mikroskop) erforderlich ist, ist darüber hinaus eine Reduzierung Zeit-und Kosteneinsparungen erzielt.
Alles, was die Experimente, in mikroporösen Membran durchgeführt wurden einfügen Systeme mit einer Probe (Barriere) bestehend aus Agarosegel oder eine Kollagen-Zellmodell gegründet auf der Membran. Fluoreszierende Stoffe (Spender) mit unterschiedlichen molekularen Größen wurden an die Spitze der Stichprobe angewendet und die Konzentration des Stoffes durchdrungen auf der Unterseite (Akzeptor) mit einem Fluoreszenz-Platte-Kartenleser erkannt wurde (siehe Abbildung 1). Um die Methode zu validieren und testen die Genauigkeit der Simulation, wurden Agarose-Gele produziert und verwendet als Barriere. Hydrogele sind in der Regel für die Untersuchung der Diffusion und Permeation Prozesse in porösen Medium in den biologischen Wissenschaften13verwendet. Die Methode wurde dann in eine Zelle ausgesät System bestehend aus einem Kollagen-Matrix primäre Fibroblasten und menschlichen Erwachsenen niedrige Kalzium hohe Temperatur Keratinozyten (HaCaT) Zellen (Zelle-Matrix-Modell), die eine vereinfachte Haut Modell18,19 ist getestet .
Darüber hinaus wurde die Permeation Prozess mittels Strömungssimulationen mit computational Fluid Dynamics – simuliert. Es wurde festgestellt, dass die Diffusionskoeffizienten mittels Parameteroptimierung, konnte aus den experimentellen Daten berechnet werden. Diese Simulation bietet in der Regel verschiedene Anwendungen; zum Beispiel ist es möglich, vorherzusagen, eine Permeation beruhend auf kurze Experimente und die Simulation kann erheblich reduzieren die Anzahl der Experimente.
Experimentelle Methode und Simulation wurden entwickelt für die Anwendung auf eine Orgel-on-a-Chip-System1,20,21, kommerziell entwickelt, speziell der 2-Orgel-Chip (2-OC)1,22, 23,24,25. Im Prinzip kann der Permeation Prozess von jedem Organ-Modell basierend auf Membran-Insert-Systeme auf diese Weise beschrieben werden.
Protokoll
1. Vorbereitung der Probe für Durchlässigkeit Studien
Hinweis: Zur Permeation Messungen und Simulationen zu überprüfen, wurde eine Stichprobe aus Agarosegel oder eine Zelle-Matrix-Modell basierend auf Anbau von Hautmodell verwendet.
- Agarose-gel
- 0,2 g Agarose hochauflösende Pulver in 10 mL H2O (bidestilliertem Wasser) auflösen.
- Mischen Sie die Lösung und erhitzen Sie es bis zu 80 ° C. Behalten Sie die Temperatur für 8 Minuten.
- 28.6 µL Agarose-Gel auf die Membran des 96-Well-Membran einfügen Systems (4,26 mm Durchmesser) oder Verwendung 226 µL für die 12 gut Membran fügen Sie System (12 mm Durchmesser) (z.B. Transwell System).
- Warten Sie 10 min, bis das Gel verfestigt wird.
- Kollagen gel
Hinweis: Alle Schritte sind unter sterilen Bedingungen durchgeführt und die Lösungen befinden sich auf dem Eis, um die Polymerisation von Kollagen-Gel zu verlangsamen.- Mix 125 µL von Hanks' Balanced Salz Lösung (HBSS) mit 1 mL 0,4 % Kollagen R Lösung (Ratte Schweif Kollagen).
- Titrieren Sie die Lösung mit 1 M NaOH (Natriumhydroxid) (~ 6 µL), bis die Farbe von Phenol rot wechselt von gelb auf rot.
- Das Kollagen Gel 125 µL Dulbeccos geändert Eagle Medium (DMEM) + 10 % fetalen Kälberserum (FCS) hinzufügen und mit einer Pipettenspitze vorsichtig vermengen.
- 28.6 µL Kollagen Gel auf die Membran des 96-Well-Membran einfügen Systems oder 226 µL für die 12-Well-Membran fügen Sie System.
- Lassen Sie das Gel in einem Inkubator (37 ° C, 5 % CO2) für 30 min.
- Kollagen Zellmodell mit Fibroblasten
Hinweis: Alle Schritte werden unter sterilen Bedingungen ausgeführt.- Bereiten Sie primäre Fibroblasten 5-7 Tage vor dem Experiment. Pflegen Sie die Fibroblasten mit DMEM + 10 % FCS in Zellkulturflaschen (75 cm2) und verändern Sie alle 2-3 Tage das Medium.
Hinweis: Je nach Versuchsaufbau, kann eine größere Anzahl von Zellen verwendet werden. - Entfernen Sie das Medium aus der Zelle Kultur Kolben (80 % Zusammenfluss) und waschen zweimal mit 10 mL (Kultur-Kolben 75 cm2) Phosphat gepufferte Kochsalzlösung (PBS). Fügen Sie 3 mL 0,05 % Trypsin / Ethylenediaminetetraacetic Säure (EDTA) und 3 min bei 37 ° c inkubieren
- Tippen Sie sanft auf den Kultur-Kolben, die Zellen von der Oberfläche zu lösen. Stoppen Sie die Reaktion durch Zugabe von 3 mL DMEM + 10 % FCS. Übertragen Sie die Lösung in ein Zentrifugenröhrchen.
- Die Zellsuspension bei 120 X g Zentrifugieren, überstand zu entfernen und Aufschwemmen der Zellen mit 0,5 mL DMEM + 10 % FCS.
- Zählen der Zellen und zu einer Konzentration von 0,5 x 106 Zellen/mL einstellen.
Hinweis: Die folgenden Schritte werden auf dem Eis zu verlangsamen die Polymerisation von Kollagen Gel ausgeführt. - Mix 125 µL HBSS mit 1 mL 0,4 % Kollagen R Lösung.
- Die Lösung mit 1 M NaOH titrieren (~ 6 µL) bis die Farbe von Phenol rot von gelb zu rot wechselt.
- Fügen Sie 125 µL Zellsuspension (DMEM + 10 % FCS + 0,5 x 106 Zellen/mL) in das Kollagen gel und mit einer Pipette vorsichtig vermengen.
- 28.6 µL Kollagen-Gel auf die Membran des 96-Well-Membran einfügen Systems oder 226 µL für die 12-Well-Membran fügen Sie System.
- Lassen Sie das Gel in einem Inkubator (37 ° C, 5 % CO2) für 30 min.
- 75 µL DMEM + 10 % FCS auf die Geloberfläche auftragen und 300 µL auf die Empfänger-Platte der 96-Well-Membran System einfügen. Für die 12-Well-Membran fügen Sie System ein, verwenden Sie ein Volumen von 590 µL für die Oberflächen- und 1.846 µL für die Empfänger-Platte.
- Entfernen Sie das Medium aus der Oberfläche der Zelle-Matrix-Modell (Luftbrücke) und inkubieren Sie Matrix Zellmodell weiter für 7 Tage. 100 µl Medium auf der Unterseite zu verwenden und das Medium jeden Tag verändern.
- Bereiten Sie primäre Fibroblasten 5-7 Tage vor dem Experiment. Pflegen Sie die Fibroblasten mit DMEM + 10 % FCS in Zellkulturflaschen (75 cm2) und verändern Sie alle 2-3 Tage das Medium.
- Kollagen Zellmodell mit HaCaT
Hinweis: Alle Schritte werden unter sterilen Bedingungen ausgeführt.- Vorbereiten der HaCaT 5-7 Tage vor den folgenden Schritten. Die HaCaT mit DMEM + 5 % FCS in eine Zelle Kultur Kolben (75 mm2) pflegen und alle 2-3 Tage das Medium verändern.
Hinweis: Je nach Versuchsaufbau, kann eine größere Anzahl von Zellen verwendet werden. - Entfernen Sie das Medium aus der Flasche und zweimal mit 10 mL (Kultur-Kolben 75 cm2) PBS waschen. Fügen Sie 3 mL 0,05 % Trypsin/EDTA und 10 min bei 37 ° c inkubieren Die Reaktion mit 3 mL DMEM + 10 % FCS zu stoppen. Übertragen Sie die Lösung in ein Zentrifugenröhrchen.
- Die Zellsuspension bei 120 X g Zentrifugieren, überstand zu entfernen und Aufschwemmen der Zellen mit 0,5 mL DMEM + 10 % FCS.
- Zählen der Zellen und zu einer Konzentration von 0,5 x 106 Zellen/mL einstellen.
Hinweis: Die folgenden Schritte werden auf dem Eis zu verlangsamen die Polymerisation von Kollagen Gel ausgeführt. - Mix 125 µL HBSS mit 1 mL 0,4 % Kollagen R Lösung.
- Die Lösung mit 1 M NaOH titrieren (~ 6 µL) bis die Farbe von Phenol rot von gelb zu rot wechselt.
- Das Kollagen Gel 125 µL DMEM + 10 % FCS hinzu und mischen Sie es sorgfältig mit einer Pipette.
- 28.6 µL Zellsuspension auf der Membran des 96-Well-Membran einfügen Systems oder 226 µL für die 12-Well-Membran fügen Sie System.
- Lassen Sie das Gel in einem Inkubator (37 ° C, 5 % CO2) für 30 min.
- 75 µL Zellsuspension auf die Geloberfläche auftragen und 300 µL DMEM + 10 % FCS auf den Empfänger Teller der 96-Well-Membran einfügen System hinzufügen. Für die 12-Well-Membran fügen Sie System ein, verwenden Sie ein Volumen von 590 µL Zellsuspension für die Oberflächen- und 1.846 µL DMEM + 10 % FCS für die Empfänger-Platte.
- 3 Tage inkubieren Sie Matrix Zellmodell; tauschen Sie das Medium nach 2 Tagen.
- Entfernen Sie das Medium aus der Oberfläche der Zelle-Matrix-Modell und inkubieren Sie die Zelle-Matrix-Modell für weitere 7 Tage. 100 µl Medium auf der Unterseite zu verwenden und das Medium jeden Tag verändern.
- Vorbereiten der HaCaT 5-7 Tage vor den folgenden Schritten. Die HaCaT mit DMEM + 5 % FCS in eine Zelle Kultur Kolben (75 mm2) pflegen und alle 2-3 Tage das Medium verändern.
- Kollagen Zellmodell mit Fibroblasten und HaCaT
Hinweis: Alle Schritte werden unter sterilen Bedingungen auf dem Eis zu verlangsamen die Polymerisation von Kollagen Gel ausgeführt. Vorbereiten der Fibroblasten, wie unter Punkt 1.3 bis Schritt 1.3.5 beschrieben, und bereiten einen Tag später HaCaT wie unter Schritt 1.4 bis Schritt 1.4.4.- Mix 125 µL HBSS in 1 mL 0,4 % Kollagen R Lösung.
- Die Lösung mit 1 M NaOH neutralisieren (~ 6 µL) bis Phenol rot von gelb bis rot violett verfärbt.
- Fügen Sie 125 µL Zellsuspension primäre Fibroblasten bestehend aus DMEM + 10 % FCS + 0,5 x 106 Zellen/mL, das Kollagen gel und vorsichtig umrühren.
- 28.6 µL Zellsuspension auf die Membrane des 96-Well-Membran einfügen Systems oder 226 µL für die 12-Well-Membran fügen Sie System.
- Lassen Sie das Gel in einem Inkubator (37 ° C, 5 % CO2) für 30 min.
- Als nächstes wenden 75 µL DMEM + 10 % FCS auf den Geloberfläche und 300 µL auf dem Empfänger-Teller der 96-Well-Membran System einfügen. Legen Sie für die 12-Well-Membran System, ein Volumen von 590 µL für die Oberflächen- und 1.846 µL für die Empfänger-Platte verwendet wird.
- 1 Tag bei 37 ° C und 5 % CO2inkubieren.
- Entfernen Sie das Medium von der Oberfläche und fügen Sie einer HaCaT Zellsuspension mit 0,5 x 106 Zellen/mL hinzu. Das Volumen ist das gleiche wie unter Schritt 1.5.6 beschrieben.
- 3 Tage inkubieren Sie Matrix Zellmodell; tauschen Sie das Medium nach 2 Tagen.
- Entfernen Sie das Medium aus der Oberfläche der Zelle-Matrix-Modell und inkubieren Sie die Zelle-Matrix-Modell für weitere 7 Tage. 100 µl Medium auf der Unterseite zu verwenden und das Medium jeden Tag verändern.
Hinweis: Für diese Untersuchung wurden 3 Gel/Zellmodell Proben für die 12-Well Membran-Insert-System vorbereitet. Für die 96-Well-Membran System einfügen, haben wir 6 Proben für das Gel/Handy-Modell. Für statistische Zwecke sind 3 Proben üblich. Aber für die Experimente in der 96-Well Membran-Insert-System mit Kollagen-Matrix-Modell erwartet wir Fehler und Abweichungen für die Zellkultur. Daher wählten wir eine größere Anzahl von Proben.
2. Durchlässigkeit Studien in der Membran einfügen System
-
Spender-Substanz
Hinweis: Zwei Fluorescein Natriumsalze (NaFl) entstehen.- NaFl in H2O in einer Konzentration von 0,1 mg/mL und 0,01 mg/mL auflösen. Die verschiedenen Fluorescein erfolgt-Dextranes (FD) mit einem Molekulargewicht von 4.000, 10.000, 20.000 und 40.000 g/Mol werden in H2O in einer Konzentration von 2 mg/mL gelöst. Verwenden Sie diese Lösungen als Spender Substanz für die Durchlässigkeit Experimente (siehe Abbildung 1) mit Agarosegel.
- Bereiten Sie das Setup mit dem Kollagen-Zelle-Modell alle Lösungen mit DMEM + 10 % FCS anstelle von Wasser.
Hinweis: Bereiten Sie Stammlösungen (10 x höhere Konzentration) des Spenders Stoffes. Kleine Abweichungen von der Spender-Konzentration können die Ergebnisse des Experiments Permeabilität beeinflussen.
-
Experimentelle Methode
Hinweis: Die Durchlässigkeit Experiment wird bei 37 ° C und einer Luftfeuchtigkeit von > 90 % ausgeführt. Dieser Parameter wird die Lebensfähigkeit der Zellen gewährleistet. Temperatur beeinflusst den Diffusionsprozess, sodass die gleichen Parameter für die Experimente mit Agarosegel, Kollagen Gel und Kollagen Zellmodell verwendet werden. Die Volume-Informationen in der Klammer bezieht sich auf die 12-Well Membran-Insert-System.- Bereiten Sie eine 96 (oder 12) gut Membran Insert System mit einer Barriere, bestehend aus Agarose-gel (siehe Protokoll 1.1) oder Handy-Modell (siehe Protokoll 1,2 – 1,5) und die Fluoreszenz-Spender-Substanz.
- Bereiten Sie Verdünnungen von 01:10, 01:20, 01:40, 1: 80, 1: 160 und 1:320 des Stoffes Spender für die Errichtung einer Standardkurve. Pipette 300 µL (1.846 µL) jeder Verdünnung in drei Brunnen der Empfänger Platte. Legen Sie für die 12-Well-Membran System verwendet einen separaten Empfänger-Teller. Die serielle Verdünnungen werden verwendet, um die gemessenen Fluoreszenz [RFU] in die entsprechende Konzentration [mg/mL] umwandeln.
- Fügen Sie 75 µL (590 µL) Spender Substanz auf die Probe (Agarose-Gel oder Zelle Modell) und 300 µL (1.846 µL) Akzeptor Substanz (H2O oder DMEM + 10 % FCS) in der Empfänger-Platte (siehe Abbildung 1).
Hinweis: Stellen Sie sicher, dass die Oberflächen der Flüssigkeit in der Membran System einfügen und in der Empfänger-Platte das gleiche Maß haben, hydrostatischen Druck zu vermeiden. - Das gesamte System auf einem Shaker in den Inkubator zu übertragen. Passen Sie das Schütteln um homogene Durchmischung zu erreichen (Gesamthub Umlaufbahn beträgt 1,5 mm, Geschwindigkeit ist eingestellt auf Ebene 3.5, bezogen auf eine Drehung des ~ 480 1/min), ein Konzentrationsgradient zu vermeiden, die den Diffusionsprozess beeinflusst.
- Fluoreszenz in regelmäßigen Abständen stündlich zu bestimmen. Zur Messung der Fluoreszenz, Transfersystem der Membran einfügen in einen leeren Teller und Messung der Fluoreszenz in den Empfänger mit einem Teller-Reader. Verwenden eines Anregung Wellenlänge von 485 nm und Emission von 535 nm für Fluorescein.
- Führen Sie das Experiment für 5 h.
Hinweis: Während der Experimente verdampft die Flüssigkeit aus dem gesamten System. Die Verdunstung ändert sich die Konzentration in den Donor und Akzeptor und beeinflusst die Ergebnisse. Dieser Effekt wird vernachlässigt, bei einer Laufzeit von 5 h, aber für längere Laufzeiten, die es in Betracht gezogen werden sollte.
-
Berechnung der Durchlässigkeit Koeffizienten
- Herstellen der Standardkurve, zeichnen die Fluoreszenz von Verdünnungsreihen versus Konzentration und eine lineare Regression über die Daten durchführen.
- Verwenden Sie die Steigung der linearen Regression, die Fluoreszenz-Daten des Experiments Permeation in Konzentration umwandeln. Im Rahmen dieser Simulation umrechnen Sie Einheiten in Mol/m3.
- Die Konzentration als Funktion im Laufe der Zeit des Grundstückes und der linearen Datensegment (siehe Abbildung 2) zu etablieren.
- Bestimmen Sie die Steigung dieser linearen Teil und die Durchlässigkeit Koeffizienten gemäß der folgenden Gleichung berechnen (siehe das Beispiel in Abbildung 2):
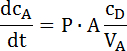
wo dcA/ dt ist die Änderung der Konzentration des Stoffes in der Akzeptor-Seite im Laufe der Zeit (die Steigung); CD ist die Konzentration auf der Geberseite; P ist die Durchlässigkeit Koeffizienten; A ist die Permeation Oberfläche und VA ist das Volumen der Akzeptor. Diese Gleichung Fick'schens erste Hauptsatz abgeleitet ist und kann nur angewendet werden, wenn CD » CA6,22. - Hinweis: Die Konzentrationen in den Spender haben, viel höher als die Konzentration in den Akzeptor erkannt werden. Dies wurde in der Versuchsanordnung verifiziert.
(3) simulation
Hinweis: Die Simulation erfolgte mit COMSOL Multiphysics 5.1. Ein Grundwissen wird vorausgesetzt. Für die Simulation der Diffusion, werden folgende Annahmen getroffen: (a) der Diffusionskoeffizienten von Stoffen in H2O ist viel höher im Vergleich zu dem im Gel. Um diesen Unterschied auszugleichen, wird die Simulation einen Wert von 1 x 10-9 m2/s, der höher ist um den Faktor 10 bis 100 im Vergleich zu den Diffusionskoeffizienten von NaFl durch 2 % Agarose-Gel verwendet. (b) im Experiment die Substanz diffundiert durch die Schranke und fügen Sie dann durch die Membran der Membran System. Im Gegensatz zu den Versuchsaufbau gelten die virtuelle Agarose-Gel oder Zelle Matrix und Membran als eine homogene Phase. (c) Randeffekte an Wänden sind so eingestellt, "no Slip", alle Rutschen Effekt an Wänden (nicht zwischen flüssig und Gel oder Flüssigkeit und Zelle Modell) von der Membran-Insert-System werden vernachlässigt und sind nicht für den Diffusionsprozess von Bedeutung.
- Setup der Diffusion simulation
Hinweis: Diese Schritte demonstrieren das Setup der Simulation des Experiments Durchlässigkeit. Die Simulationen für die 96 - und 12-Well Membran einfügen Systeme wurden separat eingerichtet. Das "chemische Spezies Transportmodul" verwendet eine Formel, die anhand Fick'schens zweiten Gesetzes der Diffusion: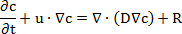
wo c ist die Konzentration des Stoffes, t ist die Zeit, u ist die Geschwindigkeit, ist die Diffusionskoeffizienten D und R ist die Reaktionsgeschwindigkeit. Die Geschwindigkeit der Reaktion wurde vernachlässigt, da keine chemische Reaktion in den Diffusionsprozess aufgetreten ist.- Öffnen Sie das Programm und starten Sie ein neues Modell. Wählen Sie die "Modell-Assistenten", wählen Sie das 3D Modell hinzufügen "Transport of verdünnt Species" Physik-Schnittstelle in der Pull-Down-Menü klicken Sie auf "Studie", wählen Sie die "Zeit-abhängige" Studie, und klicken Sie auf "Fertig".
- Gehen Sie auf die "globale Definitionen" und fügen Sie hinzu "Parameter" mit Rechtsklick. Geben Sie die geometrischen und physikalischen Parameter im Raster (siehe Tabelle 1, Tabelle 2und Abbildung 3e).
Hinweis: Die konkave Oberfläche der Agarose-Gel in einem 96-Well-Membran-Insert-System wurde mit einer Kugel eintauchen angenähert. - Richten Sie die Geometrie der Membran-Insert-System von den Experimenten. Schritt 3.2 ist ein Beispiel wie die Geometrie des 96-Well-Membran einfügen Systems erstellt. Befindet sich die Längeneinheit Meter.
Hinweis: Erstellen Sie nicht die ganze Geometrie um Rechenzeit zu sparen. Stattdessen kann die Geometrie mithilfe von Mittellinien von einem Viertel der Geometrie reduziert werden (siehe Abbildung 3a und Abbildung 3 b). - Fügen Sie zwei "Domain Sonden" in "Definitionen" (rechts klicken Sie auf "Definitionen" und suchen Sie "Sonde") und wählen Sie eine Sonde der Akzeptor-Domäne und der andere als der Spender-Domäne. Wählen Sie für beide "Durchschnittlich" und der Ausdruck "c" mit der Einheit "Mol/m3" geben.
Hinweis: Dieser Schritt ist optional und zeigt die Konzentration der Akzeptor und Spender während der Simulation. - Legen Sie die Diffusionskoeffizienten (Dc) in "Transporteigenschaften 1" in "Transport verwässertes Arten"als "Dif_w".
Hinweis: "Transporteigenschaften 1" ist für Empfänger und Spender Domäne verwendet. Im nächsten Schritt wird die Barriere Domäne überschrieben. - Fügen Sie einen zweiten "Transporteigenschaften 2" mit Rechts-Klick auf "Transport of verdünnt Species hinzu" und wählen Sie die Barriere (2) in der "Domain-Auswahl". Je nach Zielsetzung der Simulation kann die Diffusionskoeffizienten als Wert der Barriere oder als eine dummy-Variable "D" eingestellt werden. Legen Sie für den ersten Testlauf einen Wert von 2E-10 m2/s.
Hinweis: "D" wird später in Schritt 3.3 deklariert werden. - In "Transport of verdünnt Species" für "Initial-Werte 1" definieren die Konzentration als Null.
Hinweis: "Initiale Werte 1" ist für Schranke und Akzeptor-Domäne verwendet. Im nächsten Schritt wird die Spender-Domäne überschrieben. - Fügen Sie einen zweiten "Initiale Werte 2" mit Rechts-Klick auf "Transport of verdünnt Species hinzu" und wählen Sie den Spender (3) als der Domänennamens. Legen Sie die Konzentration als die Ausgangskonzentration der Spender Substanz (z. B.C_fl aus Tabelle 2).
- "Symmetrie 1" mit Rechtsklick auf "Transport of verdünnt Species" hinzufügen, hinzufügen und wählen Sie alle Flächen der "Grenze Auswahl", die die ganze Geometrie spiegeln (z.B. Geometrie im Schritt 3.2 ist es die Grenze Nummer 1, 2, 4, 5, 7, 8).
Hinweis: Dieser Punkt kann vernachlässigt werden, wenn die ganze Geometrie eingerichtet wurde. - Fügen Sie mit der rechten Maustaste auf "Mesh" zwei "freie Tetraeder". Wählen Sie die Barriere (2) als der Domäne (Änderung der geometrische Objekt-Ebene in "Domain"). Fügen Sie "Größe" mit der rechten Maustaste auf "kostenlose Tetrahedral 1" und für das vordefinierte Netz "Feiner" für die 12-Well-Membran insert System oder "extra fein" für eine 96-Well-Membran insert System.
- In der zweiten "freien Tetraeder" wählen Sie den Akzeptor und Spender wie Domain und den vordefinierten Mesh "Normal" für eine 12-Well-Membran System INSERT oder "Feiner" für eine 96-Well-Membran System Insert (siehe Abbildung 3 c und 3d Abbildung).
Hinweis: Es ist auch möglich, einen gröberen Netz um Rechenzeit zu sparen zu wählen. Dies könnte die Genauigkeit der Ergebnisse verringern. Klicken Sie auf "Build All" inmitten der"Mesh", die Geometrie zu vernetzen. - Starten Sie die Simulation mit "Compute" in der "Studie 1".
- Beispiel-Setup für eine Geometrie
Hinweis: Hier ist ein Beispiel wie die Geometrie der 96-Well-Membran Insert System (mit konkaven Barriere) gegeben. Alle Schritte werden in der Geometrie-Modul des Programms ausgeführt. Befindet sich die Längeneinheit Meter.- Generieren Sie einen Zylinder 1 (rechter Mausklick auf "Geometrie 1") mit Radius von D_w/2 und die Höhe des H_sp + H_b + H_a.
- Generieren Sie einen Zylinder 2 mit Radius von D_tran/2, Höhe von H_b + H_a und Z-Position des H_sp.
- Verwenden Sie die Option "Differenz" (Rechtsklick auf "Geometrie 1" finden "Boolesche Werte und Partition") Zylinder 2 von Zylinder 1 subtrahieren. Wählen Sie "cyl1" in die "Objekte hinzufügen" aktivieren "Objekt abziehen" und "cyl2" wählte. Der neue Band ist die Geometrie der Akzeptor.
- Generieren Sie einen Zylinder 3 mit Radius der D_a/2, Höhe von H_b und Z-Position des H_sp.
- Generieren Sie eine Kugel 1 mit Radius R und Z-Position-R_z.
- Die Option "Unterschied" Kugel 1 (sph1) von Zylinder 3 (cyl3) abziehen. Das neue Volume wird Unterschied 2 genannt.
- Erzeugen einen 4 Zylinder mit Radius der D_a/2, Höhe von H_b + H_a und positionieren von H_sp Z.
- Die Option "Unterschied" Zylinder 4 (cyl4) von Unterschied 2 subtrahieren. Der neue Band ist die Geometrie der Akzeptor.
- Wiederholen Sie die Schritte 3.2.4-3.2.6 um die Barriere (Agarose-Gel oder Zelle Modell im Experiment) zu bauen.
- Machen Sie eine Union 1 aller Geometrie-Elemente (rechts Klick auf "Geometrie 1" finden "Boolesche Werte und Partition").
- Erzeugt einen Block 1 mit allen Kanten stellen auf einer Länge von D_tran * Position 2, X - D_tran und y D_tran * 2.
- Erzeugt einen Block 2 mit allen Kantenlänge von D_tran * Position 2, X - D_tran * 2 und y - D_tran.
- Die Option "Unterschied" zu subtrahieren Union 1 von Block 1 und block 2.
- Die Simulation hinzufügen der Parameteroptimierung
Hinweis: Mit Hilfe der Parameteroptimierung kann die Diffusionskoeffizienten an die zuvor generierten experimentellen Daten ausgestattet werden. Die folgenden Anweisungen zeigen, wie die Optimierung Teil in die Simulation der Diffusion zu integrieren. Stellen Sie sicher, dass die Simulation der Diffusion vor Beginn dieser Schritte funktioniert.- Das Physik-Modul "Optimierung" mittels "Add Physic" hinzufügen (Optimierung finden Sie in der "Mathematik" in der Kategorie "Optimierung und Sensibilität") bis hin zur Simulation. Klicken Sie auf "Komponente hinzufügen".
- Fügen Sie "Variablen" mit Rechtsklick unter "Definitionen" (lokal in Komponente) und geben Sie die Variablen aus Tabelle 3.
Hinweis: Die Parameteroptimierung nutzt reelle Zahlen, d. h., der Faktor 1-10 von den Diffusionskoeffizienten muss separat definiert werden. - "Durchschnittlich 1" mit Rechtsklick auf "Definitionen" im Abschnitt "Kupplung Komponente" und Typ in der Operatorname "Akzeptor" hinzufügen.
- Ein separates Textdokument mit den experimentellen Daten zu generieren.
Hinweis: Ein Semikolon trennt Spalten; ein Zeilenumbruch trennt Zeilen. Erklärung der Zeit wird in Sekunden, Konzentration in Mol/m3gemessen. Entfernen Sie den ersten und zweiten Datenpunkt in der Lag-Phase (siehe Abbildung 2) Experimente möglich Montagefehler zu vermeiden. Hier ist ein Beispiel wie das Textdokument aussehen könnte:
3540; 0.00216
7140; 0.00724
12240; 0.01707
15180; 0.02230
18660; 0.02697
21540; 0.02931
Dieses Beispiel kann verwendet werden, um die Simulation zu testen. - Hinzufügen "Least-Squares Gesamtziel" mit der rechten Maustaste auf "Optimierung", die "experimentelle Daten" das Textdokument aus Schritt 3.3.4 beimessen und definieren Sie die erste Spalte als "Spalte" Time "1" mit rechts klicken Sie auf "Kleinste-Quadrate-Gesamtziel" und die zweite Spalte als "Wert der Spalte 1" mit Rechtsklick auf "Kleinste-Quadrate-Gesamtziel". In der "Ausdruck" der "Spalte der Wert" geben Sie die Variable "C".
- Fügen Sie "Globale Variablen steuern 1" mit Rechtsklick auf "Optimierung" und "D_search" als Variable mit den anfänglichen Wert "1" Untergrenze "0" und Obergrenze "1000" zu erklären.
- Fügen Sie "Optimierung" mit der rechten Maustaste auf "Studie 1" und "SNOPT" als eine Optimierungsmethode Solver wählte. Legen Sie die Optimalität Toleranz bis 1E-9.
Hinweis: Wenn die Simulation nicht konvergiert hat, erhöhen Sie die Optimalität Toleranz. Denken Sie daran, dass die Simulation ungenau werden, wenn die Optimalität Toleranz zu groß ist. - Starten Sie die Parameteroptimierung mit "Compute" in "Studie". Vergessen Sie nicht, die Diffusionskoeffizienten für die Barriere als "D" festzulegen.
Ergebnisse
Durchlässigkeit Experimente in einer 96-Well-Membran einfügen-System mit 2 % Agarosegel wie eine Barriere wurden durchgeführt, um die Genauigkeit der Simulation zu bewerten. Fluorescein Natrium-Salz (NaFl) und Fluorescein erfolgt-Dextranes (FD) wurden verwendet, um die Auswirkungen der molekularen Größe der diffundierende Substanz von 5 x 10-10 m bis 45 x 10-10 m Stokes Radius (376.27-40.000 Mol Wt) zu überprüfen. Die Simulation native Parameteroptimierung wurde verwendet, um die Simulation zu experimentellen Daten passen.
Zu diesem Zweck wurden die Pisten nur lineare Teile der simulierten Durchlässigkeit zu den experimentellen Ergebnissen verglichen. Für molekulare Untergrößen waren Simulation und experimentelle Daten in guter Übereinstimmung mit 99,2 % NaFl und 80,2 % für FD 4.000 (siehe Abbildung 4a und 4 b Abbildung). Größere Molekülgröße erzeugt höhere Abweichungen zeigen Zusammenhänge von 50,5 % für FD 10.000, 79,7 % für FD 20.000 und 53,6 % FD 40.000. Kurvenverlauf in den Simulationen zeigten eine Verzögerung zu Beginn und einen stärkeren Anstieg im weiteren Verlauf des Graphen (siehe Abbildung 4 c–4e).
Durchlässigkeit Koeffizienten und simulierten Diffusionskoeffizienten ergeben sich Tabelle 4. Die Permeation Koeffizienten verringert sich mit zunehmender Molekülgröße. Standardabweichung lag zwischen 0,08 x 10-8 m/s und 0,47 x 10-8 m/s (N = 7), die auf einen absoluten Fehler von 4.18 bis 46.15 % entsprach. Versuche mit größeren Molekülen zeigten einen größere absoluten Fehler. Die simulierten Diffusionskoeffizienten verhielt sich sehr ähnlich an experimentellen Durchlässigkeit Koeffizienten. Stoffe mit größeren Radien Stokes zeigte abnehmende Diffusionskoeffizienten und des absoluten Fehlers reichte 9,09 bis 18.46 % (N = 3).
In zusätzlichen Permeation Experimente dienten vier verschiedene Kollagen Modell Zelltypen als Barrieren in einer 12-Well-Membran System einfügen. Diese Modelle umfassen eine zellfreie und eine Zellenmodell mit verschiedenen Kombinationen der primäre Fibroblasten in der Kollagen-Gel und HaCaT auf der Oberfläche. Die folgenden Kombinationen wurden verwendet: Kollagen (Kol.) als zellfreie Modell, Kollagen + Fibroblasten (Kol. + F.), HaCaT (Kol. + H.), und Kollagen + Fibroblasten, Kollagen + HaCaT (Kol. + F. + H.). Fluorescein Natrium-Salz mit DMEM + 10 % FCS diente als Spender Substanz. Für Bild war Analyse der das Kollagen Zellenmodell, Färbung mit Hämatoxylin und Eosin (HE) verwendet. Diese Färbung erfolgte mit der Hersteller-Protokoll. In Abbildung 5ist solch ein Fleck mit einem repräsentativen Kol. + F. + H.-Modell dargestellt. Das HE Flecken leicht die Gewebestruktur des Kollagen-Matrix. Die Fibroblasten befinden sich in der Matrix und die Kernen der Fibroblasten und HaCaT-Zellen sind in dunklem Violett gefärbt. Am Anfang der Kollagen-Matrix gibt es eine Ebene mit vielen Kernen, die die Kerne von HaCaTs, Aufbau einer einschließenden Schicht auf der Oberseite des Modells sein sollte.
In Tabelle 5werden experimentelle Permeation Koeffizienten und simulierten Diffusionskoeffizienten aufgelistet. Ein Trend ist für die meisten Modelle mit HaCaT, die geringere Durchdringung/Diffusionskoeffizienten im Vergleich zu den Modellen ohne HaCaT ersichtlich. Der absolute Fehler der Permeation Koeffizienten ist 10,9-24,4 %, und für die Verbreitung Koeffizienten 5.2-12,9 %.
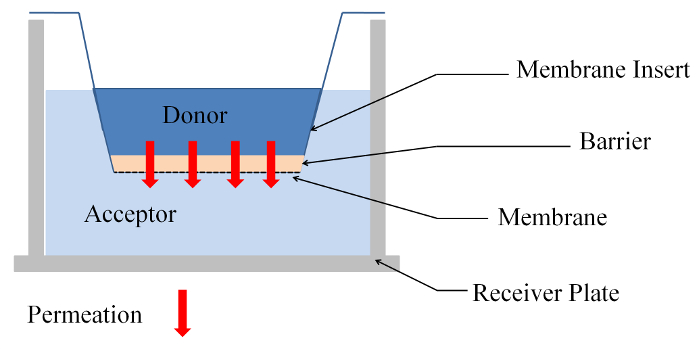
Abbildung 1: Seitenansicht des Experiments in einer Membran Durchlässigkeit insert System. Bitte klicken Sie hier für eine größere Version dieser Figur.
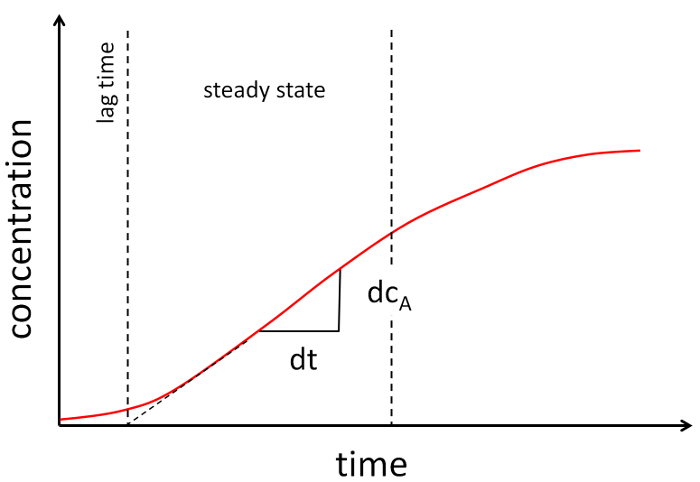
Abbildung 2: beispielhafte Grafik eines Experiments Durchlässigkeit. Die Konzentration von den Akzeptor ist im Laufe der Zeit aufgetragen. Zwei gestrichelte Linien Klammer den nahezu linearen Teil des Diagramms. Die Steigung der linearen Teil dient zur Bestimmung der Durchlässigkeit Koeffizienten. Bitte klicken Sie hier für eine größere Version dieser Figur.
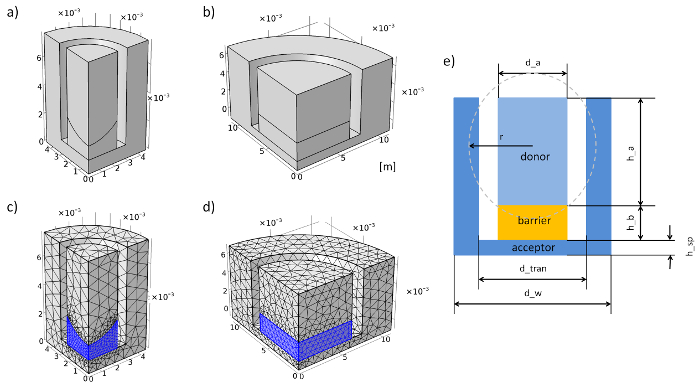
Abbildung 3: Einfügen von Geometrie und Maschen der Membran in der Simulation System. (ein) Geometrie der 96-Well-Membran System einfügen. (b) Geometrie der 12-Well Membran Insert System. (c) Netz der 96-Well-Membran-Insert-System. (d) Netz der Membran 12-Well-Insert-System. (e) Querschnitt und Parameter der Membran System einfügen. Bitte klicken Sie hier für eine größere Version dieser Figur.
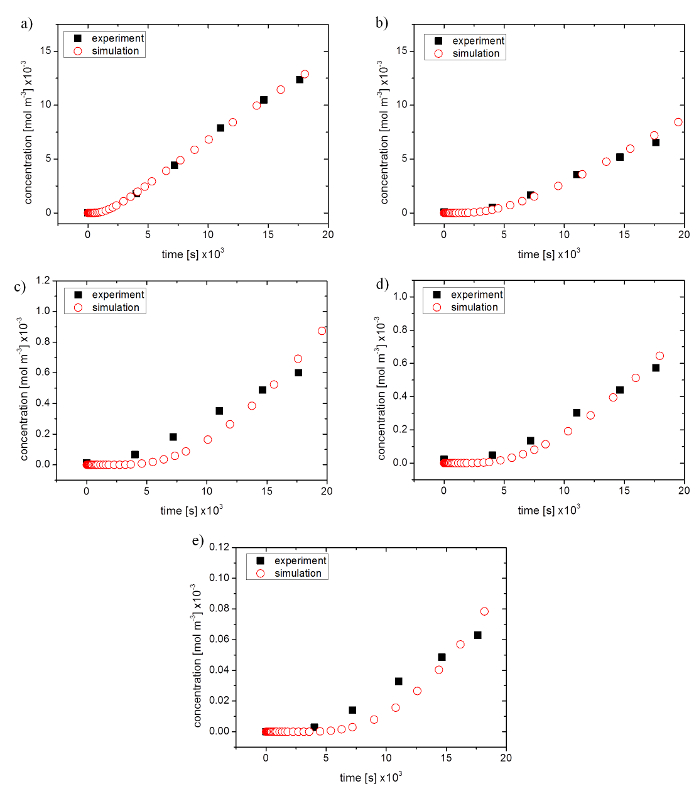
Abbildung 4: Vergleich der experimentellen Daten aus einem Permeation Experiment bis hin zur optimierten Simulation. (ein) Fluorescein Natrium-Salz, (b) Fluorescein erfolgt-Dextran 4.000 Mol WT (c) 10.000 Mol Gew.%, (d) 20.000 Mol WT und (e) 40.000 Mol WT Klicken Sie bitte hier, um eine größere Version dieser Figur.
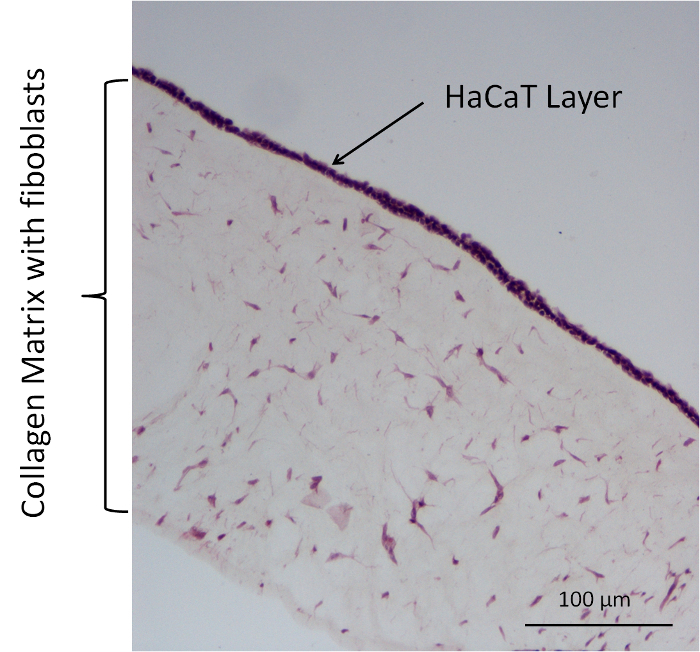
Abbildung 5: Vertreter HE Färbung eines Kollagen-Zelle-Modells (Fibroblasten, Kollagen + HaCaT). Bitte klicken Sie hier für eine größere Version dieser Figur.
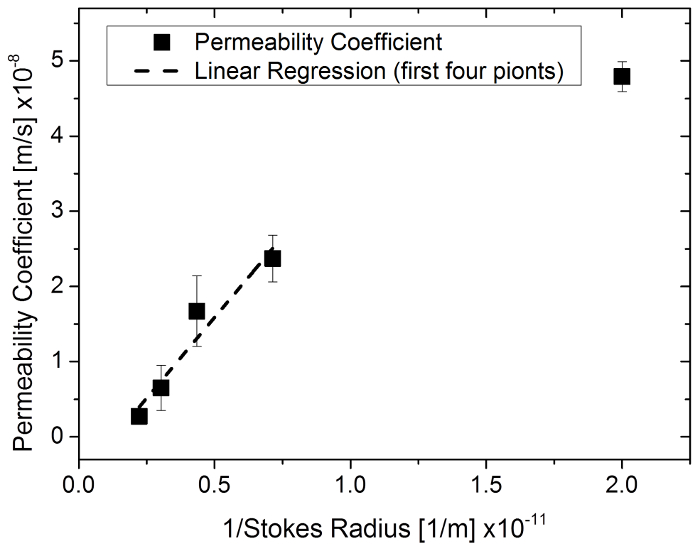
Abbildung 6: Durchlässigkeit Koeffizienten in Abhängigkeit von der 1/Stokes-Radius mit Fluorescein Natriumsalz und Fluorescein erfolgt-Dextran in einer 96-Well-Membran einfügen System. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Name | Experession für 96 Brunnenanlage in mm | Experssion für 12-Well-System in mm | Beschreibung |
| d_tran | 5,65 [mm] | 14.7 [mm] | Durchmesser des Brunnens |
| D_A | 4.26 [mm] | 12.1 [mm] | Durchmesser der Membran |
| d_w | 8,79 [mm] | 21.97 [mm] | Durchmesser von den Akzeptor |
| h_b | 2 [mm] | 2 [mm] | Höhe der Barriere |
| h_sp | 1 [mm] | 1 [mm] | Abstand zwischen gut und unten |
| h_a | 4.73 [mm] | 5.24 [mm] | Hoch von den Akzeptor |
| b | H_b/2 | - | Eintauchtiefe |
| r | ((d_a)^2+4*b^2)/(8*b) | - | Umkreis von Immersion Ball+ |
| r_z | R + h_b | - | Z-Position des Balles Immersion+ |
Tabelle 1: Geometrie-Parameter für "Chemischer Spezies Transport" Simulation. + Nur zur Verwendung für die Simulation von Agarose Gel in 96 gut Membran System einfügen.
| Name | Ausdruck | Wert | Beschreibung |
| C_fl | 0.1 [mg/ml]/376.28 [g/Mol] | 0.26576 Mol/m2 | Konzentration von Fl.So. |
| C_4 | 2 [mg/ml] / 4000 [g/Mol] | 0,5 Mol/m2 | Konzentration von FD 4.000 |
| C_10 | 2 [mg/ml] / 10000 [g/Mol] | 0,2 Mol/m2 | Konzentration von FD 10.000 |
| C_20 | 2 [mg/ml] / 20000 [g/Mol] | 0,1 Mol/m2 | Konzentration von FD 20.000 |
| C_40 | 2 [mg/ml] / 40000 [g/Mol] | 0,05 Mol/m2 | Konzentration von FD 40.000 |
| Dif_w | 1E-9 [m ^ 2/s] | 1E - 9m2/s | Diffusionskoeffizienten von Anmachwasser |
Tabelle 2: Physikalische Parameter für die Simulation "Chemischer Spezies Transport".
| Name | Ausdruck | Beschreibung |
| C | Acceptor(c) | Definition der Akzeptor-Konzentration |
| D | D_search * 1e-10 | Änderung der Faktor für D |
Tabelle 3: Parameter für die Simulation der "Optimierung".
| Durchdringen | Durchlässigkeit Koeffizienten (m/s) x 10-8 | Diffusionskoeffizienten (m/s2) x 10-10 | Stokes Radius des Permeats (m) x 10-10 |
| Fl.So. | 4,79 ± 0,20 | 1.94 ± 0,34 | 5 |
| FD 4.000 | 2,37 ± 0,31 | 0.65 ± 0.12 | 14 |
| FD10, 000 | 1.67 ± 0.47 | 0,22 ± 0,02 | 23 |
| FD 20.000 | 0.65 ± 0,30 | 0,29 ± 0,04 | 33 |
| FD 40.000 | 0,27 ± 0,08 | 0,14 ± 0,02 | 45 |
Tabelle 4: Durchlässigkeit und Diffusion Koeffizient von Stoffen mit anderen Stokes Radius durch 2 % Agarose-Gel + Membran in einer 96-Well-Membran einfügen System. (Fluorescein Natriumsalz = FL. So., Fitc-Dextran = FD).
| Modell | Durchlässigkeit Koeffizienten (m/s) x 10-8 | Diffusionskoeffizienten (m/s2) x 10-10 |
| Kol. | 2.18 ± 0,29 | 1.22 ± 0,06 |
| Kol. + F. | 1,77 ± 0,38 | 0,93 ± 0.12 |
| Kol. + H. | 1,64 ± 0,40 | 0,96 ± 0,05 |
| Kol. + F. + H. | 1.65 ± 0,18 | 0,88 ± 0,11 |
Tabelle 5: Durchlässigkeit und Diffusion Koeffizient von Fluorescein Natriumsalz durch eine Kollagen-Zelle-Modell in einem 12-gut Membran einfügen System (Kol = Kollagen, F. = Fibroblast, H. = HaCaT).
Diskussion
Diese Studie dokumentiert eine Methode entwickelt, um die Permeation durch ein Gewebe-Konstrukt entwickelt auf einer Membran zu quantifizieren. Durchdringung von Stoffen mit unterschiedlichen molekularen Größen durch Agarosegel wurde zuerst testen und validieren der Methode und die entsprechende Simulation untersucht. Es ist bekannt, dass kleinere Moleküle schneller durch eine Matrix-Netz (mit Ausnahme der Effekt Gel Filtration von Durchlässigkeit Chromatographie) durchdringen. Ähnliche Beobachtungen wurden mit Größe-Ausschluss Experimente von Substanzen durch Sklera26, menschlichen epidermalen Membran27, menschliche Haut17und Ratte Haut28. Eine inverse Korrelation zwischen Durchlässigkeit Koeffizienten und der entsprechenden Stokes Radius (Radius einer harten Kugel, die mit der gleichen Diffusionsrate als die Moleküle beschrieben, in der Regel kleiner als der effektive Radius des Moleküls bewegt) nachweislich 26 , 28und ein ähnliches Verhältnis wurde in Experimenten mit Stoffen unterschiedlicher molekularer Größe festgestellt. Durch Auftragen der Durchlässigkeit Koeffizienten über 1/Stokes Radius, fand man eine lineare Korrelation über die vier Gruppen mit der kleinsten molekularen Größe (R2 = 0,93) (Abbildung 6). Dies bedeutet, dass simulierte Durchlässigkeit Koeffizienten mit der vorgeschlagenen Methode in eine realistische Reichweite sind.
Der Fehler von 46.15 % in den Experimenten ist etwas größer als für Durchlässigkeit Experimente mit dem Franz Diffusion Zelle System10gemeldet. Eine mögliche Erklärung könnte die Größenverteilung von Fluorescein-Herstellung-Dextran, die später erläutert wird.
Die beschriebene Methode hat wichtige Vorteile gegenüber Methoden mit dem Franz-Diffusion-Zellsystem. Erstens ist das Setup kompakter; die Experimente werden direkt in eine Membran-Insert-System ausgeführt, die das Ausmaß einer kommerziellen well-Platte (∼ 13 cm x 8,5 cm) hat. Dies ermöglicht mehrere Proben gleichzeitig ausgeführt werden, bedarf es eine separate Franz Diffusion Zelle für jede Probe. Zweitens kann die Durchlässigkeit der Hautmodell direkt in die Membran einfügen gemessen werden, wo der Anbau stattfindet. Mit Franz Diffusion Zellen müssen die Proben herausgenommen und montiert auf dem System, das ist für kleine Proben mehr umständlich und auch mehr Zeit in Anspruch.
Permeation Experimente mit Kollagen Zelle Matrizen zeigten, dass diese Methode erfolgreich in Zelle ausgesät Systeme angewendet werden kann. Das hier vorgestellte Modell wurde für Hautmodelle überprüft; Allerdings kann das Verfahren auf andere Arten von organischen Zellkulturen, z.B.Niere oder Leber angewendet werden.
In dieser Studie eine Kollagen-Zelle Modell wurde verwendet, in denen die HaCaT-Zellen vollständig die Modelloberfläche bedeckt (siehe Abbildung 5). Dies führte zu einer Verringerung der Durchlässigkeit Koeffizienten, zeigen, dass die Methode empfindlich genug ist, um die Durchlässigkeit Koeffizienten zwischen Kollagen Zellmodell mit und ohne eine Schicht von HaCaT zu unterscheiden. Im Idealfall ein Hautmodell sollte eine Barriere, die die Epidermis eine echte Haut29nähert, aufbauen und es ist daher wichtig, die Qualität (z.B. Gebäude der Dermis, Epidermis) des Modells Haut vor dem tatsächlichen Gebrauch zu überprüfen. Die Entwicklung eines Modells der Haut kann visualisiert mit Färbetechniken und von der Erkennung von Haut Eiweiß und Kollagen30,31,32quantifiziert. Die Durchlässigkeit Koeffizienten kann auch ein wichtiger Faktor für die Beurteilung der Entwicklung des Modells Haut sein, aber weitere Experimente sind erforderlich, um dies zu bestätigen. Wie bereits erwähnt ermöglicht diese Methode mehrere Proben parallel laufen. Es ist auch möglich, Proben nehmen, während der Anbau zur Messung der Durchlässigkeit und dabei beobachten die Entwicklung dieses Parameters Hautmodell.
Es sei darauf hingewiesen, dass Durchlässigkeit durch ein Gel/Kollagen-Zelle-Modell und eine Membran gleichzeitig gemessen wird. Die erkannten Durchlässigkeit Koeffizienten ist systemspezifisch, wobei die Ergebnisse der verschiedenen Hautmodelle nur verglichen werden kann, wenn Sie der gleichen Membran einfügen verwenden. Darüber hinaus muss das Hautmodell, die gesamte Anbaufläche abzudecken, um sicherzustellen, dass die Prüfsubstanz nur durch das Modell durchdringen wird und nicht neben ihr, würde die Fehler der Permeabilität gemessen zu induzieren. Ein weiterer Aspekt bei zukünftigen Experimenten berücksichtigt werden sollte ist die natürliche Umgebung der Haut. Normalerweise ist die Temperatur der Hautoberfläche niedriger im Vergleich zu den Innenbereich, der Permeation Bedingungen beeinflussen können.
Um Laborexperimente mit Hilfe von Computersimulationen auszurichten, wurde eine Methode die Parameteroptimierung für angewandte Simulation ermöglicht vorgestellt. Simulationen fanden sich gut mit den experimentellen Daten für Stoffe mit kleinen molekularen Größen übereinstimmen. Jedoch wurden Abweichungen zwischen Simulation und experimentelle Daten für Stoffe mit größeren molekularer Größen beobachtet. Großen Polysaccharid Moleküle können erhöhen die Reibung und den Diffusionsprozess in einem Gel verlangsamen. Dieser Effekt bewirkt, dass abnorme Diffusion, ist ein möglicher Grund für die Abweichung zwischen experimentellen und Simulation Werte33,34. Eine weitere Erklärung könnte die Anwesenheit von kleineren oder größeren Partikeln in Fluorescein-Herstellung-Dextran sein. Der Hersteller gibt das Molekulargewicht des Stoffes als die mittlere Größe mit einem bestimmten Bereich, wodurch kleinere und größere Partikel vorhanden sein. Es ist auch unklar, wie verteilte diese Substanzen sind, wie die kleineren Teilchen schneller durch das Gel und den fließenden Kanal durchdringen. Es ist möglich, die Simulation zu prüfen, diese Verbreitung und Reibungseffekte zu erweitern.
Die Durchlässigkeit Experiment und Simulation wurden entwickelt für den Einsatz in einem 2-oC. Mit Hilfe der Simulation kann diese experimentelle Methode direkt auf anspruchsvollere Versuchsaufbauten übertragen werden. Beispielsweise kann die Membran Insert Systemsimulation leicht auf die Geometrie des 2-OC oder zu anderen Systemen mit ähnlichen Einstellungen übertragen werden. Diese Option der Modulierung der Simulations kann verwendet werden, um die Gestaltung der zukünftigen Experimente zu unterstützen. Darüber hinaus können Nebenwirkungen wie Verdunstung, abnorme Diffusion und Membran-Effekte integriert werden, um die Simulation, und verbessert die Genauigkeit zu erhöhen. Das Simulationsprogramm gibt die Möglichkeit, ändern oder ergänzen die Simulation Gleichung, sowie anderen physikalischen Modulen zu integrieren, um andere Aspekte der Haut Modellentwicklung zu untersuchen. Ein Beispiel ist die Simulation von Glukose-Verbrauch und Laktat-Produktion in einem Kollagen-Zelle-Modell.
Ein besonders interessanter Aspekt bei der Prüfung von medizinischen Substanzen ist wie die Stoffe in einem Organ-on-a-Chip-System verteilt werden. Die Simulation und Durchlässigkeit Parameter, die meine Hilfe beantworten Fragen wie z.B. wie schnell eine Substanz in das System durchdringt sowie die Konzentration für andere Gewebe in einem multi-organ-Chip zur Verfügung stehen. Diese Methode kann zu unterstützen und verbessern, die Entwicklung und Erprobung solcher Orgel-on-Chip-Systeme.
Offenlegungen
Uwe Marx ist der Geschäftsführer und Gesellschafter und Gerd Lindner ist Gesellschafter der TissUse GmbH, ein Unternehmen Herstellung und Kommerzialisierung der MOC-Technologie. Andere Autoren erklären keinen Interessenkonflikt bezüglich der Veröffentlichung dieses Artikels.
Danksagungen
Diese Arbeit wurde mit finanzieller Unterstützung von der Deutschen Forschungsgemeinschaft (DFG) unter Grant Nein geschaffen. PO413/12-1 und LA 1028/7-1.
Materialien
| Name | Company | Catalog Number | Comments |
| Agarose | Carl Roth | K297.2 | High Resolution Powder |
| Collagen | Serva | 47256.01 | Collagen R solution 0.4 % |
| DMEM | Lonza (Biozym Scientific GmbH) | 880010-12 | High Glucose with L-Glutamine |
| FCS | Biochrom GmbH | S0615 0114F | Fetal Calf Serum |
| Fluorescein Sodium Salt | Sigma-Aldrich | 46960-25G-F | |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | 46944-500MG | 4000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD10S-250MG | 10 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD20S-250MG | 20 000 g/mol |
| Fluorescein Isothiocyanate-dextran | Sigma-Aldrich | FD40S-250MG | 40 000 g/mol |
| HBSS | ThermoFisher Scientific | 14170120 | no calcium, no magnesium , with phenol red |
| NaOH | Merck | 1.06467.9010 | granulated |
| PBS | Gibco | 18912-014 | tablets |
| Transwell Cell Culture Inserts | Corning | 3391 | 96 well, 0.4 µm pore size |
| Transwell Cell Culture Inserts | Corning (VWR) | 734-1563 | 12 well, 0.4 µm pore size |
| Trypsin | Biochrom GmbH | L2143 | with EDTA |
Referenzen
- Marx, U., et al. Human-on-a-chip developments: a translational cutting-edge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man?. ATLA. 40 (5), 235-257 (2012).
- Maschmeyer, I., et al. Chip-based human liver-intestine and liver-skin co-cultures - A first step toward systemic repeated dose substance testing in vitro. Eur J Pharm Biopharm. 95, 77-87 (2015).
- Prunieras, M., Regnier, M., Woodley, D. Methods for Cultivation of Keratinocytes with an Air-Liquid Interface. J Invest Dermatol. 81 (1), 28-33 (1983).
- Cannon, C. L., et al. New epidermal model for dermal irritancy testing. Toxicol In Vitro. 8 (4), 889-891 (1994).
- Ackermann, K., et al. The Phenion Full-Thickness Skin Model for Percutaneous Absorption Testing. Skin Pharmacol Physiol. 23 (2), 105-112 (2010).
- Netzlaff, F., et al. Permeability of the reconstructed human epidermis model Episkin in comparison to various human skin preparations. Eur J Pharm Biopharm. 66 (1), 127-134 (2007).
- Bran, B., et al. A New Discriminative Criterion for the Development of Franz Diffusion Tests for Transdermal Pharmaceuticals. J Pharm Sci. 13 (2), 218-230 (2010).
- Pineau, A., et al. In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J Inorg Biochem. 110, 21-26 (2012).
- Filon, F. L., et al. In vitro percutaneous absorption of cobalt. Int Arch Occup Environ Health. 77 (2), 85-89 (2004).
- Ng, S. -. F., et al. Validation of a Static Franz Diffusion Cell System for In Vitro Permeation Studies. AAPS PharmSciTech. 11 (3), 1432-1441 (2010).
- Bonferoni, M. C., et al. A Modified Franz Diffusion Cell for Simultaneous Assessment of Drug Release and Washability of Mucoadhesive Gels. Pharm Dev Tecnol. 4 (1), 45-53 (1999).
- Seiffer, S., Oppermann, W. Systematic evaluation of FRAP experiments performed in a confocal laser scanning microscope. J Microsc. 220 (1), 20-30 (2005).
- Pluen, A., et al. Diffusion of Macromolecules in Agarose Gels: Comparison of Linear and Globular Configurations. Biophys J. 77, 542-552 (1999).
- Cornelissen, L. H., et al. Diffusion measurements in epidermal tissues with fluorescent recovery after photobleaching. Skin Res Technol. 14 (4), 462-467 (2008).
- Pirot, F., et al. Characterization of the permeability barrier of human skin in vivo. PNAS. 94 (4), 1562-1567 (1997).
- Tetteh, J., et al. Local examination of skin diffusion using FTIR spectroscopic imaging and multivariate target factor analysis. Anal Chim Acta. 642 (1-2), 246-256 (2009).
- Guldbrand, S., et al. Two-photon fluorescence correlation spectroscopy as a tool for measuring molecular diffusion within human skin. Eur J Pharm Biopharm. 84 (2), 430-436 (2013).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Rech. 291 (11), 600-605 (1999).
- Veronike, M., et al. Epidermal Organization and Differentiation of HaCaT Keratinocytes in Organotypic Coculture with Human Dermal Fibroblasts. J Invest Dermatol. 112 (3), 343-353 (1999).
- Moraes, C., et al. Organs-on-a-chip: a focus on compartmentalized microdevices. Ann Biomed Eng. 40 (6), 1211-1227 (2012).
- Huh, D., et al. From Three-Dimensional Cell Culture to Organs-on-Chips. Trends Cell Biol. 21 (12), 745-754 (2011).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab Chip. 13 (18), 3588 (2013).
- Materne, E. -. M., et al. The Multi-organ Chip - A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), (2015).
- Materne, E. -. M., et al. A multi-organ chip co-culture of neurospheres and liver equivalents for long-term substance testing. J Biotechnology. 205, 36-46 (2015).
- Materne, E. -. M., Tonevitsky, A. G., Marx, U. Chip-based liver equivalents for toxicity testing - organotypicalness versus cost-efficient high throughput. Lab Chip. 13 (18), 3481 (2013).
- Jayakrishna, A., et al. Diffusion of High Molecular Weight Compounds through Sclera. IOVS. 41 (5), 1181-1185 (2000).
- Peck, K., et al. Hindered Diffusion of Polar Molecules Through and Effective Pore Radii Estimate of Intact and Ethanol. Pharm Res. 11 (9), 1309-1314 (1994).
- Ogiso, T., et al. Mechanism of the Enhancement Effect of n-Octyl-β-D-thioglucoside on the Transdermal Penetration of Fluorescein Isothiocyanate-Labeled Dextrans and the Molecular Weight Dependence of Water-Soluble Penetrants through Stripped Skin. J Pharm Sci. 83 (12), 1676-1681 (1994).
- Hadgraft, J. Skin, the final frontier. Int J Pharm. 224 (1-2), 1-18 (2001).
- Asselineau, D., et al. Human Epidermis Reconstructed by Culture: Is It "Normal"?. J Invest Dermatol. 86 (2), 181-186 (1986).
- Casasco, A., et al. Cell proliferation and differentiation in a model of human skin equivalent. Anat Rec. 264 (3), 261-272 (2001).
- Kehe, K., et al. Tissue engineering with HaCaT cells and a fibroblast cell line. Arch Dermatol Res. 291 (11), 600-605 (1999).
- Laurent, T. C., et al. Diffusion of Dextran in Concentrated Solutions. Eur J Biochem. 68, 95-102 (1976).
- Metzler, R., Klafter, J. The random walk's guide to anomalous diffusion: A fractional dynamics approach. Phys Rep. 339 (1), 1-77 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten