Method Article
Visualización de compactación del ADN en cianobacterias por Tomography del Cryo-electrón de alta tensión
En este artículo
Resumen
Este protocolo describe cómo visualizar la compactación de ADN transitoria en cianobacterias. Cultivo sincrónico, monitoreo por microscopía de fluorescencia, congelación rápida y alta tomography del cryo-electrón de voltaje se utilizan. Se presenta un protocolo para estas metodologías, y se discuten avances y futuras aplicaciones.
Resumen
Este protocolo describe cómo visualizar la compactación de ADN transitoria en cianobacterias. Compactación del ADN es un evento citoplásmico dramático recientemente encontrado que ocurren en algunas cianobacterias antes de la división celular. Sin embargo, debido al tamaño grande de la célula y el carácter transitorio, es difícil investigar la estructura en detalle. Para superar las dificultades, en primer lugar, compactación de ADN es reproducible producida en la cianobacteria Synechococcus elongatus PCC 7942 por cultura sincrónica utilizando 12 h cada ciclo luz/oscuridad. En segundo lugar, compactación de ADN es por microscopía de fluorescencia y capturada por congelamiento rápido. En tercer lugar, la estructura detallada del ADN compactado las células se visualiza en tres dimensiones (3D) por tomography del cryo-electrón de alta tensión. Este conjunto de métodos es ampliamente aplicable para investigar las estructuras transitorias en las bacterias, por ejemplo, la división celular, segregación cromosómica, phage infección etcetera., que son supervisados por microscopía de fluorescencia y visualizado directamente por tomography del Cryo-electrón en momentos apropiados.
Introducción
Compactación del ADN es un evento dramático citoplásmico que se ha identificado en algunas cianobacterias. Cuando Synechococcus elongatus fue cultivada bajo 12 horas cada ciclo luz/oscuridad, ADN aparecido resumida al final del periodo de luz, que era claramente diferente de su aspecto en otro momento puntos de1. Se ha sugerido que este proceso es controlado por un reloj circadiano que se basa en la de proteínas de Kai2. Seki et al. han reportado que el ADN teñido con Hoechst 33342 fue compactado en células de S. elongatus hacia el final del período de luz y mostró una forma de barra ondulada bajo un microscopio de fluorescencia. El ADN compactado luego separado en dos en el centro de la varilla como la célula dividida y volvió finalmente a una distribución normal uniforme en cada célula hija3. Sin embargo, su naturaleza transitoria y gran tamaño para microscopía electrónica impidieron análisis estructural. Murata et al. combinar varios métodos, incluyendo cultura síncrona, microscopía de fluorescencia, congelación rápida y alta tensión electrónica crio-tomografía (cryo-HVET) y tuvo éxito en la identificación de la estructura de compactación del ADN transitoria, incluyendo la cinética de polifosfato cuerpos (PPBs)4. El manuscrito proporciona una explicación visual de un material de difícil detalle combinando los procedimientos experimentales.
S. elongatus tiene forma de cápsula, aparece una longitud de 2 a 5 μm, una anchura de 0,5 μm y la perfecta compactación de ADN en las células vivas sólo para un tiempo muy corto. Por lo tanto, los cambios estructurales que ocurren en la compactación de ADN cianobacterias eran desconocidos en detalle. Para investigar estas estructuras por microscopia electrónica, es necesario superar dos problemas técnicos principales. Una es la observación de un espécimen de espesor de la bacteria entera en cerca de condiciones nativas, y la otra es la rápida fijación de una estructura dinámica. En cuanto al primer problema, el camino libre medio inelástico (iMFP) de electrones depende del voltaje de aceleración del microscopio electrónico5. En un microscopio electrónico de transmisión (TEM) de 300 kV, es menos de 350 nm. Por ejemplo, cuando una cianobacteria hielo incrustado (espécimen grueso ≈ 600 nm) se observa en 200kV TEM (iMFP ≈ 250 nm), las estructuras dentro de la célula son difíciles de observar. Por el contrario, 1 MV TEM (iMFP ≈ 500 nm) puede dar y la imagen de la estructura citoplasmática a través de la célula (figura 1). En este protocolo, como parte de la solución, un microscopio electrónico de alto voltaje (HVEM) en un voltaje de aceleración de 1 MV fue empleado. Sin embargo, servicios que implementan HVEM son limitadas en todo el mundo. Posibles soluciones alternativas se discuten en la sección de discusión. El segundo problema fue solucionado por microscopia del cryo-electrón (cryo-EM). Esta es una poderosa herramienta para la visualización de estructuras dinámicas en cerca de condiciones nativas, donde la muestra se congela rápidamente en etano líquido utilizando un dispositivo de congelación rápido y directamente se observa el momento congelado con un mínimo de modificaciones6. La combinación con la tomografía, una instantánea de estructuras tridimensionales (3D) se puede reconstruir de la inclinación serie7. En este experimento, compactación de ADN fue reproducida en S. elongatus usando la cultura síncrona bajo 12 horas ciclo de cada luz/oscuridad, y el momento de la congelación de la muestra se determinó mediante el control de un microscopio de fluorescencia.
Los enfoques descritos aquí son ampliamente aplicables para el estudio de estructuras dinámicas en las células bacterianas, por ejemplo, la división celular y segregación cromosómica infección phage y tienen un potencial para abrir nuevos caminos en la investigación microbiológica.
Protocolo
1. sincrónico cultivo de cianobacterias
- La cultura S. elongatus PCC 7942 esterilizada placa BG 11 (en caja 9 cm estéril plástico Petri) que contiene 1.5% (p/v) de agar y de tiosulfato de sodio 0.3% (w/v)8.
- Coloque las placas en una cámara de crecimiento a 23 ° C con una intensidad de luz de 50 µE/m2/s y 12 h luz/12 h oscuro los ciclos.
- La transferencia de las células en placas de agar BG11 frescas una vez por semana.
Nota: Las culturas en el agar aparecerán como bandas verdes de proliferar activamente las células después de una semana bajo esta condición de cultura. - Tomar verdes grupos de células con un lazo de alambre esterilizados llama y raya las células sobre una placa fresca de agar BG11. Hacerlo en una mesa de trabajo limpia.
2. supervisión por microscopía de fluorescencia
- Utilizar células cultivadas en la placa de agar para 6 días para observar la compactación del ADN. Recoger las células de la placa al final del periodo de luz por verter 1 mL de solución de sacarosa de 0.2 M sobre las células. Repita verter la solución sobre las células que se recoge la mayoría de las células. Transferir la solución de células suspendidas en un tubo de micro para la tinción de ADN.
- Añadir solución de colorante (por ejemplo Hoechst 33342) a 500 μl de la solución de células suspendidas en un micro tubo a una concentración final de 1 μg/mL de tinción del ADN. A continuación, mantenga el tubo en la oscuridad durante 10 minutos.
- Centrifugar por 1 min a 2.000 x g de sedimento las células. Deseche el sobrenadante y añadir 10 μl de solución de sacarosa de 0.2 M para obtener una suspensión densa.
- Transferencia de 1 μl de la solución que contiene células a un cristal de corredera, poner un cubreobjetos y observar con un microscopio de epifluorescencia equipado con un filtro UV con un objetivo de un aumento de 100 X y aceite de inmersión.
- Confirmar que la compactación del DNA se observa en este punto en la mayoría de las células, y luego preparar la muestra para el siguiente paso de congelación.
3. muestra de congelación para Cryo-HVET
- Configurar un dispositivo de congelación profunda. Llene el tanque con nitrógeno líquido y comenzar la crio-cámara de enfriamiento después de conectar el tanque y la cámara con un tubo de teflón.
- Terraplén de etano líquido en una olla de cobre pequeño dentro de la cámara tras la cámara a la temperatura de nitrógeno líquido de enfriamiento. Usar gafas durante la operación, porque el etano líquido es explosivo.
- Resplandor descarga lo de carbono de un EM recubiertas de carbón perforado rejilla (rejilla perforada) durante 30 s a 50 mA usando un bombarder de iones de plasma.
- Aplicar 1 μl de trazador de BSA gold (15 nm) a la red perforada como un marcador fiduciario.
- Aplicar una alícuota de 2,5 μl de células en la etapa de compactación del ADN a la rejilla perforada. Secar el el exceso con un papel de filtro. Sumergen a la rejilla en etano líquido utilizando un émbolo en el dispositivo de congelación profunda inmediatamente.
- Almacenar las rejillas congeladas en el almacenamiento de nitrógeno líquido hasta que son examinados.
4. Cryo-HVET
- Configurar el HVEM a una alta tensión de 1 MV.
- Montar la red congelada en un crio mordazas para HVEM preenfriado a-150 ° C con nitrógeno líquido dentro de la cryo-estación de trabajo y cargarla en el HVEM. Tenga cuidado para evitar la contaminación por hielo.
- Seleccione un área de proyección de imagen en un aumento menor de 1, 000 X. Ajuste la altura del eje z de eucentric.
- La platina a-60 ° de inclinación y quitar la holgura de la rotación de la inclinación.
- Ajustar el foco cerca de la ubicación de destino en un aumento de 10, 000 X. Establecer un bajo enfoque de 6 a 10 μm por desviación de la imagen enfocada. Para la proyección de imagen, ajustar la dosis a 2 e–/Å-2 o menos en la muestra de antemano.
- Medir la dosis de electrones por la densidad de corriente en la pantalla de imagen en HVEM. Tomar una imagen en una película de electrón o con cámara digital en el mismo aumento que en el proceso de enfoque.
- Recopila imágenes de inclinación manualmente por el mismo procedimiento como en (4.5) de-60 ° a + 60 ° en un incremento del ángulo de inclinación de 2 ° a 4 °.
Nota: En muchos microscopios electrónicos modernos, la adquisición de la serie de inclinación se automatiza por la combinación de una cámara digital. En ese caso, siga el manual de instrucciones. Para las películas negativas, desarrollar las películas durante 12 minutos a 20° C en un tanque de revelador con un developer de toda la fuerza y arreglar en un fixer para 10 minutos digitalizar las películas con una resolución de 4.000 dpi (0,635 nm/pixel en la imagen) con un escáner plano. En el caso de una cámara digital, tema las imágenes recogidas directamente en el siguiente paso de procesamiento de imagen. Si es necesario, reducir el tamaño de la imagen un filtro mediana con binning (tamaño reducir factor) y el software apropiado (por ejemplo, ImageJ) dos a cuatro.
5. Reconstrucción tomográfica
- Hacer un archivo de imagen de la pila de la persona imágenes usando el comando "tif2mrc" o "newstack" en IMOD software9de incline.
- ETomo GUI software en IMOD y definir los parámetros de imagen: diámetro fiducial, rotación de imagen, tamaño de píxel, etcetera. Crear secuencias de comandos.
- Ejecutar programas individuales según el software que se enumeran en las tablas de materiales, donde la serie de inclinación se alinea usando marcadores fiduciales (con un media error residual menos de 0.5). Por último, reconstruir una tomografía 3D utilizando el algoritmo SIRT en IMOD.
- Extracto de una región de interés (ROI) de la tomografía de tórax y denoise usando un filtro de denoise: un filtro de difusión anisotrópica en IMOD, un filtro bilateral en EMAN10o una morfología matemática filtro11, etc., con parámetros adecuados para mejorar el contraste.
6. segmentación de la característica de interés
Nota: El procedimiento descrito a continuación es específico para el software utilizado (véase Tabla de materiales), pero pueden utilizar otros paquetes de software. Consulte su guía de usuario.
- En la ventana del visor 3D, abra el archivo tomograma Amira software y generar un OrthoSlice.
- En la ventana del Editor de segmentación, cree un archivo de segmentación mediante la selección de un nuevo "campo de etiqueta".
- Manualmente trazar la frontera de la característica de interés (FOI). Siga la libertad de información a través de todos los sectores de tomografía. Para el segundo FOI, crear un nuevo "material" y repetir la misma operación.
- Generar una representación superficial seleccionando el menú "SurfaceGen". Para visualizar el volumen segmentado, seleccione el menú "SurfaceView". Para mover, rotar y zoom en el volumen 3D, utilice las herramientas en la ventana del visor 3D.
- Para la segmentación automática, utilice la herramienta de varita mágica. Haga clic en un objeto y ajuste el cursor en pantalla y Masking para cubrir el rango de valores para que el objeto completamente seleccionado por sus características.
Resultados
En una cultura sincrónica precisa menos de 12 h cada oscuros ciclo, ADN marcado con Hoechst muestra una distribución uniforme normal en la condición oscura (Figura 2a). Sin embargo, progresivamente compacta dentro de la célula durante el período de luz y aparece como una estructura de barra como ondulada (figura 2b) al final del periodo de luz. Finalmente, la barra se divide en el centro (flechas en figura 2 c) y sus dos partes se distribuyen en las células hijas (Figura 2d). Después de la división celular, el ADN compactado inmediatamente desaparece y el ADN vuelve a una distribución uniforme normal.
Cuando una alícuota de celdas que contiene las células en la etapa final de compactación del ADN fueron inmediatamente transferidas hacia una rejilla perforada y rápido congelado en etano líquido, y se observó la red congelada por 1 MV cryo-HVEM, las estructuras internas de las cianobacterias como ADN, capas de membrana de tilacoides, las paredes celulares y PPBs, aparecieron como en una instantánea en el momento de la congelación (figura 3a). Muchas células mostraron distinta compactación del ADN en las células (flechas blancas en la figura 3a) y pueden ser fácilmente distinguidas de las células normales (flecha blanca en la figura 3b). Algunos exhiben una constricción en el centro de las células como se esperaba antes de la división celular (flecha amarilla en la figura 3a).
En 3D tomogramas, podrían ser dividido en segmentos principales organelos de la célula; pared celular, capas de la membrana del thylakoid, ADN y PPBs podrían ser distinguido (figura 4). En particular, el ADN condensado fue separado por un espacio distinto en el citoplasma donde el ADN fue rodeado por material de baja densidad y las capas de la membrana del thylakoid fueron distorsionadas a lo largo de la varilla ondulada de ADN compactado. Recientemente se observó el comportamiento dinámico del PPBs: en ADN compactado las células, muchos pequeños PPBs fueron considerados para adherirse al ADN, mientras que son grandes y menos en las células normales. Además, la mayoría de las PPBs apareció como pares y algunos ADN parecía ser en un proceso de separación desde el PPBs. Esto sugiere que PPBs se dividen en dos por duplicación del ADN y la función como proveedores de fosfato para síntesis de DNA.
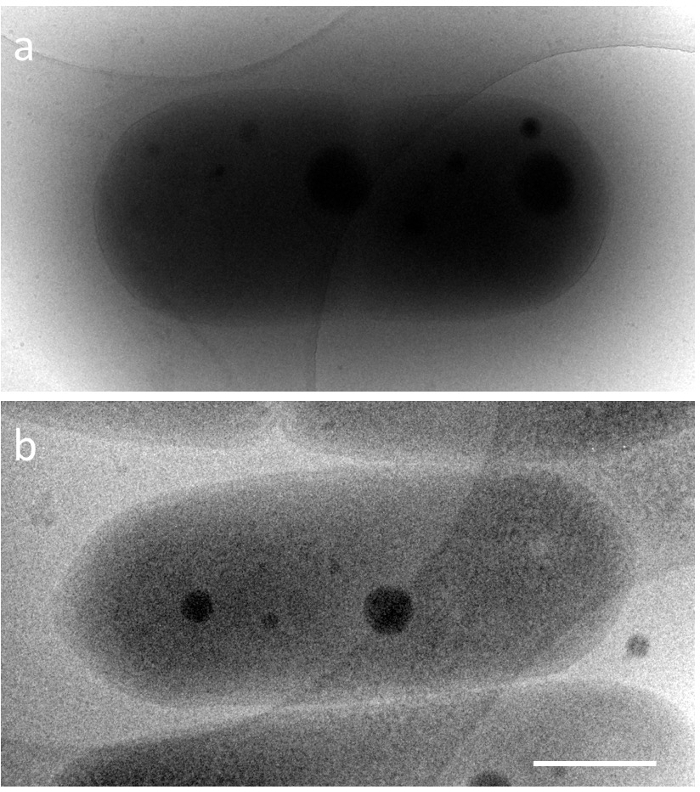
Figura 1. Imágenes de Cryo-EM de hielo incrustado normales cianobacterias, S. elongatus PCC 7942 a diferentes voltajes de aceleración. un) 200kV y b) 1000kV. Barra de escala = 500 nm. Haga clic aquí para ver una versión más grande de esta figura.
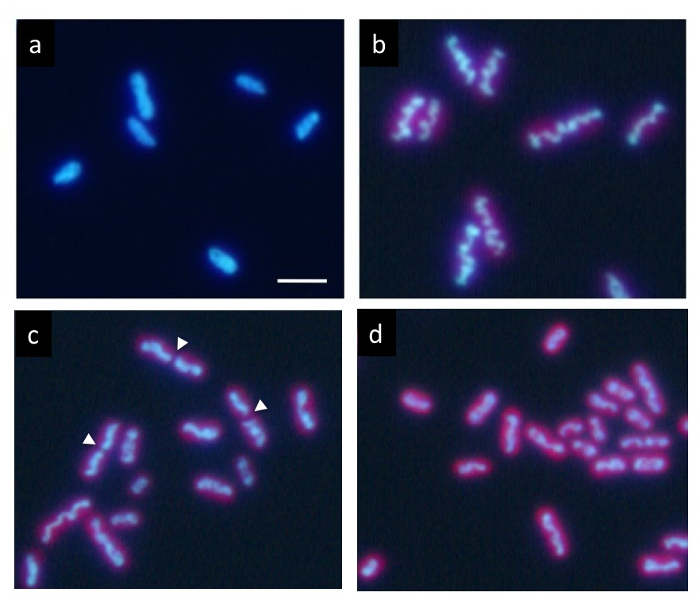
Figura 2: Microscopía de fluorescencia de las células de S. elongatus cianobacteria. Después de menos de 12 horas cada oscuros ciclos la cultura síncrona, las células fueron teñidas con Hoechst 33342. (a) las células después de 2 h de inicio del Estado oscuro muestran uniformes ADN etiquetado. El ADN en las células muchos condensa gradualmente durante el periodo de luz. Finalmente formó una gruesa varilla ondulada (b) típico de compactación del ADN. Después de esta etapa, las estructuras de ADN condensadas rápidamente divididas en sus centros (puntas de flecha) durante la división celular (c) y los dos fragmentos separaron en las células hijas (d). Las células de la hija volvió al uniforme ADN etiquetado otra vez en el período oscuro. Barra de escala = 2 μm. haga clic aquí para ver una versión más grande de esta figura.
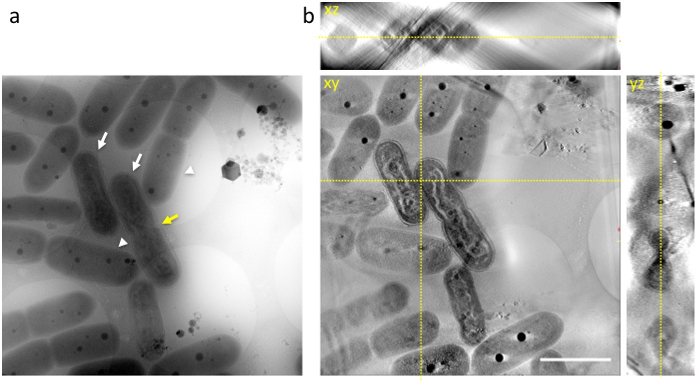
Figura 3: imagen de Cryo-HVEM de cianobacterias incrustada en hielo amorfo (a) muestra una imagen raw en inclinación de 0 °. Imágenes fueron tomadas al final del periodo de luz. Algunas células muestran cuerpos de ADN en forma de barra ondulados similar a eukaryotic cromosomas condensados (flechas blancas). En las células normales, cianobacterias muestran una estructura discernible del ADN dentro del citoplasma (flecha blanca). Algunos exhiben una constricción en el centro de las celdas como se esperaba antes de la división celular (flecha amarilla). (b) xy, xz, yz-rodajas de una tomografía 3D. Líneas amarillas punteadas muestran las intersecciones de las rebanadas. Barra de escala = 2 μm. haga clic aquí para ver una versión más grande de esta figura.
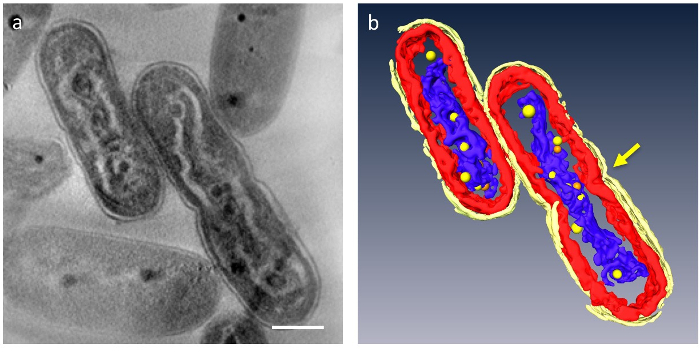
Figura 4: compactado de la ultraestructura de las células que contienen DNA. Los componentes principales están segmentados: pared celular (amarillo brillante), membranas de tilacoides (rojo) y ADN (azul). (a) muestra una rodaja z de una tomografía 3D. (b) todos los segmentos. La constricción que indica separación de la célula aparece en el centro de la célula (flecha). PPBs se modelan como esferas de color amarillas o naranja; cada esfera naranja representa a la contraparte de la esfera amarilla más cercana. Barra de escala = 500 nm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hemos presentado una secuencia de protocolos para la visualización de transitoria compactación de ADN en cianobacterias. El concepto básico es similar a la de la luz correlativa y microscopia electrónica (CLEM)12. Además, en este método, cianobacterias vivo fueron por microscopía de fluorescencia, rápidamente congelados en rejillas de EM y visualizados directamente con tomography del cryo-electrón de alta tensión. Como primera aplicación, la estructura detallada del ADN había compactado las células bacterianas con éxito fue visualizado en 3D. Actualmente, este procedimiento es específico para este tema, pero se aplicará más extensivamente, con metodología modificada en algunos casos. Aquí, se discuten las ventajas, las limitaciones y las posibilidades futuras de este método.
Una de las ventajas de este método es la visualización 3D de la célula entera. 1 MV HVEM visualizado con éxito la dinámica estructura de las organelas subcelulares en el ADN compactado las células. Sin embargo, la estructura de la multa dentro de las células normales no se distinguen debido al contraste de la imagen baja. Aumento inelástico y dispersión múltiple en muestras gruesas desenfoca la imagen13. Imagen sin pérdida y más probable de pérdida de filtrado por un filtro de energía puede mejorar el contraste de la imagen reduciendo la dispersión inelástica14,15, pero no va a funcionar para muestras más gruesas que iMFP. Los picos sin pérdida y más probable de pérdida disminuyen drásticamente con el grueso de la muestra. Es particularmente difícil obtener una relación señal a ruido suficiente para las electrónica sensible embebido en hielo las muestras. Murata et al. han demostrado que 1MV la transmisión análisis da microscopia (STEM) mayor contraste de la imagen que una imagen de campo claro de plástico encajado las células de levadura con 5 μm de espesor, donde el contraste de la imagen se da principalmente por el contraste de amplitud13 . Sin embargo, se espera que el efecto del daño devastador sobre electrones acelerados mayor crea otra limitación a la dosis de irradiación para daños sensibles cryo-muestras16. La aplicación de Volta y Zernike fase placas17,18 HVEM puede reducir el daño devastador al reducir la dosis total en el futuro. Otra limitación al uso de HVEM para muestras gruesas viene del hecho de que las instalaciones de usuario que proporcionan HVEM son escasas en todo el mundo.
Utilizando una metodología alternativa para observar a especímenes gruesos, tomografía crio-madre de 300 kV ha demostrado imágenes de alto contraste en muestras congeladas-hidratado con espesor superior a varios cientos de nanómetros19. Para recuperar el contraste de la fase en cryo-tallo, microscopía electrónica de pthychographic también se ha introducido, en la que la placa de fase en la lente de condensador transpone una difracción fase modulada a un detector 2D pixelados del20. Las imágenes son obtenidas por cálculo de diffractions múltiples. Directo y rápido 3D cryo-proyección de imagen del nativo grandes congeladas las muestras, FIB-cryo-SEM puede también ser usado21, donde serie de seccionamiento con un haz de iones enfocado y bloquear la proyección de imagen de cara se aplica para la proyección de imagen completamente había hidratada a muestras congeladas. Aunque estas tecnologías amplían la gama de la visión de especímenes biológicos, es difícil encontrar la ubicación de destino de las bacterias, por ejemplo etiquetado bacterias, porque el objetivo es completamente bajo el hielo y no puede ser identificado antes de recortar.
Compactación del ADN produce una estructura distinta en cianobacterias. DNA compactado células distinguen fácilmente incluso sin ser manchado por un sesgo de densidad grande dentro de las células que no está presente en las células normales. Sin embargo, para poder visualizar más eventos locales dentro de la célula, es necesario transferir el ROI fluorescencia marcado en el microscopio electrónico. Para correlativa luz y la microscopia (CLEM), imágenes de microscopio óptico y microscopio electrónico se correlaciona generalmente con gotas de látex fluorescentes o puntos cuánticos en EM buscador redes12. Las partículas de etiquetado deben ser de densidad electrónica alta además de fluorescencia. Pueden con precisión y fiabilidad se correlacionan las posiciones entre las dos imágenes. Además, confirmando la zona marcada con microscopia del cryo-luz, superposición completa de retorno de la inversión puede lograrse entre dos microscopios. Cuando la caracterización más detalladas eventos estructurales en compactación de ADN, estas partículas y cryo-luz microscopio será una herramienta indispensable para una correlación más robusta y precisa en el futuro.
Este artículo muestra cómo la estructura transitoria de compactación del ADN en cianobacterias se caracterizan por una combinación de cultura síncrona, microscopía de fluorescencia y tomography del cryo-electrón de alta tensión. Este protocolo se centra en la observación del ADN compactado. Al combinar este método con otras nuevas tecnologías mencionadas, será posible investigar el proceso de compactación del DNA con mayor detalle y métodos convenientemente modificados son ampliamente aplicables a otros eventos dinámicos estructurales en bacterias.
Divulgaciones
Los autores no declaran a intereses financieros en competencia.
Agradecimientos
Los autores agradecen Tammo Reisewitz lectura crítica del manuscrito y tanto Mako Hayashi y Sayuri Hagiwara para cultivo cuidado y observación de cianobacterias, Yoshitaka Kimori para procesamiento de imágenes, Chihong Song, Naoyuki Miyazaki, Miyoko Nagayoshi para ayudar con la segmentación de las estructuras. Este trabajo fue financiado por el programa de estudio de colaboración del Instituto Nacional de Ciencias Fisiológicas (NIPS) a Y.K.
Materiales
| Name | Company | Catalog Number | Comments |
| Hoechst 33342 solution | Dojindo | 346-07951 | 1mg/mL in H2O |
| Agar Powder (for plant culture) | Wako | 016-11875 | |
| Boric acid | Wako | 027-02192 | 99.5% |
| Manganese chloride tetrahydrate | Wako | 139-00722 | 99% |
| Zinc sulfate heptahydrate | Wako | 264-00405 | 99.5% |
| Sodium molybdate | Wako | 196-02472 | 99% |
| Copper sulfate pentahydrate | Wako | 039-04412 | 99.5% |
| Cobalt nitrate hexahydrate | Wako | 031-03752 | 99.5% |
| Sodium nitrate | Wako | 191-02542 | 99% |
| Magnesium sulfate heptahydrate | Wako | 131-00405 | 99.5% |
| Calcium chloride dehydrate | Wako | 031-00435 | 99.5% |
| Citric acid | Wako | 036-05522 | 98% |
| EDTA-2Na | Dojindo | 343-01861 | 99.5% |
| Sodium carbonate | Wako | 197-01581 | 99.8% |
| Potassium phosphate dibasic | Wako | 164-04295 | 99% |
| TES (Good’s buffer) | Dojindo | 344-02653 | 99% |
| Ferric ammonium citrate | Wako | 092-00802 | 1st Grade |
| Sodium thiosulfate pentahydrate | Wako | 197-03585 | 99% |
| BSA gold tracer 15nm | Aurion | 215.133 | |
| Quantifoil EM grid | Quantifoil MicroTools | R3.5/1 Copper grid | |
| Electron films | Kodak | SO-163 | |
| Developer | Kodak | D19 | |
| Fixer | Kodak | Rapid fixer | Solution |
| Filter paper | Whatman | Grade 1 | |
| Growth chamber | NKsystem | LH-100SP | |
| Fluorescent microscope | Nikon | ECLIPSE 50i | |
| High voltage TEM | HItachi | H1250M | |
| Cryo-specimen holder for HVEM | Gatan | ||
| plunge-freezing device | Leica | EM CPC | |
| Plasma Ion bombarder | Vacuum device | PIB-10 | |
| Liquid nitrogen storage | Taylor-Wharton | 25LDB | |
| Developing tank | Dosaka EM | TB-3-75 | |
| flatbed scanner | Nikon | Coolscan 9000ED | |
| Segmentation software | FEI | Amira | https://www.fei.com/software/amira |
| Tomographic Reconstruction software | eTOMO | http://bio3d.colorado.edu/imod |
Referencias
- Smith, R. M., Williams, S. B. Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus. Proc. Nat. Acad. Sci. USA. 103 (22), 8564-8569 (2006).
- Kondo, T. A cyanobacterial circadian clock based on the kai oscillator. CSHS Quant. Biol. 72, 47-55 (2007).
- Seki, Y., Nitta, K., Kaneko, Y. Observation of polyphosphate bodies and DNA during the cell division cycle of Synechococcus elongatus PCC 7942. Plant biol. 16 (1), 258-263 (2014).
- Murata, K., Hagiwara, S., Kimori, Y., Kaneko, Y. Ultrastructure of compacted DNA in cyanobacteria by high-voltage cryo-electron tomography. Sci. Rep. 6, 34934 (2016).
- Koster, A. J., et al. Perspectives of molecular and cellular electron tomography. J. struct. boil. 120 (3), 276-308 (1997).
- Lučić, V., Rigort, A., Baumeister, W. Cryo-electron tomography: The challenge of doing structural biology in situ. J. Cell Biol. 202 (3), 407-419 (2013).
- Murata, K., et al. Visualizing Adsorption of Cyanophage P-SSP7 onto Marine Prochlorococcus. Sci. Rep. 7, 44176 (2017).
- Rippka, R., Deruelles, J., Waterbury, J. B., Herdman, M., Stanier, R. Y. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. J. Gen. Microbiol. 111, 1-61 (1979).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J. struct. boil. 116, 71-76 (1996).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. J. Struct. Biol. 144, 114-122 (2003).
- Kimori, Y. Morphological image processing for quantitative shape analysis of biomedical structures: effective contrast enhancement. J. Sync. Rad. 20, 848-853 (2013).
- Jun, S., Zhao, G., Ning, J., Ga Gibson, ., Watkins, S. C., Zhang, P. Correlative microscopy for 3D structural analysis of dynamic interactions. J. Visual. Exper. 76, e50386 (2013).
- Murata, K., Esaki, M., Ogura, T., Arai, S., Yamamoto, Y., Tanaka, N. Whole-cell imaging of the budding yeast Saccharomyces cerevisiae by high-voltage scanning transmission electron tomography. Ultramicros. 146, 39-45 (2014).
- Kortje, K. H., Paulus, U., Ibsch, M., Rahmann, H. Imaging of thick sections of nervous tissue with energy-filtering transmission electron microscopy. J. Microsc. 183, 89-101 (1996).
- Bouwer, J. C., et al. Automated most-probable loss tomography of thick selectively stained biological specimens with quantitative measurement of resolution improvement. J. Struct. Biol. 148 (3), 297-306 (2004).
- Egerton, R. F., Li, P., Malac, M. Radiation damage in the TEM and SEM. Micron. 35 (6), 399-409 (2004).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proc. Nat. Acad. Sci. USA. 111 (44), 15635-15640 (2014).
- Murata, K., et al. Zernike phase contrast cryo-electron microscopy and tomography for structure determination at nanometer and subnanometer resolutions. Structure. 18 (8), 903-912 (2010).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of biological cells. Nat. Methods. 11 (4), 423-428 (2014).
- Ophus, C., et al. Efficient linear phase contrast in scanning transmission electron microscopy with matched illumination and detector interferometry. Nat. Comm. 7, 1-7 (2016).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. J. Struct. Biol. 184 (2), 355-360 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados