Method Article
ויזואליזציה של דחיסת DNA ב כחוליות על ידי מתח גבוה הקפאה-אלקטרון טומוגרפיה
In This Article
Summary
פרוטוקול זה מתאר כיצד ניתן להמחיש דחיסת אן ארעי של כחוליות. טיפוח סינכרונית, פיקוח על-ידי קרינה פלואורסצנטית מיקרוסקופ, הקפאה מהירה ו גבוה מתח הקפאה-אלקטרון טומוגרפיה משמשים. פרוטוקול עבור מתודולוגיות אלה מוצג, יישומים עתידיים ופיתוחים הנדונים.
Abstract
פרוטוקול זה מתאר כיצד ניתן להמחיש דחיסת אן ארעי של כחוליות. דחיסת DNA הוא אירוע cytoplasmic דרמטי לאחרונה מצאו להופיע אצל כמה כחוליות לפני חלוקת התא. עם זאת, בשל גודל תא גדול ואת התו ארעי, קשה לחקור את המבנה בפירוט. כדי להתגבר על הקשיים, ראשית, דחיסת DNA reproducibly מיוצר cyanobacterium Synechococcus elongatus PCC 7942 ובתרבות סינכרונית באמצעות 12 שעות בכל מחזור/כהה. שנית, דחיסת DNA המנוטרת על-ידי קרינה פלואורסצנטית מיקרוסקופ, נתפס על ידי הקפאה מהירה. שלישית, מבנה נתונים היסטוריים של ה-DNA לדחוס את התאים הוא מדמיין בתלת מימד (3D) על ידי טומוגרפיה אלקטרונים הקפאה של מתח גבוה. קבוצה זו של שיטות ישימה באופן נרחב כדי לחקור מבנים ארעיים חיידקים למשל חלוקת התא, כרומוזום סגרגציה, זיהום phage ועוד., אשר המנוטרת על-ידי קרינה פלואורסצנטית במיקרוסקופ הינם ישירות דמיינו ידי טומוגרפיה הקפאה אלקטרונים בנקודות זמן מתאים.
Introduction
דחיסת DNA הוא אירוע דרמטי cytoplasmic זוהתה ב כמה כחוליות. כאשר Synechococcus elongatus היה תרבותי מתחת לגיל 12 שעות בכל מחזור/כהה, DNA הופיע מרוכז בסוף תקופת אור, אשר היה בבירור שונה מהמראה שלה בזמנו אחרים נקודות1. הוצע כי תהליך זה נשלטת על ידי שעון היממה המבוססים על חלבונים קאי2. . ההלטה ואח דיווחו כי ה-DNA מוכתם Hoechst 33342 נדחס בתאים elongatus ס לקראת סוף תקופת אור, הראה רוד מסולסל-צורה תחת מיקרוסקופ זריחה. ה-DNA הדחוס מופרדים ואז לתוך שני במרכז המוט של התא מחולק, ולבסוף חזר הפצה אחידה נורמלי בכל תא בת3. עם זאת, את הארעיות ואת גודל גדול עבור מיקרוסקופ אלקטרונים המניע ניתוח מבנה. מוראטה. ואח בשילוב מספר שיטות, כולל התרבות סינכרונית, מיקרוסקופיה פלורסצנטיות, הקפאה מהירה גבוה מתח אלקטרון הקפאה-טומוגרפיה (הקפאה-HVET), והצלחתי לזהות את המבנה של דחיסה אן ארעי, כולל את קינטיקה של גופים (PPBs) הפוליפוספאט4. כתב היד מספק הסבר ויזואלי של חומר קשה בפירוט על ידי שילוב של ההליכים ניסיוני.
ס elongatus יש צורה קפסולה, באורך של 2-5 מיקרומטר, ברוחב של 0.5 מיקרומטר ו דחיסת DNA מושלם מופיע בתאים חיים רק למשך זמן קצר מאוד. לכן, השינויים המבניים המתרחשים הדחוס DNA cyanobacterial היו ידועות בפירוט. על מנת לחקור את המבנים הללו על ידי מיקרוסקופ אלקטרונים, זה הכרחי להתגבר על שתי בעיות עיקריות טכני. אחד הוא התצפית של הדגימה כזה עבה של החיידק כל-ליד תנאים מקומיים, והשני הוא קיבעון מהירה של מבנה דינמי. לגבי הבעיה הראשונה, פלסטית חופשי ממוצע (iMFP) של אלקטרונים תלוי המתח מאיץ של מיקרוסקופ אלקטרונים5. במיקרוסקופ אלקטרונים הילוכים (TEM) של 300 kV, זה פחות מ 350 ננומטר. לדוגמה, בעת cyanobacterium קרח-מוטבע (≈ עובי הדגימה 600 nm) הוא ציין 200kV TEM (iMFP ≈ 250 ננומטר), המבנים בתוך התא הם קשה להתבונן. לעומת זאת, 1 MV TEM (iMFP ≈ 500 ננומטר) יכול לתת, תמונה של מבנה cytoplasmic ברחבי התא (איור 1). ב פרוטוקול זה, כחלק אחד של הפתרון, מיקרוסקופ אלקטרונים מתח גבוה (HVEM) במתח מאיץ 1 MV הועסק. עם זאת, מתקנים המיישמים HVEM מוגבלות ברחבי העולם. פתרונות חלופיים אפשריים הם דנו גם במקטע דיון. הבעיה השנייה נפתרה על ידי הקפאה-מיקרוסקופ (הקפאה-EM). זהו כלי רב עוצמה ליצירת אפקטים של מבנים דינמי-ליד תנאים מקומיים, שבו הדגימה במהירות הוא קפוא באתאן נוזלי באמצעות מכשיר הקפאה מהירה, הרגע הקפוא נצפית ישירות עם מינימום של שינויים6. שילוב עם טומוגרפיה ממוחשבת, תמונת מצב של מבנים תלת-ממדיים (3D) יכול להיות ששוחזר מכתב הטיה הסדרה7. בניסוי זה, דחיסת DNA שוכפלה על ס' elongatus באמצעות תרבות סינכרונית מחזור כל/כהה מתחת לגיל 12 h, העיתוי של ההקפאה של הדגימה נקבע על-ידי ניטור תחת מיקרוסקופ זריחה.
הגישות המתוארות כאן חלים נרחב במחקר של מבנים דינמיים תאים חיידקיים, למשל חלוקת התא, כרומוזום סגרגציה ולדלקת phage, ויש אפשרות לפתוח כיוונים חדשים במחקר מיקרוביולוגית.
Protocol
1. סינכרוני תרבות של כחוליות
- תרבות elongatus ס PCC 7942 בצלחת סטיריליים BG 11 (בצלוחית 9 ס מ סטרילי פלסטיק) המכילה אגר 1.5% (w/v) ו- 0.3% (w/v) נתרן תיוסולפט8.
- מקם את הצלחות תא הצמיחה ב 23 ° C עם עוצמת האור של 50 µE/m2/s ובכפוף 12 שעות אור/12 מחזורים כהה h.
- העבר את התאים על פלטות אגר BG11 טריים פעם בשבוע.
הערה: התרבויות על אגר יופיעו להקות ירוק של תאים מתרבים באופן פעיל אחרי שבוע אחד תחת תנאי זה תרבות. - קח ירוק גושים של תאים עם לולאות תיל סטיריליים להבה, פס התאים על צלחת אגר BG11 טריים. לעשות זאת על ספסל נקי.
2. פיקוח על-ידי קרינה פלואורסצנטית מיקרוסקופ
- להשתמש בתאים תרבותי על הצלחת אגר במשך 6 ימים להתבונן דחיסת DNA. לאסוף התאים מהצלחת בסוף תקופת אור על ידי שפיכת 1 מ"ל של פתרון סוכרוז 0.2 מ' מעל התאים. חזור על מזיגת הפתרון על גבי התאים כך רוב התאים נאספים. העברת הפתרון מושעה-תא לתוך צינור מיקרו עבור ה-DNA מכתים.
- הוסף DNA צביעת צבע (למשל Hoechst 33342) לפתרון µL 500 של הפתרון תא מושעה בצינור מיקרו כדי ריכוז סופי של 1 µg/mL. אז להשאיר את הצינור באפלה במשך 10 דקות.
- Centrifuge עבור 1 דקות ב- x 2,000 g כדי משקעים התאים. למחוק את תגובת שיקוע והוסף 10 µL של 0.2 מ' פתרון סוכרוז לקבל השעיה תא עבות.
- העברת µL 1 של התמיסה המכילה ויטראז'ים לתאים כוס שקופיות, לשים מכסה ולצפות עם מיקרוסקופ פלורסצנטיות מצויד עם פילטר UV באמצעות עדשת מטרה הגדלה של 100 X וטבילה שמן.
- לאשר כי דחיסת DNA הוא ציין בשלב זה של רוב התאים ולאחר מכן להכין את הדגימה מקפיא לשלב הבא.
3. מדגם קפוא על הקפאה-HVET
- להגדיר את התקן קירור מים עמוקים. למלא את המיכל חנקן נוזלי ולהתחיל הקירור. תא הקפאה לאחר חיבור המיכל, התא עם צינור טפלון.
- למלא אתאן נוזלי לתוך סיר קטן cupper בתוך החדר לאחר לצנן את החדר לטמפרטורה חנקן נוזלי. משקפיים במהלך המבצע, מכיוון אתאן נוזלי הוא חומר נפץ.
- זוהר פריקה הפחמן-לצד EM מצופים פחמן חור ברשת (חור ברשת) עבור 30 s-50 אמא באמצעות bombarder יון פלזמה.
- 1 µL של מעקב BSA זהב החלת (15 ננומטר) לרשת חור כסמן fiducial.
- להחיל על aliquot 2.5 µL של תאים בשלב דחיסת DNA לרשת חור. למחוק את הפתרון עודף עם נייר הסינון. טיבלו הרשת אתאן נוזלי בעזרת פומפה במכשיר הקפאה עמוקה באופן מיידי.
- אחסן את רשתות קפוא אחסון בחנקן נוזלי עד הם נבדקים.
4. הקפאה-HVET
- להגדיר את HVEM-מתח גבוה של 1 MV.
- הר על הרשת קפוא בעל הקפאה-הדגימה HVEM precooled ל-150 מעלות צלזיוס עם חנקן נוזלי בתוך הקפאה-תחנת העבודה, ירגישו HVEM. להיות זהירים כדי למנוע זיהום על ידי קרח.
- בחר אזור ההדמיה בהגדלה נמוכה יותר גדולה של 1, 000 X. להתאים את גובה ציר z ' eucentric '.
- להטות את הבמה הדגימה ל-60 ° ולהסיר את התגובה הנגדית של הטיית הסיבוב.
- התאם את המוקד בסמוך למיקום היעד בהגדלה גדולה של 10, 000 X. הגדר תחת המוקד של 6 עד 10 מיקרומטר על ידי סטיית מהתמונה ממוקד. עבור הדמיה, הגדר את המינון e–2 /Å-2 או פחות על הדגימה מראש.
- למדוד את המינון אלקטרונים על ידי צפיפות הזרם על המסך תמונות ב- HVEM. לקחת תמונה על סרט אלקטרון או על-ידי מצלמה דיגיטלית בהגדלה אותו כמו תהליך המיקוד.
- לאסוף תמונות להטות באופן ידני על-ידי הפרוצדורה זהה כמו (4.5)-60 ° +60 °-תוספת קבועה זווית הטיה של ° 2 עד 4 °.
הערה: ב מיקרוסקופים אלקטרון מודרניים רבים, הרכישה של הסדרה הטיה אוטומטי על-ידי השילוב של מצלמה דיגיטלית. במקרה זה, בצע את ההוראות. הסרטים שלילי, לפתח הסרטים במשך 12 דקות ב 20 מעלות צלזיוס בתוך מיכל מפתח באמצעות מפתח במלוא העוצמה, התיקון במתקן 10 דקות דיגיטייז הסרטים ברזולוציה של 4,000 dpi (0.635 nm לפיקסל על התמונה) באמצעות סורק משטח אופקי. במקרה של מצלמה דיגיטלית, נושא את התמונות שנאספו ישירות אל השלב הבא של עיבוד תמונה. במידת הצורך, להקטין את גודל התמונה על-ידי מסנן החציוני באמצעות שניים עד ארבעה binning (גודל תוך צמצום פקטור) ותוכנות המתאים (למשל ImageJ).
5. שחזור טומוגרפי
- להפוך קובץ תמונה מחסנית של הפרט להטות תמונות באמצעות הפקודה "tif2mrc" או "newstack" ב IMOD תוכנת9.
- הפעלת eTomo GUI תוכנה ב- IMOD ולהגדיר פרמטרים בתמונה: גודל הפיקסל, קוטר fiducial, סיבוב תמונה, וכו '. לאחר מכן ליצור סקריפטים.
- ביצוע תוכניות בודדות על-פי התוכנות המפורטות בטבלאות של חומרים, שם הסדרה הטיה מיושר באמצעות סמנים fiducial (עם רשע שיורית שגיאה של פחות מ- 0.5). לבסוף, לשחזר tomogram תלת-ממד באמצעות האלגוריתם SIRT ב- IMOD.
- לחלץ אזור בעל עניין (ROI) tomogram, הסר רעש באמצעות מסנן denoise: מסנן דיפוזיה אניסוטרופי IMOD, מסנן דו צדדיים אימן10או תאור מתמטי של מסנן11, וכדומה, עם פרמטרים מתאימים כדי לשפר את הניגודיות.
6. פילוח של התכונה עניין
הערה: ההליך המתואר להלן ספיציפית התוכנה בשימוש (ראה טבלת חומרים) אבל חבילות תוכנה אחרות ניתן להשתמש במקום זאת. עיין במדריך למשתמש שלהם.
- בחלון הצופה 3D, פתח את הקובץ tomogram על אמירה תוכנה וצור של OrthoSlice.
- בחלון העורך פילוח, ליצור קובץ פילוח על-ידי בחירה "תווית שדה חדש".
- לעקוב באופן ידני את הגבול של התכונה עניין (FOI). בצע את FOI דרך כל הפרוסות tomogram. עבור, קרומים, נייר השני יצירת "חומר חדש" וחזור על הפעולה זהה.
- צור עיבוד פני השטח על-ידי בחירה בתפריט "SurfaceGen". כדי להמחיש את עוצמת הקול מקוטע, בחר בתפריט "SurfaceView". כדי להזיז, לסובב, להגדיל את תלת-ממדי, השתמש בכלים בחלון הצופה 3D.
- על פילוח אוטומטי, השתמש בכלי מטה הקסם. לחץ על אובייקט, והתאם את המחוונים התצוגה ואת המסיכה לכסות את טווח הערכים כך האובייקט נבחר באופן מלא על ידי התכונות שלו.
תוצאות
תרבות סינכרונית מדויק מחזור כל/כהה מתחת לגיל 12 h, DNA המסומנת Hoechst מראה התפלגות אחידה נורמלי במצב כהה (איור 2 א). עם זאת, זה בהדרגה דוחסת בתוך התא במהלך תקופת אור, ומופיע מבנה דמוי מוט גליים (איור 2b) בסוף תקופת אור. לבסוף המטה מחלק במרכז (חיצים ג' באיור 2), שני חלקיו מופצים לתוך התאים הבת (איור דו-ממדי). לאחר חלוקת התא, ה-DNA הדחוס ונעלם מייד ומחזירה ה-DNA הפצה אחידה נורמלי.
Aliquot של התאים המכילים את התאים בשלב הסופי של דחיסת DNA מיד הועברו על גבי רשת חור ומהירה קפוא אתאן נוזלי, ומתי הרשת קפוא נצפתה על ידי 1 MV הקפאה-HVEM, המבנים הפנימיים של כחוליות כולל ה-DNA, שכבות קרום תילקואיד, קירות התא, PPBs, הופיע כמו תמונת ברגע של קפוא (איור 3 א). תאים רבים הראו ברורים דחיסת DNA בתאים (החצים הלבנים ב איור 3 א), יכול להיות בקלות מכובד של תאים נורמליים (חץ לבן ב- 3b איור). כמה הפגינו כיווץ במרכזו של התאים כצפוי לפני חלוקת התא (חץ צהוב ב איור 3a).
ב- 3D tomograms, organelles העיקריים של התא יכול להיות מקוטע; דופן התא, שכבות קרום תילקואיד, DNA ו PPBs יכול להיות מכובד (איור 4). בפרט, ה-DNA הדחוס הופרד על ידי פער מובהק בציטופלסמה הדנ א היה מוקף בצפיפות נמוכה חומר ואיפה הרבדים ממברנה תילקואיד התעוותו לאורך המוט גלי ה-DNA הדחוס. התנהגות דינמית של PPBs נצפתה לאחרונה: ב- DNA לדחוס את התאים, PPBs קטנים רבים נראו לדבוק ה-DNA, ואילו הם גדולים ופחות בתאים נורמליים. בנוסף, רוב PPBs הופיע בתור זוגות, אנ שנראה בתהליך פרידה PPBs. זה הציע כי PPBs את עצמם נחלקים לשניים על-ידי שכפול ה-DNA ותפקוד בתור ספקים של פוספט למזון לסינתזת DNA.
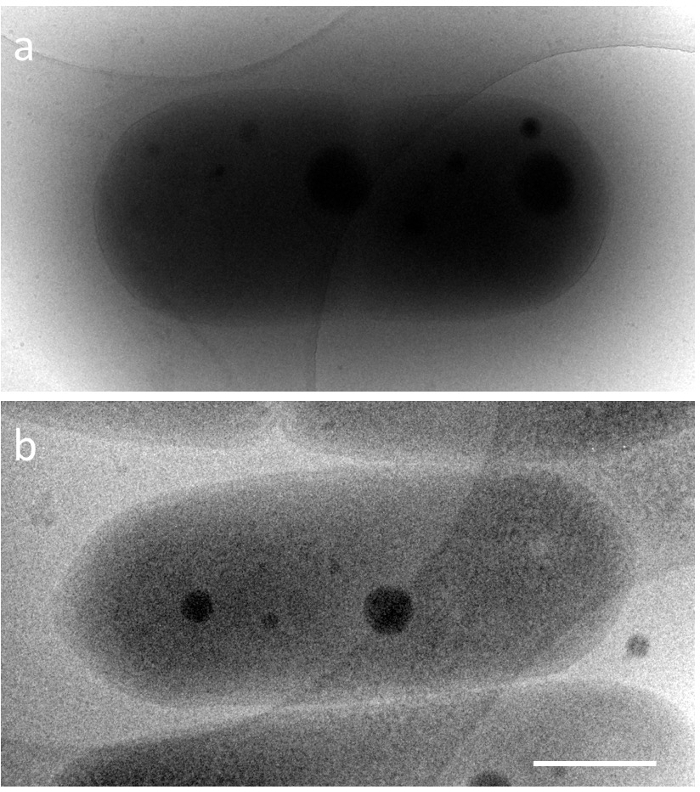
איור 1. הקפאה-EM תמונות של קרח-מוטבע כחוליות נורמלי, elongatus ס PCC 7942-מתחים מאיץ שונים. a) 200kV, ב) 1000kV. סרגל קנה מידה = 500 ננומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
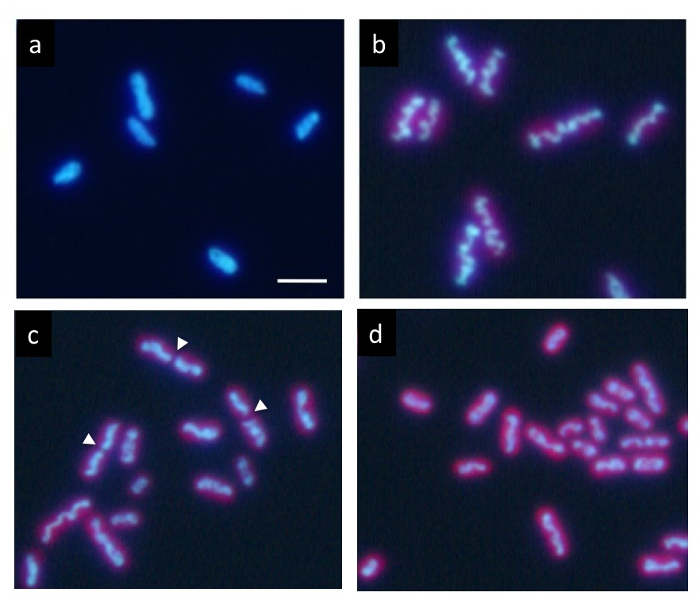
איור 2: זריחה מיקרוסקופיה של תאים elongatus ס cyanobacterium. לאחר תרבות סינכרונית מחזורים כל/כהה מתחת לגיל 24 שעות ביממה, התאים היו מוכתמים Hoechst 33342. (א) תאים לאחר שעתיים של היווצרות המדינה כהה להראות תיוג DNA אחיד. ה-DNA בתאים רבים מרוכז בהדרגה במהלך תקופת אור. זה בסופו של דבר היוו רוד מסולסל עבה (b) טיפוסי של דחיסת DNA. לאחר שלב זה, המבנים DNA הדחוס במהירות לחלק במרכזי שלהם (חץ) במהלך חלוקת התא (ג), ושני קטעים מופרדים לתוך התאים בתי (ד). התאים הבת חזר ל DNA אחיד תיוג שוב בתקופה החשוכה. סרגל קנה מידה = 2 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
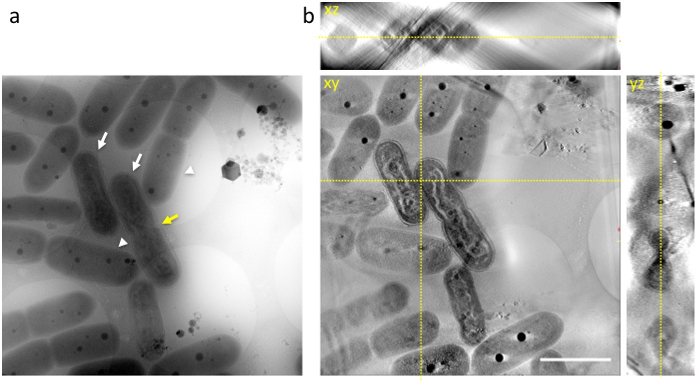
איור 3: הקפאה-HVEM התמונה של כחוליות נעוץ אמורפי קרח (א) מציג תמונת raw ב- 0 ° הטיה. התמונות צולמו בסוף תקופת אור. כמה תאים מציגים גופות DNA מוט בצורת גלי הדומה כרומוזומים מרוכז האיקריוטים (החצים הלבנים). בתאים נורמליים, כחוליות להפגין מבנה ה-DNA ניכרת בתוך הציטופלסמה (חץ לבן). כמה התערוכה כיווץ במרכזו של התאים כצפוי לפני חלוקת התא (חץ צהוב). (b) xy, xz, yz ימאהה-פרוסות tomogram תלת-ממד. קווים מנוקדים צהוב הצג חיתוכים של פרוסות. סרגל קנה מידה = 2 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
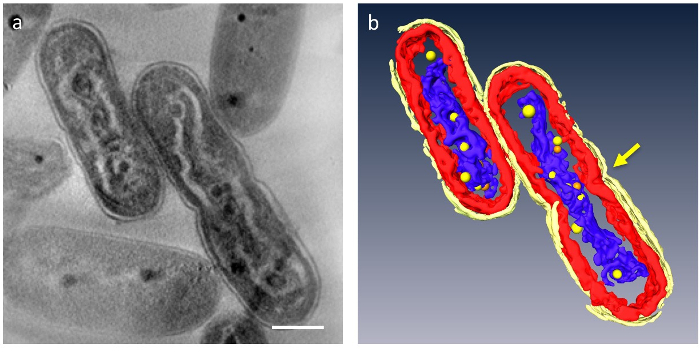
איור 4: Ultrastructure של תאים המכילים לדחוס את הדנ א. המרכיבים העיקריים הם מחולקים: דופן התא (צהוב בהיר), תילקואיד ממברנות (אדום) ו- DNA (כחול). (א) מראה z-חתיכה tomogram תלת-ממד. (b) כל שכבות. הכיווץ המציין למחקר מופיע במרכז של התא (חץ). PPBs הם עוצב כמו הספירות צהוב או כתום; כל כדור כתום מייצג המקבילה של הכדור הצהוב הקרוב ביותר. סרגל קנה מידה = 500 ננומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
הציגו לנו רצף של פרוטוקולים להמחשת דחיסת אן ארעי ב כחוליות. הרעיון הבסיסי הוא דומה לזה של מיקרוסקופ אלקטרונים (קלם)12ואור correlative. בנוסף, בשיטה זו, כחוליות בשידור חי היו המנוטרת על-ידי קרינה פלואורסצנטית מיקרוסקופ, קפוא במהירות על רשתות EM, דמיינו ישירות טומוגרפיה אלקטרונים הקפאה של מתח גבוה. כמו יישום הראשון, מבנה נתונים היסטוריים של ה-DNA נדחס תאים חיידקיים היה מדמיין בהצלחה ב- 3D. כיום, ההליך זה ספציפי לנושא הזה, אבל יהיה שימושי יותר בהרחבה, עם מתודיקה שונה במקרים מסוימים. . הנה, נדונים היתרונות, המגבלות, והאפשרויות העתידי של שיטה זו.
אחד היתרונות של שיטה זו הוא 3D להדמיה של התא כולו. 1 MV HVEM בהצלחה דמיינו את הדינמיקה מבנה organelles subcellular ב- DNA לדחוס את התאים. עם זאת, לא ניתן להבחין את המבנה הדק בתוך תאים נורמליים בשל ניגוד תמונה נמוכה. הגדלת פלסטית, פיזור מספר דגימות עבה טשטוש תמונה13. התמונה אפס-הפסד ואובדן ביותר-עילה סינון לפי מסנן אנרגיה יכול לשפר את הניגוד בתמונה על ידי הקטנת פיזור פלסטית14,15, אבל זה לא יעבוד עבור דגימות עבה יותר iMFP. הפסגות אפס- ואובדן של רוב-עילה-הפסד להפחית באופן דרסטי עם עובי הדגימה. זה קשה במיוחד כדי לקבל יחס אות לרעש מספקת דגימות הקרח-מוטבע רגיש אלקטרון. מוראטה. et al. הראו את השידור סריקה 1MV מיקרוסקופ (גזע) מעניק חדות התמונה גבוהה יותר מאשר תמונת שדה בהיר בפלסטיק מוטבע תאי שמרים עם עובי 5 מיקרומטר, שבו הניגוד תמונה ניתנת בעיקר לעומת משרעת13 . עם זאת, הוא צפוי כי ההשפעה של דבר הנזק על אלקטרונים מואצת גבוה יותר יוצר מגבלה אחרת המינון הקרנה עבור נזק רגיש הקפאה-דגימות16. היישום של וולטה, Zernike שלב צלחות17,18 עבור HVEM ייתכן שתוכל לצמצם נזק דבר על-ידי הפחתת המינון הכולל בעתיד. מגבלה נוספת באמצעות HVEM עבור דגימות עבה נובעת מהעובדה כי המתקנים המשתמש לספק HVEM נדירים ברחבי העולם.
באמצעות מתודולוגיה חלופיים כדי לבחון דגימות עבה, הקפאה-גזע טומוגרפיה 300 kV הוכיחה תמונות חדות גבוהה על דגימות קפוא-להתייבש עם עובי מעל מאות ננומטר מספר19. כדי לאחזר שלב ניגודיות בגזע-הקפאה, מיקרוסקופ pthychographic גם כבר הציג, שבה מחליף הצלחת שלב תוך העדשה מעבה דיפרקציה מאופנן שלב כדי pixelated גלאי 2D20. התמונות מאוחזרות על ידי חישוב של diffractions מרובים. הקפאה מהיר 3D הישירים -הדמיה של יליד גדול קפוא דגימות, הקפאה-שיקרתי-SEM יכול גם להיות בשימוש21, איפה טורי חלוקתה עם קרן יון ממוקד, לחסום את הפנים הדמיה מיושם עבור הדמיה להתייבש לחלוטין דגימות קפוא. למרות טכנולוגיות אלה להרחיב את טווח הצפייה של דגימות ביולוגיות, זה קשה למצוא את מיקום היעד של החיידקים, למשל עם התווית חיידקים, כי המטרה היא לגמרי מתחת לקרח אין אפשרות לזהות לפני חיתוך.
דחיסת DNA יוצר מבנה של כחוליות. ה-DNA לדחוס את התאים הם מכובדים בקלות גם בלי להיות מוכתם בשל דעה קדומה צפיפות גדולה בתוך התאים שאינו נוכח תאים נורמליים. עם זאת, על מנת להמחיש עוד אירועים מקומיים בתוך התא, זה צורך להעביר את רועי fluorescently שכותרתו לתוך המיקרוסקופ האלקטרוני. עבור אור correlative ואלקטרון (קלם), בסיוע מיקרוסקופ אור תמונות ותמונות מיקרוסקופ אלקטרונים נמצאים בדרך כלל בקורלציה באמצעות חרוזים לייטקס פלורסנט או נקודות קוונטיות ב EM finder רשתות12. החלקיקים labelling להיות צפיפות אלקטרונים גבוה בנוסף זריחה. הם יכולים בדייקנות ובאמינות לתאם את העמדות בין שתי תמונות. יתר על כן, על-ידי המאשר את האזור עם תוויות עם מיקרוסקופ אור הקפאה, תושג חפיפה מלאה של רועי בין שני מיקרוסקופים. בעת אפיון מפורט יותר מבניים םיעוריא דחיסת DNA, אלה חלקיקים, מיקרוסקופ אור הקפאה יהיה כלי הכרחי עבור מתאם מדויק ועמיד יותר בעתיד.
מאמר זה מציג כיצד לאפיין את מבנה ארעי של דחיסת DNA ב כחוליות ע י שילוב של תרבות סינכרונית, מיקרוסקופיה פלורסצנטיות וטומוגרפיה הקפאה-אלקטרון מתח גבוה. פרוטוקול זה מתמקד התצפית של DNA הדחוס. על ידי שילוב של שיטה זו עם טכנולוגיות אחרות שהוזכרו לעיל, תהיה אפשרות לחקור את התהליך של דחיסת DNA בפירוט נוסף, שיטות כראוי ששונה חלים נרחב אירועים מבניים דינמיים אחרים של חיידקים.
Disclosures
המחברים מצהירים אין אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מודים Tammo Reisewitz על קריאה ביקורתית של כתב היד, ו- Mako הייאשי והן Sayuri Hagiwara לטיפוח זהיר ועל התבוננות כחוליות Yoshitaka Kimori לעיבוד תמונה, שיר Chihong, מיאזאקי Naoyuki, Miyoko Nagayoshi עוזר עם פילוח של המבנים. עבודה זו נתמכה על ידי תוכנית הלימודים שיתופי של המכון הלאומי עבור פיזיולוגיים מדעי (פיטמי) כדי Y.K.
Materials
| Name | Company | Catalog Number | Comments |
| Hoechst 33342 solution | Dojindo | 346-07951 | 1mg/mL in H2O |
| Agar Powder (for plant culture) | Wako | 016-11875 | |
| Boric acid | Wako | 027-02192 | 99.5% |
| Manganese chloride tetrahydrate | Wako | 139-00722 | 99% |
| Zinc sulfate heptahydrate | Wako | 264-00405 | 99.5% |
| Sodium molybdate | Wako | 196-02472 | 99% |
| Copper sulfate pentahydrate | Wako | 039-04412 | 99.5% |
| Cobalt nitrate hexahydrate | Wako | 031-03752 | 99.5% |
| Sodium nitrate | Wako | 191-02542 | 99% |
| Magnesium sulfate heptahydrate | Wako | 131-00405 | 99.5% |
| Calcium chloride dehydrate | Wako | 031-00435 | 99.5% |
| Citric acid | Wako | 036-05522 | 98% |
| EDTA-2Na | Dojindo | 343-01861 | 99.5% |
| Sodium carbonate | Wako | 197-01581 | 99.8% |
| Potassium phosphate dibasic | Wako | 164-04295 | 99% |
| TES (Good’s buffer) | Dojindo | 344-02653 | 99% |
| Ferric ammonium citrate | Wako | 092-00802 | 1st Grade |
| Sodium thiosulfate pentahydrate | Wako | 197-03585 | 99% |
| BSA gold tracer 15nm | Aurion | 215.133 | |
| Quantifoil EM grid | Quantifoil MicroTools | R3.5/1 Copper grid | |
| Electron films | Kodak | SO-163 | |
| Developer | Kodak | D19 | |
| Fixer | Kodak | Rapid fixer | Solution |
| Filter paper | Whatman | Grade 1 | |
| Growth chamber | NKsystem | LH-100SP | |
| Fluorescent microscope | Nikon | ECLIPSE 50i | |
| High voltage TEM | HItachi | H1250M | |
| Cryo-specimen holder for HVEM | Gatan | ||
| plunge-freezing device | Leica | EM CPC | |
| Plasma Ion bombarder | Vacuum device | PIB-10 | |
| Liquid nitrogen storage | Taylor-Wharton | 25LDB | |
| Developing tank | Dosaka EM | TB-3-75 | |
| flatbed scanner | Nikon | Coolscan 9000ED | |
| Segmentation software | FEI | Amira | https://www.fei.com/software/amira |
| Tomographic Reconstruction software | eTOMO | http://bio3d.colorado.edu/imod |
References
- Smith, R. M., Williams, S. B. Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus. Proc. Nat. Acad. Sci. USA. 103 (22), 8564-8569 (2006).
- Kondo, T. A cyanobacterial circadian clock based on the kai oscillator. CSHS Quant. Biol. 72, 47-55 (2007).
- Seki, Y., Nitta, K., Kaneko, Y. Observation of polyphosphate bodies and DNA during the cell division cycle of Synechococcus elongatus PCC 7942. Plant biol. 16 (1), 258-263 (2014).
- Murata, K., Hagiwara, S., Kimori, Y., Kaneko, Y. Ultrastructure of compacted DNA in cyanobacteria by high-voltage cryo-electron tomography. Sci. Rep. 6, 34934 (2016).
- Koster, A. J., et al. Perspectives of molecular and cellular electron tomography. J. struct. boil. 120 (3), 276-308 (1997).
- Lučić, V., Rigort, A., Baumeister, W. Cryo-electron tomography: The challenge of doing structural biology in situ. J. Cell Biol. 202 (3), 407-419 (2013).
- Murata, K., et al. Visualizing Adsorption of Cyanophage P-SSP7 onto Marine Prochlorococcus. Sci. Rep. 7, 44176 (2017).
- Rippka, R., Deruelles, J., Waterbury, J. B., Herdman, M., Stanier, R. Y. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. J. Gen. Microbiol. 111, 1-61 (1979).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J. struct. boil. 116, 71-76 (1996).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. J. Struct. Biol. 144, 114-122 (2003).
- Kimori, Y. Morphological image processing for quantitative shape analysis of biomedical structures: effective contrast enhancement. J. Sync. Rad. 20, 848-853 (2013).
- Jun, S., Zhao, G., Ning, J., Ga Gibson, ., Watkins, S. C., Zhang, P. Correlative microscopy for 3D structural analysis of dynamic interactions. J. Visual. Exper. 76, e50386 (2013).
- Murata, K., Esaki, M., Ogura, T., Arai, S., Yamamoto, Y., Tanaka, N. Whole-cell imaging of the budding yeast Saccharomyces cerevisiae by high-voltage scanning transmission electron tomography. Ultramicros. 146, 39-45 (2014).
- Kortje, K. H., Paulus, U., Ibsch, M., Rahmann, H. Imaging of thick sections of nervous tissue with energy-filtering transmission electron microscopy. J. Microsc. 183, 89-101 (1996).
- Bouwer, J. C., et al. Automated most-probable loss tomography of thick selectively stained biological specimens with quantitative measurement of resolution improvement. J. Struct. Biol. 148 (3), 297-306 (2004).
- Egerton, R. F., Li, P., Malac, M. Radiation damage in the TEM and SEM. Micron. 35 (6), 399-409 (2004).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proc. Nat. Acad. Sci. USA. 111 (44), 15635-15640 (2014).
- Murata, K., et al. Zernike phase contrast cryo-electron microscopy and tomography for structure determination at nanometer and subnanometer resolutions. Structure. 18 (8), 903-912 (2010).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of biological cells. Nat. Methods. 11 (4), 423-428 (2014).
- Ophus, C., et al. Efficient linear phase contrast in scanning transmission electron microscopy with matched illumination and detector interferometry. Nat. Comm. 7, 1-7 (2016).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. J. Struct. Biol. 184 (2), 355-360 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved