Method Article
Visualisation de Compaction de l’ADN chez les cyanobactéries par haute tension Cryo-electron Tomography
Dans cet article
Résumé
Ce protocole décrit comment visualiser la compaction de l’ADN transitoire chez les cyanobactéries. Culture synchrone, suivi par la microscopie en fluorescence, congélation rapide et élevé tomographie cryo-électronique de tension sont utilisés. Un protocole pour ces méthodologies est présenté, et discutent de développements et futures applications.
Résumé
Ce protocole décrit comment visualiser la compaction de l’ADN transitoire chez les cyanobactéries. Compaction de l’ADN est un dramatique événement cytoplasmique récemment trouvé à se produire dans certaines cyanobactéries avant la division cellulaire. Toutefois, en raison de la taille de grandes cellules et le caractère transitoire, il est difficile d’enquêter sur la structure en détail. Pour surmonter les difficultés, tout d’abord, compaction de l’ADN est reproductible produite dans la cyanobactérie Synechococcus elongatus PCC 7942 par culture synchrone à l’aide de 12 h chaque cycle lumière/obscurité. Deuxièmement, compaction de l’ADN est contrôlée par la microscopie en fluorescence et capturée par congélation rapide. Troisièmement, la structure détaillée de l’ADN compacté cellules est visualisée en trois dimensions (3D) par tomographie cryo-électronique haute tension. Cet ensemble de méthodes est largement applicable pour étudier les structures transitoires dans les bactéries, par exemple la division cellulaire, ségrégation des chromosomes, infection par le phage etc.., qui sont surveillés par la microscopie en fluorescence et visualisées directement par tomographie Cryo-électronique aux moments appropriés.
Introduction
Compaction de l’ADN est un événement dramatique cytoplasmique qui a été identifié dans certaines cyanobactéries. Quand Synechococcus elongatus ont été cultivés sous 12 h chaque cycle lumière/obscurité, ADN apparu condensée à la fin de la période de lumière, qui était clairement différente de son apparence à l’époque d’autre points de1. Il a été suggéré que ce processus est contrôlé par une horloge circadienne basée sur les protéines de Kai2. Seki et coll. ont rapporté que l’ADN coloré avec Hoechst 33342 a été compacté dans les cellules de S. elongatus vers la fin de la période de lumière et a montré une forme tige ondulée sous un microscope à fluorescence. L’ADN compacté puis séparés en deux au centre de la tige que la cellule divisé et est finalement revenu à une répartition normale dans chaque cellule fille3. Cependant, son caractère transitoire et grande taille pour la microscopie électronique entravaient l’analyse structurale. Murata et coll. combiné plusieurs méthodes, notamment la culture synchrone, microscopie à fluorescence, congélation rapide et haute tension, cryo électrons-positons (cryo-HVET) et a réussi à identifier la structure de la compaction de l’ADN transitoire, y compris la cinétique de polyphosphate organes (RCB)4. Le manuscrit fournit une explication visuelle d’un matériau difficile en détail en combinant les procédures expérimentales.
S. elongatus a une forme de capsule, une longueur de 2 à 5 mm, une largeur d’environ 0,5 µm et la compaction de l’ADN parfaite apparaît dans les cellules vivantes que pour un temps très court. Par conséquent, les changements structurels qui se produisent dans la compaction de l’ADN cyanobactérienne étaient inconnues en détail. Afin d’enquêter sur ces structures en microscopie électronique, il est nécessaire de surmonter les deux principaux problèmes techniques. L’un est l’observation d’un tel spécimen épais de la bactérie tout à proximité de conditions natives, et l’autre est la fixation rapide d’une structure dynamique. En ce qui concerne le premier problème, le parcours libre moyen (iMFP) inélastique des électrons dépend de la tension d’accélération du microscope électronique5. Dans un microscope électronique à transmission (TEM) de 300 kV, il est inférieur à 350 nm. Par exemple, lorsqu’une cyanobactérie glace incorporé (spécimen épaisseur ≈ 600 nm) est observée en 200kV TEM (iMFP ≈ 250 nm), les structures à l’intérieur de la cellule sont difficiles à observer. En revanche, 1 MV TEM (iMFP ≈ 500 nm) peut donner et l’image de la structure cytoplasmique tout au long de la cellule (Figure 1). Dans le présent protocole, dans le cadre de la solution, un microscope électronique à haute tension (HVEM) à une tension d’accélération de 1 MV a été employé. Toutefois, les installations qui implémentent HVEM sont limitées dans le monde entier. Des solutions de rechange possibles sont également abordées dans la section « Discussion ». Le deuxième problème a été résolu par cryo microscopie électronique (cryo-EM). Il s’agit d’un puissant outil de visualisation de structures dynamiques au près des conditions naturelles, où l’échantillon est congelé rapidement dans l’éthane liquide à l’aide d’un appareil de congélation rapid, et le moment gelé on observe directement avec un minimum de modifications6. Alliant à la tomographie, un instantané des structures tridimensionnelles (3D) peut être reconstruit à partir l’inclinaison série7. Dans cette expérience, compaction de l’ADN a été reproduite dans s. elongatus , à l’aide de la culture synchrone sous 12 h cycle de chaque lumière/obscurité, et le moment de la congélation de l’échantillon a été déterminé en surveillant sous un microscope à fluorescence.
Les approches décrites ici sont largement applicables à l’étude des structures dynamiques dans les cellules bactériennes, par exemple la division cellulaire, ségrégation des chromosomes et infection par le phage et risquent d’ouvrir de nouvelles avenues de recherche microbiologique.
Protocole
1. synchrone Culture de cyanobactéries
- La culture S. elongatus PCC 7942 sur plaque du BG 11 stérilisé (dans un plat de Pétri plastique stérile 9 cm) contenant 1,5 % (p/v) d’agar et de thiosulfate de sodium 0,3 % (p/v)8.
- Placer les plaques dans une chambre de croissance à 23 ° C avec une intensité lumineuse de 50 µE/m2/s et soumis à des cycles foncé h de la lumière/12-12 h.
- Transférer les cellules sur des plaques de gélose BG11 frais une fois par semaine.
Remarque : Les cultures sur gélose seront affiche sous forme de bandes vertes de cellules en prolifération active après une semaine dans ces conditions de culture. - Prendre des touffes vertes des cellules avec une boucle de fil stérilisé de flamme et l’ensemencer les cellules sur une gélose de frais BG11. Pour ce faire sur un banc propre.
2. suivi par microscopie de Fluorescence
- Utilisez les cellules cultivées sur la gélose pour 6 jours pour observer la compaction de l’ADN. Prélever des cellules de la plaque à la fin de la période de lumière de verser 1 mL de solution de saccharose de 0,2 M au-dessus des cellules. Répétez verser la solution dans les cellules pour que la plupart des cellules est recueillie. Transvaser la solution de cellules suspendues dans un micro tube pour la coloration de l’ADN.
- Ajouter ADN coloration solution de colorant (p. ex. Hoechst 33342) à 500 µL de la solution de suspension de cellules dans un tube micro à une concentration finale de 1 µg/mL. Ensuite, tenir le tube dans l’obscurité pendant 10 min.
- Centrifuger pendant 1 min à 2 000 x g pour les sédiments, les cellules. Jeter le surnageant et ajouter 10 µL de solution de saccharose de 0,2 M pour obtenir une suspension cellulaire dense.
- Transférer 1 µL de la solution contenant les cellules colorées pour un verre de diapositive, mettre une lamelle et observer avec un microscope à fluorescence équipé d’un filtre UV à l’aide d’une lentille d’objectif avec un grossissement de 100 X et huile à immersion.
- Confirmer que la compaction de l’ADN est observée à ce point dans la plupart des cellules, puis préparation des échantillons pour la prochaine étape de congélation.
3. échantillon de gel pour Cryo-HVET
- Mettre en place un dispositif de plongeon du point de congélation. Remplissez le réservoir avec de l’azote liquide et commence à refroidir la cryo-chambre après avoir connecté le réservoir et la chambre avec un tube téflon.
- Remplissez éthane liquide dans une casserole de cuivre petit à l’intérieur de la chambre après refroidissement de la chambre à la température de l’azote liquide. Porter des lunettes pendant l’opération, parce que l’éthane liquide est explosive.
- La carbone du côté d’une trouée EM carbone enduit à décharge luminescente grid (grille trouée) pendant 30 s à 50 mA à l’aide d’un bombarder d’ion de plasma.
- Appliquer 1 µL de traceur de BSA gold (15 nm) à la grille trouée comme marqueur fiducial.
- Appliquer une quantité de 2,5 µL de cellules dans la phase de compactage de l’ADN à la grille trouée. Tache au large de l’excédent de solution avec un filtre en papier. Plonger la grille dans l’éthane liquide, utiliser un piston dans l’appareil de congélation plonger immédiatement.
- Rangez les grilles congelés dans le stockage de l’azote liquide jusqu'à ce qu’ils sont examinés.
4. Cryo-HVET
- Mettre en place le HVEM à une tension élevée de 1 MV.
- Monter la grille congelée dans un porte-cryo-spécimen pour HVEM refroidi à-150 ° C avec de l’azote liquide à l’intérieur de la cryo-station de travail et le charger dans le HVEM. Veillez à éviter toute contamination par de la glace.
- Sélectionnez une zone d’imagerie à un grossissement inférieur de 1, 000 X. Régler la hauteur d’axe z eucentric.
- La platine à-60 ° d’inclinaison et enlever le contrecoup de la rotation pendulaire.
- Ajuster la mise au point près de l’emplacement de la cible à un grossissement de 10, 000 X. Définir au titre de l’objectif de 6 à 10 µm de déviation par rapport à l’image focalisée. Pour l’imagerie, définir la dose à 2 e–/Å-2 ou moins sur l’échantillon au préalable.
- Mesurer la dose d’électrons par la densité de courant sur l’écran de l’image en HVEM. Prendre une image sur un film d’électron ou par appareil photo numérique au même grossissement que dans le processus de mise au point.
- Recueillir des images tilt manuellement par la même procédure que celle de (4.5) de-60 ° à + 60 ° à un incrément d’angle inclinaison de 2 ° à 4 °.
Remarque : Dans beaucoup modernes des microscopes électroniques, l’acquisition de la série d’inclinaison est automatisée par la combinaison d’un appareil photo numérique. Dans ce cas, suivez le mode d’emploi. Pour les films négatifs, développer les films pendant 12 min à 20° C dans un réservoir de développeur à l’aide d’un développeur à pleine puissance et fixer dans un fixateur pour 10 min. numériser les films avec une résolution de 4 000 PPP (0,635 nm/pixel sur l’image) à l’aide d’un scanner à plat. Dans le cas d’un appareil photo numérique, sous réserve des images recueillies directement à l’étape de la transformation de l’image. Si nécessaire, réduire la taille de l’image par un filtre médian à l’aide de deux à quatre binning (facteur réducteur taille) et des logiciels appropriés (par exemple ImageJ).
5. tomographique Reconstruction
- Faire un fichier d’image de pile de l’individu incliner les images à l’aide de la commande « tif2mrc » ou « newstack » l’IMOD logiciel9.
- Démarrer le logiciel eTomo GUI dans IMOD et définir les paramètres de l’image : taille de pixel, diamètre fiducial, rotation d’image, etc.. Puis créez des scripts.
- Exécuter des programmes individuels selon les logiciels répertoriés dans les tables des matières, où la série tilt est alignée à l’aide de marqueurs fiducial (avec une moyenne erreur résiduelle inférieure à 0,5). Enfin, reconstruire un tomogramme 3D à l’aide de l’algorithme SIRT en IMOD.
- Extrait une région d’intérêt (ROI) de la tomodensitométrie : et débruiter denoise filtre : un filtre de diffusion anisotrope IMOD, un filtre bilatéral dans EMAN10ou une morphologie mathématique filtre11, etc., avec les paramètres appropriés pour améliorer le contraste.
6. la segmentation de la fonctionnalité d’intérêt
NOTE : La procédure décrite ci-dessous est spécifique pour le logiciel utilisé (voir la Table des matières) mais les autres paquets de logiciel peuvent être utilisées à la place. Se référer à leur guide de l’utilisateur.
- Dans la fenêtre de la visionneuse 3D, ouvrez le fichier tomogramme sur logiciel Amira et générer un OrthoSlice.
- Dans la fenêtre de l’éditeur de Segmentation, créez un fichier de segmentation en sélectionnant un nouveau « champ de l’étiquette ».
- Manuellement tracer la frontière de la fonctionnalité d’intérêt (FOI). Suivre la FOI à travers toutes les tranches de tomodensitométrie :. Pour la deuxième FOI, créer un « matériau » et répéter la même opération.
- Générer un rendu de surface en sélectionnant le menu « SurfaceGen ». Afin de visualiser le volume segmenté, sélectionnez le menu « SurfaceView ». Pour déplacer, faire pivoter et zoomer dans le volume 3D, utilisez les outils dans la fenêtre de la visionneuse 3D.
- Pour la segmentation automatique, utilisez l’outil baguette magique. Cliquez sur un objet et réglez les curseurs dans l’affichage et de masquage pour couvrir la plage de valeurs pour que l’objet est entièrement sélectionné par ses caractéristiques.
Résultats
Dans une culture synchrone précise sous 12 h cycle de chaque lumière/obscurité, ADN marquée avec Hoechst montre une répartition normale dans l’État foncé (Figure 2 a). Cependant, il progressivement compacte au sein de la cellule au cours de la période de lumière et apparaît comme une structure en forme de tige ondulée (Figure 2 b) à la fin de la période de lumière. Enfin, la tige se divise au Centre (flèches dans la Figure 2c) et ses deux parties sont distribués dans les cellules filles (Figure 2d). Après la division cellulaire, l’ADN compacté disparaît immédiatement, et l’ADN renvoie à une répartition normale.
Quand une partie aliquote de cellules contenant les cellules dans la phase finale de la compaction de l’ADN ont été immédiatement transférés vers une grille trouée et rapide congelés en éthane liquide, et la grille congelée a été observée par 1 MV cryo-HVEM, les structures internes des cyanobactéries dont ADN, couches de membrane de thylakoid, parois cellulaires et RCB, est apparu comme une capture instantanée au moment de la congélation (Figure 3 a). Plusieurs cellules ont montré distincte compaction de l’ADN dans les cellules (flèches blanches dans la Figure 3 a) et pourraient être aisément distinguées des cellules normales (pointes de flèche blanches dans la Figure 3 b). Certains présentaient une constriction au centre des cellules comme prévu avant la division cellulaire (flèche jaune dans la Figure 3 a).
Dans 3D tomographies, principaux organites de la cellule pourraient être segmentés ; paroi cellulaire, couches de membrane de thylakoid, ADN et SPPB pourrait être distinguées (Figure 4). En particulier, l’ADN compacté a été séparé par un espace distinct dans le cytoplasme où l’ADN était entourée d’un matériau à faible densité et les couches de membrane de thylakoid furent déformées le long de la tige ondulée d’ADN compacté. Comportement dynamique des RCB a été récemment observé : ADN compacté cellules, nombreuses petites PPBs ont été vus à adhérer à l’ADN, alors qu’ils sont grands et moins dans les cellules normales. En outre, la plupart de la RCB est apparu sous forme de paires, et certains ADN semble être dans un processus de séparation d'avec la RCB. Cela suggère que SPPB eux-mêmes est divisés en deux par la duplication de l’ADN et de la fonction en tant que fournisseurs de phosphate pour la synthèse de l’ADN.
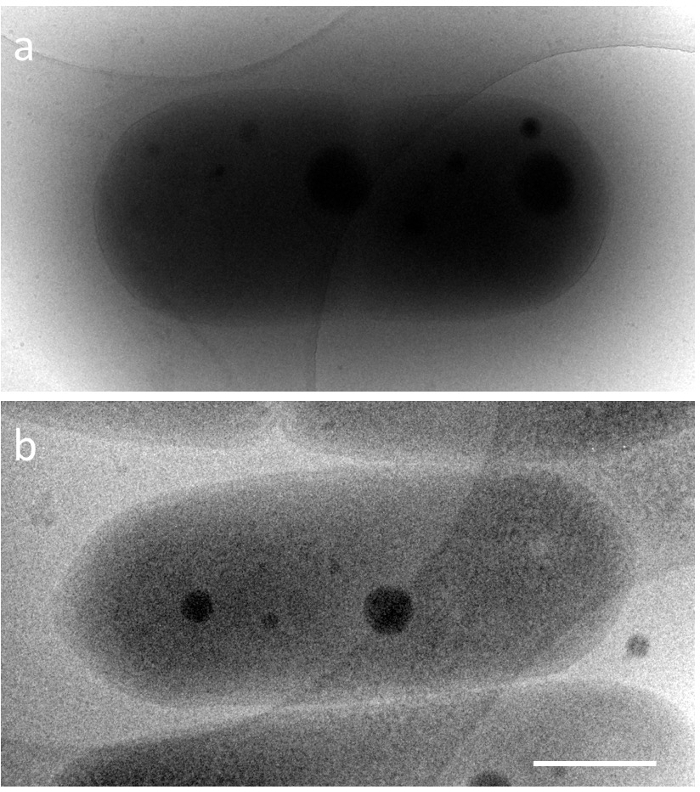
La figure 1. Images de Cryo-EM de cyanobactéries normales glace incorporé, S. elongatus PCC 7942 à différentes tensions d’accélération. une) 200kV et b) 1000kV. Echelle = 500 nm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
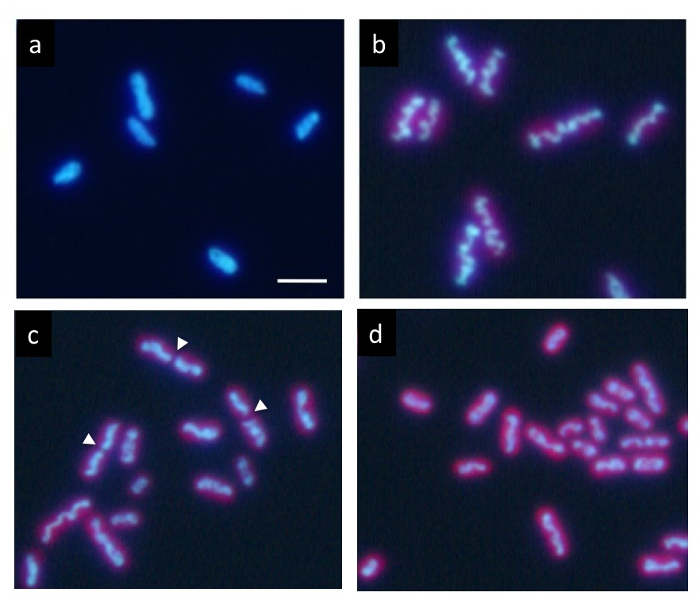
Figure 2 : La microscopie de Fluorescence des cellules S. elongatus cyanobactérie. Après la culture synchrone cycles de chaque lumière/obscurité de moins de 12 heures, les cellules ont été colorés avec Hoechst 33342. (a) les cellules après 2 h de l’apparition de l’État foncé présentent marquage uniforme d’ADN. L’ADN dans les cellules de nombreux condensés progressivement au cours de la période de lumière. En fin de compte, il a formé une épaisse tige ondulée (b) typique de la compaction de l’ADN. Après cette étape, les structures d’ADN compactés rapidement divisés dans leurs centres (pointes de flèches) pendant la division cellulaire (c) et les deux fragments séparés dans les cellules de fille (d). Les cellules de fille retourna à marquage uniforme d’ADN à nouveau à l’obscurité. Echelle = 2 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
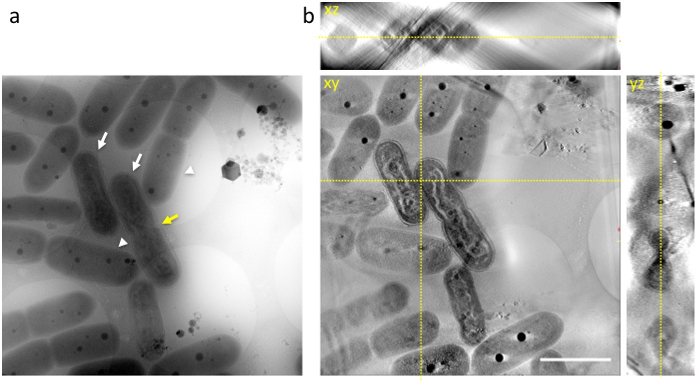
Figure 3 : image de Cryo-HVEM de cyanobactéries incorporé en glace amorphe (a) montre une image raw à inclinaison de 0 °. Des images ont été prises à la fin de la période de lumière. Certaines cellules montrent des ondulées en forme de bâtonnet ADN organes semblables aux chromosomes condensés eucaryotes (flèches blanches). Dans les cellules normales, les cyanobactéries présentent une structure discernable de l’ADN dans le cytoplasme (flèches blanches). Certains présentent une constriction au centre des cellules comme prévu avant la division cellulaire (flèche jaune). (b) xy, xz, yz-tranches d’une tomodensitométrie 3D :. Les lignes pointillées jaunes montrent aux intersections des tranches. Echelle = 2 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
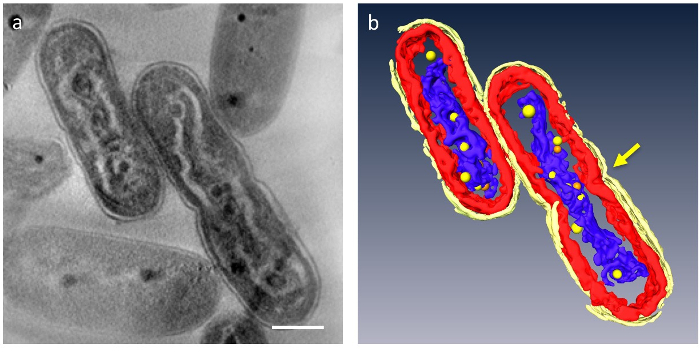
Figure 4 : Ultrastructure des cellules contenant compacté ADN. Les principales composantes sont segmentés : paroi cellulaire (jaune vif), les membranes thylakoïdes (rouges) et l’ADN (bleu). (a) montre une z-tranche d’un tomogramme 3D. (b) tous les segments. La constriction indiquant la séparation des cellules apparaît au centre de la cellule (flèche). PPBs sont modélisés comme des sphères jaunes ou oranges ; chaque sphère orange représente l’équivalent de la sphère jaune plus proche de vous. Echelle = 500 nm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous avons présenté une série de protocoles de visualisation transitoire compaction de l’ADN chez les cyanobactéries. Le concept de base est similaire à celle de la lumière corrélative et microscopie électronique (CLEM)12. En outre, dans cette méthode, cyanobactéries vivantes ont été surveillés par microscopie de fluorescence, rapidement gelés sur les grilles de l’EM et visualisés directement avec la tomographie cryo-électronique haute tension. Comme une première demande, la structure détaillée de l’ADN compacté cellules bactériennes a été visualisé avec succès en 3D. Actuellement, cette procédure est spécifique à ce sujet, mais il sera appliqué de manière plus approfondie, avec une méthode modifiée dans certains cas. Ici, les avantages, les limites et les possibilités futures de cette méthode sont discutées.
Un des avantages de cette méthode est la visualisation 3D de la cellule entière. 1 MV HVEM visualisé avec succès la dynamique compactés de structure des organites subcellulaires dans l’ADN des cellules. Cependant, la structure fine à l’intérieur des cellules normales ne pouvait distinguer en raison du contraste de l’image faible. Augmentation d’inélastiques et diffusions multiples spécimens épais brouille l' image13. Zéro-perte et plus-probable image filtrées par un filtre d’énergie peut améliorer le contraste de l’image en réduisant la diffusion inélastique14,15, mais cela ne fonctionnera pas pour les spécimens plus épais que l’iMFP. Les pics de zéro-perte et plus-probable diminuent considérablement avec l’épaisseur de l’échantillon. Il est particulièrement difficile d’obtenir un rapport signal-bruit suffisant pour les spécimens de glace incorporé sensibles d’électrons. Murata et coll. ont montré que transmission de balayage de 1MV donne de microscopie (tige) plus haut contraste de l’image qu’une image de champ lumineux en plastique intégrée des cellules de levure avec 5 µm d’épaisseur, où le contraste de l’image est principalement donné par contraste amplitude13 . Cependant, il est prévu que l’effet de dégâts de boule de neige sur les électrons accélérés supérieurs crée une autre limitation à la dose d’irradiation pour dommages sensibles cryo-spécimens de16. L’application de Volta et Zernike phase plaques17,18 pour HVEM peut être en mesure de réduire les dégâts de boule de neige en réduisant la dose totale à l’avenir. Une autre limitation à l’utilisation de HVEM pour échantillons épais vient du fait que les installations de l’utilisateur qui fournissent HVEM sont rares dans le monde entier.
En utilisant une autre méthode d’observer des échantillons épais, tomographie cryo-tige à 300 kV a démontré images à contraste élevé sur des échantillons congelés hydratés d’épaisseur supérieure à plusieurs centaines de nanomètres19. Pour récupérer le contraste de phase en cryo-tige, pthychographic la microscopie électronique a également été introduite, dans laquelle la plaque de phase dans la lentille condenseur transpose une diffraction modulés en phase à un pixélisé détecteur 2D20. Les images sont récupérées par des calculs de diffractions multiples. Cryo-imagerie directe et rapide 3D de grande originaire congelés échantillons, cryo-FIB-SEM peut aussi être utilisé21, où série sectionnant avec un faisceau ionique focalisé et bloquer le visage d’imagerie est appliqué pour l’imagerie entièrement hydratés échantillons congelés. Bien que ces technologies élargir le champ de vision de spécimens biologiques, il est difficile de trouver l’emplacement de la cible de la bactérie, étiqueté par ex. bactéries, car la cible est complètement sous la glace et ne peut être identifiée avant de tailler.
Compaction de l’ADN produit une structure distincte chez les cyanobactéries. ADN compacté cellules sont facilement distingués même sans être teinté en raison d’un préjugé de grande densité au sein des cellules qui n’est pas présent dans les cellules normales. Toutefois, afin de visualiser plus d’événements les au sein de la cellule, il est nécessaire de transférer le ROI fluorescent étiqueté dans le microscope électronique. Pour corrélatif microscopie photonique et électronique (CLEM), les images au microscope photonique et au microscope électronique sont généralement corrélés à l’aide des billes de latex fluorescentes ou points quantiques sur EM finder grilles12. Les particules d’étiquetage doivent être de densité électronique élevée en plus de la fluorescence. Ils peuvent avec précision et fiabilité corréler les positions entre les deux images. En outre, en confirmant la zone étiquetée avec la microscopie de cryo-lumière, chevauchement complet de retour sur investissement peut être réalisé entre les deux microscopes. Lors de la caractérisation des événements structurels plus détaillées dans la compaction de l’ADN, ces particules et microscopie de cryo-light sera un outil indispensable pour une corrélation plus robuste et précis à l’avenir.
Cet article montre comment caractériser la structure transitoire de compaction de l’ADN chez les cyanobactéries par une combinaison de culture synchrone, de microscopie par fluorescence et de tomographie cryo-électronique haute tension. Ce protocole met l’accent sur l’observation de l’ADN compacté. En combinant cette méthode avec d’autres nouvelles technologies mentionnées ci-dessus, il sera possible d’étudier le processus de compactage d’ADN plus en détail, et méthodes convenablement modifiées sont largement applicables à d’autres événements structurels dynamiques dans les bactéries.
Déclarations de divulgation
Les auteurs déclarent sans intérêts financiers concurrents.
Remerciements
Les auteurs remercient Tammo Reisewitz pour une lecture critique du manuscrit et les deux Mako Hayashi et Sayuri Hagiwara pour la culture attentive et l’observation des cyanobactéries, Yoshitaka Kimori pour traitement d’image, Chihong Song, Naoyuki Miyazaki et Miyoko Nagayoshi pour aider avec la segmentation des structures. Ce travail a été soutenu par le programme d’étude Collaborative de l’Institut National des Sciences physiologiques (pin) à Y.K.
matériels
| Name | Company | Catalog Number | Comments |
| Hoechst 33342 solution | Dojindo | 346-07951 | 1mg/mL in H2O |
| Agar Powder (for plant culture) | Wako | 016-11875 | |
| Boric acid | Wako | 027-02192 | 99.5% |
| Manganese chloride tetrahydrate | Wako | 139-00722 | 99% |
| Zinc sulfate heptahydrate | Wako | 264-00405 | 99.5% |
| Sodium molybdate | Wako | 196-02472 | 99% |
| Copper sulfate pentahydrate | Wako | 039-04412 | 99.5% |
| Cobalt nitrate hexahydrate | Wako | 031-03752 | 99.5% |
| Sodium nitrate | Wako | 191-02542 | 99% |
| Magnesium sulfate heptahydrate | Wako | 131-00405 | 99.5% |
| Calcium chloride dehydrate | Wako | 031-00435 | 99.5% |
| Citric acid | Wako | 036-05522 | 98% |
| EDTA-2Na | Dojindo | 343-01861 | 99.5% |
| Sodium carbonate | Wako | 197-01581 | 99.8% |
| Potassium phosphate dibasic | Wako | 164-04295 | 99% |
| TES (Good’s buffer) | Dojindo | 344-02653 | 99% |
| Ferric ammonium citrate | Wako | 092-00802 | 1st Grade |
| Sodium thiosulfate pentahydrate | Wako | 197-03585 | 99% |
| BSA gold tracer 15nm | Aurion | 215.133 | |
| Quantifoil EM grid | Quantifoil MicroTools | R3.5/1 Copper grid | |
| Electron films | Kodak | SO-163 | |
| Developer | Kodak | D19 | |
| Fixer | Kodak | Rapid fixer | Solution |
| Filter paper | Whatman | Grade 1 | |
| Growth chamber | NKsystem | LH-100SP | |
| Fluorescent microscope | Nikon | ECLIPSE 50i | |
| High voltage TEM | HItachi | H1250M | |
| Cryo-specimen holder for HVEM | Gatan | ||
| plunge-freezing device | Leica | EM CPC | |
| Plasma Ion bombarder | Vacuum device | PIB-10 | |
| Liquid nitrogen storage | Taylor-Wharton | 25LDB | |
| Developing tank | Dosaka EM | TB-3-75 | |
| flatbed scanner | Nikon | Coolscan 9000ED | |
| Segmentation software | FEI | Amira | https://www.fei.com/software/amira |
| Tomographic Reconstruction software | eTOMO | http://bio3d.colorado.edu/imod |
Références
- Smith, R. M., Williams, S. B. Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus. Proc. Nat. Acad. Sci. USA. 103 (22), 8564-8569 (2006).
- Kondo, T. A cyanobacterial circadian clock based on the kai oscillator. CSHS Quant. Biol. 72, 47-55 (2007).
- Seki, Y., Nitta, K., Kaneko, Y. Observation of polyphosphate bodies and DNA during the cell division cycle of Synechococcus elongatus PCC 7942. Plant biol. 16 (1), Stuttgart, Germany. 258-263 (2014).
- Murata, K., Hagiwara, S., Kimori, Y., Kaneko, Y. Ultrastructure of compacted DNA in cyanobacteria by high-voltage cryo-electron tomography. Sci. Rep. 6, 34934(2016).
- Koster, A. J., et al. Perspectives of molecular and cellular electron tomography. J. struct. boil. 120 (3), 276-308 (1997).
- Lučić, V., Rigort, A., Baumeister, W. Cryo-electron tomography: The challenge of doing structural biology in situ. J. Cell Biol. 202 (3), 407-419 (2013).
- Murata, K., et al. Visualizing Adsorption of Cyanophage P-SSP7 onto Marine Prochlorococcus. Sci. Rep. 7, 44176(2017).
- Rippka, R., Deruelles, J., Waterbury, J. B., Herdman, M., Stanier, R. Y. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. J. Gen. Microbiol. 111, 1-61 (1979).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J. struct. boil. 116, 71-76 (1996).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. J. Struct. Biol. 144, 114-122 (2003).
- Kimori, Y. Morphological image processing for quantitative shape analysis of biomedical structures: effective contrast enhancement. J. Sync. Rad. 20, 848-853 (2013).
- Jun, S., Zhao, G., Ning, J., Ga Gibson,, Watkins, S. C., Zhang, P. Correlative microscopy for 3D structural analysis of dynamic interactions. J. Visual. Exper. 76, e50386(2013).
- Murata, K., Esaki, M., Ogura, T., Arai, S., Yamamoto, Y., Tanaka, N. Whole-cell imaging of the budding yeast Saccharomyces cerevisiae by high-voltage scanning transmission electron tomography. Ultramicros. 146, 39-45 (2014).
- Kortje, K. H., Paulus, U., Ibsch, M., Rahmann, H. Imaging of thick sections of nervous tissue with energy-filtering transmission electron microscopy. J. Microsc. 183, 89-101 (1996).
- Bouwer, J. C., et al. Automated most-probable loss tomography of thick selectively stained biological specimens with quantitative measurement of resolution improvement. J. Struct. Biol. 148 (3), 297-306 (2004).
- Egerton, R. F., Li, P., Malac, M. Radiation damage in the TEM and SEM. Micron. 35 (6), 399-409 (2004).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proc. Nat. Acad. Sci. USA. 111 (44), 15635-15640 (2014).
- Murata, K., et al. Zernike phase contrast cryo-electron microscopy and tomography for structure determination at nanometer and subnanometer resolutions. Structure. 18 (8), 903-912 (2010).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of biological cells. Nat. Methods. 11 (4), 423-428 (2014).
- Ophus, C., et al. Efficient linear phase contrast in scanning transmission electron microscopy with matched illumination and detector interferometry. Nat. Comm. 7, 1-7 (2016).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. J. Struct. Biol. 184 (2), 355-360 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon