Method Article
Siyanobakteriler yüksek gerilim Cryo-elektron tomografi tarafından DNA sıkıştırma görselleştirme
Bu Makalede
Özet
Bu iletişim kuralı, siyanobakteriler geçici DNA sıkıştırma görselleştirmek açıklar. Zaman uyumlu ekimi, floresans mikroskobu, Hızlı dondurma ve yüksek tarafından izleme gerilim cryo-elektron tomografi kullanılır. Bu metodolojileri için bir protokol sundu ve gelecekteki uygulamalar ve gelişmeler ele alınmıştır.
Özet
Bu iletişim kuralı, siyanobakteriler geçici DNA sıkıştırma görselleştirmek açıklar. DNA sıkıştırma son zamanlarda bazı Siyanobakteriler hücre bölünmesi önce gerçekleşmesi için bulundu dramatik sitoplazmik olaydır. Ancak, büyük hücre boyutu ve geçici karakteri nedeniyle yapısı ayrıntılı araştırmak zordur. Zorlukları aşmak için ilk olarak, DNA sıkıştırma tekrarlanarak cyanobacterium Synechococcus elongatus PCC 7942 12 h her ışık/karanlık döngüsü kullanılarak zaman uyumlu kültür tarafından üretilmektedir. İkinci olarak, DNA sıkıştırma floresans mikroskobu tarafından izlenen ve hızlı donma tarafından ele geçirdi. Üçüncü olarak, hücre DNA'ın ayrıntılı yapısı sıkıştırılmış yüksek gerilim cryo-elektron tomografi tarafından üç boyutlu (3D) olarak görüntülenir. Bu yöntemler bakteri, Örneğin hücre bölünmesi, kromozom segregasyon, fajının enfeksiyon vbgeçici yapılarını araştırmak için yaygın olarak uygulanabilir ayarlanır., hangi floresans mikroskobu tarafından izlenen ve doğrudan tarafından görüntülenmiştir Cryo-elektron tomografi uygun zaman noktalarda.
Giriş
DNA sıkıştırma bazı Siyanobakteriler olduğu belirlendi dramatik bir sitoplazmik olaydır. Ne zaman Synechococcus elongatus altında 12 h her ışık/karanlık döngüsü, görünümü diğer zaman açıkça farklı ışık süresi kısaltılmış göründü DNA kültürlü1puan. Bu işlem tarafından Kai proteinler2dayalı bir sirkadiyen saat denetlenir sürülmüştür. Seki ve ark. Höchst 33342 ile lekeli DNA ışık döneminin sonuna doğru S. elongatus hücrelerdeki sıkıştırılmış ve floresan mikroskop altında dalgalı bir çubuk şekli gösterdi bildirdin. Sıkıştırılmış DNA sonra çubuk ortasındaki ikiye bölünmüş ve nihayet her kızı hücre3normal tekdüze dağılım için döndürülen hücre olarak ayrılmış. Ancak, onun geçici doğası ve büyüklüğü elektron mikroskopi için yapısal analizi engellemiştir. Murata vd. kombine zaman uyumlu kültür, floresans mikroskobu, Hızlı dondurma ve yüksek de dahil olmak üzere çeşitli yöntemler gerilim elektron cryo-tomografi (cryo-HVET) ve geçici DNA sıkıştırma, yapısını belirlenmesinde başarılı oldu polifosfat organları (PPBs)4kinetik dahil olmak üzere. El yazması deneysel prosedürler birleştirerek görsel zor bir malzeme ayrıntılı açıklamasını sağlar.
S. elongatus kapsül bir şekli vardır, canlı hücreler çok kısa bir süre için sadece 2-5 µm, 0.5 µm hakkında bir genişliği ve mükemmel DNA sıkıştırma uzunluğu görünür. Bu nedenle, siyanobakteriyel DNA sıkıştırma içinde meydana gelen yapısal değişiklikler ayrıntılı olarak bilinmiyordu. Bu yapıların elektron mikroskobu tarafından araştırmak için iki ana teknik sorunların üstesinden gelmek gereklidir. Bir yerel koşullar yakınındaki bakteri bütün kalın bir örnek gözlem ve diğer dinamik bir yapısı hızlı fiksasyonu. İlk sorun gelince, esnek olmayan ortalama özgür keçiyolu (iMFP) elektron elektron mikroskobu5hızlanan voltajı bağlıdır. 300 transmisyon elektron mikroskobu (TEM) içinde kV, sanki daha az 350 nm. Örneğin, bir buz gömülü cyanobacterium zaman (numune kalınlığı ≈ 600 nm) 200kV TEM görülmektedir (iMFP ≈ 250 nm), hücre içindeki yapıları gözlemlemek zordur. Buna karşılık, 1 MV TEM (iMFP ≈ 500 nm) vermek ve görüntü hücre (Şekil 1) boyunca sitoplazmik yapısının. Bu iletişim kuralı ' belgili tanımlık eriyik, 1 hızlanan bir gerilim, bir yüksek gerilim elektron mikroskobu (HVEM) bir parçası olarak MV istihdam. Ancak, HVEM uygulamak İmkanlar dünya çapında sınırlıdır. Olası alternatif çözümler de tartışma bölümde ele alınmıştır. İkinci sorun cryo-elektron mikroskobu (cryo-EM) tarafından çözüldü. Bu dinamik yapılar yerel koşullar, nerede örnek sıvı etan hızlı dondurucu cihaz kullanarak hızla dondurulur ve donmuş an doğrudan değişiklikler6minimum görülmektedir yakınındaki görüntülenmesi için güçlü bir araçtır. Tomografi ile birleştirerek, üç boyutlu (3D) yapıları bir anlık görüntü tilt serisi7' den yeniden olabilir. Bu deneyde, DNA sıkıştırma zaman uyumlu kültür altında 12 h her açık/koyu döngüsü kullanarak elongatus S. yeniden oluşturulmalı ve numune dondurulması zamanlaması floresan mikroskop altında izleyerek tespit edildi.
Burada açıklanan yaklaşım yaygın olarak bakteri hücreleri, Örneğin hücre bölünmesi, kromozom segregasyon ve faj enfeksiyon dinamik yapıları incelenmesi için geçerlidir ve mikrobiyolojik araştırmada yeni yollar açmak için bir potansiyele sahiptir.
Protokol
1. zaman uyumlu Siyanobakteriler kültürünün
- S. elongatus PCC 7942 %1,5 (w/v) agar ve %0,3 (w/v) sodyum thiosulfate8içeren steril BG 11 plaka (içinde 9 cm steril plastik petri kabına) üzerinde kültür.
- Tabakları bir büyüme Odası 23 ° c ile 50 µE/m2/s ve 12 h ışık/12 s karanlık döngüleri tabi bir ışık şiddeti yerleştirin.
- Hücreleri üzerine taze BG11 ağar kaplamalar haftada bir kez transfer.
Not: Kültürler agar üzerinde yeşil şeritler halinde görünür bu kültür koşul altında bir hafta sonra aktif Proliferasyona hücreleri. - Yeşil kümeleri bir alev sterilize tel döngü ve çizgi içeren hücrelerin hücre bir taze BG11 agar plaka üzerine al. Temiz bir bankta bunu.
2. izleme tarafından floresans mikroskobu
- 6 gün agar tabakta kültürlü hücreleri DNA sıkıştırma gözlemlemek için kullanın. Hücreleri plaka ışık dönemin sonunda hücrenin üzerine dökülen 1 mL tarafından 0.2 M Sükroz çözeltisi toplamak. Böylece hücrelerin çoğu toplanan çözüm hücreleri dökülen yineleyin. Askıya-hücre çözümü DNA boyama için mikro bir tüp içine aktarın.
- DNA 500 µL askıya alınan hücre çözüm 1 µg/ml nihai bir konsantrasyon için mikro bir tüp boya (Örneğin Höchst 33342) çözüm boyama ekleyin. Daha sonra tüp 10 min için karanlıkta tutmak.
- 2.000 x g tortu için de 1 dk. için hücreleri santrifüj kapasitesi. Süpernatant atmak ve bir yoğun hücre süspansiyon elde etmek için 0.2 M Sükroz çözüm 10 µL ekleyin.
- Bir slayt cam için lekeli hücreleri içeren çözüm 1 µL transfer için bir kapak kayma koymak ve 100 X ve daldırma yağ bir büyütme ile bir objektif lens kullanarak UV filtre ile donatılmış bir floresan mikroskop ile gözlemlemek.
- DNA sıkıştırma en hücreleri bu noktasında görülmektedir onaylayın, sonra örnek dondurucu adım için hazır olun.
3. örnek Cryo-HVET için dondurma
- Dalma-donma aygıtı ayarlama. Sıvı azot ile tank doldurmak ve cryo-odası soğutma tankı ve odası ile bir Teflon tüp bağlandıktan sonra başlar.
- Sıvı azot sıcaklık odasına aşağı soğutma sonra odanın içinde bir küçük bakır pota sıvı etan doldurun. Sıvı etan patlayıcı olduğu için işlem sırasında gözlük.
- Kızdırma boşaltma delikli bir karbon kaplı icin karbon tarafında kılavuz (delikli ızgara) 30 s 50 plazma iyon bombarder kullanarak anne.
- 1 µL BSA altın izleme uygulamak (15 nm) delikli ızgarasına indirgeme bir işaretleyici olarak.
- 2.5 µL aliquot hücrelerinin DNA düzenleme aşamasında delikli ızgarasına uygulanır. Bir filtre kağıdı fazlalık çözümüyle kapalı leke. Kılavuz kullanarak bir dalgıç dalma dondurucu cihaz hemen sıvı etan Dalma.
- Onlar incelenir kadar donmuş ızgaralar sıvı azot depoda saklamak.
4. Cryo-HVET
- 1 yüksek gerilim, HVEM kurmak MV.
- Cryo-numune tutucu-150 ° c cryo-iş istasyonu içinde sıvı azot ile precooled HVEM için dondurulmuş kılavuzunda mount ve HVEM yükleyin. Buz tarafından kirlenmesini önlemek için dikkatli olun.
- 1, daha düşük büyütmede görüntüleme alanı seçme 000 X. Eucentric z ekseni yüksekliğini ayarla.
- Örneği Sahne Alanı'na-60 ° eğim ve tepki devirme dönme kaldırın.
- Bir büyütme 10, hedef konumda yakın odak ayarlamak 000 X. Ayarla bir 6-10 µm odaklı görüntü sapma tarafından odak noktası altında. Görüntüleme için doz 2 e-/Å-2 için ayarla veya önceden numune üzerinde daha az.
- HVEM görüntü ekranda akım yoğunluğu tarafından elektron doz ölçmek. Fotoðraf bir elektron film veya dijital kamera odaklama işleminin olduğu gibi aynı büyütmede tarafından.
- Tilt görüntüleri el ile (4.5) olduğu gibi aynı yordam tarafından-60 ° ila + 60 ° 2 ° ila 4 ° tilt açı artışı, toplamak.
Not: içinde birçok modern elektron mikroskoplar, tilt serisi edinimi bir dijital fotoğraf makinesi kombinasyonu tarafından otomatikleştirilmiştir. Bu durumda, kullanım kılavuzu izleyin. Negatif ince tabaka için için bir su tankında tam güçte geliştirici kullanarak Geliştirici 20 ° C'de 12 dk filmler geliştirmek ve düzeltmek bir fixer 10 dk. dijital ortama için 4000 dpi (0.635 nm/piksel görüntü üzerinde) bir çözünürlükte filmler düz yataklı tarayıcı kullanarak. Bir dijital fotoğraf makinesi söz konusu olduğunda toplanan görüntüleri doğrudan sonraki görüntü işleme adımının için tabi. Gerekirse, iki ila dört binning (boyutu azaltma faktörü) ve ilgili yazılım (Örneğin ImageJ) kullanarak bir Medyan filtresi tarafından görüntü boyutunu azaltmak.
5. tomografik imar
- Komut "tif2mrc" veya "newstack" but yazılım9' kullanarak görüntüleri eğimli bir yığın görüntü dosyasından tek tek yapmak.
- BUT içinde eTomo GUI yazılım başlatın ve görüntü parametreleri ayarlayın: piksel boyutunu, indirgeme çapı, görüntü döndürme, vb. Daha sonra komut dosyaları oluşturun.
- Malzemeler, tablolarda listelenen yazılımlar göre bireysel programları çalıştırmak nerede tilt serisi (bir ortalama artık hata ile 0.5 daha az) indirgeme işaretçileri kullanarak hizalanır. Son olarak, but içinde SIRT algoritmasıyla bir 3D tomogram yeniden.
- Faiz (ROI) bölgesinin tomogram ayıklamak ve denoise filtre kullanarak denoise: bir anizotropik difüzyon but, EMAN10ikili bir filtre veya matematiksel bir morfoloji filtre11, vb, uygun parametrelerle birlikte karşıtlığı artırmak için.
6. ayrılmasını faiz özelliği
Not: aşağıda açıklanan yordamı yazılım kullanılan (bkz: Malzemeler tablo) özgüdür ancak diğer yazılım paketleri yerine kullanılabilir. Onların Kullanıcı kılavuzuna başvurun.
- 3B görüntüleyici penceresinde Amira yazılım tomogram dosyasını açın ve bir OrthoSlice oluşturmak.
- Segmentasyon Düzenleyicisi penceresinde, yeni bir "etiket alan" seçerek bir bölümleme dosyası oluşturun.
- El ile ilgi (FOI) özelliğinin kenarlığı izleyin. Bütün tomogram dilimleri ile FOI izleyin. İkinci FOI için yeni bir "malzeme" oluşturmak ve aynı işlemi yineleyin.
- "SurfaceGen" menüsünden seçerek bir yüzey işleme oluşturmak. Kesimli birimin görselleştirmek için "SurfaceView" menü. Taşımak, döndürmek ve 3B cilt yakınlaştırmak için 3D Görüntüleyici penceresinde araçları kullanın.
- Otomatik bölümleme için Sihirli Değnek aracını kullanın. Bir nesne üzerinde tıklatın ve görüntü ve maskeleme böylece tam özellikleri tarafından seçilen değer aralığını kapsayacak şekilde kaydırıcıları ayarlayın.
Sonuçlar
Küçük 12 h her açık/koyu döngüsü bir kesin zaman uyumlu kültürde Höchst ile etiketli DNA karanlık durumda (Şekil 2a) normal tekdüze dağılım gösterir. Ancak, bu kademeli hücre içinde ışık döneminde düzenler ve ışık dönemin sonunda bir dalgalı çubuk benzeri yapı (Şekil 2b) olarak görünür. Son olarak, Merkezi ( Şekil 2c oklar) çubuk böler ve onun iki bölümden kızı hücreleri (Şekil 2B) dağıtılır. Hücre bölünmesi sonra sıkıştırılmış DNA hemen kaybolur ve DNA için normal bir üniforma dağılımı verir.
Ne zaman bir aliquot hücreleri DNA sıkıştırma son aşamasında içeren hücre hemen transfer delikli bir ızgara üzerine ve hızlı donmuş sıvı etan ve donmuş kılavuz 1 MV cryo-HVEM, siyanobakteriler dahil olmak üzere iç yapıları tarafından gözlenmiştir DNA, thylakoid membran katmanları, hücre duvarları ve PPBs, olduğu gibi bir anlık görüntü (Şekil 3a) dondurma anda ortaya çıktı. Birçok hücreler hücreleri ( Şekil 3a' beyaz ok) farklı DNA sıkıştırma gösterdi ve normal hücreleri ( Şekil 3biçinde beyaz ok uçları) kolayca ayırt edici olabilir. Bazı hücrelerin ortasındaki bir daralma önce hücre bölünmesi ( Şekil 3a' sarı ok) beklendiği gibi sergiledi.
3D tomograms içinde büyük organellerin hücre bölümlenmiş; hücre duvarı, thylakoid membran katmanları, DNA ve PPBs olabilir (Şekil 4) ayırt. Özellikle, sıkıştırılmış DNA nerede DNA düşük yoğunluklu malzeme ile çevrili ve thylakoid membran katmanlar düzenlenen DNA'ın çubuk dalgalı bozuk sitoplazma içinde ayrı bir boşluk ayrılmış. PPBs dinamik davranışı yeni gözlenen: DNA'sı hücreleri, sıkıştırılmış ise büyük birçok küçük PPBs DNA için uygun görüldü ve normal hücrelere daha az. Buna ek olarak, çoğu PPBs çiftleri olarak ortaya çıktı ve bazı DNA PPBs ayrılması bir süreçte olduğu ortaya çıktı. Bu PPBs kendilerini iki DNA ikilenmesi ve işlevi tarafından fosfat DNA sentezi için tedarikçileri olarak ayrılır olduğunu ileri sürdü.
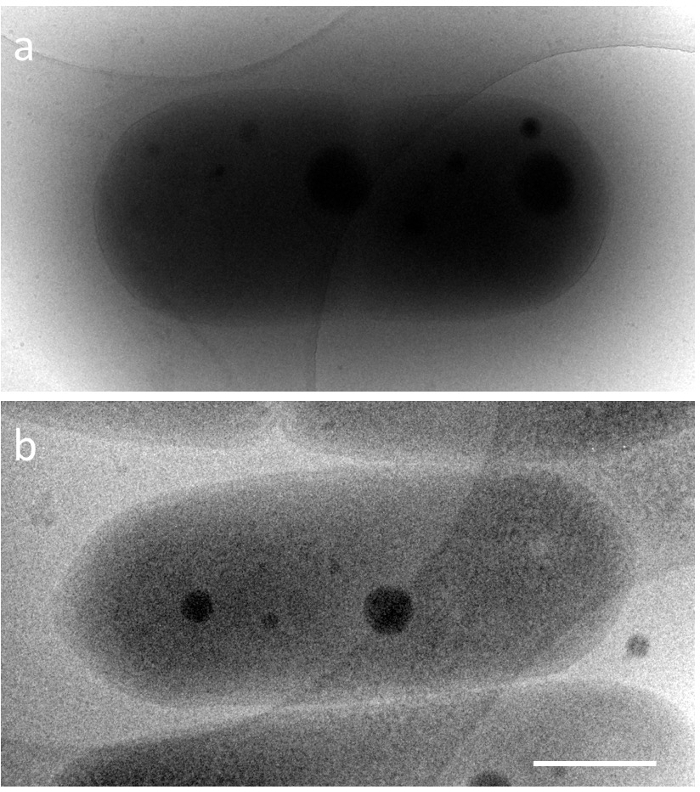
Şekil 1. Cryo-EM görüntülerini normal Siyanobakteriler, S. elongatus PCC 7942 farklı hızlanan gerilimleri, buz gömülü. a) 200kV ve b) 1000kV. Ölçek çubuğu = 500 nm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
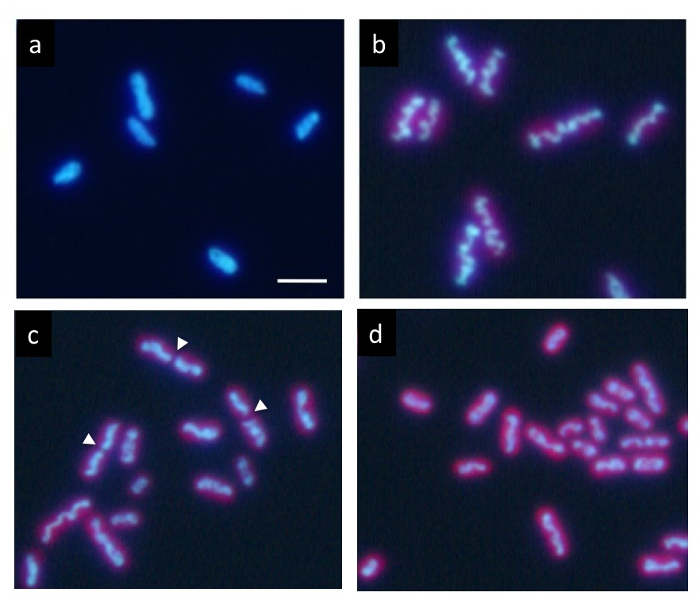
Resim 2: Floresan mikroskopi cyanobacterium S. elongatus hücre. Her açık/koyu altında 12 saat döngüleri zaman uyumlu kültür sonra hücreleri Höchst 33342 ile lekeli. (a) hücreleri koyu devlet başlangıcı 2 h sonra tek tip DNA etiketleme gösterir. Birçok hücrelerdeki DNA yavaş yavaş ışık döneminde yoğunlaşmak. Sonuçta bir kalın dalgalı çubuk (b) DNA sıkıştırmak tipik kurdu. Bu aşamadan sonra hızlı bir şekilde kendi merkezlerinde (ok uçları) bölünmüş hücre bölünmesi (c) ve iki parça sırasında sıkıştırılmış DNA yapıları ayrılmış kızı hücreleri (d). Kızı hücreleri tek tip DNA karanlık dönemde tekrar etiketleme için döndürdü. Ölçek çubuğu 2 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
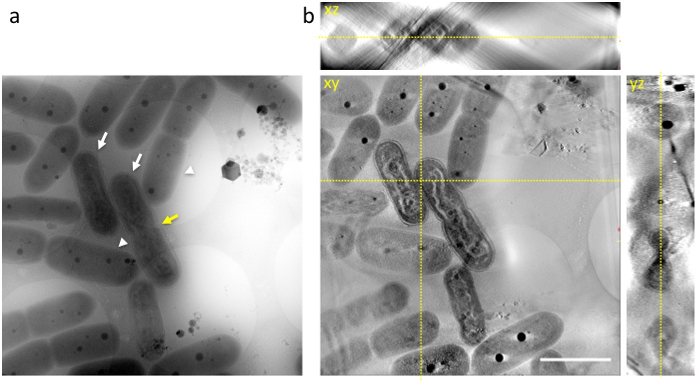
Şekil 3: Siyanobakteriler görüntüsünü Cryo-HVEM gömülü amorf buz (a) bir raw resim 0 ° tilt olarak gösterir. Görüntüleri ışık dönemin sonunda alındı. Bazı hücreleri dalgalı çubuk şekilli DNA organları benzer ökaryotik yoğun kromozomlar (beyaz ok) gösterir. Normal hücrelerde, siyanobakteriler discernable DNA yapısı içinde sitoplazma (beyaz ok uçları) sergi. Bazı hücrelerin hücre bölünmesi (sarı ok) önce beklendiği gibi merkezi bir daralma sergi. (b) xy, xz, yz-3D tomogram dilim. Sarı noktalı çizgiler kavşak dilimleri göster. Ölçek çubuğu 2 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
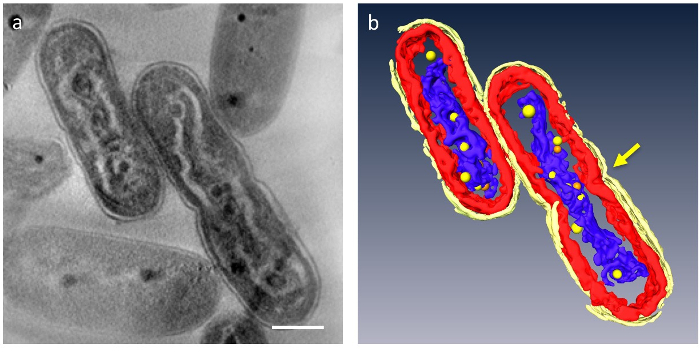
Şekil 4: Ultrastructure hücre içeren sıkıştırılmış DNA'sı. Ana bileşenleri parçalara: hücre duvarı (parlak sarı), thylakoid membranlar (kırmızı) ve DNA (mavi). (a) 3D tomogram dilim z gösterir. (b) tüm kesimleri. Hücre ayrılık gösteren daralma hücre (ok) ortasında görünür. PPBs sarı veya turuncu küreler modellenmiştir; turuncu her alanda en yakın sarı küre muadili temsil eder. Ölçek çubuğu = 500 nm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Biz bir sıra geçici DNA sıkıştırma Siyanobakteriler içinde görüntülenmesi için iletişim kurallarının sundu. Temel kavram bağdaşık ışık ve elektron mikroskobu (CLEM)12benzemektedir. Buna ek olarak, bu yöntemde, canlı Siyanobakteriler floresans mikroskobu tarafından izlenen, hızla EM ızgaralar donmuş ve doğrudan yüksek gerilim cryo-elektron tomografi ile görüntülenir. İlk uygulama, DNA'ın ayrıntılı yapısı bakteri hücreleri sıkıştırılmış gibi başarılı bir şekilde 3D görselleştirildiği. Şu anda, bu konuya özel bir işlemdir ama daha kapsamlı, bazı durumlarda değiştirilmiş metodolojisi ile uygulanacaktır. Burada, avantajları, sınırlamaları ve bu yöntemi gelecekteki olanakları ele alınmıştır.
Bu yöntemin avantajları, biri bütün hücre 3D görselleştirme. 1 MV HVEM başarıyla görüntülenir Dinamik DNA hücre altı organelleri yapısını sıkıştırılmış hücreleri. Ancak, normal hücrelere ince yapısı nedeniyle düşük görüntü kontrastı ayırt edilebilir değil. Esnek olmayan artan ve kalın numuneler birden çok saçılma bulanıklaştırır görüntü13. Sıfır-kaybı ve en olası kaybı görüntü bir enerji filtresi yoluyla filtre elastik saçılma14,15azaltarak görüntü kontrastı artırabilir ama numuneler iMFP kalın için çalışmaz. Sıfır-kaybı ve en olası kaybı doruklarına numune kalınlığı ile büyük ölçüde azaltır. Elektron hassas buz gömülü numuneler için yeterli bir sinyal-gürültü oranı elde etmek özellikle zordur. Murata vd göstermiştir bu 1MV tarama iletim plastik parlak alan görüntüde daha yüksek görüntü kontrastı Maya hücreleri 5 µm kalınlık ile gömülü mikroskobu (kök) verir nerede görüntü kontrastı öncelikle genlik kontrast13 tarafından verilir . Ancak, daha yüksek hızlandırılmış elektron Knock hasar etkisi zarar duyarlı cryo-numune16için ışınlama doz için başka bir sınırlama oluşturur bekleniyor. Faz plaka17,18 Volta ve Frits kullanma HVEM için toplam doz gelecekte azaltarak Knock zarar azaltmak mümkün olabilir. HVEM için kalın örnekler kullanarak başka bir sınırlama HVEM sağlamak Kullanıcı Özellikleri dünya çapında kıt olduğu gerçeği gelir.
Kalın numuneler, cryo-kök tomografi vasıl 300 gözlemlemek için alternatif bir yöntem kullanarak kV yüksek kontrastlı görüntüler dondurulmuş-sulu numuneler üzerinde birkaç yüz nanometre19aşan kalınlı¤ında göstermiştir. Cryo-kök faz kontrast almak için elektron pthychographic mikroskobu Ayrıca, faz plaka kondansatör objektif bir faz modülasyonlu kırınım pixelated 2D dedektörü20transposes girmiştir. Görüntüleri birden çok diffractions hesaplamadan tarafından alınır. Doğrudan ve hızlı 3D cryo-görüntüleme büyük yerli cryo-yalan-SEM örnekleri, donmuş Ayrıca kullanılan21, seri nerede ile odaklı iyon kiriş kesit ve yüz görüntüleme engellemek için görüntüleme tamamen donmuş numuneler sulu için uygulanır. Bu teknolojiler Biyolojik örneklerin görüş yelpazesini genişletmek, bakteri, hedef konumunu bulmak zor olsa da Örneğin etiketli bakteri, çünkü hedef tamamen buz altında ve kırpma önce tanımlanamıyor.
DNA sıkıştırma Siyanobakteriler farklı bir yapıda üretir. DNA sıkıştırılmış hücreleri bile normal hücrelerde mevcut değil bir büyük yoğunluk önyargı hücrelerindeki nedeniyle lekeli olmadan kolayca ayırt edilirler. Ancak, hücre içinde daha fazla yerel etkinlikler görselleştirmek için fluorescently etiketli ROI elektron mikroskobu aktarmak gereklidir. Bağdaşık ışık ve elektron mikroskobu (CLEM) için ışık mikroskobu görüntüler ve elektron mikroskobu görüntüleri genellikle EM Bulucu ızgaralar12tarihinde floresan lateks boncuk veya kuantum nokta kullanarak correlated. Etiketleme parçacıklar yüksek elektron yoğunluğu floresans yanı sıra olması gerekir. Doğru ve güvenilir bir şekilde iki görüntü arasında pozisyonlar ilişkilendirmek. Ayrıca, etiketli alanı cryo-ışık mikroskobu ile teyit ederek, Roi tam örtüşme arasında iki mikroskoplar elde edilebilir. Bu parçacıklar ve cryo-ışık mikroskobu DNA sıkıştırma daha ayrıntılı yapısal olaylar karakterize, daha sağlam ve doğru bir ilişki içinde belgili tanımlık gelecek için vazgeçilmez bir araç olacaktır.
Bu makalede, siyanobakteriler DNA sıkıştırma geçici yapısını zaman uyumlu kültür, floresans mikroskobu ve yüksek gerilim cryo-elektron tomografi birleşimiyle karakterize gösterilmiştir. Bu iletişim kuralı sıkıştırılmış DNA gözlem üzerinde duruluyor. Bu yöntem yukarıda bahsedilen diğer yeni teknolojilerle birleştirildiğinde, bu DNA sıkıştırma daha ayrıntılı süreci araştırmak mümkün ve uygun değiştirilmiş yöntemleri yaygın olarak bakteri diğer dinamik yapısal olaylara tabidir.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının bildirin.
Teşekkürler
Yazarlar Tammo Reisewitz el yazması ve hem Mako Hayashi ve Sayuri Hagiwara dikkatli ekimi için eleştirel okuma ve Siyanobakteriler, görüntü işleme için Yoshitaka Kimori, Chihong şarkı, Naoyuki Miyazaki ve Miyoko gözlem için teşekkür ederiz Nagayoşi yapıları bölümleme ile yardım ettiğin için. Bu eser için Fizyolojik Bilimler (NIPS) Y.K. için ulusal Enstitü ortak çalışma programı tarafından desteklenen
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hoechst 33342 solution | Dojindo | 346-07951 | 1mg/mL in H2O |
| Agar Powder (for plant culture) | Wako | 016-11875 | |
| Boric acid | Wako | 027-02192 | 99.5% |
| Manganese chloride tetrahydrate | Wako | 139-00722 | 99% |
| Zinc sulfate heptahydrate | Wako | 264-00405 | 99.5% |
| Sodium molybdate | Wako | 196-02472 | 99% |
| Copper sulfate pentahydrate | Wako | 039-04412 | 99.5% |
| Cobalt nitrate hexahydrate | Wako | 031-03752 | 99.5% |
| Sodium nitrate | Wako | 191-02542 | 99% |
| Magnesium sulfate heptahydrate | Wako | 131-00405 | 99.5% |
| Calcium chloride dehydrate | Wako | 031-00435 | 99.5% |
| Citric acid | Wako | 036-05522 | 98% |
| EDTA-2Na | Dojindo | 343-01861 | 99.5% |
| Sodium carbonate | Wako | 197-01581 | 99.8% |
| Potassium phosphate dibasic | Wako | 164-04295 | 99% |
| TES (Good’s buffer) | Dojindo | 344-02653 | 99% |
| Ferric ammonium citrate | Wako | 092-00802 | 1st Grade |
| Sodium thiosulfate pentahydrate | Wako | 197-03585 | 99% |
| BSA gold tracer 15nm | Aurion | 215.133 | |
| Quantifoil EM grid | Quantifoil MicroTools | R3.5/1 Copper grid | |
| Electron films | Kodak | SO-163 | |
| Developer | Kodak | D19 | |
| Fixer | Kodak | Rapid fixer | Solution |
| Filter paper | Whatman | Grade 1 | |
| Growth chamber | NKsystem | LH-100SP | |
| Fluorescent microscope | Nikon | ECLIPSE 50i | |
| High voltage TEM | HItachi | H1250M | |
| Cryo-specimen holder for HVEM | Gatan | ||
| plunge-freezing device | Leica | EM CPC | |
| Plasma Ion bombarder | Vacuum device | PIB-10 | |
| Liquid nitrogen storage | Taylor-Wharton | 25LDB | |
| Developing tank | Dosaka EM | TB-3-75 | |
| flatbed scanner | Nikon | Coolscan 9000ED | |
| Segmentation software | FEI | Amira | https://www.fei.com/software/amira |
| Tomographic Reconstruction software | eTOMO | http://bio3d.colorado.edu/imod |
Referanslar
- Smith, R. M., Williams, S. B. Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus. Proc. Nat. Acad. Sci. USA. 103 (22), 8564-8569 (2006).
- Kondo, T. A cyanobacterial circadian clock based on the kai oscillator. CSHS Quant. Biol. 72, 47-55 (2007).
- Seki, Y., Nitta, K., Kaneko, Y. Observation of polyphosphate bodies and DNA during the cell division cycle of Synechococcus elongatus PCC 7942. Plant biol. 16 (1), Stuttgart, Germany. 258-263 (2014).
- Murata, K., Hagiwara, S., Kimori, Y., Kaneko, Y. Ultrastructure of compacted DNA in cyanobacteria by high-voltage cryo-electron tomography. Sci. Rep. 6, 34934(2016).
- Koster, A. J., et al. Perspectives of molecular and cellular electron tomography. J. struct. boil. 120 (3), 276-308 (1997).
- Lučić, V., Rigort, A., Baumeister, W. Cryo-electron tomography: The challenge of doing structural biology in situ. J. Cell Biol. 202 (3), 407-419 (2013).
- Murata, K., et al. Visualizing Adsorption of Cyanophage P-SSP7 onto Marine Prochlorococcus. Sci. Rep. 7, 44176(2017).
- Rippka, R., Deruelles, J., Waterbury, J. B., Herdman, M., Stanier, R. Y. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. J. Gen. Microbiol. 111, 1-61 (1979).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J. struct. boil. 116, 71-76 (1996).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. J. Struct. Biol. 144, 114-122 (2003).
- Kimori, Y. Morphological image processing for quantitative shape analysis of biomedical structures: effective contrast enhancement. J. Sync. Rad. 20, 848-853 (2013).
- Jun, S., Zhao, G., Ning, J., Ga Gibson,, Watkins, S. C., Zhang, P. Correlative microscopy for 3D structural analysis of dynamic interactions. J. Visual. Exper. 76, e50386(2013).
- Murata, K., Esaki, M., Ogura, T., Arai, S., Yamamoto, Y., Tanaka, N. Whole-cell imaging of the budding yeast Saccharomyces cerevisiae by high-voltage scanning transmission electron tomography. Ultramicros. 146, 39-45 (2014).
- Kortje, K. H., Paulus, U., Ibsch, M., Rahmann, H. Imaging of thick sections of nervous tissue with energy-filtering transmission electron microscopy. J. Microsc. 183, 89-101 (1996).
- Bouwer, J. C., et al. Automated most-probable loss tomography of thick selectively stained biological specimens with quantitative measurement of resolution improvement. J. Struct. Biol. 148 (3), 297-306 (2004).
- Egerton, R. F., Li, P., Malac, M. Radiation damage in the TEM and SEM. Micron. 35 (6), 399-409 (2004).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proc. Nat. Acad. Sci. USA. 111 (44), 15635-15640 (2014).
- Murata, K., et al. Zernike phase contrast cryo-electron microscopy and tomography for structure determination at nanometer and subnanometer resolutions. Structure. 18 (8), 903-912 (2010).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of biological cells. Nat. Methods. 11 (4), 423-428 (2014).
- Ophus, C., et al. Efficient linear phase contrast in scanning transmission electron microscopy with matched illumination and detector interferometry. Nat. Comm. 7, 1-7 (2016).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. J. Struct. Biol. 184 (2), 355-360 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır