Method Article
Caracterización de células inmunes en el tejido adiposo humano mediante el uso de citometría de flujo
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo describe un método para analizar el contenido de la célula inmune del tejido adiposo por el aislamiento de las células inmunes del tejido adiposo y posterior análisis mediante citometría de flujo.
Resumen
Infiltración de células inmunes en el tejido adiposo subcutáneo y visceral (a) depósitos conduce a una inflamación de bajo grada que contribuye al desarrollo de complicaciones asociadas a la obesidad como diabetes tipo 2. Cuantitativa y cualitativamente investigar los subconjuntos de células inmunes en humanos en los depósitos, hemos desarrollado un método de citometría de flujo. La fracción vascular estromal (SVF), que contiene las células inmunes, se aísla de la subcutánea y visceral en biopsias por digestión de colagenasa. Adipocitos se eliminan después de la centrifugación. Se tiñen las células SVF para múltiples marcadores de membrana-limite seleccionado para distinguir entre subconjuntos de células inmunitarias y analizaron mediante citometría de flujo. Como resultado de este enfoque, pro - y antiinflamatoria macrófago subconjuntos, las células dendríticas (DCs), células B, CD4+ y CD8+ células T y células NK pueden ser detectadas y cuantificadas. Este método da información detallada sobre las células inmunes en el AT y la cantidad de cada subconjunto específico. Puesto que existen numerosos anticuerpos fluorescentes, nuestro enfoque de citometría de flujo puede ajustarse para medir varios otros marcadores celulares e intracelulares de interés.
Introducción
Obesidad se caracteriza con en bajo grado inflamación1 y la infiltración de células inmunes inflamatorias en visceral y subcutáneo en (IVA, sAT). Acumulación de células inflamatorias inmunes en el IVA provoca resistencia a la insulina que es el principal factor de riesgo para desarrollar diabetes 2 de tipo2. Las células inmunes del sistema inmune innato y adaptativo se encuentran en la en obesa, como macrófagos, mastocitos, neutrófilos, CD4+ y CD8+ las células T y células B3,4,5,6 ,7. Estas células inmunitarias, junto con las células endoteliales, células estromales, progenitores de adipocitos, fibroblastos y pericitos, constituyen el SVF8 y son la principal fuente de sustancias pro-inflamatorias en el AT9.
El estado inflamatorio de AT es comúnmente investigado por técnicas como Western blot10, qPCR11, inmunohistoquímica11. Sin embargo, al utilizar estas técnicas, en todo, adipocitos y SVF, se utiliza. Esto hace difícil determinar la cantidad y subconjuntos de células inmunes presentes en el AT. Las células inmunes tienen varios marcadores de la célula para definir y categorizar, como los macrófagos. Macrófagos muestran una heterogeneidad significativa en la célula y la función de expresión de marcador superficial12. Por lo tanto, a menudo se dividen en dos poblaciones de macrófagos: M1 y M2. Los macrófagos m2 generalmente se llaman macrófagos alternativamente activados12,13 y residen en el AT de magra, metabólicamente normales seres humanos14. Sin embargo, durante la obesidad, un interruptor fenotípico ocurre de M2 macrófagos macrófagos M1. Clásicamente estos activan M1 macrófagos expresan CD11C12 y se acumulan en adipocitos muertos para formar la corona-como las estructuras13. Se ha demostrado que CD11C+ los macrófagos en la en impedir la acción de la insulina y se asocian a resistencia a la insulina en seres humanos obesos15. Para identificar los macrófagos M1 y M2 en el AT, la inmunohistoquímica es una opción. Esta técnica da información sobre la ubicación de los macrófagos en el tejido. Sin embargo, limitará el número de marcadores que pueden utilizarse en una coloración. Por otra parte, también es difícil de cuantificar. Por lo tanto, para investigar los subconjuntos diferentes de células inmunitarias en el IVA y el sAT depósitos, hemos desarrollado un método de citometría de flujo. Este enfoque nos da la oportunidad de utilizar varios marcadores por celular con citometría de un flujo análisis para definir subconjuntos de la célula y los números de cada subconjunto presente en los depósitos en la cuenta.
Protocolo
Visceral y subcutáneo en las muestras fueron tomadas de sujetos incluidos en el estudio aprobado por la ética médica Comité Jessa Hospital, Hasselt y Universidad de Hasselt, Bélgica, según la declaración de Helsinki.
1. preparación de reactivos
- Solución de colagenasa
- Disolver 1 g de colagenasa en 10 mL de fosfato tampón salino (PBS, sin calcio y magnesio) para hacer una solución madre de 100 mg/mL. Preparar alícuotas μl 200 y almacenar a-20 ° C.
- Disolver 1 g de colagenasa XI en 10 mL de PBS para hacer una solución madre de 100 mg/mL. Preparar alícuotas μl 200 y almacenar a-20 ° C.
- Disolver 10 mg de la ADNsa I en 10 mL de PBS para hacer una solución stock de 10 mg/mL. Preparar alícuotas μl 180 y almacenar a-20 ° C.
- Añadir 100 μl colagenasa I (100 mg/mL), 100 μl colagenasa XI (100 mg/mL) y 90 de μl de DNasa I (10 mg/mL) 10 mL de DMEM Ham F12. Hacen de colagenasa solución fresca para cada aislamiento.
- Tampón de lisis de eritrocitos
- Disolver 0,84 g de NH4Cl en 100 mL de agua ultrapura.
- Ajuste el pH a 7.4 antes de su uso. Almacenar en un frasco de vidrio a 4 ° C.
- Coloque el buffer de lisis de eritrocitos en hielo antes de usarlo.
- Tampón FACS
- Disolver 0.5 g albúmina de suero bovino (BSA) en 100 mL de PBS para obtener 0,5% BSA PBS.
- Disolver 65 mg de NaN3 en 100 mL 0,5% BSA PBS para obtener 10 mM NaN3 0,5% BSA PBS. Almacene la solución en un frasco de vidrio a 4 ° C.
- Tampón FACS lugar en hielo antes de usarlo.
PRECAUCIÓN: NaN3 es altamente tóxico. Trabajar en una campana de humos y use gafas de seguridad y guantes de protección durante la manipulación de NaN3.
- Bloque de IgG humana
- Disolver 10 mg de IgG humana en 10 mL de PBS para obtener 1 mg/mL. Preparar alícuotas μl 100 y almacenar a-20 ° C.
- Coloque el bloque de IgG humano en hielo antes de usarlo.
2. aislamiento de SVF de AT
- Corte la 1 g de en la biopsia (± 2 mm2) con un bisturí y transferencia a un tubo de centrífuga de 50 mL (por ejemplo, tubo de halcón). Añadir 10 mL de solución de colagenasa a cada uno en la muestra.
Nota: Cerrar completamente la tapa del tubo y gire la tapa ¼ detrás. - Incubar por 60 min a 37 ° C en un baño de agua con agitación suave (60 ciclos/min).
- Filtrar la suspensión resultante con un filtro de 200 μm y recolectar la muestra en un tubo de centrífuga de 50 mL nuevo. Agregar 7 mL de PBS sobre el filtro para enjuagar el filtro y obtener todas las células.
- Centrifugar la muestra a 280 x g durante 5 min a 4 ° C.
- Eliminar la fracción flotante del adipocito por pipeteo. El pellet celular es el SVF.
Nota: Retire la fracción del adipocito para obtener SVF. Evitar sumergiendo la punta entera en la muestra porque esto sólo eliminará el PBS y no los adipocitos flotantes. - Resuspender el SVF en 5 mL de PBS para eliminar la colagenasa, filtrar la suspensión con un filtro de 70 μm, enjuagar el filtro con 5 mL de PBS y Centrifugue la muestra a 280 x g durante 5 min a 4 ° C.
- Quite el sobrenadante y resuspender el precipitado en 3 mL de tampón de lisis de eritrocitos.
- Incubar durante 5 minutos en hielo. Agregar 7 mL de PBS después de la incubación.
- Centrifugar la muestra a 280 x g durante 5 min a 4 ° C.
3. coloración de SVF para análisis de citometría de flujo
- Disolver el precipitado de células en 90 μl de tampón FACS de 4 ° C y añadir 10 μl de bloque de IgG humana de 1 mg/mL. Dividir la suspensión celular en 2 pocillos de una placa bien de forma de v 96. Coloque la placa de hielo y dejar el bloque de IgG humano incubar por 15 min.
- Añadir 100 μl de tampón FACS a cada muestra para lavar y centrifugar la placa por 5 min con 280 x g a 4 ° C. Quite el sobrenadante inclinando la placa boca abajo en un movimiento suave sin golpeando ligeramente la placa.
Nota: Asegúrese de quitar cualquier líquido restante de la parte superior de la placa con un pañuelo mientras manteniendo la placa boca abajo. - Preparar cócteles de anticuerpos macrófagos y subconjuntos de DC (panel 1 de FACS) y subconjuntos de células T y B (panel de FACS 2) como se describe en la tabla 1 y tabla 2. Los volúmenes descritos en la tabla 1 y tabla 2 se seleccionan después de optimizar las concentraciones de anticuerpo y son suficientes para un IVA o muestra sAT.
Nota: En el panel 1 de la FACS, use los marcadores CD303 y CD141 para confirmar que CD11C+ CD11Bbajo las células son DCs. Sin embargo, se recomienda excluir estos marcadores del panel con una coloración en vivo/muerto. Ambos panel de FACS 1 y 2 puede combinarse con la viabilidad LIVE/DEAD fijable rojo muerto celular Kit Stain tinción cuando excluyendo CD303 en panel 1 como canal PE será sin usar. Realizar viabilidad coloración según las instrucciones del fabricante. - Resuspender el pellet en 29,5 anticuerpo μl coctel para panel de FACS 1 y 23 μl anti coctel para panel de FACS 2. Incubar por 30 min en la oscuridad en el hielo.
- Añadir 150 μL de tampón FACS a cada pocillo y resuspender el precipitado de células para realizar un segundo paso de lavado. Centrifugar la placa durante 5 minutos a 280 x g a 4 ° C. Quite el sobrenadante inclinando la placa boca abajo.
- Añadir solución de formaldehido de 1% de 150 μL a cada pocillo para fijar las células. Transferir la suspensión de células de cada pozo al tubo correspondiente de FACS mediante pipeteo con una pipeta de P200. Almacenar tubos FACS a 4 ° C en el oscuro hasta 7 días.
Nota: También es posible una medición directa. Añadir 150 μL de tampón FACS a cada pocillo en vez de formaldehído al 1%, las células de transferencia mediante pipeteo con una pipeta de P200 a los tubos correspondientes de FACS y analizar las células.
PRECAUCIÓN: El formaldehído es muy tóxico. Preparar soluciones de formaldehído al trabajar en una campana de humos para evitar la inhalación y utilizar guantes y gafas de seguridad para la protección.
4. Análisis de citometría de flujo de
- Antes de la primera medición, utilice un control negativo sin mancha para establecer la forward scatter (FSC) y el lado scatter (SSC). Ajustar los voltajes de la citometría de flujo según las instrucciones del fabricante para que todas las poblaciones de interés son visibles en el gráfico de FSC y SSC y puede hacerse una distinción entre residuos y células vivas.
- Realizar análisis de compensación de varios colores con cuentas de captura de anticuerpos siguiendo el protocolo del fabricante.
- Preparar fluorescencia menos uno controla (FMO) haciendo la mezcla de anticuerpos pero excluye un anticuerpo de la mezcla. Hacer esto para cada anticuerpo, creando 8 mezclas de anticuerpos para el panel 1 de la FACS y 6 mezclas de anticuerpos para el panel de FACS 2. Estas mezclas de anticuerpos FMO se utilizan para manchas SVF como se describió anteriormente en el presente Protocolo.
- Medir todos los controles de FMO y establezca la estrategia bloquea basada en controles FMO. Utilice los controles FMO para detectar posible auto-fluorescencia de las células.
Nota: Al eliminar un anticuerpo de la mezcla, cualquier nivel de fluorescencia detectada en este canal es una señal de fondo/autofluorescent. Por lo tanto, comparando lo diferentes FMO control resultados de FACS, puertas pueden establecerse en poblaciones específicas, asegurando que el guardapolvo se basan en las células positivas y no basada en auto-fluorescencia. - Tubos de vórtice la FACS a 800 rpm antes de colocarlos en el citómetro de flujo y a partir de la medición.
Nota: Se recomienda un mínimo de 50.000 eventos en la puerta directo para asegurar que suficientes células miden de cada subpoblación.
Resultados
El SVF aislado del IVA y el sAT se midió mediante citometría de flujo. Mediciones del flujo cytometry generan parcelas con diferentes poblaciones celulares basadas en marcadores celulares (figura 1A y 1B). En primer lugar, trazando forward scatter (FSC-W) de ancho y adelante celular de (FSC-A), de área de dispersión agregados pueden ser eliminados del análisis de las células que bloquean como bajo FSC-W. Siguiente, energizadas las células se seleccionan, y ruina celular es excluido por bloquear las células del tamaño correcto y la complejidad mediante FSC-lado A y el área de dispersión (SSC-A), respectivamente. Las células muertas son pequeñas y por lo tanto visible como una población distinta con un pequeño FSC-A. Las células inmunes, próximo fueron seleccionadas por el uso de la pistola de pan-leucocitos CD45 (Panel 1 y 2, figura 1A). Para analizar los macrófagos, las células de otros inmune como las células T (CD3), linfocitos B (CD19), neutrófilos (CD66b+ CD11b+), y las células NK (CD56) fueron excluidas de análisis mediante el uso de diferentes anticuerpos contra estas células, pero con el mismo fluorocromo. Otra subdivisión de las células restantes se basó en la expresión de CD11b y CD11c. Esto dio lugar a las siguientes poblaciones: CD11b+ CD11c+ los macrófagos, CD11b+ CD11c macrófagos– y CD11bbajo /- CD11c+ DCs (FACS el panel 1, figura 1B). Medición de intensidad de fluorescencia media (IFM) permitió la cuantificación de la expresión de CD303 (marcador de la C.C. del plasmacytoid) y CD141 (marcador de DC), en CD11b+ CD11c+ macrófagos y CD11bbajo /- CD11c+ DCs. Expresión de ambos estos marcadores fueron mayores en CD11bbajo /- CD11c+ células confirmando que CD11bbajo /- CD11c+ células eran DCs (figura 1).
El CD45+ las células (figura 1A) se dividieron en las células T y células B con CD3 y CD19, respectivamente. Las células T se subdividieron en las células T-helper (CD4+) y células T citotóxicas (CD8+). Por último, CD3–CD19–células se trazaron para cuantificar utilizando el marcador CD56 de células NK (FACS el panel 2, figura 1). El número de células en cada puerta se cuantifica y puede utilizarse para calcular el porcentaje de este tipo de celulares de todas las células vivas (cuadro 3).
El porcentaje de células vivas puede ser calculado para cada tema que permite el cálculo de un promedio de todos los sujetos en un grupo de por ejemplo los hombres magros u obesos mostrando la abundancia de un específico células inmunitarias, es decir, el CD11b pro-inflamatoria+ CD11c+ macrófago en AT visceral (figura 2).
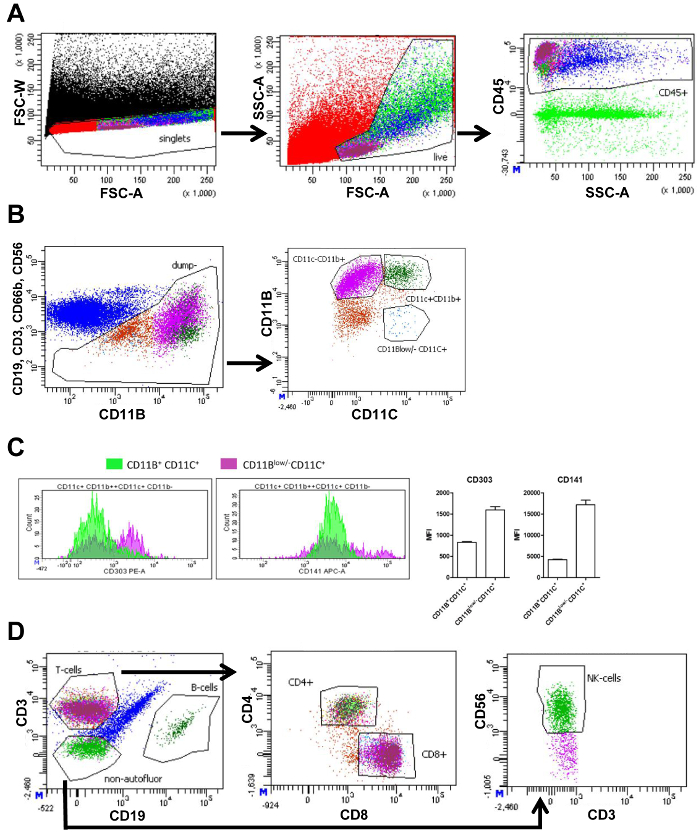
Figura 1. Estrategia de tejido adiposo visceral que bloquean FACS. (A) FACS trama de todos los eventos (negro) con intensidad de anchura de forward scatter (FSC-W) y la intensidad de la zona de forward scatter (FSC-A) que contiene una puerta para seleccionar solamente las células (rojo) seguidas de una parcela de FACS basada en intensidad de dispersión lateral y FSC-A zona (SSC-A) que contiene una puerta de selección de células vivas (verde claro). Parcela junto con SSC-A y la intensidad de fluorescencia de CD45 contiene una puerta de selección CD45 todos+ (inmune) las células (azul). (B) FACS parcela de CD56, CD19, CD3 y CD66b intensidad de fluorescencia versus CD11b intensidad de fluorescencia y una puerta de seleccionar todas las celdas que son negativas CD56, CD19, CD3 y CD66b (marrón) de más división en las poblaciones. Subdivisión adicional en la trama siguiente basada en la intensidad de fluorescencia de CD11b y CD11c. Puertas se muestran con CD11b+ CD11c+ macrófagos (verde oscuro), CD11b+ CD11c macrófagos– (morados) y CD11bbajo /- CD11c+ las células dendríticas (azul). (C) cantidad de CD11b+, CD11c+, o CD11bbajo /- CD11c+ mostrando sus niveles de intensidad de fluorescencia (eje x) para CD303 y CD141 y la cuantificación correspondiente de la media de las células (eje y) intensidad de fluorescencia (IMF). (D) FACS parcela mostrando el CD45 anterior+ población (azul) basado en la intensidad de la fluorescencia del CD3 y CD19 que contienen puertas de selección de células T (magenta), las células de B (verde oscuro) y no autofluorescent células (verde) negativo para ambos CD3 y CD19. El diagrama siguiente se basa en fluorescencia CD4 y CD8 con puertas selección CD4+ (verde claro) y CD8+ (magenta) células de T. Una idéntica estrategia bloquea se utiliza para el tejido adiposo subcutáneo. Una idéntica estrategia bloquea se utiliza para el tejido adiposo subcutáneo. Esta figura ha sido modificada de Wouters et al. 16 Haga clic aquí para ver una versión más grande de esta figura.
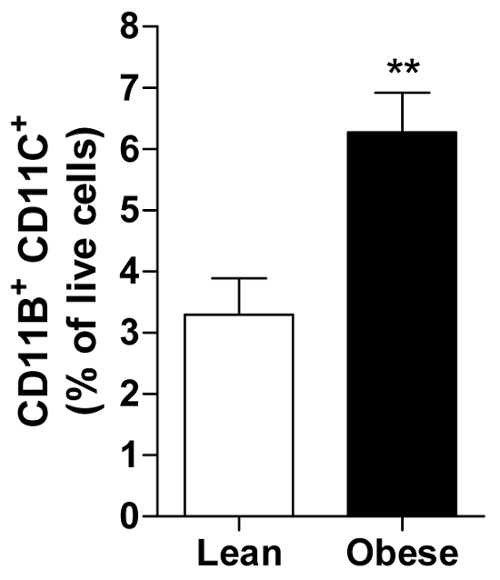
Figura 2. IVA obeso contiene macrófagos pro-inflamatorias más. La cantidad de CD11b+ CD11c+ los macrófagos presentados como porcentaje de todas las células vivas en el IVA de los hombres obesos y magros. Todos los datos son medios ± SEM; n = 20 lean y n = 31 para obesos. p ≤ 0.01 vs lean. Haga clic aquí para ver una versión más grande de esta figura.
| Blanco | Objetivo de la definición | Presentes en | Fluorocromo | Cantidad | Clon |
| CD11B | marcador de integrina mieloide | granulocitos, monocitos/macrófagos, células dendríticasbaja y las células asesinas naturales | BV421 | 2,5 ΜL | ICRF44 |
| CD19 | antígeno común de la célula de B | Desarrollo de la célula de b de células pro-B a la célula de B del blastoid y células de B del plasma | FITC | 3 ΜL | HIB19 |
| CD3 | antígeno común de la célula de T | Los linfocitos T, células de T naturales del asesino y timocitos | FITC | 3 ΜL | UCHT1 |
| CD66B | miembro del antígeno carcinoembrionario (CEA)-como familia de glicoproteína | granulocitos | FITC | 5 ΜL | G10F5 |
| CD56 | pesadamente glycosylated proteínas de adherencia | células de asesino naturales y células de T naturales del asesino | FITC | 5 ΜL | B159 |
| CD303 | tipo Glicoproteína transmembrana II | células dendríticas plasmocitoides | PE | 1 ΜL | 201A |
| CD141 | trombomodulina | monocitos/macrófagosbajo, subpoblación de las células dendríticas | APC | 1 ΜL | M80 |
| CD11C | tipo I Glicoproteína transmembrana; integrina αx | monocitos/macrófagos, células dendríticas, granulocitos, células de asesino naturales, subconjunto de células B y T | APC-Cy7 | 0.5 ΜL | Bu15 |
| CD45 | antígeno leucocitario común | todos los leucocitos humanos incluyendo linfocitos, monocitos, granulocitos, eosinófilos y timocitos | PE-Cy7 | 1 ΜL | HI30 |
| Tampón FACS | - | - | - | μl de 7.5 | - |
Tabla 1. Cocktail de anticuerpos FACS panel 1 para identificar subconjuntos de macrófagos y células dendríticas poblaciones. Cantidad de anticuerpo descrito es para el análisis de una muestra.
| Blanco | Objetivo de la definición | Presentes en | Fluorocromo | Cantidad | Clon |
| CD19 | antígeno común de la célula de B | Desarrollo de la célula de b de células pro-B a la célula de B del blastoid y células de B del plasma | BV421 | 1 ΜL | HIB19 |
| CD3 | antígeno común de la célula de T | Los linfocitos T, células de T naturales del asesino y timocitos | V500 | 3 ΜL | UCHT1 |
| CD56 | pesadamente glycosylated proteínas de adherencia | células de asesino naturales y células de T naturales del asesino | APC | 5 ΜL | HCD56 |
| CD4 | Superfamilia de las Ig, Glicoproteína transmembrana de tipo I | Tipo de célula del ayudante de T, timocitos, monocitos/macrófagos, células de T naturales del asesino II | PerCP-Cy5.5 | 1 ΜL | RPA-T4 |
| CD8 | Α-subunidad de un complejo bimolecular disulfuro-ligado | células de T citotóxicas, timocitos, subconjunto de células de asesino naturales | APC-H7 | 2 ΜL | SK1 |
| CD45 | antígeno leucocitario común | todos los leucocitos humanos incluyendo linfocitos, monocitos, granulocitos, eosinófilos y timocitos | PE-Cy7 | 1 ΜL | HI30 |
| Tampón FACS | - | - | - | 10 μl | - |
Tabla 2. Cocktail de anticuerpos FACS panel 2para identificar las poblaciones de células T y B. Cantidad de anticuerpo descrito es para el análisis de una muestra.
| Panel de macrófago | ||
| Nombre de la puerta | # Células | % de vivo |
| Células | 183054 | |
| en vivo | 10477 | 100 |
| CD45 | 4100 | 39.13 |
| descarga– | 771 | 7.36 |
| CD11C CD11B– + | 430 | 4.1 |
| CD11C+ CD11B+ | 104 | 0.99 |
| CD11C+ CD11Bbajo /- | 15 | 0.14 |
| Panel de células T, células B, células NK | ||
| Nombre de la puerta | #Cells | % de vivo |
| Células | 34616 | |
| En vivo | 3728 | 100 |
| CD45+ | 1589 | 42.62 |
| Células NK | 29 | 0,78 |
| CD3+ | 953 | 25.56 |
| CD4+ | 601 | 16.12 |
| CD8+ | 328 | 8.8 |
| CD19+ | 20 | 0.54 |
Tabla 3. Abundancia de células inmunes de diferentes tipos de células en el IVA. Número de células en cada puerta y el porcentaje de los diferentes tipos de células basan en la cantidad total de células vivas.
Discusión
Estos métodos describen cómo aislar el SVF de IVA y se sentaban y cuantificar las cantidades relativas de las células inmunes dentro de estos tejidos. Además, los métodos indican cómo determinar la expresión de marcadores en tipos celulares específicos.
Citometría de flujo de las células inmunes del tejido es una técnica poderosa para fenotipo el estado inmunológico de los tejidos. La cuantificación de las células inmunes del tejido puede tener muchas aplicaciones. Como se describe en los resultados, es posible comparar la presencia de células inmunes específicas entre grupos de pacientes (por ejemplo, lean vs obesos). Además, realizando también citometría de flujo en la sangre de los mismos pacientes, se pueden investigar las asociaciones entre la circulación de las células y las células del tejido. Con esta aplicación hemos podido determinar que un subconjunto específico de los monocitos circulantes se asocia con pro-inflamatoria CD11C+ de los macrófagos del tejido adiposo16.
Ajustes en el protocolo descrito ampliará sus aplicaciones como numerosos anticuerpos fluorescentes disponibles citometría de flujo muy versátil. Con los diferentes anticuerpos se distinguen casi todos los tipos de la célula y puede detectarse la expresión de muchos marcadores. Además, es posible manchar marcadores intracelularmente por permeabilizing de la membrana celular para permitir la Unión intracelular de los anticuerpos fluorescentes. Estas características permiten la distinción de las poblaciones de macrófagos muy diversos más allá de los subtipos de macrófagos M1 y M2 excesivamente simplificadas. Además de medida de la expresión superficial del marcador, proteínas (es decir, citoquinas) pueden tinción intracelular facilitando información sobre funcionalidad del macrófago. Además, marcadores de proliferación como el Ki67 se utilizan para cuantificar las tasas de proliferación. Como se describe, distinción entre macrófagos y DCs se basó en niveles MFI de marcadores de DC. Un marcador de macrófagos general, tales como CD68 puede ser incorporado en el panel de macrófagos (FACS panel 1). Sin embargo, CD68 necesita teñirse intracelular que requiere permeabilización de la membrana celular que no es preferible y extendería el protocolo. Otros marcadores de macrófagos son marcadores de subconjunto como CD163 y CD206 o CD11c, este último integrado en el panel de macrófago presentado aquí.
En nuestros paneles de FACS, un marcador para distinguir las células vivas y muertas no se incluyó, que sería preferible porque permite una exclusión más precisa de las células muertas que el uso de FSC y SSC. Utilizadas es el ADN de tinción viabilidad tintes yoduro de propidio (PI) o 4', 6-diamidino-2-phenylindole (DAPI) así como amina libre reaccionar tintes como el LIVE/DEAD fijable muerto celular Kit Stain, que está disponible en colorante diferentes colores. Sin embargo, DAPI y PI no pueden utilizarse cuando se fijan las células. Como se describe en el protocolo, la tinción de viabilidad LIVE/DEAD fijable muerto eritrocitos puede integrarse en dos paneles sin afectar el FACS general Estrategia que bloquean.
Además, los datos se expresan como un porcentaje de células vivas, lo que significa que todos los datos son relativos. Sólo introduciendo un exacto, conocido el número de células en el citómetro de flujo, sería posible determinar las cifras exactas de cada tipo de célula. Un número aproximado de células podría calcularse después de contar las células en la fracción SVF utilizando una cámara de conteo. Sin embargo, este número tendría que ser ajustado por la cantidad de tejido de biopsia utilizado para aislar el SVF, pero esto tiene limitaciones cuando se comparan lean a obesos en. Una masa similar de obesos en consiste en menos adipocitos ya que están llenas de lípidos y han ampliado grandemente. Esto podría conducir a una subestimación del número de células inmunes si presentado como número de células inmunes por gramo de a o por el adipocito.
En estudios en humanos, inclusión de pacientes se realiza durante un largo periodo de tiempo que la estandarización de los procedimientos experimentales de gran importancia. Para la comparación de datos de citometría de flujo entre los pacientes, hay varias opciones. Como se describe en este protocolo, las células pueden fijarse antes de medición permite el análisis de varias muestras en el mismo día. Esto puede lograrse también congelando el SVF antes les coloración, permite que el procedimiento de tinción sea igual entre todas las muestras, pero podría afectar la viabilidad de las células. Por último, también empleado en este estudio, son perlas fluorescentes para instalar los niveles de compensación y citómetro seguimiento granos fueron utilizados dos veces por semana para estandarizar mediciones diarias de la citometría. Esta última opción es la más eficiente cuando mide muestras de un estudio que abarca un largo período de tiempo.
Un factor limitante para citometría de flujo en general es el uso de la fluorescencia. El número de etiquetas fluorescentes que pueden detectarse simultáneamente es limitado debido a la superposición de espectros de emisión. Sin embargo, con smart FACS panel desarrollo y el uso de varios cócteles de anticuerpo por IVA o muestra sAT, este problema puede superarse como se describe en este protocolo. Un aspecto importante del desarrollo del panel de FACS es controles FMO. Mediante el uso de los anticuerpos del grupo excepto uno, potenciales niveles de Autofluorescencia pueden apreciarse al comparar el FMO con el panel completo. Esto permite control exacto de las poblaciones y estos procedimientos deben ser realizados cuando se configura un nuevo panel de FACS. Además, las nuevas generaciones de dispositivos FACS pueden detectar hasta 50 parámetros que permiten la detección simultánea de muchas características por la célula. Otro tema relacionado con el aspecto de la fluorescencia es la autofluorescencia de las células, especialmente macrófagos. Después de la excitación de las células con el láser de FACS (principalmente con 488 excitación de longitud de onda nm), estas células emiten una señal fluorescente (principalmente < 640 nm) que puede traslapo con los espectros de emisión del anticuerpo etiquetas17,18. Para tener en cuenta esto, las células sin manchas deben medirse para determinar la autofluorescencia en cada canal. Con este conocimiento, se deben seleccionar fluorocromos que muestran una señal que excede la señal autofluorescent. Esta señal de fondo autofluorescent debe tenerse en cuenta al determinar la estrategia bloquea de las poblaciones. Por lo tanto, por aplicación de este protocolo y diseño de panel de FACS inteligente es posible en subtipos de profundidad fenotipo macrófago. EN distintos nuevos macrófagos y su función pueden ser caracterizados.
Divulgaciones
Los autores no declaran conflictos de interés.
Agradecimientos
Nos gustaría agradecer a J. van de Gaar y Vroomen M. (Universidad de Maastricht, los Países Bajos) por su apoyo técnico. Además, nos gustaría dar las gracias K. Verboven, D. Hansen, J. Jocken, y E. Blaak para proporcionar las biopsias de tejido y sangre se utiliza para configurar este protocolo y los experimentos subsecuentes.
Materiales
| Name | Company | Catalog Number | Comments |
| Centrifuge | Hettich Rotanta 460R | 5660 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)-Ham’s F12 | Gibco ThermoFisher | 31330-095 | |
| Collagenase XI from Clostridium histolyticum | Sigma Aldrich | C7657-1g | |
| Collagenase I from Clostridium histolyticum | Sigma Aldrich | C0130-1g | |
| DNAse I from bovine pancreas | Sigma Aldrich | DN25 | |
| NH4Cl | Merck | 1.01145.0500 | |
| Bovine Serum Albumine | Sigma Aldrich | A4503-100 | |
| NaN3 | Merck | 1.06688.0100 | |
| 200 µM syringe Filcons | BD Biosciences | 340613 | |
| 70 µM filter | Greiner Bio-one | 542070 | |
| Fc block / human IgG | Sigma Aldrich | 14506 | |
| Formaldehyde | Merck | 1.04003.2500 | |
| CD11b-BV421 | Biolegend | 301324 | |
| CD19-Fitc | BD Biosciences | 555412 | |
| CD3-Fitc | BD Biosciences | 561807 | |
| CD66b-Fitc | BD Biosciences | 555724 | |
| CD56-Fitc | BD Biosciences | 562794 | |
| CD11c-APC-Cy7 | Biolegend | 337218 | |
| CD45-PE-Cy7 | BD Biosciences | 557748 | |
| CD19-BV421 | Biolegend | 302234 | |
| CD3-V500 | BD Biosciences | 561416 | |
| CD56-APC | Biolegend | 318310 | |
| CD4-PerCP-Cy5.5 | Biolegend | 300528 | |
| CD8-APC-H7 | BD Biosciences | 641400 | |
| CD303-PE | Biolegend | 354204 | |
| CD141-APC | Biolegend | 344106 | |
| FACS-Canto II | BD Biosciences | ||
| 96 v-shape well plate | Greiner Bio-one | 651101 | |
| PBS PH 7.4 | Gibco ThermoFisher | 10010023 | |
| FACS tube 5 mL polystyrene round-bottom tube | Corning | 352052 | |
| IgG from human serum | Sigma Aldrich | I4506 | |
| Anti-Rat Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552844 | |
| Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552843 | |
| LIVE/DEAD Fixable Red Dead Cell Stain Kit | ThermoFisher | L23102 | |
| IKA MS 3 basic shaker | Sigma Aldrich | Z645028-1EA |
Referencias
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Makki, K., Froguel, P., Wolowczuk, I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013, 139239 (2013).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U S A. 110 (13), 5133-5138 (2013).
- Elgazar-Carmon, V., Rudich, A., Hadad, N., Levy, R. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding. J Lipid Res. 49 (9), 1894-1903 (2008).
- Han, J. M., Levings, M. K. Immune regulation in obesity-associated adipose inflammation. J Immunol. 191 (2), 527-532 (2013).
- Liu, J., et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat Med. 15 (8), 940-945 (2009).
- Nishimura, S., et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 15 (8), 914-920 (2009).
- Koh, Y. J., et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 31 (5), 1141-1150 (2011).
- Peinado, J. R., et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 10 (18), 3356-3366 (2010).
- Leggate, M., et al. Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males. Journal of Applied Physiology. 112 (8), 1353-1360 (2012).
- Divoux, A., et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 97 (9), E1677-E1685 (2012).
- Harford, K. A., Reynolds, C. M., McGillicuddy, F. C., Roche, H. M. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc. 70 (4), 408-417 (2011).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Morris, D. L., Singer, K., Lumeng, C. N. Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states. Curr Opin Clin Nutr Metab Care. 14 (4), 341-346 (2011).
- Wentworth, J. M., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 59 (7), 1648-1656 (2010).
- Wouters, K., et al. Circulating classical monocytes are associated with CD11c+ macrophages in human visceral adipose tissue. Sci Rep. 7, 42665 (2017).
- Duan, M., et al. Distinct macrophage subpopulations characterize acute infection and chronic inflammatory lung disease. J Immunol. 189 (2), 946-955 (2012).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. J Immunol Methods. 386 (1-2), 101-107 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados