Method Article
Характеристика иммунных клеток в жировых тканях человека с помощью проточной цитометрии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта статья описывает метод для анализа содержания иммунной клетки жировой ткани путем изоляции иммунных клеток из жировой ткани и последующего анализа с помощью проточной цитометрии.
Аннотация
Проникновение иммунных клеток в подкожной и висцеральных жировой ткани (AT) месторождения приводит к низкосортных воспаления, способствуют развитию ожирения ассоциированных осложнений, таких как диабет типа 2. Количественно и качественно исследовать подмножеств иммунных клеток человека на месторождениях, мы разработали подход цитометрии потока. Стромальные сосудистой дроби (СФДВ), содержащий иммунных клеток, изолирована от подкожного и висцеральных на биопсии коллагеназы пищеварение. Адипоцитов удаляются после центрифугирования. СФДВ клетки витражи для несколько маркеров привязанных к мембране выбрана дифференцировать между подмножествами иммунных клеток и анализируются с помощью проточной цитометрии. В результате этого подхода, про - и анти - противовоспалительное подмножеств макрофагов, дендритные клетки (DCs), B-клетки, CD4+ и CD8+ Т-клеток, и НК-клеток может быть обнаружен и количественно. Этот метод дает подробную информацию о иммунные клетки в AT и количество каждого конкретного подмножества. Поскольку многочисленные флуоресцентные антитела, наш подход цитометрия потоков может настраиваться для измерения различных клеточных и внутриклеточных маркеров интерес.
Введение
Ожирение характеризуется с низкопробным AT воспаления1 и проникновение про воспалительных иммунных клеток в висцеральных и подкожно в (НДС, сб). Накопление про воспалительных иммунных клеток в НДС приводит к сопротивление инсулина, который является основным фактором риска развития диабета 2 типа2. Иммунные клетки врожденная и адаптивного иммунитета находятся в ожирением AT, например тучные клетки, макрофаги, нейтрофилы, CD4+ и CD8+ Т-клеток и B-клетки,3,4,5,6 ,7. Эти клетки иммунной системы, вместе с эндотелиальных клеток, стромальные клетки, Адипоцит прародителями, фибробластов и pericytes, представляют собой СФДВ8 и являются главным источником про воспалительных веществ в AT9.
Воспалительные состояния AT обычно расследуются методов, включая западную помарку10, ПЦР11и иммуногистохимии11. Однако при использовании этих методов, весь AT, адипоциты и СФДВ, используется. Это делает его трудно определить объем и подмножеств иммунных клеток в AT. Иммунные клетки имеют различные ячейки маркеры, чтобы определить и классифицировать их, такие как макрофаги. Макрофаги показывают значительную гетерогенность в функции и клеток поверхности маркер выражения12. Таким образом, они часто делятся на две популяции макрофагов: М1 и м2. М2 макрофаги обычно называются также Активированные макрофаги12,13 и проживают в AT худой, метаболически нормальные люди14. Однако при ожирении, фенотипические переключатель происходит от макрофагов M2 M1 макрофагов. Эти классически активирован M1 макрофаги Экспресс CD11C12 и накапливать вокруг мертвого адипоциты для формирования структуры короны13. Было доказано, что CD11C+ макрофагов в AT ослабить действие инсулина и связанные с сопротивлением инсулина в тучных людей15. Чтобы определить М1 и м2 макрофагов в AT, иммуногистохимия является вариантом. Этот метод дает информацию о местоположении макрофаги в ткани. Однако он будет ограничивать количество маркеров, которые могут использоваться в одном пятнать. Кроме того это также трудно подсчитать. Таким образом для расследования различных иммунных клеток подмножества в НДС и сидел депозитов, мы разработали подход цитометрии потока. Этот подход дает нам возможность использовать несколько маркеров в клетку с одного потока cytometry анализ для определения подмножества ячеек и подсчитать количество каждого подмножества в AT месторождений.
протокол
Висцеральная и подкожной на образцы были взяты из вопросов, охваченных в исследовании, одобренных медицинских этического Комитета Джесса больницы, Хасселт и университета Хассельт, Бельгия, в соответствии с Хельсинкской декларации.
1. Подготовка реагентов
- Решение коллагеназы
- Растворить 1 g из коллагеназы я в 10 мл фосфата буфер солевой раствор (PBS, без кальция и магния) чтобы сделать Стоковый раствор 100мг/мл. Подготовка 200 мкл аликвоты и хранить при температуре от-20 ° C.
- Растворите 1 g коллагеназы XI в 10 мл PBS сделать Стоковый раствор 100мг/мл. Подготовка 200 мкл аликвоты и хранить при температуре от-20 ° C.
- 10 мг DNase растворяют в 10 мл PBS сделать Стоковый раствор 10 мг/мл. Подготовка 180 мкл аликвоты и хранить при температуре от-20 ° C.
- Добавить 100 мкл коллагеназы I (100 мг/мл), 100 мкл коллагеназы XI (100 мг/мл) и 90 мкл DNase I (10 мг/мл)-10 мл DMEM Хэм F12. Сделайте решение коллагеназы свежие для каждой изоляции.
- Буфер lysis эритроцитов
- Растворите 0,84 г NH4Cl в 100 мл ультрачистая вода.
- Установите рН 7,4 перед использованием. Хранить в стеклянной колбе при 4 ° C.
- Место буфера lysis эритроцитов на льду перед использованием.
- СУИМ буфер
- 0.5 g бычьим сывороточным альбумином (БСА) растворяют в 100 мл PBS для получения 0,5% BSA PBS.
- Растворите 65 мг3 NaN в 100 мл 0,5% BSA PBS для получения 10 мм НАН3 0,5% BSA PBS. Хранят раствор в стеклянную колбу на 4 ° C.
- Место СУИМ буфер на льду перед использованием.
Предупреждение: НАН3 высоко токсичен. Работа в зонта и надевайте защитные очки и перчатки для защиты при обработке НАН3.
- Человека IgG блок
- Растворите 10 мг IgG человека в 10 мл PBS для получения 1 мг/мл. Подготовка 100 мкл аликвоты и хранить при температуре от-20 ° C.
- Место человека IgG блок на льду перед использованием.
2. изоляция СФДВ от AT
- 1 g на биопсии мелко нарежьте (± 2 мм2) с скальпель и передачи в 50-мл пластиковых пробирок (например, метро Сокол). Добавьте 10 мл раствора коллагеназы каждый на образец.
Примечание: Полностью закройте крышку трубки и поверните крышку ¼ обратно. - Инкубируйте 60 мин при 37 ° C в ванне с водой под мягкий встряхивания (60 циклов/мин).
- Фильтровать результирующий подвеска с 200 мкм фильтром и собирать образца в новом 50 мл пластиковых пробирок. Добавление 7 мл PBS на верхней части фильтра промойте фильтр и получить все клетки.
- Центрифугуйте образцы на 280 x g 5 мин при 4 ° C.
- Удалите плавающей Адипоцит дроби, закупорить. Пелле клеток является СФДВ.
Примечание: Удалите Адипоцит дроби для получения СФДВ. Избегайте погружаемой весь кончик в образце, потому что это будет только снять PBS и не плавающей адипоцитов. - Ресуспензируйте СФДВ в 5 мл PBS для удаления коллагеназы, фильтровать подвеска с 70 мкм фильтром, промойте фильтр с 5 мл PBS и Центрифугуйте образцы на 280 x g 5 мин при 4 ° C.
- Удалить супернатант и Ресуспензируйте гранулы в 3 мл буфера lysis эритроцитов.
- Инкубируйте 5 мин на льду. Добавление 7 мл PBS после инкубации.
- Центрифугуйте образцы на 280 x g 5 мин при 4 ° C.
3. Окрашивание СФДВ для потока Cytometry анализ
- Растворяют гранулы ячейки в буфер СУИМ 4 ° C 90 мкл и 10 мкл человека блока 1 мг/мл IgG. Разделите суспензию клеток в 2 скважины 96 v образные пластины хорошо. Место пластину на льду и пусть блока IgG человека Инкубируйте 15 мин.
- Добавить 100 мкл СУИМ буфера для каждого образца, чтобы умыться и центрифуги пластину для 5 мин с 280 x g при 4 ° C. Удалите супернатант, чаевые пластину вниз в одном плавное движение без разговоров пластину.
Примечание: Не забудьте удалить любые оставшиеся жидкости из верхней части пластины с ткани в то время как сохраняя пластину вниз головой. - Подготовка антител коктейли для макрофагов и DC подмножеств (Группа 1 FACS) и T - и B-клеток подмножеств (Группа 2 СУИМ) как описано в таблице 1 и таблице 2. Тома, описанных в таблице 1 и таблице 2 выбираются после оптимизации концентрации антител и достаточно для одного НДС или СБ образца.
Примечание: В СУИМ группа 1, используйте маркеры CD303 и CD141 для подтверждения этого CD11C+ CD11Bнизкой клетки являются DCs. Однако рекомендуется исключить эти маркеры из панели, чтобы включить жить/мертвые пятнать. Обе СУИМ группа 1 и 2 могут быть объединены с LIVE/мертвые поправимо красный мертвых клеток пятно комплект жизнеспособности, окрашивание когда исключая CD303 панели 1 как PE канал будет неиспользуемые. Выполните жизнеспособности пятнать согласно инструкциям производителя. - Ресуспензируйте гранулы в 29,5 мкл антител коктейль для СУИМ группа 1 и 23 мкл антител коктейль для СУИМ панели 2. Инкубируйте 30 мин в темноте на льду.
- Добавить 150 мкл буфера СУИМ в каждой скважине и Ресуспензируйте Пелле ячейки для выполнения второй шаг мыть. Центрифуга пластину для 5 мин на 280 x g и 4 ° C. Удалите супернатант, чаевые пластину вниз головой.
- Добавьте 150 мкл 1% раствора формальдегида в каждой скважине исправить клетки. Передать суспензию клеток от каждой скважины соответствующие трубки СУИМ, дозирование с пипеткой P200. Хранить СУИМ труб при температуре 4 ° C в темных до 7 дней.
Примечание: Прямое измерение также возможна. Добавить 150 мкл буфера СУИМ в каждой скважине вместо 1% формальдегида, передачи клетки, дозирование с Р200 пипетки для соответствующего трубы СУИМ и анализировать клетки.
Предупреждение: Формальдегид является весьма токсичным. Готовить растворы формальдегида во время работы в Зонта избегать вдыхания и носить перчатки и защитные очки для защиты.
4. поток Cytometry анализ
- До первого измерения используйте неокрашенных отрицательный контроль вперед точечной (FSC) и стороны точечной (SSC). Отрегулируйте напряжение проточный цитометр согласно инструкции производителя, так, что все население интерес видны в графе FSC и ККК и мусора и живые клетки может быть различие между.
- Выполните анализ многоцветные компенсации с бисером захвата антитела после производителя протокол.
- Подготовить флуоресценции минус один (FMO) элементы управления, сделав смесь антител, но исключить одного антитела от mix. Сделайте это для каждого антитела, создавая 8 антитела для СУИМ группа 1 и 6 антитела смесей для СУИМ панели 2. Эти смеси FMO антитела используются для пятно СФДВ, как описано ранее в этом протоколе.
- Измерить все FMO элементы управления и задайте стробирования стратегию, основанную на FMO элементов управления. Используйте элементы управления FMO для обнаружения возможных auto флуоресценции клеток.
Примечание: Путем удаления одного антитела от mix, любой уровень флюоресценции, обнаружены в этот канал — это фон/autofluorescent сигнал. Таким образом, сравнивая различные FMO контролировать результаты СУИМ, ворота можно извлечь на конкретные группы населения, обеспечение того, что gatings основаны на позитивные клетки и не основывается на авто флуоресценции. - Вихревой СУИМ трубы на 800 об/мин до помещения их в проточный цитометр и начала измерения.
Примечание: Минимум 50 000 событий в живой ворот рекомендуется обеспечить достаточное количество ячеек измеряются от каждой подгруппе населения.
Результаты
СФДВ изолированы от НДС и сидел была измерена с помощью проточной цитометрии. Расходометрия цитометрии генерировать участков, показаны различные клеточных популяций на основе клеточных маркеров (рис. 1A и 1B). Во-первых путем построения вперед разброс ширина (FSC-W) и вперед разброс области (FSC-A), ячейку, которую агрегаты могут быть исключены из дальнейшего анализа, стробирование единичных клеток как низкий FSC-W. Следующий, живой клетки выбраны, и сотовой мусора исключается стробирования клетки правильного размера и сложности, с использованием FSC-и разброс области (SSC-A), соответственно. Мертвые клетки являются небольшими и поэтому видны как собственный населения с небольшим FSC-A. Следующий, иммунные клетки были отобраны с использованием маркера Пан лейкоцита CD45 (Группа 1 и 2, рис. 1A). Чтобы проанализировать макрофагов, другие иммунной клетки как Т-лимфоцитов (CD3), B-клетки (CD19), нейтрофилов (CD66b+ CD11b+), и NK-клетки (CD56) были исключены из дальнейшего анализа с помощью различных антител, ориентация этих клеток, но с тем же флюрохром. Дальнейшее подразделение остальных клеток была основана на CD11b и CD11c выражения. Это привело к следующим населения: CD11b+ CD11c+ макрофагов, CD11b+ CD11c– макрофагов и CD11bнизкая /- CD11c+ DCs (FACS группа 1, рис. 1B). Измерения интенсивности (MFI) означает флуоресценции допускается количественная оценка выражения CD303 (маркер плазмоцитарная DC) и CD141 (DC маркер), на CD11b+ CD11c+ макрофагов и CD11bнизкая /- CD11c+ РСУ. Выражение обеих этих маркеров были выше в CD11bнизкая /- CD11c+ клетки подтверждающие что CD11bнизкая /- CD11c+ клетки были DCs (рис. 1 c).
CD45+ клеток (рис. 1A) были разделены на Т-клетки и В-клеток с помощью CD3 и CD19, соответственно. T-клетки были разделены на Т-хелперов (CD4+) и цитотоксические Т-клетки (CD8+). И наконец, CD3–CD19–клетки были построены для количественного определения NK-клетки, используя маркер CD56 (FACS группа 2, рис. 1 d). Количество клеток в каждом стробе количественно и может быть использована для вычисления процент этого типа ячейки всех живых клеток (Таблица 3).
Процент живых клеток могут быть рассчитаны для каждого предмета, позволяя расчета в среднем всех субъектов в группе например худой или ожирением мужчины, отображение обилие конкретных иммунных клеток, то есть, про воспалительных CD11b+ CD11c+ макрофагов в висцеральных AT (рис. 2).
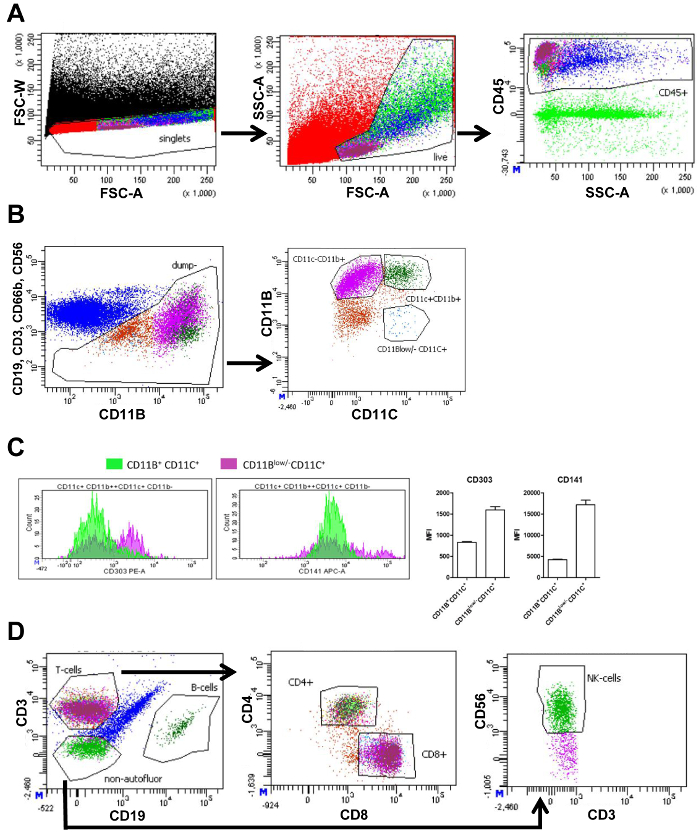
Рисунок 1. СУИМ стробирования стратегия висцеральных жировой ткани. (A) СУИМ участок всех событий (черный) с вперед разброс ширина интенсивности (FSC-W) и области вперед точечной (FSC-A) содержащий ворота для выбора только одной клетки (красный) следуют СУИМ сюжет, основанный на FSC-A и боковых разброс области интенсивности (SSC-A) содержащие ворота, выбор живых клеток (светло-зеленый). Следующий участок с SSC-A и интенсивности флуоресценции CD45 содержит ворота, выбрав все CD45+ (иммунный) клетки (синий). (B) СУИМ участок CD19, CD3, CD66b и CD56 интенсивности флуоресценции против интенсивности флуоресценции CD11b и ворота выбрать все ячейки, которые являются CD19, CD3, CD66b и CD56 отрицательные (коричневый) для дальнейшего разделения населения. Дальнейшее подразделение в следующий сюжет, основанный на интенсивности флуоресценции CD11b и CD11c. Ворота будут отображены, содержащие CD11b+ CD11c+ макрофагов (тёмно-зелёный), CD11b+ CD11c– макрофагов (фиолетовый), а также CD11bнизкая /- CD11c+ дендритных клеток (синий). (C) сумма CD11b+, CD11c+, или CD11bнизкая /- CD11c+ клетки (ось y) отображение их уровней интенсивности флуоресценции (ось x) для CD303 и CD141 и соответствующей количественной оценки среднего интенсивность флуоресценции (МРИ). Участок (D) СУИМ, отображение предыдущих CD45+ населения (синий) на основании CD3 и CD19 интенсивности флуоресценции, содержащие ворота, выбрав Т-клетки (пурпурный), B-клетки (тёмно-зеленый) и не autofluorescent клетки (зеленый) негативные для обоих CD3 и CD19. Следующий сюжет основан на CD4 и CD8 флуоресценции с воротами, выбрав CD4+ (светло-зелёный) и CD8+ (пурпурный) Т-клеток. Идентичные стробирования стратегия используется для подкожной жировой ткани. Идентичные стробирования стратегия используется для подкожной жировой ткани. Эта цифра была изменена от Ваутерс et al. 16 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
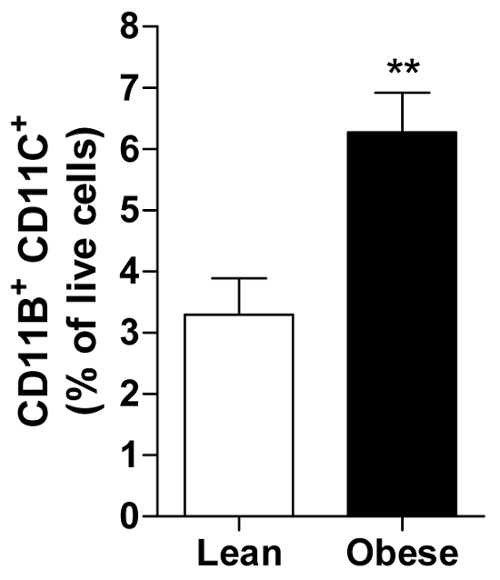
Рисунок 2. Ожирением НДС содержит больше макрофагами провоспалительных. Количество CD11b+ CD11c+ макрофагов, представлены как процент всех живых клеток в НДС худой и ожирением мужчины. Все данные являются средства ± SEM; n = 20 для lean и n = 31 для страдающих ожирением. p ≤ 0.01 против мяса. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Цель | Определение цели | Представить на | Флюрохром | Количество | Клон |
| CD11B | Миелоидные Интегрин маркер | гранулоцитов, моноцитов/макрофагов, дендритные клеткинизкой на всей территории отеля и в естественных клеток-киллеров | BV421 | 2.5 МКЛ | ICRF44 |
| CD19 | Общие клетки B антиген | Развитие b клеток от pro-B клетки Бластоидеи клетки B и B клетки плазмы | FITC | 3 МКЛ | HIB19 |
| CD3 | Общие Т-клеток антиген | Т-лимфоциты, естественных киллеров T и тимоцитов | FITC | 3 МКЛ | UCHT1 |
| CD66B | член раковоэмбрионального антиген (CEA)-как гликопротеин семья | гранулоциты | FITC | 5 МКЛ | G10F5 |
| CD56 | сильно гликозилированного адгезии белка | естественные киллеры и естественных киллеров T | FITC | 5 МКЛ | B159 |
| CD303 | Тип II трансмембранный гликопротеин | дендритные клетки плазмоцитарная | PE | 1 МКЛ | 201A |
| CD141 | Тромбомодулин | моноцитов/макрофаговнизкий, субпопуляции дендритных клеток | APC | 1 МКЛ | M80 |
| CD11C | Тип I трансмембранный гликопротеин; Интегрин αx | моноцитов/макрофагов, дендритные клетки, гранулоцитов, естественные киллеры, подмножество B и T ячеек | БТР Cy7 | 0.5 МКЛ | Bu15 |
| CD45 | Общий лейкоцитарный антиген | все человеческих лейкоцитов, лимфоцитов, моноцитов, гранулоцитов, эозинофилов и тимоцитов | PE-Cy7 | 1 МКЛ | HI30 |
| СУИМ буфер | - | - | - | 7.5 мкл | - |
Таблицы 1. Коктейль для антитела СУИМ pАнель 1 для определения подмножества макрофаги и дендритные клетки населения. Количество антител, в описанный предназначен для анализа одного образца.
| Цель | Определение цели | Представить на | Флюрохром | Количество | Клон |
| CD19 | Общие клетки B антиген | Развитие b клеток от pro-B клетки Бластоидеи клетки B и B клетки плазмы | BV421 | 1 МКЛ | HIB19 |
| CD3 | Общие Т-клеток антиген | Т-лимфоциты, естественных киллеров T и тимоцитов | V500 | 3 МКЛ | UCHT1 |
| CD56 | сильно гликозилированного адгезии белка | естественные киллеры и естественных киллеров T | APC | 5 МКЛ | HCD56 |
| CD4 | Ig надсемейства, тип I трансмембранный гликопротеин | T вспомогательные клетки, тимоцитов, моноцитов/макрофагов, тип II естественных киллеров T | PerCP-Cy5.5 | 1 МКЛ | РПА T4 |
| CD8 | Α-субъединицы связаны дисульфидных bimolecular комплекса | тимоцитов, подмножество естественных клеток-киллеров и цитотоксических Т-клеток | APC-H7 | 2 МКЛ | SK1 |
| CD45 | Общий лейкоцитарный антиген | все человеческих лейкоцитов, лимфоцитов, моноцитов, гранулоцитов, эозинофилов и тимоцитов | PE-Cy7 | 1 МКЛ | HI30 |
| СУИМ буфер | - | - | - | 10 мкл | - |
В таблице 2. Коктейль для антитела СУИМ Группа 2для идентификации T - и B-клеток населения. Количество антител, в описанный предназначен для анализа одного образца.
| Макрофагов группа | ||
| Название ворот | # Клетки | % живых |
| Отдельные ячейки | 183054 | |
| жить | 10477 | 100 |
| CD45 | 4100 | 39,13 |
| дамп– | 771 | 7.36 |
| CD11C– CD11B+ | 430 | 4.1 |
| CD11C+ CD11B+ | 104 | 0.99 |
| CD11C+ CD11Bнизкая /- | 15 | 0,14 |
| Группа Т-клеток, B-клеток, НК клетки | ||
| Название ворот | #Cells | % живых |
| Отдельные ячейки | 34616 | |
| Жить | 3728 | 100 |
| CD45+ | 1589 | 42,62 |
| NK-клетки | 29 | 0.78 |
| CD3+ | 953 | 25.56 |
| CD4+ | 601 | 16.12 |
| CD8+ | 328 | 8.8 |
| CD19+ | 20 | 0.54 |
В таблице 3. Иммунных клеток обилие различных типов клеток в НДС. Количество клеток в каждом стробе и доли различных типов клеток, основанный на общее количество живых клеток.
Обсуждение
Эти методы описывают как изолировать СФДВ от НДС и сидел и количественно относительные количества иммунокомпетентных клеток в этих тканях. Кроме того методы состояния как определить выражение маркеров на типы конкретных клеток.
Проточной цитометрии иммунных клеток ткани – это мощный метод для фенотип иммунологическое состояние тканей. Количественная оценка иммунных клеток тканей может иметь множество приложений. Как описано в результатах, можно сравнить наличие конкретных иммунных клеток между группами больных (например, худой против ожирением). Кроме того также выполняя проточной цитометрии крови же пациентов, могут расследоваться ассоциации между циркулирующих клеток и клеток тканей. С помощью этого приложения мы смогли определить, что определенное подмножество циркулирующих моноцитов связан с про воспалительных CD11C+ жировой ткани макрофагами16.
Корректировок к Протоколу описанные расширит ее применения, как многочисленные имеющиеся флуоресцентные антитела сделать проточной цитометрии очень разносторонний. С различными антитела можно выделить почти все типы клеток и выражение многих маркеров могут быть обнаружены. Кроме того возможна пятно маркеры внутриклеточно, permeabilizing клеточной мембраны позволяют внутриклеточных привязки флуоресцентных антител. Эти характеристики позволяют различия весьма разнообразны макрофагов населения за пределами чрезмерно упрощенной подтипы макрофагов М1 и м2. Помимо измерения поверхностных маркер выражения белки (то есть, цитокинов) могут быть окрашены внутриклеточно предоставление информации о функциональности макрофагов. Кроме того для количественной оценки распространения ставки используются маркеры распространения таких Ki67. Как описано, различие между макрофагами и DCs была основана на уровнях МФО DC маркеров. Общие макрофагов маркер, например CD68 могут быть включены в макрофагов панель (FACS 1). Однако CD68 необходимо быть запятнано внутриклеточно требующих permeabilization клеточной мембраны, которая не является предпочтительным и расширит протокол. Другие маркеры макрофагов, подмножество маркеров CD163 и CD206 или CD11c, интегрированный в панели макрофаг, представленные здесь.
В наших панелей СУИМ, маркер, чтобы отличить живые и мертвые клетки не был включен, который бы предпочтительнее, потому что он позволяет более точное исключение мертвых клеток чем использование FSC и SSC. Часто используемые ДНК пятнать жизнеспособности красители пропидий йодидом (PI) или 4', 6-diamidino-2-phenylindole (DAPI), а также бесплатные Амин, реагируя красителей, таких как LIVE/мертвые поправимо мертвых клеток пятно комплект, который доступен в различных краска цвета. Однако PI и DAPI не могут использоваться при установлении клетки. Как описано в протоколе, окрашивание жизнеспособности поправимо красный LIVE/мертвые мертвые клетки могут быть интегрированы обе панели не затрагивая общей СУИМ, стробирование стратегии.
Кроме того данные выражаются в процентах от живых клеток, что означает, что все данные являются относительными. Только, введя точные, известный количество клеток в проточный цитометр, было бы невозможно определить точное число каждого типа клеток. Приблизительное количество клеток могут рассчитываться после подсчета клеток в СФДВ фракции с помощью Счетной палаты. Однако это число будет должны быть скорректированы на сумму биопсия тканей, используемых для изоляции СФДВ, но это имеет ограничения при сравнении худой с ожирением на. Аналогичный масса ожирением в состоит из менее адипоцитов как они заполнены с липидами и значительно расширили. Это может привести к недооценке числа иммунных клеток, если представлены как количество иммунных клеток на грамм на или за Адипоцит.
В исследованиях на человека включение пациентов обычно делается течение более длительного периода времени, делая стандартизации экспериментальных процедур большое значение. Для сравнения данных цитометрия потоков между пациентами существует несколько вариантов. Как описано в настоящем Протоколе, клетки может быть исправлена до измерения, позволяя анализ нескольких образцов в тот же день. Это также может быть достигнуто путем замораживания СФДВ, прежде чем их окрашивания, который позволяет окрашивание процедуры, чтобы быть равными между всеми образцами, но жизнеспособность клеток могут быть затронуты. И наконец также работающих в настоящем исследовании, являются люминесцентные бусы для установки уровней компенсации, и цитометр отслеживания бусины были использованы два раза в неделю для стандартизации ежедневных измерений цитометр. Этот последний вариант является наиболее эффективным при измерении образцы из исследования, охватывающих длительный период времени.
Ограничивающим фактором для проточной цитометрии в целом является использование флюоресценции. Количество флуоресцентные метки, которые могут быть обнаружены одновременно ограничена из-за наложения спектров выбросов. Однако с смарт СУИМ Группа развития и использования нескольких коктейлей антитела на НДС или СБ образца, этот вопрос можно преодолеть, как описано в настоящем Протоколе. Важным аспектом развития Группа СУИМ является FMO контроля. Используя все антитела группы за исключением одного, могут быть оценены потенциальные уровни аутофлюоресценция при сравнении FMO с полной панели. Это позволяет точные стробирования населения, и эти процедуры должны выполняться при создании новой панели СУИМ. Кроме того новые поколения СУИМ устройств может обнаружить до 50 параметров, позволяя одновременного обнаружения многих характеристик в клетку. Другой вопрос связан с флуоресцентным аспект является аутофлюоресценция клеток, особенно макрофаги. После возбуждения клеток с лазерной СУИМ (главным образом с 488 нм длины волны возбуждения), эти клетки выделяют флуоресцентного сигнала (главным образом < 640 Нм) что может совпадения с выбросов спектры антитела этикетки17,18. С учетом этого, безупречная клетки должны измеряться для определения аутофлюоресценция в каждом канале. С этим знанием должен быть выбран флуорохромов, отображающие сигнала, который превышает сигнал autofluorescent. Этот сигнал фон autofluorescent должны приниматься во внимание при определении стробирования стратегии населения. Таким образом путем применения этого протокола и умный дизайн группа СУИМ возможна в глубине фенотип макрофагов подтипы. Новый собственный AT можно охарактеризовать макрофагов и их функции.
Раскрытие информации
Авторы заявляют отсутствие конфликта интересов.
Благодарности
Мы хотели бы поблагодарить J. ван де Гаар и м. Vroomen (Университет Маастрихт, Нидерланды) за их техническую поддержку. Кроме того мы хотели бы поблагодарить K. Verboven, D. Hansen, J. Jocken, и E. Блаак для предоставления биопсия тканей и крови используется для настройки этого протокола и последующих экспериментов.
Материалы
| Name | Company | Catalog Number | Comments |
| Centrifuge | Hettich Rotanta 460R | 5660 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)-Ham’s F12 | Gibco ThermoFisher | 31330-095 | |
| Collagenase XI from Clostridium histolyticum | Sigma Aldrich | C7657-1g | |
| Collagenase I from Clostridium histolyticum | Sigma Aldrich | C0130-1g | |
| DNAse I from bovine pancreas | Sigma Aldrich | DN25 | |
| NH4Cl | Merck | 1.01145.0500 | |
| Bovine Serum Albumine | Sigma Aldrich | A4503-100 | |
| NaN3 | Merck | 1.06688.0100 | |
| 200 µM syringe Filcons | BD Biosciences | 340613 | |
| 70 µM filter | Greiner Bio-one | 542070 | |
| Fc block / human IgG | Sigma Aldrich | 14506 | |
| Formaldehyde | Merck | 1.04003.2500 | |
| CD11b-BV421 | Biolegend | 301324 | |
| CD19-Fitc | BD Biosciences | 555412 | |
| CD3-Fitc | BD Biosciences | 561807 | |
| CD66b-Fitc | BD Biosciences | 555724 | |
| CD56-Fitc | BD Biosciences | 562794 | |
| CD11c-APC-Cy7 | Biolegend | 337218 | |
| CD45-PE-Cy7 | BD Biosciences | 557748 | |
| CD19-BV421 | Biolegend | 302234 | |
| CD3-V500 | BD Biosciences | 561416 | |
| CD56-APC | Biolegend | 318310 | |
| CD4-PerCP-Cy5.5 | Biolegend | 300528 | |
| CD8-APC-H7 | BD Biosciences | 641400 | |
| CD303-PE | Biolegend | 354204 | |
| CD141-APC | Biolegend | 344106 | |
| FACS-Canto II | BD Biosciences | ||
| 96 v-shape well plate | Greiner Bio-one | 651101 | |
| PBS PH 7.4 | Gibco ThermoFisher | 10010023 | |
| FACS tube 5 mL polystyrene round-bottom tube | Corning | 352052 | |
| IgG from human serum | Sigma Aldrich | I4506 | |
| Anti-Rat Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552844 | |
| Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552843 | |
| LIVE/DEAD Fixable Red Dead Cell Stain Kit | ThermoFisher | L23102 | |
| IKA MS 3 basic shaker | Sigma Aldrich | Z645028-1EA |
Ссылки
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Makki, K., Froguel, P., Wolowczuk, I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013, 139239 (2013).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U S A. 110 (13), 5133-5138 (2013).
- Elgazar-Carmon, V., Rudich, A., Hadad, N., Levy, R. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding. J Lipid Res. 49 (9), 1894-1903 (2008).
- Han, J. M., Levings, M. K. Immune regulation in obesity-associated adipose inflammation. J Immunol. 191 (2), 527-532 (2013).
- Liu, J., et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat Med. 15 (8), 940-945 (2009).
- Nishimura, S., et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 15 (8), 914-920 (2009).
- Koh, Y. J., et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 31 (5), 1141-1150 (2011).
- Peinado, J. R., et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 10 (18), 3356-3366 (2010).
- Leggate, M., et al. Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males. Journal of Applied Physiology. 112 (8), 1353-1360 (2012).
- Divoux, A., et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 97 (9), E1677-E1685 (2012).
- Harford, K. A., Reynolds, C. M., McGillicuddy, F. C., Roche, H. M. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc. 70 (4), 408-417 (2011).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Morris, D. L., Singer, K., Lumeng, C. N. Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states. Curr Opin Clin Nutr Metab Care. 14 (4), 341-346 (2011).
- Wentworth, J. M., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 59 (7), 1648-1656 (2010).
- Wouters, K., et al. Circulating classical monocytes are associated with CD11c+ macrophages in human visceral adipose tissue. Sci Rep. 7, 42665 (2017).
- Duan, M., et al. Distinct macrophage subpopulations characterize acute infection and chronic inflammatory lung disease. J Immunol. 189 (2), 946-955 (2012).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. J Immunol Methods. 386 (1-2), 101-107 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены