Method Article
Cytometry 사용 하 여 인간 지방 조직에서 면역 세포의 특성
* 이 저자들은 동등하게 기여했습니다
요약
이 문서에서는 지방 조직 및 cytometry 사용 하 여 이후 분석에서 면역 세포의 고립에 의해 지방 조직의 면역 세포 콘텐츠를 분석 하는 방법을 설명 합니다.
초록
(에) 예금 피하와 내장 지방 조직에서 면역 세포의 침투 타입 2 당뇨병과 같은 비만 관련 합병증의 발전에 기여 낮은 학년 염증 이끌어 낸다. 양적 및 질적 조사 예금에서 인간의 면역 세포 부분 집합, 교류 cytometry 방법을 개발 했습니다. Stromal 혈관 분수 (SVF), 면역 세포를 포함 하는 피하와 내장 biopsies에 콜라 소화에 의해 격리 됩니다. Adipocytes 원심 분리 후 제거 됩니다. SVF 세포는 여러 막 바운드 마커 면역 세포 하위 구분을 선택 하 고 cytometry 사용 하 여 분석에 대 한 스테인드. 이 방법은, 프로 및 안티 inflammatory macrophage 하위 결과로 수지상 세포 (DCs), B-세포, CD4+ 와 CD8+ T-세포, NK 세포 수 있습니다 감지 하 고 계량. 이 메서드는 AT에 면역 세포 및 각 특정 하위 집합에 대 한 자세한 정보를 제공합니다. 이후에 사용할 수 있는 수많은 형광 항 체는, 우리의 교류 cytometry 방법은 측정 하는 다양 한 다른 세포와 세포내 표식 관심을 조정할 수 있습니다.
서문
비만 저급에 특징은 염증1 과 (부가 가치세, 토)에 내장 및 피하 프로-염증 성 면역 세포의 침투. 부가 가치세에 프로-염증 성 면역 세포의 축적은 유형 2 당뇨병2개발을 위한 기본 위험 요소는 인슐린 저항 이끌어 낸다. 모두 타고 난 및 적응형 면역 시스템의 면역 세포 CD4 세포, 돛대 세포, 호 중구, 비만 발견 된다+ 와 CD8+ T-세포와 B 세포3,,45,6 ,7. 이러한 면역 세포, 내 피 세포, stromal 세포, 체형 창시자, 섬유 아 세포, 및 pericytes, SVF8 구성 되며 AT9프로-염증 성 물질의 주요 소스.
염증 상태는 일반적으로 서쪽 오 점10, immunohistochemistry11, 정량11, 등 기법에 의해 조사 하 고 있다. 그러나, 이러한 기술을, 전체에, adipocytes, 및 SVF를 사용할 때 사용 됩니다. 이 어렵게 금액 및 면역 세포에는 AT의 하위 집합을 결정 합니다. 면역 세포는 다양 한 세포 마커를 정의 하 고 대 식 세포와 같은 그들을 분류. 대 식 세포 기능 및 세포 표면 마커 식12에 중요 한이 표시합니다. 따라서, 그들은 종종 두 대 식 세포 인구로 분류 됩니다: M1 및 m 2. M2 세포는 일반적으로 또는 활성화 된 대 식 세포12,13 불리고, metabolically 정상적인 인간14AT에. 그러나, 비만, 동안 phenotypic 스위치에 발생 합니다 M2 세포에서 m 1 대 식 세포. 이러한 고전적인 M1 세포 CD11C12 를 표현 하 고 왕관 모양의 구조13를 죽은 adipocytes 주위 축적을 활성화. 그것은 그 CD11C+ AT에서 대 식 세포 인슐린 활동을 손상 하 고 뚱뚱한 인간15에 인슐린 저항와 관련. M1 및 m 2는 AT에서 대 식 세포를 식별 하려면 immunohistochemistry 옵션입니다. 이 기술은 조직의 대 식 세포의 위치에 대 한 정보를 제공합니다. 그러나, 그것은 하나의 얼룩에 사용할 수 있는 표시의 수를 제한 합니다. 또한, 그것은 또한 계량 어렵다입니다. 따라서, 부가 가치세 및 토 예금 다른 면역 세포 하위 집합을 조사 하는 교류 cytometry 방법을 개발 했습니다. 이 이렇게 우리가 하나의 흐름 cytometry 분석 셀 당 여러 개의 마커를 사용 하 여 셀의 하위 집합을 정의 하 고 각 하위 집합에 예금에의 숫자를 계산 하는 기회를 제공 합니다.
프로토콜
내장 및 샘플에서 피하는 의료 윤리 위원회 제사 병원, Hasselt, Hasselt 대학, 벨기에, 헬싱키 선언에 따라 승인을 공부에 등록 하는 과목에서 촬영 됐다.
1입니다. 시 약의 준비
- 콜라 솔루션
- 디졸브 1g 콜라의 인산 염의 10 ml에서 나 버퍼링 식 염 수 (PBS, 칼슘 및 마그네슘) 100 mg/mL 재고 솔루션. 200 µ L aliquots를 준비 하 고-20 ° c.에 저장
- 100 mg/mL 재고 솔루션을 만들기 위해 PBS의 10 mL에 콜라 XI의 1 g을 분해. 200 µ L aliquots를 준비 하 고-20 ° c.에 저장
- 10 mg DNase의 분해 10 mg/mL 재고 솔루션을 만들기 위해 PBS의 10 mL에 나. 180 µ L aliquots를 준비 하 고-20 ° c.에 저장
- 추가 100 µ L 콜라 나 (100mg/mL), 100 µ L 콜라 사이 (100mg/mL), 및 90 µ L DNase I (10 mg/mL) 10ml DMEM 햄의 F12. 각 격리에 대 한 신선한 콜라 솔루션을 확인 합니다.
- 적혈구 세포의 용 해 버퍼
- 0.84 g NH4Cl 초순 물 100 mL에 용 해.
- 사용 하기 전에 7.4에서 pH를 설정 합니다. 4 ° c.에 유리 플라스 크에 저장
- 적혈구 세포의 용 해 버퍼를 사용 하기 전에 얼음에 놓습니다.
- FACS 버퍼
- 0.5% BSA PBS를 PBS의 100 mL에 0.5 g 소 혈 청 알 부 민 (BSA)를 용 해.
- 10mm 할머니3 0.5% BSA PBS를 100 mL 0.5% BSA PBS에 할머니3 의 65 밀리 그램을 디졸브. 4 ° c.에 유리 플라스 크에 저장소 솔루션
- 사용 하기 전에 얼음에 장소 FACS 버퍼입니다.
주의: NaN3 은 매우 독성이 있습니다. 증기 두건 및 안전 안경과 NaN3을 처리 하는 동안 보호 장갑을 착용 합니다.
- 인간 IgG 블록
- 10 ml PBS 1 mg/mL를 인간 IgG의 10 mg을 디졸브. 100 µ L aliquots를 준비 하 고-20 ° c.에 저장
- 사용 하기 전에 얼음에 인간 IgG 블록을 배치 합니다.
2입니다. AT에서 SVF의 격리
- 잘라 1 g의 생 검에서 작은 조각 (± 2 m m2) 메스와 전송으로 50 mL 원심 분리기 튜브 (예, 팔 콘 튜브). 각 샘플에서 콜라 솔루션의 10 mL를 추가 합니다.
참고: 튜브의 뚜껑 완전히 닫고 다시 뚜껑 ¼ 회전을 설정 합니다. - 부드러운 진동 (60 사이클/min)에서 물을 욕조에 37 ° C에서 60 분 동안 품 어.
- 200 µ M 필터 결과 정지를 필터링 하 고 새로운 50 mL 원심 분리기 튜브에서 샘플을 수집 합니다. 7 mL PBS 위에 필터를 헹 구 고 모든 셀에 필터를 추가 합니다.
- 4 ° c.에서 5 분 동안 280 x g에서 샘플을 원심
- Pipetting으로 부동 체형 분수를 제거 합니다. 셀 펠 릿은 SVF입니다.
참고: SVF를 체형 분수를 제거 합니다. 이 PBS와 하지 부동 adipocytes 제거할 것입니다 때문에 예제에서 전체 팁 잠수를 하지 마십시오. - 콜라를 제거, 정지 70 µ M 필터와 필터와 5 mL PBS, 필터 린스와 4 ° c.에서 5 분 동안 280 x g에서 샘플 원심 PBS의 5 ml에서는 SVF를 resuspend
- 상쾌한을 제거 하 고 적혈구 세포의 용 해 버퍼의 3 mL에 펠 릿을 resuspend.
- 얼음에 5 분 동안 품 어. 부 화 후 PBS의 7 mL를 추가 합니다.
- 4 ° c.에서 5 분 동안 280 x g에서 샘플을 원심
3. 교류 Cytometry 분석을 위한 SVF의 얼룩
- 90 µ L 4 ° C FACS 버퍼에 셀 펠 릿을 녹이 고 1 mg/mL 인간 IgG 블록의 10 µ L을 추가. V 자형 96 잘 접시의 2 우물에 세포 현 탁 액을 나눕니다. 얼음에 접시를 놓고 15 분 동안 품 어 인간 IgG 차단 하 게 합니다.
- 원심 4 ° c.에 280 x g로 5 분 동안 접시를 씻어 각 샘플 100 µ L FACS 버퍼를 추가 접시를 활용 하지 않고 한 부드러운 움직임에 거꾸로 접시를 팁으로 상쾌한을 제거 합니다.
참고: 거꾸로 접시를 유지 하는 동안 티슈로 접시 위에서 어떤 남아 있는 액체를 제거 해야 합니다. - 표 1 과 표 2에 설명 된 대로 대 식 세포 및 DC 하위 집합 (FACS 패널 1) 및 하위 집합 T와 B 세포 (FACS 패널 2)에 대 한 항 체 칵테일 준비. 표 1 및 표 2 에 설명 된 볼륨 항 체 농도 최적화 한 후 선택 하 고 충분 한 부가 가치세 또는 토 샘플.
참고: FACS 패널 1를 사용 하 여 CD303 및 CD141 마커 확인 그 CD11C+ CD11B낮은 세포는 Dc. 그러나, 이러한 마커 얼룩 라이브/죽은 포함 하는 패널에서 제외 하는 것이 좋습니다. 라이브/죽은 고칠 수 레드 죽은 세포 얼룩 키트 생존 얼룩 패널 PE 채널 1에서에서 CD303를 제외 되지 것입니다 사용 하는 경우와 두 FACS 패널 1과 2를 결합할 수 있습니다. 제조업체의 지침에 따라 얼룩 생존 능력을 수행 합니다. - 29.5 µ L 항 체 FACS 패널 1, 칵테일에 펠 릿과 칵테일 FACS 패널 2 23 µ L 항 체를 resuspend. 얼음에 어둠 속에서 30 분 동안 품 어.
- 각 우물을 150 µ L FACS 버퍼를 추가 하 고 두 번째 세척 단계를 수행 하려면 셀 펠 릿 resuspend. 280 x g와 4 ° C에서 5 분 동안 접시를 원심 거꾸로 접시를 팁으로 상쾌한을 제거 합니다.
- 세포를 해결 하기 위해 각 잘에 150 µ L 1% 포름알데히드 솔루션을 추가 합니다. P200 피 펫과 pipetting으로 각 우물에서 해당 FACS 관 세포 현 탁 액을 전송. 어두운 최대 7 일에에서 4 ° C에서 FACS 튜브를 저장 합니다.
참고: 직접 측정도 가능 하다입니다. 각 잘 1% 포름알데히드 대신에 150 µ L FACS 버퍼를 추가 하 고 해당 FACS 관에 P200 피 펫과 pipetting 셀 전송 셀 분석.
주의: 포름알데히드는 매우 독성이 있다. 흡입을 방지 하 고 장갑과 보호를 위한 안전 유리를 착용 하는 증기 두건에서 작업 하는 동안 포름알데히드 솔루션을 준비 합니다.
4. 교류 Cytometry 분석
- 첫 번째 측정 하기 전에 앞으로 산포 (FSC) 및 측면 살포 (SSC)를 설정 하는 흠 없는 부정적인 컨트롤을 사용 합니다. 관심의 모든 인구는 FSC 그리고 SSC 그래프에 표시 되 고 파편과 라이브 셀을 구별 할 수 있다 그래야 제조업체의 지침에 따라 교류 cytometer의 전압을 조정 합니다.
- 항 체 캡처 구슬 제조 업체의 프로토콜을 따르고 다 색 보상 분석을 수행 합니다.
- 1 (FMO) 컨트롤 마이너스 형광 항 체 혼합 하 여 준비 하지만 혼합에서 한 항 체를 제외. 이렇게 모든 항 체, FACS 패널 1, 8 항 체 믹스 및 FACS 패널 2 6 항 체 믹스 만들기. 이러한 FMO 항 체 믹스 얼룩 SVF 이전이 프로토콜에서 설명 된 대로 사용 됩니다.
- FMO의 모든 컨트롤을 측정 하 고 FMO 컨트롤 기반 제어 전략을 설정 합니다. FMO 컨트롤을 사용 하 여 셀의 가능한 자동 형광을 검출 하기 위하여.
참고: 혼합에서 한 항 체를 제거 하 여이 채널에서 검색 된 모든 형광 수준 배경/autofluorescent 신호입니다. 따라서, 다른 FMO를 비교 하 여 제어 FACS 결과, 게이츠는 gatings는 긍정적인 세포에 기반 하 고 자동 형광에 기반 하지 않은 특정 인구에 그릴 수 있습니다. - 소용돌이 FACS 교류 cytometer에서 그들을 배치 하 고 측정을 시작 하기 전에 800 rpm에 튜브.
참고: 50000 이벤트 라이브 게이트에서의 최소는 충분 한 세포 각 부분 모집단에서 측정 되도록 것이 좋습니다.
결과
부가 가치세에서 고립 되 고 토 SVF cytometry 사용 하 여 측정 했다. 교류 cytometry 측정 다른 세포 인구 세포 마커 (그림 1A 및 1B)에 따라 보여주는 플롯을 생성 합니다. 첫째, 그려서 전달 폭 (FSC-W)를 피해 및 피해 지역 (FSC-A), 셀 집계 추가 분석에서 낮은 FSC-W.로 단일 셀 게이팅에 의해 삭제 될 수 있다 앞으로 다음, 라이브 셀이 선택 된, 그리고 정확한 크기와 복잡 한 FSC를 사용 하 여 셀을 게이팅 하 여 세포질 파편은 제외-고 측면 피해 지역 (SSC-A), 각각. 죽은 세포는 작은 명료한 인구로 따라서 볼 수 작은 FSC-. 다음, 면역 세포 (패널 1과 2, 그림 1A) CD45 팬 백혈구 마커의 사용에 의해 선정 되었다. 대 식 세포를 분석, T-세포 (CD3), B-세포 (CD19), 호 중구 등 다른 면역 세포 (CD66b+ CD11b+), NK 세포 (CD56)이이 세포를 대상으로 독특한 항 체를 사용 하 여 있지만 같은 추가 분석에서 제외 했다 형광 색소입니다. 나머지 셀의 추가 하위 CD11b 및 CD11c 식에 근거 했다. 이 결과 다음 인구: CD11b+ CD11c+ 세포, CD11b+ CD11c- 대 식 세포, 및 CD11b낮은 /- CD11c+ Dc (FACS 패널 1, 그림 1B). 평균 형광 강도 (MFI)의 측정 허용 CD303 식의 정량화 (plasmacytoid DC 마커) 및 CD141 (DC 표식), CD11b에+ CD11c+ 세포와 CD11b낮은 /- CD11c+ Dc. 표현의 두 이들이 마커 했다 CD11b에서 높은낮은 /- CD11c+ 확인 세포는 CD11b낮은 /- CD11c+ 세포 했다 Dc (그림 1C).
CD45+ 세포 (그림 1A)는 T-세포와 B 세포로 분할 되었다 CD3와 CD19, 각각 사용 하 여. T-세포 T 보조 세포 세분화 했다 (CD4+)와 세포 독성 T-세포 (CD8+). 마지막으로, CD3-CD19-셀 CD56 마커를 사용 하 여 NK 세포를 척도를 표시 했다 (FACS 패널 2, 그림 1D). 각 게이트 셀 수 정량은 고이 세포 유형의 모든 살아있는 세포 (표 3)의 비율을 계산 하는 데 사용 될 수 있습니다.
모두의 평균의 계산을 허용 하는 각 과목의 그룹 예 상체 또는 뚱뚱한 남자는 특정 면역 세포, 즉, 프로-염증 성 CD11b의 풍부를 표시 과목에 대 한 살아있는 세포의 백분율을 계산할 수 있습니다+ CD11c+ 내장 AT에서 대 식 세포 (그림 2).
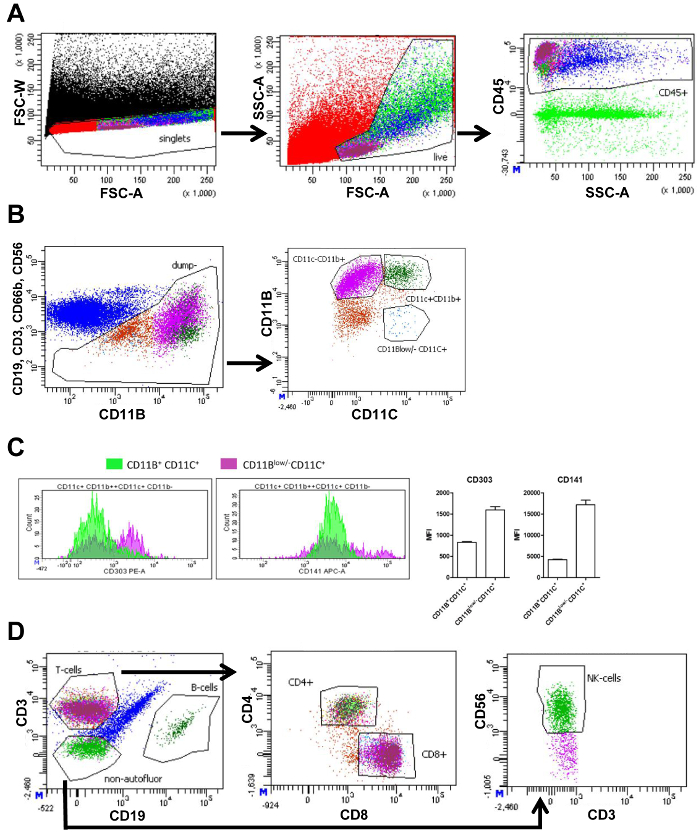
그림 1입니다. 내장 지방이 많은 직물의 전략 게이팅 FACS. 앞으로 분산형 폭 강도 (FSC-W)와 앞으로 피해 지역 강도 (FSC-A)만 단일 셀 선택 (레드) FACS 음모 뒤 게이트 포함 된 모든 이벤트 (블랙)의 (A) FACS 줄거리 FSC-A와 측면 분산형 영역 강도에 따라 (SSC-A) 라이브 셀 (옅은 녹색) 선택 게이트 포함 하. SSC-A와 다음 플롯 CD45 형광 강도 포함 모든 CD45 선택 게이트+ (면역) 세포 (파란색). (B) FACS CD11b 형광 강도, 그리고 게이트 CD19, CD3, CD66b, 및 CD56 부정적인 모든 셀 선택 (브라운) 인구에 더 부 대 CD19, CD3, CD66b, 및 CD56 형광 강도 플롯. CD11b 및 CD11c 형광 강도에 따라 다음 작에서 더 하위 단위. 게이츠는 사용자에 게 표시 됩니다 CD11b를 포함 하는+ CD11c+ 대 식 세포 (짙은 녹색), CD11b+ CD11c (보라색),- 대 식 세포 그리고 CD11b낮은 /- CD11c+ 수지상 세포 (파란색). (C) 금액의 CD11b+, CD11c+, 또는 CD11b낮은 /- CD11c+ 셀 (y 축) CD303와 CD141, 그리고 의미의 해당 정량화에 대 한 형광 강도 (x 축)의 그들의 정도 표시 형광 강도 (MFI)입니다. (D) FACS 플롯 이전 CD45 표시+ 게이츠 두 CD3 T-세포 (마젠타), B-세포 (짙은 녹색), 및 비 autofluorescent 셀 (녹색) 부정적인 선택 포함 된 CD3와 CD19 형광 강도 기반으로 하는 인구 (블루) 그리고 CD19입니다. 다음 플롯 기반 c d 4와 CD8 형광 CD4 선택 문을 가진+ (밝은 녹색)과 CD8+ (마젠타) T 세포. 동일한 제어 전략은 피하 지방 조직에 사용 됩니다. 동일한 제어 전략은 피하 지방 조직에 사용 됩니다. 이 그림 Wouters 그 외 여러분 에서 수정 되었습니다. 16 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
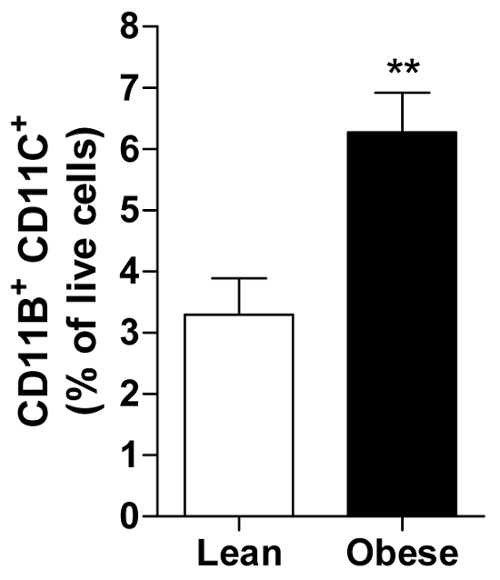
그림 2입니다. 비만 vAT 포함 더 많은 프로-염증 성 세포. CD11b 양의+ CD11c+ 세포 야 위 고 뚱뚱한 남자의 통에 모든 살아있는 세포의 비율으로. 모든 데이터는 의미 ± SEM; n = 20 및 n에 대 한 31 = 비만. 엎드려 서 대p ≤ 0.01 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 대상 | 정의 대상 | 에 제시 | 형광 색소 | 수량 | 클론 |
| CD11B | 골수성 integrin 마커 | granulocytes, monocytes/대 식 세포, 수지상 세포낮은 및 자연 킬러 세포 | BV421 | 2.5 Μ L | ICRF44 |
| CD19 | 일반적인 B 세포 항 원 | Blastoid B 세포 및 플라스마 B 세포에서 프로-B 세포 b 세포 개발 | Fitc | 3 Μ L | HIB19 |
| CD3 | 일반적인 T 세포 항 원 | 자연적인 살인자 T 세포, T 세포, thymocytes | Fitc | 3 Μ L | UCHT1 |
| CD66B | carcinoembryonic 항 원 (CEA)의 회원-당단백질 가족 처럼 | granulocytes | Fitc | 5 Μ L | G10F5 |
| CD56 | 무 겁 게 당화 접착 단백질 | 자연 킬러 세포 그리고 자연적인 살인자 T 세포 | Fitc | 5 Μ L | B159 |
| CD303 | 유형 II 막 횡단 당단백질 | plasmacytoid 수지상 세포 | PE | 1 Μ L | 201A |
| CD141 | thrombomodulin | monocytes/세포낮은, 수지상 세포의 부분 모집단 | APC | 1 Μ L | M80 |
| CD11C | 유형 I 막 횡단 당단백질; integrin αx | monocytes/대 식 세포, 수지상 세포, granulocytes, 자연 킬러 세포, B와 T 세포의 부분 집합 | APC-Cy7 | 0.5 Μ L | Bu15 |
| CD45 | 일반적인 백혈구 항 원 | 모든 인간의 백혈구 림프 톨, monocytes, granulocytes, 호 산 구는, thymocytes 등 | PE-Cy7 | 1 Μ L | HI30 |
| FACS 버퍼 | - | - | - | 7.5 µ l | - |
표 1입니다. 항 체에 대 한 칵테일 FACS panel 하위 집합 대 식 세포와 수지상 세포 인구를 식별 하는 1. 설명 하는 항 체의 한 샘플의 분석입니다.
| 대상 | 정의 대상 | 에 제시 | 형광 색소 | 수량 | 클론 |
| CD19 | 일반적인 B 세포 항 원 | Blastoid B 세포 및 플라스마 B 세포에서 프로-B 세포 b 세포 개발 | BV421 | 1 Μ L | HIB19 |
| CD3 | 일반적인 T 세포 항 원 | 자연적인 살인자 T 세포, T 세포, thymocytes | V500 | 3 Μ L | UCHT1 |
| CD56 | 무 겁 게 당화 접착 단백질 | 자연 킬러 세포 그리고 자연적인 살인자 T 세포 | APC | 5 Μ L | HCD56 |
| CD4 | Superfamily Ig, 유형 I 막 횡단 당단백질 | Monocytes/대 식 세포, thymocytes, T 도우미 셀 입력 II 자연적인 살인자 T 세포 | PerCP-Cy5.5 | 1 Μ L | RPA T4 |
| CD8 | 아 황산 연결 된 분자 복합물의 α 소 단위 | 세포 독성 T 세포, thymocytes, 자연 킬러 세포의 부분 집합 | APC H7 | 2 Μ L | SK1 |
| CD45 | 일반적인 백혈구 항 원 | 모든 인간의 백혈구 림프 톨, monocytes, granulocytes, 호 산 구는, thymocytes 등 | PE-Cy7 | 1 Μ L | HI30 |
| FACS 버퍼 | - | - | - | 10 µ l | - |
표 2입니다. 항 체에 대 한 칵테일 FACS 패널 2T 및 B 세포 인구를 식별 하. 설명 하는 항 체의 한 샘플의 분석입니다.
| 대 식 세포 패널 | ||
| 게이트 이름 | # 셀 | 라이브의 % |
| 단일 셀 | 183054 | |
| 라이브 | 10477 | 100 |
| CD45 | 4100 | 39.13 |
| 덤프- | 771 | 7.36 |
| CD11C- CD11B+ | 430 | 4.1 |
| CD11C+ CD11B+ | 104 | 0.99 |
| CD11C+ CD11B낮은 /- | 15 | 0.14 |
| T-세포, B 세포, NK 셀 패널 | ||
| 게이트 이름 | #Cells | 라이브의 % |
| 단일 셀 | 34616 | |
| 라이브 | 3728 | 100 |
| CD45+ | 1589 | 42.62 |
| NK 세포 | 29 | 0.78 |
| CD3+ | 953 | 25.56 |
| CD4+ | 601 | 16.12 |
| CD8+ | 328 | 8.8 |
| CD19+ | 20 | 0.54 |
테이블 3입니다. 부가 가치세에 다른 종류의 면역 세포 풍부. 셀 각 게이트에서의 수와는 다른 종류의 세포 백분율 살아있는 세포의 총 금액에 따라.
토론
이러한 방법을 부가 가치세에서 SVF를 분리 하는 방법을 설명 하 고 앉아서이 조직 내의 면역 세포의 상대적인 양을 계량. 또한, 메서드 상태 마커 특정 세포 유형에의 식을 결정 하는 방법.
Cytometry 조직 면역 세포의 표현 형의 조직 면역 상태에 강력한 기술입니다. 조직 면역 세포의 정량화는 많은 응용 프로그램을 가질 수 있습니다. 결과에 설명 된 대로 (예를 들어, 상체 비만 대) 환자의 그룹 사이 특정 면역 세포의 존재를 비교 가능 하다. 더하여, 또한 동일한 환자의 혈액에서 cytometry 수행, 순환 세포 및 조직 세포 사이 협회를 조사 수 있습니다. 이 응용과 더불어 우리 monocytes 순환의 특정 하위 집합은 연관-프로-염증 성 CD11C 확인할 수 있었다+ 지방 조직 세포16.
설명된 프로토콜을 조정 cytometry 수많은 사용 가능한 형광 항 체에 게 매우 다양 한 응용 프로그램을 확장 됩니다. 다른 항 체와 함께 거의 모든 셀 유형을 구분할 수 있습니다 그리고 많은 마커의 식 검출 될 수 있다. 또한, 형광 항 체의 세포내 바인딩 수 있도록 세포 막 permeabilizing 여 침 마커 얼룩을 가능 하다. 이러한 특성 지나치게 단순화 된 M1 및 M2 macrophage 하위 넘어 매우 다양 한 대 식 세포 인구의 구별 하실 수 있습니다. 표면 마커 식의 측정, 외 단백질 (즉, cytokines) 침 대 식 세포 기능에 정보를 제공 하는 얼룩이 수 있다. 또한, Ki67 같은 확산 마커는 확산 속도 계량 하는 데 사용 됩니다. 설명, 대 식 세포와 Dc 사이 구별 DC 마커의 MFI 수준에 근거 했다. 일반적인 대 식 세포 마커, CD68 등 macrophage 패널 (FACS 패널 1)에 통합할 수 있습니다. 그러나, CD68이 바람직합니다 하 고 프로토콜을 확장할 것 이다 세포 막의 침 필요한 permeabilization 스테인드 될 필요가 있다. 다른 대 식 세포 마커는 CD163 및 CD206 등 CD11c, 여기에 제시 된 macrophage 패널에 후자 되 고 통합 하위 집합 마커.
우리의 FACS 패널에서 라이브 하 고 죽은 세포를 구별 하는 마커는 포함, FSC 그리고 SSC의 사용 보다는 죽은 세포의 더 정확한 배제를 허용 하기 때문에 더 좋을 것 이다. 자주 사용 되는 DNA 얼룩 생존 염료 propidium 요오드 화물 (PI) 또는 4' 6-diamidino-2-phenylindole (DAPI) 뿐 아니라, 자유로운 아민 반응 라이브/죽은 고칠 수 죽은 세포 얼룩 키트, 같은 염료는 다른 염료 색상에서 사용할 수 있습니다. 그러나, PI와 DAPI 사용할 수 없습니다 셀을 수정 하는 경우. 프로토콜에 설명 된 대로 라이브/죽은 고칠 수 레드 죽은 세포 생존 얼룩 수 있습니다 통합할 수 두 패널 전략 게이팅 전반적인 FACS를 영향을 주지 않고.
또한, 데이터는 라이브 셀 모든 데이터는 상대적 의미의 백분율로 표현 됩니다. 만 입력 하 여 일치, 교류 cytometer로 셀의 수를 알려진 그것 것입니다 각 세포 종류의 정확한 숫자를 확인할 수 있습니다. 셀의 대략적인 수 세 챔버를 사용 하 여 SVF 분수에 셀 계산 후 계산 수 있습니다. 그러나,이 숫자는 SVF를 격리 하는 데 사용 하는 생 검 조직 양을 조정 해야 했 상체에 비만을 비교할 때이 제한이 있다. 유사한 질량의 비만 덜 adipocytes 지질으로 채워진다 고 크게 확대 구성 되어 있습니다. 이 면역 세포에의 그램 당 또는 당 체형의 수로 제시 하는 경우 면역 세포 수의 과소 발생할 수 있습니다.
인간 연구에서 환자의 포함 매우 중요 실험 절차의 표준화를 만드는 시간의 긴 기간 동안 일반적으로 수행 됩니다. 환자 간에 교류 cytometry 데이터의 비교에 대 한 몇 가지 옵션이 있습니다. 이 프로토콜에서 설명 된 대로 셀 같은 날에 여러 샘플의 분석을 허용 하는 측정 하기 전에 해결할 수 있습니다. 이 전에 모든 샘플 사이 얼룩 프로시저 수 있습니다 그들을 얼룩, 세포의 생존 능력에 영향을 받을 수는 SVF를 동결 하 여 얻을 수 있습니다. 마지막으로, 또한이 연구에서 채택, 형광 구슬 보상 수준, 설치 그리고 cytometer 추적 비즈는 cytometer의 매일 측정 표준화 격주 사용 했다. 이 마지막 옵션은 가장 효율적인 때 오랜 기간에 걸친 연구에서 샘플을 측정.
Cytometry에 대 한 제한 요소는 일반적으로 형광의 사용 이다. 동시에 검출 될 수 있는 형광 레이블 수 방출 스펙트럼에 중복으로 인해 제한 됩니다. 그러나, 스마트 FACS 패널 개발 및 부가 가치세 또는 토 샘플 당 여러 항 체 칵테일의 사용이이 문제 극복할 수 있습니다이 프로토콜에서 설명 된 대로. FACS 패널 개발의 중요 한 측면은 FMO 컨트롤. 하나를 제외 하 고 패널의 모든 항 체를 사용 하 여 전체 패널 FMO 비교할 때 잠재적인 autofluorescence 레벨을 감상할 수 있습니다. 이 인구의 정확한 게이팅 있으며 새로운 FACS 패널을 설정할 때이 절차를 수행 해야 합니다. 또한, FACS 장치의 새로운 세대 셀 마다 많은 특성의 동시 탐지를 허용 하는 최대 50 매개 변수를 검색할 수 있습니다. 형광 측면에 관련 된 또 다른 문제는 세포, 특히 세포의 autofluorescence. (488 nm 파장 여기)와 주로 FACS 레이저 셀의 여기, 후이 세포 형광 신호를 방출 (주로 < 640 nm) 그 수는 항 체의 방출 스펙트럼과 중복 레이블17,18. 이 계정, 흠 없는 세포 각 채널에 autofluorescence를 결정 하기 위해 측정 되어야 한다. 이 지식으로 형광 선정 되어야 한다 autofluorescent 신호를 초과 하는 신호 강도 표시 하는. 이 autofluorescent 배경 신호는 인구 제어 전략을 결정할 때 계정에 취해야 한다. 따라서이 프로토콜 및 지능형 FACS 패널 디자인의 응용 프로그램에 의해 그것은 깊이 형 macrophage 하위에 수 있습니다. 새로운 고유에 대 식 세포 및 그들의 기능을 나타낼 수 있다.
공개
저자는 관심 없음 충돌 선언합니다.
감사의 말
우리는 그들의 기술 지원에 대 한 제이 밴 드 Gaar M. Vroomen (마스트리히트 대학, 네덜란드)를 감사 하 고 싶습니다. 또한, 우리는 K. Verboven, D. 한 센, J. Jocken, 감사 하 고 싶습니다 그리고 E. Blaak 제공 하는 혈액과 조직 생 검이이 프로토콜 및 후속 실험 설정에 대 한 사용.
자료
| Name | Company | Catalog Number | Comments |
| Centrifuge | Hettich Rotanta 460R | 5660 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)-Ham’s F12 | Gibco ThermoFisher | 31330-095 | |
| Collagenase XI from Clostridium histolyticum | Sigma Aldrich | C7657-1g | |
| Collagenase I from Clostridium histolyticum | Sigma Aldrich | C0130-1g | |
| DNAse I from bovine pancreas | Sigma Aldrich | DN25 | |
| NH4Cl | Merck | 1.01145.0500 | |
| Bovine Serum Albumine | Sigma Aldrich | A4503-100 | |
| NaN3 | Merck | 1.06688.0100 | |
| 200 µM syringe Filcons | BD Biosciences | 340613 | |
| 70 µM filter | Greiner Bio-one | 542070 | |
| Fc block / human IgG | Sigma Aldrich | 14506 | |
| Formaldehyde | Merck | 1.04003.2500 | |
| CD11b-BV421 | Biolegend | 301324 | |
| CD19-Fitc | BD Biosciences | 555412 | |
| CD3-Fitc | BD Biosciences | 561807 | |
| CD66b-Fitc | BD Biosciences | 555724 | |
| CD56-Fitc | BD Biosciences | 562794 | |
| CD11c-APC-Cy7 | Biolegend | 337218 | |
| CD45-PE-Cy7 | BD Biosciences | 557748 | |
| CD19-BV421 | Biolegend | 302234 | |
| CD3-V500 | BD Biosciences | 561416 | |
| CD56-APC | Biolegend | 318310 | |
| CD4-PerCP-Cy5.5 | Biolegend | 300528 | |
| CD8-APC-H7 | BD Biosciences | 641400 | |
| CD303-PE | Biolegend | 354204 | |
| CD141-APC | Biolegend | 344106 | |
| FACS-Canto II | BD Biosciences | ||
| 96 v-shape well plate | Greiner Bio-one | 651101 | |
| PBS PH 7.4 | Gibco ThermoFisher | 10010023 | |
| FACS tube 5 mL polystyrene round-bottom tube | Corning | 352052 | |
| IgG from human serum | Sigma Aldrich | I4506 | |
| Anti-Rat Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552844 | |
| Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552843 | |
| LIVE/DEAD Fixable Red Dead Cell Stain Kit | ThermoFisher | L23102 | |
| IKA MS 3 basic shaker | Sigma Aldrich | Z645028-1EA |
참고문헌
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Makki, K., Froguel, P., Wolowczuk, I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013, 139239 (2013).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U S A. 110 (13), 5133-5138 (2013).
- Elgazar-Carmon, V., Rudich, A., Hadad, N., Levy, R. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding. J Lipid Res. 49 (9), 1894-1903 (2008).
- Han, J. M., Levings, M. K. Immune regulation in obesity-associated adipose inflammation. J Immunol. 191 (2), 527-532 (2013).
- Liu, J., et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat Med. 15 (8), 940-945 (2009).
- Nishimura, S., et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 15 (8), 914-920 (2009).
- Koh, Y. J., et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 31 (5), 1141-1150 (2011).
- Peinado, J. R., et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 10 (18), 3356-3366 (2010).
- Leggate, M., et al. Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males. Journal of Applied Physiology. 112 (8), 1353-1360 (2012).
- Divoux, A., et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 97 (9), E1677-E1685 (2012).
- Harford, K. A., Reynolds, C. M., McGillicuddy, F. C., Roche, H. M. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc. 70 (4), 408-417 (2011).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Morris, D. L., Singer, K., Lumeng, C. N. Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states. Curr Opin Clin Nutr Metab Care. 14 (4), 341-346 (2011).
- Wentworth, J. M., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 59 (7), 1648-1656 (2010).
- Wouters, K., et al. Circulating classical monocytes are associated with CD11c+ macrophages in human visceral adipose tissue. Sci Rep. 7, 42665 (2017).
- Duan, M., et al. Distinct macrophage subpopulations characterize acute infection and chronic inflammatory lung disease. J Immunol. 189 (2), 946-955 (2012).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. J Immunol Methods. 386 (1-2), 101-107 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유