Method Article
Caracterização de células imunes no tecido adiposo humano usando citometria de fluxo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo descreve um método para analisar o conteúdo da célula imune do tecido adiposo por isolamento de células do sistema imunológico de tecido adiposo e posterior análise utilizando a citometria de fluxo.
Resumo
Infiltração de células do sistema imunológico no tecido adiposo subcutâneo e visceral (AT) depósitos leva a uma inflamação de baixo grau contribuindo para o desenvolvimento de complicações associadas a obesidade como a diabetes tipo 2. Para quantitativamente e qualitativamente investigar os subconjuntos de célula imunológica em humanos em depósitos, desenvolvemos uma abordagem de citometria de fluxo. A fração do estroma vascular (SVF), que contém as células do sistema imunológico, é isolada da subcutânea e visceral em biópsias por digestão de colagenase. Adipócitos são removidos após a centrifugação. As células SVF estão manchadas por vários marcadores de membrana-limite selecionado para diferenciar entre os subconjuntos de células imunes e analisados utilizando citometria de fluxo. Como resultado desta abordagem, pro e anti angentes macrófago subconjuntos, células dendríticas (DCs), células B, CD4+ e CD8+ -células T, células NK podem ser detectadas e quantificadas. Este método fornece informações detalhadas sobre as células imunes no AT e a quantidade de cada subconjunto específico. Uma vez que existem inúmeros anticorpos fluorescentes disponível, nossa abordagem de citometria de fluxo pode ser ajustada para medir vários outros marcadores celulares e intracelulares de interesse.
Introdução
A obesidade é caracterizada com baixa qualidade AT inflamação1 e infiltração de células imunes pró-inflamatórias em visceral e subcutânea em (IVA, sentou-se). Acúmulo de células imunes pro-inflamatórios no caldeirão leva à resistência à insulina, que é um fator de risco principal para desenvolver o tipo 2 diabetes2. Células do sistema imunológico do sistema imune inato e adaptativo são encontradas no AT obeso, tais como os mastócitos, macrófagos, neutrófilos, CD4+ e CD8+ células T e células B3,4,5,6 ,7. Estas células do sistema imunológico, juntamente com as células endoteliais, células do estroma, progenitores dos adipócitos, fibroblastos e pericitos, constituem o SVF8 e são a principal fonte de substâncias pró-inflamatórias do AT9.
O status inflamatório da AT é comumente investigado por técnicas incluindo borrão ocidental10qPCR11e imuno-histoquímica11. No entanto, ao usar essas técnicas, o AT todo, adipócitos e SVF, é usado. Isso torna difícil determinar a quantidade e subconjuntos de células do sistema imunológico presentes no AT. As células imunes têm vários marcadores de célula para definir e categorizá-los, tais como os macrófagos. Os macrófagos mostram heterogeneidade significativa em tanto a função e a célula de expressão do marcador de superfície12. Portanto, eles frequentemente são categorizados em duas populações de macrófagos: M1 e M2. Os macrófagos m2 são geralmente chamados de macrófagos alternativamente ativados12,13 e residem no AT do seres humanos metabolicamente normais, magra14. No entanto, durante a obesidade, um interruptor fenotípico ocorre de macrófagos M2 aos macrófagos M1. Estas classicamente ativado M1 macrófagos expressam CD11C12 e se acumulam em torno de adipócitos mortos para formar estruturas semelhantes a coroa13. Tem sido demonstrado que CD11C+ macrófagos no AT prejudicar a ação da insulina e estão associados com a resistência à insulina em humanos obesos15. Para identificar os macrófagos M1 e M2 no AT, imuno-histoquímica é uma opção. Esta técnica dá informações sobre a localização dos macrófagos no tecido. No entanto, que vai limitar o número de marcadores que podem ser usados em uma coloração. Além disso, também é difícil de quantificar. Portanto, para investigar os subconjuntos de células imunes diferentes no IVA e depósitos via satélite, nós desenvolvemos uma abordagem de citometria de fluxo. Esta abordagem dá-na oportunidade de usar vários marcadores por célula com análise de citometria de um fluxo definir subconjuntos de célula e contar os números de cada subconjunto presente nos depósitos de AT.
Protocolo
Visceral e subcutânea em amostras foram tiradas de temas incluídos no estudo aprovado pelo Hospital de Jessa Comissão médica ética, Hasselt e Universidade de Hasselt, Bélgica, em conformidade com a declaração de Helsinque.
1. preparação dos reagentes
- Solução de colagenase
- Dissolver 1 g de colagenase em 10 mL de fosfato tampão salino (PBS, sem cálcio e magnésio) para fazer uma solução estoque de 100 mg/mL. Preparar 200 alíquotas µ l e armazenar a-20 ° C.
- Dissolva 1 g de colagenase XI em 10 mL de PBS tornar-se uma solução estoque de 100 mg/mL. Preparar 200 alíquotas µ l e armazenar a-20 ° C.
- Dissolver 10 mg de DNase I em 10 mL de PBS para fazer um 10 mg/mL de solução. 180 alíquotas µ l de preparar e armazenar a-20 ° C.
- Adicionar 100 µ l colagenase I (100mg/mL), 100 µ l colagenase XI (100mg/mL) e 90 µ l DNase I (10 mg/mL) 10 mL de F12 do DMEM presunto. Fazer a colagenase solução fresca para cada isolamento.
- Tampão de lise de eritrócitos
- Dissolva 0,84 g NH4Cl em 100 mL de água ultrapura.
- Defina o pH em 7,4 antes do uso. Armazenar em um frasco de vidro a 4 ° C.
- Coloque a lise de eritrócitos no gelo antes de usar.
- Buffer de FACS
- Dissolva 0,5 g albumina de soro bovino (BSA) em 100 mL de PBS para obter 0,5% BSA PBS.
- Dissolva 65 mg de NaN3 em 100 mL 0,5% BSA PBS para obter 10 mM NaN3 0,5% BSA PBS. Armazenar a solução num frasco de vidro a 4 ° C.
- Buffer de FACS lugar no gelo antes de usar.
Cuidado: NaN3 é altamente tóxico. Trabalho em uma coifa e use óculos de segurança e luvas para proteção durante o manuseio de NaN3.
- Bloco de IgG humano
- Dissolva 10 mg de IgG humana em 10 mL de PBS para obter 1 mg/mL. Preparar 100 alíquotas µ l e armazenar a-20 ° C.
- Coloque o bloco de IgG humano no gelo antes de usar.
2. isolamento de SVF da AT
- Corte 1 g de na biópsia em pedaços pequenos (± 2 mm2) com um bisturi e a transferência de um tubo de centrífuga de 50 mL (por exemplo, tubo Falcon). Adicione 10 mL de solução de colagenase a cada um na amostra.
Nota: Feche a tampa do tubo completamente e voltar a tampa ¼ de volta. - Incube durante 60 min a 37 ° C em banho-maria sob agitação suave (60 ciclos/min).
- A suspensão resultante de filtragem com um filtro de 200 µM e coletar a amostra num tubo de centrífuga de 50 mL novo. Adicione 7 mL de PBS em cima o filtro, lave o filtro e obter todas as células.
- Centrifugar a amostra a 280 x g por 5 min a 4 ° C.
- Remova a fração dos adipócitos flutuante por pipetagem. O centrifugado é o SVF.
Nota: Remova a fração dos adipócitos para obter SVF. Evite submergir a ponta inteira na amostra, porque isto só irá remover o PBS e não os adipócitos flutuantes. - Ressuspender o SVF em 5 mL de PBS para remover colagenase, filtrar a suspensão com um filtro de 70 µM, lave o filtro com 5 mL de PBS e centrifugar a amostra a 280 x g por 5 min a 4 ° C.
- Remover o sobrenadante e ressuspender o precipitado em 3 mL de tampão de lise de eritrócitos.
- Incube durante 5 min no gelo. Adicione 7 mL de PBS após incubação.
- Centrifugar a amostra a 280 x g por 5 min a 4 ° C.
3. mancha de SVF para análise de citometria de fluxo
- Dissolver o centrifugado no buffer de FACS 90 µ l 4 ° C e adicionar 10 µ l de bloco de IgG humano 1 mg/mL. Divida a suspensão de eritrócitos em 2 poços de uma placa de 96 v-forma bem. Coloque a placa no gelo e deixe o bloco de IgG humano incube por 15 min.
- Juntar 100 µ l de tampão de FACS para cada amostra a lavar e centrifugar a placa por 5 min com 280 x g a 4 ° C. Remova o sobrenadante inclinar o prato de cabeça para baixo em um movimento suave sem bater a chapa.
Nota: Certifique-se de remover qualquer líquido restante da parte superior da placa com um lenço de papel, enquanto mantendo a placa de cabeça para baixo. - Prepare coquetéis de anticorpo para macrófagos e subconjuntos DC (FACS do painel 1) e de subconjuntos de células T e B (FACS do painel 2) conforme descrito na tabela 1 e tabela 2. Os volumes descritos na tabela 1 e tabela 2 são selecionados após otimizar as concentrações de anticorpos e são suficientes para uma barca ou amostra via satélite.
Nota: No painel de FACS 1, use os marcadores CD303 e CD141 para confirmar essa CD11C+ CD11B célulasbaixa são DCs. No entanto, é recomendável excluir estes marcadores de painel para incluir uma coloração ao vivo/morto. Ambos os painel de FACS 1 e 2 pode ser combinados com a viabilidade LIVE/mortos fixável Red Dead célula mancha Kit coloração quando excluir CD303 no painel 1 como o canal de PE for utilizado. Execute a viabilidade de coloração de acordo com as instruções do fabricante. - Resuspenda o pellet em 29,5 anticorpo µ l cocktail para painel FACS 1 e 23 µ l anticorpo cocktail para FACS do painel 2. Incube durante 30 min no escuro no gelo.
- Juntar 150 µ l de tampão de FACS a cada poço e resuspenda o pellet de célula para executar uma segunda etapa de lavagem. Centrifugue a placa por 5 min em 280 x g e 4 ° C. Remova o sobrenadante inclinar o prato de cabeça para baixo.
- Adicione solução de formaldeído a 150 µ l 1% a cada poço para consertar as células. Transferi a suspensão de células de cada poço do correspondente tubo de FACS pipetando com uma pipeta P200. Armazenar os tubos FACS a 4 ° C no escura acima de 7 dias.
Nota: A medição direta também é possível. Juntar 150 µ l de tampão de FACS a cada poço em vez de 1% de formaldeído, transferir as células pipetando com uma pipeta P200 para os tubos de FACS correspondentes e analisar as células.
Atenção: O formaldeído é muito tóxico. Prepare soluções de formaldeído enquanto trabalhava em uma coifa para evitar a inalação e usar luvas e óculos de segurança para proteção.
4. fluxo Cytometry Analysis
- Antes da primeira medição, use um controle negativo imaculado para definir a dispersão para a frente (FSC) e dispersão lateral (SSC). Ajuste as tensões do citômetro de fluxo de acordo com as instruções do fabricante para que todas as populações de interesse são visíveis no gráfico de FSC e SSC e pode ser feita uma distinção entre escombros e células vivas.
- Realizar análise de compensação multi-color com grânulos de captura anticorpo seguindo o protocolo do fabricante.
- Prepare fluorescência menos um controles (FMO), fazendo a mistura de anticorpos, mas exclui um anticorpo da mistura. Faça isso para cada anticorpo, criando 8 misturas de anticorpo para painel FACS 1 e 6 misturas de anticorpo para FACS do painel 2. Estas misturas de anticorpo FMO são usadas para manchar SVF conforme descrito anteriormente neste protocolo.
- Medir todos os controles FMO e definir a estratégia associada com base em controles FMO. Use os controles FMO para detectar possível autofluorescência das células.
Nota: Removendo um anticorpo da mistura, qualquer nível de fluorescência detectada neste canal é um sinal de fundo/autofluorescent. Assim, comparando a diferente FMO FACS resultados do controlo, portões podem ser desenhados em populações específicas, garantindo que os gatings são baseados em células positivas e não baseados em autofluorescência. - Tubos de vórtice o FACS a 800 rpm antes de colocá-los no citômetro de fluxo e iniciar a medição.
Nota: É recomendado um mínimo de 50.000 eventos no portão ao vivo para garantir que suficiente células são medidas de cada subpopulação.
Resultados
O SVF isolado do IVA e sentou foi medido utilizando citometria de fluxo. Medições de citometria de fluxo geram parcelas mostrando as populações de célula diferente baseadas em marcadores celulares (figura 1A e 1B). Primeiro, traçando o avançado scatter largura (FSC-W) e encaminhar a dispersão área (FSC-), célula a agregados podem ser eliminados de uma análise mais aprofundada por retenção de células única como baixa FSC-W. Em seguida, ao vivo as células estiverem selecionadas, e restos celulares é excluído pelo gating as células do tamanho correto e complexidade usando FSC-um e o lado espalhar área (SSC-A), respectivamente. As células mortas são pequenos e, portanto, visível como uma população distinta, com um pequeno FSC-A. Próximo, imunes células foram Selecionadodas pelo uso do marcador panleucócitos CD45 (painel 1 e 2, figura 1A). Para analisar os macrófagos, imunológico outro células como as células-T (CD3), as células B (CD19), neutrófilos (CD66b+ CD11b+), e as células NK (CD56) foram excluídas de uma análise mais aprofundada usando anticorpos distintos direcionamento dessas células, mas com o mesmo fluorocromo. Subdivisão adicional das células restantes baseou-se na expressão de CD11b e CD11c. Isto resultou nas seguintes populações: CD11b+ CD11c+ macrófagos, CD11b+ CD11c macrófagos– e CD11bbaixa /- CD11c+ DCs (FACS do painel 1, figura 1B). Medição da intensidade de fluorescência média (IFM) permitiu a quantificação da expressão de CD303 (marcador plasmocitoide DC) e CD141 (marcador de DC), na CD11b+ CD11c+ macrófagos e CD11bbaixa /- CD11c+ DCs. Expressão de ambos estes marcadores foram maiores no CD11bbaixa /- CD11c+ células confirmando que CD11bbaixa /- CD11c+ células foram DCs (Figura 1).
A CD45+ células (figura 1A) foram divididas em células T e células B usando CD3 e CD19, respectivamente. As células T foram subdivididas em células T helper (CD4+) e células T citotóxicas (CD8+). Por último, CD3–CD19–células foram plotadas quantificar células NK-usando o marcador CD56 (FACS painel de 2, Figura 1). O número de células em cada portão é quantificado e pode ser usado para calcular a percentagem deste tipo de célula de todas as células vivas (tabela 3).
A porcentagem de células vivas pode ser calculada para cada assunto, permitindo o cálculo de uma média de todos os indivíduos em um grupo de por exemplo homens magros ou obesos, exibindo a abundância de uma imune célula específica, ou seja, o pro-inflamatórios CD11b+ CD11c+ macrófago no AT visceral (Figura 2).
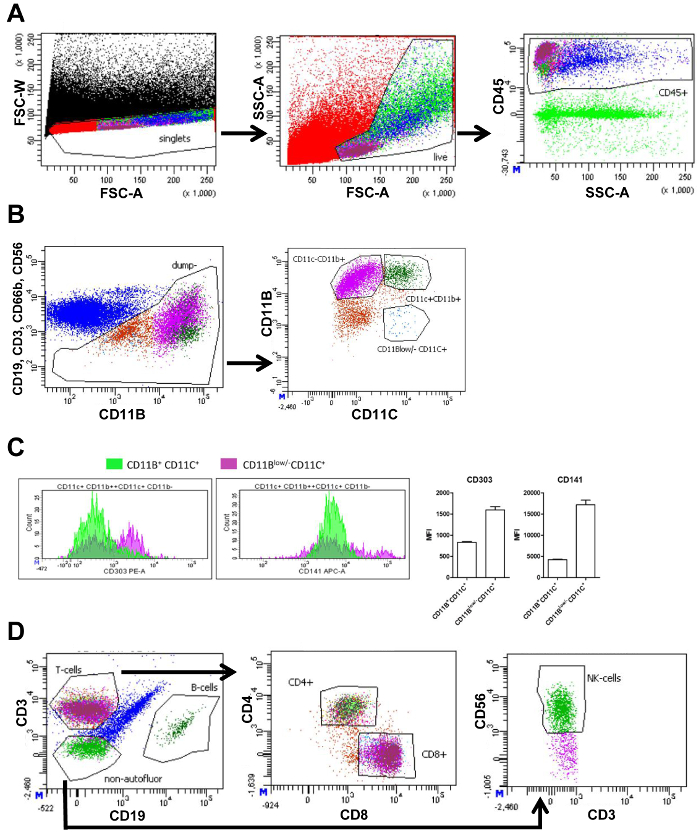
Figura 1. FACS gating estratégia de visceral de tecido adiposo. (A), FACS enredo de todos os eventos (preto) com intensidade de largura de dispersão para a frente (FSC-W) e intensidade de área de dispersão para a frente (FSC-A), contendo um portão para selecionar somente células únicas (vermelho) seguidas por uma trama de FACS com base na intensidade de área de dispersão FSC-A e lateral (SSC-A) contendo um portão selecionando células vivas (verde claro). Próximo lote com SSC-A e a intensidade de fluorescência CD45 contém um portão selecionando todos CD45+ (imune) células (azul). (B), FACS enredo da intensidade de fluorescência CD19, CD3, CD66b e CD56 versus a intensidade de fluorescência CD11b e um portão selecionar todas as células que são CD19, CD3, CD66b e CD56 negativo (marrom) para ainda mais a divisão em populações. Outra subdivisão da próxima parcela com base na intensidade de fluorescência CD11b e CD11c. Portões são exibidos contendo CD11b+ CD11c+ macrófagos (verde escuro), CD11b+ CD11c macrófagos– (roxos) e CD11bbaixa /- CD11c+ células dendríticas (azul). (C) quantidade de CD11b+, CD11c+, ou CD11bbaixa /- CD11c+ células (eixo y) exibindo os seus níveis de intensidade de fluorescência (eixo x) para CD303 e CD141 e a correspondente quantificação da média intensidade de fluorescência (IFM). (D), FACS trama exibindo a CD45 anterior+ população (azul) com base na intensidade de fluorescência de CD3 e CD19 contendo gates selecionando células T (magenta), as células B (verde escuro) e as células não-autofluorescent (verde) negativas para ambos CD3 e CD19. O seguinte enredo é baseado em fluorescência de CD4 e CD8 com portões selecionando CD4+ (verde claro) e CD8+ (magenta) células T. Uma estratégia associada idêntica é usada para o tecido adiposo subcutâneo. Uma estratégia associada idêntica é usada para o tecido adiposo subcutâneo. Esta figura foi modificada de Wouters et al 16 Clique aqui para ver uma versão maior desta figura.
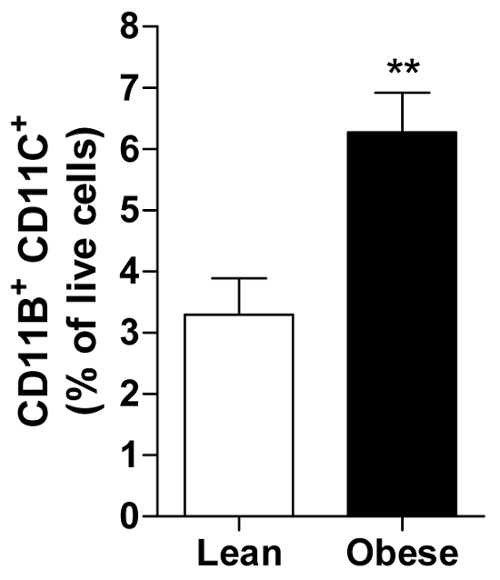
Figura 2. IVA obesa contém mais pró-inflamatórias macrófagos. A quantidade de CD11b+ CD11c+ macrófagos apresentados como porcentagem de todas as células vivas em IVA de homens magros e obesos. Todos os dados são ± significa SEM; n = 20 por lean e n = 31 para obesos. p ≤ 0,01 vs magra. Clique aqui para ver uma versão maior desta figura.
| Alvo | Alvo de definição | Apresentar-se na | Fluorocromo | Quantidade | Clone |
| CD11B | marcador mieloide integrina | granulócitos, monócitos/macrófagos, células dendríticasbaixa e células assassinas naturais | BV421 | 2,5 Μ l | ICRF44 |
| CD19 | antígeno de células B comum | Desenvolvimento de células b do celular pro-B para Blastoidea de células B e células B de plasma | FITC | 3 Μ l | HIB19 |
| CD3 | antígeno de células T comum | Linfócitos T, células de T naturais killer e timócitos | FITC | 3 Μ l | UCHT1 |
| CD66B | membro do antígeno carcinoembryonic (CEA)-como a família de glicoproteína | granulócitos | FITC | 5 Μ l | G10F5 |
| CD56 | proteína de adesão altamente glicosilados | células assassinas naturais e naturais as pilhas de T do assassino | FITC | 5 Μ l | B159 |
| CD303 | tipo de glicoproteína transmembrana II | células dendríticas plasmocitoide | PE | 1 Μ l | 201A |
| CD141 | trombomodulina | monócitos/macrófagosbaixa, subpopulação de células dendríticas | APC | 1 Μ l | M80 |
| CD11C | tipo I glicoproteína transmembrana; integrina αx | monócitos/macrófagos, células dendríticas, granulócitos, células assassinas naturais, subconjunto de células B e T | APC-Cy7 | 0,5 Μ l | Bu15 |
| CD45 | comum Antígeno leucocitário | todos os leucócitos humanos, incluindo linfócitos, granulócitos, monócitos, eosinófilos e timócitos | PE-Cy7 | 1 Μ l | HI30 |
| Buffer de FACS | - | - | - | 7,5 µ l | - |
Tabela 1. Coquetel de anticorpos FACS panel 1 para identificar subconjuntos de macrófagos e células dendríticas populações. Quantidade de anticorpos descrito destina-se a análise de uma amostra.
| Alvo | Alvo de definição | Apresentar-se na | Fluorocromo | Quantidade | Clone |
| CD19 | antígeno de células B comum | Desenvolvimento de células b do celular pro-B para Blastoidea de células B e células B de plasma | BV421 | 1 Μ l | HIB19 |
| CD3 | antígeno de células T comum | Linfócitos T, células de T naturais killer e timócitos | V500 | 3 Μ l | UCHT1 |
| CD56 | proteína de adesão altamente glicosilados | células assassinas naturais e naturais as pilhas de T do assassino | APC | 5 Μ l | HCD56 |
| CD4 | Superfamília de IG, glicoproteína transmembrana do tipo I | Tipo de T helper cell, timócitos, monócitos/macrófagos, células T assassinas naturais de II | PerCP-Cy5.5 | 1 Μ l | RPA-T4 |
| CD8 | Α-subunidade de um complexo bimolecular dissulfeto-lig | as células T citotóxicas, timócitos, subconjunto de células assassinas naturais | APC-H7 | 2 Μ l | SK1 |
| CD45 | comum Antígeno leucocitário | todos os leucócitos humanos, incluindo linfócitos, granulócitos, monócitos, eosinófilos e timócitos | PE-Cy7 | 1 Μ l | HI30 |
| Buffer de FACS | - | - | - | 10 µ l | - |
Tabela 2. Coquetel de anticorpos FACS painel 2para identificar as populações de células T e B. Quantidade de anticorpos descrito destina-se a análise de uma amostra.
| Painel do macrófago | ||
| Nome de portão | # As células | % ao vivo |
| Células únicas | 183054 | |
| ao vivo | 10477 | 100 |
| CD45 | 4100 | 39.13 |
| despejo– | 771 | 7,36 |
| CD11C CD11B– + | 430 | 4.1 |
| CD11C+ CD11B+ | 104 | 0,99 |
| CD11C+ CD11Bbaixa /- | 15 | 0,14 |
| Painel de células T, células B, células NK | ||
| Nome de portão | #Cells | % ao vivo |
| Células únicas | 34616 | |
| Ao vivo | 3728 | 100 |
| CD45+ | 1589 | 42.62 |
| Células NK | 29 | 0,78 |
| CD3+ | 953 | 25.56 |
| CD4+ | 601 | 16.12 |
| CD8+ | 328 | 8.8 |
| CD19+ | 20 | 0,54 |
Tabela 3. Abundância de células imunes de diferentes tipos de células no IVA. Número de células em cada portão e a percentagem dos tipos diferentes de célula com base na quantidade total de células vivas.
Discussão
Esses métodos descrevem como isolar o SVF do IVA e sentou-se e quantificar os montantes relativos de células imunes dentro desses tecidos. Além disso, os métodos do estado como determinar a expressão de marcadores em tipos específicos de célula.
Citometria de fluxo das células do sistema imunológico de tecido é uma técnica poderosa para fenótipo o estado imunológico dos tecidos. A quantificação de células do sistema imunológico de tecido pode ter muitas aplicações. Conforme descrito nos resultados, é possível comparar a presença de células do sistema imunológico específicas entre grupos de pacientes (por exemplo, magra vs obesos). Além disso, também realizando citometria de fluxo no sangue dos pacientes mesmos, associações entre células de tecidos e células de circulação podem ser investigadas. Com esta aplicação fomos capazes de determinar que um subconjunto específico de monócitos em circulação é associado com pro-inflamatórios CD11C+ de macrófagos de tecido adiposo16.
Ajustes do protocolo descrito expandirá suas aplicações como numerosos disponíveis anticorpos fluorescentes fazem citometria de fluxo muito versátil. Com diferentes anticorpos podem distinguir-se quase todos os tipos de células e a expressão de muitos marcadores pode ser detectada. Além disso, é possível ficar manchado marcadores intracelular por permeabilizing da membrana celular para permitir a ligação intracelular dos anticorpos fluorescentes. Estas características permitem a distinção das populações muito diversas macrófago além os subtipos de macrófagos M1 e M2 excessivamente simplificadas. Além de medição da expressão do marcador de superfície, proteínas (ou seja, citocinas) podem ser manchadas intracelular, fornecendo informações sobre a funcionalidade de macrófagos. Além disso, os marcadores de proliferação como Ki67 são usados para quantificar taxas de proliferação. Conforme descrito, distinção entre macrófagos e DCs foi baseada em níveis de IFM de marcadores de DC. Um marcador para macrófagos geral, tais como CD68 pode ser incorporado do painel do macrófago (FACS painel 1). No entanto, CD68 precisa ser manchado intracelular que requerem permeabilização da membrana celular que não é preferível e seria estender o protocolo. Outros marcadores de macrófagos são marcadores de subconjunto como CD163 e CD206 ou CD11c, sendo este último integrado no painel do macrófago aqui apresentado.
Em nossos painéis de FACS, um marcador para distinguir células vivas e mortas não foi incluído, que seria preferível, porque permite uma exclusão mais precisa de células mortas do que o uso do FSC e SSC. Frequentemente usados é o DNA coloração viabilidade corantes iodeto de propidium (PI) ou 4', 6-diamidino-2-phenylindole (DAPI) bem como amina livre reagindo corantes como o LIVE/mortos fixável mortos célula mancha Kit, que está disponível em cores diferentes de tinta. No entanto, PI e DAPI não podem ser usado quando as células de fixação. Conforme descrito no protocolo, a coloração de viabilidade fixável LIVE/DEAD Red Cell morta pode ser integrada em ambos os painéis sem afetar o geral FACS gating estratégia.
Além disso, os dados são expressos como uma porcentagem de células vivas, ou seja, todos os dados são relativos. Apenas inserindo um exato, conhecido o número de células para o citômetro de fluxo, será possível determinar os números exatos de cada tipo de célula. Um número aproximado de células poderia ser calculado após a contagem das células na fração SVF usando uma câmara de contagem. No entanto, esse número teria que ser ajustado para a quantidade de tecido de biópsia usado para isolar o SVF, mas isso tem limitações quando comparando magra para obesos em. Uma massa semelhante de obeso AT consiste menos adipócitos, como eles são preenchidos com lipídios e expandiram-se grandemente. Isto poderia levar a uma subestimação do número de células imunes se apresentado como o número de células do sistema imunológico por grama de no ou por adipócitos.
Em estudos humanos, a inclusão de pacientes é feito geralmente por um longo período de tempo, tornando a padronização de procedimentos experimentais de grande importância. Para comparação dos dados de citometria de fluxo entre pacientes, existem várias opções. Conforme descrito no presente protocolo, as células podem fixar-se antes da medição, permitindo a análise de várias amostras no mesmo dia. Isto também pode ser conseguido congelando o SVF antes mancha-los, que permite que o procedimento de coloração ser igual entre todas as amostras, mas a viabilidade das células pode ser afetada. Por último, também utilizados neste estudo, são grânulos fluorescentes para instalar os níveis de compensação, e grânulos de rastreamento citômetro foram usados bi-semanal para padronizar as medições diárias do citômetro. Esta última opção é mais eficiente quando medir amostras de um estudo abrangendo um longo período de tempo.
Um fator limitante para citometria de fluxo em geral é o uso da fluorescência. O número de etiquetas fluorescentes que podem ser detectados simultaneamente é limitado devido à sobreposição em espectros de emissão. No entanto, com desenvolvimento de painel inteligente FACS e o uso de vários cocktails de anticorpo por IVA ou amostra sAT, esse problema pode ser superado, conforme descrito no presente protocolo. Um aspecto importante do desenvolvimento de painel de FACS é FMO controles. Usando todos os anticorpos do painel, com exceção de uma, níveis possíveis de autofluorescência podem ser apreciados quando se compara o FMO com o painel completo. Isto permite gating precisos das populações e esses procedimentos devem ser realizados quando a criação de um novo painel de FACS. Além disso, as novas gerações de dispositivos de FACS podem detectar até 50 parâmetros que permite a deteção simultânea de muitas características por célula. Outra questão relacionada com o aspecto de fluorescência é a autofluorescência de células, especialmente de macrófagos. Após a excitação das células com o laser de FACS (principalmente com a excitação de comprimento de onda 488 nm), estas células emitem um sinal fluorescente (principalmente < 640 nm) que pode coincidir com os espectros de emissão do anticorpo rotula17,18. Para explicar isso, imaculadas células devem ser medidas para determinar a autofluorescência em cada canal. Com esse conhecimento, fluorochromes devem ser selecionados que exibem um sinal que excede o sinal de autofluorescent. Este sinal de fundo de autofluorescent deve ter em conta ao determinar a estratégia associada das populações. Portanto, pela aplicação do presente protocolo e design de painel de FACS inteligente é possível em subtipos de macrófagos de fenótipo de profundidade. Nova AT distinta macrófagos e sua função podem ser caracterizados.
Divulgações
Os autores declaram não há conflitos de interesse.
Agradecimentos
Gostaríamos de agradecer a J. van de Gaar e M. Vroomen (Universidade de Maastricht, Países Baixos), pelo apoio técnico. Além disso, gostaríamos de agradecer a K. Verboven, D. Hansen, J. Jocken, e E. Blaak para fornecer as biópsias de sangue e tecido usado para a configuração deste protocolo e as experiências subsequentes.
Materiais
| Name | Company | Catalog Number | Comments |
| Centrifuge | Hettich Rotanta 460R | 5660 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)-Ham’s F12 | Gibco ThermoFisher | 31330-095 | |
| Collagenase XI from Clostridium histolyticum | Sigma Aldrich | C7657-1g | |
| Collagenase I from Clostridium histolyticum | Sigma Aldrich | C0130-1g | |
| DNAse I from bovine pancreas | Sigma Aldrich | DN25 | |
| NH4Cl | Merck | 1.01145.0500 | |
| Bovine Serum Albumine | Sigma Aldrich | A4503-100 | |
| NaN3 | Merck | 1.06688.0100 | |
| 200 µM syringe Filcons | BD Biosciences | 340613 | |
| 70 µM filter | Greiner Bio-one | 542070 | |
| Fc block / human IgG | Sigma Aldrich | 14506 | |
| Formaldehyde | Merck | 1.04003.2500 | |
| CD11b-BV421 | Biolegend | 301324 | |
| CD19-Fitc | BD Biosciences | 555412 | |
| CD3-Fitc | BD Biosciences | 561807 | |
| CD66b-Fitc | BD Biosciences | 555724 | |
| CD56-Fitc | BD Biosciences | 562794 | |
| CD11c-APC-Cy7 | Biolegend | 337218 | |
| CD45-PE-Cy7 | BD Biosciences | 557748 | |
| CD19-BV421 | Biolegend | 302234 | |
| CD3-V500 | BD Biosciences | 561416 | |
| CD56-APC | Biolegend | 318310 | |
| CD4-PerCP-Cy5.5 | Biolegend | 300528 | |
| CD8-APC-H7 | BD Biosciences | 641400 | |
| CD303-PE | Biolegend | 354204 | |
| CD141-APC | Biolegend | 344106 | |
| FACS-Canto II | BD Biosciences | ||
| 96 v-shape well plate | Greiner Bio-one | 651101 | |
| PBS PH 7.4 | Gibco ThermoFisher | 10010023 | |
| FACS tube 5 mL polystyrene round-bottom tube | Corning | 352052 | |
| IgG from human serum | Sigma Aldrich | I4506 | |
| Anti-Rat Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552844 | |
| Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552843 | |
| LIVE/DEAD Fixable Red Dead Cell Stain Kit | ThermoFisher | L23102 | |
| IKA MS 3 basic shaker | Sigma Aldrich | Z645028-1EA |
Referências
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Makki, K., Froguel, P., Wolowczuk, I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013, 139239 (2013).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U S A. 110 (13), 5133-5138 (2013).
- Elgazar-Carmon, V., Rudich, A., Hadad, N., Levy, R. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding. J Lipid Res. 49 (9), 1894-1903 (2008).
- Han, J. M., Levings, M. K. Immune regulation in obesity-associated adipose inflammation. J Immunol. 191 (2), 527-532 (2013).
- Liu, J., et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat Med. 15 (8), 940-945 (2009).
- Nishimura, S., et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 15 (8), 914-920 (2009).
- Koh, Y. J., et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 31 (5), 1141-1150 (2011).
- Peinado, J. R., et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 10 (18), 3356-3366 (2010).
- Leggate, M., et al. Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males. Journal of Applied Physiology. 112 (8), 1353-1360 (2012).
- Divoux, A., et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 97 (9), E1677-E1685 (2012).
- Harford, K. A., Reynolds, C. M., McGillicuddy, F. C., Roche, H. M. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc. 70 (4), 408-417 (2011).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Morris, D. L., Singer, K., Lumeng, C. N. Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states. Curr Opin Clin Nutr Metab Care. 14 (4), 341-346 (2011).
- Wentworth, J. M., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 59 (7), 1648-1656 (2010).
- Wouters, K., et al. Circulating classical monocytes are associated with CD11c+ macrophages in human visceral adipose tissue. Sci Rep. 7, 42665 (2017).
- Duan, M., et al. Distinct macrophage subpopulations characterize acute infection and chronic inflammatory lung disease. J Immunol. 189 (2), 946-955 (2012).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. J Immunol Methods. 386 (1-2), 101-107 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados