Method Article
Evaluación visual y microscópica de mutantes desarrollo de Streptomyces
En este artículo
Resumen
Aquí presentamos protocolos para noveles investigadores para iniciar phenotyping del farmacológicamente importante Género bacteriano Streptomyces.
Resumen
Streptomycetes son filamentosos suelo bacterias pertenecientes al phylum Actinobacteria que se encuentran en todo el mundo y producen una amplia gama de antibióticos y otros metabolitos secundarios. Coelicolor de los Streptomyces es una especie bien caracterizada, no patógena que es susceptible a una variedad de análisis en el laboratorio. Los métodos de fenotipado descritos aquí utilizan S. Coelicolor de los como un modelo streptomycete; sin embargo, los métodos son aplicables a todos los miembros de este género grandes así como algunos actinomicetos estrechamente relacionados. Phenotyping es necesario caracterizar nuevas especies de Streptomyces , identificado en el entorno, y también es un vital primer paso en la caracterización de cepas mutantes recién aisladas de Streptomyces. Competencia en fenotipado es importante para los muchos investigadores que entran en el campo de la investigación de Streptomyces , que incluye el estudio de desarrollo bacteriano, división celular y segregación cromosómica, segundo mensajero señalización. El crowdsourcing reciente del descubrimiento de antibióticos mediante el aislamiento de nuevos microbios de suelo ha dado lugar a una creciente necesidad de formación en fenotipado de profesores nuevos en el campo de la investigación de Streptomyces y su Universidad o high School secundaria estudiantes. Este manuscrito describe métodos para la propagación de la cepa bacteriana, el almacenamiento y la caracterización a través de examen visual y microscópico. Después de leer este artículo, nuevos investigadores (Microbiología educación laboratorios y científicos del ciudadano) deben ser capaces de manipular las cepas Streptomyces y comienzan los experimentos de caracterización visual.
Introducción
Streptomycetes son bacterias del suelo Gram-positiva, filamentosos conocidas por su capacidad producir una variedad de metabolitos secundarios, incluyendo más de dos tercios de los antibióticos disponibles en el mercado, así como antitumorales, drogas anti-VIH y antiparasitarias 1. S. Coelicolor de los es el miembro más genéticamente caracterizado el género2,3 y es la especie utilizada en los métodos descritos aquí. S. Coelicolor de los tiene un complejo ciclo de vida que comienza con la germinación de una sola espora, progresando a un micelio vegetativo extenso, ramificación que crece en el medio de agar. Medida que avanza el ciclo de vida, filamentos aéreos forman que rompen la tensión superficial del micelio de sustrato y finalmente se dividen en largas cadenas de células que finalmente se convierten en esporas maduras, pigmentado de gris. Dispersión de las esporas recién formadas constituye el inicio del siguiente ciclo de vida4.
Debido a su complejo patrón de diferenciación, S. Coelicolor de los sirve como un excelente modelo para el estudio de desarrollo bacteriano. Históricamente, las mutaciones resultan en bloques de dos etapas principales del desarrollo y producen distintos fenotipos visuales. Los mutantes (Calvo) bld están bloqueados para la formación de micelio aéreo y resultado en la falta de un micelio aéreo difuso impartiendo un aspecto de las colonias "Calvo". Mutantes inhibición en la formación de esporas y maduración se denominan mutantes whi (blanco) porque por lo general no producen niveles de tipo salvaje del pigmento gris esporas y el micelio aéreo sigue siendo blanco. Otros mutantes interesantes son inhibidas en la producción de antibióticos, división celular, segregación cromosómica u otros procesos importantes4,5.
A pesar del descubrimiento de muchos genes del desarrollo en especies de Streptomyces , hay muchos más que existen en base a la falta de saturación de pantallas mutantes. Nuestros laboratorios siguen identificar nuevos genes del desarrollo, mediante un sistema de mini-transposones que hemos construido. Nuevos mutantes cepas aisladas en experimentos de mutagénesis al azar con el transposón se someten a detección fenotípica para identificar el posible papel de cada nuevo gen descubierto6,7. Los métodos de fenotipado bacteriana descritas aquí son pertinentes a Streptomyces mutantes aislados por transposon mutagénesis8,9,10,11,12, 13 y otros métodos al azar, como químicos y ultra violeta (UV) mutagénesis14, así como la construcción dirigida de mutaciones tales como canceladuras del gene usando recombineering15,16 o Genoma de CRISPR-Cas9 (agrupadas regularmente otro corto palindrómico repeticiones) edición de tecnología17,18,19 y mutaciones de punto20.
Como resistencia a los antibióticos entre patógenos se convierte cada vez más frecuente, la necesidad de nuevos antibióticos se convierte cada vez más urgente21,22. La "Iniciativa de mundo pequeño" (o suizo) es una efectiva ciencia, tecnología, ingeniería y matemáticas (STEM) aprendizaje investigación y23 estrategia24 para combatir la resistencia a los antibióticos mediante el crowdsourcing de estudiantes universitarios y más recientemente los estudiantes de secundaria. Apoyo cursos de trabajo incluye la identificación de nuevos microbios de suelo que producen nuevos antibióticos (http://www.smallworldinitiative.org). Se cree que la principal fuente de antibióticos sin descubrir seguirá siendo Streptomyces especies encontraron en una amplia gama de suelos y agua habitat25,26,27,28, 29,31. Recientemente, nuestro laboratorio y el trabajo de otros han descubierto y caracterizado genes de señalización en especies de Streptomyces que regulan la morfología y desarrollo, incluyendo la producción de antibióticos7,32, 33. Cambios en la expresión de estos genes dan lugar a un cambio en la cantidad y distribución de antibióticos producidos. Phenotyping calificado de nuevas especies y nuevos mutantes antibiótico-producir seguirá siendo importante. Como nuevos instructores y sus estudiantes se convierten en contribuidores importantes al campo de descubrimiento de fármacos, entrenamiento en fenotipado bacteriana es necesario para el éxito de estos individuos novatos. Además, estos experimentos son manejables para la high School secundaria de tallo o laboratorios de enseñanza de Microbiología de la Universidad. Representan una manifestación de principios básicos de genéticas microbianas en un laboratorio de enseñanza que se ajuste.
Protocolo
1. preparar instrumentos, medios de cultivo, soluciones y platos de Petri
- Palillos del autoclave en un matraz de 50 mL cubren con papel de aluminio para mantener estéril.
- Esterilizar todos los productos secos que serán utilizados (consejos, palillos, cristalería, etc.) en un autoclave.
Nota: PRECAUCIÓN! Seguir todas las instrucciones de seguridad para el modelo de autoclave utilizado. Los autoclaves plantean un riesgo de explosiones y quemaduras debido al vapor y el contacto con superficies calientes, materiales y medios de comunicación. Para la seguridad de la autoclave, Ve el "Adecuado uso de los Autoclaves"34. -
Preparar el MS agar manitol soja harina (bosques)14 para crecer culturas.
- Añadir 5 g de harina de soya y 5 g de agar al matraz de 1 L.
- Disolver 5 g de manitol en 250 mL de agua y echar en el matraz que contiene la harina de soya y agar.
- Añadir un tapón de espuma y papel de aluminio para la apertura de la mufla y autoclave a 121 ° C, 15 psi durante al menos 30 minutos.
PRECAUCIÓN: Este medio se reduce fácilmente. Utilizar un frasco que puede contener por lo menos cuatro veces el volumen real de agar MS ser esterilizado. Puede usarse una olla a presión estándar en lugar de un autoclave con similares consideraciones de seguridad. Como alternativa, puede usarse un horno de microondas para esterilizar los medios de comunicación y materiales si el acceso a un autoclave no es posible35,36. Profesores de enseñanza secundaria también puede colaborar con colegios locales o universidades para acceder a fuentes de autoclave. - Medios Cool hasta lo suficientemente cómoda para manejar. Tenga cuidado de no enfriar demasiado porque el agar se solidifica a temperaturas por debajo de 50 ° C.
- Verter agar MS del frasco en placas de Petri estériles hasta que la parte inferior de cada placa de Petri es aproximadamente la mitad lleno (aproximadamente 25 mL de medio por placa de Petri). Dejar para solidificar antes de usar placas de agar. Almacenar las placas de agar en una bolsa plástica a temperatura ambiente hasta que se necesite.
Nota: Las placas de Agar pueden guardarse en el refrigerador, especialmente si se necesitan antibióticos en los medios de comunicación.
2. raya Streptomyces en las placas para la propagación
- Cepas de Streptomyces estría en placas de agar de MS a colonias individuales usando un método estándar, como el cuadrante de la raya método como se muestra en Sanders, 201237.
Nota: Pueden utilizarse un asa de inoculación o mondadientes estériles. Opcional: Otros medios de comunicación utilizan con frecuencia para las especies de Streptomyces , como R2YE y la mínima media14. - Incube las placas a 30 º C.
- Restreak placas escogiendo una colonia solo cada 4 – 6 días. Como edad de colonias llegan a ser propensas a la mutación al azar.
3. crear acciones micelial glicerol para el almacenamiento de bacteria
Nota: Las existencias miceliales pueden crearse para todas las cepas de Streptomyces , incluyendo whi bld cepas y otros desarrollo mutantes que son incapaces de completar la esporulación.
- Macerar de 15 a 20 colonias en 200-500 μl de glicerol 20% mediante un aplicador estéril de clavija de madera.
- Transferir la mezcla de colonias maceradas a un tubo de cultivo de congelador de 1,5 mL, utilizando una micropipeta o pipeta de transferencia estéril.
Nota: Los aspectos básicos del uso de Micropipetas están cubiertos en otra parte38. - Añadir suficiente glicerol 20% para el volumen final 1 mL y mezclar suavemente. Almacenar las muestras a-80 ° C.
Nota: PRECAUCIÓN! Utilizar guantes de seguridad criogénicos y una bata para proteger la piel del contacto con frío extremo. Alternativamente, puede utilizarse un congelador de-20 ° C con reducción potencial en tiempo de almacenamiento a largo plazo. Evitar el exceso de congelación y descongelación para prolongar la viabilidad.
4. crear las poblaciones de esporas de glicerol para cepas capaces de esporulación
Nota: Las poblaciones de esporas son preferibles para la viabilidad a largo plazo pero sólo son factibles para las cepas que son capaces de completar la esporulación.
-
Extensión 100 μl de material macerado (del paso 3.1) sobre una placa de agar para obtener un césped confluente de crecimiento37.
Nota: Placas de extensión se muestran en Sanders37 (modificación: un plato no es necesario.). La placa puede girar con una mano mientras con la otra mano mover el separador en un suave vaivén movimiento a través de los medios de agar.- Pipetee 100 μl del micelio macerado en el centro de una placa de agar de MS.
- Esterilizar un vidrio o metal difusión herramienta parcialmente sumergiendo en etanol al 70% y pasar una vez el distribuidor lentamente a través de una llama de mechero de Bunsen para acelerar la evaporación del etanol.
PRECAUCIÓN: El etanol es muy inflamable. No coloque el esparcidor de llamas en etanol ni la llamas gota de etanol a caer en el plato de etanol. Alternativamente, use un hisopo de algodón estéril desechable para trasmitir las bacterias en la placa, que no requiere etanol o llama. - A su vez MS agar de la placa con una mano, mientras usa un nuevo movimiento hacia y para inocular la placa con el spreader estéril.
- Incubar durante 5 – 7 días a 30 ° C hasta que la tensión está bien esporulada.
Nota: Tiempos de incubación variará dependiendo de la especie y cepa.
- Añadir 2 mL de solución salina estéril (0,8% NaCl) en el centro de un césped confluente de células de Streptomyces que ha sufrido la esporulación.
- Cosecha de esporas frotando suavemente la superficie del micelio con un estéril inocular lazo (o un bastoncillo de algodón), poco a poco hacia el borde del césped.
- Pipeta de la solución salina que contiene las esporas a un tubo cónico de 15 mL. Vortex vigorosamente a romper cadenas de esporas en células individuales.
- Centrifugar a temperatura ambiente durante 5 minutos a aproximadamente 2.500 x g.
- Pipeta el sobrenadante y deséchelo. Dispersar el pellet de esporas por agitación vigorosa de vórtice en la pequeña cantidad de líquido restante.
- Resuspender las esporas en 1 mL de glicerol al 20% mediante la elaboración de la solución hacia arriba y hacia abajo con una pipeta.
- Transferencia de la población de esporas de glicerol a un tubo de 1,5 mL con congelador. Tienda a-80 ° C.
PRECAUCIÓN: Use guantes de seguridad criogénicos y una bata para proteger la piel del contacto con frío extremo. Alternativamente, puede utilizarse un congelador de-20 ° C con potencial de reducción de la viabilidad en el tiempo de almacenamiento a largo plazo. Evitar el exceso de congelación y descongelación para prolongar la viabilidad.
5. realizar mutagénesis
- Realizar mutagénesis basándose en los resultados deseados como se indica en la Introducción y revisado recientemente por Baltz, 201639.
Nota: Algunos experimentos de fenotipado no requieren de mutagénesis, tales como la intención de identificar nuevas especies del entorno. Métodos de mutagénesis al azar incluyen el uso de un transposon8,9,10,11,12,13, radiación UV o productos químicos14. Sitio dirigido mutagénesis15,16,17,18,19,20 las técnicas pueden utilizarse para crear el específicas mutaciones puntuales, deleciones, o otros tipos de mutaciones.
6. comparar y registrar el aspecto Visual
- Tome nota de morfología de las colonias para cada mutante en comparación con la cepa de tipo salvaje padre después de rayar todas las tensiones como en el paso 2. Comparar el nuevo aislante a la de una especie bien estudiada, como S. Coelicolor de los o S. venezuelaa, cuando la caracterización de nuevas especies de Streptomyces . Tenga en cuenta las características (figura 1) como forma básica, la superficie de la Colonia (fuzzy, Calvo, arrugado, etc.), opacidad, elevación y pigmentación (distinguir entre micelio vegetativo, micelio aéreo y medio ambiente).
- Etiqueta un agar MS cepas de tipo salvaje y mutantes placa y raya en los patrones de la cuña (figura 1). Tenga cuidado de que ninguna cepa toca otra cepa para evitar contaminación cruzada. Tenga en cuenta la fecha y hora que las cepas son veteadas en la placa. Incubar las placas a 30 º C.
- Lugar crecido de Petri sobre papel blanco o de color para homogeneizar el fondo. Escriba en el papel el nombre de la cepa, fecha, temperatura de incubación y tiempo de la primera placa veteado. Tomar imágenes digitales de la placa con la información de este último escrita sobre el papel de modo que se minimiza la confusión.
Nota: La escritura puede ser recortada de la fotografía en un momento posterior si es que se utilizará para la preparación de la figura.
7. realizar microscopía de contraste de fase
- Esterilice las pinzas por lavado en etanol al 70% y luego pasar por una llama de mechero de Bunsen para evaporar el etanol. Deje que se enfríe.
- Esterilizar el cubreobjetos por lavado en etanol al 70% y luego permitiendo que se sequen en una placa Petri estéril.
-
Preparar una cubreobjetos elevación del crecimiento bacteriano para ser examinado.
- Recoger un cubreobjetos estéril con pinza estéril y colocar el cubreobjetos sobre una placa de agar de MS donde el crecimiento bacteriano es denso. Presione en la parte posterior del cubreobjetos suavemente con las pinzas para asegurar a suficiente transferencia de bacterias esporas y micelio aéreo.
- Recoger el cubreobjetos de la placa y colocarla para que quede el lado con el material de la célula hacia la superficie de un portaobjetos con una gota de 15 μl de glicerol 50% preparado en agua para el montaje. Reducir las burbujas de aire al colocar el cubreobjetos en un ángulo de 45° a la diapositiva y se deja caer el 50% de glicerol.
- (Opcional) Sello con claro de uñas polaco para la preservación de la diapositiva.
-
Realizar microscopía de contraste de fase como se describe por Frohlich40 en diversos intervalos de tiempo durante los ciclos de vida.
Nota: Proyección de imagen repetida permite un análisis más completo y la capacidad para detectar retrasos en el desarrollo. Independientemente, repetir las observaciones para asegurar exactitud y reproducibilidad.- Colocar el portaobjetos preparado en la platina del microscopio y añada una gota de aceite de inmersión para el centro de la hoja de cubierta. Rotar la fase X 100 objetivo Coloque y fije la torreta del condensador para el ajuste correcto de la fase "coincidente". Enfocar la imagen usando solamente el pomo de ajuste fino, una vez que el objetivo esté en contacto con el aceite.
- Examinar varios campos de vista para discernir sensibles y consistentes diferencias entre cepas mutantes y el tipo silvestre, como la capacidad de esporas de forma, tamaño de la espora y la forma y número total de esporas (ver figura 2).
Nota: Alternativas a la microscopia de contraste de fase incluyen interferencia diferencial (DIC) de contraste microscopia40 y técnicas de tinción simple para usan con campo brillante microscopios41, por ejemplo, tinción de cristal violeta.
8. realizar microscopía de fluorescencia
- Esterilizar pinzas por lavado en etanol al 70% y luego hasta la llama de un mechero de Bunsen.
- Recoger un cubreobjetos estéril con pinzas estériles y colóquela sobre una placa de agar de MS donde es evidente el crecimiento bacteriano. Toque suavemente la parte posterior del cubreobjetos con la pinza para asegurar a transferencia suficiente de esporas bacterianas y filamentos aéreos.
- Recoger el cubreobjetos de la placa y colocarla para que quede mirando hacia arriba, el lado con el material de la célula en cartulina para facilitar la manipulación del cubreobjetos.
- Inundar el cubreobjetos con metanol helada (~ 300 μL de un cubreobjetos de 20 x 20 mm2 ) y dejarlo secar al aire completamente.
PRECAUCIÓN: El metanol es un mutágeno. Evitar el contacto directo con la piel. - Lave el cubreobjetos tres veces en fosfato tampón salino (PBS)42 suministro y eliminación de la solución suavemente.
- Añadir 15 μl de 100 μg/ml de yoduro de propidio o aglutinina del germen de trigo de 10 μg/mL conjugado con isotiocianato de fluoresceína (FITC-WGA) hecho en glicerol al 50% a un portaobjetos de microscopio etiquetado.
Nota: El yoduro de propidio manchas ADN rojo para detectar la ubicación cromosómica de ADN mientras que WGA-FITC manchas verdes de la pared celular. - Invierta el cubreobjetos boca abajo sobre la gota de colorante fluorescente en el portaobjetos de cristal. (Opcionalmente) sellar con esmalte claro para la preservación de la diapositiva. Los colorantes son sensibles a la luz, incube durante 15 minutos en una habitación oscura o poco iluminada.
- Observar las diapositivas bajo una lente de objetivo 100 X con un contraste de fase o microscopio DIC equipado con cubos de excitación de epifluorescencia yoduro de propidio ('Texas Red' filtro establecido o máximos de excitación/emisión/617 535 nm) y FITC (FITC filtro conjunto o 490/525 nm máximos de excitación/emisión).
- Colocar el portaobjetos en el escenario y enfoque mediante las perillas de ajuste grueso y fino.
- Observar la fluorescencia como se indica en otra parte43.
- Utilice un paquete de software de análisis de imágenes que puede ayudar en la identificación de las esporas con menor fluorescencia intensidad44.
Resultados
Phenotyping inicial experimentos son necesarios para la caracterización de cepas y nuevas especies y pueden ser utilizados como un enfoque complementario a la filogenia y experimentos de hibridación de DNA de la DNA que se utilizan para la caracterización de nuevas especies. Streptomyces mutantes resultantes de los métodos de mutagénesis al azar tales como químicos, UV, o mutagénesis de transposon se identifican normalmente a través pantallas visuales directas en placas de agar. Colonias de Streptomyces se examinan los cambios en el fenotipo en comparación con la cepa de tipo salvaje, los padres. Por ejemplo, un micelio aéreo color ligero puede indicar un menor nivel de pigmento gris, causado por un defecto en la esporulación, o la falta de un aspecto borroso es indicativa de un bloque en la formación de micelio aéreo (figura 1). Muchos streptomycetes producen antibióticos pigmentados en micelio vegetativo o agar circundante. S. Coelicolor de los produce dos antibióticos pigmentadas como dos incoloras. Actinorhodin es un antibiótico de pigmentación azul y undecylprodigiosin es un antibiótico pigmentado rojo45. Cepas que han sido sometidos a pantallas de Colonia visual inicial luego se propagan por vetas de colonias individuales.
Tras la identificación visual de potencialmente interesantes mutantes, las cepas son sometidas a examen microscópico. Fase-Ponga en contraste microscopia es especialmente adecuada para examinar Streptomyces mutantes para defectos de desarrollo, utilizando la cepa de tipo salvaje como un control (figura 2). Colonias de S. Coelicolor de los de tipo salvaje suelen producen un micelio aéreo por cerca de dos días de crecimiento a 30 ° C en agar de MS y largas cadenas de esporas por tres días de crecimiento. El ciclo de vida progresará ligeramente más lento o más rápido en otros tipos de medios de comunicación. Es imprescindible analizar los mutantes en las mismas condiciones de crecimiento como el tipo salvaje, elaboración de conclusiones acerca de los defectos del desarrollo y retrasos. Calvos mutantes pueden producir esporas tras crecimiento prolongado en medios de agar. Una clase de mutantes conocido como mutantes blanco pueden retrasarse o bien por formación de esporas, muestran una reducción en la abundancia de esporas producidas, producen esporas con defectos de forma o tamaño, o simplemente producen niveles más bajos de la espora madura, gris pigmento46 . Otros mutantes investigados hasta el momento pueden ser retrasados o acelerados en la progresión del ciclo de vida como los mutantes afectados por la acumulación de moléculas (por ejemplo, -di-GMP cíclico47) de señalización.
Un simple seguimiento de la técnica de microscopía de luz descrita es microscopia de fluorescencia utilizando yoduro de propidio para manchas nucleoids de ADN cromosómicos y la aglutinina de fluorescencia etiquetada germen de trigo a la mancha de la pared celular de los septos de la esporulación. Esporas que carecen de un cromosoma será desprovisto de la roja propidio coloración, mientras que las esporas que contienen menos ADN que generalmente puede ser identificado si parecen haber disminuido manchas (figura 3). Aglutinina de germen de trigo se puede utilizar para manchar la pared celular y pueden observarse diferencias en patrones (es decir, defectos de la división de célula) la coloración de la pared celular. En figura 4 el tipo de cepa de S. venezuelaa, una especie que recientemente está siendo utilizada como otro modelo streptomycete debido a su rápido ciclo de vida y capacidad para esporular en líquido45, ha sido manchada con WGA-FITC para aclarar la escalera-como matriz de tabiques de división que se consideran típicamente temprano durante la esporulación.
Las estrategias de fenotipado inicial descritas aquí deben resultar en lo siguiente: 1) identificación de cepas mutantes de interés para el estudio adicional; 2) conocimientos sobre el mutante recientemente identificado y el papel potencial del gen que ha sido transformado; 3) la formulación de una serie subsecuente de pasos experimentales que pueden usarse para aclarar aún más el papel del gen en cuestión. En el caso de un streptomycete nuevamente identificado del ambiente, el investigador obtendrán conocimiento de las potenciales nuevas especies comparadas ya caracterizado especies de Streptomyces.

Figura 1: Fotografía de una placa de agar representativos que demuestran fenotipos macroscópico de la colonia de S. Coelicolor de los. La placa de agar muestra difusa, gris aspecto visual del micelio aéreo de tipo salvaje S. Coelicolor de los cepa MT1110 (WT) en comparación con varios mutantes de inserción transposones aleatorio con fenotipos del desarrollo. Mutantes o bien carecen de un micelio aéreo [Calvo (bld)] o un micelio aéreo con pigmentación reducida espora [blanco (whi)]. Mutantes de Transposon se generaron usando mini-Tn5 de mutagénesis de inserción6,7. Las cepas fueron cultivadas en agar de MS por 5 días a 30 ° C. Diámetro de plato de Petri, 100 mm.
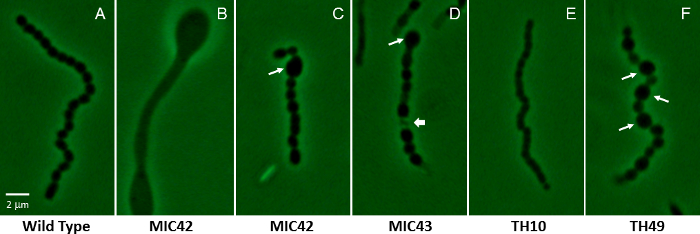
Figura 2: Imágenes de contraste de fase mostrando un representante aéreo filamento para el mutante de S. Coelicolor de los blancos las cepas que contienen mutaciones de inserción aleatoria transposon. (A) se muestra es un filamento aéreas representativas de tipo salvaje que ha sufrido sincrónicas, regularmente espaciadas las divisiones de célula, produciendo uniformemente en forma y tamaño de las esporas (MT1110). (B–F) Los paneles restantes muestran los muy diferentes fenotipos microscópicos de varios mutantes blancos que fueron aislados mediante mutagénesis de transposon al azar. Panel B muestra un filamento aéreo que no ha sufrido la esporulación, pero que en cambio ha producido zonas abultadas en el filamento. Las flechas largas en C, Dy F indican anormalmente grandes esporas que son característicos de los mutantes MIC42, MIC43 y TH49. La flecha corta en panel D indica un ejemplo de un compartimiento de esporas sometidas a lisis. El panel E muestra los compartimientos más pequeños parcialmente estrechos que son típicos de las cadenas de esporas producidas por mutante TH10. Las cepas fueron cultivadas en agar de MS por 5 días a 30 ° C. Los mutantes están relacionadas con las que se muestran en la figura 1. Una espora de tipo salvaje es aproximadamente 1.1 μm en el eje largo. Barra de escala = 2 μm. haga clic aquí para ver una versión más grande de esta figura.
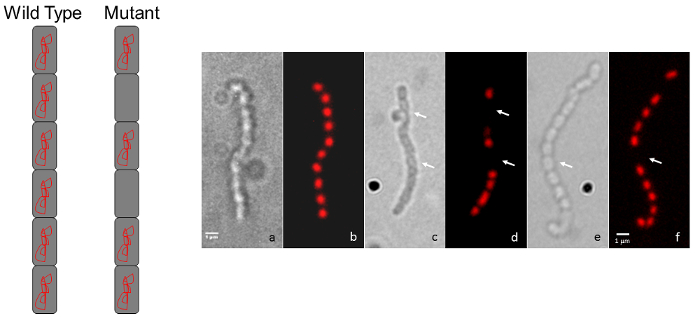
Figura 3: Micrografías representativas que muestran cromosoma mutante de S. Coelicolor de los fenotipos de segregación. (A) A diagrama representación muestra el típico aspecto tinción tipo salvaje, regularmente espaciadas para una cadena de esporas (cada espora contiene ADN cromosómico) en comparación con el patrón de tinción intermitente en un mutante que muestra un cromosoma defecto de la segregación. (B) cada par de paneles muestra la misma espora cadena observada por imagen de contraste de interferencia diferencial (DIC) de la izquierda y una imagen de fluorescencia teñido de yoduro de propidio es mostrada a la derecha. El fenotipo de tipo salvaje (a, b) es comparado con dos mutantes de inserción del transposón al azar (c, d y e, f). Las flechas indican las esporas carente de ADN. Las cepas fueron cultivadas en agar de MS por 5 días a 30 ° C. Los mutantes que se muestra están relacionados con los de la figura 1 y figura 2. Barra de escala = 1 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Micrografía de la fluorescencia de la cepa de tipo salvaje de venezuelaa S. teñido con WGA-FITC. (A) A esquema de un filamento aéreo aparece lisa sin hendiduras y no hay signos visibles de esporulación mediante microscopía de contraste de fase en comparación con la matriz de escala-como de la coloración de la pared celular que indica una etapa temprana de la esporulación ha comenzó en ese mismo filamento usando WGA-FITC bajo microscopía de fluorescencia. (B) imágenes de tipo salvaje S. venezuelaa. (a) liso filamentos aéreos están presentes entre las cadenas de esporas. (b) en el micelio se muestra en el panel, una antena filamento en una etapa temprana de desarrollo posee una escalera-como variedad de deposición de la pared celular. Las flechas indican la formación regularmente espaciados de Cruz paredes manchadas por WGA-FITC que desarrollar sincrónicamente dentro de un solo filamento aéreo sufre asociados al desarrollo de la esporulación. La cepa fue cultivada en agar MYM MYM (altoseM, Yeste extracto, extracto alt M) 38 h a 30 ° C. Barra de escala = 2 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí presentamos protocolos para partir del Streptomyces investigadores para iniciar estudios incluyendo los pasos necesarios para propagar cepas y preparar acciones para el almacenamiento a largo plazo. A continuación describimos los protocolos para la caracterización visual y microscópico de cepas de Streptomyces . Algunos pasos iniciales típicos en mutantes desarrollo phenotyping son: 1) examen visual de las colonias mutantes en comparación con el tipo salvaje colonias en medio agar; 2) microscopía de fase-ponga en contraste; y 3) microscopía de fluorescencia de hifas aéreas sporogenic. Según el fenotipo muestra en estos tres pasos, se puede emplear una variedad de técnicas más discernir el fenotipo de una cepa particular.
Experimentos iniciales phenotyping comúnmente se utilizan para caracterizar especies nuevas, identificar a mutantes de interés, parcialmente caracterizar a mutantes y comienzan a discernir el papel típico de un gen en particular basado en el fenotipo de un mutante identificado. Los métodos aquí descritos ya han sido utilizados en laboratorios para identificar y caracterizar una amplia variedad de mutantes de Streptomyces , los defectos incluidos en la división celular48,49, de docencia universitaria 50 , 51 , 52 , 53 , 54, esporulación55,56, micelio aéreo formación57,58, producción de antibióticos59, segundo mensajero señalización47y segregación cromosómica 60. estas técnicas son los primeros pasos vitales para determinar el fenotipo de los mutantes en general y revelan una gran cantidad de información importante sobre las funciones de los genes de interés. Los métodos pueden extenderse fácilmente a otras especies de Streptomyces y ya han sido utilizados para describir las cepas de S. griseus, S. venezuelaa, S. sarnay muchos otros streptomycetes. El videos protocolos descritos aquí deben servir como un recurso importante para nuevos investigadores entrar en campos de investigación de Streptomyces , como en el área de descubrimiento de fármacos. Esto incluye los nuevos instructores que trabajan para combatir la crisis de resistencia a los antibióticos y educar a los innumerables investigadores estudiante universitario unirse a los esfuerzos de crowdsourcing de la iniciativa de mundo pequeño.
Las técnicas descritas aquí pueden ser fácilmente adaptadas para uso de aula college y high School secundaria además de laboratorios de investigación, con las modificaciones descritas en el video y el texto. Los estudiantes en un primer módulo de microscopia de año en un Colegio de artes liberales pequeños fueron capaces de cepas de la raya, tomar fotografías digitales de las cepas cultivadas en medios de agar y realizar microscopía de contraste de fases y fluorescencia, lo que culminó con la presentación de un cartera de múltiples paredes figuras al final del módulo 3 semana, representando a 15 h de trabajo en el laboratorio. Aproximadamente 160 primeros estudiantes del año fueron responsables de la inicial phenotyping de mutantes novela transposon 320. Estudiantes de investigación en tres instituciones participaron en el fenotipo inicial de mutantes adicionales y la posterior caracterización de muchas de las cepas. Los datos obtenidos en un período relativamente corto de tiempo, ilustran el valor de los protocolos descritos aquí. Cientos de mutantes adicionales almacenados como existencias micelial de glicerol para la futura caracterización.
Tras los iniciales experimentos descritos aquí, una variedad de métodos puede emplearse para ampliar la calidad de la información relacionada con las cepas de interés. Si la mutación es desconocida, debe emplearse un método de genotipificación para determinar el tipo o la localización de la mutación. Por ejemplo, mutagénesis de transposon al azar del cromosoma de tipo salvaje6,7,8,9,10,11,12,13 resultados de colonias que deben experimentar iniciales fenotípicas pantallas como las que se describen arriba. Entonces debe identificarse la ubicación de los transposones usando una técnica como la inversa de la polimerasa de reacción en cadena (iPCR)61. Determinar el genotipo de mutantes recién descubiertos es un paso importante tras la caracterización inicial.
Algunos comúnmente utilizados métodos avanzados de análisis phenotyping posterior que se mencionaron en el aula o explorado a través de la investigación incluyen la proteína fluorescente verde (GFP) marcado para determinar los patrones de localización de la proteína de interés, Análisis de expresión génica como real tiempo de PCR cuantitativa (qPCR) y patrones de expresión génica global de tipo salvaje y mutante mediante secuenciación de ARN (RNA-seq). Phenotyping habilidades también son necesarios para el análisis de la complementación genética. En un experimento de la complementación, la copia de un gen de tipo salvaje es introducida en una cepa mutada para determinar si el alelo recién agregado puede compensar la pérdida de función del alelo mutado. Comparando el fenotipo de la cepa complementa a la de la mutante original y el parental, cepa de tipo salvaje es necesario.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean reconocer la Universidad Otterbein para becas de investigación de estudiantes de pregrado y los premios fondo de investigación de estudiantes GVK y SGK; y el Memorial de profesor Gilbert E. molinos Otterbein había dotado Premio programa sabáticos y el Departamento de biología y Ciencias de la tierra Facultad investigación y beca habían dotado Premio a JAB. El Bert y Jane cuerno dotado estudiante de investigación del fondo en las Ciencias fue otorgado a GVK y SGK. Los autores también gustaría agradece que Universidad Duquesne financiado becas de programa de investigación de pregrado de GVK y SGK. Ex Juniata investigación universitarios, Lindsey Draper y Ryan Johnson contribuyeron con las imágenes de microscopía para las figuras 2 y 3, respectivamente.
Materiales
| Name | Company | Catalog Number | Comments |
| 50% Glycerol | Sigma-Aldrich | G5516 | |
| Immersion Oil (Type DF) | Cragille | 16482 | |
| Lens Paper | Fisherbrand | 11-995 | |
| Sterile Water | GeneMate | G-3250-1L | |
| 100% Ethanol | Sigma-Aldrich | E7023 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Toothpicks (flat) | Target | 081-22-1957 | |
| Pipette Tips (10 ml) | GeneMate | P-1240-10 | |
| Pipette Tips (200 ml) | GeneMate | P-1240-200Y | |
| Pipette Tips (1250 ml) | GeneMate | P-1240-1250 | |
| Wooden Applicators 6'' | Solon Care | 070809 | |
| Cotton Swabs | Fisherbrand | 23-400-124 | |
| Soy Flour | Bob's Red Mill | 1516C164 | |
| D-Mannitol | Sigma-Aldrich | M4125-1KG | |
| Agar | Sigma-Aldrich | A1296-1KG | |
| Glycerol 100% | VWR amresco life science | 0854-1L | |
| 0.8% NaCl (Saline) | Sigma-Aldrich | SLBB9000V | |
| 1.2 mL freezer tube | NEST | 606101 | |
| Ultra low (-80°C) freezer | SO-LOW | U85-18 | |
| Cryo Safety Gloves | Bel-Art | H13201 | |
| Petri dishes | Sigma-Aldrich | P5856-500EA | |
| Cover slips #1.5 | Thomas Scientific | 64-0721 | |
| Slides | Carolina | 63-2010 | |
| Autoclave | Tuttnauer | 2540E | |
| Phase-Contrast Microscope | Olympus | BX40 | |
| Forceps | Carolina Biological | 624504 | |
| Bunsen Burner | Carolina Biological | 706706 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| PBS (phosphate buffer saline) | Sigma-Aldrich | P4417-50TAB | |
| WGA-FITC | Biotium | 29022-1 | |
| Clear nail polish | OPI | 22001009000 | |
| Image J | NIH | Free Software | |
| 100 mL beaker | Pyrex USA | 1000-T | |
| 1 L beaker | Carolina Biological | 721253 | |
| 1 L flask | Fisherbrand | S63274 | |
| 250 mL flask | Pyrex USA | 4980 | |
| 100 mL graduated cylinder | Carolina Biological | 721788 | |
| 500 mL graduated cylinder | Carolina Biological | 721792 | |
| Stir Bar | Fisher Scientific | 22-271825 | |
| Centrifuge | Eppendorf | 5810R | |
| Camera for Microscope | Olympus | DP72 | |
| Nitrile Examination Gloves (Med) | Bio Excell | 71011002 | |
| Vortex Mixer | Carolina Biological | 701077 |
Referencias
- Barka, E. A., et al. Taxonomy, physiology, and natural products of Actinobacteria. Microbiol. Mol. Biol. Rev. 80 (1), 1-43 (2015).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (2), 141-147 (2002).
- Redenbach, M., et al. A set of ordered cosmids and a detailed genetic and physical map for the 8 Mb Streptomyces coelicolor A3(2) chromosome. Mol. Microbiol. 21 (1), 77-96 (1996).
- McCormick, J. R., Flardh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36 (1), 206-231 (2012).
- Flardh, K., Buttner, M. J. Streptomyces morphogenetics: dissecting differentiation in a filamentous bacterium. Nat. Rev. Microbiol. 7 (1), 36-49 (2009).
- Bennett, J. A. . Molecular Genetic analysis of division and development in Streptomyces coelicolor. , (2007).
- Hull, T. D., et al. Cyclic Di-GMP phosphodiesterases RmdA and RmdB are involved in regulating colony morphology and development in Streptomyces coelicolor. J. Bacteriol. 194 (17), 4642-4651 (2012).
- Petzke, L., Luzhetskyy, A. In vivo Tn5-based transposon mutagenesis of streptomycetes. Appl. Microbiol. Biotechnol. 83 (5), 979-986 (2009).
- Xu, Z., et al. Large-Scale Transposition Mutagenesis of Streptomyces coelicolor Identifies Hundreds of Genes Influencing Antibiotic Biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Fernandez-Martinez, L. T., et al. A transposon insertion single-gene knockout library and new ordered cosmid library for the model organism Streptomyces coelicolor A3(2). Antonie Van Leeuwenhoek. 99 (3), 515-522 (2011).
- Gehring, A. M., Nodwell, J. R., Beverley, S. M., Losick, R. Genomewide insertional mutagenesis in Streptomyces coelicolor reveals additional genes involved in morphological differentiation. Proc. Natl. Acad. Sci. U.S.A. 97 (17), 9642-9647 (2000).
- Bishop, A., Fielding, S., Dyson, P., Herron, P. Systematic insertional mutagenesis of a streptomycete genome: a link between osmoadaptation and antibiotic production. Genome Res. 14 (5), 893-900 (2004).
- Bilyk, B., Weber, S., Myronovskyi, M., Bilyk, O., Petzke, L., Luzhetskyy, A. In vivo random mutagenesis of streptomycetes using mariner-based transposon Himar1. Appl. Microbiol. Biotechnol. 97 (1), 351-359 (2013).
- Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. F., Hopwood, D. A. . Practical Streptomyces Genetics. , (2000).
- Gust, B., Kieser, T., Chater, K. F. . REDIRECT technology: PCR-targeting system in Streptomyces coelicolor. , (2002).
- Gust, B., Chandra, G., Jakimowicz, D., Yuqing, T., Bruton, C. J., Chater, K. F. Lambda red-mediated genetic manipulation of antibiotic-producing Streptomyces. Adv. Appl. Microbiol. 54, 107-128 (2004).
- Tong, Y., Charusanti, P., Zhang, L., Weber, T., Lee, S. Y. CRISPR-Cas9 based engineering of Actinomycetal genomes. ACS Synth. Biol. 4 (9), 1020-1029 (2015).
- Huang, H., Zheng, G., Jiang, W., Hu, H., Lu, Y. One-step high-efficiency CRISPR/Cas9-mediated genome editing in Streptomyces. Acta BiochimBiophys. Sin.(Shanghai). 47 (4), 231-243 (2015).
- Cobb, R. E., Wang, Y., Zhao, H. High-efficiency multiplex genome editing of Streptomyces species using an engineered CRISPR/Cas system. ACS Synth. Biol. 4 (6), 723-728 (2015).
- Carey, M. F., Peterson, C. L., Smale, S. T. PCR-mediated site-directed mutagenesis. Cold Spring Harb Protoc. 2013 (8), 738-742 (2013).
- Brown, E. D., Wright, G. D. Antibacterial drug discovery in the resistance era. Nature. 529 (7586), 336-343 (2016).
- Dodds, D. R. Antibiotic resistance: A current epilogue. Biochem. Pharmacol. 134, 139-146 (2017).
- Caruso, J. P., Israel, N., Rowland, K., Lovelace, M. J., Saunders, M. J. Citizen Science: The Small World Initiative improved lecture grades and California critical thinking skills test scores of nonscience major students at Florida Atlantic University. J. Microbiol. Biol. Educ. 17 (1), 156-162 (2016).
- Davis, E., et al. Antibiotic discovery throughout the Small World Initiative: A molecular strategy to identify biosynthetic gene clusters involved in antagonistic activity. Microbiology Open. 6 (3), (2017).
- van Keulen, G., Dyson, P. J. Production of specialized metabolites by Streptomyces coelicolor A3(2). Adv. Appl. Microbiol. 89, 217-266 (2014).
- Aigle, B., et al. Genome mining of Streptomyces ambofaciens. J. Ind. Microbiol. Biotechnol. 41 (2), 251-263 (2014).
- Antoraz, S., Santamaria, R. I., Diaz, M., Sanz, D., Rodriguez, H. Toward a new focus in antibiotic and drug discovery from the Streptomyces arsenal. Front. Microbiol. 6, 461 (2015).
- Onaka, H. Novel antibiotic screening methods to awaken silent or cryptic secondary metabolic pathways in actinomycetes. J. Antibiot.(Tokyo). 70 (8), 865-870 (2017).
- Chen, J., Wu, Q., Hawas, U. W., Wang, H. Genetic regulation and manipulation for natural product discovery. Appl. Microbiol. Biotechnol. 100 (7), 2953-2965 (2016).
- Katz, L., Baltz, R. H. Natural product discovery: past, present, and future. J. Ind. Microbiol. Biotechnol. 43 (2-3), 155-176 (2016).
- Liu, G., Chater, K. F., Chandra, G., Niu, G., Tan, H. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiol. Mol. Biol. Rev. 77 (1), 112-143 (2013).
- den Hengst, C. D., Tran, N. T., Bibb, M. J., Chandra, G., Leskiw, B. K., Buttner, M. J. Genes essential for morphological development and antibiotic production in Streptomyces coelicolor are targets of BldD during vegetative growth. Mol. Microbiol. 78 (2), 361-379 (2010).
- Tran, N. T., Den Hengst, C. D., Gomez-Escribano, J. P., Buttner, M. J. Identification and characterization of CdgB, a diguanylate cyclase involved in developmental processes in Streptomyces coelicolor. J. Bacteriol. 193 (12), 3100-3108 (2011).
- Anonymous. Lab Safety. Proper Use of Autoclaves. JoVE Science Education Database. , (2017).
- Border, B. G., Rice-Spearman, L. Microwaves in the laboratory: effective decontamination. Clin. Lab. Sci. 12 (3), 156-160 (1999).
- Bhattacharjee, M. K., Delsol, J. K. Does microwave sterilization of growth media involve any non-thermal effect?. J. Microbiol. Methods. 96, 70-72 (2014).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J. Vis. Exp. (63), e3064 (2012).
- Anonymous, General Laboratory Techniques. An Introduction to the Micropipettor. JoVE Science Education Database. , (2017).
- Baltz, R. H. Genetic manipulation of secondary metabolite biosynthesis for improved production in Streptomyces and other actinomycetes. J. Ind. Microbiol. Biotechnol. 43 (2-3), 343-370 (2016).
- Frohlich, V. C. Phase Contrast and Differential Interference Contrast (DIC) Microscopy. J. Vis. Exp. (18), e844 (2008).
- Anonymous, General Laboratory Techniques. Introduction to Light Microscopy. JoVE Science Education Database. , (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory. 3, (1989).
- Anonymous, General Laboratory Techniques. Introduction to Fluorescence Microscopy. JoVE Science Education Database. , (2017).
- Jensen, E. C. Quantitative analysis of histological staining and fluorescence using ImageJ. Anat. Rec.(Hoboken). 296 (3), 378-381 (2013).
- Chater, K. F. Recent advances in understanding Streptomyces. F1000Res. 5, (2016).
- Chater, K. F. Regulation of sporulation in Streptomyces coelicolor A3(2): a checkpoint multiplex?. Curr. Opin. Microbiol. 4 (6), 667-673 (2016).
- Tschowri, N. Cyclic dinucleotide-controlled regulatory pathways in Streptomyces species. J. Bacteriol. 198 (1), 47-54 (2016).
- Bennett, J. A., et al. Medium-dependent phenotypes of Streptomyces coelicolor with mutations in ftsI or ftsW. J. Bacteriol. 191 (2), 661-664 (2009).
- Mistry, B. V., Del Sol, R., Wright, C., Findlay, K., Dyson, P. FtsW is a dispensable cell division protein required for Z-ring stabilization during sporulation septation in Streptomyces coelicolor. J. Bacteriol. 190 (16), 5555-5566 (2008).
- Bennett, J. A., Aimino, R. M., McCormick, J. R. Streptomyces coelicolor genes ftsL and divIC play a role in cell division but are dispensable for colony formation. J. Bacteriol. 189 (24), 8982-8992 (2007).
- Bennett, J. A., McCormick, J. R. Two new loci affecting cell division identified as suppressors of an ftsQ-null mutation in Streptomyces coelicolor A3(2). FEMS Microbiol. Lett. 202 (2), 251-256 (2001).
- Dharmatilake, A. J., Kendrick, K. E. Expression of the division-controlling gene ftsZ during growth and sporulation of the filamentous bacterium Streptomyces griseus. Gene. 147 (1), 21-28 (1994).
- McCormick, J. R., Losick, R. Cell division gene ftsQ is required for efficient sporulation but not growth and viability in Streptomyces coelicolor A3(2). J. Bacteriol. 178 (17), 5295-5301 (1996).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor mutant for the cell division gene ftsZ. Mol. Microbiol. 14 (2), 243-254 (1994).
- Flärdh, K., Findlay, K. C., Chater, K. F. Association of early sporulation genes with suggested developmental decision points in Streptomyces coelicolor A3(2). Microbiology. 145 (9), 2229-2243 (1999).
- van Wezel, G. P., van der Meulen, J., Kawamoto, S., Luiten, R. G., Koerten, H. K., Kraal, B. ssgA is essential for sporulation of Streptomyces coelicolor A3(2) and affects hyphal development by stimulating septum formation. J. Bacteriol. 182 (20), 5653-5662 (2000).
- Capstick, D. S., Willey, J. M., Buttner, M. J., Elliot, M. A. SapB and the chaplins: connections between morphogenetic proteins in Streptomyces coelicolor. Mol. Microbiol. 64 (3), 602-613 (2007).
- Ma, H., Kendall, K. Cloning and analysis of a gene cluster from Streptomyces coelicolor that causes accelerated aerial mycelium formation in Streptomyces lividans. J. Bacteriol. 176 (12), 3800-3811 (1994).
- Xu, Z., et al. Large-scale transposition mutagenesis of Streptomyces coelicolor identifies hundreds of genes influencing antibiotic biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Dedrick, R. M., Wildschutte, H., McCormick, J. R. Genetic interactions of smc, ftsK, and parB genes in Streptomyces coelicolor and their developmental genome segregation phenotypes. J. Bacteriol. 191 (1), 320-332 (2009).
- Pavlopoulos, A. Identification of DNA sequences that flank a known region by inverse PCR. Methods Mol. Biol. 772, 267-275 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados