Method Article
Avaliação visual e microscópica de Streptomyces mutantes do desenvolvimento
Neste Artigo
Resumo
Aqui nós apresentamos protocolos para iniciante pesquisadores para iniciar fenotipagem para farmacologicamente importante bacteriana gênero Streptomyces.
Resumo
Estreptomicetos são bactérias filamentosas solo do filo Actinobacteria que são encontrados em todo o mundo e produzir uma ampla gama de antibióticos e outros metabólitos secundários. Streptomyces coelicolor é uma espécie bem caracterizada, não-patogênico que é passível de uma variedade de análises no laboratório. Os métodos de fenotipagem descritos aqui usam coelicolor S. como um modelo streptomycete; no entanto, os métodos são aplicáveis a todos os membros deste grande gênero, bem como alguns actinomicetos estreitamente relacionados. Fenotipagem é necessária para caracterizar novas espécies de Streptomyces identificado no ambiente, e também é um primeiro passo vital na caracterizando recém isoladas estirpes mutantes de Streptomyces. Proficiência em fenotipagem é importante para os pesquisadores de novos muitos que estão entrando em campo de pesquisa de Streptomyces , que inclui o estudo do desenvolvimento bacteriano, divisão celular, segregação do cromossomo e segundo mensageiro sinalização. O crowdsourcing recente de antibiótica descoberta através do isolamento de novos micróbios do solo, resultou em uma maior necessidade de treinamento em fenotipagem para instrutores de novos para o campo de pesquisa de Streptomyces e sua faculdade ou escola estudantes. Este manuscrito descreve métodos para a propagação de estirpe bacteriana, armazenamento e caracterização através de exame visual e microscópico. Depois de ler este artigo, novos pesquisadores (laboratórios de ensino de Microbiologia e cidadão cientistas) devem ser capazes de manipular cepas de Streptomyces e começar as experiências de caracterização visual.
Introdução
Estreptomicetos são bactérias gram-positivas, filamentosas solo conhecidas por sua capacidade de produzir uma variedade de metabólitos secundários, incluindo mais de dois terços dos antibióticos disponíveis comercialmente, também como anti-tumor, drogas anti-HIV e anti-parasitários 1. S. coelicolor é o membro mais geneticamente caracterizado do género2,3 e é a espécie utilizada em métodos descritos aqui. S. coelicolor tem um complexo ciclo de vida que começa com a germinação de um esporo único, progredindo para um micélio vegetativo extenso, ramificação que cresce no meio de ágar-ágar. Como o ciclo de vida do produto, aerial filamentos são formados que quebrar a tensão superficial de micélio do substrato e dividem-se, finalmente, em longas cadeias de células que em última análise, são convertidas em esporos maduros, cinza-pigmentadas. Dispersão destes esporos recém-formado constitui o início do próximo ciclo de vida4.
Por causa do seu complexo padrão de diferenciação, S. coelicolor serve como um excelente modelo para o estudo do desenvolvimento bacteriano. Historicamente, as mutações resultam em blocos para dois diferentes estágios de desenvolvimento e produzem fenótipos visuais distintos. Os mutantes (careca) bld são bloqueados para a formação de micélio aéreo e resultado na falta de um micélio aéreo difusa transmitir uma aparência de colônia "careca". Os mutantes inibida na formação de esporos e maturação são referidos como os mutantes whi (branco), porque eles normalmente não produzem níveis do selvagem-tipo do pigmento cinza de esporos e o micélio aéreo permanece branco. Outros mutantes interessantes são inibidos na produção de antibióticos, divisão celular, segregação do cromossomo ou outros processos importantes4,5.
Apesar da descoberta de genes de desenvolvimento de muitas espécies de Streptomyces , há muitos mais acreditava existir com base na falta de saturação de telas mutantes. Nossos laboratórios continuam a identificar novos genes de desenvolvimento usando um sistema de transposon mini que temos construído. Romance mutantes cepas isoladas em experimentos de mutagênese aleatória com nosso transposon passam por triagem fenotípica para identificar o possível papel de cada novo gene descoberto6,7. Os métodos para fenotipagem bacteriana descritos aqui são relevantes para os mutantes de Streptomyces isolados por transposon mutagênese8,9,10,11,12, 13 e outros métodos aleatórios, tais como químicos e raios ultravioleta (UV) mutagênese14, bem como a construção dirigida de mutações tais como exclusões de gene usando recombineering15,16 ou CRISPR-Cas9 (Clustered regularmente intercaladas curta palíndromo repete) genoma tecnologia17,18,19 e mutações pontuais20de edição.
Como a resistência aos antibióticos entre patógenos torna-se cada vez mais prevalente, a necessidade de novos antibióticos torna-se cada vez mais urgente21,22. A "Iniciativa de mundo pequeno" (ou SWI) é uma efetiva ciência, tecnologia, engenharia e matemática (STEM) aprendizagem23 e pesquisa estratégia24 para combater a resistência aos antibióticos através do crowdsourcing de estudantes universitários e muito mais recentemente a alunos do ensino médio. Suporte para cursos de trabalho inclui a identificação de novos micróbios do solo que produzem novos antibióticos (http://www.smallworldinitiative.org). Acredita-se que das principais fontes de antibióticos não descobertos continuará a ser espécies de Streptomyces encontraram em uma ampla gama de solo e água dos habitats25,26,,27,28, 29,31. Recentemente, nosso laboratório e o trabalho de outros têm descoberto e caracterizado sinalização genes em espécies de Streptomyces que regulam a morfologia e desenvolvimento, incluindo a produção de antibióticos7,32, 33. Mudanças na expressão destes genes resultam em uma mudança na quantidade e tempo de antibióticos produzidos. Qualificados fenotipagem de novas espécies e novos mutantes produtora de antibiótico vai continuar a ser importante. Como novos instrutores e seus alunos tornam-se maiores contribuintes para o domínio da descoberta de drogas, formação em fenotipagem bacteriana é necessária para o sucesso destes indivíduos de principiante. Além disso, estas experiências são tractable para escola haste ou laboratórios de ensino de Microbiologia de universitários. Eles representam uma demonstração dos princípios básicos de genéticas microbianas em um laboratório de ensino definindo.
Protocolo
1. preparar instrumentos, meios de cultura, soluções e placas de Petri
- Palitos de autoclave em um copo de 50 mL, coberto com papel de alumínio para manter estéril.
- Esterilizar todos os produtos secos que será usado (dicas, varas, vidraria, etc.) em uma autoclave.
Nota: cuidado! Siga todas as instruções de segurança para o modelo de autoclave usado. Autoclaves representam um risco de explosões e queimaduras de vapor e o contato com superfícies quentes, materiais e meios de comunicação. Para segurança de autoclave, ver "Uso adequado de Autoclaves"34. -
Prepare a MS agar (manitol soja farinha (SFM))14 a crescer culturas.
- Adicione 5 g de farinha de soja e 5 g de ágar-ágar ao frasco de 1 L.
- Dissolver 5 g de manitol em 250 mL de água da torneira e dispense o balão contendo a farinha de soja e agar.
- Adicione um plug de espuma e papel, para a abertura do frasco e autoclave a 121 ° C, 15 psi para pelo menos 30 min.
Atenção: Este meio facilmente ferve. Use um balão que pode conter pelo menos quatro vezes o volume real de ágar MS ser autoclavado. Uma panela de pressão padrão pode ser usada no lugar de uma autoclave com considerações de segurança semelhantes. Alternativamente, um forno de microondas pode ser utilizado para esterilizar materiais e meios de comunicação se acesso a uma autoclave não é possível35,36. Professores do ensino médio também podem querer colaborar com locais faculdades ou universidades para acessar o material esterilizado. - Mídia legal até confortável o suficiente para manipular. Tenha cuidado para não resfriá-lo por muito tempo porque o ágar solidifies em temperaturas abaixo de 50 ° C.
- Agar de MS do recipiente despeje pratos de Petri estéril até que o fundo de cada prato de Petri é aproximadamente metade cheio (cerca de 25 mL de mídia por placa de Petri). Deixe para solidificar antes de usar placas de ágar. Armazenar placas de ágar em um saco plástico à temperatura ambiente até que seja necessário.
Nota: Placas de ágar também podem ser armazenadas em geladeira, especialmente se os antibióticos são necessários na mídia.
2. raia Streptomyces nas chapas para propagação
- Cepas de Streptomyces raia em placas de ágar MS para colônias simples, usando um método padrão, tais como o quadrante marcam método, conforme mostrado na Sanders, 201237.
Nota: Um loop inoculando ou palitos estéril podem ser usados. Opcional: Outras mídias são comumente usadas para espécies de Streptomyces , como R2YE e media mínimos14. - Incubar as placas a 30 ° C.
- Restreak placas escolhendo uma única colônia cada 4 – 6 dias. Como idade de colônias tornam-se propenso a mutação aleatória.
3. criar ações micelial de glicerol para armazenamento bacteriano
Nota: Micelial estoques podem ser criados para todas as cepas de Streptomyces , incluindo whi e estirpes bld e outros mutantes do desenvolvimento que são incapazes de completar a esporulação.
- Macerar 15 – 20 colônias em 200-500 µ l de glicerol 20% usando um aplicador estéril passador de madeira.
- Transfira a pasta das colónias maceradas para um tubo de cultura de congelador 1,5 mL, utilizando uma micropipeta ou pipeta de transferência estéril.
Nota: As noções básicas de uso micropipeta são cobertas em outro lugar38. - Adicionar suficiente 20% de glicerol para tornar o volume final 1 mL e misture suavemente. Armazenar as amostras a-80 ° C.
Nota: cuidado! Criogênico uso luvas e avental para proteger a pele do contato com frio extremo. Alternativamente, um congelador-20 ° C pode ser usado com potencial redução no tempo de armazenamento de longo prazo. Evite excesso de congelação e descongelação para estender a viabilidade.
4. criar estoques de esporos de glicerol para cepas capazes de esporulação
Nota: Estoques de esporos são preferíveis para a viabilidade a longo prazo, mas só são viáveis para as tensões que são capazes de completar a esporulação.
-
Espalhou-se 100 µ l de material macerado (da etapa 3.1) sobre uma placa de ágar para obter um gramado confluente de crescimento37.
Nota: Chapeamento de propagação é mostrado em Sanders37 (modificação: um toca-discos não é necessário.). A placa pode ser transformada com uma mão enquanto com a outra mão para mover o espaçador em um delicado e para trás movimento em toda a mídia de ágar.- Pipetar 100 µ l de micélio macerado para o centro de uma placa de ágar de MS.
- Esterilize um vidro ou metal espalhando ferramenta parcialmente submergindo em etanol a 70% e passando o propagador uma vez lentamente através de uma chama do bico de Bunsen para acelerar a evaporação do etanol.
Cuidado: O álcool etílico é altamente inflamável. Não coloque o difusor em chamas em etanol ou permitir a gota em chamas de etanol cair o prato de etanol. Como alternativa, use um cotonete estéril descartável para espalhar as bactérias na placa, que não requer etanol ou chama. - Vez o ágar MS placa com uma mão, enquanto usando um back movimento para trás e para semear a placa com o espalhador estéril.
- Incube durante 5-7 dias a 30 ° C até que a tensão é bem esporulada.
Nota: Tempos de incubação pode variar dependendo da espécie e estirpe.
- Adicionar 2 mL de solução salina estéril (0,8% NaCl) ao centro de um gramado confluente de Streptomyces células que se submeteu a esporulação.
- Colheita de esporos, esfregando suavemente a superfície de micélio com um estéril inocular loop (ou um cotonete), lentamente se movendo em direção à borda do gramado.
- Pipetar o salina contendo esporos em um tubo cônico de 15 mL. Vórtice vigorosamente para quebrar cadeias de esporos em células individuais.
- Centrifugar a temperatura ambiente por 5 min à aproximadamente 2.500 x g.
- Pipetar o sobrenadante e descarte. Disperse a pelota de esporos por agitação vigorosa vórtice na pequena quantidade de líquido restante.
- Resuspenda os esporos em 1 mL de glicerol 20% pelo desenho da solução acima e para baixo com uma pipeta.
- Transferi o estoque de esporos de glicerol a um tubo do congelador de 1,5 mL. Loja a-80 ° C.
Cuidado: Use luvas de segurança criogênicas e um avental para proteger a pele do contato com frio extremo. Alternativamente, um congelador-20 ° C pode ser usado com redução potencial de viabilidade no tempo de armazenamento de longo prazo. Evite excesso de congelação e descongelação para estender a viabilidade.
5. executar o Mutagenesis
- Execute mutagênese com base nos resultados desejados como referenciado na introdução e recentemente revisado por Baltz, 201639.
Nota: Alguns experimentos de fenotipagem não exigirá mutagênese, tais como a intenção de identificar novas espécies do ambiente. Métodos de mutagênese aleatória incluem o uso de um transposon8,9,10,11,12,13, radiação UV ou produtos químicos,14. Local-dirigido mutagênese15,16,17,18,19,20 técnicas podem ser usadas para criar específicas mutações pontuais, deleções, ou outros tipos de mutações.
6. comparar e registrar a aparência Visual
- Tome nota da morfologia das colónias para cada mutante em comparação com a estirpe selvagem-tipo depois de listar todas as cepas como na etapa 2. Compare o novo isolado para que de uma espécie estudada, tais como s. coelicolor ou s. venezuelae, quando caracterizar novas espécies de Streptomyces . Observe as características (Figura 1) como a forma básica, superfície da colônia (fuzzy, careca, rugas, etc.), opacidade, elevação e pigmentação (distinção entre micélio vegetativo, micélio aéreo e/ou meio circundante).
- Rotule um ágar de MS estirpes de tipo selvagem e mutantes placa e raia em padrões de Cunha (Figura 1). Cuidado para que nenhuma tensão toca outra estirpe para evitar a contaminação cruzada. Observe a data e hora que cepas há listras brancas na chapa. Incubar as placas a 30 ° C.
- Coloque pratos de Petri adulto colorido ou papel branco para homogeneizar o fundo. Escreva no papel o nome de estirpe, data, temperatura de incubação e tempo da primeira placa estrias. Leve digital foto (s) da placa com a informação de último escrita sobre o fundo de papel de modo que a confusão é minimizado.
Nota: A escrita pode ser cortada a partir da fotografia em um momento posterior se é para ser usado para a preparação de figura.
7. realizar microscopia de contraste de fase
- Esterilize pinças lavar em etanol a 70% e passando através de uma chama do bico de Bunsen evaporar o etanol. Deixe arrefecer.
- Esterilize as lamelas lavando em etanol a 70% e em seguida, permitindo-os secar em uma placa de Petri estéril.
-
Prepare uma lamela carona do crescimento bacteriano para ser examinado.
- Pegar uma lamela estéril com pinça estéril e colocar a lamela sobre uma placa de ágar de MS onde o crescimento bacteriano é denso. Pressione na parte de trás da lamela cuidadosamente com uma pinça para garantir a transferência suficiente de esporos bacterianos e micélio aéreo.
- Pegar a lamela do prato e colocá-lo para que o lado com o material da célula é voltado para a superfície de uma lâmina de microscópio, com uma queda de 15 µ l de glicerol a 50% preparado em água para a montagem. Reduzir as bolhas de ar, colocando a lamela em um ângulo de 45° para o slide e deixá-lo cair de glicerol a 50%.
- (Opcional) Selo com clear esmaltes para preservação do slide.
-
Execute a microscopia de contraste de fase, conforme descrito por Frohlich40 em vários intervalos de tempo durante os ciclos de vida.
Nota: Imagens repetidas permite uma análise mais completa e a capacidade de detectar atrasos no desenvolvimento. Independentemente repeti as observações para garantir precisão e reprodutibilidade.- Coloque o slide preparado no palco microscópio e adicionar uma gota de óleo de imersão para o centro da lamínula. Gire a fase X 100 objectivo no lugar e conjunto a torreta do condensador para o ajuste adequado de fase "correspondência". Focar a imagem usando apenas o botão de ajuste fino, uma vez que a lente objetiva está em contacto com o óleo.
- Examine os vários campos de visão para discernir as diferenças perceptíveis e consistentes entre cepas mutantes e o tipo selvagem, como a capacidade de esporos de forma, tamanho de Esporo e forma e número total de esporos (ver Figura 2).
Nota: Alternativas para a microscopia de contraste de fase incluem interferência diferencial de microscopia de contraste (DIC)40 e técnicas de coloração simples para usam com microscópios campo claro41, tais como coloração violeta cristal.
8. Realize a microscopia de fluorescência
- Esterilize pinças lavar em etanol a 70% e executando através de uma chama do bico de Bunsen.
- Pegar uma lamela estéril com pinça estéril e coloque sobre uma placa de ágar de MS onde o crescimento bacteriano é evidente. Toque as costas da lamela suavemente com a pinça para garantir a transferência suficiente de esporos bacterianos e filamentos aéreos.
- Pegue a lamela do prato e colocá-lo para que o lado com o material da célula é virada para cima, na cartolina para facilitar a manipulação da lamela.
- Inundar a lamela com metanol gelada (~ 300 µ l de uma lamela de2 20 x 20 mm) e deixá-lo secar ao ar completamente.
Atenção: O metanol é um agente mutagénico. Evite o contato direto com a pele. - Lave a lamela três vezes em fosfato tamponado salino (PBS)42 suavemente dispensação e removendo a solução.
- Adicionar 15 µ l de 100 μg/ml iodeto de Propidium e/ou 10 μg/mL trigo-germe-Agglutinin conjugado com isotiocianato de fluoresceína (FITC-WGA) feito em glicerol 50% para uma lâmina de microscópio rotulada.
Nota: Iodeto de Propidium manchas DNA vermelho para detectar a localização de DNA cromossômica enquanto WGA-FITC manchas verdes de parede celular. - Inverta a lamela de bruços sobre a gota de mancha fluorescente sobre a lâmina de vidro. (Opcionalmente) sele com esmaltes claros para preservação do slide. Como os corantes são sensíveis à luz, incube por 15 minutos em uma sala escura ou mal iluminada.
- Observar os slides sob uma lente de objetiva 100 X usando um contraste de fase ou microscópio DIC equipado com cubos de excitação de epifluorescência para iodeto de propidium ('Texas Red' filtro definido ou maxima de excitação/emissão 535/617 nm) e FITC (FITC filtrar conjunto ou 490/525 nm maxima de excitação/emissão).
- Coloque o slide sobre o palco e foco usando os botões de ajuste grosso e fino.
- Observe a fluorescência como mostrado em outra parte43.
- Use um pacote de software de análise de imagem gratuito que pode ajudar na identificação dos esporos com menor intensidade de fluorescência44.
Resultados
Experimentos de fenotipagem inicial são necessários para caracterizar as cepas e novas espécies e podem ser usados como uma abordagem complementar à filogenia e as experiências de hibridação de DNA-DNA que são usadas para caracterizar novas espécies. Mutantes de Streptomyces resultantes de métodos de mutagênese aleatória como químico, UV, ou mutagénese transposon normalmente são identificados através de telas diretas, visuais em placas de ágar. Colônias de Streptomyces são examinadas para alterações no fenótipo em comparação com a estirpe selvagem-tipo, parental. Por exemplo, um micélio aéreo colorido mais leve pode indicar um nível inferior de pigmento cinzento causado por um defeito na esporulação, ou a falta de uma aparência difusa é indicativa de um bloco na formação de micélio aéreo (Figura 1). Muitos estreptomicetos produzem antibióticos pigmentados no micélio vegetativo ou ágar circundante. S. coelicolor produz dois antibióticos pigmentados, bem como dois entes não pigmentada. Actinorhodin é um antibiótico azul pigmentada e undecylprodigiosin é um antibiótico pigmentada vermelho45. As tensões que submeteram-se telas de colônia visual inicial então são propagadas por estrias para colônias única.
Após a identificação visual de potencialmente interessantes mutantes, cepas são submetidas a exame microscópico. Contraste de fase microscopia é especialmente adequada para examinar os mutantes de Streptomyces por defeitos no desenvolvimento, utilizando a cepa selvagem-tipo como um controle (Figura 2). Tipo selvagem coelicolor S. colônias normalmente produzem um micélio aéreo por cerca de dois dias de crescimento, a 30 ° C, em ágar de MS e longas cadeias de esporos por três dias de crescimento. O ciclo de vida vai avançar um pouco mais lento ou mais rápido em outros tipos de mídia. É imperativo que os mutantes analisados sob as mesmas condições de crescimento que o tipo selvagem quando tirar conclusões sobre os defeitos do desenvolvimento e atrasos. Carecas mutantes podem produzir esporos após crescimento prolongado em meios de ágar. Uma classe de mutantes referido como mutantes brancos também podem ser adiados para formação de esporo, mostram uma redução na abundância de esporos produzidos, produzem esporos com defeitos de forma e/ou tamanho, ou simplesmente produzir níveis mais baixos da esporo maduro, cinza pigmento46 . Outros mutantes investigados até agora podem ser retardados ou acelerados na progressão do ciclo de vida como os mutantes afetados para a acumulação de moléculas (por exemplo, di-GMP cíclico47) de sinalização.
Um simples acompanhamento para a técnica de microscopia de luz descrita acima é a microscopia de fluorescência usando iodeto de propidium nucleoids de DNA cromossômicos mancha e germe de trigo fluorescente etiquetadas aglutininas para manchar a parede celular dos septos de esporulação. Esporos, falta um cromossomo será desprovido de iodeto de propidium vermelho, coloração, enquanto os esporos que contêm menos DNA do que o habitual pode ser identificado se parecem ter diminuído a coloração (Figura 3). Aglutininas de germe de trigo podem ser usada para manchar a parede celular e podem ser observadas diferenças na parede celular, manchando os padrões (ou seja, defeitos de divisão celular). Na Figura 4 o selvagem-tipo cepa de S. venezuelae, uma espécie que recentemente está sendo usada como um outro modelo streptomycete por causa de seu ciclo de vida e a capacidade de esporular no líquido45, mais rápido tem sido manchado com WGA-FITC elucidar a escada-como matriz de septos de divisão que normalmente são vistos durante a esporulação.
As estratégias de fenotipagem inicial descritas aqui devem resultar no seguinte: 1) identificação de cepas mutantes de interesse para um estudo mais aprofundado; 2) adquiriu o conhecimento sobre o mutante recentemente identificado e o papel potencial do gene que tem sido uma mutação; 3) a formulação de uma série subsequente de próximas etapas experimentais que podem ser usados para esclarecer o papel do gene em questão. No caso de um recém identificado streptomycete do ambiente, o pesquisador vai ganhar conhecimento da nova espécie potencial em comparação com o já caracterizado espécies de Streptomyces.

Figura 1: Fotografia de uma placa de ágar representante demonstrando fenótipos colônia macroscópica de coelicolor S.. Placa de ágar mostra o difuso, aparência visual cinza de micélio aéreo para o selvagem-tipo S. coelicolor tensão MT1110 (WT) em comparação com vários mutantes de inserção aleatória transposon com fenótipos do desenvolvimento. Os mutantes também estão faltando um micélio aéreo [careca (bld)] ou um micélio aéreo com pigmentação reduzida esporo [branco (whi)]. Mutantes de Transposon foram gerados usando mini-Tn5 para inserção mutagênese6,7. As cepas foram cultivadas em agar de MS durante 5 dias a 30 ° C. Diâmetro da placa de Petri, 100 mm.
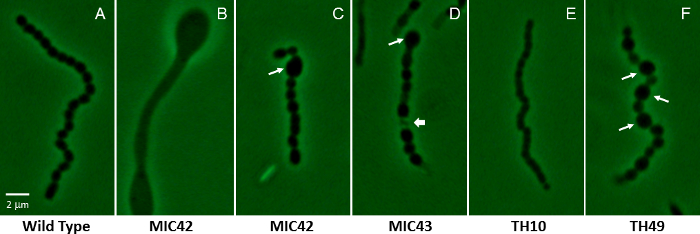
Figura 2: Micrografias de contraste de fase, mostrando um representante aérea filamento para S. coelicolor branco mutante cepas que contêm mutações de inserção aleatória transposon. (A) mostrado é um filamento aérea representante tipo selvagem que sofreu divisões celulares síncronas, regularmente espaçados, produzindo uniformemente em forma e tamanho de esporos (MT1110). (B–F) Os restantes painéis mostram os vastamente diferentes fenótipos microscópicos de vários mutantes brancos que foram isolados através de mutagénese aleatória transposon. Painel B mostra um filamento aéreo que não sofreu a esporulação, mas em vez disso produziu abaulamento áreas dentro do filamento. As setas longas em C, De F indicam anormalmente grandes esporos que são característicos dos mutantes, MIC42, MIC43 e TH49. A seta curta no painel D indica um exemplo de um compartimento de esporo lisados. Painel E mostra os parcialmente constringidos compartimentos menores que são típicos das cadeias de esporo produzidas por mutante TH10. As cepas foram cultivadas em agar de MS durante 5 dias a 30 ° C. Os mutantes estão relacionados com as mostradas na Figura 1. Um esporo de tipo selvagem é aproximadamente 1,1 µm no eixo longo. Barra de escala = 2 µm. clique aqui para ver uma versão maior desta figura.
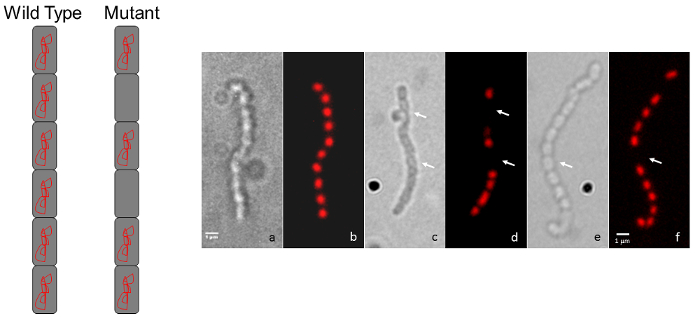
Figura 3: Representante micrografias mostrando cromossomas mutantes S. coelicolor fenótipos segregação. Diagrama a (A), A representação mostra a selvagem-tipo, regularmente espaçados coloração aparência típica de uma cadeia de esporos (cada esporo contém DNA cromossômico) comparada com o padrão de coloração intermitente para um mutante que exibe um cromossomo defeito de segregação. (B) cada par de painéis mostra spore da mesmo cadeia observado pela imagem de contraste de interferência diferencial (DIC) do lado esquerdo e uma imagem de fluorescência manchadas de iodeto de propidium é mostrada à direita. O fenótipo tipo selvagem (a, b) é comparado com dois mutantes de inserção aleatória transposon (c, d e e, f). As setas indicam os esporos desprovidos de DNA. As cepas foram cultivadas em agar de MS durante 5 dias a 30 ° C. Os mutantes mostrados estão relacionados com aqueles na Figura 1 e Figura 2. Barra de escala = 1 µm. clique aqui para ver uma versão maior desta figura.

Figura 4: Micrografia de fluorescência da estirpe do selvagem-tipo S. venezuelae manchado com WGA-FITC. (A), A diagrama de um filamento aéreo aparece liso, sem marcas e sem sinais visíveis de esporulação usando microscopia de contraste de fase em comparação com a matriz de escada, como de parede celular coloração que indica uma fase inicial de esporulação tem iniciada nesse mesmo filamento usando WGA-FITC sob microscopia de fluorescência. (B) micrografias do selvagem-tipo S. venezuelae. (um) filamentos aéreos suave estão presentes entre cadeias de esporos. (b) dentro do micélio mostrado no painel, um filamento aéreo na fase inicial de desenvolvimento possui uma escada, como matriz de deposição de parede celular. As setas indicam a formação regularmente espaçados de cruz-paredes manchadas pelo WGA-FITC que desenvolvem sincronicamente dentro de um único filamento aéreo como sofre esporulação desenvolvente associadas. A cepa foi cultivada em ágar MYM MYM (altoseM, YOriente extrato, extrato de alt M) para 38 h a 30 ° C. Barra de escala = 2 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Aqui apresentamos os protocolos para o início de Streptomyces pesquisadores para iniciar estudos, incluindo os passos necessários para propagar as estirpes e preparar ações para armazenamento a longo prazo. Em seguida, descrevemos os protocolos para caracterização visual e microscópica de cepas de Streptomyces . Alguns passos iniciais típicos em mutantes do desenvolvimento fenotipagem são: 1) exame visual das colônias mutantes em relação ao tipo selvagem colônias em ágar-ágar; 2) microscopia de contraste fase; e 3) microscopia de fluorescência de hifas aéreas sporogenic. Baseado no fenótipo exibido nestas três etapas, uma variedade de técnicas pode ser empregada para discernir ainda mais o fenótipo de uma estirpe.
Experimentos de fenotipagem inicial são comumente usados para caracterizar novas espécies, identificar os mutantes de interesse, parcialmente caracterizar mutantes e começar a discernir o papel típico de um determinado gene baseado o fenótipo de um mutante identificado. Os métodos descritos aqui já foram usados na Universidade ensino laboratórios para identificar e caracterizar uma grande variedade de mutantes de Streptomyces , incluindo aqueles com defeitos na divisão celular48,49, 50 , 51 , 52 , 53 , 54, esporulação55,56, formação de micélio aéreo57,58, antibiótico produção59, segundo mensageiro sinalização47e segregação do cromossomo 60. essas técnicas são os primeiros passos vitais para determinar o fenótipo de mutantes em geral e revelam uma grande quantidade de informações importantes sobre as funções dos genes de interesse. Os métodos podem ser facilmente estendidos para outras espécies de Streptomyces e já têm sido usados para descrever cepas de S. griseus, S. venezuelae, S. sarnae muitos outros estreptomicetos. Os protocolos de vídeo aqui descritos são esperados para servir como um recurso importante para novos pesquisadores entrar em campos de pesquisa de Streptomyces , tais como na área de descoberta de drogas. Isso inclui os novos instrutores que estão trabalhando para combater a crise de resistência aos antibióticos e educar o número incontável de novos pesquisadores de estudante de graduação, juntando os esforços crowdsourcing da iniciativa de mundo pequeno.
As técnicas descritas aqui podem ser facilmente adaptadas para uso em aulas de faculdade e colégio além de laboratórios de pesquisa, usando as modificações descritas no vídeo e texto. Alunos em um primeiro módulo de microscopia do ano em uma faculdade de artes liberais pequenas foram capazes de cepas de raia, tirar fotografias digitais de estirpes cultivadas em meios de ágar e realizar microscopia de contraste de fase e fluorescência, que culminou com a apresentação de um portfólio de figuras com vários painéis no final do módulo 3 semana, representando 15 h de trabalho no laboratório. Cerca de 160 alunos de primeiro ano foram responsáveis pela fenotipagem inicial de 320 mutantes novela transposon. Alunos de iniciação científica em três instituições participaram da fenotipagem inicial dos mutantes adicionais e a subsequente caracterização de muitas das cepas. Os dados completos obtidos em um período relativamente curto de tempo, ilustram o valor dos protocolos descritos aqui. Centenas de mutantes adicionais foram armazenadas como estoques micelial de glicerol para a caracterização do futura.
Após os primeiros experimentos descritos aqui, uma variedade de métodos pode ser empregada para estender a qualidade de informações referentes a cepas de interesse. Se a mutação for desconhecida, um método de genotipagem deve ser empregado para determinar o tipo e/ou localização da mutação. Por exemplo, o mutagenesis aleatório transposon do selvagem-tipo cromossomo6,7,8,9,10,11,12,13 resulta em colônias que devem se submeter a iniciais telas fenotípicas como as descritas acima. Então a localização do transposon deve ser identificada usando uma técnica como o inverso do polymerase reação em cadeia (iPCR)61. Determinar o genótipo dos mutantes recém descobertos é um passo importante após caracterização inicial.
Alguns métodos avançados comumente usados para análise posterior fenotipagem que pode ser mencionado em sala de aula ou explorada através de novas pesquisas incluem proteína verde fluorescente (GFP) marcação para determinar os padrões de localização da proteína de interesse, análise de expressão do gene como real tempo PCR quantitativo (qPCR) e padrões de expressão genética global do selvagem-tipo versus mutante através do sequenciamento de RNA (RNA-seq). Habilidades de fenotipagem também são necessárias para análise genética de complementação. Em um experimento de complementação, a selvagem-tipo cópia de um gene é introduzida em uma cepa mutante para determinar se o alelo recém-adicionado pode compensar a perda da função do alelo mutante. Comparando o fenótipo da estirpe complementado ao mutante original e o parental, selvagem-tipo tensão é necessária.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de reconhecer Otterbein Universidade para bolsas de pesquisa de estudante de graduação e estudante Research Fund Awards GVK e do SGK; e o Memorial do Professor Gilbert E. Mills Otterbein dotado sabático programa prêmio e o departamento de biologia e pesquisa da faculdade de Ciências da terra e bolsa dotado Award para JAB. O Bert e Jane corno dotado estudante fundo de investigação nas ciências foi concedido a GVK e do SGK. Os autores também gostaria de reconhecer com gratidão que Universidade Duquesne financiado graduação pesquisa programa de bolsas para GVK e do SGK. Alunos de iniciação científica antiga Juniata College, Ryan Johnson e Lindsey Draper contribuiu com as imagens de microscopia para as figuras 2 e 3, respectivamente.
Materiais
| Name | Company | Catalog Number | Comments |
| 50% Glycerol | Sigma-Aldrich | G5516 | |
| Immersion Oil (Type DF) | Cragille | 16482 | |
| Lens Paper | Fisherbrand | 11-995 | |
| Sterile Water | GeneMate | G-3250-1L | |
| 100% Ethanol | Sigma-Aldrich | E7023 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Toothpicks (flat) | Target | 081-22-1957 | |
| Pipette Tips (10 mL) | GeneMate | P-1240-10 | |
| Pipette Tips (200 mL) | GeneMate | P-1240-200Y | |
| Pipette Tips (1,250 mL) | GeneMate | P-1240-1250 | |
| Wooden Applicators 6'' | Solon Care | 070809 | |
| Cotton Swabs | Fisherbrand | 23-400-124 | |
| Soy Flour | Bob's Red Mill | 1516C164 | |
| D-Mannitol | Sigma-Aldrich | M4125-1KG | |
| Agar | Sigma-Aldrich | A1296-1KG | |
| Glycerol 100% | VWR amresco life science | 0854-1L | |
| 0.8% NaCl (Saline) | Sigma-Aldrich | SLBB9000V | |
| 1.2 mL freezer tube | NEST | 606101 | |
| Ultra low (-80 °C) freezer | SO-LOW | U85-18 | |
| Cryo Safety Gloves | Bel-Art | H13201 | |
| Petri dishes | Sigma-Aldrich | P5856-500EA | |
| Cover slips #1.5 | Thomas Scientific | 64-0721 | |
| Slides | Carolina | 63-2010 | |
| Autoclave | Tuttnauer | 2540E | |
| Phase-Contrast Microscope | Olympus | BX40 | |
| Forceps | Carolina Biological | 624504 | |
| Bunsen Burner | Carolina Biological | 706706 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| PBS (phosphate buffer saline) | Sigma-Aldrich | P4417-50TAB | |
| WGA-FITC | Biotium | 29022-1 | |
| Clear nail polish | OPI | 22001009000 | |
| ImageJ | NIH | Free Software | |
| 100 mL beaker | Pyrex USA | 1000-T | |
| 1 L beaker | Carolina Biological | 721253 | |
| 1 L flask | Fisherbrand | S63274 | |
| 250 mL flask | Pyrex USA | 4980 | |
| 100 mL graduated cylinder | Carolina Biological | 721788 | |
| 500 mL graduated cylinder | Carolina Biological | 721792 | |
| Stir Bar | Fisher Scientific | 22-271825 | |
| Centrifuge | Eppendorf | 5810R | |
| Camera for Microscope | Olympus | DP72 | |
| Nitrile Examination Gloves (Med) | Bio Excell | 71011002 | |
| Vortex Mixer | Carolina Biological | 701077 |
Referências
- Barka, E. A., et al. Taxonomy, physiology, and natural products of Actinobacteria. Microbiol. Mol. Biol. Rev. 80 (1), 1-43 (2015).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (2), 141-147 (2002).
- Redenbach, M., et al. A set of ordered cosmids and a detailed genetic and physical map for the 8 Mb Streptomyces coelicolor A3(2) chromosome. Mol. Microbiol. 21 (1), 77-96 (1996).
- McCormick, J. R., Flardh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36 (1), 206-231 (2012).
- Flardh, K., Buttner, M. J. Streptomyces morphogenetics: dissecting differentiation in a filamentous bacterium. Nat. Rev. Microbiol. 7 (1), 36-49 (2009).
- Bennett, J. A. . Molecular Genetic analysis of division and development in Streptomyces coelicolor. , (2007).
- Hull, T. D., et al. Cyclic Di-GMP phosphodiesterases RmdA and RmdB are involved in regulating colony morphology and development in Streptomyces coelicolor. J. Bacteriol. 194 (17), 4642-4651 (2012).
- Petzke, L., Luzhetskyy, A. In vivo Tn5-based transposon mutagenesis of streptomycetes. Appl. Microbiol. Biotechnol. 83 (5), 979-986 (2009).
- Xu, Z., et al. Large-Scale Transposition Mutagenesis of Streptomyces coelicolor Identifies Hundreds of Genes Influencing Antibiotic Biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Fernandez-Martinez, L. T., et al. A transposon insertion single-gene knockout library and new ordered cosmid library for the model organism Streptomyces coelicolor A3(2). Antonie Van Leeuwenhoek. 99 (3), 515-522 (2011).
- Gehring, A. M., Nodwell, J. R., Beverley, S. M., Losick, R. Genomewide insertional mutagenesis in Streptomyces coelicolor reveals additional genes involved in morphological differentiation. Proc. Natl. Acad. Sci. U.S.A. 97 (17), 9642-9647 (2000).
- Bishop, A., Fielding, S., Dyson, P., Herron, P. Systematic insertional mutagenesis of a streptomycete genome: a link between osmoadaptation and antibiotic production. Genome Res. 14 (5), 893-900 (2004).
- Bilyk, B., Weber, S., Myronovskyi, M., Bilyk, O., Petzke, L., Luzhetskyy, A. In vivo random mutagenesis of streptomycetes using mariner-based transposon Himar1. Appl. Microbiol. Biotechnol. 97 (1), 351-359 (2013).
- Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. F., Hopwood, D. A. . Practical Streptomyces Genetics. , (2000).
- Gust, B., Kieser, T., Chater, K. F. . REDIRECT technology: PCR-targeting system in Streptomyces coelicolor. , (2002).
- Gust, B., Chandra, G., Jakimowicz, D., Yuqing, T., Bruton, C. J., Chater, K. F. Lambda red-mediated genetic manipulation of antibiotic-producing Streptomyces. Adv. Appl. Microbiol. 54, 107-128 (2004).
- Tong, Y., Charusanti, P., Zhang, L., Weber, T., Lee, S. Y. CRISPR-Cas9 based engineering of Actinomycetal genomes. ACS Synth. Biol. 4 (9), 1020-1029 (2015).
- Huang, H., Zheng, G., Jiang, W., Hu, H., Lu, Y. One-step high-efficiency CRISPR/Cas9-mediated genome editing in Streptomyces. Acta BiochimBiophys. Sin.(Shanghai). 47 (4), 231-243 (2015).
- Cobb, R. E., Wang, Y., Zhao, H. High-efficiency multiplex genome editing of Streptomyces species using an engineered CRISPR/Cas system. ACS Synth. Biol. 4 (6), 723-728 (2015).
- Carey, M. F., Peterson, C. L., Smale, S. T. PCR-mediated site-directed mutagenesis. Cold Spring Harb Protoc. 2013 (8), 738-742 (2013).
- Brown, E. D., Wright, G. D. Antibacterial drug discovery in the resistance era. Nature. 529 (7586), 336-343 (2016).
- Dodds, D. R. Antibiotic resistance: A current epilogue. Biochem. Pharmacol. 134, 139-146 (2017).
- Caruso, J. P., Israel, N., Rowland, K., Lovelace, M. J., Saunders, M. J. Citizen Science: The Small World Initiative improved lecture grades and California critical thinking skills test scores of nonscience major students at Florida Atlantic University. J. Microbiol. Biol. Educ. 17 (1), 156-162 (2016).
- Davis, E., et al. Antibiotic discovery throughout the Small World Initiative: A molecular strategy to identify biosynthetic gene clusters involved in antagonistic activity. Microbiology Open. 6 (3), (2017).
- van Keulen, G., Dyson, P. J. Production of specialized metabolites by Streptomyces coelicolor A3(2). Adv. Appl. Microbiol. 89, 217-266 (2014).
- Aigle, B., et al. Genome mining of Streptomyces ambofaciens. J. Ind. Microbiol. Biotechnol. 41 (2), 251-263 (2014).
- Antoraz, S., Santamaria, R. I., Diaz, M., Sanz, D., Rodriguez, H. Toward a new focus in antibiotic and drug discovery from the Streptomyces arsenal. Front. Microbiol. 6, 461 (2015).
- Onaka, H. Novel antibiotic screening methods to awaken silent or cryptic secondary metabolic pathways in actinomycetes. J. Antibiot.(Tokyo). 70 (8), 865-870 (2017).
- Chen, J., Wu, Q., Hawas, U. W., Wang, H. Genetic regulation and manipulation for natural product discovery. Appl. Microbiol. Biotechnol. 100 (7), 2953-2965 (2016).
- Katz, L., Baltz, R. H. Natural product discovery: past, present, and future. J. Ind. Microbiol. Biotechnol. 43 (2-3), 155-176 (2016).
- Liu, G., Chater, K. F., Chandra, G., Niu, G., Tan, H. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiol. Mol. Biol. Rev. 77 (1), 112-143 (2013).
- den Hengst, C. D., Tran, N. T., Bibb, M. J., Chandra, G., Leskiw, B. K., Buttner, M. J. Genes essential for morphological development and antibiotic production in Streptomyces coelicolor are targets of BldD during vegetative growth. Mol. Microbiol. 78 (2), 361-379 (2010).
- Tran, N. T., Den Hengst, C. D., Gomez-Escribano, J. P., Buttner, M. J. Identification and characterization of CdgB, a diguanylate cyclase involved in developmental processes in Streptomyces coelicolor. J. Bacteriol. 193 (12), 3100-3108 (2011).
- Anonymous. Lab Safety. Proper Use of Autoclaves. JoVE Science Education Database. , (2017).
- Border, B. G., Rice-Spearman, L. Microwaves in the laboratory: effective decontamination. Clin. Lab. Sci. 12 (3), 156-160 (1999).
- Bhattacharjee, M. K., Delsol, J. K. Does microwave sterilization of growth media involve any non-thermal effect?. J. Microbiol. Methods. 96, 70-72 (2014).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J. Vis. Exp. (63), e3064 (2012).
- Anonymous, General Laboratory Techniques. An Introduction to the Micropipettor. JoVE Science Education Database. , (2017).
- Baltz, R. H. Genetic manipulation of secondary metabolite biosynthesis for improved production in Streptomyces and other actinomycetes. J. Ind. Microbiol. Biotechnol. 43 (2-3), 343-370 (2016).
- Frohlich, V. C. Phase Contrast and Differential Interference Contrast (DIC) Microscopy. J. Vis. Exp. (18), e844 (2008).
- Anonymous, General Laboratory Techniques. Introduction to Light Microscopy. JoVE Science Education Database. , (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory. 3, (1989).
- Anonymous, General Laboratory Techniques. Introduction to Fluorescence Microscopy. JoVE Science Education Database. , (2017).
- Jensen, E. C. Quantitative analysis of histological staining and fluorescence using ImageJ. Anat. Rec.(Hoboken). 296 (3), 378-381 (2013).
- Chater, K. F. Recent advances in understanding Streptomyces. F1000Res. 5, (2016).
- Chater, K. F. Regulation of sporulation in Streptomyces coelicolor A3(2): a checkpoint multiplex?. Curr. Opin. Microbiol. 4 (6), 667-673 (2016).
- Tschowri, N. Cyclic dinucleotide-controlled regulatory pathways in Streptomyces species. J. Bacteriol. 198 (1), 47-54 (2016).
- Bennett, J. A., et al. Medium-dependent phenotypes of Streptomyces coelicolor with mutations in ftsI or ftsW. J. Bacteriol. 191 (2), 661-664 (2009).
- Mistry, B. V., Del Sol, R., Wright, C., Findlay, K., Dyson, P. FtsW is a dispensable cell division protein required for Z-ring stabilization during sporulation septation in Streptomyces coelicolor. J. Bacteriol. 190 (16), 5555-5566 (2008).
- Bennett, J. A., Aimino, R. M., McCormick, J. R. Streptomyces coelicolor genes ftsL and divIC play a role in cell division but are dispensable for colony formation. J. Bacteriol. 189 (24), 8982-8992 (2007).
- Bennett, J. A., McCormick, J. R. Two new loci affecting cell division identified as suppressors of an ftsQ-null mutation in Streptomyces coelicolor A3(2). FEMS Microbiol. Lett. 202 (2), 251-256 (2001).
- Dharmatilake, A. J., Kendrick, K. E. Expression of the division-controlling gene ftsZ during growth and sporulation of the filamentous bacterium Streptomyces griseus. Gene. 147 (1), 21-28 (1994).
- McCormick, J. R., Losick, R. Cell division gene ftsQ is required for efficient sporulation but not growth and viability in Streptomyces coelicolor A3(2). J. Bacteriol. 178 (17), 5295-5301 (1996).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor mutant for the cell division gene ftsZ. Mol. Microbiol. 14 (2), 243-254 (1994).
- Flärdh, K., Findlay, K. C., Chater, K. F. Association of early sporulation genes with suggested developmental decision points in Streptomyces coelicolor A3(2). Microbiology. 145 (9), 2229-2243 (1999).
- van Wezel, G. P., van der Meulen, J., Kawamoto, S., Luiten, R. G., Koerten, H. K., Kraal, B. ssgA is essential for sporulation of Streptomyces coelicolor A3(2) and affects hyphal development by stimulating septum formation. J. Bacteriol. 182 (20), 5653-5662 (2000).
- Capstick, D. S., Willey, J. M., Buttner, M. J., Elliot, M. A. SapB and the chaplins: connections between morphogenetic proteins in Streptomyces coelicolor. Mol. Microbiol. 64 (3), 602-613 (2007).
- Ma, H., Kendall, K. Cloning and analysis of a gene cluster from Streptomyces coelicolor that causes accelerated aerial mycelium formation in Streptomyces lividans. J. Bacteriol. 176 (12), 3800-3811 (1994).
- Xu, Z., et al. Large-scale transposition mutagenesis of Streptomyces coelicolor identifies hundreds of genes influencing antibiotic biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Dedrick, R. M., Wildschutte, H., McCormick, J. R. Genetic interactions of smc, ftsK, and parB genes in Streptomyces coelicolor and their developmental genome segregation phenotypes. J. Bacteriol. 191 (1), 320-332 (2009).
- Pavlopoulos, A. Identification of DNA sequences that flank a known region by inverse PCR. Methods Mol. Biol. 772, 267-275 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados