Method Article
Valutazione visiva e microscopiche di Streptomyces mutanti inerente allo sviluppo
In questo articolo
Riepilogo
Presentiamo qui i ricercatori per avviare phenotyping per il genere di batteri Streptomycesfarmacologicamente importante protocolli per il debuttante.
Abstract
Streptomycetes sono batteri filamentosi terreno appartenenti al phylum Actinobacteria che si trovano in tutto il mondo e producono una vasta gamma di antibiotici e di altri metaboliti secondari. Coelicolor degli streptomiceti è una specie ben caratterizzata, non patogeni che è favorevole a una varietà di analisi in laboratorio. I metodi phenotyping descritti qui utilizzano S. coelicolor come un modello streptomycete; Tuttavia, i metodi sono applicabili a tutti i membri di questo genere di grandi dimensioni, nonché alcuni attinomiceti strettamente correlati. Fenotipizzazione è necessario caratterizzare nuove specie di Streptomyces identificato nell'ambiente, ed è anche un primo passo fondamentale nella caratterizzazione dei ceppi mutanti recentemente isolati di Streptomyces. Competenza in phenotyping è importante per i molti nuovi ricercatori che stanno entrando in campo della ricerca di Streptomyces , che comprende lo studio di sviluppo batterico, divisione cellulare, la segregazione del cromosoma e secondo messaggero di segnalazione. Il crowdsourcing recente di antibiotico scoperta attraverso l'isolamento di nuovi microbi del suolo ha provocato una maggiore necessità di formazione in phenotyping per istruttori nuovi nel campo della ricerca di Streptomyces e loro college o high school gli studenti. Questo manoscritto descrive metodi di propagazione di ceppo batterico, deposito e caratterizzazione attraverso l'esame visivo e microscopica. Dopo aver letto questo articolo, nuovi ricercatori (laboratori di microbiologia istruzione e cittadini scienziati) dovrebbero essere in grado di manipolare ceppi di Streptomyces e iniziare esperimenti di caratterizzazione visiva.
Introduzione
Streptomycetes sono batteri Gram-positivi, filamentosi terreno conosciuti per la loro capacità di produrre una varietà di metaboliti secondari, tra cui oltre due terzi degli antibiotici disponibili in commercio, anche come anti-tumorali, farmaci anti-HIV e anti-parassitari 1. S. coelicolor è il membro più geneticamente caratterizzato del genere2,3 ed è la specie utilizzata nei metodi descritti qui. S. coelicolor ha un complesso ciclo di vita che inizia con germinazione di una spora singola, procedendo a un vasto, ramificazione micelio vegetativo che cresce nel terreno di agar. Come procede il ciclo di vita, si formano filamenti aeree che rompere la tensione superficiale del micelio substrato e infine si dividono in lunghe catene di cellule che sono in definitiva convertite in spore mature, grigio-pigmentato. Dispersione di queste spore neonate costituisce l'inizio del prossimo ciclo di vita4.
A causa del suo complesso di differenziazione, S. coelicolor serve come un eccellente modello per lo studio di sviluppo batterico. Storicamente, le mutazioni provocare blocchi per i due principali fasi di sviluppo e producono fenotipi distinti visual. I mutanti (calvo) bld sono bloccati per la formazione di micelio aerea e risultato nella mancanza di un micelio aerea fuzzy, impartendo un aspetto di Colonia "calvo". Mutanti inibita in formazione della spora e maturazione sono indicati come mutanti whi (bianco) perché riescono in genere a produrre livelli di selvaggio-tipo del pigmento grigio spora e il micelio aereo rimane bianco. Altri interessanti mutanti sono inibite in produzione antibiotica, divisione cellulare, segregazione del cromosoma o altri processi importanti4,5.
Nonostante la scoperta di molti geni dello sviluppo in specie di Streptomyces , ci sono molti più ritiene che esistano basata sulla mancanza di saturazione degli schermi mutanti. I nostri laboratori continuano ad identificare nuovi geni dello sviluppo utilizzando un sistema di mini-trasposone che abbiamo costruito. Nuovi ceppi mutanti isolati negli esperimenti di mutagenesi casuale con nostro trasposone subiscono la selezione fenotipica per identificare il possibile ruolo di ogni nuovo di gene scoperto6,7. I metodi per batterica phenotyping descritti qui sono rilevanti per mutanti di Streptomyces isolati da trasposoni mutagenesi8,9,10,11,12, 13 e altri metodi casuali, quali chimica e ultravioletti (UV) mutagenesi14, come pure la costruzione diretta di mutazioni come delezioni del gene utilizzando recombineering15,16 o CRISPR-Cas9 (cluster regolarmente intervallate brevi palindromi ripetizioni) genoma tecnologia17,18,19 e mutazioni puntiformi20di editing.
Come antibiotico-resistenza tra i patogeni diventa sempre più prevalente, l'esigenza di nuovi antibiotici diventa sempre più urgente21,22. "L'iniziativa piccolo mondo" (o SWI) è un efficace di scienza, tecnologia, ingegneria e matematica (STEM) apprendimento23 e ricerca di strategia24 per combattere la resistenza agli antibiotici attraverso il crowdsourcing di studenti universitari e di più recentemente studenti delle scuole superiori. Sostenuto corsi di lavoro include l'identificazione di nuovi microbi del suolo che producono nuovi antibiotici (http://www.smallworldinitiative.org). Si ritiene che delle principali fonti di antibiotici da scoprire continuerà ad essere la specie di Streptomyces trovato in una vasta gamma di suolo e acqua habitat25,26,27,28, 29,31. Recentemente, il nostro laboratorio e il lavoro di altri hanno scoperto e caratterizzato segnalazione geni in specie di Streptomyces che regolano la morfologia e lo sviluppo, tra cui produzione antibiotica7,32, 33. Cambiamenti nell'espressione di questi geni provocano un cambiamento nella quantità e la tempistica di antibiotici prodotti. Fenotipizzazione qualificati di nuove specie e nuovi mutanti Antibiotico-produrre continuerà ad essere importante. Come nuovi istruttori e studenti diventano maggiori contributori al campo del drug discovery, formazione in phenotyping batterica è necessario per il successo di questi individui inesperti. Inoltre, questi esperimenti sono trattabili per high school staminali o laboratori di formazione di microbiologia dell'Università. Essi rappresentano una dimostrazione dei principi base di genetici microbici in un laboratorio di insegnamento impostazione.
Protocollo
1. preparare gli strumenti, terreni di coltura, soluzioni e capsule di Petri
- Stuzzicadenti di autoclave in un becher da mL 50 coperti con carta stagnola per mantenere sterile.
- Sterilizzare tutti i prodotti secchi che saranno utilizzati (suggerimenti, bastoni, vetreria, ecc.) in autoclave.
Nota: attenzione! Seguire tutte le indicazioni di sicurezza per il modello di autoclave utilizzato. Autoclavi rappresentano un rischio per gli effetti, ustioni da contatto con superfici calde, materiali e media e a vapore. Per sicurezza autoclave, vedi "Corretto uso di autoclavi"34. -
Preparare la MS agar (mannitolo soia farina (SFM))14 a crescere culture.
- Aggiungere 5 g di farina di soia e 5 g di agar in bottiglia da 1L.
- Sciogliere 5 g di mannitolo in 250 mL di acqua di rubinetto e versare nel matraccio contenente la farina di soia e l'agar.
- Aggiungere un tappo di schiuma e stagnola per l'apertura della boccetta e autoclave a 121 ° C, 15 psi per almeno 30 min.
Attenzione: Questo mezzo si riduce facilmente. Utilizzare un pallone che può contenere almeno quattro volte il volume effettivo di agar MS essere sterilizzato nell'autoclave. Pentola a pressione standard può essere utilizzata al posto di un autoclave con simili considerazioni di sicurezza. In alternativa, un forno a microonde può essere utilizzato per sterilizzare materiali e mezzi se ad un'autoclave non è possibile35,36. Insegnanti delle scuole superiori si consiglia inoltre di collaborare con i locali scuole o Università per accedere in autoclave forniture. - Media freschi fino a quando è abbastanza comodo da maneggiare. Fare attenzione a non raffreddarlo troppo a lungo perché agar solidifica a temperature inferiori a 50 ° C.
- Versare MS agar dal pallone in Petri sterili fino alla parte inferiore di ogni scatola di Petri è circa la metà piena (circa 25 mL di media per ogni piatto di Petri). Lasciar per solidificare prima di utilizzare piastre di agar. Conservare le piastre di agar in un sacchetto di plastica a temperatura ambiente fino a quando necessario.
Nota: Piastre di Agar possono anche essere conservati in frigorifero, soprattutto se gli antibiotici sono necessari in media.
2. striscia Streptomyces sulle piastre per propagazione
- Ceppi di Streptomyces striscia sulle piastre di agar MS alle singole colonie utilizzando un metodo standard, come il quadrante inoculare il metodo come mostrato in Sanders, 201237.
Nota: Un'ansa da inoculo o stuzzicadenti sterili possono essere utilizzati. Opzionale: Altri mezzi di comunicazione sono comunemente usati per le specie di Streptomyces , come R2YE e minimo di media14. - Incubare le piastre a 30 ° C.
- Restreak piastre selezionando una singola Colonia ogni 4 – 6 giorni. Come età di colonie che diventano inclini a mutazione casuale.
3. creare scorte miceliari glicerolo per deposito batterica
Nota: Miceliari scorte possono essere create per tutti i ceppi di Streptomyces , tra cui whi bld ceppi e altri mutanti inerente allo sviluppo che sono in grado di completare la sporulazione.
- Macerare 15 – 20 colonie in 200 – 500 µ l di glicerolo 20% utilizzando un applicatore sterile tassello di legno.
- Trasferire l'impasto di colonie macerati in una provetta di cultura congelatore 1,5 mL, utilizzando una micropipetta o una pipetta sterile.
Nota: Le basi di utilizzo della micropipetta sono coperti altrove38. - Aggiungere sufficiente glicerolo 20% per rendere il volume finale 1 mL e mescolare delicatamente. Conservare i campioni a-80 ° C.
Nota: attenzione! Usare guanti di sicurezza criogenico e un camice da laboratorio per proteggere la pelle dal contatto con il freddo estremo. In alternativa, un congelatore a-20 ° C può essere utilizzato con potenziale riduzione del tempo di conservazione a lungo termine. Evitare eccessiva di congelamento e scongelamento per estendere la redditività.
4. creare scorte di Spore di glicerolo per ceppi in grado di sporulazione
Nota: Scorte di Spore sono preferibili per la redditività a lungo termine ma solo sono fattibili per i ceppi che sono in grado di completare la sporulazione.
-
Sviluppa 100 µ l di materiale macerato (dal punto 3.1) su una piastra di agar per ottenere un prato confluente di crescita37.
Nota: Placcatura di diffusione è mostrato in Sanders37 (modifica: un giradischi non è richiesto.). La piastra può essere attivata con una mano mentre con l'altra mano per spostare il diffusore in modo dolce e indietro movimento tutti i supporti di agar.- Pipettare 100 µ l di micelio macerato al centro di una piastra di agar di MS.
- Sterilizzare un vetro o metallo strumento di diffusione parzialmente sommergendo in etanolo al 70% e passando il diffusore una volta lentamente attraverso una fiamma di bruciatore di Bunsen per accelerare l'evaporazione dell'etanolo.
Attenzione: L'etanolo è altamente infiammabile. Non posizionare il supporto a stella fiammeggiante in etanolo o consentire il fiammeggiante goccia di etanolo per cadere il piatto di etanolo. In alternativa, utilizzare un tampone di cotone sterile monouso per diffondere i batteri sulla piastra, che non richiede alcuna etanolo o fiamma. - Disabilita l'agar MS piastra con una sola mano, mentre usando un retro e indietro scopante per inoculare la piastra con la spatola sterile.
- Incubare per 5 – 7 giorni a 30 ° C fino a quando il ceppo è ben sporulato.
Nota: Tempi di incubazione variano a seconda della specie e ceppo.
- Aggiungere 2 mL di soluzione fisiologica sterile (0,8% NaCl) al centro di un prato confluente di cellule di Streptomyces che ha subito la sporulazione.
- Raccogliere le spore strofinando delicatamente la superficie del micelio con una sterile inoculando loop (o un batuffolo di cotone), lentamente spostandosi verso il bordo del prato.
- Dispensare la soluzione fisiologica contenente spore in una provetta conica da 15 mL. Vortice vigorosamente per rompere le catene di spore in singole celle.
- Centrifugare a temperatura ambiente per 5 min a circa 2.500 x g.
- Dispensare il surnatante e scartare. Disperdere il pellet di spora di agitazione vigorosa vortice nella piccola quantità di liquido residuo.
- Risospendere le spore in 1 mL di glicerolo 20% disegnando la soluzione su e giù con una pipetta.
- Trasferire lo stock di spora di glicerolo in una provetta di congelatore 1,5 mL. Conservare a-80 ° C.
Attenzione: Usare guanti di sicurezza criogenico e un camice da laboratorio per proteggere la pelle dal contatto con il freddo estremo. In alternativa, un congelatore a-20 ° C può essere utilizzato con potenziale riduzione della redditività nel tempo di immagazzinamento a lungo termine. Evitare eccessiva di congelamento e scongelamento per estendere la redditività.
5. eseguire la mutagenesi
- Eseguire mutagenesi basato sui risultati auspicati a cui fa riferimento l' Introduzione e recentemente rivisto da Baltz, 201639.
Nota: Alcuni esperimenti che phenotyping non richiederà di mutagenesi, come l'intento di identificare nuove specie dall'ambiente. Metodi di mutagenesi casuale includono l'uso di un trasposone8,9,10,11,12,13, radiazione UV o sostanze chimiche14. Sito-diretta mutagenesi15,16,17,18,19,20 tecniche possono essere utilizzate per creare specifiche mutazioni puntiformi, delezioni, o altri tipi di mutazioni.
6. confrontare e registrare l'aspetto visivo
- Prendere nota della morfologia di Colonia per ogni mutante rispetto al ceppo selvaggio-tipo dopo striature tutti i ceppi come al punto 2. Confrontare il nuovo isolato a quello di una specie ben studiata, come s. coelicolor o s. venezuelae, quando che caratterizzano la nuova specie di Streptomyces . Nota le caratteristiche (Figura 1) come forma di base, superficie della Colonia (fuzzy, calvo, rugosa, ecc.), opacità, elevazione e pigmentazione (distinguere tra micelio vegetativo, micelio aerea e/o mezzo circostante).
- Etichettare un agar MS piatto e striscia ceppi wild-type e mutanti in modelli di Cuneo (Figura 1). Fare attenzione che il ceppo non tocca un altro ceppo per evitare la contaminazione incrociata. Si noti la data e l'ora che ceppi sono striature sulla piastra. Incubare le piastre a 30 ° C.
- Luogo coltivato di Petri colorata o carta bianca per omogeneizzare lo sfondo. Scrivere su carta il nome del ceppo, data, temperatura di incubazione e ora da primo piatto striature. Prendere immagini digitali della piastra con le informazioni di quest'ultime scritte sullo sfondo carta in modo che la confusione è ridotto al minimo.
Nota: La scrittura può essere ritagliata dalla fotografia in un secondo momento se deve essere utilizzato per la preparazione di figura.
7. eseguire la microscopia di contrasto di fase
- Sterilizzare una pinzetta lavaggio in etanolo al 70% e quindi passando attraverso una fiamma di bruciatore di Bunsen per far evaporare l'etanolo. Lasciare per raffreddare.
- Sterilizzare le lamelle lavaggio in etanolo al 70% e quindi permettendo ad asciugare in una capsula di Petri sterile.
-
Preparare un vetrino coprioggetti ascensore della crescita batterica da esaminare.
- Pick up un coprioggetto sterile con pinzette sterili e inserire il vetrino coprioggetto su una piastra di agar MS dove la crescita batterica è densa. Premere sulla parte posteriore del vetrino coprioggetto delicatamente con le pinzette per garantire sufficiente trasferimento delle spore batteriche e aerea micelio.
- Pick up il coprioggetto dalla piastra e posizionarlo in modo che il lato con il materiale cellulare è rivolto verso la superficie di un vetrino da microscopio, con un calo di 15 µ l di glicerolo al 50% preparato in acqua per il montaggio. Ridurre le bolle di aria posizionando il coprioggetto verso la diapositiva con un'angolazione di 45° e lasciarlo cadere il glicerolo di 50%.
- (Opzionale) Guarnizione con clear nail polacco per la conservazione della diapositiva.
-
Eseguire microscopia di contrasto di fase come descritto da Frohlich40 a vari intervalli di tempo durante i cicli di vita.
Nota: Formazione immagine ripetuta consente un'analisi più completa e la capacità di rilevare ritardi nello sviluppo. Ripetere in modo indipendente le osservazioni per garantire accuratezza e riproducibilità.- Posizionare il vetrino preparato sul tavolino del microscopio e aggiungere una goccia di olio da immersione al centro del vetrino coprioggetti. Ruotare la fase X 100 obiettivo in inserire e impostare la torretta del condensatore per l'impostazione corretta di fase "corrispondenti". Mettere a fuoco l'immagine utilizzando solo la manopola di regolazione fine, una volta che la lente dell'obiettivo è a contatto con l'olio.
- Esaminare i diversi campi di vista per discernere le differenze evidenti e coerente tra ceppi mutanti e wild type, ad esempio la possibilità di spore di forma, dimensione di spora e forma e numero complessivo di spore (Vedi Figura 2).
Nota: Alternative alla microscopia a contrasto di fase includono interferenza differenziale contrasto (DIC) microscopia40 e semplici tecniche di colorazione per utilizzano con microscopi campo luminoso41, come la colorazione viola di cristallo.
8. eseguire la microscopia a fluorescenza
- Sterilizzare una pinzetta lavaggio in etanolo al 70% ed eseguendo quindi attraverso una fiamma di bruciatore di Bunsen.
- Pick up un coprioggetto sterile con pinzette sterili e posto su una piastra di agar MS dove è evidente la crescita batterica. Toccare la parte posteriore del coprivetrino delicatamente con le pinzette per garantire sufficiente trasferimento delle spore batteriche e filamenti aeree.
- Pick up il coprioggetto dalla piastra e posizionarlo in modo che il lato con il materiale cellulare è rivolto verso l'alto, il cartoncino per la facilità nella manipolazione del coprivetrino.
- Inondare il coprioggetto con metanolo ghiacciato (~ 300 µ l per un vetrino coprioggetto di 20 x 20 mm2 ) e lasciate asciugare completamente.
Attenzione: Il metanolo è un agente mutageno. Evitare il contatto diretto con la pelle. - Lavare il vetrino coprioggetto tre volte in soluzione salina tampone fosfato (PBS)42 delicatamente erogazione e rimuovendo la soluzione.
- Aggiungere 15 µ l di 100 μg/ml ioduro di propidio e/o 10 μg/mL frumento-germe-agglutinina coniugata con isotiocianato di fluorescina (WGA-FITC) realizzato in glicerolo al 50% per un vetrino da microscopio con etichetta.
Nota: Ioduro di propidio macchie di rosso per rilevare la posizione cromosomica del DNA mentre WGA-FITC macchie verde della parete cellulare del DNA. - Invertire il vetrino coprioggetto faccia in giù sulla goccia di colorante fluorescente su vetrino. (Facoltativamente) sigillare con smalto trasparente per la conservazione della diapositiva. Come le tinture sono sensibili alla luce, incubare per 15 minuti in una stanza buia o poco illuminata.
- Osservare i vetrini sotto una lente di obiettivo X 100 utilizzando un contrasto di fase o microscopio DIC equipaggiato con cubetti di eccitazione di epifluorescenza per ioduro di propidio ('Texas Red' filtro impostato o 535/617 nm eccitazione/emissione massimi) e FITC (FITC filtro impostato o 490/525 nm maxima di eccitazione/emissione).
- Porre il vetrino sul palco e messa a fuoco utilizzando le manopole di regolazione grossolana e fine.
- Osservare la fluorescenza come illustrato altrove43.
- Utilizzare un pacchetto di software di analisi immagine gratuito che può aiutare nell'identificazione delle spore con bassa intensità di fluorescenza44.
Risultati
Fenotipizzazione iniziali esperimenti sono necessari per la caratterizzazione di ceppi e nuove specie e possono essere utilizzati come un approccio gratuito alla filogenesi e gli esperimenti di ibridazione DNA-DNA che vengono utilizzati per la caratterizzazione di nuove specie. Streptomyces mutanti risultanti da metodi di mutagenesi casuale come chimici, UV, o mutagenesi transposon in genere vengono identificati attraverso schermi diretti, visivo su piastre di agar. Colonie di Streptomyces sono esaminati per i cambiamenti nel fenotipo in confronto il ceppo selvaggio-tipo, parentale. Ad esempio, un micelio aereo colorato leggero potrebbe indicare un livello inferiore di pigmento grigio causato da un difetto in sporulazione, o la mancanza di un aspetto sfocato è indicativa di un blocco nella formazione aerea micelio (Figura 1). Molti streptomycetes producono antibiotici pigmentati in micelio vegetativo o agar circostanti. S. coelicolor produce due antibiotici pigmentati come pure due quelle incolori. Actinorhodin è un antibiotico blu-pigmentato e undecylprodigiosin è un antibiotico pigmentate rosso45. Ceppi che sono stati sottoposti a schermi di Colonia visiva iniziale vengono propagate da striature per singole colonie.
A seguito di identificazione visiva di potenzialmente interessanti, mutanti, ceppi sono sottoposti ad esame microscopico. Contrasto di fase microscopia è particolarmente adatta per esaminare Streptomyces mutanti per difetti di sviluppo, utilizzando il ceppo selvaggio-tipo come controllo (Figura 2). Wild type S. coelicolor colonie in genere producono un micelio aereo di circa due giorni di crescita a 30 ° C su agar MS e lunghe catene di spore da tre giorni di crescita. Il ciclo di vita progredirà leggermente più lento o più veloce su altri tipi di supporti. È imperativo che i mutanti analizzati sotto le stesse condizioni di crescita come il tipo selvaggio quando trarre conclusioni circa i difetti inerenti allo sviluppo e ritardi. Mutanti Calvi possono produrre spore dopo prolungata crescita su agarizzati. Una classe di mutanti denominati mutanti bianchi potrebbero essere ritardati o per formazione della spora, mostrano una riduzione l'abbondanza di spore prodotte, producono spore con difetti di forma o nella taglia, o semplicemente produrre i livelli più bassi del pigmento spora matura, grigio46 . Altri mutanti studiati finora possono essere ritardate o accelerate nella progressione del ciclo di vita come i mutanti colpiti per l'accumulo di molecole (ad es., ciclico-di-GMP47) di segnalazione.
Un semplice follow-up per la tecnica di microscopia chiara sopra descritta è microscopia di fluorescenza usando lo ioduro di propidio per macchia cromosomica del DNA nucleoids e dell'agglutinina germe di grano fluorescente contrassegnati a macchiare la parete cellulare dei setti di sporulazione. Spore manca un cromosoma sarà priva l'ioduro di propidio rosso colorazione, mentre le spore che contengono meno del DNA di solito può essere identificato se essi sembrano diminuiti macchiatura (Figura 3). Agglutinina germe di grano può essere usato per macchiare la parete cellulare e possono essere osservate differenze nella parete cellulare colorazione modelli (cioè, difetti di divisione delle cellule). Nella Figura 4 il selvaggio-tipo ceppo di S. venezuelae, una specie che recentemente viene utilizzata come un altro modello streptomycete a causa del suo ciclo di vita e la capacità di sporulare in liquido45, più veloce è stato macchiato con WGA-FITC delucidare la matrice di scala-come dei setti di divisione che in genere si vedono presto durante la sporulazione.
Le strategie di fenotipizzazione iniziale descritte qui dovrebbero comportare quanto segue: 1) identificazione di ceppi mutanti di interesse per ulteriori studi; 2) acquisito conoscenza circa il mutante recentemente identificato ed il ruolo potenziale del gene, che è stato mutato; 3) la formulazione di una successiva serie di passaggi successivi sperimentale che può essere utilizzato per chiarire ulteriormente il ruolo del gene in questione. Nel caso di un streptomycete recentemente identificata dall'ambiente, il ricercatore otterrà conoscenza della potenziale nuova specie rispetto ai già caratterizzato specie di Streptomyces.

Figura 1: La fotografia di una piastra di agar rappresentativi dimostrando fenotipi macroscopica Colonia di S. coelicolor. La piastra di agar viene illustrato lo sfocato, grigio aspetto visivo del micelio aereo per selvaggio-tipo S. coelicolor ceppo MT1110 (WT) rispetto ai vari mutanti di inserimento casuale trasposone con fenotipi inerente allo sviluppo. Mutanti sono carenti sia un micelio aereo [calvo (bld)] o un micelio aereo con pigmentazione ridotta spora [bianco (whi)]. Mutanti di trasposoni sono stati generati utilizzando mini-Tn5 per inserimento mutagenesi6,7. I ceppi sono stati coltivati su agar MS per 5 giorni a 30 ° C. Capsula di Petri diametro 100 mm.
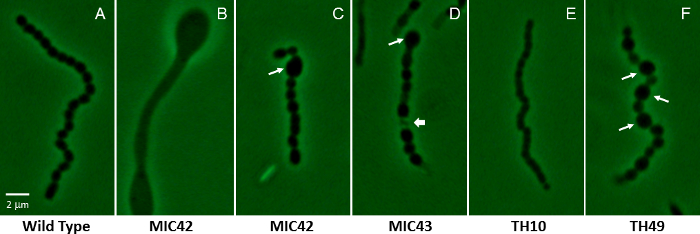
Figura 2: Micrografie di contrasto di fase mostrando un rappresentante aerea filamento per S. coelicolor bianco mutante ceppi contenenti mutazioni di inserimento casuale trasposone. (A) mostrato è un filamento aerea di tipo wild rappresentativo che ha subito sincrone, regolarmente distanziati divisioni cellulari, producendo in modo uniforme a forma e dimensioni di spore (MT1110). (B–F) I pannelli restanti mostrano i fenotipi microscopici notevolmente differenti di vari mutanti bianchi che sono stati isolati tramite mutagenesi casuale trasposoni. Pannello B Mostra un filamento aereo che non ha subito la sporulazione, ma invece ha prodotto aree sporgenti all'interno il filamento. Le frecce lunghe in C, Ded F indicano anormalmente grandi spore che sono caratteristici dei mutanti, MIC42, MIC43 e TH49. La breve freccia nel pannello D indica un esempio di un vano di lisato spora. Pannello E Mostra i parzialmente ristretti scomparti più piccoli che sono tipiche delle catene di spore prodotte dal mutante TH10. I ceppi sono stati coltivati su agar MS per 5 giorni a 30 ° C. I mutanti sono estranei a quelli mostrati nella Figura 1. Una spora di wild-type è circa 1,1 µm sull'asse lungo. Barra della scala = 2 µm. Clicca qui per visualizzare una versione più grande di questa figura.
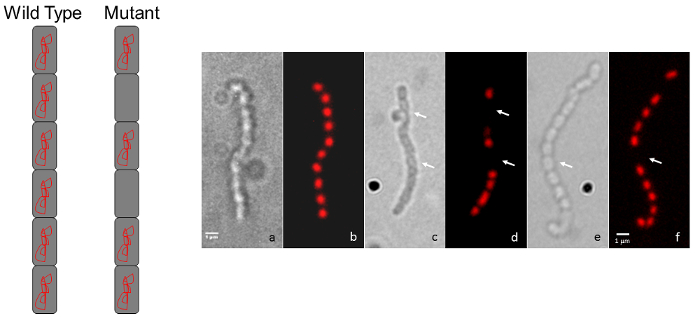
Figura 3: Rappresentante micrografie risultati S. coelicolor mutante cromosoma fenotipi segregazione. (A) A diagramma rappresentazione Mostra il tipico aspetto di colorazione selvaggio-tipo, regolarmente distanziati per una catena di spore (ogni spora contiene DNA cromosomico) rispetto al modello di macchiatura intermittente per un mutante che visualizza un cromosoma difetto di segregazione. (B) ogni coppia di pannelli Mostra la spora stessa catena osservata dall'immagine di contrasto di interferenza differenziale (DIC) sulla sinistra e un'immagine di propidio ioduro-ha macchiato di fluorescenza è mostrata a destra. Il fenotipo di selvaggio-tipo (a, b) viene confrontato con due mutanti di inserimento casuale trasposone (c, d ed e, f). Le frecce indicano le spore privo di DNA. I ceppi sono stati coltivati su agar MS per 5 giorni a 30 ° C. I mutanti mostrati sono estranei a quelli in Figura 1 e Figura 2. Barra della scala = 1 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Micrografo di fluorescenza del ceppo selvaggio-tipo S. venezuelae macchiato con WGA-FITC. (A) A diagramma di un filamento aereo apparirà liscio con non rientri e nessun segno visibile di sporulazione utilizzando la microscopia a contrasto di fase in confronto con la matrice di scala-come di macchiatura della parete cellulare che indica una fase iniziale di sporulazione ha cominciato in quello stesso filamento utilizzando WGA-FITC sotto microscopia di fluorescenza. (B) micrografie di selvaggio-tipo S. venezuelae. (un) filamenti aeree liscio sono presenti tra le catene di spore. (b) entro il micelio mostrato nel pannello un, uno aerea filamento in una fase iniziale nello sviluppo possiede una scala-come matrice di deposizione della parete cellulare. Le frecce indicano la formazione regolarmente distanziati di croce-pareti macchiate dalla WGA-FITC che si sviluppano in modo sincrono all'interno di un singolo filamento aereo come subisce sporulazione inerente allo sviluppo-collegata. Il ceppo è stato coltivato su agar MYM MYM (Maltose, Estratto di Yest, Estratto di alt M) per 38 h a 30 ° C. Barra della scala = 2 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui presentiamo i protocolli per i ricercatori di Streptomyces per avviare studi includendo i passaggi necessari per propagare ceppi e preparare scorte per l'archiviazione a lungo termine di inizio. Descriviamo quindi i protocolli per la caratterizzazione visiva e microscopiche di ceppi di Streptomyces . Alcuni passi iniziali tipici nei mutanti inerente allo sviluppo che phenotyping sono: 1) esame visivo delle colonie mutante rispetto al wild-type colonie su agar; 2) microscopia di contrasto di fase; e 3) microscopia di fluorescenza di sporogenic IFE aeree. Sulla base del fenotipo visualizzato in questi tre passaggi, una varietà di tecniche può essere impiegata per discernere ulteriormente il fenotipo di un particolare ceppo.
Gli esperimenti iniziali phenotyping sono comunemente usati per caratterizzare nuove specie, identificare mutanti di interesse, parzialmente caratterizzare mutanti e cominciare a discernere il ruolo tipico di un gene particolare basato sul fenotipo di un mutante identificato. I metodi descritti qui sono già stati utilizzati in laboratori di identificare e caratterizzare un'ampia varietà di Streptomyces mutanti, compresi quelli con difetti nella divisione cellulare48,49, di insegnamento universitario 50 , 51 , 52 , 53 , 54, sporulazione55,56, micelio aerea formazione57,58, produzione antibiotica59, secondo messaggero segnalazione47e segregazione del cromosoma 60. queste tecniche sono i primi passi fondamentali per determinare il fenotipo dei mutanti in generale e rivelare una grande quantità di informazioni importanti circa il ruolo dei geni di interesse. I metodi possono essere facilmente esteso ad altre specie di Streptomyces e sono già stati utilizzati per descrivere i ceppi di S. griseus, S. venezuelae, S. scabbiae molti altri streptomycetes. I protocolli dei video descritti qui sono tenuti a servire come una risorsa importante per i ricercatori di nuovi entrare in campi di ricerca di Streptomyces , come nella zona del drug discovery. Questo include nuovi istruttori che lavorano per combattere la crisi di resistenza agli antibiotici ed educare il numero incalcolabile di nuovi ricercatori di studente universitario, unendo gli sforzi di crowdsourcing dell'iniziativa mondo piccolo.
Le tecniche qui descritte possono essere facilmente adattate per uso in classe college e scuole superiori oltre a laboratori di ricerca, utilizzando le modifiche descritte nel video e testo. Gli studenti in un modulo di microscopia di anno primo presso un piccolo liberal arts college sono stati in grado di inoculare ceppi, scattare fotografie digitali dei ceppi coltivato su agarizzati ed eseguire la microscopia di fluorescenza e contrasto di fase, che culminarono con la presentazione di un portfolio di Multi-rivestiti figure alla fine del modulo 3 settimana, che rappresenta 15 h di lavoro in laboratorio. Circa 160 studenti del primo anno erano responsabili per la fenotipizzazione iniziale di 320 mutanti trasposone romanzo. Studenti universitari ricerche alle tre istituzioni hanno partecipato la fenotipizzazione iniziale di ulteriori mutanti e la successiva caratterizzazione di molti dei ceppi. I dati completi ottenuti in un periodo relativamente breve di tempo, illustrano il valore dei protocolli descritti qui. Centinaia di altri mutanti è stati archiviati sotto forma di scorte miceliari glicerolo per futuri caratterizzazione.
In seguito gli esperimenti iniziali descritti qui, una varietà di metodi può essere impiegata per estendere la qualità delle informazioni relative al ceppi di interesse. Se la mutazione è sconosciuta, un metodo di genotipizzazione dovrebbe essere impiegato per determinare il tipo e/o la posizione della mutazione. Ad esempio, la mutagenesi casuale trasposone del selvaggio-tipo cromosoma6,7,8,9,10,11,12,13 traduce in colonie che devono essere sottoposti a schermate fenotipiche iniziali come quelle descritte sopra. Quindi il percorso del trasposone dovrebbe essere identificato usando una tecnica come inversa della polimerasi reazione a catena (iPCR)61. Determinare il genotipo di mutanti recentemente scoperte è un passo importante dopo caratterizzazione iniziale.
Alcuni comunemente utilizzati metodi avanzati per analisi phenotyping successivi che possono essere richiamati in aula esplorato attraverso ulteriori ricerche includono la proteina fluorescente verde (GFP) codifica per determinare gli schemi di localizzazione per la proteina di interesse, analisi di espressione genica quali real time PCR quantitativa (qPCR) e pattern di espressione genica globale di selvaggio-tipo contro mutante tramite sequenziamento di RNA (RNA-seq). Fenotipizzazione competenze sono anche necessari per l'analisi di complementazione genetica. In un esperimento di complementazione, la copia di selvaggio-tipo di un gene è stato introdotto in un ceppo mutato per determinare se l'allele appena aggiunto può compensare la perdita di funzione dell'allele mutato. Confrontando il fenotipo del ceppo accompagnato a quello parentale sia il mutante originale, ceppo selvaggio-tipo è necessaria.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori desidera ringraziare Otterbein University per Undergraduate Student Research Fellowships e Student Research Fund Awards GVK e SGK; e il memoriale di Professore Gilbert E. Mills Otterbein dotato sabbatico programma Award e il dipartimento di biologia e la ricerca di facoltà di Scienze della terra e la borsa di studio dotato Award per JAB. Il fondo di corno dotato studente ricerca Jane nelle scienze e Bert è stato assegnato a GVK e SGK. Gli autori vorrebbero anche Duquesne University Undergraduate programma borse di studio finanziato GVK e SGK con gratitudine. Gli studenti universitari ricerche ex Juniata College, Ryan Johnson e Lindsey Draper ha contribuito le immagini di microscopia per figure 2 e 3, rispettivamente.
Materiali
| Name | Company | Catalog Number | Comments |
| 50% Glycerol | Sigma-Aldrich | G5516 | |
| Immersion Oil (Type DF) | Cragille | 16482 | |
| Lens Paper | Fisherbrand | 11-995 | |
| Sterile Water | GeneMate | G-3250-1L | |
| 100% Ethanol | Sigma-Aldrich | E7023 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Toothpicks (flat) | Target | 081-22-1957 | |
| Pipette Tips (10 mL) | GeneMate | P-1240-10 | |
| Pipette Tips (200 mL) | GeneMate | P-1240-200Y | |
| Pipette Tips (1,250 mL) | GeneMate | P-1240-1250 | |
| Wooden Applicators 6'' | Solon Care | 070809 | |
| Cotton Swabs | Fisherbrand | 23-400-124 | |
| Soy Flour | Bob's Red Mill | 1516C164 | |
| D-Mannitol | Sigma-Aldrich | M4125-1KG | |
| Agar | Sigma-Aldrich | A1296-1KG | |
| Glycerol 100% | VWR amresco life science | 0854-1L | |
| 0.8% NaCl (Saline) | Sigma-Aldrich | SLBB9000V | |
| 1.2 mL freezer tube | NEST | 606101 | |
| Ultra low (-80 °C) freezer | SO-LOW | U85-18 | |
| Cryo Safety Gloves | Bel-Art | H13201 | |
| Petri dishes | Sigma-Aldrich | P5856-500EA | |
| Cover slips #1.5 | Thomas Scientific | 64-0721 | |
| Slides | Carolina | 63-2010 | |
| Autoclave | Tuttnauer | 2540E | |
| Phase-Contrast Microscope | Olympus | BX40 | |
| Forceps | Carolina Biological | 624504 | |
| Bunsen Burner | Carolina Biological | 706706 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| PBS (phosphate buffer saline) | Sigma-Aldrich | P4417-50TAB | |
| WGA-FITC | Biotium | 29022-1 | |
| Clear nail polish | OPI | 22001009000 | |
| ImageJ | NIH | Free Software | |
| 100 mL beaker | Pyrex USA | 1000-T | |
| 1 L beaker | Carolina Biological | 721253 | |
| 1 L flask | Fisherbrand | S63274 | |
| 250 mL flask | Pyrex USA | 4980 | |
| 100 mL graduated cylinder | Carolina Biological | 721788 | |
| 500 mL graduated cylinder | Carolina Biological | 721792 | |
| Stir Bar | Fisher Scientific | 22-271825 | |
| Centrifuge | Eppendorf | 5810R | |
| Camera for Microscope | Olympus | DP72 | |
| Nitrile Examination Gloves (Med) | Bio Excell | 71011002 | |
| Vortex Mixer | Carolina Biological | 701077 |
Riferimenti
- Barka, E. A., et al. Taxonomy, physiology, and natural products of Actinobacteria. Microbiol. Mol. Biol. Rev. 80 (1), 1-43 (2015).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (2), 141-147 (2002).
- Redenbach, M., et al. A set of ordered cosmids and a detailed genetic and physical map for the 8 Mb Streptomyces coelicolor A3(2) chromosome. Mol. Microbiol. 21 (1), 77-96 (1996).
- McCormick, J. R., Flardh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36 (1), 206-231 (2012).
- Flardh, K., Buttner, M. J. Streptomyces morphogenetics: dissecting differentiation in a filamentous bacterium. Nat. Rev. Microbiol. 7 (1), 36-49 (2009).
- Bennett, J. A. . Molecular Genetic analysis of division and development in Streptomyces coelicolor. , (2007).
- Hull, T. D., et al. Cyclic Di-GMP phosphodiesterases RmdA and RmdB are involved in regulating colony morphology and development in Streptomyces coelicolor. J. Bacteriol. 194 (17), 4642-4651 (2012).
- Petzke, L., Luzhetskyy, A. In vivo Tn5-based transposon mutagenesis of streptomycetes. Appl. Microbiol. Biotechnol. 83 (5), 979-986 (2009).
- Xu, Z., et al. Large-Scale Transposition Mutagenesis of Streptomyces coelicolor Identifies Hundreds of Genes Influencing Antibiotic Biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Fernandez-Martinez, L. T., et al. A transposon insertion single-gene knockout library and new ordered cosmid library for the model organism Streptomyces coelicolor A3(2). Antonie Van Leeuwenhoek. 99 (3), 515-522 (2011).
- Gehring, A. M., Nodwell, J. R., Beverley, S. M., Losick, R. Genomewide insertional mutagenesis in Streptomyces coelicolor reveals additional genes involved in morphological differentiation. Proc. Natl. Acad. Sci. U.S.A. 97 (17), 9642-9647 (2000).
- Bishop, A., Fielding, S., Dyson, P., Herron, P. Systematic insertional mutagenesis of a streptomycete genome: a link between osmoadaptation and antibiotic production. Genome Res. 14 (5), 893-900 (2004).
- Bilyk, B., Weber, S., Myronovskyi, M., Bilyk, O., Petzke, L., Luzhetskyy, A. In vivo random mutagenesis of streptomycetes using mariner-based transposon Himar1. Appl. Microbiol. Biotechnol. 97 (1), 351-359 (2013).
- Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. F., Hopwood, D. A. . Practical Streptomyces Genetics. , (2000).
- Gust, B., Kieser, T., Chater, K. F. . REDIRECT technology: PCR-targeting system in Streptomyces coelicolor. , (2002).
- Gust, B., Chandra, G., Jakimowicz, D., Yuqing, T., Bruton, C. J., Chater, K. F. Lambda red-mediated genetic manipulation of antibiotic-producing Streptomyces. Adv. Appl. Microbiol. 54, 107-128 (2004).
- Tong, Y., Charusanti, P., Zhang, L., Weber, T., Lee, S. Y. CRISPR-Cas9 based engineering of Actinomycetal genomes. ACS Synth. Biol. 4 (9), 1020-1029 (2015).
- Huang, H., Zheng, G., Jiang, W., Hu, H., Lu, Y. One-step high-efficiency CRISPR/Cas9-mediated genome editing in Streptomyces. Acta BiochimBiophys. Sin.(Shanghai). 47 (4), 231-243 (2015).
- Cobb, R. E., Wang, Y., Zhao, H. High-efficiency multiplex genome editing of Streptomyces species using an engineered CRISPR/Cas system. ACS Synth. Biol. 4 (6), 723-728 (2015).
- Carey, M. F., Peterson, C. L., Smale, S. T. PCR-mediated site-directed mutagenesis. Cold Spring Harb Protoc. 2013 (8), 738-742 (2013).
- Brown, E. D., Wright, G. D. Antibacterial drug discovery in the resistance era. Nature. 529 (7586), 336-343 (2016).
- Dodds, D. R. Antibiotic resistance: A current epilogue. Biochem. Pharmacol. 134, 139-146 (2017).
- Caruso, J. P., Israel, N., Rowland, K., Lovelace, M. J., Saunders, M. J. Citizen Science: The Small World Initiative improved lecture grades and California critical thinking skills test scores of nonscience major students at Florida Atlantic University. J. Microbiol. Biol. Educ. 17 (1), 156-162 (2016).
- Davis, E., et al. Antibiotic discovery throughout the Small World Initiative: A molecular strategy to identify biosynthetic gene clusters involved in antagonistic activity. Microbiology Open. 6 (3), (2017).
- van Keulen, G., Dyson, P. J. Production of specialized metabolites by Streptomyces coelicolor A3(2). Adv. Appl. Microbiol. 89, 217-266 (2014).
- Aigle, B., et al. Genome mining of Streptomyces ambofaciens. J. Ind. Microbiol. Biotechnol. 41 (2), 251-263 (2014).
- Antoraz, S., Santamaria, R. I., Diaz, M., Sanz, D., Rodriguez, H. Toward a new focus in antibiotic and drug discovery from the Streptomyces arsenal. Front. Microbiol. 6, 461 (2015).
- Onaka, H. Novel antibiotic screening methods to awaken silent or cryptic secondary metabolic pathways in actinomycetes. J. Antibiot.(Tokyo). 70 (8), 865-870 (2017).
- Chen, J., Wu, Q., Hawas, U. W., Wang, H. Genetic regulation and manipulation for natural product discovery. Appl. Microbiol. Biotechnol. 100 (7), 2953-2965 (2016).
- Katz, L., Baltz, R. H. Natural product discovery: past, present, and future. J. Ind. Microbiol. Biotechnol. 43 (2-3), 155-176 (2016).
- Liu, G., Chater, K. F., Chandra, G., Niu, G., Tan, H. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiol. Mol. Biol. Rev. 77 (1), 112-143 (2013).
- den Hengst, C. D., Tran, N. T., Bibb, M. J., Chandra, G., Leskiw, B. K., Buttner, M. J. Genes essential for morphological development and antibiotic production in Streptomyces coelicolor are targets of BldD during vegetative growth. Mol. Microbiol. 78 (2), 361-379 (2010).
- Tran, N. T., Den Hengst, C. D., Gomez-Escribano, J. P., Buttner, M. J. Identification and characterization of CdgB, a diguanylate cyclase involved in developmental processes in Streptomyces coelicolor. J. Bacteriol. 193 (12), 3100-3108 (2011).
- Anonymous. Lab Safety. Proper Use of Autoclaves. JoVE Science Education Database. , (2017).
- Border, B. G., Rice-Spearman, L. Microwaves in the laboratory: effective decontamination. Clin. Lab. Sci. 12 (3), 156-160 (1999).
- Bhattacharjee, M. K., Delsol, J. K. Does microwave sterilization of growth media involve any non-thermal effect?. J. Microbiol. Methods. 96, 70-72 (2014).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J. Vis. Exp. (63), e3064 (2012).
- Anonymous, General Laboratory Techniques. An Introduction to the Micropipettor. JoVE Science Education Database. , (2017).
- Baltz, R. H. Genetic manipulation of secondary metabolite biosynthesis for improved production in Streptomyces and other actinomycetes. J. Ind. Microbiol. Biotechnol. 43 (2-3), 343-370 (2016).
- Frohlich, V. C. Phase Contrast and Differential Interference Contrast (DIC) Microscopy. J. Vis. Exp. (18), e844 (2008).
- Anonymous, General Laboratory Techniques. Introduction to Light Microscopy. JoVE Science Education Database. , (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory. 3, (1989).
- Anonymous, General Laboratory Techniques. Introduction to Fluorescence Microscopy. JoVE Science Education Database. , (2017).
- Jensen, E. C. Quantitative analysis of histological staining and fluorescence using ImageJ. Anat. Rec.(Hoboken). 296 (3), 378-381 (2013).
- Chater, K. F. Recent advances in understanding Streptomyces. F1000Res. 5, (2016).
- Chater, K. F. Regulation of sporulation in Streptomyces coelicolor A3(2): a checkpoint multiplex?. Curr. Opin. Microbiol. 4 (6), 667-673 (2016).
- Tschowri, N. Cyclic dinucleotide-controlled regulatory pathways in Streptomyces species. J. Bacteriol. 198 (1), 47-54 (2016).
- Bennett, J. A., et al. Medium-dependent phenotypes of Streptomyces coelicolor with mutations in ftsI or ftsW. J. Bacteriol. 191 (2), 661-664 (2009).
- Mistry, B. V., Del Sol, R., Wright, C., Findlay, K., Dyson, P. FtsW is a dispensable cell division protein required for Z-ring stabilization during sporulation septation in Streptomyces coelicolor. J. Bacteriol. 190 (16), 5555-5566 (2008).
- Bennett, J. A., Aimino, R. M., McCormick, J. R. Streptomyces coelicolor genes ftsL and divIC play a role in cell division but are dispensable for colony formation. J. Bacteriol. 189 (24), 8982-8992 (2007).
- Bennett, J. A., McCormick, J. R. Two new loci affecting cell division identified as suppressors of an ftsQ-null mutation in Streptomyces coelicolor A3(2). FEMS Microbiol. Lett. 202 (2), 251-256 (2001).
- Dharmatilake, A. J., Kendrick, K. E. Expression of the division-controlling gene ftsZ during growth and sporulation of the filamentous bacterium Streptomyces griseus. Gene. 147 (1), 21-28 (1994).
- McCormick, J. R., Losick, R. Cell division gene ftsQ is required for efficient sporulation but not growth and viability in Streptomyces coelicolor A3(2). J. Bacteriol. 178 (17), 5295-5301 (1996).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor mutant for the cell division gene ftsZ. Mol. Microbiol. 14 (2), 243-254 (1994).
- Flärdh, K., Findlay, K. C., Chater, K. F. Association of early sporulation genes with suggested developmental decision points in Streptomyces coelicolor A3(2). Microbiology. 145 (9), 2229-2243 (1999).
- van Wezel, G. P., van der Meulen, J., Kawamoto, S., Luiten, R. G., Koerten, H. K., Kraal, B. ssgA is essential for sporulation of Streptomyces coelicolor A3(2) and affects hyphal development by stimulating septum formation. J. Bacteriol. 182 (20), 5653-5662 (2000).
- Capstick, D. S., Willey, J. M., Buttner, M. J., Elliot, M. A. SapB and the chaplins: connections between morphogenetic proteins in Streptomyces coelicolor. Mol. Microbiol. 64 (3), 602-613 (2007).
- Ma, H., Kendall, K. Cloning and analysis of a gene cluster from Streptomyces coelicolor that causes accelerated aerial mycelium formation in Streptomyces lividans. J. Bacteriol. 176 (12), 3800-3811 (1994).
- Xu, Z., et al. Large-scale transposition mutagenesis of Streptomyces coelicolor identifies hundreds of genes influencing antibiotic biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Dedrick, R. M., Wildschutte, H., McCormick, J. R. Genetic interactions of smc, ftsK, and parB genes in Streptomyces coelicolor and their developmental genome segregation phenotypes. J. Bacteriol. 191 (1), 320-332 (2009).
- Pavlopoulos, A. Identification of DNA sequences that flank a known region by inverse PCR. Methods Mol. Biol. 772, 267-275 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon