Method Article
Визуальные и микроскопических оценки Streptomyces развития мутантов
В этой статье
Резюме
Здесь мы представляем протоколы для начинающих исследователей начать фенотипирование для фармакологически важных бактерий рода Streptomyces.
Аннотация
Нитчатые почвенных бактерий, принадлежащих к типу актиномицеты, которые встречаются во всем мире и производить широкий спектр антибиотиков и других вторичных метаболитов стрептомицетов. Streptomyces coelicolor является хорошо изученных, непатогенных видов, которые поддаются различные анализы в лаборатории. Фенотипирование методы, описанные здесь использовать S. coelicolor в качестве модели стрептомицетовой; Однако методы применимы для всех членов этого большого рода, а также несколько тесно связанных актиномицетов. Фенотипирование необходима для описания новых видов Streptomyces определены в окружающей среде, и это также жизненно важным первым шагом в характеристике вновь изолированных мутантных штаммов стрептомицетов. Знание фенотипирование имеет важное значение для многих новых исследователей, которые выходят области Streptomyces исследований, который включает в себя изучение развития бактерий, деление клеток, хромосома сегрегации и второй messenger сигнализации. Последние краудсорсинг антибиотик открытия через изоляции новых почвенных микробов привела к повышенная потребность фенотипирование подготовки инструкторов новой области исследований Streptomyces и их колледж или средней школы студентов. Эта рукопись описывает методы для распространения бактерий штамма, хранения и характеристика через визуальные и микроскопических экспертизы. После прочтения этой статьи, новые исследователи (лаборатории микробиологии образование и ученые гражданина) должны быть в состоянии манипулировать штаммов стрептомицетов и начать эксперименты визуальных характеристик.
Введение
Стрептомицетов являются грамположительных, нитчатые почвенных бактерий, известный для их способности производить различных вторичных метаболитов, в том числе более двух третей из коммерчески доступных антибиотиков, а также как противоопухолевый, борьбы с ВИЧ и Противопаразитарные препараты 1. S. coelicolor является наиболее генетически характеризуется членов род2,3 и видов, используемых в описанные здесь методы. S. coelicolor имеет сложный жизненный цикл, который начинается с прорастанием одного Spore, развивается в обширные, ветвящиеся вегетативного мицелия, который превращается в средство агар. Поскольку жизненный цикл продолжается, воздушные нитей формируются которые нарушают поверхностное натяжение субстрата мицелием и наконец разделены в длинные цепочки клеток, которые в конечном итоге превращаются в зрелых, серо пигментированные споры. Дисперсия этих недавно сформированной спор представляет начало следующего цикла4.
Из-за ее сложный характер дифференциации S. coelicolor служит прекрасной моделью для изучения развития бактерий. Исторически мутации приводят к блоков для двух основных стадий развития и производить различные визуальные фенотипов. Bld (Лысый) мутантов блокируются для формирования воздушного мицелия и результат в отсутствие нечетких воздушного мицелия, придавая вид «лысый» колонии. Мутанты тормозится в споро формирования и созревания именуются как мутантов whi (белый), потому что они обычно не в состоянии произвести одичал тип уровни серого споро пигмента и воздушный мицелий остается белым. Другие интересные мутантов тормозится в антибиотиков производства, деление клеток, хромосома сегрегации или другие важные процессы4,5.
Несмотря на открытие многих развития генов в Streptomyces видов есть много более считается существовать на основании отсутствия насыщения мутант экранов. Наши лаборатории по-прежнему выявлять новых развития генов с помощью мини-transposon системы, что мы построили. Роман мутантных штаммов, изолированных в случайных мутагенеза эксперименты с нашей transposon проходят фенотипические скрининг для выявления возможной роли каждого нового гена обнаружил6,7. Методы для бактериального фенотипа, описанные здесь отношение к Streptomyces мутантов, изолированные transposon мутагенеза8,9,10,11,12, 13 и другие случайные методы, такие как химические и ультрафиолетового (УФ) мутагенеза14, а также режиссер строительство мутации как ген удаления с помощью recombineering,1516 или Редактирования технологии17,18,19 и точечные мутации20геном ТРИФОСФАТЫ-Cas9 (Clustered регулярно Interspaced короткие палиндром повторяет).
Антибиотикорезистентности среди возбудителей становится все более распространенной, потребность в новых антибиотиков становится все более настоятельной21,22. «Маленький мир инициатива» (или SWI) является эффективным науки, технологии, инженерии и математики (STEM) обучения23 и исследовательские стратегии24 для борьбы с антибиотикорезистентности через краудсорсинг студентов колледжа, и многое другое Недавно учащихся средней школы. Поддерживает курсы, работа включает в себя выявление новых почвенных микробов, которые производят новые антибиотики (http://www.smallworldinitiative.org). Считается, что основным источником неоткрытых антибиотиков будет продолжать быть Streptomyces видов найдены в широком диапазоне почвы и воды обитания25,26,27,28, 29,31. Недавно Наша лаборатория и работу других обнаружили и характеризуется сигнальных генов в Streptomyces видов, которые регулируют морфологии и развития, в том числе антибиотиков производства7,32, 33. Изменения в экспрессии этих генов приводят к изменению суммы и сроков производства антибиотиков. Квалифицированных фенотипирование новых видов и новых мутантов антибиотик производство будет продолжать иметь важное значение. Как новые инструкторы и их студенты становятся основными донорами в области лекарственных препаратов, обучение в бактериальных фенотипа является необходимым для успеха этих лиц, начинающих. Кроме того эти эксперименты шансов справиться с возникающими для средней школы стволовых или университетские лаборатории микробиологии образование. Они представляют собой демонстрацию основных микробных генетических принципов в лаборатории обучения установка.
протокол
1. Подготовьте инструменты, средства массовой информации культуры, решения и Петри
- Автоклав зубочистки в 50 мл стакан, покрытые алюминиевой фольги для хранить стерильные.
- Стерилизовать всех сухих грузов, которые будут использоваться в автоклаве (советы, палочки, посуда и т.д.).
Примечание: осторожно! Следуйте всем безопасности для автоклава модель, используемая. Автоклавы угрозу для взрывов и ожоги от пара и контакта с нагретыми поверхностями, материалы и средства массовой информации. Для безопасности автоклава вид «Правильное использование Автоклавы»34. -
Подготовьте MS агар (маннитол соевой муки (УЛП))14 расти культур.
- Добавьте 5 g соевой муки и 5 g агар флакон 1 Л.
- Растворяют 5 г маннитола в 250 мл водопроводной воды и обойтись во флакон, содержащий соевой муки и агар.
- Добавьте вилки пены и фольга для открытия колбу и автоклаве при температуре 121 ° C, 15 psi для по крайней мере 30 минут.
Предупреждение: Это средство легко кипит. Используйте настой, который может содержать по крайней мере четыре раза фактический объем агар МС, будучи газобетона. Стандартная плита давления может быть использован вместо автоклав с аналогичными соображениями безопасности. Кроме того микроволновой печи могут использоваться для стерилизации средств массовой информации и материалов, если доступ к автоклав не является возможным в35,36. Учителей средней школы могут также хотят сотрудничать с местных колледжей или университетов для доступа к газобетона поставок. - Прохладный СМИ пока достаточно комфортно обрабатывать. Будьте осторожны, чтобы не охладить его слишком долго, потому что агар затвердевает при температуре ниже 50 ° C.
- Налить MS агар из колбы в стерильные чашки Петри, до тех пор, пока в нижней части каждой чашке Петри составляет примерно половину полный (примерно 25 мл СМИ за Петри блюдо). Позволяют укрепить перед использованием плиты агара. Хранить плиты агара в пластиковый пакет при комнатной температуре до тех пор, пока требуется.
Примечание: Плиты агара могут также храниться в холодильнике, особенно если антибиотики необходимы в средствах массовой информации.
2. полоска Streptomyces на пластины для распространения
- Полоска штаммов стрептомицетов на плиты агара MS одной колонии, с использованием стандартного метода, таких как quadrant испещрять метод, как показано в Сандерс, 201237.
Примечание: Может использоваться пересевать цикла или стерильной зубочистки. Дополнительно: Другие средства массовой информации обычно используются для Streptomyces видов, таких как R2YE и минимальным СМИ14. - Инкубировать пластины при 30 ° C.
- Restreak плиты, выбирая один колонии каждые 4 – 6 дней. Возрастом колоний, они становятся подвержены случайные мутации.
3. Создайте глицерин мицелиальных запасов для бактериальных хранения
Примечание: Мицелиальных запасы могут быть созданы для всех штаммов стрептомицетов , включая whi и bld штаммов и другие области развития мутантов, которые неспособны завершить заспорение.
- Размачиваем 15 – 20 колоний в 200 – 500 мкл 20% глицерина с помощью стерильных деревянный дюбель аппликатор.
- Передать навозной жижи вымоченных колоний 1,5 мл трубки морозильник культуры, используя микропипеткой или стерильной передачи пипеткой.
Примечание: Основы использования микропипеткой покрыты других38. - Добавьте достаточно 20% глицерина, чтобы сделать окончательный объем 1 мл и аккуратно перемешать. Хранить образцы на-80 ° C.
Примечание: осторожно! Применение криогенных защитные перчатки и лаборатории пальто для защиты кожи от контакта с холода. Кроме того морозильник-20 ° C может использоваться с потенциального снижения в долгосрочной перспективе время хранения. Избегайте чрезмерного замерзания и оттаивания продлить жизнеспособность.
4. Создание глицерин Spore запасов штаммов, способных заспорение
Примечание: Spore запасы являются предпочтительными для долгосрочной жизнеспособности, но возможны только для штаммов, которые способны завершить заспорение.
-
Распространение 100 мкл вымоченных материала на плите агар для получения вырожденная газон роста37(от шага 3.1).
Примечание: Спред покрытием показан в Сандерс37 (модификация: проигрыватель не требуется.). Пластина может быть включен с одной стороны при использовании с другой стороны, чтобы переместить разбрасыватель в нежные и обратно движения через средства массовой информации агар.- Накапайте 100 мкл вымоченных мицелия в центре плиты агара MS.
- Стерилизуйте, стекла или металла, распространяя инструмент частично погружаясь в 70% этанола и передавая разбрасыватель раз медленно через пламя горелки Бунзена ускорить испарение этанола.
Предупреждение: Этанол легко воспламеняется. Не место пламенный разбрасыватель в этанол или разрешить пылающий падение этанола попадают в блюдо этанола. Кроме того используйте одноразовые стерильные ватным тампоном распространить бактерии на пластину, которая не требует этанола или пламени. - Повернуть MS агар пластины с одной стороны, при использовании обратно и поступательное движение для инокуляции пластины с стерильных распределителя.
- Инкубируйте на 5-7 дней при 30 ° C до тех пор, пока штамм является хорошо sporulated.
Примечание: Время инкубации будет варьироваться в зависимости от видов и процедите.
- Добавить 2 мл стерильного физиологического раствора (0,8% NaCl) к центру вырожденная газон Streptomyces клеток, которая претерпела заспорение.
- Урожай споры, аккуратно протирая поверхности мицелий с стерильных прививки цикла (или ватным тампоном), медленно движущейся к краям газона.
- Накапайте физиологическим содержащие споры в коническую пробирку 15 мл. Вихрь энергично сломать споро цепи в отдельные клетки.
- Центрифуга при комнатной температуре за 5 мин на приблизительно 2500 x g.
- Накапайте супернатант и отменить. Разогнать Пелле спор путем энергичных вихревого перемешивания в небольшое количество оставшихся жидкости.
- Ресуспензируйте споры в 1 мл 20% глицерина, рисование решение вверх и вниз с помощью пипетки.
- Передачи акций споро глицерин 1,5 мл морозильник. Хранить при температуре-80 ° C.
Предупреждение: Использование криогенных защитные перчатки и лаборатории пальто для защиты кожи от контакта с холода. Кроме того морозильник-20 ° C может использоваться с потенциальными снижение жизнеспособности в долгосрочной перспективе время хранения. Избегайте чрезмерного замерзания и оттаивания продлить жизнеспособность.
5. выполнить мутагенеза
- Выполните мутагенеза основанные на желаемых результатов, как указано в введении и недавно рассмотрен Бальтца, 201639.
Примечание: Некоторые эксперименты фенотипа не будет требовать мутагенеза, такие, как намерение для выявления новых видов от окружающей среды. Методы случайных мутагенеза включают использование transposon8,9,10,11,12,13, УФ радиации или химических веществ14. Сайт Направленный мутагенез15,-16,17,-18,19,-20 методы могут использоваться для создания конкретных точечные мутации, удаления, или другие типы мутаций.
6. Сравните и записывать внешний вид
- Принять к сведению колонии морфологии для каждого мутант по сравнению с одичал тип родительского штамм после полос всех штаммов, как в шаге 2. Сравнение нового изолировать, хорошо изученных видов, таких как S. coelicolor или S. venezuelae, характеристике новых видов Streptomyces . Обратите внимание (Рисунок 1) такие характеристики, как основные формы, поверхности колонии (нечеткой, лысый, морщинистые, и т.д.), непрозрачность, высота и пигментации (различие между вегетативного мицелия, воздушного мицелия и/или окружающей средой).
- Ярлык MS агар пластины и полоса дикого типа и мутантов штаммов в шаблоны клина (рис. 1). Будьте осторожны, что не штамм прикасается другой напрягаться, чтобы избежать перекрестного загрязнения. Обратите внимание на дату и время, что штаммы прожилками на пластину. Инкубировать пластины при 30 ° C.
- Место, выращенных Петри на цветные или белой книге для гомогенизации фон. Напишите на бумаге штамм имя, Дата, температуры инкубации и время от первого пластины мелирование. Возьмите цифровые изображения пластины с последней информацией, написанные на справочный документ, таким образом, чтобы свести к минимуму путаница.
Примечание: Написание может обрезаться из фотографии на более позднее время если она будет использоваться для подготовки рисунок.
7. выполнить фазово контрастной микроскопии
- Стерилизуйте пинцета стирки в 70% этанола и затем проходящей через пламя горелки Бунзена испаряться этанола. Дайте ему остыть.
- Стерилизуйте coverslips стирки в 70% этанола и затем позволяя им высохнуть в стерильных Петри.
-
Подготовьте coverslip Лифт бактериального роста необходимо изучить.
- Подобрать стерильные coverslip стерильным пинцетом и место coverslip на плите агар MS, где рост бактерий плотной. Нажмите на задней coverslip аккуратно пинцетом для обеспечения достаточной передачи бактериальных спор и воздушного мицелия.
- Подобрать coverslip от плиты и поместите его так, чтобы сторона с клеточным материалом обращена к поверхности микроскопа, с 15 мкл капли 50% глицерина, подготовленный в воде для монтажа. Уменьшить пузырьки воздуха, поместив coverslip под углом 45° к слайду и дайте ему упасть на 50% глицерина.
- (Необязательно) Печать с четкими ногтей Лак для сохранения слайд.
-
Выполните фазово контрастной микроскопии, как описано в Frohlich40 на различных временных интервалах в течение жизненного цикла.
Примечание: Повторяющиеся изображения позволяет для более полного анализа и способность обнаруживать задержки в развитии. Самостоятельно повторите наблюдения для обеспечения точности и воспроизводимости.- Поместите подготовленные слайд на микроскопа и добавить каплю масла погружения в центре крышки выскальзования. Вращайте этапа 100 X цель в место и установить конденсатор башни для надлежащего «соответствия» фаз. Резкость изображения, используя только штраф регулировочной после объектив контакт с маслом.
- Изучите несколько полей зрения различать различия заметны и последовательной мутантных штаммов и дикого типа, такие как возможность формы споры, споры размер и форму и общее количество спор (см. Рисунок 2).
Примечание: Альтернативы фазово контрастной микроскопии включают дифференциальной помехи контраст (DIC) микроскопия40 и простые методы окраски для использования с яркой области Микроскопы41, как кристалл фиолетового окрашивания.
8. выполнить микроскопии флуоресцирования
- Стерилизуйте пинцета, промывание в 70% этанола и затем проходит через пламя горелки Бунзена.
- Подобрать стерильные coverslip с стерильным пинцетом и место на плите агар MS, где рост бактерий является очевидным. Сенсорных задней coverslip аккуратно пинцетом для обеспечения достаточной передачи бактериальных спор и воздушные нитей.
- Подобрать coverslip от плиты и поместите его так, чтобы сторона с клеточным материалом вверх, на картон для упрощения манипуляций coverslip.
- Наводнение coverslip с ледяной метанола (~ 300 мкл для coverslip2 20 x 20 мм) и дайте ему полностью сухой воздух.
Предупреждение: Метанол является мутагенным. Избегайте прямого контакта с кожей. - Мыть coverslip три раза в фосфат буфер солевой (PBS)42 нежно дозирования и удаления решения.
- 15 мкл 100 мкг/мл пропидий йодидом и/или 10 мкг/мл пшеницы-Росток-агглютининов конъюгированных флуоресцеин Изотиоцианаты (WGA-FITC) внесенные помечены микроскопа в 50% глицерина.
Примечание: Пропидий йодидом пятна красные для выявления хромосомных ДНК расположение хотя WGA-FITC пятна клеточной стенки Зеленый ДНК. - Инвертируйте coverslip лицом вниз на падение флуоресцентные пятна на стеклянное скольжение. (Необязательно) печать с четкой Лак для сохранения слайд. Как краски чувствительны к свету, Инкубируйте 15 минут в потемнели или тускло освещенной комнате.
- Наблюдать за слайды под 100 X объектив с помощью фазово контрастной или DIC микроскоп оснащен эпифлуоресцентного возбуждения кубов для пропидий йодидом (набор фильтров «Техас красный» или возбуждения/выбросов Максима 535/617 Нм) и FITC (FITC фильтровать набор или 490/525 Нм возбуждение/выбросов Максима).
- Место слайда на сцене и с помощью ручки грубой и тонкой регулировки фокуса.
- Наблюдать за флуоресценции, как показано в других странах43.
- Используйте пакет программного обеспечения анализа бесплатные изображения, которые могут помочь в идентификации споры с нижней интенсивности флуоресценции44.
Результаты
Первоначальный фенотипирование эксперименты необходимы для характеризующие новые виды и штаммы и может использоваться в качестве бесплатного подход к филогенетика и экспериментов гибридизации ДНК-ДНК, которые используются для описания новых видов. Стрептомицеты мутантов, вытекающие из случайных мутагенеза методов, таких как химическая, УФ, или transposon мутагенеза обычно определяются по прямой, визуальный экранов на плитах агара. Колонии Streptomyces рассматриваются изменения в фенотипе по сравнению с одичал тип, родительский сорт. Например Зажигалки цветные воздушного мицелия может указывать на более низкий уровень серого пигмента, вызванные дефектом заспорение или отсутствие нечетких появление свидетельствует о блока в формировании воздушного мицелия (рис. 1). Многие стрептомицетов производят пигментированной антибиотиков в вегетативного мицелия или окружающие агар. S. coelicolor производит два пигментированной антибиотиков, а также два из них-пигментированные. Actinorhodin сине пигментированные антибиотиками и undecylprodigiosin красно пигментированные антибиотик45. Штаммы, которые подверглись экраны первоначального визуального колонии затем передаются мелирование для одного колоний.
После визуальной идентификации потенциально интересных мутантов штаммы подвергаются микроскопического исследования. Фазово контрастной микроскопии особенно подходит для изучения Streptomyces мутантов для дефектов развития, используя одичал тип деформации как элемент управления (рис. 2). Дикого типа S. coelicolor колонии, как правило, производят воздушного мицелия примерно двух дней роста на 30 ° C на MS агар, и длинные цепи споры на три дня роста. Жизненный цикл будет развиваться немного медленнее или быстрее, на другие виды средств массовой информации. Важно, что мутанты анализироваться на тех же условиях роста как дикого типа при подготовке выводов о пороков и задержки. Лысые мутанты могут производить споры после продолжительного роста на агаре СМИ. Класс мутантов, именуемый как белый мутантов либо может быть отложено для формирования споро, показывают снижение обилие споры производства, производят споры с дефекты формы и/или размер, или просто производить более низкого уровня зрелой, серый споро пигмент46 . Другие мутанты, расследование до настоящего времени может быть отложено или ускорился в прогрессии жизненного цикла таких мутантов, пострадавших за накопление сигнальных молекул (например, циклические ди GMP47).
Микроскопии флуоресцирования, используя пропидий йодидом пятно хромосомной ДНК нуклеоидах и дневно обозначенные зародышей пшеницы агглютининов пятно клеточной стенки заспорение септы простое продолжение световой микроскопии метод, описанный выше. Споры, не хватает хромосомы будет лишена красный пропидий йодидом, окрашивание, хотя споры, которые содержат меньше ДНК, чем обычно может определить, если они, как представляется, уменьшились окрашивание (рис. 3). Зародыши пшеницы агглютининов могут быть использованы для пятно клеточной стенки и могут наблюдаться различия в клеточной стенки, окрашивания моделей (например, деление клеток дефектов). В рисунке 4 одичал типа штамма S. venezuelae, виды, которые недавно используется как другой модели стрептомицетовой из-за его быстрее жизненный цикл и возможность sporulate в жидком45, был окрашенных с WGA-FITC для выяснения лестница как массив разделение перегородками, которые обычно рассматриваются в ранний период заспорение.
Первоначальный фенотипирование стратегий, описанных здесь должно привести в следующем: 1) идентификация мутантных штаммов интерес для дальнейшего изучения; 2) приобретенные знания о недавно выявленных мутант и потенциальной роли ген, который мутировал; 3) формулировка последующей серии следующий экспериментальный шагов, которые могут использоваться для дальнейшего уточнения роли в вопросе гена. В случае вновь выявленных стрептомицетовой из окружающей среды исследователь будет получить знания о потенциальных новых видов, по сравнению с уже охарактеризованы виды Streptomyces.

Рисунок 1: Фотография представитель агар пластины, демонстрируя макроскопических колонии фенотипы S. coelicolor. Плита агара показывает нечеткий, серый внешний вид воздушного мицелия для дикого типа S. coelicolor штамма MT1110 (WT) по сравнению с различных случайных transposon вставки мутантов с развития фенотипов. Мутанты отсутствуют либо воздушного мицелия [лысый (bld)] или воздушного мицелия с сокращением споро пигментации [белый (whi)]. Transposon мутанты были получены с помощью мини Tn5 для вставки мутагенеза6,7. Штаммы были выращены на MS агар для 5 дней при температуре 30 ° C. Петри блюдо диаметр, 100 мм.
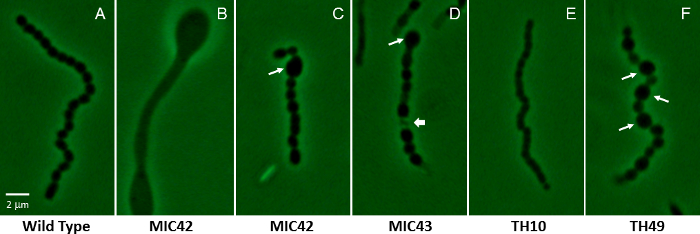
Рисунок 2: Фазово контрастной микроскопии показаны представитель воздушных накаливания для S. coelicolor белый мутантных штаммов содержащих случайные transposon вставки мутации. Показано на рисунке (A) является представителем дикого типа воздушных накаливания, которая претерпела синхронной, регулярно расположенных клеточных делений, производить равномерно форме и размеру споры (MT1110). (FB–) Остальные панели показывают значительно отличаются микроскопических фенотипов различных белый мутантов, которые были изолированы через случайные transposon мутагенеза. Группа B показывает воздушные накаливания, не претерпела заспорение, но вместо выпустила выпуклые областей внутри нити накала. Длинные стрелки в C, Dи F показывают аномально большие споры, которые характерны для мутантов, MIC42, MIC43 и TH49. Короткие стрелку на панели D указывает пример лизированных споро отсека. Группа E показывает частично свёрнутые небольших отсеках, которые являются типичными для цепей споро, производимые мутант TH10. Штаммы были выращены на MS агар для 5 дней при температуре 30 ° C. Мутанты не связаны с тем, как показано на рисунке 1. Споро дикого типа находится приблизительно в 1,1 мкм на длинной оси. Шкалы бар = 2 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
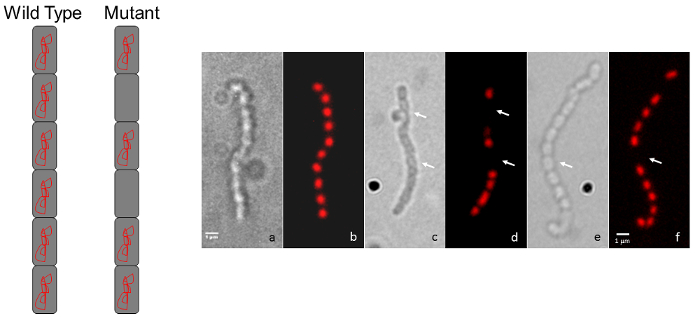
Рисунок 3: Представитель микроскопии показаны мутант хромосома S. coelicolor сегрегация фенотипов. (A) A диаграмме представление показывает типичный одичал тип, регулярно расположенных окрашивание вид для цепи споры (каждый спор содержит хромосомной ДНК) по сравнению с прерывистой окрашивание шаблон для мутант, который отображает хромосомы дефект сегрегации. (B) каждая пара панелей показывает же споро цепи наблюдается контраст дифференциальной помехи (DIC) изображения слева и пропидий йодид окрашенных флуоресценции изображение показано справа. Фенотип одичал типа (а, б) сравнивается с двумя мутантов вставки случайных transposon (c, d и e, f). Стрелки показывают споры лишенный ДНК. Штаммы были выращены на MS агар для 5 дней при температуре 30 ° C. Мутанты показано связаны с тем, на рисунке 1 и на рисунке 2. Шкалы бар = 1 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Микрофотография флуоресценции штамма S. venezuelae одичал типа окрашенных с WGA-FITC. (A) A схема воздушных накаливания появляется гладкая с без отступов и есть никаких видимых признаков с помощью фазово контрастной микроскопии по сравнению с лестницы как массив пятнать клеточных стенок, указывает на ранней стадии заспорение заспорение в этой же нити, используя WGA-FITC под микроскопии флуоресцирования начато. (B) микроскопии одичал типа S. venezuelae. () гладкой воздушные нити присутствуют среди цепи споры. (b) в пределах мицелий, отображаемые в панели, одна воздушная накаливания на ранней стадии в развитии обладает лестница как массив осаждения клеточной стенки. Стрелки показывают, регулярно интервала формирования кросс стены запятнана WGA-FITC, что развиваться синхронно в пределах только одной нити накала воздушные, как она подвергается развивающих связанные заспорение. Штамм был выращен на MYM MYM (Maltose, YВосток, экстракт alt M) агар для 38 h при 30 ° C. Шкалы бар = 2 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Здесь мы представляем протоколы для начинающих исследователей Streptomyces инициировать исследования, включая шаги, необходимые для распространения штаммов и подготовка запасов для длительного хранения. Мы затем описывают протоколы для визуального и микроскопические характеристики штаммов стрептомицетов . Некоторые типичные первые шаги развития мутантов фенотипирование являются: 1) визуальный осмотр мутант колоний, по сравнению с дикого типа колоний на агаре носителе; 2) фазово контрастной микроскопии; и 3) флуоресцентной микроскопии sporogenic воздушные гифы. Основываясь на фенотип, отображаемые в этих трех шагов, различные методы могут быть использованы для дальнейшего различить фенотип конкретного штамма.
Первоначальный фенотипирование эксперименты обычно используется для характеристики новых видов, идентифицировать мутантов интерес, частично характеризуют мутантов и начинают различать типичная роль определенного гена, основанный на фенотип выявленных мутант. Описанные здесь методы уже были использованы в университете учебных лабораторий для выявления и описания широкий спектр Streptomyces мутантов, в том числе с дефектами в деление клетки48,49, 50 , 51 , 52 , 53 , 54, заспорение55,56, воздушный мицелий формирования57,58, антибиотиков производства59, второй посланник сигнализации47и хромосомы сегрегации 60. Эти методы являются жизненно важные первые шаги для определения фенотипа мутантов в целом и выявить большое количество важной информации о ролях генов интерес. Методы могут легко распространяться на другие виды Streptomyces и уже были использованы для описания штаммов S. griseus, S. venezuelae, S. чесоткаи многие другие стрептомицетов. Ожидается, что видео протоколы, описанные здесь, служить в качестве важного ресурса для новых исследователей ввода поля Streptomyces исследований, такие как в области лекарственных препаратов. Это включает в себя новые инструкторы, которые работают для борьбы с антибиотикорезистентности кризиса и просвещение бесчисленное количество новых исследователей студент, объединив усилия краудсорсинг небольшой инициативы Всемирного.
Описанные здесь методы могут быть легко адаптированы для использования в классе колледжей и средних школ помимо научно-исследовательские лаборатории, используя изменения, описанные в видео и текст. Студенты в модуле микроскопии первый год в колледже небольшой либеральных искусств были в состоянии испещрять штаммов, принимать цифровой фотографии штаммов, выращенных на агаре СМИ и выполнять фазово контрастной и флуоресцентной микроскопии, который завершился в представлении Портфолио несколькими панелями цифры в конце модуля 3 недели, представляющих 15 h работы в лаборатории. Приблизительно 160 студентов первого курса были ответственны за первоначальный фенотипирование 320 Роман transposon мутантов. Бакалавриату исследований студентов на три учреждения приняли участие в первоначальных фенотипирование дополнительных мутантов и последующего квалификация многих штаммов. Всеобъемлющие данные, полученные в течение относительно короткого времени, иллюстрируют значение протоколов, описанные здесь. Сотни дополнительных мутантов, было сохранено как глицерин мицелиальных запасов для будущих характеристик.
После первоначального эксперименты, описанные здесь различные методы могут быть использованы для расширения качество информации, касающимся штаммов интерес. Если неизвестен мутации, метод генотипирования должны использоваться для определения типа или расположения мутации. Например случайные transposon мутагенеза одичал тип хромосома6,,78,9,10,11,12,13 результаты в колониях, которые должны пройти первоначальный фенотипические экранов, например описанных выше. Расположение transposon должны быть идентифицированы с помощью метода обратная полимеразная цепная реакция (iPCR)61. Определение генотипа недавно обнаруженных мутантов представляет собой важный шаг, после первоначальных характеристик.
Некоторые часто используемые передовые методы для анализа последующих фенотипа, которые могут быть упомянуты в классе или изучены посредством дальнейших исследований включают Зеленый флуоресцентный белок (ГПУП) меток для определения локализации шаблонов для протеина интереса, анализ выражения гена как реального времени количественного PCR (ПЦР) и картин выражения гена глобальные дикого типа против мутантов через последовательность РНК (РНК seq). Фенотипирование навыки необходимы также для анализа генетических комплементарности. В эксперименте комплементарности одичал тип копии гена вводится в мутировавших напрягаться, чтобы определить ли добавленный аллелей может компенсировать потери функции мутировавших аллеля. Сравнивая фенотип штамма дополняет оригинальный мутант и родительский, штамм одичал типа не требуется.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы признать Otterbein университета для студентов студенческие исследовательские стипендии и студенческих исследований фонда премии ЖВК и SGK; и профессор Гилберт E. мельницы Мемориал Otterbein наделены годичные программы награды и кафедра биологии и наук о земле факультет исследований и стипендий наделены награду в ОАС. Берт и Джейн рога наделены Студенческий научный фонд в науках была присуждена ЖВК и SGK. Авторы хотели бы также с благодарностью признать, что Университета Duquesne финансируемых Undergraduate исследований программы стипендий для ЖВК и SGK. Бывший Джуниата бакалавриату исследований студентов, Райан Джонсон и Линдси Дрейпер внесли микроскопии изображений на рисунках 2 и 3, соответственно.
Материалы
| Name | Company | Catalog Number | Comments |
| 50% Glycerol | Sigma-Aldrich | G5516 | |
| Immersion Oil (Type DF) | Cragille | 16482 | |
| Lens Paper | Fisherbrand | 11-995 | |
| Sterile Water | GeneMate | G-3250-1L | |
| 100% Ethanol | Sigma-Aldrich | E7023 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Toothpicks (flat) | Target | 081-22-1957 | |
| Pipette Tips (10 mL) | GeneMate | P-1240-10 | |
| Pipette Tips (200 mL) | GeneMate | P-1240-200Y | |
| Pipette Tips (1,250 mL) | GeneMate | P-1240-1250 | |
| Wooden Applicators 6'' | Solon Care | 070809 | |
| Cotton Swabs | Fisherbrand | 23-400-124 | |
| Soy Flour | Bob's Red Mill | 1516C164 | |
| D-Mannitol | Sigma-Aldrich | M4125-1KG | |
| Agar | Sigma-Aldrich | A1296-1KG | |
| Glycerol 100% | VWR amresco life science | 0854-1L | |
| 0.8% NaCl (Saline) | Sigma-Aldrich | SLBB9000V | |
| 1.2 mL freezer tube | NEST | 606101 | |
| Ultra low (-80 °C) freezer | SO-LOW | U85-18 | |
| Cryo Safety Gloves | Bel-Art | H13201 | |
| Petri dishes | Sigma-Aldrich | P5856-500EA | |
| Cover slips #1.5 | Thomas Scientific | 64-0721 | |
| Slides | Carolina | 63-2010 | |
| Autoclave | Tuttnauer | 2540E | |
| Phase-Contrast Microscope | Olympus | BX40 | |
| Forceps | Carolina Biological | 624504 | |
| Bunsen Burner | Carolina Biological | 706706 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| PBS (phosphate buffer saline) | Sigma-Aldrich | P4417-50TAB | |
| WGA-FITC | Biotium | 29022-1 | |
| Clear nail polish | OPI | 22001009000 | |
| ImageJ | NIH | Free Software | |
| 100 mL beaker | Pyrex USA | 1000-T | |
| 1 L beaker | Carolina Biological | 721253 | |
| 1 L flask | Fisherbrand | S63274 | |
| 250 mL flask | Pyrex USA | 4980 | |
| 100 mL graduated cylinder | Carolina Biological | 721788 | |
| 500 mL graduated cylinder | Carolina Biological | 721792 | |
| Stir Bar | Fisher Scientific | 22-271825 | |
| Centrifuge | Eppendorf | 5810R | |
| Camera for Microscope | Olympus | DP72 | |
| Nitrile Examination Gloves (Med) | Bio Excell | 71011002 | |
| Vortex Mixer | Carolina Biological | 701077 |
Ссылки
- Barka, E. A., et al. Taxonomy, physiology, and natural products of Actinobacteria. Microbiol. Mol. Biol. Rev. 80 (1), 1-43 (2015).
- Bentley, S. D., et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2). Nature. 417 (2), 141-147 (2002).
- Redenbach, M., et al. A set of ordered cosmids and a detailed genetic and physical map for the 8 Mb Streptomyces coelicolor A3(2) chromosome. Mol. Microbiol. 21 (1), 77-96 (1996).
- McCormick, J. R., Flardh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36 (1), 206-231 (2012).
- Flardh, K., Buttner, M. J. Streptomyces morphogenetics: dissecting differentiation in a filamentous bacterium. Nat. Rev. Microbiol. 7 (1), 36-49 (2009).
- Bennett, J. A. . Molecular Genetic analysis of division and development in Streptomyces coelicolor. , (2007).
- Hull, T. D., et al. Cyclic Di-GMP phosphodiesterases RmdA and RmdB are involved in regulating colony morphology and development in Streptomyces coelicolor. J. Bacteriol. 194 (17), 4642-4651 (2012).
- Petzke, L., Luzhetskyy, A. In vivo Tn5-based transposon mutagenesis of streptomycetes. Appl. Microbiol. Biotechnol. 83 (5), 979-986 (2009).
- Xu, Z., et al. Large-Scale Transposition Mutagenesis of Streptomyces coelicolor Identifies Hundreds of Genes Influencing Antibiotic Biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Fernandez-Martinez, L. T., et al. A transposon insertion single-gene knockout library and new ordered cosmid library for the model organism Streptomyces coelicolor A3(2). Antonie Van Leeuwenhoek. 99 (3), 515-522 (2011).
- Gehring, A. M., Nodwell, J. R., Beverley, S. M., Losick, R. Genomewide insertional mutagenesis in Streptomyces coelicolor reveals additional genes involved in morphological differentiation. Proc. Natl. Acad. Sci. U.S.A. 97 (17), 9642-9647 (2000).
- Bishop, A., Fielding, S., Dyson, P., Herron, P. Systematic insertional mutagenesis of a streptomycete genome: a link between osmoadaptation and antibiotic production. Genome Res. 14 (5), 893-900 (2004).
- Bilyk, B., Weber, S., Myronovskyi, M., Bilyk, O., Petzke, L., Luzhetskyy, A. In vivo random mutagenesis of streptomycetes using mariner-based transposon Himar1. Appl. Microbiol. Biotechnol. 97 (1), 351-359 (2013).
- Kieser, T., Bibb, M. J., Buttner, M. J., Chater, K. F., Hopwood, D. A. . Practical Streptomyces Genetics. , (2000).
- Gust, B., Kieser, T., Chater, K. F. . REDIRECT technology: PCR-targeting system in Streptomyces coelicolor. , (2002).
- Gust, B., Chandra, G., Jakimowicz, D., Yuqing, T., Bruton, C. J., Chater, K. F. Lambda red-mediated genetic manipulation of antibiotic-producing Streptomyces. Adv. Appl. Microbiol. 54, 107-128 (2004).
- Tong, Y., Charusanti, P., Zhang, L., Weber, T., Lee, S. Y. CRISPR-Cas9 based engineering of Actinomycetal genomes. ACS Synth. Biol. 4 (9), 1020-1029 (2015).
- Huang, H., Zheng, G., Jiang, W., Hu, H., Lu, Y. One-step high-efficiency CRISPR/Cas9-mediated genome editing in Streptomyces. Acta BiochimBiophys. Sin.(Shanghai). 47 (4), 231-243 (2015).
- Cobb, R. E., Wang, Y., Zhao, H. High-efficiency multiplex genome editing of Streptomyces species using an engineered CRISPR/Cas system. ACS Synth. Biol. 4 (6), 723-728 (2015).
- Carey, M. F., Peterson, C. L., Smale, S. T. PCR-mediated site-directed mutagenesis. Cold Spring Harb Protoc. 2013 (8), 738-742 (2013).
- Brown, E. D., Wright, G. D. Antibacterial drug discovery in the resistance era. Nature. 529 (7586), 336-343 (2016).
- Dodds, D. R. Antibiotic resistance: A current epilogue. Biochem. Pharmacol. 134, 139-146 (2017).
- Caruso, J. P., Israel, N., Rowland, K., Lovelace, M. J., Saunders, M. J. Citizen Science: The Small World Initiative improved lecture grades and California critical thinking skills test scores of nonscience major students at Florida Atlantic University. J. Microbiol. Biol. Educ. 17 (1), 156-162 (2016).
- Davis, E., et al. Antibiotic discovery throughout the Small World Initiative: A molecular strategy to identify biosynthetic gene clusters involved in antagonistic activity. Microbiology Open. 6 (3), (2017).
- van Keulen, G., Dyson, P. J. Production of specialized metabolites by Streptomyces coelicolor A3(2). Adv. Appl. Microbiol. 89, 217-266 (2014).
- Aigle, B., et al. Genome mining of Streptomyces ambofaciens. J. Ind. Microbiol. Biotechnol. 41 (2), 251-263 (2014).
- Antoraz, S., Santamaria, R. I., Diaz, M., Sanz, D., Rodriguez, H. Toward a new focus in antibiotic and drug discovery from the Streptomyces arsenal. Front. Microbiol. 6, 461 (2015).
- Onaka, H. Novel antibiotic screening methods to awaken silent or cryptic secondary metabolic pathways in actinomycetes. J. Antibiot.(Tokyo). 70 (8), 865-870 (2017).
- Chen, J., Wu, Q., Hawas, U. W., Wang, H. Genetic regulation and manipulation for natural product discovery. Appl. Microbiol. Biotechnol. 100 (7), 2953-2965 (2016).
- Katz, L., Baltz, R. H. Natural product discovery: past, present, and future. J. Ind. Microbiol. Biotechnol. 43 (2-3), 155-176 (2016).
- Liu, G., Chater, K. F., Chandra, G., Niu, G., Tan, H. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiol. Mol. Biol. Rev. 77 (1), 112-143 (2013).
- den Hengst, C. D., Tran, N. T., Bibb, M. J., Chandra, G., Leskiw, B. K., Buttner, M. J. Genes essential for morphological development and antibiotic production in Streptomyces coelicolor are targets of BldD during vegetative growth. Mol. Microbiol. 78 (2), 361-379 (2010).
- Tran, N. T., Den Hengst, C. D., Gomez-Escribano, J. P., Buttner, M. J. Identification and characterization of CdgB, a diguanylate cyclase involved in developmental processes in Streptomyces coelicolor. J. Bacteriol. 193 (12), 3100-3108 (2011).
- Anonymous. Lab Safety. Proper Use of Autoclaves. JoVE Science Education Database. , (2017).
- Border, B. G., Rice-Spearman, L. Microwaves in the laboratory: effective decontamination. Clin. Lab. Sci. 12 (3), 156-160 (1999).
- Bhattacharjee, M. K., Delsol, J. K. Does microwave sterilization of growth media involve any non-thermal effect?. J. Microbiol. Methods. 96, 70-72 (2014).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. J. Vis. Exp. (63), e3064 (2012).
- Anonymous, General Laboratory Techniques. An Introduction to the Micropipettor. JoVE Science Education Database. , (2017).
- Baltz, R. H. Genetic manipulation of secondary metabolite biosynthesis for improved production in Streptomyces and other actinomycetes. J. Ind. Microbiol. Biotechnol. 43 (2-3), 343-370 (2016).
- Frohlich, V. C. Phase Contrast and Differential Interference Contrast (DIC) Microscopy. J. Vis. Exp. (18), e844 (2008).
- Anonymous, General Laboratory Techniques. Introduction to Light Microscopy. JoVE Science Education Database. , (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular Cloning: A Laboratory. 3, (1989).
- Anonymous, General Laboratory Techniques. Introduction to Fluorescence Microscopy. JoVE Science Education Database. , (2017).
- Jensen, E. C. Quantitative analysis of histological staining and fluorescence using ImageJ. Anat. Rec.(Hoboken). 296 (3), 378-381 (2013).
- Chater, K. F. Recent advances in understanding Streptomyces. F1000Res. 5, (2016).
- Chater, K. F. Regulation of sporulation in Streptomyces coelicolor A3(2): a checkpoint multiplex?. Curr. Opin. Microbiol. 4 (6), 667-673 (2016).
- Tschowri, N. Cyclic dinucleotide-controlled regulatory pathways in Streptomyces species. J. Bacteriol. 198 (1), 47-54 (2016).
- Bennett, J. A., et al. Medium-dependent phenotypes of Streptomyces coelicolor with mutations in ftsI or ftsW. J. Bacteriol. 191 (2), 661-664 (2009).
- Mistry, B. V., Del Sol, R., Wright, C., Findlay, K., Dyson, P. FtsW is a dispensable cell division protein required for Z-ring stabilization during sporulation septation in Streptomyces coelicolor. J. Bacteriol. 190 (16), 5555-5566 (2008).
- Bennett, J. A., Aimino, R. M., McCormick, J. R. Streptomyces coelicolor genes ftsL and divIC play a role in cell division but are dispensable for colony formation. J. Bacteriol. 189 (24), 8982-8992 (2007).
- Bennett, J. A., McCormick, J. R. Two new loci affecting cell division identified as suppressors of an ftsQ-null mutation in Streptomyces coelicolor A3(2). FEMS Microbiol. Lett. 202 (2), 251-256 (2001).
- Dharmatilake, A. J., Kendrick, K. E. Expression of the division-controlling gene ftsZ during growth and sporulation of the filamentous bacterium Streptomyces griseus. Gene. 147 (1), 21-28 (1994).
- McCormick, J. R., Losick, R. Cell division gene ftsQ is required for efficient sporulation but not growth and viability in Streptomyces coelicolor A3(2). J. Bacteriol. 178 (17), 5295-5301 (1996).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor mutant for the cell division gene ftsZ. Mol. Microbiol. 14 (2), 243-254 (1994).
- Flärdh, K., Findlay, K. C., Chater, K. F. Association of early sporulation genes with suggested developmental decision points in Streptomyces coelicolor A3(2). Microbiology. 145 (9), 2229-2243 (1999).
- van Wezel, G. P., van der Meulen, J., Kawamoto, S., Luiten, R. G., Koerten, H. K., Kraal, B. ssgA is essential for sporulation of Streptomyces coelicolor A3(2) and affects hyphal development by stimulating septum formation. J. Bacteriol. 182 (20), 5653-5662 (2000).
- Capstick, D. S., Willey, J. M., Buttner, M. J., Elliot, M. A. SapB and the chaplins: connections between morphogenetic proteins in Streptomyces coelicolor. Mol. Microbiol. 64 (3), 602-613 (2007).
- Ma, H., Kendall, K. Cloning and analysis of a gene cluster from Streptomyces coelicolor that causes accelerated aerial mycelium formation in Streptomyces lividans. J. Bacteriol. 176 (12), 3800-3811 (1994).
- Xu, Z., et al. Large-scale transposition mutagenesis of Streptomyces coelicolor identifies hundreds of genes influencing antibiotic biosynthesis. Appl. Environ. Microbiol. 83 (6), (2017).
- Dedrick, R. M., Wildschutte, H., McCormick, J. R. Genetic interactions of smc, ftsK, and parB genes in Streptomyces coelicolor and their developmental genome segregation phenotypes. J. Bacteriol. 191 (1), 320-332 (2009).
- Pavlopoulos, A. Identification of DNA sequences that flank a known region by inverse PCR. Methods Mol. Biol. 772, 267-275 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены