Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterizaciones de rendimiento del Metal de la transición solo átomo catalizador electroquímico CO2 reducción y síntesis
En este artículo
Resumen
Aquí, presentamos un protocolo para la síntesis y pruebas electroquímicas de átomos individuales de metal de la transición coordinan en grafeno vacantes como centros activos para la reducción selectiva de dióxido de carbono al monóxido de carbono en soluciones acuosas.
Resumen
Este protocolo presenta el método de síntesis del catalizador solo átomo Ni tanto como la prueba electroquímica de su actividad catalítica y selectividad en acuosa reducción de CO2 . A diferencia de los nanocristales de metal tradicional, la síntesis de átomos metálicos solo consiste en un material de matriz que puede confinar los átomos individuales y evitar la agregación. Divulgamos un electrospinning y térmica método para preparar Ni solo átomos dispersión y coordinan en una cáscara de grafeno, como centros activos para la reducción de CO2 a CO del recocido. Durante la síntesis, dopantes N juegan un papel fundamental en la generación de vacantes de grafeno para atrapar átomos de Ni. Aberración-corregido transmisión microscopía electrónica y tomografía de sonda atómica tridimensional se emplearon para identificar los sitios atómicos Ni solo vacantes de grafeno. Configuración detallada de electroquímica CO2 reducción aparato juntada con una cromatografía de gases en línea también está demostrado. Comparado con Ni metálico, Ni solo átomo catalizador exhiben dramáticamente mejorada reducción de CO2 y suprime la reacción de parte de evolución de2 H.
Introducción
Conversión de CO2 en productos químicos o combustibles usando energía limpia es cada vez más importancia como una ruta potencial para prevenir más CO2 emisiones1,2,3,4, 5,6. Sin embargo, esta aplicación práctica es actualmente cuestionada por la baja actividad y selectividad de CO2 reacción de reducción (CO2RR) debido a las altas barreras cinéticas y la competencia con la reacción de evolución de hidrógeno (HER) en medio acuoso medios de comunicación. La mayor parte del catalizador tradicional de metales de transición, tales como Fe, Co y Ni, exhibe baja CO2RR selectividad debido a su magnífica HER actividades7,8. Tuning con eficacia sus propiedades de los materiales para cambiar las vías de reacción de estos catalizadores de metales de transición se convierte en crítica para mejorar su selectividad de CO2RR. Entre diferentes métodos para modificar las propiedades electrónicas de catalizadores, dispersión de átomos del metal en una morfología del solo-átomo atrae atención intensiva recientemente debido a su comportamiento catalítico dramáticamente cambiante en comparación con sus contrapartes a granel 9 , 10 , 11. sin embargo, debido a la alta movilidad de los átomos sin límites, es muy difícil obtener átomos metálicos solo sin la presencia de materiales de apoyo. Por lo tanto, es necesario un material de matriz de host con defectos creados para limitar y coordinar con los átomos del metal de la transición. Esto podría abrir nuevas oportunidades para: 1) sintonizar las propiedades electrónicas de los metales de transición como sitios activos de CO2RR y 2) al mismo tiempo mantener coordinación atómica relativamente simple para los estudios de mecanismo fundamental. Además, los átomos de metales de transición atrapados en un ambiente confinado no pueden fácilmente moverse durante la catálisis, lo que impide la nucleación o reconstrucciones de átomos superficiales observadas en muchos casos12,13 ,14.
Grafeno capas bidimensional es de particular interés como anfitrión para átomos individuales metálicos debido a su conductividad electrónica alta, estabilidad química e inercia a la reducción de CO2 y sus reacciones catalíticas. Lo más importante, Fe, Co y Ni los metales eran conocidos por ser capaces de catalizar el proceso de grafitización del carbono en su superficie15. En Resumen, los metales de transición aleación con carbono durante la térmica de alta temperatura proceso de recocido. Cuando la temperatura desciende, el carbón comienza a precipitar fuera de la fase de aleación y es catalizado a capas de grafeno de forma en la superficie del metal de la transición. Durante este proceso, con grafeno defectos generados, metal átomos individuales ser atrapados en los defectos de grafeno como los sitios activos para CO2RR16,17,18,19. Aquí, Divulgamos este protocolo detallado con la intención de ayudar a nuevos profesionales en el campo de la catálisis del solo átomo, así como para proporcionar una demostración explícita de CO en línea análisis de producto de la reducción de2 . Puede encontrar más información en nuestro artículo recientemente publicado19 y una serie de trabajos relacionados con20,21,22,23.
Protocolo
1. preparación de catalizadores de átomo de Ni Single (NiN-GS)
- Preparación de la solución precursora de electrospinning
- Tomar un vial de centelleo de 20 mL, disolver 0,5 g de poliacrilonitrilo (Mw= 150.000), 0,5 g de polypyrrolidone (Mw= 1.300.000), 0,5 g de Ni (NO3)2·6H2O y 0.1 g de Diciandiamida (DCDA) en 10 mL de dimetilformamida (DMF).
- La mezcla de DMF a 80 ° C y mantener la mezcla a 80 ° C con agitación constante hasta que se disuelvan todos los polímeros y sal y se observa una clara solución.
- Electrospinning para producir fibras de polímeros
- Definir los parámetros de electrospinning convencionales como: 15 kV de voltaje eléctrico estático, 15 cm de aire gap distancia, un sustrato de la colección de 8 × 8 cm de fibra de carbono papel (PPC) con - 4 kV de tensión eléctrica.
- Extraer 5 mL de la solución precursora en una jeringa de 5 mL, poner en marcha la bomba de jeringa a una velocidad de flujo de 1,2 mL h−1, entonces inicio el electrospinning.
Nota: Un alto voltaje se utiliza para el electrospinning. A pesar de muy baja corriente pasa a través del sistema durante el proceso de hilado, se sugiere un gabinete de madera aislado. - Sacar el sustrato de PPC una vez finalizado el proceso de centrifugado eléctrico. Una película de polímero fibra cubre la superficie de la PPC.
- Fibras de polímero recocido en nanotubos de carbono
- Calentar la fibra polímero preparado como película/PPC a 300 ° C en 1,5 h en un horno de caja y mantener la temperatura de 0,5 h para la oxidación de los polímeros.
Nota: Después del proceso de oxidación, las nanofibras (NFs) se auto separadas de papel en la película independiente. - Utilice un par de tijeras para cortar las nanofibras en trozos más pequeños (~ 0,5 cm × 2 cm) y colóquelos en un barco de cuarzo.
- Coloque el barco de cuarzo en un horno de tubo y desairear dentro formación de atmósfera de gas (5% H2 en Ar). Mantener la tasa de flujo de gas como 100 sccm y la presión como 1 Tor.
- Calentar 10 min rampa a 300 ° C y 2 h en rampa a 750 ° C, donde es mantenida por otra 1 h y seguido por el enfriamiento natural.
- Calentar la fibra polímero preparado como película/PPC a 300 ° C en 1,5 h en un horno de caja y mantener la temperatura de 0,5 h para la oxidación de los polímeros.
- Bola molino sintetizado como NiN-GS catalizador por 5 min a nanopolvos para la catálisis y caracterizaciones.
2. medidas de reducción de CO electroquímica2
- Célula y electrodos
- Para preparar 0.1 M KHCO3 del electrólito para las siguientes medidas, en primer lugar disolver 2,5 g de KHCO3 en 250 mL de agua ultrapura, luego purificar electrolito electrólisis entre dos barras de grafito en 0.1 mA para 24 h para quitar cualquier rastro cantidad de metal iones.
- Tomar un carbón vidrioso (electroquímico) pulido fresco (1 cm x 2 cm) y cubren su parte posterior con una cera electroquímicamente inerte, hidrofóbica, como el substrato del electrodo de trabajo.
- Tomar un vial de centelleo de 4 mL, 5 mg de catalizador de NiN-GS como preparado de la mezcla con 1 mL de etanol y 100 μl de solución de ionómero (5% en 2-propanol) dentro del frasco y someter a ultrasonidos durante 20 min obtener una suspensión de tinta catalizador homogéneo.
- Pipeta 80 μl de la tinta del catalizador sobre la superficie de carbón vidrioso de2 cm 2 (0,2 mg cm-2 masa de carga) y el vacío en seco el catalizador electrodo cubierto en un desecador antes de uso.
- Utilice una lámina de platino y un electrodo de calomel saturado (SCE) como el contador y el electrodo de referencia, respectivamente.
- Usar un modificado para requisitos particulares herméticos tipo H vidrio celular, separado por la membrana de intercambio de protones, para los anteriores 3 electrodos montaje así como las pruebas electroquímicas corriendo.
- Coloque el electrodo de trabajo y electrodo de referencia de SCE en un compartimiento de célula H y electrodo de Pt de la hoja en la otra cámara. Inyecte ~ 25 mL de electrólito en cada compartimiento de célula H.
- Conecte los 3 electrodos en celda de H a la estación de trabajo electroquímico para el control potencial.
- El electrolito con N2 en 50.0 sccm (controlado por controlador de flujo másico) de la burbuja por 30 min hacia N2-saturados 0,1 M KHCO3.
- Seleccionar técnica de voltametría cíclica (CV) en software EC-Lab, establecer "Serie E (potencial)" como "-10 V a 10 V", "van (actual)", como "Auto", realizar análisis de CV continuadas 5 de -0,5 V a-1.8 V (vs SCE) a una velocidad de escaneo de 50 mV/s en N2-saturados 0,1 M KHCO3.
- Cambiar a 50 sccm CO2 flujo de gas, espere 30 min hacia CO2-saturadas 0.1 M KHCO3 del electrólito y mantener el mismo flujo de CO2 a lo largo de la siguiente electrólisis.
- Seleccionar técnica CV en software EC-Lab, establecer "Serie E (potencial)" como "-10 V a 10 V", "van (actual)", como "Auto", realizar análisis de CV continuadas 5 de -0,5 V a-1.8 V (vs SCE) a una velocidad de escaneo de 50 mV/s en CO2-saturados 0,1 M KHCO3.
- Utilice un medidor de pH para determinar los valores de pH de electrólitos, es decir., 0.1 M KHCO3 saturada de N2 o CO2.
- Convertir todos los potenciales medidos contra el CPE a la escala de electrodo (RHE) de hidrógeno reversible en este trabajo utilizando E (vs RHE) = E (vs SCE) + 0.244 V + 0.0591 × pH.
- Determinar la resistencia (Ru) de la solución en software EC-laboratorio seleccionando técnica espectroscopia de impedancia electroquímica (PEIS) de Potentiostatic, a continuación, establecer frecuencias de 0,1 Hz a 200 kHz, el valor de la resistencia.
- Compensar manualmente iR-drop como E (iR corregido vs RHE) = E (vs RHE) - Ru x I (amperios de media actual).
- Análisis de productos de reducción CO2 por on-line cromatógrafo de gases (GC)
- Emplear un GC, equipado con una combinación de tamiz molecular 5A y micropacked columnas, análisis de productos de gas en CO2RR.
Nota: Los tipos de columna de GC detallados pueden encontrarse en la adjunta Tabla de materiales. - Utilice un detector de conductividad térmica (TCD) para cuantificar la concentración de H2 y un detector de ionización de llama (FID) con un metanizador análisis cuantitativo CO contenido o cualquier otra especie de alcano.
- Utilizar dos diversos gases estándar para las curvas de calibración de concentración de CO y H2 (H2: 100 y 1042 ppm; CO: 496.7 y 100 ppm; equilibrado con argón).
- Durante la electrolisis, mantener la tasa de flujo de gas CO2 a 50.0 sccm, entregan CO2 en el compartimiento catódico que contiene CO2-saturados 0,1 M KHCO3 electrolito y salida de los gases de escape en GC.
- Tono de manera gradual la tensión en el electrodo de trabajo, que van desde -0,3 a -1.0 V vs RHE, mantener ~ 15 minutos para cada potencial y el registro de la correspondiente curva de chronoamperimetric.
- Determine el H2 y CO contenido en los gases de escape de señales de TCD y FID, respectivamente.
Nota: Los productos de gas se muestrean después de una electrólisis continua de ~ 10 min debajo de cada potencial. El 50 sccm CO2 gas, mezclado con continuamente producen H2 y CO, fluido a través del bucle de muestreo (1 mL) de GC durante la electrólisis. - Calcular la densidad de corriente parcial de un producto dado gas como a continuación:
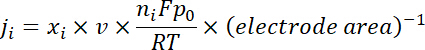
donde x es la fracción de volumen de ciertos productos determinados por cromatografía de gases en línea se hace referencia a las curvas de calibración de dos muestras de gas estándar (Scott y Airgas), v es la velocidad de flujo de 50 sccm, n es el número de de los electrones implicados, p0 = 101,3 kPa y F es la constante de Faradaic y R es la constante de gas. - Calcular la eficiencia Faradaic correspondiente (FE) en cada potencial como
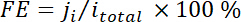 .
.
Nota: La eficacia general Faradaic podría ser dentro de un rango de 90 a 110% debido a los errores de flujo del gas, densidad de corriente y análisis de la concentración de gas en GC.
- Emplear un GC, equipado con una combinación de tamiz molecular 5A y micropacked columnas, análisis de productos de gas en CO2RR.
Resultados
Microscopía electrónica de barrido (SEM), análisis de microscopía electrónica de transmisión (madre) y espectroscopía de rayos x de energía dispersiva (EDX) imágenes de mapas se muestran en la figura 1 para la caracterización de la morfología de NiN-GS. Tridimensional átomo sonda tomografía (3D-APT) resultados se muestran en la figura 2 para la identificación directa de solo Ni distribución de sitios así como su v...
Discusión
En el proceso de centrifugado eléctrico anterior, cabe señalar dos pasos importantes en los procedimientos de síntesis de materiales: 1) la mezcla DMF (paso 1.1.2) y 2) el tipo bomba de ajuste (paso 1.2.2) para que coincida con la velocidad de giro de la calefacción. La imagen de SEM en la figura 1A muestra las nanofibras de carbono obtenidos interconectadas entre sí (~ 200 nm de diámetro). Fueron rotas en pequeños pedazos por la bola que muele para caracterizaciones como se muestra e...
Agradecimientos
Este trabajo fue apoyado por el programa de becarios de Rowland en el Rowland Institute de Harvard University. Este trabajo fue realizado en parte en el centro para sistemas a nanoescala (CNS), un miembro de la red nacional de infraestructura de la nanotecnología, que es apoyado por la National Science Foundation bajo la concesión no. ECS-0335765. El SNC es parte de la Universidad de Harvard.
Materiales
| Name | Company | Catalog Number | Comments |
| syringe pump | KD Scientific | KDS-100 | |
| tube furnance | Lindberg/Blue M | TF55035A-1 | |
| ball miller | SPEX SamplePrep | 5100 | |
| electrochemical work station | BioLogic | VMP3 | |
| pH meter | Orion | 320 PerpHecT | 2 points calibration before use |
| gas chromatograph | Shimadzu | GC-2014 | a combined seperation system consisting of molecular sieve 5A, Hayesep Q, Hayesep T, and Hayesep N |
| mass flow controller | Alicat Scientific | MC-50SCCM-D/5M | |
| ultrapure water system | Millipore | Synergy | |
| vacuum desiccator | PolyLab | 55205 | |
| polyacrylonitrile | Sigma-Aldrich | 181315 | Mw=150,000 |
| polypyrrolidone | Sigma-Aldrich | 437190 | Mw=1,300,000 |
| Ni(NO3)26H2O | Sigma-Aldrich | 244074 | |
| dicyandiamide | Sigma-Aldrich | D76609 | |
| dimethylformamide | Sigma-Aldrich | 227056 | |
| carbon fiber paper | AvCarb | MGL370 | |
| Nafion 117 membrane | Fuel Cell Store | 117 | used as proton exchange membrane in H-cell |
| KHCO3 | Sigma-Aldrich | 431583 | further purified by electrolysis |
| platinum foil | Beantown Chemical | 126580 | |
| saturated calomel electrode | CH Instruments | CHI150 | |
| glassy carbon electrode | HTW GmbH | SIGRADUR | 1 cm × 2 cm |
| wax | Apiezon | W-W100 | |
| Nafion 117 solution | Sigma-Aldrich | 70160 | used as ionomer in catalyst ink preparation |
| forming gas | Airgas | UHP | 5% H2 balanced with Ar |
| carbon dioxide | Airgas | LaserPlus | |
| sandard gas | Airgas | customized | 500 ppm CO, 500 ppm CH4, 1000 ppm H2 balanced with Ar |
| sandard gas | Air Liquide | customized | 100 ppm H2, 100 ppm CO and other alkanes balanced with Ar |
Referencias
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. P. Natl. Acad. Sci. USA. 103, 15729-15735 (2006).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chem. Rev. 113, 6621-6658 (2013).
- Jhong, H. R., Ma, S. C., Kenis, P. J. A. Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities. Curr. Opin. Chem. Eng. 2, 191-199 (2013).
- Ashford, D. L., et al. Molecular Chromophore-Catalyst Assemblies for Solar Fuel Applications. Chem. Rev. 115, 13006-13049 (2015).
- Nocera, D. G. Solar Fuels and Solar Chemicals Industry. Accounts. Chem. Res. 50, 616-619 (2017).
- Larrazabal, G. O., Martin, A. J., Perez-Ramirez, J. Building Blocks for High Performance in Electrocatalytic CO2 Reduction: Materials, Optimization Strategies, and Device Engineering. J. Phys. Chem. Lett. 8, 3933-3944 (2017).
- Hori, Y., Wakebe, H., Tsukamoto, T., Koga, O. Electrocatalytic Process of Co Selectivity in Electrochemical Reduction of Co2 at Metal-Electrodes in Aqueous-Media. Electrochim. Acta. 39, 1833-1839 (1994).
- Hori, Y. . Modern aspects of electrochemistry. , 89-189 (2008).
- Lin, S., et al. Covalent organic frameworks comprising cobalt porphyrins for catalytic CO2 reduction in water. Science. 349, 1208-1213 (2015).
- Zhang, X., et al. Highly selective and active CO2 reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures. Nat. Commun. 8, 14675 (2017).
- Zhao, C. M., et al. Ionic Exchange of Metal Organic Frameworks to Access Single Nickel Sites for Efficient Electroreduction of CO2. J. Am. Chem. Soc. 139, 8078-8081 (2017).
- Manthiram, K., Beberwyck, B. J., Aivisatos, A. P. Enhanced Electrochemical Methanation of Carbon Dioxide with a Dispersible Nanoscale Copper Catalyst. J. Am. Chem. Soc. 136, 13319-13325 (2014).
- Yang, M., et al. Catalytically active Au-O(OH)(x)-species stabilized by alkali ions on zeolites and mesoporous oxides. Science. 346, 1498-1501 (2014).
- Manthiram, K., Surendranath, Y., Alivisatos, A. P. Dendritic Assembly of Gold Nanoparticles during Fuel-Forming Electrocatalysis. J. Am. Chem. Soc. 136, 7237-7240 (2014).
- Amini, S., Garay, J., Liu, G., Balandin, A. A., Abbaschian, R. Growth of large-area graphene films from metal-carbon melts. J. Appl. Phys. 108, 094321 (2010).
- Krasheninnikov, A. V., Lehtinen, P. O., Foster, A. S., Pyykkö, P., Nieminen, R. M. Embedding Transition-Metal Atoms in Graphene: Structure, Bonding, and Magnetism. Phys. Rev. Lett. 102, 126807 (2009).
- Jiang, K., Siahrostami, S., Zheng, T., Hu, Y., Hwang, S., Stavitski, E., Peng, Y., Dynes, J., Gangishetty, M., Su, D., Attenkofer, K., Wang, H. Isolated Ni Single Atoms in Graphene Nanosheets for High-performance CO2 Reduction. Energy Environ. Sci. , (2018).
- Rodríguez-Manzo, J. A., Cretu, O., Banhart, F. Trapping of Metal Atoms in Vacancies of Carbon Nanotubes and Graphene. ACS Nano. 4, 3422-3428 (2010).
- Jiang, K., et al. Transition metal atoms in a graphene shell as active centers for highly efficient artificial photosynthesis. Chem. 3, 950-960 (2017).
- Jiang, K., Wang, H., Cai, W. B., Wang, H. T. Li Electrochemical Tuning of Metal Oxide for Highly Selective CO2 Reduction. ACS Nano. 11, 6451-6458 (2017).
- Jiang, K., et al. Silver Nanoparticles with Surface-Bonded Oxygen for Highly Selective CO2 Reduction. ACS Sustain Chem. Eng. 5, 8529-8534 (2017).
- Siahrostami, S., et al. Theoretical Investigations into Defected Graphene for Electrochemical Reduction of CO2. ACS Sustain Chem. Eng. 5, 11080-11085 (2017).
- Jiang, K., et al. Metal Ion Cycling of Cu Foil for Selective C-C Coupling in Electrochemical CO2 Reduction. Nat. Catal. , (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados