È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi e caratterizzazione di prestazioni di catalizzatore singolo atomo del metallo di transizione per elettrochimica CO2 riduzione
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per la sintesi e test elettrochimico di singoli atomi di metallo di transizione coordinati in posti vacanti grafene come centri attivi per la riduzione di anidride carbonica selettiva al monossido di carbonio nelle soluzioni acquose.
Abstract
Questo protocollo presenta sia il metodo di sintesi del catalizzatore singolo atomo Ni e il test elettrochimico delle sue attività catalitica e selettività in acquoso riduzione di CO2 . Diverso dal tradizionale metallo nanocristalli, la sintesi di singoli atomi metallici comporta un materiale di matrice che può confinare i singoli atomi e impedire loro di aggregazione. Segnaliamo un elettrofilatura e termico ricottura metodo per preparare Ni singoli atomi dispersero e coordinato in un guscio di grafene, come centri attivi per la riduzione di CO2 di CO. Durante la sintesi, droganti N svolgono un ruolo critico nella generazione di posti vacanti di grafene per intrappolare atomi di Ni. Aberrazione-corretta scansione microscopia elettronica di trasmissione e tomografia sonda atomo tridimensionale sono stati impiegati per identificare singoli siti atomici Ni in grafene posti vacanti. Installazione dettagliata dell'elettrochimica CO2 riduzione apparato accoppiato con una cromatografia gas on-line è anche dimostrato. Rispetto al Ni metallico, Ni singolo atomo catalizzatore notevolmente migliorata riduzione di CO2 per mostre e soppressa reazione collaterale H2 evoluzione.
Introduzione
Converting CO2 in sostanze chimiche o combustibili utilizzando energia elettrica pulita sta diventando sempre più importante come un potenziale mezzo per prevenire ulteriori CO2 emissioni1,2,3,4, 5,6. Tuttavia, questa pratica applicazione attualmente è sfidata dalla bassa attività e selettività di CO2 riduzione reazione (CO2RR) dovuto le alte barriere cinetiche e la concorrenza con reazione di evoluzione di idrogeno (HER) a acquosa mezzi di comunicazione. La maggior parte del catalizzatore tradizionali metalli di transizione, come Fe, Co e Ni, esibiscono CO2RR selettività bassa a causa della loro superba HER attività7,8. Ottimizzazione efficacemente loro proprietà per modificare i percorsi di reazione su questi catalizzatori di metalli di transizione diventa fondamentale per migliorare la loro selettività di2RR CO. Tra vari metodi per modificare le proprietà elettroniche dei catalizzatori, disperdendo atomi del metallo in una morfologia di singolo-atomo attira attenzioni intensivi recentemente a causa dei loro comportamenti catalitici radicalmente mutati rispetto alla loro controparte alla rinfusa 9 , 10 , 11. Tuttavia, a causa l'elevata mobilità degli atomi non vincolati, è abbastanza difficile ottenere singoli atomi di metallo senza la presenza di materiali di supporto. Pertanto, un materiale di matrice ospite con difetti creato per confinare e coordinare con atomi di metalli di transizione è necessario. Questo potrebbe aprire nuove opportunità per: 1) ottimizzare le proprietà elettroniche dei metalli di transizione come siti attivi di CO2RR e 2) allo stesso tempo mantenere relativamente semplice coordinamento atomico per gli studi di meccanismo fondamentale. Inoltre, quegli atomi di metalli di transizione intrappolati in un ambiente confinato, non possono essere facilmente spostati durante la catalisi, che impedisce la nucleazione o ricostruzioni degli atomi di superficie osservati in molti casi12,13 ,14.
Bidimensionale grafene a strati è di particolare interesse come host per metallo singoli atomi a causa della loro conducibilità alta dell'elettrone, la stabilità chimica e l'inerzia sia riduzione di CO2 e le sue reazioni catalitiche. Ancora più importante, Fe, Co e Ni metalli erano noti per essere in grado di catalizzare il processo di grafitizzazione di carbonio sulla loro superficie15. In breve, quei metalli di transizione in lega con il carbonio durante la termica ad alta temperatura processo di ricottura. Quando la temperatura scende, carbonio inizia a precipitare fuori la fase lega ed è catalizzato da strati di grafene forma sulla superficie del metallo di transizione. Durante questo processo, con difetti di grafene generati, metallo singoli atomi sarebbero intrappolati in quei difetti di grafene come i siti attivi per CO2RR16,17,18,19. Qui, segnaliamo questo protocollo dettagliato con l'intenzione di aiutare nuovi praticanti nel campo della catalisi di singolo atomo, così da fornire una dimostrazione esplicita di on-line CO2 analisi del prodotto di riduzione. Ulteriori informazioni possono essere trovati nel nostro articolo recentemente pubblicato19 e una serie di opere relative al20,21,22,23.
Protocollo
1. preparazione del catalizzatore di Ni singolo atomo (NiN-GS)
- Preparazione della soluzione di precursore di elettrofilatura
- Prendere un flacone di scintillazione 20ml, sciogliere 0,5 g di poliacrilonitrile (Mw= 150.000), 0,5 g di usato (Mw= 1.300.000), 0,5 g di Ni (NO3)2·6H2O e 0,1 g di diciandiammide (DCDA) in 10 mL di dimetilformammide (DMF).
- La miscela DMF a 80 ° C di calore e mantenere la miscela ad 80 ° C mescolando costantemente fino a quando tutti i polimeri e sale si dissolvono e si osserva una soluzione chiara.
- Elettrofilatura per produrre fibre polimeriche
- Impostare i parametri di elettrofilatura convenzionali come: 15 kV di tensione elettrica statica, 15 cm di aria gap di distanza, un substrato di raccolta di 8 carta di × 8 cm di fibra di carbonio (PCP) con - 4 kV di tensione elettrica.
- Estratto 5 mL di soluzione di precursore in una siringa da 5 mL, avviare la pompa a siringa ad una portata di 1,2 mL h−1, quindi iniziare l'elettrofilatura.
Nota: Un'ad alta tensione viene utilizzata per elettrofilatura. Anche se molto bassa corrente passa attraverso il sistema durante il processo di filatura, è suggerito un cabinet in legno coibentato. - Estrarre il substrato di PCP, una volta completato il processo di elettrofilatura. Un film di fibra di polimero ricopre la superficie di PCP.
- Ricottura di fibre polimeriche in nanotubi di carbonio
- Preparato come polimero fibra film/PCP a 300 ° C in 1,5 h in una fornace di casella di calore e mantenere la temperatura per 0,5 h ossidare i polimeri.
Nota: Dopo il processo di ossidazione, le nanofibre (NFs) sono auto-staccate dalla carta carbone risultanti nel film indipendente. - Utilizzare un paio di forbici per tagliare quei nanofibre in pezzi più piccoli (~ 0,5 cm × 2 cm) e inserirli in una barca di quarzo.
- Mettere la barca al quarzo in un forno tubolare e disareare esso all'interno formando atmosfera di gas (5% H2 in Ar). Mantenere il tasso di flusso di gas come sccm 100 e la pressione come 1 Tor.
- Riscaldarli entro 10 min in rampa a 300 ° C e 2 h rampa a 750 ° C, dove viene mantenuta per un altro h 1 e seguito dal raffreddamento naturale.
- Preparato come polimero fibra film/PCP a 300 ° C in 1,5 h in una fornace di casella di calore e mantenere la temperatura per 0,5 h ossidare i polimeri.
- Ball mill come sintetizzato NiN-GS catalizzatore per 5 min a nanopolveri per catalisi e caratterizzazioni.
2. misure di riduzione di CO elettrochimica2
- Cella e gli elettrodi
- Per preparare dell'elettrolito 0,1 M KHCO3 per le seguenti misure, prima sciogliere 2,5 g di KHCO3 in 250 mL di acqua ultrapura, quindi purificare l'elettrolita per elettrolisi tra due barre di grafite a 0.1 mA per 24 h per rimuovere qualsiasi traccia quantità di metallo ioni.
- Prendere un fresco carbonio vetroso (elettrochimicamente) lucido (1 × 2cm) e coprire la sua parte posteriore con una cera elettrochimicamente inerte, idrofobica, come il substrato di elettrodo di lavoro.
- Prendere un flacone di scintillazione 4 mL, mescolare 5 mg di preparato come catalizzatore di NiN-GS con 1 mL di etanolo e 100 µ l di soluzione ionomero (5% in 2-proponal) all'interno del flacone e Sonicare per 20 min ottenere una sospensione di inchiostro di catalizzatore omogeneo.
- Dispensare 80 µ l di inchiostro catalizzatore sulla superficie di 2cm2 carbonio vetroso (0,2 mg cm-2 la massa di caricamento) e il vuoto a secco il catalizzatore dell'elettrodo rivestito in un essiccatore prima dell'uso.
- Utilizzare una lamina di platino e un elettrodo al calomelano saturo (SCE) come il contatore e l'elettrodo di riferimento, rispettivamente.
- Utilizzare una tenuta di gas H-tipo vetro cella personalizzata, separata da membrana a scambio protonico, per i sopra 3 elettrodi assemblaggio, nonché le prove elettrochimiche in esecuzione.
- Posizionare l'elettrodo di lavoro ed elettrodo di riferimento SCE in uno scomparto della H-cella ed elettrodo di Pt foglio in altra camera. Iniettare ~ 25 mL di elettrolita in ogni vano del H-cell.
- Collegare gli 3 elettrodi in H-cella della stazione di lavoro elettrochimico per controllo potenziale.
- Bolla dell'elettrolito con N2 a 50.0 sccm (monitorata da controllore di flusso di massa) per 30 min verso N2-saturi 0,1 M KHCO3.
- Selezionare la tecnica di voltammetria ciclica (CV) in CE-Lab software, impostare "E gamma (potenziale)" come "-10 V a 10 V", "gamma (corrente)" come "Auto", eseguire 5 continuo CV scansioni da -0.5 V a -1,8 V (vs SCE) a una velocità di scansione di 50 mV/s a N2-saturi 0,1 M KHCO3.
- Cambiare 50 sccm CO2 flusso di gas, attendere 30 min verso CO2-saturi dell'elettrolito 0,1 M KHCO3 e mantenere lo stesso flusso di CO2 durante l'elettrolisi seguente.
- Selezionare la tecnica di CV in CE-Lab software, impostare "E gamma (potenziale)" come "-10 V a 10 V", "gamma (corrente)" come "Auto", eseguire 5 continuo CV scansioni da -0.5 V a -1,8 V (vs SCE) a una velocità di scansione di 50 mV/s in CO2-saturi 0,1 M KHCO3.
- Utilizzare un misuratore di pH per determinare i valori di pH degli elettroliti, cioè., 0,1 M KHCO3 saturata con N2 o CO2.
- Convertire tutti i potenziali misurati contro SCE per la scala di elettrodo (RHE) idrogeno reversibile in questo lavoro utilizzando E (vs RHE) = E (vs SCE) + 0,244 V + 0.0591 × pH.
- Determinare la soluzione resistenza (Ru) in CE-Lab software selezionando la tecnica di spettroscopia di impedenza elettrochimica potenziostatica (PEIS), quindi la gamma di frequenza impostata da 0,1 Hz a 200 kHz, registrare il valore di resistenza.
- Compensare manualmente iR-drop come E (correzione iR vs RHE) = E (vs RHE) - ×u R I (amp di corrente media).
- Analisi di prodotti di CO2 riduzione di on-line gascromatografo (GC)
- Impiegare un GC, dotato di una combinazione di setaccio molecolare 5A e micropacked colonne, per analisi di gas prodotti durante la CO2RR.
Nota: I tipi di colonna GC dettagliati è reperibile in allegato Tabella materiali. - Utilizzare un rivelatore a conducibilità termica (TCD) per quantificare la concentrazione di2 H e un rivelatore a ionizzazione di fiamma (FID) con un methanizer a tenore di CO di analisi quantitativa e/o di qualsiasi altra specie di alcano.
- Utilizzare due diversi tipi di gas standard per le curve di calibrazione di H2 e concentrazione di CO (H2: 1042 e 100 ppm; CO: 496.7 e 100 ppm; bilanciato con Argon).
- Durante l'elettrolisi, mantenere CO2 portata gas a 50.0 sccm, consegnare CO2 nel vano catodico contenenti CO2-saturi 0,1 M KHCO3 elettrolito e sfiato del gas di scarico in GC.
- Tune graduale la tensione sull'elettrodo di lavoro, che vanno da -0,3 a -1,0 V vs RHE, mantenere ~ 15 min per ogni potenziale e registrare la corrispondente curva di chronoamperimetric.
- Determinare H2 e CO contenuti nei gas di scarico dai segnali di TCD e FID, rispettivamente.
Nota: I prodotti di gas vengono campionati dopo un'elettrolisi continua di ~ 10 min sotto ogni potenziale. Il 50 sccm CO2 gas, mescolato con continuamente prodotto H2 e CO, scorreva attraverso il ciclo di campionamento (1 mL) di GC durante l'elettrolisi. - Calcolare la densità di corrente parziale per un prodotto dato gas come qui sotto:
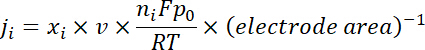
dove xho è la frazione di volume di determinato prodotto determinato dal GC online a cui fa riferimento alle curve di calibrazione da due campioni di gas standard (Scott e Airgas), v è la portata di 50 sccm, n è il numero di elettroni coinvolti, p0 = 101.3 kPa e F è la costante faradica e R è la costante dei gas. - Calcolare l'efficienza faradica corrispondente (FE) presso ogni potenziale come
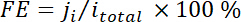 .
.
Nota: L'efficienza generale faradica potrebbe essere all'interno di una gamma di 90-110% a causa di errori da portata gas, densità di corrente e l'analisi di concentrazione di gas su GC.
- Impiegare un GC, dotato di una combinazione di setaccio molecolare 5A e micropacked colonne, per analisi di gas prodotti durante la CO2RR.
Risultati
Microscopia elettronica (SEM), scansione microscopia elettronica della trasmissione (STEM) e spettroscopia a raggi x energia-dispersiva (EDX) mappatura di immagini è mostrati nella Figura 1 per la caratterizzazione della morfologia di NiN-GS. Atomo tridimensionale sonda tomografia (3D-APT) risultati sono mostrati nella Figura 2 per l'identificazione diretta dell'unico Ni siti distribuzione così come loro vicini ambiente chimico...
Discussione
Nel processo di elettrofilatura sopra, due passi importanti dovrebbero essere notate in procedure di sintesi materiale: 1) la miscela DMF (punto 1.1.2) e 2) il tasso di pompa regolazione (passo 1.2.2) per adeguarsi alla velocità di filatura di riscaldamento. L'immagine di SEM in Figura 1A Mostra le nanofibre di carbonio ottenuta interconnesse tra loro (~ 200 nm di diametro). Essi sono stati suddivisi in piccoli pezzi da palla di fresatura per caratterizzazioni come mostrato in
Riconoscimenti
Questo lavoro è stato supportato dalla Rowland Fellows Program presso l'Università di Rowland Institute di Harvard. Quest'opera è stata eseguita in parte al centro per sistemi su scala nanometrica (CNS), un membro della nanotecnologia infrastruttura rete nazionale, che è sostenuto dalla National Science Foundation sotto Premio no. ECS-0335765. Il CNS è parte dell'Università di Harvard.
Materiali
| Name | Company | Catalog Number | Comments |
| syringe pump | KD Scientific | KDS-100 | |
| tube furnance | Lindberg/Blue M | TF55035A-1 | |
| ball miller | SPEX SamplePrep | 5100 | |
| electrochemical work station | BioLogic | VMP3 | |
| pH meter | Orion | 320 PerpHecT | 2 points calibration before use |
| gas chromatograph | Shimadzu | GC-2014 | a combined seperation system consisting of molecular sieve 5A, Hayesep Q, Hayesep T, and Hayesep N |
| mass flow controller | Alicat Scientific | MC-50SCCM-D/5M | |
| ultrapure water system | Millipore | Synergy | |
| vacuum desiccator | PolyLab | 55205 | |
| polyacrylonitrile | Sigma-Aldrich | 181315 | Mw=150,000 |
| polypyrrolidone | Sigma-Aldrich | 437190 | Mw=1,300,000 |
| Ni(NO3)26H2O | Sigma-Aldrich | 244074 | |
| dicyandiamide | Sigma-Aldrich | D76609 | |
| dimethylformamide | Sigma-Aldrich | 227056 | |
| carbon fiber paper | AvCarb | MGL370 | |
| Nafion 117 membrane | Fuel Cell Store | 117 | used as proton exchange membrane in H-cell |
| KHCO3 | Sigma-Aldrich | 431583 | further purified by electrolysis |
| platinum foil | Beantown Chemical | 126580 | |
| saturated calomel electrode | CH Instruments | CHI150 | |
| glassy carbon electrode | HTW GmbH | SIGRADUR | 1 cm × 2 cm |
| wax | Apiezon | W-W100 | |
| Nafion 117 solution | Sigma-Aldrich | 70160 | used as ionomer in catalyst ink preparation |
| forming gas | Airgas | UHP | 5% H2 balanced with Ar |
| carbon dioxide | Airgas | LaserPlus | |
| sandard gas | Airgas | customized | 500 ppm CO, 500 ppm CH4, 1000 ppm H2 balanced with Ar |
| sandard gas | Air Liquide | customized | 100 ppm H2, 100 ppm CO and other alkanes balanced with Ar |
Riferimenti
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. P. Natl. Acad. Sci. USA. 103, 15729-15735 (2006).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chem. Rev. 113, 6621-6658 (2013).
- Jhong, H. R., Ma, S. C., Kenis, P. J. A. Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities. Curr. Opin. Chem. Eng. 2, 191-199 (2013).
- Ashford, D. L., et al. Molecular Chromophore-Catalyst Assemblies for Solar Fuel Applications. Chem. Rev. 115, 13006-13049 (2015).
- Nocera, D. G. Solar Fuels and Solar Chemicals Industry. Accounts. Chem. Res. 50, 616-619 (2017).
- Larrazabal, G. O., Martin, A. J., Perez-Ramirez, J. Building Blocks for High Performance in Electrocatalytic CO2 Reduction: Materials, Optimization Strategies, and Device Engineering. J. Phys. Chem. Lett. 8, 3933-3944 (2017).
- Hori, Y., Wakebe, H., Tsukamoto, T., Koga, O. Electrocatalytic Process of Co Selectivity in Electrochemical Reduction of Co2 at Metal-Electrodes in Aqueous-Media. Electrochim. Acta. 39, 1833-1839 (1994).
- Hori, Y. . Modern aspects of electrochemistry. , 89-189 (2008).
- Lin, S., et al. Covalent organic frameworks comprising cobalt porphyrins for catalytic CO2 reduction in water. Science. 349, 1208-1213 (2015).
- Zhang, X., et al. Highly selective and active CO2 reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures. Nat. Commun. 8, 14675 (2017).
- Zhao, C. M., et al. Ionic Exchange of Metal Organic Frameworks to Access Single Nickel Sites for Efficient Electroreduction of CO2. J. Am. Chem. Soc. 139, 8078-8081 (2017).
- Manthiram, K., Beberwyck, B. J., Aivisatos, A. P. Enhanced Electrochemical Methanation of Carbon Dioxide with a Dispersible Nanoscale Copper Catalyst. J. Am. Chem. Soc. 136, 13319-13325 (2014).
- Yang, M., et al. Catalytically active Au-O(OH)(x)-species stabilized by alkali ions on zeolites and mesoporous oxides. Science. 346, 1498-1501 (2014).
- Manthiram, K., Surendranath, Y., Alivisatos, A. P. Dendritic Assembly of Gold Nanoparticles during Fuel-Forming Electrocatalysis. J. Am. Chem. Soc. 136, 7237-7240 (2014).
- Amini, S., Garay, J., Liu, G., Balandin, A. A., Abbaschian, R. Growth of large-area graphene films from metal-carbon melts. J. Appl. Phys. 108, 094321 (2010).
- Krasheninnikov, A. V., Lehtinen, P. O., Foster, A. S., Pyykkö, P., Nieminen, R. M. Embedding Transition-Metal Atoms in Graphene: Structure, Bonding, and Magnetism. Phys. Rev. Lett. 102, 126807 (2009).
- Jiang, K., Siahrostami, S., Zheng, T., Hu, Y., Hwang, S., Stavitski, E., Peng, Y., Dynes, J., Gangishetty, M., Su, D., Attenkofer, K., Wang, H. Isolated Ni Single Atoms in Graphene Nanosheets for High-performance CO2 Reduction. Energy Environ. Sci. , (2018).
- Rodríguez-Manzo, J. A., Cretu, O., Banhart, F. Trapping of Metal Atoms in Vacancies of Carbon Nanotubes and Graphene. ACS Nano. 4, 3422-3428 (2010).
- Jiang, K., et al. Transition metal atoms in a graphene shell as active centers for highly efficient artificial photosynthesis. Chem. 3, 950-960 (2017).
- Jiang, K., Wang, H., Cai, W. B., Wang, H. T. Li Electrochemical Tuning of Metal Oxide for Highly Selective CO2 Reduction. ACS Nano. 11, 6451-6458 (2017).
- Jiang, K., et al. Silver Nanoparticles with Surface-Bonded Oxygen for Highly Selective CO2 Reduction. ACS Sustain Chem. Eng. 5, 8529-8534 (2017).
- Siahrostami, S., et al. Theoretical Investigations into Defected Graphene for Electrochemical Reduction of CO2. ACS Sustain Chem. Eng. 5, 11080-11085 (2017).
- Jiang, K., et al. Metal Ion Cycling of Cu Foil for Selective C-C Coupling in Electrochemical CO2 Reduction. Nat. Catal. , (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon