Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthese und Performance Charakterisierungen von Übergangsmetall Einzelatom Katalysator für elektrochemische CO2 -Reduktion
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll für die Synthese und Elektrochemische Prüfung Übergangsmetall einzelner Atome als aktive Zentren für selektive Kohlendioxid-Reduktion zu Kohlenmonoxid in wässrigen Lösungen in Graphen stellen koordiniert.
Zusammenfassung
Dieses Protokoll stellt die Synthese-Methode des Katalysators Ni einzelnes Atom, sowohl die Elektrochemische Prüfung ihrer katalytischen Aktivität und Selektivität in wässrigen CO2 -Reduktion. Anders als bei traditionellen Metall-Nanokristalle, beinhaltet die Synthese der einzelnen metallatomen Matrixmaterial, die die einzelne Atome zu beschränken und Aggregation hindern kann. Wir berichten über eine Elektrospinnen und thermische Methode um Ni vorzubereiten, einzelne Atome verteilt und koordiniert in einem Graphen-Shell als aktive Zentren für CO2 -Reduktion Co, Glühen. Während der Synthese spielen N Dotierstoffe eine entscheidende Rolle bei der Schaffung von Graphen stellen Ni Atome auffangen. Aberration korrigiert Scan Transmissions-Elektronenmikroskopie und dreidimensionale Atom Probe Tomography wurden eingesetzt, um den einzelnen Ni atomaren Standorten in Graphen stellen zu identifizieren. Detaillierten Aufbau der elektrochemische CO2 Reduktion Apparat mit einem Online-Gaschromatographie gekoppelt wird auch demonstriert. Im Vergleich zu metallischen Ni, Ni einzelatom Katalysator weisen deutlich verbesserte CO2 -Reduktion und H2 Evolution Seite Reaktion unterdrückt.
Einleitung
Konvertieren von CO2 in Chemikalien oder Kraftstoffe mit sauberem Strom gewinnt zunehmend an Bedeutung als ein möglicher Weg zur Verhinderung weiterer CO2 Emissionen1,2,3,4, 5,6. Jedoch mit dieser praktischen Anwendung derzeit durch die geringe Aktivität und Selektivität der CO2 Reduktionsreaktion (CO2RR) durch die hohe kinetischen Barrieren und die Konkurrenz mit Wasserstoff Evolution Reaktion (HER) in wässrigen herausgefordert Medien. Die meisten traditionellen Übergangsmetall-Katalysators, wie Fe, Co, Ni, weisen niedrige CO2RR Selektivität durch ihre hervorragende HER Aktivitäten7,8. Effektiv ihre Materialeigenschaften ändern die Reaktionswege auf diese Übergangsmetallkatalysatoren tuning wird kritisch ihre CO2RR Selektivität zu verbessern. Unter verschiedenen Methoden zum Ändern der elektronischen Eigenschaften von Katalysatoren zieht die Metallatome in einem einzelatom-Morphologie Dispergieren intensive Aufmerksamkeit vor kurzem wegen ihrer dramatisch veränderten katalytische Verhalten im Vergleich zu ihrer Masse Gegenstück 9 , 10 , 11. jedoch aufgrund der hohen Beweglichkeit der ungebundene Atome, es ist ziemlich schwierig, einzelne Metallatome ohne die Anwesenheit von unterstützenden Materialien zu erhalten. Deshalb Host Matrixmaterial mit defekten erstellt beschränken und mit Übergangsmetall Atome koordinieren muss. Dies könnte eröffnen Ihnen neue Möglichkeiten auf: (1) die elektronischen Eigenschaften der Übergangsmetalle als CO2RR aktive Zentren und 2 Stimmen) gleichzeitig pflegen relativ einfachen atomaren Koordination für grundlegender Mechanismus Studien. Diese Übergangsmetall-Atome gefangen in einer beengten Umgebung darüber hinaus können nicht leicht während der Katalyse, verschoben werden um die Keimbildung oder Rekonstruktionen von Oberflächenatomen beobachtet in vielen Fällen12,13 verhindert ,14.
Zweidimensionalen Ebenen Graphen ist von besonderem Interesse als Host für einzelne Metallatome aufgrund ihrer hohen elektronenleitfähigkeit, chemische Beständigkeit und Trägheit, CO2 -Reduktion und ihre katalytische Reaktionen. Noch wichtiger ist, kannte man Fe, Co und Ni Metalle zu den Kohlenstoff Graphitisierung Prozess auf ihrer Oberfläche15katalysieren können. Kurz gesagt, würde diese Übergangsmetalle mit Kohlenstoff während der Hochtemperatur-thermische glühprozess Legierung. Sinkt die Temperatur, Carbon beginnt, Legierungsmetall phasenverschoben auszufällen und Form Graphene Schichten auf der Oberfläche des Übergangsmetall katalysiert wird. Während dieses Prozesses wäre mit Graphen-Fehler generiert, einzelne Metallatome in Graphen Mängel als die aktiven Zentren für CO2RR16,17,18,19gefangen. Hier berichten wir über dieses ausführliche Protokoll Absicht zu helfen, neue Praktiker auf dem Gebiet der einzelnen Atom Katalyse, sowie eine explizite Demonstration Online-Co2 -Reduktion-Produkt-Analyse zur Verfügung zu stellen. Weitere Informationen finden in unserer kürzlich veröffentlichten Artikel19 und eine Reihe von damit verbundenen Arbeiten20,21,22,23.
Protokoll
1. Vorbereitung der Ni Single Atom Katalysator (NiN-GS)
- Vorbereitung der Elektrospinnen Vorläufer Lösung
- Nehmen Sie ein Fläschchen 20 mL funkeln, Auflösen von 0,5 g Polyacrylnitril (Mw= 150.000), 0,5 g Polypyrrolidone (Mw= 1.300.000), 0,5 g Ni (Nr.3)2·6H2O und 0,1 g Dicyandiamid (DCDA) in 10 mL der Dimethylformamid (DMF).
- Erhitzen Sie die DMF-Mischung auf 80 ° C und halten Sie die Mischung auf 80 ° C unter ständigem Rühren, bis alle Polymere und Salz aufgelöst und eine klare Lösung wird beobachtet.
- Elektrospinnen Polymerfasern herzustellen
- Konventionelle Elektrospinnen Parameter als: 15 kV statische elektrische Spannung, 15 cm Luft Spalt Abstand, eine Sammlung Substrat 8 × 8 cm Kohlefaser-Papier (GFP) mit - 4 kV elektrische Spannung.
- Extrakt 5 mL Vorläufer-Lösung in eine 5 mL Spritze, Spritze Pumpe mit einer Durchflussrate von 1,2 mL h−1und dann beginnen die Elektrospinnen.
Hinweis: Eine hohe Spannung wird für Elektrospinnen verwendet. Obwohl sehr geringer Strom durch das System während Spinnen Prozess geht, empfiehlt sich eine isolierte Holzgehäuse. - Nehmen Sie das GFP-Substrat, sobald die Elektrospinnen abgeschlossen ist. Ein Polymerfilm Faser deckt die GFP-Oberfläche.
- Glühen Polymerfasern in Kohlenstoff-Nanoröhren
- Heizen Sie als vorbereitet Polymer Faser Film/GFP bis 300 ° C in 1,5 h in einem Box-Ofen zu, und halten Sie die Temperatur für 0,5 h, die Polymere zu oxidieren.
Hinweis: Nach der Oxidation ist Nanofasern (NFs) selbst losgelöst von der resultierenden in der freistehenden Film Kohlepapier. - Der Schere verwenden, um diese Nanofasern in kleinere Stücke geschnitten (~ 0,5 cm × 2 cm) und legen Sie sie in ein quarzboot.
- Legen Sie das quarzboot in einem Rohrofen und innerhalb bilden Gasatmosphäre (5 % H2 Ar) entlüften. Halten Sie den Gasdurchsatz als 100 Sccm und der Druck als 1 Tor.
- Innerhalb von 10 min Rampen bis 300 ° C und 2 h Rampen bis 750 ° C, wo es ein weiteres 1 h gewartet und gefolgt von der natürlichen Abkühlung erwärmen.
- Heizen Sie als vorbereitet Polymer Faser Film/GFP bis 300 ° C in 1,5 h in einem Box-Ofen zu, und halten Sie die Temperatur für 0,5 h, die Polymere zu oxidieren.
- Ball Mühle als synthetisiert NiN-GS Katalysator für 5 min zu Nanopulver für Katalyse und Charakterisierungen.
2. elektrochemische CO2 -Reduktion-Messungen
- Zelle und Elektroden
- 0,1 M KHCO3 Elektrolyt für die folgenden Messungen vorbereiten, lösen Sie zuerst 2,5 g KHCO3 in 250 mL Reinstwasser, dann Reinigen des Elektrolyts durch Elektrolyse zwischen beiden Graphitstäbe bei 0,1 mA für 24 h, entfernen verfolgen Menge an Metall Ionen.
- Nehmen Sie eine frische (elektrochemisch) polierte glasige Kohlenstoff (1 cm × 2 cm), und bedecken Sie seine Rückseite mit einer elektrochemisch inerten, hydrophobe Wachs als funktionierende Elektrode Substrat.
- Nehmen Sie ein Fläschchen 4 mL funkeln, 5 mg als bereit NiN-GS Katalysator mit 1 mL Ethanol und 100 µL Ionomer-Lösung (5 % in 2-Proponal) in das Fläschchen mischen und für 20 min eine homogene Katalysatoren Tinte Aussetzung zu beschallen.
- Pipettieren 80 µL der Katalysator Tinte auf 2 cm2 glassy Carbon-Oberfläche (0,2 mg cm-2 Masse laden) und Vakuum trocknen den Katalysator überdachte Elektrode in den Exsikkator gestellt vor dem Gebrauch.
- Verwenden Sie eine platinfolie und einer gesättigten Kalomel-Elektrode (SCE) als Zähler und Bezugselektrode, beziehungsweise.
- Verwenden Sie eine angepasste gasdichte H-Typ Glas Zelle, getrennt durch Proton Exchange Membrane für die oben genannten 3 Elektroden, die Montage sowie die elektrochemische Tests ausgeführt.
- Legen Sie die Arbeitselektrode und SCE Bezugselektrode in einem Abteil H-Zelle und Pt Folie Elektrode in die andere Kammer. Injizieren ~ 25 mL Elektrolyt in jedem Fach H-Zelle.
- Verbinden Sie die 3 Elektroden in H-Zelle mit dem elektrochemischen Arbeitsplatz für potentielle Kontrolle.
- Bubble-Elektrolyten mit N2 bei 50.0 Sccm (von mass Flow Controller überwacht) für 30 min in Richtung N2-0,1 M KHCO3gesättigt.
- Zyklischer Voltammetrie (CV) Technik in EC-Lab Software auswählen, stellen Sie "E-Bereich (potenzielle)" als "-10 V bis 10 V", "Ich Range (aktuell)" als "Auto", führen 5 kontinuierliche CV-Scans von -0,5 V bis -1,8 V (gegen SCE) bei einer Abtastrate von 50 mV/s in N2-0,1 M KHCO3gesättigt.
- Ändern Sie in 50 Sccm CO2 Gasstrom, warten Sie 30 Minuten in Richtung CO2-0,1 M KHCO3 Elektrolyt gesättigt und pflegen den gleichen CO2 Fluss während der folgenden Elektrolyse.
- CV-Technik in EC-Lab Software auswählen, stellen Sie "E-Bereich (potenzielle)" als "-10 V bis 10 V", "Ich Range (aktuell)" als "Auto", führen 5 kontinuierliche CV-Scans von -0,5 V bis -1,8 V (gegen SCE) bei einer Abtastrate von 50 mV/s CO2-0,1 M KHCO3gesättigt.
- Verwenden einen pH Meter um die pH-Werte der Elektrolyte, dhzu bestimmen., 0,1 M KHCO3 gesättigt mit N2 oder CO2.
- Konvertieren Sie alle Potentiale gemessen gegen SCE zu reversiblen Wasserstoff-Elektrode (RHE) Skala in dieser Arbeit mit E (Vs RHE) = E (gegen SCE) + 0.244 V + 0.0591 × pH.
- Bestimmen Sie Lösung Widerstand (Ru) im EC-Lab Software durch Auswahl Potentiostatischer elektrochemische Impedanz Spektroskopie (PEIS) Technik, dann eingestellte Frequenzbereich von 0,1 Hz bis 200 kHz, Aufzeichnen des Widerstandswertes.
- Manuell kompensieren iR-drop als E (iR korrigiert Vs RHE) = E (Vs RHE) - Ru × ich (Ampere des aktuellen Durchschnitts).
- CO2 -Reduktion Produktanalyse durch Online-Gaschromatographen (GC)
- Beschäftigen Sie eine GC, ausgestattet mit einer Kombination von Molekularsieb 5A Spalten "und" Micropacked für die Gasanalyse Produkte während CO2RR.
Hinweis: Detaillierte GC-Säule-Typen finden Sie im beigefügten Tabelle der Materialien. - Verwenden Sie eine Wärmeleitfähigkeit-Detektor (TCD), H2 Konzentration zu quantifizieren und einem Flammenwächter Ionisation (FID) mit einer Methanizer zur quantitativen Analyse CO-Gehalt und/oder irgendeiner anderen Alkans Sorte.
- Verwenden Sie zwei verschiedene standard-Gase für die Kalibrierkurven H2 und CO-Konzentration (H2: 100 und 1042 ppm; CO: 100 und 496.7 ppm; ausgewogen mit Argon).
- Während der Elektrolyse, pflegen CO2 -Gas-Durchfluss bei 50.0 Sccm, liefern CO2 in der kathodischen Depot mit CO2-gesättigten 0,1 M KHCO3 Elektrolyt und Vent den Auspuff in GC.
- Schrittweise Melodie halten die Spannung an der Arbeitselektrode, von -0,3 bis -1,0 V vs. RHE, ~ 15 min für jede Potenzial und Aufzeichnung der entsprechenden Chronoamperimetric-Kurve.
- Bestimmen Sie die H-2 und CO-Gehalt im Abgas von TCD und FID Signale bzw..
Hinweis: Die Gasprodukte sind nach einer kontinuierlichen Elektrolyse von Stichprobe ~ 10 min unter jedes Potenzial. Die 50 Sccm CO2 -Gas, gemischt mit kontinuierlich produziert H2 und CO, floss durch die Probenahme-Schleife (1 mL) des GC während der Elektrolyse. - Berechnen Sie die teilweise Stromdichte für ein bestimmtes Gas-Produkt als unten:
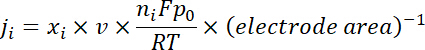
wo Xich der Volumenanteil des bestimmten Produkts durch Online-GC bezogen auf Kalibrierkurven bestimmt ist von zwei standard Gasproben (Scott und Airgas), V ist die Durchflussmenge von 50 Sccm, nich die Anzahl der Elektronen beteiligt, p0 = 101,3 kPa und F ist die Faradaic-Konstante und R die Gaskonstante ist. - Berechnen der entsprechenden Faradaic Wirkungsgrad (FE) bei jeder Potenzial als
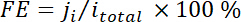 .
.
Hinweis: Die insgesamt Faradaic Effizienz könnte in einem Bereich von 90 bis 110 % aufgrund der Fehler von Gas-Durchfluss, Stromdichte und Gasanalyse Konzentration auf GC.
- Beschäftigen Sie eine GC, ausgestattet mit einer Kombination von Molekularsieb 5A Spalten "und" Micropacked für die Gasanalyse Produkte während CO2RR.
Ergebnisse
Rasterelektronenmikroskopie (SEM), Scan-Transmissions-Elektronenmikroskopie (STEM) und Energie-energiedispersiver Röntgenspektroskopie (EDX) sind Zuordnung Bilder zur Morphologie Charakterisierung von NiN-GS in Abbildung 1 dargestellt. Dreidimensionale Atom Sonde Tomographie (3D-APT) Ergebnisse sind für die direkte Identifizierung der einzelnen Ni Websites Verteilung als auch ihre benachbarten chemischen Umgebung in Abbildung 2...
Diskussion
In den oben beschriebenen Elektrospinnen Prozess, zwei wichtige Schritte in materiellen Syntheseverfahren beachten: (1) Heizung die DMF-Mischung (Schritt 1.1.2), und (2) die Pumpe Rate einstellen (Schritt 1.2.2) um die Spinnen möglichst übereinstimmen. SEM Bild in Abbildung 1A zeigt die erhaltenen Kohlenstoff Nanofasern miteinander (~ 200 nm im Durchmesser). Sie wurden durch Kugel Fräsen für Charakterisierungen wie in Abbildung 1 bin kleine Stücke gebrochen...
Danksagungen
Diese Arbeit wurde von Rowland Fellows Program an der Rowland Institute der Harvard-Universität unterstützt. Diese Arbeit erfolgte teilweise in der Mitte für Nanoscale Systems (ZNS), Mitglied der nationalen Nanotechnologie Infrastrukturnetz, die von der National Science Foundation unter Award unterstützt wird keine. ECS-0335765. Das ZNS ist Teil der Harvard University.
Materialien
| Name | Company | Catalog Number | Comments |
| syringe pump | KD Scientific | KDS-100 | |
| tube furnance | Lindberg/Blue M | TF55035A-1 | |
| ball miller | SPEX SamplePrep | 5100 | |
| electrochemical work station | BioLogic | VMP3 | |
| pH meter | Orion | 320 PerpHecT | 2 points calibration before use |
| gas chromatograph | Shimadzu | GC-2014 | a combined seperation system consisting of molecular sieve 5A, Hayesep Q, Hayesep T, and Hayesep N |
| mass flow controller | Alicat Scientific | MC-50SCCM-D/5M | |
| ultrapure water system | Millipore | Synergy | |
| vacuum desiccator | PolyLab | 55205 | |
| polyacrylonitrile | Sigma-Aldrich | 181315 | Mw=150,000 |
| polypyrrolidone | Sigma-Aldrich | 437190 | Mw=1,300,000 |
| Ni(NO3)26H2O | Sigma-Aldrich | 244074 | |
| dicyandiamide | Sigma-Aldrich | D76609 | |
| dimethylformamide | Sigma-Aldrich | 227056 | |
| carbon fiber paper | AvCarb | MGL370 | |
| Nafion 117 membrane | Fuel Cell Store | 117 | used as proton exchange membrane in H-cell |
| KHCO3 | Sigma-Aldrich | 431583 | further purified by electrolysis |
| platinum foil | Beantown Chemical | 126580 | |
| saturated calomel electrode | CH Instruments | CHI150 | |
| glassy carbon electrode | HTW GmbH | SIGRADUR | 1 cm × 2 cm |
| wax | Apiezon | W-W100 | |
| Nafion 117 solution | Sigma-Aldrich | 70160 | used as ionomer in catalyst ink preparation |
| forming gas | Airgas | UHP | 5% H2 balanced with Ar |
| carbon dioxide | Airgas | LaserPlus | |
| sandard gas | Airgas | customized | 500 ppm CO, 500 ppm CH4, 1000 ppm H2 balanced with Ar |
| sandard gas | Air Liquide | customized | 100 ppm H2, 100 ppm CO and other alkanes balanced with Ar |
Referenzen
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. P. Natl. Acad. Sci. USA. 103, 15729-15735 (2006).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chem. Rev. 113, 6621-6658 (2013).
- Jhong, H. R., Ma, S. C., Kenis, P. J. A. Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities. Curr. Opin. Chem. Eng. 2, 191-199 (2013).
- Ashford, D. L., et al. Molecular Chromophore-Catalyst Assemblies for Solar Fuel Applications. Chem. Rev. 115, 13006-13049 (2015).
- Nocera, D. G. Solar Fuels and Solar Chemicals Industry. Accounts. Chem. Res. 50, 616-619 (2017).
- Larrazabal, G. O., Martin, A. J., Perez-Ramirez, J. Building Blocks for High Performance in Electrocatalytic CO2 Reduction: Materials, Optimization Strategies, and Device Engineering. J. Phys. Chem. Lett. 8, 3933-3944 (2017).
- Hori, Y., Wakebe, H., Tsukamoto, T., Koga, O. Electrocatalytic Process of Co Selectivity in Electrochemical Reduction of Co2 at Metal-Electrodes in Aqueous-Media. Electrochim. Acta. 39, 1833-1839 (1994).
- Hori, Y. . Modern aspects of electrochemistry. , 89-189 (2008).
- Lin, S., et al. Covalent organic frameworks comprising cobalt porphyrins for catalytic CO2 reduction in water. Science. 349, 1208-1213 (2015).
- Zhang, X., et al. Highly selective and active CO2 reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures. Nat. Commun. 8, 14675 (2017).
- Zhao, C. M., et al. Ionic Exchange of Metal Organic Frameworks to Access Single Nickel Sites for Efficient Electroreduction of CO2. J. Am. Chem. Soc. 139, 8078-8081 (2017).
- Manthiram, K., Beberwyck, B. J., Aivisatos, A. P. Enhanced Electrochemical Methanation of Carbon Dioxide with a Dispersible Nanoscale Copper Catalyst. J. Am. Chem. Soc. 136, 13319-13325 (2014).
- Yang, M., et al. Catalytically active Au-O(OH)(x)-species stabilized by alkali ions on zeolites and mesoporous oxides. Science. 346, 1498-1501 (2014).
- Manthiram, K., Surendranath, Y., Alivisatos, A. P. Dendritic Assembly of Gold Nanoparticles during Fuel-Forming Electrocatalysis. J. Am. Chem. Soc. 136, 7237-7240 (2014).
- Amini, S., Garay, J., Liu, G., Balandin, A. A., Abbaschian, R. Growth of large-area graphene films from metal-carbon melts. J. Appl. Phys. 108, 094321 (2010).
- Krasheninnikov, A. V., Lehtinen, P. O., Foster, A. S., Pyykkö, P., Nieminen, R. M. Embedding Transition-Metal Atoms in Graphene: Structure, Bonding, and Magnetism. Phys. Rev. Lett. 102, 126807 (2009).
- Jiang, K., Siahrostami, S., Zheng, T., Hu, Y., Hwang, S., Stavitski, E., Peng, Y., Dynes, J., Gangishetty, M., Su, D., Attenkofer, K., Wang, H. Isolated Ni Single Atoms in Graphene Nanosheets for High-performance CO2 Reduction. Energy Environ. Sci. , (2018).
- Rodríguez-Manzo, J. A., Cretu, O., Banhart, F. Trapping of Metal Atoms in Vacancies of Carbon Nanotubes and Graphene. ACS Nano. 4, 3422-3428 (2010).
- Jiang, K., et al. Transition metal atoms in a graphene shell as active centers for highly efficient artificial photosynthesis. Chem. 3, 950-960 (2017).
- Jiang, K., Wang, H., Cai, W. B., Wang, H. T. Li Electrochemical Tuning of Metal Oxide for Highly Selective CO2 Reduction. ACS Nano. 11, 6451-6458 (2017).
- Jiang, K., et al. Silver Nanoparticles with Surface-Bonded Oxygen for Highly Selective CO2 Reduction. ACS Sustain Chem. Eng. 5, 8529-8534 (2017).
- Siahrostami, S., et al. Theoretical Investigations into Defected Graphene for Electrochemical Reduction of CO2. ACS Sustain Chem. Eng. 5, 11080-11085 (2017).
- Jiang, K., et al. Metal Ion Cycling of Cu Foil for Selective C-C Coupling in Electrochemical CO2 Reduction. Nat. Catal. , (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten