Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Grabación espacial restringido a oscilaciones en el hipocampo de ratones de comportarse
En este artículo
Resumen
Este protocolo describe la grabación de potenciales de campo local con caña múltiples sondas de silicona lineal. La conversión de las señales mediante análisis de densidad de fuente actual permite la reconstrucción de la actividad eléctrica local en el hipocampo del ratón. Con esta técnica, se pueden estudiar las oscilaciones del cerebro espacialmente restringida libremente mover ratones.
Resumen
El potencial de campo local (LFP) surge de los movimientos de iones a través de las membranas neuronales. Puesto que el voltaje registrado por los electrodos de la LFP refleja el campo eléctrico sumado de un gran volumen de tejido cerebral, extraer información sobre la actividad local es un reto. Estudio de Microcircuitos neuronales, sin embargo, requiere una distinción fiable entre eventos verdaderamente locales y llevadas a cabo por volumen señales procedentes de áreas distantes del cerebro. Análisis de densidad (CSD) de fuente actual ofrece una solución para este problema, proporcionando información sobre actuales sumideros y fuentes en las cercanías de los electrodos. En áreas del cerebro con cytoarchitecture laminar como el hipocampo, CSD unidimensional puede obtenerse mediante la estimación de la segunda derivada espacial de la LFP. Aquí, describimos un método para grabar multilaminares LFPs utilizando sondas de silicona lineal en el hipocampo dorsal. Rastros CSD se calculan a lo largo de los vástagos de la sonda. Así, este protocolo describe un procedimiento para resolver las oscilaciones espacialmente restringida red neuronal en el hipocampo de libremente mover ratones.
Introducción
Oscilaciones en la LFP están implicadas críticamente en circuitos neuronales de procesamiento de información. Cubren un amplio espectro de frecuencias, que van desde las ondas lentas (~ 1 Hz) ondulación rápida oscilaciones (~ 200 Hz)1. Bandas de frecuencia distintas se asocian con las funciones cognitivas como la memoria, el procesamiento emocional y navegación2,3,4,5,6,7. Flujo de corriente a través de membranas neuronales constituye la mayor parte de la LFP señal8. Cationes en la célula (e.g. vía activación de sinapsis excitatoria glutamatérgica) representan un fregadero actual activo (mientras carga sale el medio extracelular). En contraste, el flujo neto de carga positiva en el medio extracelular, por ejemplo por la activación de las sinapsis inhibitorias GABAérgicas, representa una fuente activa de corriente en ese lugar. En dipolos neuronales, fregaderos actuales están emparejados con fuentes pasivas y viceversa debido a la compensación de las corrientes que afectan a la carga de la membrana en sitios distantes.
El campo eléctrico producido por procesos de los nervios alejados puede también dar lugar a desviaciones considerables de voltaje en un electrodo de la grabación y así puede considerarse falsamente como un evento local. Esta conducción volumen plantea un serio desafío a la interpretación de las señales de la LFP. CSD el análisis proporciona información sobre fregaderos actuales locales y fuentes subyacentes LFP señales y por lo tanto comprende un medio para reducir el impacto de la conducción de volumen8. En laminado estructuras como el hipocampo, las señales unidimensionales de CSD pueden obtenerse por la segunda derivada espacial de la LFP grabada de perpendiculares equidistantes electrodos dispuestos en los planos laminares9. La llegada de sondas de silicona lineal disponible en el mercado ha permitido a los investigadores utilizar el método CSD para el estudio de la actividad local de la oscilación en el hipocampo. Por ejemplo, se ha demostrado que las oscilaciones gamma distintas emergen en forma de capa-específicas en el área CA1 del10. Además, análisis CSD ha identificado focos independientes de la actividad de la gamma en la capa de la célula principal de la convolución del cerebro dentada11. Importantemente, estos resultados sólo fueron evidentes en CSD local pero no en las señales de la LFP. Análisis CSD proporciona así una herramienta poderosa para ganar la penetración en las operaciones de microcircuito del hipocampo.
En este protocolo, le ofrecemos una guía completa para obtener las señales unidimensionales de CSD con sondas de silicio. Estos métodos le permiten a los usuarios investigar eventos de oscilación localizada en el hipocampo de ratones comportarse.
Protocolo
Todos los métodos que implican animales vivos han sido aprobados por el Freiburg competente con arreglo a la ley de Bienestar Animal.
1. preparaciones
- Diseñar y construir una herramienta de inserción apropiado llevar transitoriamente la punta de prueba de silicio y el conector del electrodo durante el proceso de implantación. Vea la figura 1 para una ejemplo personalizado construido herramienta.
- Suelte con cuidado el conector de electrodo y sonda de silicona de su embalaje con unas pinzas con punta de cerámica.
- Levante la placa de conector y fije con una pinza de cocodrilo atada a un soporte.
- Uso de un estereoscopio, alinee la punta de prueba con la herramienta de inserción con pinzas con punta de cerámica. Aplicar una capa de ~ 2 mm de cera de parafina derretida con un cauterizador para pegar la sonda a la herramienta de inserción. Tenga cuidado de no para tocar los vástagos de sondeo durante este procedimiento.
- Fije el conector de electrodo en el eje de la herramienta de inserción con cinta adhesiva estándar. Tenga en cuenta que dependiendo del fabricante, los cables de tierra puede ser que necesite ser soldadas a la placa de conector electrodo antes de la implantación. Retire el aislamiento de dos piezas cortas barniz aislante del alambre de cobre con estaño-soldadura con un soldador (400 ° C). La soldadura de los cables de tierra a las ranuras correspondientes en la Junta del conector de electrodo.
- Retire el aislamiento de dos piezas adicionales de cable de cobre. Envuelva cada alambre desnudo de cobre tres veces alrededor de un tornillo de acero inoxidable (1 mm de diámetro, 2 mm de longitud). Aplique fundente adecuado para soldar acero y soldar el alambre de cobre en la parte inferior de la tapa de rosca. Asegúrese de que la parte inferior de la mitad de los restos de la rosca de tornillo libre de estaño-soldadura.
- Utilice un multímetro estándar para comprobar el contacto eléctrico entre el cable y tornillo.
- Desinfectar los vástagos de la sonda de silicona y los tornillos de tierra mediante inmersión en etanol al 70% (10 s).
- Preparar una cubierta protectora para el implante de sonda cortando la cabeza de una pipeta Pasteur de plástico por la mitad.
2. implantación cirugía
- Esterilizar los instrumentos quirúrgicos (pinzas de punta fina, tijeras, pinzas quirúrgicas) con un esterilizador de grano caliente. Limpie todas las superficies con etanol al 70%.
- Inducir la anestesia con isoflurano de 3% en oxígeno suministrado en ~ 1 L/min.
- Para el mantenimiento, uso de 1-1.5% isoflurano. Tenga en cuenta que la concentración de isoflurano necesaria para lograr la tolerancia quirúrgica puede variar desde animal a animal.
- Tolerancia quirúrgica estable se logra cuando el animal no responde a pellizcos del dedo del pie. El ritmo de respiración del ratón y ajustar la concentración de isoflurano si es necesario.
- Aplique ungüento para los ojos del animal para evitar que se sequen.
- Montar el ratón en un marco estereotáxicas insertando barras oído suavemente en el canal auditivo. Una vez que se estabiliza la cabeza del ratón por las barras de la oreja, coloque un pedazo de boca sobre el hocico para la entrega continua del isoflurano. Coloque el ratón en toalla o cojín sobre una almohadilla de calefacción e inyecte la buprenorfina por vía subcutánea (0.05 - 0.1 mg/kg de peso corporal) para la analgesia postoperatoria.
- Afeitarse la cabeza con una afeitadora estándar y desinfectar la piel con etanol al 70%. Usando tijeras quirúrgicas, hacer una incisión en la piel a lo largo de la línea media del cráneo y abrir la piel con pinzas quirúrgicas.
- Alinear la cabeza del animal con la ayuda de una herramienta de alineación estereotáctica a nivel bregma y lambda. Debe haber menos de 50 μm de compensación de altura entre bregma y lambda. Además, la cabeza en el eje mediolateral mediante la medición de la profundidad del vértice del cráneo de la superficie en el nivel definido distancias izquierdas y derechas (por ejemplo, 1 mm a la izquierda y derecha de bregma). Ajustar la inclinación de la cabeza si es necesario.
- Limpie el cabezal con peróxido de hidrógeno 3% y secar con toallitas de algodón estéril.
- Determinar la ubicación de la craneotomía en relación a bregma usando un apropiado estereotáxicas atlas12.
- Usando una cabeza de broca de 0,9 mm, perfore dos agujeros en el hueso sobre el cerebelo para colocar tornillos referencia y tierra. Además, 1-3 agujeros para tornillos de anclajes son deseables para estabilizar el implante. La ubicación de los tornillos de anclaje dependerá de la ubicación de la craneotomía. Para su implantación en el hipocampo, coloque tornillos de anclaje sobre la corteza frontal parietal y ipsilateral contralateral. Inserte los tornillos en el hueso con un destornillador adecuado. Tenga cuidado de no para penetrar en el cerebro.
- Realizar la craneotomía enrareciendo poco a poco el cráneo con el taladro en un área rectangular alrededor del lado de la implantación. Humedecer con frecuencia el hueso con tampón de fosfato esterilizada (PB). El cráneo diluido restante puede perforado suavemente y retirar con la ayuda de una fina aguja de inyección (27G) y un par de pinzas.
- Cuidadosamente perforar la duramadre con una aguja fina (27G). Forma un pequeño gancho doblando la punta de la aguja con un par de pinzas y tire la dura para el retiro. Aplicar PB para impedir que se seque la superficie del cerebro.
- Montar la herramienta de inserción del electrodo en un portamuestras estereotáxicas, cero la sonda en bregma y mueva la sonda a las coordenadas estereotáxicas sobre la craneotomía. Penetrar lentamente en la superficie del cerebro. Asegúrese de que no doblan los ejes de la sonda. Evitar implantar a través de los vasos sanguíneos.
- Baje lentamente la sonda hasta ~ 200 μm superior la profundidad deseada. La craneotomía y la caña de la sonda de silicona con vaselina esterilizada para la protección de la cubierta. Aplique el cemento dental para corregir la base de la sonda al tornillo de anclaje en el cráneo.
- A la derecha después de la aplicación de cemento, mueva lentamente la sonda hasta la profundidad del objetivo. Avanza la última ~ 200 μm después de aplicación del cemento reduce el movimiento lateral de la sonda y asegura daño mínimo del tejido en el área de destino. Tenga en cuenta que el tiempo de curado del cemento utilizado puede influir en este paso del protocolo. Con cemento de curado rápido, omite este paso y directamente implantes la sonda a la profundidad del objetivo para evitar daños en la sonda de silicona.
- Después de que el cemento haya curado, soltar la sonda de la herramienta de inserción por la fusión de la cera con un cauterizador.
- Libere la Junta del conector del dispositivo de inserción y colocarlo en un lugar adecuado en el cráneo con una pinza de cocodrilo atada a la manija de inserción. En caso de implantación de la sonda en el hipocampo, coloque la Junta del conector en el hueso parietal contralateral. Fije la tarjeta del conector al cráneo con cemento dental.
- Suelde los cables Tierra y referencia de la Junta del conector en los cables a los tornillos sobre el cerebelo.
- Cortar la tapa a la altura correcta y colóquelo sobre la sonda de silicona. Fijar la cubierta a la placa de conector y cráneo con cemento dental, evitando la piel que rodea el cráneo expuesto. Suturar la piel alrededor del sitio de implantación generalmente no es necesario.
3. recuperación después de la cirugía
- Aplicar un tratamiento analgésico adecuado durante al menos 2 días (por ejemplo, las inyecciones subcutáneas de buprenorfina cada 6 h durante el día y en el agua potable durante la noche combinado con carprofeno (4-5 mg/kg de peso corporal) por vía subcutánea cada 24 h). Vivienda solo se recomienda para evitar daños en el implante.
- Permite al menos una semana para la recuperación. Consultar con guías locales de bienestar animal.
4. adquisición de datos
- Registro LFPs mueva libremente ratones utilizando un sistema de adquisición de datos adecuados conectado a través de un conmutador. Para adquirir LFPs, utilizar una frecuencia de muestreo de 1-5 kHz. Tasas de muestreo más altas (20-30 kHz) están necesarias si descargas unitarias son a grabar junto con la LFP.
- Almacenar archivos de grabación raw de los canales individuales para análisis fuera de línea.
5. histología
- Después de la terminación de la grabación, profundamente anestesiar el animal (por ejemplo, 2 g/kg cuerpo peso uretano inyectada por vía intraperitoneal). Confirmar el estado anestésico por la falta de respuesta a pellizcos.
- Inundar el transcardially ratón con helada salina con tampón fosfato (~ 1 min) seguida de paraformaldehído al 4% (~ 10 min) uso de métodos de perfusión intracardial estándar13. Antes de la perfusión, lesiones electrolíticas de los sitios de grabación puede ser realizada (por ejemplo, mediante la aplicación de 10-20 V de voltaje constante para hasta 1 s). Alternativamente, tintes fluorescentes aplican a las puntas de caña antes de implantación se puede utilizar para seguimiento de identificación. Se recomienda la prueba de los distintos métodos para la identificación de posiciones de los electrodos para obtener resultados óptimos con diferentes tipos de sondas de silicio.
- Cortar secciones de la cerebral (~ 100 μm) y mancha las rebanadas con 4'-6-diamidino-2-phenylindole (DAPI, 1 μg/mL) seguido de tres pasos de lavado en PB (cada 10 min a temperatura ambiente).
- Coloque las secciones en un portaobjetos de microscopio, aplique una gota de medio de inclusión y cubrir la sección con un cubreobjetos. Dejar que la incrustación medio seque durante la noche a temperatura ambiente.
- Con un epifluorescencia o microscopio de escaneo láser confocal, identificar la ubicación de los sitios de grabación.
- Para intentar la recuperación de la sonda de silicona para su uso posterior, sostenga la sonda con una pinza de cocodrilo y lanzar la sonda desde el scull derritiendo con cuidado el cemento dental con un soldador (400 ° C). ¡Tenga cuidado de no para tocar los vástagos de sondeo durante este procedimiento!
- Lavar la sonda con agua destilada caliente (~ 80 ° C, 15 min) seguida de solución enzimática (1% Tergazyme en agua destilada, 30 min a temperatura ambiente) y otro lavado en agua destilada (15 min). Tenga en cuenta que la tasa de éxito de la recuperación de la sonda es baja.
6. CSD análisis
- Un ambiente de análisis adecuado (por ejemplo, Python), convierte datos de la LFP de una caña individual al CSD por aproximación de la segunda derivada espacial a lo largo de la caña como
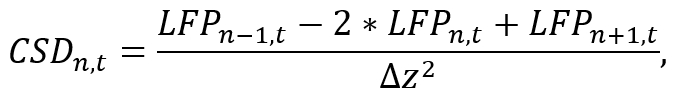
donde LFPn, t es la señal de la LFP en el electrodo deth nen el tiempo t y Δz es la distancia entre electroda. Tenga en cuenta que debido a las operaciones de n+ 1 y n-1, el CSD de los electrodos y de la caña no puede ser estimado, que tiene que ser tomado en consideración durante la colocación de la sonda. Aplicar la fórmula de aproximación usando un corto segmento de código que calcula la señal CSD para cada electrodo mientras iterando con el tiempo (ver archivo de código suplementario). - Utilice la señal obtenida del CSD para su posterior análisis (por ejemplo, estudiando las bandas de frecuencia específicas de oscilaciones del cerebro aplicando filtros band-pass).
Resultados
La figura 1 ilustra la herramienta utilizada para la implantación de sondas de silicio. Grabaciones del silicio crónicamente implantado sondas dirigidas a la zona CA1 y la capa de la célula del gránulo de la convolución del cerebro dentate se muestran en la figura 2. Grabamos LFPs de la caña de punta de prueba en movimiento libre en el homecage. Para minimizar el efecto de la conducción de volumen, las señales obtenidas f...
Discusión
Evidencias crecientes indican que las oscilaciones del cerebro en circuitos neuronales hippocampal ocurren en dominios espaciales discretos10,11,16. Análisis CSD reduce drásticamente la influencia de la conducción de volumen, un requisito previo fundamental para el estudio de eventos de oscilación local. Con este video, le ofrecemos a una guía para la implantación de sondas de silicio en el hipocampo del ratón para el an?...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Karin Winterhalter y Kerstin Semmler asistencia técnica. Este trabajo fue apoyado por el cluster de excelencia BrainLinks - BrainTools (EXC 1086) de la Fundación alemana de investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
Referencias
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados