É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Gravação espacialmente restrita oscilações no hipocampo de ratos de comportar-se
Neste Artigo
Resumo
Este protocolo descreve a gravação dos potenciais de campo local com haste multi sondas de silicone linear. Conversão de sinais usando análise de densidade atual fonte permite a reconstrução do local atividade elétrica no hipocampo do mouse. Com esta técnica, oscilações espacialmente restrita do cérebro podem ser estudadas em ratos movimentando-se livremente.
Resumo
O potencial do campo local (LFP) emerge de movimentos de íons através das membranas neurais. Desde que a tensão gravada por eletrodos LFP reflete o campo elétrico somado de um grande volume de tecido cerebral, extrair informações sobre a atividade local é um desafio. Estudando microcircuitos neuronais, no entanto, exige uma confiança distinção entre eventos verdadeiramente locais e volume-conduzido sinais originários de regiões distantes do cérebro. Análise de densidade (CSD) fonte atual oferece uma solução para este problema, fornecendo informação sobre dissipadores atuais e fontes na proximidade dos eléctrodos. Em áreas do cérebro com cytoarchitecture laminar, tais como o hipocampo, CSD unidimensional pode ser obtido, estimando-se a segunda derivada espacial da LFP. Aqui, descrevemos um método de registro multilaminar LFPs usando sondas de silicone linear implantadas no hipocampo dorsal. Vestígios CSD são calculados ao longo de hastes individuais da sonda. Assim, este protocolo descreve um procedimento para resolver espacialmente restrita rede neuronal oscilações no hipocampo de ratos movimentando-se livremente.
Introdução
Oscilações na LFP criticamente estão envolvidas no processamento pelos circuitos neuronais de informações. Eles cobrem um amplo espectro de frequências, que variam de ondas lentas (~ 1 Hz) a ondulação rápido oscilações (~ 200 Hz)1. Bandas de frequências distintas estão associadas com funções cognitivas, incluindo memória, processamento emocional e navegação2,3,4,5,6,7. Fluxo de corrente através das membranas neuronais constitui a maior parte da LFP sinal8. Cações, entrando na célula (por exemplo, através da ativação de sinapses excitatório glutamatérgico) representam um coletor atual ativo (como carga deixa o meio extracelular). Em contraste, o fluxo líquido de carga positiva para o meio extracelular, por exemplo, a ativação de sinapses inibitórias gabaérgica, retrata uma fonte de corrente ativa naquele local. Em dipolos neuronais, atuais pias estão emparelhadas com fontes passivas e vice-versa devido a correntes de carga de membrana em locais distantes de compensação.
O campo elétrico produzido por processos neurais remotos também pode resultar em desvios de tensão considerável sobre um eletrodo de gravação e, portanto, pode ser falsamente considerado como um evento local. Esta condução volume constitui um sério desafio para a interpretação dos sinais da LFP. Análise CSD fornece informações sobre o locais atuais pias e fontes subjacentes LFP sinaliza e compreende, portanto, um meio para reduzir o impacto da condução de volume8. Em laminado estruturas como o hipocampo, sinais CSD unidimensionais podem ser obtidos pela segunda derivada espacial da LFP gravado da perpendicular equidistantes eletrodos dispostos ao laminar aviões9. O advento do silicone linear comercialmente disponíveis sondas permitiu aos pesquisadores utilizam o método de CDs para o estudo da atividade de oscilação local no hipocampo. Por exemplo, foi demonstrado que oscilações gama distintos emergem de forma camada específica no CA1 área10. Além disso, a análise CSD identificou pontos independentes da atividade de gama na camada de célula principal do giro denteado11. Importante, estas conclusões foram apenas aparentes no CSD local mas não em sinais LFP. Análise de CDs, portanto, fornece uma ferramenta poderosa para ganhar a introspecção em operações de microcircuito do hipocampo.
Neste protocolo, nós fornecemos um guia completo para obter sinais CSD unidimensionais com sondas de silicone. Estes métodos irão permitir que usuários investigar eventos oscilação localizadas no hipocampo de ratos de comportamento.
Protocolo
Todos os métodos que envolvam animais vivos foram aprovados pelo Regierungspräsidium Freiburg em conformidade com o alemão Animal Welfare Act.
1. preparações
- Projetar e construir uma ferramenta de inserção adequada, transitoriamente, carregando a sonda de silicone e o conector do eletrodo durante o processo de implantação. Veja a Figura 1 para uma ferramenta de inserção construído personalizado de exemplo.
- Solte cuidadosamente o conector de sonda e eletrodo de silicone da embalagem usando pinça com ponta de cerâmica.
- Levante a placa de ligação e corrigi-lo firmemente com uma pinça de crocodilo anexada a um carrinho.
- Usando um estereoscópio, alinhe a sonda com a ferramenta de inserção com a pinça com ponta de cerâmica. Aplica uma camada de cera de parafina derretida com um cauterizador para colar a sonda para a ferramenta de inserção ~ 2 mm. Tome cuidado para não tocar as canelas de sonda durante este procedimento.
- Conserte o conector no eixo da ferramenta inserção usando fita adesiva padrão de eletrodo. Note que dependendo do fabricante, fios de terra talvez precisem ser soldado à placa de ligação de eletrodo, antes da implantação. Remova o isolamento de duas peças curtas de fio de cobre isolado de verniz usando solda estanho aplicada com um ferro de solda (400 ° C). Solde os fios do chão para os apropriado slots na placa de ligação do eletrodo.
- Remova o isolamento de duas peças adicionais de fio de cobre. Enrole cada fio de cobre desencapado, três vezes ao redor de um parafuso de aço inoxidável (1 mm de diâmetro, comprimento de 2 mm). Aplicar o fluxo adequado para soldar o aço e soldar o fio de cobre a parte inferior da tampa da parafuso. Certifique-se de que o fundo metade da rosca permanece livre de solda de estanho.
- Use um multímetro padrão para verificar se há contato elétrico entre o fio e o parafuso.
- Desinfectar as canelas da sonda de silicone e os parafusos do chão por imersão em etanol a 70% (10 s).
- Prepare uma capa protetora para o implante de sonda cortando a cabeça de uma pipeta Pasteur de plástico ao meio.
2. a implantação cirurgia
- Esterilize instrumentos cirúrgicos (tesouras, pinças de ponta fina, grampos cirúrgicos) com um esterilizador de grânulo quente. Limpe todas as superfícies com etanol a 70%.
- Induzi a anestesia com isoflurano 3% de oxigénio fornecido em ~ 1 L/min.
- Para a manutenção, use 1-1,5% de isoflurano. Observe que a concentração de isoflurano necessária para obter tolerância cirúrgica pode variar de animal para animal.
- Tolerância cirúrgica estável é alcançada quando o animal não responder ao dedo do pé-beliscar. Monitorar a taxa de respiração do rato e ajustar a concentração de isoflurano, se necessário.
- Aplica a pomada para os olhos do animal para evitar que sequem.
- Monte o mouse em uma armação estereotáxica introduzindo suavemente barras de orelha no canal auditivo. Uma vez que a cabeça do rato é estabilizada por barras de orelha, coloque um pedaço de boca sobre o focinho para entrega contínua de isoflurano. Posicione o mouse na toalha ou almofada sobre uma almofada de aquecimento e injetar buprenorfina por via subcutânea (0,05 - 0,1 mg/kg de peso corporal) para assegurar analgesia pós-operatória.
- Raspar a cabeça com uma máquina de barbear padrão e desinfectar a pele com álcool 70%. Utilizando tesouras cirúrgicas, fazer uma incisão na pele ao longo da linha média do crânio e abrir a pele usando grampos cirúrgicos.
- Alinhe a cabeça do animal com o auxílio de uma ferramenta de alinhamento estereotáxica para nível bregma e o lambda. Deve haver menos de 50 µm de deslocamento de altura entre o bregma e o lambda. Além disso, o nível a cabeça ao longo do eixo mediolateral medindo a profundidade do bregma no crânio de superfície no definido distâncias esquerdas e direita (por exemplo, 1 mm esquerda e direita do bregma). Se necessário, ajuste a inclinação da cabeça.
- Limpe a cabeça com 3% de peróxido de hidrogênio e seque com toalhitas de algodão estéril.
- Determine a localização da craniotomia em relação ao bregma usando um apropriado atlas estereotáxica12.
- Usando uma cabeça de broca de 0,9 mm, dois furos parafuso no osso sobre o cerebelo para colocar parafusos de chão e referência. Além disso, 1-3 furos para parafusos de ancoragem são desejáveis para estabilizar o implante. A localização dos parafusos de ancoragem dependerá da localização da craniotomia. Para implantação em hipocampo, coloque os parafusos de ancoragem sobre contralateral parietal e ipsilateral córtex frontal. Insira os parafusos no osso usando uma chave de fenda apropriada. Tome cuidado para não penetrar no cérebro.
- Execute a craniotomia diluindo lentamente o crânio com a broca em uma área retangular do lado de implantação. Frequentemente, umedeça o osso com tampão fosfato esterilizado (PB). O restante diluído crânio pode ser suavemente furou e removido com o auxílio de uma fina agulha de injeção (27G) e um par de pinças.
- Cuidadosamente, perfuram a dura-máter com uma fina agulha de injeção (27G). Formar um pequeno gancho, dobrando a ponta da agulha com um par de pinças e puxe a dura-máter para remoção. Aplica PB para impedir a secagem da superfície do cérebro.
- Montar a ferramenta de inserção de eletrodos em um titular estereotáxica, zero a sonda ao bregma e passar a sonda para as coordenadas estereotáxicos a craniotomia. Lentamente penetra a superfície do cérebro. Certifique-se de que não dobrar os eixos de sonda. Evite a implantação através de vasos sanguíneos.
- Abaixe lentamente a sonda até ~ 200 µm acima a profundidade desejada. Cobrir a craniotomia e shanks da sonda com vaselina esterilizada silicone para proteção. Aplique o cimento dental para fixar a base da sonda para o parafuso de ancoragem no crânio.
- Mesmo após a aplicação de cimento, mova lentamente a sonda até à profundidade de alvo. Avançando o último ~ 200 µm após aplicação do cimento reduz o movimento lateral da sonda e garante danos mínima dos tecidos na área alvo. Observe que o tempo de cura do cimento usado pode afetar esta etapa do protocolo. Com cimento de cura rapidamente, pular essa etapa e implante diretamente a sonda até à profundidade de alvo para evitar danos à sonda de silicone.
- Após o cimento tem curado, solte a sonda da ferramenta de inserção de derreter a cera com um cauterizador.
- Solte a placa de ligação do dispositivo de inserção e posicioná-lo em um local adequado no crânio usando uma pinça crocodilo associada a alça de inserção. No caso de implantação de sonda no hipocampo, coloque a placa de ligação no osso parietal contralateral. Fixe a placa de ligação no crânio usando cimento dental.
- Solde os fios terra e referência da placa de ligação para os fios ligados aos dois parafusos sobre o cerebelo.
- Guarnição da tampa protetora para a altura correta e coloque-o sobre a sonda de silicone. Fixe a capa para o conector placa e crânio usando cimento dental, evitando a pele ao redor do crânio exposta. Sutura da pele ao redor do local de implantação geralmente não é necessário.
3. a recuperação após a cirurgia
- Aplica tratamento analgésico apropriado pelo menos 2 dias (por exemplo, injecções subcutâneas de buprenorfina cada 6 h durante o dia e na água potável a noite combinada com carprofeno (4-5 mg/kg de peso corporal) por via subcutânea cada 24 h). Single-habitação é recomendado para evitar danos ao implante.
- Permitir que pelo menos uma semana para recuperação. Consulte as orientações locais de bem-estar animal.
4. aquisição de dados
- LFPs registros de ratos usando um sistema de aquisição de dados apropriado conectado através de um comutador movimentando-se livremente. Para adquirir LFPs, use uma frequência de amostragem de 1-5 kHz. Taxas de amostragem mais altas (20 a 30 kHz) são necessárias se unitárias descargas devem ser registados junto com a LFP.
- Armazenar arquivos de gravação crua dos canais individuais para análise off-line.
5. histologia
- Após a conclusão da gravação, profundamente anestesia o animal (por exemplo, 2g/kg corpo peso uretano injetado intraperitonealmente). Confirme o estado anestésico por falta de resposta aos pés de beliscar.
- Perfundir o rato transcardially com gelada fosfato salino (~ 1 min) seguido por paraformaldeído 4% (~ 10 min), usando padrão intracardíaca perfusão métodos13. Antes da perfusão, eletrolítico maciços dos sites gravação pode por executada (por exemplo, através da aplicação de 10-20 V de tensão constante para até 1 s). Alternativamente, corantes fluorescentes aplicados para as pontas da haste antes de implantação pode ser usada para controlar a identificação. Testar os diversos métodos para a identificação de posições de eletrodo para obter óptimos resultados com diferentes tipos de sondas de silicone é recomendado.
- Seções do cérebro (~ 100 µm) de corte e mancha as fatias com 4'-6-diamidino-2-phenylindole (DAPI, 1 µ g/mL) seguido por três etapas de lavagem em PB (cada 10 min à temperatura ambiente).
- Colocar as seções em um microscópio, aplicar uma gota de meio de incorporação e cobrir a seção com uma lamela. Deixe a incorporação média secar durante a noite em temperatura ambiente.
- Usando um microscópio confocal de varredura a laser ou um epifluorescência, identifica a localização dos sítios a gravação.
- Para tentar a recuperação da sonda para ainda mais o uso do silicone, segure a sonda com uma pinça de crocodilo e lançar a sonda do scull pela fusão cuidadosamente o cimento dental com um ferro de solda (400 ° C). Tome cuidado para não tocar as canelas de sonda durante este procedimento.
- Lavar a sonda em água destilada (~ 80 ° C, 15min), seguida por solução enzimática (1% Tergazyme em água destilada, 30 min à temperatura ambiente) e outra lavagem em água destilada (15 min). Note que a taxa de sucesso de recuperação de sonda é baixa.
6. CSD análise
- Usando um ambiente de análise apropriado (por exemplo, Python), converte dados de LFP de uma haste individual a CSD por aproximação a segunda derivada espacial ao longo da haste como
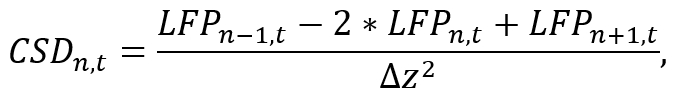
onde LFPn, t é o sinal LFP em nth eléctrodo no tempo t e Δz é do afastamento entre eletrodos inter. Note que devido as operações de n+ 1 e n-1, o CSD dos eléctrodos de primeira e últimos da haste não pode ser estimado, que tem que ser levado em consideração durante a colocação da sonda. Implemente a fórmula de aproximação usando um pequeno segmento de código que calcula o sinal CSD para cada eletrodo durante a iteração ao longo do tempo (ver arquivo de código suplementar). - Use o sinal CSD obtido para uma análise mais adicional (por exemplo, estudando bandas de frequências específicas das oscilações do cérebro através da aplicação de filtros passa-faixa).
Resultados
A Figura 1 ilustra a ferramenta de inserção utilizada para a implantação de sondas de silicone. Gravações de silício implantado cronicamente sondas segmentação da área CA1 e a camada de células grânulo de giro do pectínea são mostrados na Figura 2. Nós gravamos LFPs de Souza a sonda durante a livre circulação no homecage. Para minimizar o efeito de condução de volume, os sinais obtidos foram convertidos para CD...
Discussão
Evidências crescentes indicam que oscilações de cérebro em circuitos neuronais hippocampal ocorrem em domínios espaciais discretas10,11,16. Análise CSD reduz drasticamente a influência da condução de volume, um pré-requisito crucial para o estudo dos eventos de oscilação local. Com este vídeo, nós fornecemos um guia para implantar silicone sondas do hipocampo de rato para a análise de dados CSD. Mostramos exemplos...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Estamos gratos a Karin Winterhalter e Kerstin Semmler para assistência técnica. Este trabalho foi apoiado pelo cluster de excelência BrainLinks - BrainTools (EXC. 1086), da Fundação de pesquisa alemã.
Materiais
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
Referências
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados