Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Запись пространственно ограниченный колебания в гиппокампе поведение мышей
В этой статье
Резюме
Этот протокол описывает запись местных потенциалов поля с несколькими хвостовиком, которую Датчики линейные кремния. Преобразование сигналов с использованием текущего источника плотность анализа позволяет реконструкции местной электрической активности в гиппокампе мыши. С этой техникой колебаний пространственно ограниченных мозга могут быть изучены в свободно перемещающихся мышей.
Аннотация
Потенциал местных полей (LFP) вытекает из движения ионов через нервные мембраны. Поскольку напряжение, записанная LFP электродами отражает суммируются электрическое поле большого объема ткани головного мозга, извлечение информации о деятельности на местах является сложной задачей. Однако, изучая нейрональных микросхемы, требует надежной различие между действительно местные мероприятия и объем проведенных сигналов, поступающих в областях дистанционного мозга. Текущий анализ плотности (КУР) источник предлагает решение для этой проблемы путем предоставления информации о текущих раковины и источники вблизи электродов. В зонах мозга с ламинарные cytoarchitecture например гиппокампа одномерный кур можно получить путем оценки второй пространственная производная LFP. Здесь мы описываем метод для записи multilaminar LFPs с помощью линейной кремния зондов имплантируется в спинной гиппокампа. КУР следы вычисляются вдоль отдельных хвостовик зонда. Таким образом, этот протокол описывает процедуру решить колебаний пространственно ограниченных нейронной сети в гиппокампе свободно перемещающихся мышей.
Введение
Колебания в LFP критически участвуют в обработке нейронных цепей информации. Они охватывают широкий спектр частот, начиная от медленных волн (~ 1 Гц) до быстро пульсации колебания (~ 200 Гц)1. Различных частотных полос связаны с когнитивных функций, включая память, эмоциональной обработки и навигации2,3,4,5,6,7. Текущий поток через нейрональных мембран является самой большой частью LFP сигнал8. Вхождении в ячейку (например через глутаматергические синапсов и возбуждающим) катионов представляют активный текущий приемник (как заряд покидает внеклеточных среды). И наоборот чистый поток положительного заряда внеклеточного носитель, например путем активации ГАМК ингибирующее синапсы, изображает активный текущий источник в этом месте. В нейрональных диполей текущий раковины спарены с пассивных источников и наоборот за счет компенсации токов затрагивающих заряда мембраны на удаленных объектах.
Электрические поля, порождаемого удаленного нервные процессы могут также привести к прогибов значительное напряжение на электроде записи и может таким образом быть ложно считается локальное событие. Этот объем проводимости создает серьезную проблему для интерпретации LFP сигналов. КУР анализ предоставляет информацию о местных текущего раковины и лежащие в основе LFP источников сигналов и поэтому включает средства для сокращения воздействия объем проводимости8. В слоистых структурах, таких как гиппокамп одномерный кур сигналов может быть получено второй пространственная производная LFP, записанные с равноотстоящими электроды расположены перпендикулярно ламинарные самолеты9. Появлением коммерчески доступных линейной кремния зонды позволило исследователям использовать метод кур для изучения деятельности местных колебаний в гиппокампе. Например было продемонстрировано, что собственный гамма колебания возникают в соответствии слоя в области СА110. Кроме того кур анализ выявил независимые очаги гамма-активности в слое основных клеток зубчатой извилины11. Важно отметить, что эти выводы были только очевидными в местных кур, но не в LFP сигналов. КУР анализ таким образом предоставляет мощный инструмент, чтобы разобраться в работе микросхемы гиппокампа.
В этом протоколе мы обеспечиваем полное руководство для получения одномерных сигналов кур с зондами кремния. Эти методы позволят пользователям для расследования событий локализованных колебаний в гиппокампе себя мышей.
протокол
Все методы, связанные с living животными были одобрены Regierungspräsidium Freiburg в соответствии с Закон о благосостоянии животных немецкий.
1. Подготовка
- Спроектировать и построить соответствующие вставки инструмент, временно перевозящих зонд кремния и разъему электрода в процессе имплантации. Смотрите Рисунок 1 для инструмента Пользовательские построен вставки примера.
- Тщательно Освободите разъем датчика и электродом кремния из упаковки с использованием керамики наконечником щипцы.
- Приподнимите разъем платы и надежно закрепите зажим крокодил, придается стенд.
- С помощью стереоскоп, выровняйте зонд с инструмент вставки с наконечником Керамические щипцы. Применить ~ 2 мм слоем парафина воск растаял с cauterizer клеить зонд для средства вставки. Заботиться не коснуться хвостовик зонд во время этой процедуры.
- Исправьте разъему электрода к валу инструмент вставки с использованием стандартных липкая лента. Обратите внимание, что в зависимости от производителя, провода заземления может потребоваться быть припаян к плате разъем электрода до имплантации. Удалите изоляцию от двух коротких Теплоизоляционный лак медной проволоки с помощью олово припой применяется с паяльником (400 ° C). Припой провода заземления в соответствующие гнезда в разъем платы электрода.
- Удаление изоляции двух дополнительных кусочки медной проволоки. Оберните каждый голые медной проволоки три раза вокруг винт из нержавеющей стали (диаметром 1 мм, длиной 2 мм). Флюс для пайки стали применять и пайка медного провода в нижней части колпачок. Убедитесь, что дно, половина остается резьба бесплатно олово припой.
- Используйте стандартный мультиметр для проверки электрического контакта между проводом и винт.
- Лечить черенки зонд кремния и винтовой путем погружения в 70% этанола (10 s).
- Подготовьте защитный чехол для зондом имплант, режущая головка Пластиковая пипетка Пастера в два раза.
2. Имплантация хирургии
- Стерилизуйте хирургические инструменты (ножницы, пинцет, острым концом, хирургические зажимы) с горячей шарик стерилизатор. Протрите все поверхности на 70% спирте.
- Побудить анестезии с 3% изофлюрановая в кислороде на ~ 1 Л/мин.
- Для обслуживания используйте 1-1,5% изофлюрановая. Обратите внимание, что изофлюрановая концентрации, необходимой для достижения хирургической терпимости может варьироваться от животных животных.
- Стабильные хирургические терпимости достигается, когда животное не реагирует на мыс щипать. Контролировать частоту дыхания мыши и при необходимости отрегулировать концентрацию изофлюрановая.
- Применять мазь для глаз животного для предотвращения высыхания.
- Подключите мышь в стереотаксической рамы, аккуратно вставив уха баров в ушной канал. После того, как глава мыши стабилизируется в барах уха, поместите рот кусок морду для непрерывной изофлюрановая доставки. Наведите мышь на полотенце или колодки грелку и подкожно вводить бупренорфин (0,05 - 0,1 мг/кг массы тела) обеспечить послеоперационное обезболивание.
- Бритье головы с стандартные бритвы и дезинфекции кожи с 70% этиловом спирте. Используя Ножницы хирургические, надрезать кожу вдоль средней линии черепа и открыть кожи с помощью хирургических зажимов.
- Совместите голова животного с помощью стереотаксического выравнивание инструмент уровня bregma и лямбда. Там должно быть меньше 50 мкм высота смещение между bregma и лямбда. Кроме того уровень поверхности головы вдоль оси медиолатеральной путем измерения глубины от bregma на череп на определенные расстояния левый и правый (например, 1 мм слева и справа bregma). При необходимости, отрегулируйте его наклон головы.
- Очистить голову с 3% перекиси водорода и протрите сухой салфетки стерильные хлопка.
- Определите местоположение краниотомии по отношению к bregma, с использованием соответствующих стереотаксического Атлас12.
- С помощью буровой головки 0,9 мм, просверлите два отверстия для винтов в кости над мозжечка разместить Справочник по городу и винты. Кроме того 1-3 отверстия для крепления винтов, желательно, чтобы стабилизировать имплантат. Расположение якорь винта будет зависеть от расположения краниотомии. Для имплантации в гиппокампе поместите якорь винты контралатеральной теменной и ипсилатеральные лобной коры. Вставьте винты в кости с помощью подходящей отвертки. Будьте осторожны, не проникают в мозг.
- Выполните краниотомии, медленно истончение черепа с сверла в прямоугольную область вокруг стороне имплантации. Часто смачивают кости с стерилизованные фосфатного буфера (PB). Остальные разбавленным черепа можно аккуратно пронзил и удаляется с помощью тонкой иглой инъекции (27G) и пинцет.
- Тщательно проколоть dura mater с тонкой иглой инъекции (27G). Образуют небольшой крючок, сгибая кончик иглы с парой пинцетом и тянуть Дура для удаления. Примените PB для предотвращения высыхания поверхности мозга.
- Установите инструмент вставки электрода на стереотаксического держатель, нулевой зонд на bregma и наведите краниотомии зонд для стереотаксического координаты. Медленно проникать поверхности мозга. Убедитесь, что зонд валы не гнутся. Избегайте имплантации через кровеносные сосуды.
- Медленно опустите зонд до ~ 200 мкм выше желаемой глубины. Обложка краниотомии и хвостовик кремния зонда с стерильный вазелин для защиты. Примените стоматологического цемента, исправить основание штыря для анкерного крепления винта в черепе.
- Сразу после нанесения цемента, медленно переместить зонд целевой глубины. Продвижение Последний ~ 200 мкм, после применения цемента уменьшает бокового перемещения зонда и обеспечивает минимальный ткани повреждения в целевом районе. Обратите внимание, что время отверждения цемента используется может повлиять на этот шаг протокола. С быстрого отверждения цемента, пропустить этот шаг и непосредственно имплантата зонд в глубины цели для того, чтобы избежать повреждения кремния зонд.
- После отверждения цемента, отпустите зонда от инструмента вставки путем плавления воска с cauterizer.
- Освободить разъем платы от вставки устройства и поместите его в подходящее место на череп, используя Зажим крокодил, вложен в дескриптор вставки. В случае имплантации зонд в гиппокампе место разъем платы на контралатеральной теменной кости. Закрепляют соединитель Правлению черепа с использованием стоматологического цемента.
- Припой провода Справочник по городу и правления соединитель проводов прилагаемом к два винта над мозжечка.
- Trim защитную крышку на нужной высоте и поместите его над кремния зонд. Закрепите крышку разъема платы и с использованием стоматологического цемента, избегая кожи вокруг подвергаются череп черепа. Ушивание кожи вокруг имплантации сайта обычно не требуется.
3. восстановление после операции
- Применять соответствующие болеутоляющее лечение для минимум 2 дня (например , подкожной инъекции бупренорфина каждые 6 ч в дневное время и в питьевой воде на ночь в сочетании с carprofen (4-5 мг/кг массы тела) подкожно каждые 24 ч). Одноместный жилье рекомендуется для предотвращения повреждения имплантата.
- Позвольте по крайней мере одной недели для восстановления. Проконсультируйтесь с местными животными руководящими принципами.
4. сбор данных
- Запись LFPs от свободно перемещающихся мышей с использованием системы сбора подходящих данных, подключенных через коммутатор. Чтобы приобрести LFPs, используется частота дискретизации 1-5 кГц. Если единичного сбросы должны быть записаны наряду с LFP требуются более высокие коэффициенты выборки (20-30 кГц).
- Хранить файлы raw записи отдельных каналов для анализа в автономном режиме.
5. гистология
- После завершения записи глубоко анестезировать животного (например 2 г/кг тела вес уретана вводили внутрибрюшинно). Подтвердите состояние цистит, отсутствие реакции на носок щипать.
- Perfuse transcardially мыши с ледяной фосфат амортизированное saline (~ 1 мин) следуют параформальдегида 4% (~ 10 мин) с помощью стандартных intracardial перфузии методы13. Перед перфузии, электролитическое lesioning записи сайтов могут выступали (например , применяя 10-20 V постоянного напряжения до 1 s). В качестве альтернативы флуоресцентных красителей применяется к хвостовик советы до имплантации может использоваться для отслеживания идентификации. Рекомендуется использовать различные методы для определения расположения электродов для получения оптимальных результатов с различными типами ПЭП кремния тестирования.
- Вырезать мозг секций (~ 100 мкм) и пятен ломтики с 4'-6-diamidino-2-phenylindole (DAPI, 1 мкг/мл) следуют три Стиральная шаги в PB (каждый 10 мин при комнатной температуре).
- Место разделы на микроскопа, нанесите каплю встраивания среднего и охватывают раздел с крышки выскальзования. Пусть внедрения средних высушивается на ночь при комнатной температуре.
- С помощью эпифлуоресцентного или конфокальный лазерный сканирующий микроскоп, определите местоположение записи сайтов.
- Попытка восстановления кремния зонда для дальнейшего использования, удерживайте зонд с Зажим крокодил и освободить зонд из черепа, тщательно плавления стоматологического цемента с паяльником (400 ° C). Заботиться, чтобы не коснуться хвостовик зонд во время этой процедуры!
- Мыть зонд в горячей дистиллированной воды (~ 80 ° C, 15 мин) следуют ферментативные раствор (1% Tergazyme в дистиллированной воде, 30 мин при комнатной температуре) и другой Стиральная шаг в дистиллированной воде (15 мин). Обратите внимание, что успешность восстановления зонд является низким.
6. КУР анализ
- Использование подходящих анализа окружающей среды (например Python), конвертировать LFP данных отдельных хвостовика кур путем аппроксимации второй пространственная производная вдоль хвостовика как
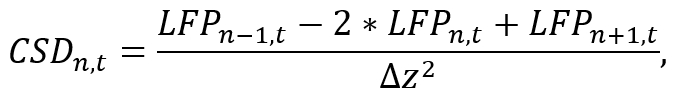
где LFPn, t LFP сигнал на электроде n-й в момент времени t и Δz является расстояние между электродами. Обратите внимание, что благодаря n-1 и n+ 1 операции, кур первый и последний электродов хвостовика не могут быть оценены, который должен приниматься в рамках рассмотрения во время зонд размещение. Реализуйте приближение формулу, используя короткий сегмент кода, вычисляющего кур сигнала для каждого электрода во время итерации по времени (см. дополнительный файл кода). - Используйте полученный сигнал кур для дальнейшего анализа (например, изучение конкретных частот колебаний мозга, применяя полосовые фильтры).
Результаты
Рисунок 1 иллюстрирует вставки инструмент, используемый для имплантации ПЭП кремния. Записи с хронически имплантированных кремниевых датчиков ориентации области СА1 и гранул слоя клеток зубчатой извилины показаны на рисунке 2. Мы запи?...
Обсуждение
Все свидетельства указывают, что колебания мозга в гиппокампе нейронных цепей происходят в дискретных пространственных домены10,11,16. Анализ кур резко уменьшает влияние объема проводимости, решающим условием для изучения местных колеб...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарны Винтерхальтер Карин и Керстин Семмлер для оказания технической помощи. Эта работа была поддержана кластера передового опыта BrainLinks - BrainTools (EXC 1086) немецкого фонда научных исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
Ссылки
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены