Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Aufzeichnung von räumlich eingeschränkt Schwingungen im Hippocampus Verhalten der Mäuse
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Aufzeichnung des lokalen Feldes Potentiale mit Multi-Schaft, die lineare Silicon-Sonden. Umwandlung der Signale mit Hilfe der aktuellen Quelle dichteanalyse ermöglicht die Rekonstruktion der lokalen elektrischen Aktivität im Hippocampus Maus. Mit dieser Technik können räumlich begrenzten Gehirn Schwingungen frei beweglichen Mäusen untersucht werden.
Zusammenfassung
Das lokale Feld-Potenzial (LFP) ergibt sich aus Ionen-Bewegungen über neuronalen Membranen. Da die Spannung von LFP-Elektroden erfasst das summierte elektrische Feld eine große Menge von Hirngewebe widerspiegelt, ist die Gewinnung von Informationen über lokale Aktivitäten eine Herausforderung. Studium der neuronale Mikroschaltungen, erfordert jedoch eine sichere Unterscheidung zwischen wirklich lokale Veranstaltungen und Volumen durchgeführt Signale mit Ursprung in fernen Hirnregionen. Aktuelle Quelle Dichte (CSD) Analyse bietet eine Lösung für dieses Problem durch die Bereitstellung von Informationen über aktuelle Senke und Quelle in der Nähe der Elektroden. In Hirnarealen mit laminarer Cytoarchitecture wie Hippocampus erhalten Sie eindimensionale CSD durch Schätzung der zweiten räumliche Ableitung von der LFP. Hier beschreiben wir eine Methode zur Aufzeichnung Multilaminar drängendere mit linearen Silizium-Sonden in den dorsalen Hippocampus implantiert. CSD-Spuren werden auf einzelne Ableger der Sonde berechnet. Dieses Protokoll beschreibt somit ein Verfahren um räumlich begrenzten neuronalen Netzes Schwingungen im Hippocampus von frei beweglichen Mäuse zu beheben.
Einleitung
Schwingungen in die LFP engagieren sich kritisch in Informationsverarbeitung durch neuronale Schaltkreise. Sie decken ein breites Spektrum an Frequenzen, von langsamen Wellen (~ 1 Hz) bis hin zu schnellen Wellen Schwingungen (~ 200 Hz)1. Unterschiedliche Frequenzbänder sind verbunden mit kognitiven Funktionen, einschließlich Gedächtnis, emotionale Verarbeitung und Navigation2,3,4,5,6,7. Stromfluss über neuronalen Membranen bildet den größten Teil des LFP Signal8. Kationen in der Zelle (z.B. durch Aktivierung der erregenden glutamatergen Synapsen) stellen eine aktive Stromsenke (da kostenlos das extrazelluläre Medium verlässt). Im Gegensatz dazu zeigt net Fluss der positiven Ladung auf das extrazelluläre Medium, z. B. durch Aktivierung des Gabaergen hemmenden Synapsen, eine aktive Stromquelle an dieser Stelle. In neuronalen Dipole sind Stromsenken mit passiven Quellen gepaart, aufgrund der Strömungen beeinflussen Membran kostenlos an entfernten Standorten zu kompensieren.
Das elektrische Feld durch neuronale Remoteprozessen produziert auch beträchtliche Spannung Durchbiegungen auf einer Aufnahme Elektrode führen kann und somit fälschlicherweise als ein lokales Ereignis angesehen werden könnte. Dieses Volumen-Leitung stellt eine ernste Herausforderung für die Interpretation der LFP-Signale. CSD-Analyse gibt Auskunft über lokale Stromsenken und Quellen zugrunde liegenden LFP signalisiert und umfasst daher ein Mittel zur Verringerung der Auswirkungen der Band Leitung8. In laminierte Strukturen wie der Hippocampus erhalten Sie durch die zweite räumliche Ableitung von der LFP, aufgenommen von Äquidistanten Elektroden angeordnet senkrecht bis laminar Flugzeuge9eindimensionale CSD-Signale. Das Aufkommen von im Handel erhältlichen linearen Silizium Sonden ermöglichte Forscher, die CSD-Methode für das Studium der lokalen Schwingung Aktivität im Hippocampus zu nutzen. Beispielsweise wurde nachgewiesen, dass unterschiedliche Gamma Schwingungen in eine Schicht-spezifisch in die CA1 Bereich10entstehen. Darüber hinaus hat CSD Analyse unabhängige Hot Spots der Gamma-Aktivität in den wichtigsten Zellschicht der dentate Gyrus11identifiziert. Wichtig ist, waren diese Ergebnisse nur in lokalen CSD aber nicht im LFP-Signale erkennbar. CSD-Analyse liefert somit ein mächtiges Werkzeug um Einblick in die batteriegestützte Operationen des Hippocampus.
In diesem Protokoll bieten wir einen umfassenden Leitfaden um eindimensionale CSD-Signale mit Silizium-Sonden zu erhalten. Diese Methoden ermöglichen Benutzern, lokalisierte Oszillation Ereignisse im Hippocampus von Mäusen, Verhalten zu untersuchen.
Protokoll
Alle Methoden, bei denen lebende Tiere sind durch das Regierungspräsidium Freiburg im Einklang mit dem deutschen Tierschutzgesetz genehmigt worden.
1. Vorbereitungen
- Entwerfen Sie und erstellen Sie eine entsprechende einsatzwerkzeug vorübergehend tragen die Silizium-Sonde und der Elektrode Stecker während des Prozesses der Implantation. Siehe Abbildung 1 für ein Beispiel benutzerdefinierte gebaute einsatzwerkzeug.
- Lösen Sie vorsichtig die Silizium Sonde und Elektrode Connector aus der Verpackung mit Keramik Spitzen Pinzette.
- Heben Sie die Anschlussplatine und sicher befestigen Sie es mit einem Krokodil-Klemme an einem Ständer befestigt.
- Verwenden ein Stereoskop, richten Sie die Sonde mit dem Einsetzwerkzeug mit Keramik-bestückte Zangen. ~ 2 mm Auftragen von Paraffinwachs geschmolzen mit einer linken, die Sonde auf das einsatzwerkzeug zu kleben. Achten Sie darauf, nicht um die Sonde Shanks während dieses Vorgangs zu berühren.
- Fixieren Sie die Elektrode-Connector an der Welle das einsatzwerkzeug mit standard Klebeband. Beachten Sie, dass je nach Hersteller, Massekabel müssen die Anschlussplatine Elektrode vor der Implantation verlötet werden könnte. Entfernen Sie die Isolierung von zwei kurze Stücke von Lack-isolierten Kupferdraht mit Lötzinn mit einem Lötkolben (400 ° C) angewendet. Löten Sie das Massekabel an die entsprechenden Schlitze in der Elektrode Anschlussplatine.
- Entfernen Sie die Isolierung von zwei zusätzliche Stücke des kupfernen Drahtes. Wickeln Sie jeden blanken Kupferdraht dreimal um eine Edelstahlschraube (1 mm Durchmesser, 2 mm Länge). Gelten Sie Flussmittel zum Löten von Stahl geeignet und Löten Sie den Kupferdraht an der Unterseite des Schraubverschlusses. Stellen Sie sicher, dass die untere Hälfte des Schraubengewindes bleibt von Zinn frei.
- Verwenden Sie ein standard-Multimeter für elektrische Kontaktierung zwischen Draht und Schrauben zu überprüfen.
- Desinfizieren Sie die Schäfte der Silizium-Sonde und den Boden Schrauben durch Eintauchen in 70 % igem Ethanol (10 s).
- Bereiten Sie eine Schutzhülle für das Implantat Sonde durch den Kopf eines Kunststoffs Pasteurpipette in zwei Hälften schneiden.
2. Implantation Operation
- Sterilisieren Sie chirurgische Instrumente (Schere, feine Spitze Pinzetten, chirurgische Klemmen) mit einem heißen Perle Sterilisator. Wischen Sie alle Oberflächen mit 70 % Ethanol.
- Anästhesie mit Isofluran 3 % Sauerstoff geliefert bei ~ 1 L/min zu induzieren.
- Verwenden Sie für die Wartung 1-1,5 % Isofluran. Beachten Sie, dass die Isofluran-Konzentration erforderlich, um chirurgische Toleranz zu erreichen von Tier zu Tier unterschiedlich sein kann.
- Stabile chirurgische Toleranz wird erreicht, wenn das Tier reagiert nicht auf Zeh kneifen. Die Atemfrequenz der Maus zu überwachen und ggf. die Konzentration von Isofluran.
- Wenden Sie Salbe auf das Tier Augen Austrocknen zu verhindern.
- Montieren Sie die Maus in einem stereotaktischen Rahmen durch sanft Ohr Bars in den Gehörgang einführen. Sobald der Kopf der Maus durch die Ohr-Balken stabilisiert wird, platzieren Sie ein Mundstück über die Schnauze für kontinuierliche Isofluran Lieferung. Platzieren Sie den Mauszeiger über ein Heizkissen auf Handtuch oder Pad und Buprenorphin subkutan zu injizieren (0,05 - 0,1 mg/kg Körpergewicht) um postoperative Analgesie zu gewährleisten.
- Rasieren Sie den Kopf mit einem standard Rasierer zu und Desinfizieren Sie die Haut mit 70 % Ethanol. Chirurgische Scheren, einen Einschnitt in die Haut entlang der Mittellinie des Schädels und die Haut mit chirurgischen Klammern öffnen.
- Richten Sie den Kopf des Tieres mit Hilfe von einer stereotaktischen Alignment-Tool zur Ebene Bregma und Lambda. Es sollte weniger als 50 µm Höhenversatz zwischen Bregma und Lambda. Darüber hinaus definiert Ebene, die den Kopf entlang der Mediolateral Achse durch Messung der Tiefe von Bregma am Schädel an der Oberfläche Abstände Links und rechts (z. B. 1 mm Links und rechts der Bregma). Stellen Sie die Neigung des Kopfes, bei Bedarf.
- Reinigen Sie den Kopf mit 3 % Wasserstoffperoxid und mit sterilen Baumwolle Tücher wischen Sie trocken.
- Bestimmen Sie den Speicherort der die Kraniotomie relativ Bregma mit einer entsprechenden stereotaktischen Atlas12.
- Bohren Sie mit einem 0,9 mm Bohrkopf, zwei Schraubenlöcher in den Knochen über das Kleinhirn, Boden und Referenz Schrauben zu platzieren. Darüber hinaus sind 1-3 Löcher für Verankerung Schrauben wünschenswert, das Implantat zu stabilisieren. Die Lage des Ankerschrauben richtet sich nach den Speicherort der die Kraniotomie. Platzieren Sie für die Implantation in Hippocampus Ankerschrauben über kontralateralen parietalen und ipsilateral frontalen Kortex. Stecken Sie die Schrauben in den Knochen mit einem geeigneten Schraubendreher. Achten Sie darauf, nicht in das Gehirn eindringen.
- Durchführen Sie die Kraniotomie durch langsam Ausdünnung des Schädels mit dem Bohrer in einem rechteckigen Bereich um die Implantation Seite. Befeuchten Sie häufig die Knochen mit steriler Phosphatpuffer (PB). Die verbleibenden ausgedünnte Schädel kann sanft durchbohrt und mit Hilfe einer feinen (27G) Injektionsnadel und Pinzette entfernt.
- Die Dura Mater sorgfältig mit einer dünnen Injektionsnadel (27G) durchstoßen. Bilden Sie einen kleinen Haken durch die Spitze der Nadel mit einer Pinzette biegen und ziehen Sie die Dura für die Entfernung. Gelten Sie PB um die Gehirn-Oberfläche Austrocknen verhindert wird.
- Das einsatzwerkzeug Elektrode auf einem stereotaktischen Halter montieren, NULL die Sonde am Bregma, und bewegen Sie die Sonde in der stereotaktischen Koordinaten über die Kraniotomie. Dringen Sie langsam in die Oberfläche des Gehirns. Stellen Sie sicher, dass die Sonde Wellen nicht biegen. Implantation durch Blutgefäße zu vermeiden.
- Senken Sie langsam die Sonde bis ~ 200 µm über die gewünschte Tiefe. Decken Sie die Kraniotomie und Ableger der Silizium-Sonde mit sterilisierter Vaseline für Schutz. Wenden Sie dental Zement um die Basis der Sonde auf die Verankerung Schraube in den Schädel zu beheben.
- Gerade nach dem Zement auftragen, langsam bewegen der Sonde auf die Solltiefe. Voran die letzten ~ 200 µm nach Anwendung des Zements seitliche Bewegung der Sonde reduziert und sorgt für minimalen Gewebeschädigung im Zielgebiet. Beachten Sie, dass die Aushärtezeit des Zements verwendet diesen Schritt des Protokolls auswirken kann. Überspringen Sie mit schnell heilen Zement diesen Schritt und Implantat direkt die Sonde die Zieltiefe zur Vermeidung von Schäden an der Silizium-Sonde.
- Nachdem der Zement ausgehärtet ist, lassen Sie die Sonde aus dem Einsetzwerkzeug durch Schmelzen des Wachses mit einem linken.
- Lassen Sie die Anschlussplatine vom Gerät einfügen und positionieren Sie es an einem geeigneten Ort auf den Schädel mit einem Krokodil Klemme an der Einfügemarke Griff befestigt. Im Falle einer Sonde Implantation in den Hippocampus setzen Sie die Connector-Platine am kontralateralen Parietal Knochen. Befestigen Sie die Anschlussplatine an den Schädel mit dental Zement.
- Löten Sie Boden und Referenz Drähten Connector Board an den Seilen über das Kleinhirn, die zwei Schrauben befestigt.
- Schneiden Sie die Schutzabdeckung auf die richtige Höhe und legen Sie es über die Silizium-Sonde. Befestigen Sie die Abdeckung auf der Anschlussplatine und Schädel mit dental Zement, die Haut um den exponierten Schädel zu vermeiden. Nähen die Haut um den Implantationsort ist in der Regel nicht erforderlich.
3. Erholung nach der Operation
- Wenden Sie geeignete schmerzstillende Behandlung für mindestens 2 Tage (z. B. subkutane Injektionen von Buprenorphin alle 6 h tagsüber und im Trinkwasser über Nacht mit Carprofen (4-5 mg/kg Körpergewicht) subkutan alle 24 h kombiniert). Single-Gehäuse wird empfohlen, um Schäden an das Implantat.
- Mindestens eine Woche für die Wiederherstellung zu ermöglichen. Wenden Sie sich an lokalen Tierschutzrichtlinien.
4. Datenerfassung
- Rekord drängendere von frei beweglichen Mäuse verwenden ein passende Datenerfassungssystem, verbunden durch einen Kommutator. Drängendere erwerben, verwenden Sie eine Abtastfrequenz von 1 bis 5 kHz. Höhere Abtastraten (20-30 kHz) sind erforderlich, wenn Monoblock-Entladungen sind zusammen mit der LFP aufgezeichnet werden.
- Speichern Sie raw-Aufnahme-Dateien der einzelnen Kanäle für offline-Analyse.
5. Histologie
- Nach Abschluss der Aufnahme tief betäuben des Tieres (z.B. 2 g/kg Körper Gewicht Urethan injiziert intraperitoneal). Bestätigen Sie die Narkose Zustand durch mangelnde Reaktion bis zu den Zehen kneifen.
- Durchspülen Sie die Maus-Transcardially mit eiskalten Phosphat-gepufferte Kochsalzlösung (~ 1 min) gefolgt von 4 % Paraformaldehyd (~ 10 min) mit standard Intracardial Perfusion Methoden13. Vor Perfusion, elektrolytische schädigendes der Aufnahme Websites möglicherweise durch durchgeführt (z. B. durch die Anwendung von 10-20 V der Konstante Spannung für bis zu 1 s). Alternativ Fluoreszenzfarbstoffen auf den Schaft Tipps angewendet, bevor Implantation verwendet werden kann, um Identifikation zu verfolgen. Testen die verschiedenen Methoden zur Identifizierung von Elektrodenpositionen, optimale Ergebnisse mit verschiedenen Arten von Silizium-Sonden zu erzielen wird empfohlen.
- Schneiden Sie Gehirn-Abschnitte (~ 100 µm) und Färben Sie die Scheiben mit 4'-6-Diamidino-2-Phenylindole (DAPI, 1 µg/mL) gefolgt von drei Waschschritten in PB (jede 10 min bei Raumtemperatur).
- Die Abschnitte auf einen Objektträger zu platzieren, geben Sie einen Tropfen der Einbettung von Medium und Abdeckprofil mit einem Deckglas. Lassen Sie die einbettende mittlere über Nacht trocknen bei Raumtemperatur.
- Mit einem Epifluoreszenz oder konfokale Laserscanning-Mikroskop, den Standort der Aufnahme Websites identifizieren.
- Zur Wiederherstellung der Silizium-Sonde für die weitere Verwendung zu versuchen, halten Sie die Sonde mit einem Krokodil-Klemme und lassen Sie die Sonde aus dem Schädel durch sorgfältig Schmelzen des dental Zements mit einem Lötkolben (400 ° C). Achten Sie darauf, nicht um die Sonde Shanks während dieses Vorgangs zu berühren!
- Waschen Sie die Sonde in heißes destilliertes Wasser (~ 80 ° C, 15 min), gefolgt von enzymatischen Lösung (1 % Tergazyme in destilliertem Wasser, 30 min bei Raumtemperatur) und ein weiteres waschen Schritt in destilliertem Wasser (15 min). Beachten Sie, dass die Erfolgsquote bei der Sonde Wiederherstellung niedrig ist.
6. CSD-Analyse
- Mit Hilfe einer geeigneten Analyseumgebung (z.B. Python), konvertieren LFP Daten von einer einzelnen Schaft zum CSD durch Annäherung an die zweite räumliche Ableitung entlang des Schafts als
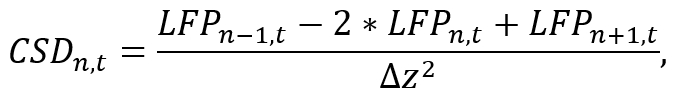
wo LFPn, t ist die LFP-Signal auf die n-th -Elektrode zum Zeitpunkt t und ΔZ ist der Abstand zwischen Elektrode. Beachten Sie, dass aufgrund der n-1 und n+ 1-Operationen, der CSD der ersten und letzten Elektroden des Schaftes abgeschätzt werden kann, die unter Berücksichtigung während der Platzierung der Sonde werden muss. Implementieren der Näherungsformel mit ein kurzes Segment des Codes, die das CSD-Signal für jede Elektrode während der Iteration über Zeit (siehe ergänzende Codedatei) berechnet. - Verwenden Sie die erhaltenen CSD-Signal für weitere Analysen (z. B. Studium bestimmte Frequenzbänder des Gehirns Schwingungen durch Anwendung der Bandpass-Filter).
Ergebnisse
Abbildung 1 zeigt das einsatzwerkzeug für die Implantation von Silizium-Sonden verwendet. Aufnahmen von chronisch implantierten Silizium-Sonden Ausrichtung der CA1-Region und das Granulat Zellschicht von dentate Gyrus sind in Abbildung 2dargestellt. Während der freien Bewegung in der Homecage verzeichneten wir drängendere aus der Sonde-Ableger. Um die Wirkung der Lautstärke Wärmeleitung zu minimieren, wurden die erhaltenen S...
Diskussion
Zunehmende Beweise zeigen, dass Gehirn Schwingungen in hippocampal neuronalen Schaltkreisen in diskreten räumlichen Bereichen10,11,16auftreten. CSD-Analyse reduziert drastisch den Einfluss der Lautstärke Wärmeleitung, eine entscheidende Voraussetzung für das Studium der lokalen Schwingung Veranstaltungen. Mit diesem Video stellen wir eine Anleitung zur Maus Hippocampus für die Analyse von CSD Daten Silizium Sonden implantie...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir sind dankbar, Karin Winterhalter und Kerstin Semmler für technische Hilfe. Diese Arbeit wurde durch des Exzellenzclusters BrainLinks - BrainTools (EXC 1086) von der Deutschen Forschungsgemeinschaft unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Crocodile clamp with stand | Reichelt Elektronik | HALTER ZD-10D | |
| Silicon probe | Cambridge Neurotech | P-series 32 | |
| Stereoscope | Olympus | SZ51 | |
| Varnish-insulated copper wire | Bürklin Elektronik | 89 F 232 | |
| Ground screws | Screws & More GmbH (screwsandmore.de) | DIN 84 A2 M1x2 | |
| Flux | Stannol | 114018 | |
| Ceramic-tipped forceps | Fine Science Tools | 11210-60 | |
| Paraffine Wax | Sigma-Aldrich | 327204 | |
| Cauterizer | Fine Science Tools | 18010-00 | |
| Soldering iron | Kurtz Ersa | OIC1300 | |
| Multimeter | Uni-T | UT61C | |
| Ethanol | Carl Roth | 9065.1 | |
| Pasteur pipettes | Carl Roth | EA65.1 | |
| Heat sterilizer | Fine Science Tools | 18000-45 | |
| Stereotaxic frame | David Kopf | Model 1900 | |
| Stereotaxic electrode holder | David Kopf | Model 1900 | |
| Isoflurane | Abbvie | B506 | |
| Oxygen concentrator | Respironix | 1020007 | |
| Buprenorphine | Indivior UK Limited | ||
| Electrical shaver | Tondeo | Eco-XS | |
| Heating pad | Thermolux | 463265/-67 | |
| Surgical clamps | Fine Science Tools | 18050-28 | |
| Hydrogen peroxide | Sigma-Aldrich | H1009 | |
| Sterile cotton wipes | Carl Roth | EH12.1 | |
| Drill | Proxxon | Micromot 230/E | |
| 21G injection needle | B. Braun | 4657527 | |
| Phosphate buffer/phosphate buffered saline | |||
| Stereotaxic atlas | Elsevier | 9.78012E+12 | |
| Surgical scissors | Fine Science Tools | 14094-11 | |
| Surgical forceps | Fine Science Tools | 11272-40 | |
| 27G injection needles | B. Braun | 4657705 | |
| Vaseline | |||
| Dental cement | Sun Medical | SuperBond T&M | |
| Carprofen | Zoetis | Rimadyl 50mg/ml | |
| Recording amplifier | Intan Technologies | C3323 | |
| USB acquisition board | Intan Technologies | C3004 | |
| Recording cables | Intan Technologies | C3216 | |
| Electrical commutator | Doric lenses | HRJ-OE_FC_12_HARW | |
| Acquisition software | OpenEphys (www.open-ephys.org) | GUI | allows platform-independent data acquisition |
| Computer for data acquisition | |||
| Analysis environment | Python (www.python.org) | allows platform-independent data analysis | |
| Urethane | Sigma-Aldrich | ||
| Vibratome | Leica | VT1000 | |
| Microscope slides | Carl Roth | H868.1 | |
| Cover slips | Carl Roth | H878.2 | |
| Embedding medium | Sigma-Aldrich | 81381-50G | |
| Distilled water | Millipore | Milli Q | Table-top machine for the production of distilled water |
| Tergazyme | Alconox | Tergazyme |
Referenzen
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Keefe, J., Recce, M. L. Phase relationship between hippocampal place units and the EEG theta rhythm. Hippocampus. 3 (3), 317-330 (1993).
- Benchenane, K., et al. Coherent theta oscillations and reorganization of spike timing in the hippocampal-prefrontal network upon learning. Neuron. 66 (6), 921-936 (2010).
- Jadhav, S. P., Kemere, C., German, P. W., Frank, L. M. Awake hippocampal sharp-wave ripples support spatial memory. Science. 336 (6087), 1454-1458 (2012).
- Yamamoto, J., Suh, J., Takeuchi, D., Tonegawa, S. Successful execution of working memory linked to synchronized high-frequency gamma oscillations. Cell. 157 (4), 845-857 (2014).
- Karalis, N., et al. 4-Hz oscillations synchronize prefrontal-amygdala circuits during fear behavior. Nature Neuroscience. 19 (4), 605-612 (2016).
- Khodagholy, D., Gelinas, J. N., Buzsáki, G. Learning-enhanced coupling between ripple oscillations in association cortices and hippocampus. Science. 358 (6361), 369-372 (2017).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13 (6), 407-420 (2012).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomena. Physiological Reviews. 65 (1), 37-100 (1985).
- Lasztóczi, B., Klausberger, T. Layer-specific GABAergic control of distinct gamma oscillations in the CA1 hippocampus. Neuron. 81 (5), 1126-1139 (2014).
- Strüber, M., Sauer, J. -. F., Jonas, P., Bartos, M. Distance-dependent inhibition facilitates focality of gamma oscillations in the dentate gyrus. Nature Communications. 8 (1), 758 (2017).
- Franklin, K. B. J., Paxinos, G. . The mouse brain in stereotaxic coordinates. , (2007).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kajikawa, Y., Schroeder, C. E. How local is the local field potential?. Neuron. 72 (5), 847-858 (2011).
- Berens, P., Keliris, G. A., Ecker, A. S., Logothetis, N. K., Tolias, A. S. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex. Frontiers in Neuroscience. 2 (2), 199-207 (2008).
- Lastóczi, B., Klausberger, T. Distinct gamma oscillations in the distal dendritic field of the dentate gyrus and the CA1 area of mouse hippocampus. Brain Structure and Function. 222 (7), 3355-3365 (2017).
- Nguyen Chi, V., Müller, C., Wolfenstetter, T., Yanovsky, Y., Draguhn, A., Tort, A. B. L., Brankačk, J. Hippocampal respiration-driven rhythm distinct from theta oscillations in awake mice. Journal of Neuroscience. 36 (1), 162-177 (2016).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Scientific Reports. 7 (1), 2773 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten