Method Article
Métodos para el descubrimiento de nuevos compuestos modular un Receptor del ácido Gamma - Aminobutírico tipo una neurotransmisión
En este artículo
Resumen
Aquí, presentamos protocolos para descubrir compuestos activos en los receptores GABAA , de la Unión a la fisiología y la farmacología.
Resumen
Presenta manuscrito un protocolo paso a paso para la detección de compuestos en gamma-aminobutírico ácido tipo un receptores (GABAA) y su uso hacia la identificación de nuevas moléculas en ensayos preclínicos de un recombinante en vitro receptor para sus efectos farmacológicos en receptores nativos en rebanadas de cerebro de roedor. Para compuestos de enlace en el sitio de benzodiazepinas de los receptores, el primer paso es configurar una pantalla principal que consiste en desarrollar ensayos de atascamiento radioligand sobre las membranas celulares que expresan los subtipos principales de GABAA . Entonces, aprovechando la expresión heteróloga de los receptores GABAA roedores y humanos en oocytes del Xenopus o células de HEK 293, es posible explorar en estudios electrofisiológicos, las propiedades fisiológicas diferentes del receptor de la subtipos y las propiedades farmacológicas de los compuestos identificados. El sistema del oocyte del Xenopus , se presentará a partir del aislamiento de los ovocitos y la microinyección con mRNAs diferentes, hasta la caracterización farmacológica con pinzas de voltaje de dos electrodos. Finalmente, se describirán grabaciones realizadas en rebanadas de cerebro de roedor que se utilizan como una prueba fisiológica secundaria para evaluar la actividad de las moléculas de sus receptores nativos en un circuito neuronal bien definido. Grabaciones extracelulares utilizando las respuestas de la población de neuronas múltiples se demuestran junto con la aplicación de la droga.
Introducción
Aquí, presentamos protocolos para el descubrimiento de compuestos activos en los receptores GABAA , de la Unión a la fisiología y la farmacología. En la búsqueda de nuevas moléculas específicas para los receptores GABAA , es crucial definir, tan precisamente como sea posible, el subtipo de interés y la evaluación de la especificidad de los compuestos recién identificados (por ejemplo, para una revisión, ver Rudolph y Knoflach1o Sieghart2). Una trayectoria típica en el descubrimiento de medicamentos y los pasos que deben realizarse se ilustran en la figura 1.
Ensayos de Unión han sido y son utilizados en gran parte como el primer paso en el descubrimiento de medicamentos. En el caso de los receptores GABAA , que están optimizadas para identificar compuestos que se unen al sitio de unión de benzodiazepinas de los receptores donde se unen las drogas terapéuticamente útiles y seguras. Otras técnicas, utilizando fluorométrico imagen placa lector (FLIPR) membrana potenciales ensayos de tinte rojo3, detectan compuestos como barbitúricos que se unen a otros sitios que son menos deseables debido a su perfil de efectos secundarios no deseado. Además, los tintes utilizados pueden activar directamente los receptores GABAA , cuestionando así la utilidad de estos análisis para drogas discovery4. Enlace ensayos sólo puede proporcionar la evidencia de que un determinado compuesto puede enlazar a una clase de receptor específico. In vitro ensayos con las membranas celulares se utilizan para identificar selectivo GABAA de ligandos de receptor humanos α5β3γ2. Células HEK293 transitorio transfected expresando el humano GABAA α5β3γ2, α1β3γ2, α2β3γ2 y α3β3γ2 receptores se utilizan para preparar las membranas para estos ensayos. El efecto de los ligandos se detecta midiendo el centelleo de [3H] flumazenil a los receptores de membrana (una inhibición de la Unión de [3H] flumazenil). La principal ventaja de esta técnica es que se facilite una rápida y eficaz determinación de la afinidad de compuestos en el receptor de interés en el receptor de interés.
Los estudios funcionales son esenciales para evaluar la actividad funcional de los compuestos y proponer una explicación fisiológica y farmacológica de los mecanismos causado por el atascamiento de los compuestos a los receptores. Hoy en día, es conocido que los receptores GABAA funcional resultan de la Asamblea de cinco subunidades alrededor de un eje de pseudosymmetry formado por el poro iónico y resultado de la Asamblea de cinco subunidades idénticas. La mayoría de los receptores GABAA se compone de dos o más subunidades diferentes. El receptor principal cerebro GABAA , por ejemplo, se compone de las subunidades α1, β2 y γ2 en una estequiometría de 1, 2 y 2 respectivamente5,6. Una reconstitución en un sistema host como la Xenopus ovocitos o células HEK293 ofrece la posibilidad de explorar rápidamente las propiedades farmacológicas de los receptores.
Luego se exploran las propiedades farmacológicas de los compuestos con registros extracelulares en rebanadas de cerebro7. Este método permite una exploración del efecto de los compuestos en la neurotransmisión y proporciona una manera eficaz para confirmar los efectos funcionales de los compuestos que se determinan en los sistemas de expresión heteróloga en el nivel de los receptores nativos en general medio ambiente neuronal. Neurotransmisión GABAérgica puede ser evaluada a nivel molecular por la medición de los efectos de los compuestos corrientes postsinápticas inhibitorios (IPSCs)8. Pero el protocolo aquí utilizado y basado en grabaciones de abrazadera de parche de célula entera en rebanadas de cerebro es más elaborado y produce un rendimiento inferior.
Finalmente, se discuten las fortalezas y debilidades de la en vitro cascada utilizado para la identificación de ligandos selectivos α5β3γ2 en la perspectiva de las diferentes técnicas y sus limitaciones intrínsecas. Este trabajo debe proporcionar expertos y no expertos en el campo de los receptores GABAA una útil revisión de la combinación de enfoques diferentes en vitro que se utiliza para abordar el descubrimiento de nuevos moduladores de estos canales ligand-bloqueados del ion.
Protocolo
Xenopus laevis se encuentra y según las directrices de animales del cantón de Ginebra.
1. así vinculante
-
Preparación de la placa de ensayo
- Preparar 1.5 L de tampón de ensayo con 5 mM KCl, 1.25 mM CaCl2, 1.25 mM MgCl2, 120 mM de NaCl y 15 mM Tris; ajustar el pH con HCl a 7.4.
- Preparar los compuestos para ser probado en 50.76 μm (p. ej., un compuesto de 10 mM en un 980 μl de tampón de ensayo en un tubo de microcentrífuga de 5 μl). Mezcle bien usando una máquina de vórtice de alta velocidad para 2 – 5 s.
- Preparar una dilución previa de la referencia del flumazenil compuesto por pipeteo 1 μl del compuesto (10 mM) a 1.970 μl de tampón de ensayo. Mezcle bien usando una máquina de vórtice de alta velocidad para 2 – 5 s.
- Diluir una solución stock de [3H] flumazenil con el tampón de ensayo a 4 ° C a 4 nM en un tubo de polipropileno de 50 mL.
- Pipetear 50 μL/pocillo del tampón de ensayo en columnas 1 y 3-11 de una microplaca de 96 pocillos como se muestra en el layout de la placa representado en la figura 2.
- Pipetee 73.2 μl de los compuestos diluidos en 50.76 μm (ver paso 1.1.2) en la columna 12 de la placa.
- Diluir cada compuesto, mediante una progresión geométrica en 9 pasos (1E-10 -1E–06 M), con un volumen de transferencia μl 23,12 y llenar columnas 3 – 11. Homogeneizar la dilución. Cambiar la punta después de cada dilución.
-
Diluir las membranas celulares
- Descongelación las membranas celulares aisladas previamente de un receptor de GABAA humano expresando HEK293 (0.025 – 0.15 mg/mL) para obtener 80 mL a temperatura ambiente (RT) y transferir la suspensión al buffer de ensayo a 4 ° C.
- Agite la solución de membrana todavía a 4 ° C con un homogeneizador de tejidos para 30 – 40 s a 10.000-12.000 rpm.
-
Diluir el diazepam para el control de la Unión no específica (NSB)
- Diluir una solución 4 mM diazepam con el tampón de ensayo a una concentración de 40 μm en 5 mL.
-
Iniciar la reacción
- Pipetear 50 μl de 4 nM [3H] flumazenil en cada pocillo de la placa de 96 pocillos y guárdela en un recipiente de agua con hielo.
- Añada 100 μl de la preparación de membranas de subtipo de GABAA receptor para tener una concentración de 0,5 mg/mL de proteína.
- Pipetear 50 μl de diazepam μm 40 en columna 2.
- Incube la placa durante 1 hora en hielo.
- Añadir 50 μl de tampón de ensayo en cada pocillo de una placa de 96 pocillos filtro para la separación de membrana posterior y la medición de radiactividad y detener la reacción después.
-
Detener la reacción
- Preparar un buffer de lavado con 50 mM Tris-HCl, pH 7,4.
- Filtrar la solución utilizando una cosechadora celular de 96 pozos. Lave la placa de 3 x con 300 μL de tampón de lavado helada por pozo.
- Sellar la parte inferior de la placa con una capa de plástico y agregar 40 μl del cóctel para el líquido de centelleo centelleo contando en cada bien y limpiar con etanol 70%.
- Agitar suavemente la placa durante al menos 1 h a TA. Dejar reposar al menos una hora a TA.
- Medir la radioactividad (en CPM) colocando la placa en un contador de centelleo. Permiten una medición de 3 min por pozo.
-
Análisis de datos
- Determinar que la media de las 8 réplicas de fijación no específica (NSB) y el atascamiento total (TB), así como los duplicados o triplicados de las muestras. Calcular el % unión específica (SB) para la media de cada muestra según la siguiente ecuación:
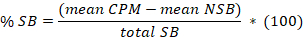
Aquí,
total SB = la media TB menos el decir NSB. - Parcela en abscisa la SB % versus en coordinar las concentraciones de inhibidor. Ajustar los datos utilizando la ecuación de análisis de la competencia solo sitio:

Aquí,
y = % de SB,
A = mínimo de y,
B = el máximo de y,
C = IC50,
X = log10 de la concentración del compuesto que compiten,
D = la pendiente de la curva (un coeficiente de Hill). - Calcular la afinidad (Ki) con la concentración inhibitoria máxima media (IC50), la constante de disociación (Kd) de [3H] flumazenil en las respectivas membranas9y la concentración de [3H] Flumazenil en el ensayo según la siguiente ecuación de datos mediante:
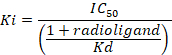
- Determinar que la media de las 8 réplicas de fijación no específica (NSB) y el atascamiento total (TB), así como los duplicados o triplicados de las muestras. Calcular el % unión específica (SB) para la media de cada muestra según la siguiente ecuación:
2. expresión y grabaciones en ovocitos de Xenopus
- Los ovarios recolección y preparación de ovocitos
- Preparar la solución estéril de Barth 88 mM NaCl, 1 mM KCl, 2,4 mM NaHCO3, 10 mM HEPES, 0,82 mM MgSO4.7H2O, 0,33 mM Ca (NO3)2.4H2O y 0,41 mM CaCl2.6H2O, a pH 7.4 , complementado con 100 unidades/mL de penicilina, estreptomicina 100 de μg/mL y 0,25 μg/mL de anfotericina B.
- Preparar el medio de x OR2 1 (no CaCl2) 88,5 mM NaCl, 2,5 mM KCl 5 mM HEPES, 1 mM MgCl2.6H2O, a pH 7.4.
- Sacrificio una Xenopus Laevis hembra por anestesia profunda por 20 min en frío Tricaine methanesulfonate (a una concentración de 150 mg/L, ajustada a pH 7.4) y bicarbonato sódico (300 mg/L) seguido de la decapitación.
- Cosechar los ovarios rápidamente con tijeras limpias y pinzas y colocarlos en 2 platos de Petri (10 cm) con 40 mL de 1 x solución de Barth y antibióticos/antimicótico.
- Almacenar los ovarios no disociado hasta 2 semanas en solución de Barth a 4 ° C.
- Para la disociación, cortar de los ovarios con una cuchilla de afeitar limpia en pequeñas fracciones (1 – 2 cm3) e incubar ellos en 50 mL de medio de OR2 sin CaCl2 (OR2-noCaCl2) que contiene 0.2% de colagenasa (tipo I) en 17 – 19 ° C en un cono de 100 mL matraz con una agitación lenta para 4-5 h. Compruebe que la barra magnética esté colocado aproximadamente 3 – 5 cm por encima del fondo del matraz spinner para evitar aplastar los ovocitos.
- Después de 4 a 5 h, verificar que la mayoría de los ovocitos es liberada de su folículo (es decir, nadan alrededor de forma individual). Lavar 5 veces con 200 mL de OR2 complementado con 1,8 mM CaCl2.
- Transferencia defolliculated ovocitos a cajas Petri (10 cm) llenan de solución de Barth y antibióticos/antimicóticos y mantienen al menos durante la noche a 17 ° C antes de la inyección de cDNA o mRNA.
- En el día siguiente, seleccione debajo de un binocular, un ovocito sano que presenta una clara y distinta animal versus un polo vegetal (marrón oscuro para el polo animal versus amarillo claro para el polo vegetal). Usar Pipetas Pasteur limpias y disponer los ovocitos uno por uno en una placa bien del 96-inyección cónica estéril.
Nota: no es necesario ningún cuidado especial en la colocación de los ovocitos de las inyecciones de mRNA; mientras que para las inyecciones de cDNA, es imprescindible orientar los ovocitos con el polo animal hacia arriba.
- inyección automática de mRNA o cDNA
- Sintetizar los mRNAs usando un kit disponible en el mercado siguiendo las instrucciones recomendadas. Limpiar los instrumentos y la mesa con RNasa y guantes de la protección adecuada.
Nota: La calidad del mRNA es determinante para una buena expresión, y es indispensable para evitar la degradación del mRNA durante el procedimiento de inyección. - Preparar cDNAs usando un kit disponible comercialmente y disolver la cantidad deseada de agua bidestilada en una concentración de 0,2 μg/μl.
- Inyectar 10-50 nL de solución de mRNA en una concentración de 0,2 μg/μl o 10 nL de cDNA solución a una concentración de 0.02-0.2 μg/μl, preferiblemente en lotes de 95 ovocitos.
- De membrana proteínas que requieren múltiples subunidades (es decir, receptores de GABAA heterómera α1β2γ2), mezcla de los mRNAs correspondientes o cDNAs de la proporción deseada (es decir, 1:1:1 o 1:10:1).
- Mantener el ovocito a 17 ° C para evitar la expresión de proteínas de choque térmico de los ovocitos; Guarde la microplaca en un área de almacenamiento térmico controlado.
- Disolver los compuestos de prueba que se dieron positivo en el ensayo del enlace en OR2 en 0.1-1.000 μm para las grabaciones electrofisiológicas y les tire apagado en una placa de polipropileno fondo plano de 96 pozos.
- Sintetizar los mRNAs usando un kit disponible en el mercado siguiendo las instrucciones recomendadas. Limpiar los instrumentos y la mesa con RNasa y guantes de la protección adecuada.
- Plásmidos de expresión
- Siga los manuales de instrucciones disponibles en el mercado de kits de para la síntesis de mRNA con el promotor T7 o T6 bacteriana y 20 μl de una solución al 0.2 μg/μl de agua libre de ARNasa.
- Preparar al menos 20 μl de una solución que contiene un vector de expresión eucariotas para la expresión de cDNA, típicamente a 0,2 μg/μl disueltas en agua bidestilada.
- Microinyección en el ovocito y la visualización de su calidad
- Inyectar 10-50 nL de la solución que contiene el plásmido (ver paso 2.3.1 o 2.3.2) utilizando una aguja de inyección micro de vidrio con un diámetro de punta que van hasta 100 μm montado en un instrumental quirúrgico equipado con un sistema de eyección de presión o con un sistema de inyección automatizado.
Nota: En el ejemplo discutido aquí, los ovocitos se inyectan por lotes de 95 con un sistema automatizado adecuado para uso con cDNA o mRNA. - Llenan la aguja de inyección de 1 μl de un colorante como el azul de metileno al 1% e inyectar los ovocitos utilizando el procedimiento estándar (o en el núcleo de cDNA en el citoplasma por el ARNm).
- Deseche los ovocitos inyectados por aproximadamente 1 minuto en agua hirviendo. Corte los ovocitos a la mitad con una cuchilla de afeitar debajo de un binocular.
Nota: El tinte permanece localizado como se muestra en la figura 3E, lo que permite una observación precisa de la inyección.
- Inyectar 10-50 nL de la solución que contiene el plásmido (ver paso 2.3.1 o 2.3.2) utilizando una aguja de inyección micro de vidrio con un diámetro de punta que van hasta 100 μm montado en un instrumental quirúrgico equipado con un sistema de eyección de presión o con un sistema de inyección automatizado.
- Grabaciones de la abrazadera del voltaje de dos electrodos
- Coloque la placa bien que contienen los ovocitos en el sistema automatizado, que utiliza el principio ilustrado en la figura 4.
Nota: En contraste con el sistema de abrazadera de parche ilustrado en la figura 5, el potencial de membrana verdadera de la célula es leído por el electrodo de tensión. - Programar el sistema de grabación automatizada con la interfaz basada en iconos, por ejemplo, el esquema ilustrado en la figura 6 para la determinación de la relación de la actividad de concentración.
- Coloque la placa bien que contienen los ovocitos en el sistema automatizado, que utiliza el principio ilustrado en la figura 4.
- Ajuste de curvas
- Analizar los resultados usando el software apropiado, usando la curva de activación concentración ilustrado, parcela la amplitud actual en función del logaritmo de la concentración del agonista.
- Observar la curva sigmoidal que puede ser equipada posteriormente con la ecuación empírica de la colina en la forma:
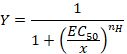
Aquí,
Y= la fracción de corriente evocada,
CE 50 = la concentración para la activación de un 50%,
x = concentración del compuesto,
nH = el coeficiente de Hill o cooperatividad aparente. - Normalizar las corrientes para una unidad dividiendo la amplitud de cada respuesta versus el valor grabado en la concentración más alta para analizar los datos obtenidos de una serie de células.
- Determinar la media y error estándar y realizar el ajuste de curvas utilizando software disponible en forma estándar.
3. electrofisiológicas grabaciones en rebanadas de cerebro
Nota: Rebanadas de hipocampo de rata son preparados de acuerdo con las directrices nacionales e institucionales.
-
Preparación de cortes de hipocampo
- Preparar el disección cerebroespinal líquido artificial (dACSF) con NaCl 124 de 124 mM, 2,5 mM KCl, 1.25 m m KH2PO4, 2 mM MgSO4.7H2O, 2,5 mM CaCl2 2 H2O, 26 mM NaHCO3, glucosa 10 mM y 4 mM sacarosa gaseado en la botella con una mezcla de 95% O2 y 5% CO2.
- Preparar el grabación cerebroespinal líquido artificial (rACSF) con 124 mM NaCl, 5 mM KCl, 1.25 m m KH2PO4, 2 mM MgSO4.7H2O, 2,5 mM CaCl2 2 H2O, 25 mM NaHCO3y 10 mM de glucosa gas en la botella con una mezcla de 95% O2 y 5% CO2.
- Anestesiar las ratas con una mezcla de 2.5% de isoflurano y oxígeno puro y decapita a los.
- Cortar el cuero cabelludo siguiendo la línea media con un buen par de tijeras. Cortar el cráneo a lo largo de la línea media sin dañar el tejido subyacente. Retire el cráneo con las pinzas y use una espátula fina para sacar el cerebro.
- El cerebro en la solución de dACSF gaseados en RT y diseccionar la formación hipocampal izquierda con una espátula fina.
- Cortar rodajas transversales (400 μm de espesor) de la parte media del hipocampo con un picador de tejido y traslado a la sala de grabación con el uso de un pincel de pintura. Mantener las rodajas a temperatura ambiente durante 45 minutos.
- Inundar las rebanadas con el rACSF gaseado a 35 ° C y a una velocidad de 1,5 mL/min la burbuja la solución con una mezcla de 95% O2 y 5% CO2.
Nota: Después de este paso, los trozos están listos para los experimentos electrofisiológicos.
-
Grabación de espiga única población
- Coloque un trozo de cerebro en la cámara de microscopio montado.
- Inundar el sector a un ritmo de 3 mL/min con rACSF.
- Tire de una micropipeta de vidrio borosilicato con el tirador de la pipeta tiene una resistencia de MΩ ~ 2.
Nota: Esta micropipeta se utiliza como un electrodo de registro y se conecta eléctricamente al amplificador. - La micropipeta se llenan de una solución 2 M de NaCl y colóquelo en el soporte de la pipeta del amplificador.
- Posición de la micropipeta de grabación en el pyramidale del estrato en la región CA1 de la rebanada hippocampal utilizando el instrumental quirúrgico adecuado.
Nota: La ubicación se representa esquemáticamente en la figura 7. - Colocar un electrodo de platino/iridio bipolar aislado en el soporte en el micromanipulador izquierdo.
Nota: Este electrodo se utiliza como el electrodo de estimulación y está conectada eléctricamente al generador de estímulo. - Coloque el electrodo de estimulación en los collaterals de Schaffer en la región de CA1 de la rebanada hippocampal utilizando el instrumental quirúrgico adecuado.
Nota: La ubicación se representa esquemáticamente en la figura 7. - Entrega un pulso de corriente al electrodo de estimulación mediante el generador de estímulos cada 30 s (100 μs de duración, a partir de las 10 μA) y poco a poco aumentar la fuerza de estímulo hasta que aparece un aumento de la población (PS).
- Ajustar la fuerza de estímulo para evocar un PS correspondiente al 45% de la amplitud máxima que puede obtenerse. PSs son filtrados a 2,4 KHz y digitalizados en 20 kilociclos usando el amplificador de señal.
-
Inhibición de junto-pulso
- Preparar las rebanadas de cerebro (paso 3.1) y proceder como se describe anteriormente (medidas 3.2.1–3.2.7).
- Entregar dos pulsos corriente (100 μs de duración en un intervalo de 20 ms) al electrodo de estimulación cada 30 s usando el generador de estímulos. Establecer la fuerza de estímulo para evocar un PS correspondiente al 45% de la máxima amplitud.
-
Compuesto de prueba
- Hacer las diluciones de los compuestos en ACSF gaseado para que la concentración final de DMSO no superior al 0,1%.
- Agregue el DMSO a la solución de control en la misma concentración que la solución compuesta.
- Grabar un single (paso 3.2) o un PS de junto-pulso (paso 3.3) evocado por estímulos colaterales de Schaffer cada 30 s durante al menos 30 minutos. La forma de PS debe ser estable durante este período de referencia.
- Preparar un vaso de precipitados con gaseados rACSF que contiene una concentración fija del compuesto a ensayar.
- Inundar el hipocampo rebanada con esta solución durante la grabación todavía PS solo o emparejado de pulso.
- Evaluar la recuperación del efecto compuesto por perfundiendo la rebanada con rACSF gaseado sin el compuesto.
Nota: Para efectos reversibles, el PS volverá a su forma inicial observado durante el período de base antes de la aplicación compuesto.
-
Análisis de datos
- Promedio los rastros PS registran durante el experimento en bloques de 4 con el software de análisis de datos.
- Medir las amplitudes de PS de los rastros de promedio.
- Normalizar las amplitudes como un porcentaje de los valores de referencia registrados 10 min antes perfundiendo un compuesto.
- Expresar los datos como media ± SEM.
Resultados
Enlace:
El ensayo en vitro con las membranas celulares se utiliza para identificar selectiva humana GABAA α5β3γ2 receptores ligandos vinculante en el sitio alostérico de la γ2 BZD que contiene los receptores. Células HEK293 transitorio transfected expresando el humano GABAA α5β3γ2, α1β3γ2, α2β3γ2 y α3β3γ2 receptores se utilizan para preparar las membranas para este ensayo. El efecto de los ligandos potenciales se detecta midiendo el centelleo de [3H] flumazenil a los receptores de membrana (una inhibición de la Unión de [3H] flumazenil). Entonces se generan curvas de desplazamiento obligatorio para evaluar la selectividad de los compuestos para un receptor de GABAA específico como en el ejemplo con RO4938581 (figura 8). Figura 9 resume el perfil de varios compuestos de referencia incluyendo el α5 selectivo GABAA receptor negativo modulador alostérico, RO49385819, que fueron generados usando el ensayo de enlace.
Grabaciones en Xenopus ovocitos:
La expresión de los receptores GABAA como el heteromer α5β3γ2 rendimientos sólidas corrientes en respuesta a la exposición de GABA. Grabaciones de pinza de voltaje típico obtienen en un oocito expresan la α5β3γ2 humana en respuesta a pulsos breves de GABA (30 s) que se extienden hasta 300 μm se muestran en la figura 6. En este experimento, las diferentes concentraciones de GABA fueron dispuestas en la placa de 96 pocillos y las respuestas fueron evocadas moviendo el celular en un pozo específico. El GABA se lavó bien por regresar el celular a la cámara central de la perfusión y la aplicación de una perfusión de solución de control activando la correspondiente bomba peristáltica. La secuencia del programa utilizada para la determinación de la curva de activación de concentración se ilustra en la figura 6A. Realizado en forma completamente automática, estos datos ilustran la calidad de las grabaciones que se pueden obtener en ovocitos de Xenopus y el alto nivel de expresión del receptor obtuvo unos días después de la inyección de mRNA. Los experimentos, realizados en combinaciones de diferentes receptores, producen una serie de CE50s, que es la concentración de GABA es necesario para activar la mitad de los receptores. Una parcela de la EC50de valores en un gráfico de araña, tal como se ilustra en la figura 10, proporciona una rápida comparación de las propiedades del receptor y la influencia de la composición de la subunidad.
Para examinar el efecto de un modulador alostérico negativo o positivo (NAM o PAM), es necesario comparar la respuesta evocada por un pulso de prueba de agonista (GABA), primero en el control y luego en presencia del modulador. Un eficiente protocolo experimental para llevar a cabo tal experimento se ilustra en la figura 11. Primero se determina la respuesta de la célula a una concentración de referencia de GABA y la secuencia se repite mediante la aplicación de la misma concentración de GABA y luego por una aplicación conjunta de la GABA plus modulador. Una trama de las dos respuestas superpuestas revela en este ejemplo una marcada inhibición causada por la presencia del modulador. Una cuantificación del efecto modulador fácilmente se obtiene computando el cociente de la respuesta había evocada en presencia de modulador versus el control y los resultados se pueden trazar en forma de una trama de calor. Los datos mostrados en la figura 12 ilustran la trama de calor correspondiente a las grabaciones de tres conjuntos de datos obtenidos para los 96 compuestos.
Tras la identificación de compuestos que son lo suficientemente activos, a menudo es indispensable para evaluar si estas moléculas son activas en otras combinaciones del receptor. En el caso de los receptores GABAA , se han identificado 19 genes que codifican para las subunidades diferentes y se conoce que un receptor funcional puede resultar de una Asamblea de multimérica de subunidades diferentes (véase Knoflach, Hernández y Bertrand10 para una revisión). Aunque la producción de subunidades y combinaciones múltiples un vasto repertorio del receptor de los subtipos que pueden requerir una gran cantidad de selección de contador para llevar a cabo, es a menudo posible foco primero en subtipo más abundantes que en el caso de la GABAA receptores, es la composición de α1β2γ2. Experimentos llevados a cabo cara a cara con la expresión de, por ejemplo, α5β3γ2 y α1β2γ2 en el mismo lote del ovocito rendimiento una buena comparación de los efectos respectivos de una molécula dada. Los resultados típicos obtenidos en tres células de α5β3γ2 y α1β2γ2 se muestran en la figura 13, que ilustra la modulación positiva preferencial de una molécula en α5β3γ2.
El protocolo experimental que se ilustra en la figura 11 es idóneo para la caracterización de una actividad de PAM. En el presente Protocolo, el compuesto que se prueba es aplicado conjuntamente con el agonista en concentraciones progresivamente crecientes. Para evitar los posibles efectos acumulativos causados por múltiples aplicaciones en la misma célula, una célula nueva e ingenua se mide para cada punto de datos. Una medida de la amplitud de la respuesta grabado con el agonista solo y luego durante la aplicación compuesta produce una relación que cuantifica el efecto de la PAM o NAM. Resultados típicos obtenidos en α1β2γ2 y α5β3γ2 de diazepam se muestran en la figura 14, revelando una sensibilidad evidente de la α5β3γ2 que es aproximadamente 10 veces mayor en esta combinación de receptor. Estos valores son en buena correlación con datos publicados11. Se cree que el sitio de benzodiazepinas está constituido por la interfaz entre el γ2 y su subunidad α adyacente12-14, la sensibilidad de la α5β3γ2 sugiere una afinidad preferencial diazepam para γ2-α5 en γ2-α1. La posibilidad de expresar combinaciones de receptores diferentes, combinadas con una eficiente caracterización funcional abre múltiples maneras de explorar los determinantes de las propiedades de PAM y su implicación para efectos fisiológicos y farmacológicos.
Rebanadas del cerebro de hippocampal:
Los experimentos con rebanadas de hipocampo de cerebro de rata se llevan a cabo para validar el perfil farmacológico de los compuestos identificados en los ensayos en vitro en un modelo de receptor nativo. Los subtipos de receptores GABAA predominante expresados en las células piramidales del hipocampo son α1β2/3γ2 α2β2/3γ2 y α5β2/3γ2, que todos son moduladas por benzodiazepinas (BDZs)15. Inhibición de junto-pulso es un paradigma que puede revelar la excitabilidad del hipocampo circuito analizando el cambio en la respuesta del segundo de dos estímulos eléctricos pares entregados 20 ms apartes. El cambio de la segunda respuesta es debido a la retroalimentación de GABAérgico por interneuronas inervan las células piramidales capa16-18. Como se muestra en la figura 7, en la situación de control, el segundo la respuesta de dos estímulos apareados es inhibida debido a una inhibición GABAérgica. Cuando esta inhibición se reduce por perfundiendo la rebanada con β-CCM, un no selectivo NAM, el segundo la respuesta de los dos estímulos apareados es inhibida en mucho menor medida. Este paradigma experimental es sensible a los compuestos selectivos para un receptor de GABAA que contiene el α5 la subunidad.
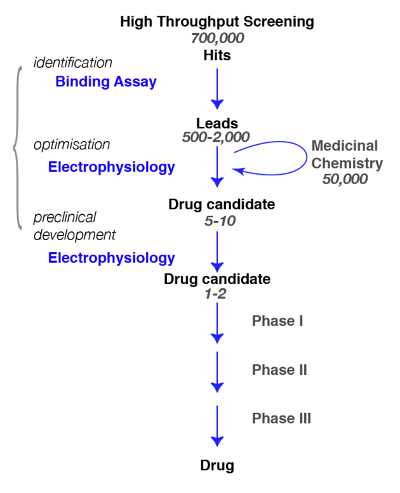
Figura 1 : Proyección estrategia. Una droga típica vía de detección comienza con la proyección de alto rendimiento en el que se proyectan grandes bibliotecas de compuestos para un objetivo específico. Tras la identificación del candidato principal, comienza el trabajo de química medicinal. Durante esta fase, químicos serán estudiar y refinar las moléculas realizando una modificación estructural para satisfacer los criterios deseados, tales como selectividad del target, penetrance de cerebro, estabilidad, degradación etc. durante esta fase crucial, es esencial evaluar si las modificaciones químicas no han modificado las propiedades de la molécula y refinar para el mejor candidato. El siguiente paso es identificar unos prometedores compuestos y llevarlos a los próximos pasos que incluyen seguridad, tolerancia, etc. nota que electrofisiología se indica como funcional del análisis pero que otros métodos, incluyendo fluorescencia de calcio ensayos o tintes sensibles del voltaje, pueden utilizarse como alternativas. Estos últimos métodos también se utilizan en los ensayos de alto rendimiento como una sustitución para los ensayos de Unión. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Diseño de un pozo de 96 plateado utilizado para atar experimentos. Columna 1 se utiliza para medidas de Unión total y columna 2 para medidas de fijación no específica. Filas A – H se llenan con 4 diferentes compuestos en el aumento de las concentraciones (columnas 3 – 12), cada uno compuesto por duplicado (es decir, compuesto de 1 en filas de A y E, 2 compuesto en filas B y F, etc.) en el diseño con colores diferentes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Microinyección utilizando un sistema automatizado de. (A) A preciso sistema XYZ, en el que una aguja de inyección de vidrio con el líquido que contiene el plásmido de interés, automáticamente se asomó en los ovocitos. (B) este panel muestra la placa de 96 pocillos de fondo cónico en el que (C) los ovocitos se inyección automáticamente. (D) este panel muestra el principio de inyección. Para la inyección nuclear, la aguja penetra en el ovocito un poco más profundo que el núcleo, como se muestra en el panel B. Luego, se retira la aguja del núcleo (ver panel C) antes de la inyección (véase el panel D). (E) para evaluar la calidad de la inyección, la aguja puede rellenarse con tinta y ovocitos "cocinado" se pueden cortar por la mitad. Haga clic aquí para ver una versión más grande de esta figura.
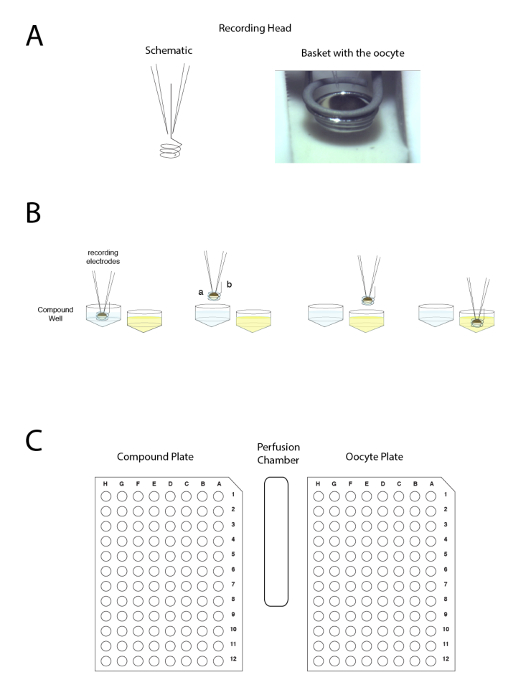
Figura 4 : El principio de electrodo pinza de voltaje dos automatizado. El principio se basa en mover la preparación entre pozos en vez de aplicar el líquido en la perfusión. (A) la parte izquierda del panel representa la disposición que permite la grabación en un ovocito de Xenopus con los dos electrodos y la pequeña cesta que mantendrá una gota de líquido alrededor de la preparación durante el movimiento de una muestra a otro. Una foto del ovocito en la canasta con los dos electrodos se muestra en el lado derecho. (B) este panel muestra una representación esquemática de la electrofisiología "boca abajo" principio de la grabación. (C) este panel muestra la disposición de los ovocitos, placa compuesta y estación de lavado en la mesa de grabación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Abrazadera del voltaje de dos electrodos grabación versus abrazadera del remiendo. Una pinza de voltaje de dos electrodos típicos de ovocitos (panel izquierdo) es comparada con la configuración de la pinza de parche utilizada para una línea celular (panel derecho). Tenga en cuenta la diferencia de tamaño entre los ovocitos que son aproximadamente 1 mm de diámetro frente a las células que están alrededor de 20 μm. En la abrazadera del voltaje de dos electrodos, el potencial de membrana de los oocitos se compara con el voltaje deseado de la explotación y la diferencia de señal se inyecta en el electrodo de corriente. En una grabación de abrazadera del remiendo, se asume que la resistencia de la toma de la abrazadera de parche es insignificante frente a la resistencia de la membrana y, por lo tanto, que la tensión impuesta por el amplificador se alimenta fielmente a la membrana de la célula19. La imagen ilustra una perfusión de líquido del filamento en el que los dos canales de un tubo de theta () se llenan con, por un lado, una solución de control y, por otro lado, con la solución que contiene la droga20,21. Haga clic aquí para ver una versión más grande de esta figura.
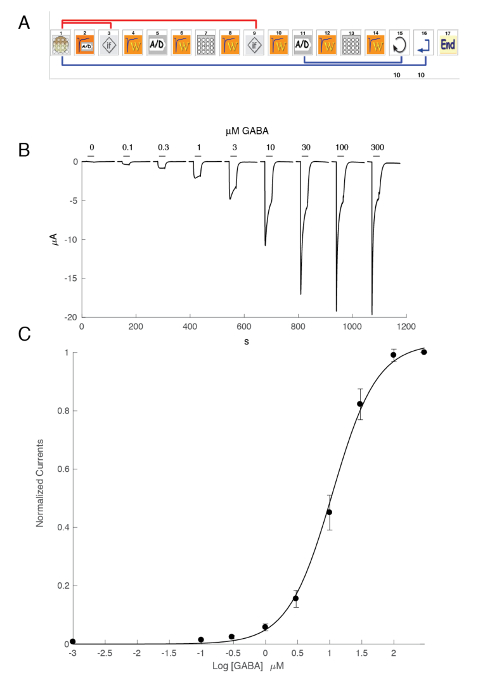
Figura 6 : Relación de activación de concentración en los receptores de α5β3γ2 humana. (A) la secuencia que controla el sistema automatizado consiste en una serie de iconos y establece el protocolo experimental para la determinación de la relación de activación de la concentración. En los pasos 1 – 3, como se muestra en este panel, el sistema carga el ovocito de la placa en la canasta de la medición. La corriente de fuga se mide en el paso 2 y, si este valor supera los criterios deseados, cambia automáticamente la celda (paso 3). Después de un período de estabilización (paso 4), la respuesta de ovocitos a una referencia de concentración de GABA es medidos (pasos 5-8). Ovocitos con corrientes mayores de 1 μA se mantienen para la medición posterior. En los pasos 11 a 13, la célula está cuestionada por diferentes concentraciones de GABAA y el proceso repite para el número deseado de las concentraciones (paso 14) y células (paso 15). (B) este panel muestra las típicas corrientes evocadas por una serie de breves aplicaciones de GABA (30 s) en orden de crecimiento. El momento de la aplicación compuesto se indica mediante las barras. (C) A parcela de la corriente hacia el interior de la máxima en función del logaritmo de la concentración de GABA produce la curva de activación de concentración que es fácilmente por la ecuación empírica de la colina, con una curva continua, un EC50 en cerca de 11 μm y una colina coeficiente del 1,3. Corrientes registradas en 8 celdas fueron normalizadas a la unidad para la máxima respuesta evocada. Las barras indican el error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
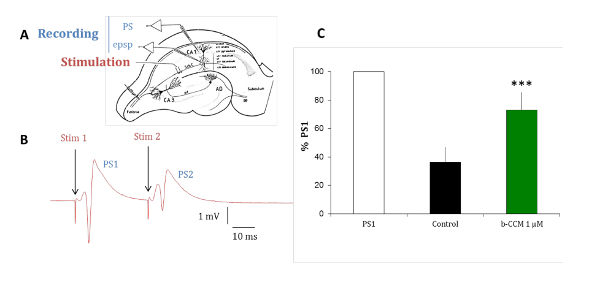
Figura 7 : Β-CCM, un GABAA NAM reduce inhibición de junto-pulso en rebanadas hippocampal. (A) este panel muestra una representación esquemática de una rebanada de hipocampo de rata. Los collaterals de Schaffer (Sch C) origina el proyecto de axones de células piramidales de CA3 a la arborización dendrítica de las neuronas piramidales de CA1. Micropipetas fueron colocados en el pyramidale del estrato (str pyramidale) para registrar picos de población (PS) y en el radiatum del estrato (str radiatum) para grabaciones dendríticas de potenciales postsynaptic excitatory (epsp) de campo. El electrodo de estimulación fue colocado dentro de los collaterals de Schaffer. (B) este panel muestra PSs evocados por estímulos apareados aplicados por el mismo electrodo estimulante en un intervalo de 20 ms. La respuesta de la población que el segundo estímulo (PS2) es de menor amplitud que el de la respuesta al primer estímulo (PS1). (C) PSs se registraron en la ausencia (barra negra) y la presencia de β-CCM, un no selectivo GABAA receptor NAM (barra verde). Β-CCM mejora la amplitud de la PS2 segundo bloqueando parcialmente cualquier inhibición GABAérgica de feed-forward. Las barras indican el error estándar de la media y *** que los datos son altamente significativos con una p < 0.01. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: resultados de enlace típicos obtienen en un análisis competitivo (inhibición o desplazamiento). Curvas de enlace de desplazamiento se generan a partir de que la IC50 y el Ki pueden ser determinada. IC50 es la concentración de un ligando que compiten que desplaza el 50% de la unión específica de la radioligand, y Ki (la constante de inhibición de un medicamento) es la concentración de un ligando que compiten que ocuparía el 50% de los receptores si no así estaban presentes. El Ki se calcula de la IC50 usando la ecuación de Cheng-Prusoff:
Haga clic aquí para ver una versión más grande de esta figura.
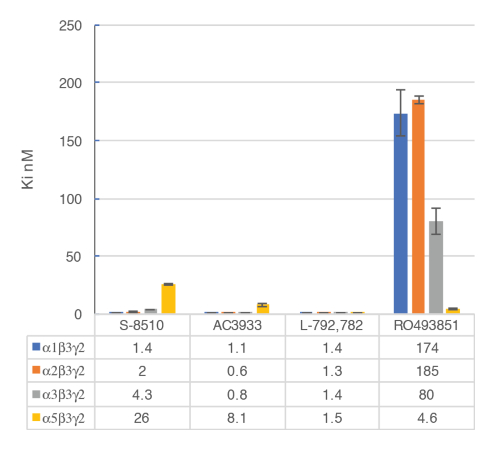
Figura 9 : Enlace de desplazamiento competitivo se realizó con ligandos vinculante en los subtipos principales de receptores GABAA . Afinidades (nM) se midieron usando un análisis de flumazenil-Unión de [3H] y las membranas de las células HEK293 transfectadas transitoriamente con humanos GABAA receptor subunidad combinaciones diferentes. La representación del histograma ilustra claramente la sensibilidad diferencial observada por el RO493851 compuesto con el Ki más baja en los receptores de α5β3γ2. Haga clic aquí para ver una versión más grande de esta figura.
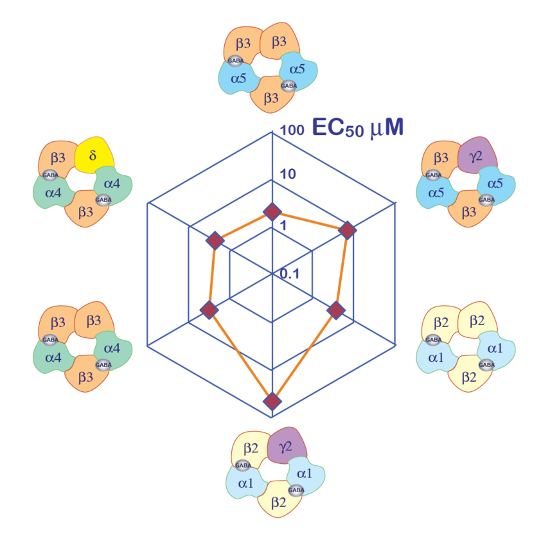
Figura 10 : Sensibilidad diferencial GABA receptores de. Una parcela del receptor GABA EC50 en una parcela de araña y una representación de la composición de la subunidad supuesta proporcionan maneras eficientes para comparar el papel de las diferentes subunidades. Tenga en cuenta que la introducción de las subunidades de γ2 está asociada con una reducción en la sensibilidad del receptor. Haga clic aquí para ver una versión más grande de esta figura.
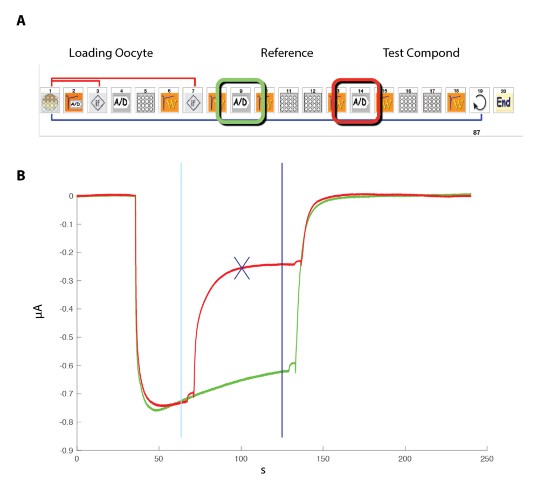
Figura 11 : El efecto de un modulador de sondeo. (A) este panel muestra la secuencia del icono utilizada para controlar el sistema automatizado. Tenga en cuenta que los dos iconos (A, D) corresponden a la grabación en el control (verde) y durante la exposición del modulador (rojo). (B) este panel muestra corrientes típicas en una célula expresan el receptor de GABAA en tal secuencia. Para evaluar los efectos de un modulador, una secuencia de medir primero la respuesta evocada por la exposición a una concentración fija de GABA (trazo verde), seguida de la exposición primero a GABA y luego a GABA plus modulador (trazo rojo), se llevó a cabo. Posicionamiento de los cursores de Cruz (cian y azul) delimita las medidas, y el Cruz azul indica la diferencia máxima entre las dos condiciones de grabación. La relación entre la condición control y modulador se calcula automáticamente en el software de análisis. Haga clic aquí para ver una versión más grande de esta figura.

Figura 12 : Parcela de calor con tres repeticiones. Este panel muestra una parcela de calor correspondiente a tres repeticiones de modulador de efectos obtenido para 96 compuestos en los receptores del GABAA α5β3γ2 humana. Las razones de la respuesta de la prueba sobre el control que oscilan entre 0.5 y 1.2 eran consideradas como no significativamente diferentes del control y están representadas por un punto verde. Ratios por debajo de 0,5 se consideran que representan un efecto inhibitorio y están representados por puntos azules. Ratios por encima de 1.2 eran considerados como mejorar la respuesta y están representados por puntos rojos. Tenga en cuenta la similitud en el patrón entre las tres grabaciones independientes. Haga clic aquí para ver una versión más grande de esta figura.
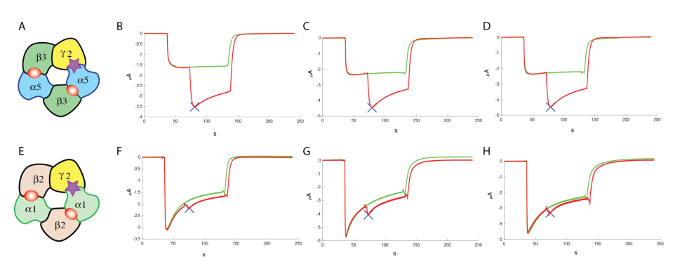
Figura 13 : Contador de proyección en α1β2γ2. (A) este panel muestra una representación de una organización subunidad putativos. Los siguientes paneles muestran (B-D) una evaluación de los efectos de un modulador alostérico positivo α5β3γ2 humana y (F-H) en α1β2γ2, usando concentraciones comparables de GABA y concentraciones similares (100 μm) de la modulador, que ponen de relieve la especificidad del compuesto probado en estos experimentos. (E) este panel muestra también una representación de una organización subunidad putativos. Haga clic aquí para ver una versión más grande de esta figura.
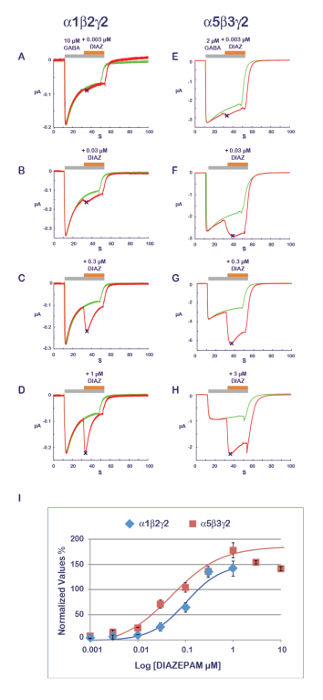
Figura 14 : Composición de sensibilidad y receptor PAM. La determinación de los efectos de una serie de concentraciones de efectos de diazepam (A-D) en α1β2γ2 yE-Hα5β3γ2 receptores revela casi una diferencia de 10 veces en la afinidad aparente. Tenga en cuenta también la influencia de la composición de la subunidad en el curso del tiempo de respuesta con una rápida desensibilización en receptores de α1β2γ2 (véase, por ejemplo, los paneles D y H). Tenga en cuenta que como la α1β2γ2 y receptores de α5β3γ2 pantalla diferentes afinidades para GABA (véase también figura 10), la concentración de agonista fue ajustada entre los dos receptores en un rango de activación comparables. () Este panel representa una parcela del doblez aumento en una amplitud de corriente normalizada a la unidad frente a la condición control. Haga clic aquí para ver una versión más grande de esta figura.
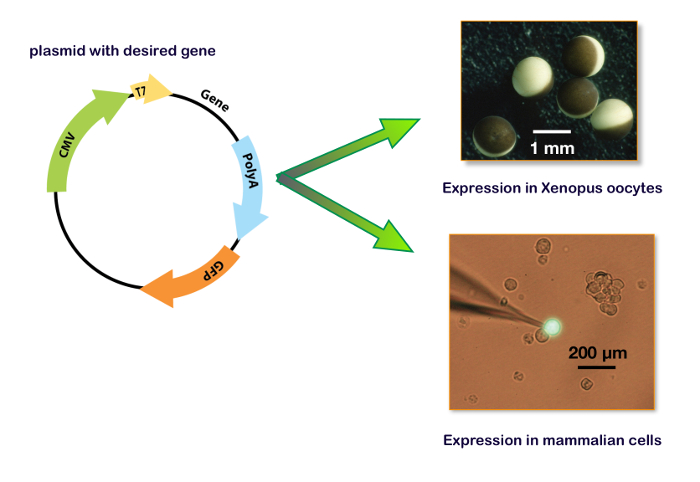
Figura 15 : Plásmido de expresión incluyendo promotor T7 y CMV. Estos paneles muestran el plásmido para la expresión en un ovocito de Xenopus (panel superior derecho) y en una línea celular. El panel derecho inferior ilustra una típica célula de HEK 293 transfectada con un plásmido que contiene también el gen para una proteína fluorescente verde (GFP) con el electrodo de la grabación de la abrazadera del remiendo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El desarrollo de nuevos compuestos activos en un canal ligand-gated ion tales como los receptores de GABAA requiere el uso de múltiples enfoques. Por lo general, el primer paso se realiza a menudo usando análisis de enlace; sin embargo, tales medidas no son suficientes para caracterizar la actividad fisiológica de lo compuesto o su farmacología precisa. En particular, un compuesto que se une a un receptor puede potenciar o inhibir su función o incluso no producir ningún efecto funcional (callar) (es decir, atan a los receptores sin modificar su función). Por lo tanto, una prueba funcional es necesaria para una caracterización del compuesto completo.
Enlace ensayos:
La principal ventaja de la prueba enlace es que pueden realizarse eficientemente en un gran número de muestras que se extienden hasta varios miles y que proporciona las afinidades de enlace para las moléculas activas. Como se describe en este documento, el primer paso consiste en establecer un método para la evaluación de los subtipos del receptor deseado. Es decir, mientras que Unión se puede conducir en receptores nativos de fracciones o el cerebro entero, dicho método evitará que la determinación de las afinidades en subtipos de receptor específico. Por lo tanto, es necesario utilizar sistemas recombinantes a las moléculas de la pantalla en el destino deseado. Hoy en día, una transfección transitoria o estable de los cDNAs de la subunidad del receptor deseado en líneas celulares ofrece un método eficaz y fiable para expresar los subtipos de receptores de interés (p. ej., GABAA α5β3γ2). Encuadernación tradicional ensayos hacen uso de radioligands, pero hoy en día las técnicas son disponibles que evita los inconvenientes de manejo de radiactividad (por ejemplo, cuantitativo basados en fluorescencia-ligando).
Expresión funcional de un sistema de host:
Para expresar genes en un sistema de host, la secuencia de codificación de interés debe insertarse en un plásmido que contiene el promotor adecuado. Por lo general, para en vitro la síntesis de ARNm, se utiliza el promotor T7 o T6 bacteriana. Para una expresión de cDNA, la transcripción del gen de interés debe ser regulada por un promotor de eucariontes como CMV (citomegalovirus) o su equivalente. Hoy en día, varios plásmidos, entre ellos los dos promotores (es decir, pUNIV, pCMV-6AC, psf-CMV/T7, pCI-neo, pcDNA), están disponibles permitiendo una en vitro la síntesis de mRNA o una expresión de cDNA como se muestra en la figura 15. Una expresión de los receptores GABAA puede obtenerse fielmente en líneas celulares o en oocytes del Xenopus . Las principales ventajas de este último son la falta de expresión del receptor endógeno, la simplicidad de las manipulaciones y la disponibilidad de un sistema automatizado para micro-inyecciones y grabaciones. Los procedimientos descritos en este protocolo ilustran la eficacia del sistema automatizado que permite la inyección de 96 ovocitos en unos 7 min y requiere ningunas habilidades de micromanipulación. Recordar que un solo ovario de un Xenopus contiene entre 10.000-30.000 oocitos, es evidente que un gran número de mediciones de la célula puede realizarse en una sola preparación. Por otra parte, como una expresión puede realizarse utilizando inyecciones de cDNA, el mismo plásmidos que contienen los genes de interés que se desarrollan para los experimentos de Unión puede ser utilizada para una caracterización funcional sin necesidad de más biología molecular manipulaciones.
Por su gran tamaño y alta expresión superficial, un ovocito solo produce una serie de receptores que es aproximadamente equivalente a las células confluentes en una placa de Petri de 35 mm. Sin embargo, una preparación de ovocitos e inyección representa una fracción del costo de una línea celular, como los experimentos no requieren de un medio de cultivo específico y manipulaciones estériles. La activación de un solo canal de GABAA rinde algunos picoamperes (10-12) y las corrientes que van hasta decenas de microamperios (10-6) se registran fácilmente en un solo ovocito, que confirma la actividad concomitante de varios millones de receptores en una sola respuesta.
Un primer paso en la caracterización de canales ligand-bloqueados del ion es a menudo la determinación de la afinidad aparente de los receptores. Los experimentos que deben llevarse a cabo consisten en aplicar una serie de pulsos de prueba breve agonista y trazar la amplitud de los evocados actual o, en algunos casos, el área bajo la curva (AUC) como una función del logaritmo de la concentración del agonista. Como es fácilmente factible microinject plásmido diferentes concentraciones y relación en el mismo lote de ovocitos, este sistema de expresión es particularmente apropiado para dicha caracterización. Por otra parte, una comparación de lote a lote reveló un alto grado de estabilidad para diferentes s de50CE. La influencia de la composición de la subunidad de afinidad aparente del receptor se visualiza fácilmente usando un diagrama de araña, como en la figura 10.
Los resultados de la abrazadera del voltaje de dos electrodos en oocytes del Xenopus se comparan a menudo con grabaciones hechas usando electrodos de pinza de parche. Considerando que iría más allá del alcance de este trabajo entrar en una detallada comparación entre estos dos sistemas, se pueden examinar algunos puntos. Mientras que una abrazadera del remiendo en las células ofrece ventajas para una caracterización biofísica con una solicitud de fármaco rápido, sus necesidades son más complejas que las de las grabaciones de dos electrodos en oocytes del Xenopus . Una dificultad primera y no despreciable es la expresión de una proteína dada la necesidad de un cultivo celular, un transitorio o transfección estable, y la identificación de las células que expresan la construcción deseada. Además, es indispensable examinar la contribución posible de la expresión endógena en la celda considerada. Por otra parte, una grabación de abrazadera de parche requiere un experto para llevar a cabo la micromanipulación bajo un microscopio de alta magnificación, mientras que esa persona también tiene que realizar un análisis adecuado durante el experimento para evaluar, por ejemplo, la calidad del sello, la resistencia de acceso etc. , en contraste, una pinza de voltaje de dos electrodos de grabación, especialmente uno usando un sistema electrofisiológico automatizado, no requiere de ninguna habilidad específica y puede llevarse a cabo por técnicos de laboratorio.
Al adquirir una instalación electrofisiológico, consideración de costo es un factor importante que debe ser cuidadosamente analizado. Por ejemplo, mientras que el costo de un sistema automatizado es relativamente alto, una comparación más cercana revela que la instalación de una plataforma electrofisiológica completa incluye compra de equipo como buen micromanipuladores, una lente de binocular, un amplificador, una perfusión sistema y una mesa antivibraciones, adquisición de datos y realizar un análisis. Una comparación de costes entre un voltaje de dos electrodos abrazadera instalación frente a un montaje de abrazadera de parche revela discrepancias aún más. Además, el sistema automatizado ofrece la ventaja de equipo totalmente automatizado y funciona sin vigilancia día y noche.
Las propiedades farmacológicas de un compuesto están determinadas por su modo de acción en el receptor. Por ejemplo, los inhibidores competitivos son moléculas que pueden entrar en el mismo bolsillo de Unión, o en sitio de orthosteric, como el agonista produce una competencia. Inhibidores no competitivos son compuestos que inhiben los receptores interactuando en otro sitio y, en el caso de un canal ligand-bloqueado del ion, que pueden entrar y bloquear el poro iónico, por ejemplo. Iría más allá del alcance de este trabajo examinar los diferentes mecanismos de interacción, pero más información se puede obtener de un libro farmacológico o de otros trabajos como Bertrand y de Bertrand22.
En el caso de moduladores alostéricos, el compuesto se une en un sitio distinto del sitio de orthosteric, pero la presencia de la molécula modifica la barrera de energía entre los Estados activos y otros. Moduladores alostéricos positivos (PAMs) son compuestos que reducen la barrera de la energía de la reclinación al estado activo y, por lo tanto, aumentar el efecto de los agonistas. Para caracterizar efectos de PAM, es, por lo tanto, necesario determinar si la exposición al compuesto mejora la respuesta al agonista y, si es así, en el que la concentración. Los experimentos presentados en la figura 11 y figura 14 ilustran los protocolos que pueden utilizarse con éxito para la caracterización de PAMs en los receptores GABAA .
En algunos casos, la exposición a la PAM solo puede ser suficiente para activar los receptores. Esta actividad puede determinarse por una ligera modificación del protocolo experimental presentado aquí. Es decir, en lugar de utilizar una aplicación conjunta del modulador durante la exposición a la GABA, el protocolo puede modificarse para la aplicación del primer compuesto solo y luego en presencia del GABA. Una caracterización de la actividad agonista directa se realizará mediante la determinación de la amplitud de la respuesta evocada por el compuesto sí mismo y en comparación con la corriente evocada por el GABA.
Experimentos llevados a cabo en rebanadas de cerebro, tal como se ilustra en la figura 7, se utilizan para confirmar la actividad compuesta en receptores nativos en un circuito inhibitorio definido antes de ir más lejos en modelos animales y en el camino hacia ensayos clínicos. El protocolo de registro y el análisis de datos relativamente simple permite la clasificación de compuestos múltiples evaluando su diferencial efecto modulador en amplitud de PS. Efectos no específicos de los compuestos que no están relacionados con el sistema de GABA también pueden ser detectado (por ejemplo, cuando se observan cambios en la forma de PS). Directa, la neurotransmisión GABAérgica puede ser evaluada en estos casos mediante la medición de los efectos de los compuestos inhibitorios postsinápticos corrientes marinas (IPSCs) usando células completas parche abrazadera técnica8.
Divulgaciones
Los autores Frédéric Knoflach y Maria Clemencia Hernandez son empleados de F. Hoffmann-La Roche AG, 4070 Basel, Suiza, una compañía farmacéutica. El autor Daniel Bertrand es un empleado de HiQScreen Sàrl 6, rte de Compois, 1222 Vésenaz Ginebra, Suiza, proporcionando instalaciones de proyección a las compañías farmacéuticas.
Agradecimientos
Los autores agradecen a Judith Lengyel, Maria Karg, Grégoire Friz, Rachel Haab y Marie Claire Pflimlin de Roche y Tifany Schaer y Deborah Paolucci de HiQScreen por su excelente asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| 96 well cell harvester -(Filtermate 196) | Packard | To filter membranes with bound radioligand | |
| Microtiter plate liquid scintillation counter (Top Count NXT) | Packard | Microplate Scintillation and Luminescence counter | |
| Vial liquid scintillation counter (Beta-Couter 2500 TR) | Packard | Vial Scintillation and Luminescence counter | |
| Liquid handler (Biomek 2000) | Beckman coulter | To prepare compound dilutions | |
| Vortex (Vortex Genie 2) | Scientific industries Inc. | To mix compound stock solutions | |
| Tissue homogenizer (Polytron PT1200E) | Kinematica AG | To resuspend the membrane preparations | |
| XLfit5 software | Microsoft Excel add-on by IDBS | Curve fitting software | |
| Smart Pull | UniPix | - | Electrode Puller |
| RoboInject | MultiChannel Systems | - | Automated Injection (Xenopus Oocytes) |
| HiClamp | MultiChannel Systems | - | Automated Voltage Clamp (Xenopus Ooocytes) |
| DataMining | MultiChannel Systems | - | Data Analysis Software |
| DataMerger | MultiChannel Systems | - | Data Processing Software |
| Digidata 1550 | Molecular Devices | Low noise data acquisition system | |
| CyberAmp 380 or equivalent | Axon Instruments | Programmable Signal Conditioner | |
| pClamp program suite | Molecular Devices | Software for data acquisition and analysis software | |
| Antivibraton table | TMC | To avoid microelectrode vibrations | |
| Patchstar Micromanipulators | Scientifica | To accurately position microelectrodes in brain slices | |
| Faraday Cage | Sutter Instruments | To isolate recordings from noise | |
| McIlwain Tissue Chopper | Campden Instruments LTD | To prepare brain slices | |
| Borosilicate glass micropipette | Warner Instruments | GC150TF-10 | To record extracellular potentials in brain slices |
| Twisted pair, platinum iridium wires stimulation electrode | World Precision Instruments | To stimulate the brain slices with current | |
| Stimulus generator for current and voltage driven stimulation | MultiChannel Systems | STG4000 | Delivers the current to the stimulation electrode |
| Plasticware | |||
| Microtiter plate round bottom | Corning | #3365 | Used for the binding assay |
| GF/C glassfibre filter-bottom 96-well microplate with 1.2 µm poresize, for cell harvesting assays using a vacuum manifoldwell filter | Packard | #6005174 | used for the binding assay |
| 50 mL Tubes | Falcon | #352070 | used for the binding assay |
| Safe-lock tubes 1.5 mL | Eppendorf | #0030 120086 | used for the binding assay |
| Safe-lock tubes 2 mL | Eppendorf | #0030 120094 | used for the binding assay |
| Shipping tubes 180 mL | Semadeni Europe AG | #3722 | used for the binding assay |
| Pony vial Polyethylene 6 mL | Perkin Elmer | #6013329 | used for the binding assay |
| Top Seal | Perkin Elmer | #60051859 | used for the binding assay |
| Spinner Flask | Bellco | BELLCO # 1965-00100 | Spinner Flask |
| 96 Well Plate (Conical) | Thermo Scientific Milian | 56368 | Injection plate for the oocytes |
| 96 Well Plate (Flat bottom) | Corning (Vitaris Switzerland) | 3364-cor | Compound Plate for the HiClamp |
| Glass capillary | Hilgenberg (Germany) | - | borosilicate glass 1.2 O.D. 0.76 I.D. with filament |
| RNA preparation | |||
| Ambion mMessage mMachine | Thermo Fisher Scientific | for the in vitro synthesis | |
| Chemicals | |||
| Assay buffer: KCl 5 mM; CaCl2 1.25 mM; MgCl2 1.25 mM; NaCl 120 mM; Tris 15 mM pH adjust with HCl to 7.4; store up to 3 months at 4 °C. | Used for binding assay | ||
| Washing buffer: Tris 50 mM -HCl pH 7.4; store at 4 °C. | Used for binding assay | ||
| Stock solution of test compounds 10 mM in DMSO | Used for binding assay | ||
| Flumazenil (RO0151788) 10 mM in DMSO | Used for binding assay | ||
| Diazepam 4 mM in DMSO | Used for binding assay | ||
| [3H]-Flumazenil 60-85 Ci/mmol in Ethanol; store at -20 °C | Used for binding assay | ||
| Microscint 40 | Packard | #6013641 | Used for binding assay |
| Ultima Gold | Perkin Elmer | #6013329 | Used for binding assay |
| MS-222 | Sigma | Sigma # A5040 | MS-222 |
| AB/AM | Sigma | Sigma # A5955 | antibiotics / antimycotics |
| Collagenase | Sigma | Sigma # C1030 | Collagenase Type I |
| Rnase | Sigma | Sigma # R2020-250 mL | RNaseZAP |
| EndoFree Plasmid maxi Kit | Qiagen | Qiagen # 12362 | |
| Salts for artificial cerebrospinal fluid (NaCl, KCl, etc.) | Sigma | ||
| Membranes | |||
| Frozen membrane preparations from transient or stably transfected HEK293 overexpressing different human GABAA receptor subtypes: α1β3γ2, α2β3γ2, α3β3γ2, α5β3γ2. See Ballard et al. 2009 for detailed methods. | Used for binding assay |
Referencias
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nature Reviews Drug Discovery. 10, 685-697 (2011).
- Sieghart, W. Structure and pharmacology of g-aminobutyric acidA receptor subtypes. Pharmacological Reviews. 47, 181-234 (1995).
- Liu, J., et al. A high-throughput functional assay for characterization of g-aminobutyric acidA channel modulators using cryopreserved transiently transfected cells. ASSAY and Drug Development Technologies. 6, 781-786 (2008).
- Mennerick, S., et al. Diverse voltage-sensitive dyes modulate GABAA receptor function. Journal of Neuroscience. 30, 2871-2879 (2010).
- Hevers, W., Luddens, H. The diversity of GABAA receptors. Pharmacological and electrophysiological properties of GABAA channel subtypes. Molecular Neurobiology. 18, 35-86 (1998).
- Macdonald, R. L., Olsen, R. W. GABAA receptor channels. Annual Review of Neuroscience. 17, 569-602 (1994).
- Kemp, J. A., Marshall, G. R., Wong, E. H., Woodruff, G. N. The affinities, potencies and efficacies of some benzodiazepine-receptor agonists, antagonists and inverse-agonists at rat hippocampal GABAA-receptors. British Journal of Pharmacology. 91, 601-608 (1987).
- Prenosil, G. A., et al. Specific subtypes of GABAA receptors mediate phasic and tonic forms of inhibition in hippocampal pyramidal neurons. Journal of Neurophysiology. 96, 846-857 (2006).
- Ballard, T. M., et al. RO4938581, a novel cognitive enhancer acting at GABAA a5 subunit-containing receptors. Psychopharmacology. 202, 207-223 (2009).
- Knoflach, F., Hernandez, M. C., Bertrand, D. GABAA receptor-mediated neurotransmission: Not so simple after all. Biochemical Pharmacology. 115, 10-17 (2016).
- Gielen, M. C., Lumb, M. J., Smart, T. G. Benzodiazepines modulate GABAA receptors by regulating the preactivation step after GABA binding. Journal of Neuroscience. 32, 5707-5715 (2012).
- Bergmann, R., Kongsbak, K., Sorensen, P. L., Sander, T., Balle, T. A unified model of the GABAA receptor comprising agonist and benzodiazepine binding sites. PLoS One. 8, 52323 (2013).
- Richter, L., et al. Diazepam-bound GABAA receptor models identify new benzodiazepine binding-site ligands. Nature Chemical Biology. 8, 455-464 (2012).
- Rudolph, U., Crestani, F., Mohler, H. GABAA receptor subtypes: dissecting their pharmacological functions. Trends in Pharmacological Sciences. 22, 188-194 (2001).
- Wisden, W., Seeburg, P. H. GABAA receptor channels: from subunits to functional entities. Current Opinion in Neurobiology. 2, 263-269 (1992).
- Davies, C. H., Davies, S. N., Collingridge, G. L. Paired-pulse depression of monosynaptic GABA-mediated inhibitory postsynaptic responses in rat hippocampus. The Journal of Physiology. 424, 513-531 (1990).
- Karnup, S., Stelzer, A. Temporal overlap of excitatory and inhibitory afferent input in guinea-pig CA1 pyramidal cells. The Journal of Physiology. 516, 485-504 (1999).
- Turner, D. A. Feed-forward inhibitory potentials and excitatory interactions in guinea-pig hippocampal pyramidal cells. The Journal of Physiology. 422, 333-350 (1990).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. 391, 85-100 (1981).
- Adelsberger, H., Brunswieck, S., Dudel, J. Block by picrotoxin of a GABAergic chloride channel expressed on crayfish muscle after axotomy. European Journal of Neuroscience. 10, 179-187 (1998).
- Hapfelmeier, G., et al. Isoflurane slows inactivation kinetics of rat recombinant a1b2g2L GABAA receptors: enhancement of GABAergic transmission despite an open-channel block. Neuroscience Letters. 307, 97-100 (2001).
- Bertrand, S., Bertrand, D. Overview of electrophysiological characterization of neuronal nicotinic acetylcholine receptors. Current Protocols in Pharmacology. , 17 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados