Method Article
Métodos para a descoberta de novos compostos modulando um Receptor do ácido gama - aminobutírico tipo uma neurotransmissão
Neste Artigo
Resumo
Aqui, apresentamos os protocolos para descobrir compostos ativos nos receptores GABAA , partir de ligação para a fisiologia e farmacologia.
Resumo
Este apresenta manuscrito um protocolo passo a passo para a seleção de compostos no gama-aminobutírico ácido tipo um receptores (GABAA) e sua utilização para a identificação de novas moléculas ativas em ensaios pré-clínicos de um recombinante em vitro receptor a seus efeitos farmacológicos em receptores nativos em fatias de cérebro de roedor. Para compostos de ligação no local do receptor benzodiazepínico, o primeiro passo é configurar uma tela primária que consiste em desenvolver ensaios obrigatórios de radioligantes em membranas celulares, expressando os principais subtipos de GABAA . Em seguida, aproveitando-se da expressão heteróloga de receptores de GABAA roedores e humanos em oócitos de Xenopus ou células HEK 293, é possível explorar, em ensaios eletrofisiológicos, as propriedades fisiológicas do receptor diferente os subtipos e as propriedades farmacológicas dos compostos identificados. O sistema de oócitos de Xenopus será apresentado aqui, começando com o isolamento dos oócitos e seu microinjection com diferentes mRNAs, até a caracterização farmacológica utilizando tensão de eletrodo de dois grampos. Finalmente, as gravações realizadas em fatias de cérebro de roedor serão descritas que são usados como um teste secundário fisiológico para avaliar a atividade das moléculas em seus receptores nativos em um circuito neuronal bem definido. Extracelulares gravações usando respostas da população de neurônios múltiplos são demonstradas juntamente com a aplicação da droga.
Introdução
Aqui, apresentamos os protocolos para a descoberta de compostos ativos nos receptores GABAA , partir de ligação para a fisiologia e farmacologia. Na busca de novas moléculas específicas para receptores GABAA , é crucial para definir, tão precisamente quanto possível, o subtipo de interesse e a avaliação da especificidade dos compostos identificados recentemente (por exemplo, para uma revisão, ver Rudolph e Knoflach1ou Sieghart2). Um caminho típico na descoberta da droga e as etapas que precisam ser alcançados são ilustrados na Figura 1.
Ensaios obrigatórios foram e são ainda largamente utilizados como o primeiro passo na descoberta da droga. No caso de receptores GABAA , eles são otimizados para identificar compostos que ligam para o sítio de ligação de benzodiazepínicos do receptor onde vincular drogas terapeuticamente útil e seguras. Outras técnicas, usando fluorométrica de imagem placa leitor (FLIPR) membrana potencial ensaios baseados em corante vermelho3, detectam compostos como barbitúricos que ligam para sites adicionais que são menos desejáveis, devido ao seu perfil de efeitos colaterais indesejado. Além disso, os corantes utilizados diretamente podem ativar receptores GABAA , assim, questionar a utilidade destes ensaios para descoberta de drogas4. Ensaios de ligação só pode fornecer a evidência de que um determinado composto pode vincular a uma classe de receptores específicos. In vitro ensaios com as membranas celulares são usados para identificar ligandos seletivos de receptores α5β3γ2 GABAA humana. Transitoriamente transfectadas células HEK293, expressando a humana GABAA α5β3γ2, α1β3γ2, α2β3γ2 e α3β3γ2 receptores são utilizadas para preparar as membranas para estes ensaios. O efeito dos ligantes é detectado pela medição da cintilação de flumazenil [3H] vinculado aos receptores de membrana (uma inibição da ligação de flumazenil [3H]). A principal vantagem desta técnica é que uma determinação rápida e eficiente da afinidade de ligação de composto no receptor de interesse é fornecida no receptor de interesse.
Estudos funcionais são essenciais para avaliar a atividade funcional dos compostos e de propor uma explicação fisiológica e farmacológica dos mecanismos causada pela ligação dos compostos para os receptores. Hoje, é bem reconhecido que os receptores GABAA funcional resultam a montagem de cinco subunidades em torno de um eixo de pseudosymmetry formado pelo poro iônico e resultado do conjunto de cinco subunidades idênticas. A maioria dos receptores de GABAA é compostos por dois ou mais diferentes subunidades. O receptor do grande cérebro GABAA , por exemplo, é composto das subunidades α1, β2 e γ2 em uma estequiometria de 2, 2 e 1 respectivamente5,6. Uma reconstituição em um sistema de host como o oócitos de Xenopus ou células HEK293 oferece a possibilidade de explorar rapidamente as propriedades farmacológicas de receptores.
As propriedades farmacológicas dos compostos são então exploradas com gravações extracelulares no cérebro fatias7. Este método permite uma exploração do efeito dos compostos na neurotransmissão e fornece uma maneira eficaz para confirmar os efeitos funcionais dos compostos determinados em sistemas de expressão heteróloga a nível dos receptores nativos em geral ambiente neuronal. Neurotransmissão gabaérgica também pode ser avaliado a nível molecular, medindo-se os efeitos dos compostos em correntes pós-sináptico inibitório (IPSCs)8. Mas o protocolo usado aqui e baseadas em gravações de braçadeira do remendo de células inteiras em fatias do cérebro é mais elaborado e produz uma baixa taxa de transferência.
Finalmente, as forças e fraquezas do em vitro triagem cascata usada para a identificação de α5β3γ2-seletivo ligantes são discutidas na perspectiva das diferentes técnicas e suas limitações intrínsecas. Este trabalho deve fornecer especialistas e não-especialistas no campo dos receptores GABAA uma avaliação útil da combinação de abordagens diferentes em vitro utilizada para enfrentar a descoberta de novos moduladores destes canais iônicos ligante.
Protocolo
Xenopus laevis são alojados e tratadas de acordo com as diretrizes de Animal do Cantão de Genebra.
1. radioligantes vinculação
-
Preparação da placa de ensaio
- Prepare-se 1,5 L de buffer de ensaio com 5 mM KCl, 1,25 mM CaCl2, 1,25 mM MgCl2, 120 mM de NaCl e 15 mM Tris; ajuste o pH com HCl a 7,4.
- Prepare os compostos para ser testado na 50.76 µM (por exemplo, um composto em 10 milímetros em um buffer de ensaio 980 µ l em um tubo de microcentrifugadora 5 µ l). Misture bem, usando uma máquina de vórtice em alta velocidade para 2-5 s.
- Prepare uma diluição prévia do flumazenil composto de referência por pipetagem 1 µ l do composto (10 mM) para 1.970 µ l de buffer de ensaio. Misture bem, usando uma máquina de vórtice em alta velocidade para 2-5 s.
- Diluir uma solução stock de flumazenil [3H] com o buffer de ensaio a 4 ° C a 4 nM em um tubo de polipropileno de 50 mL.
- Pipete 50 µ l/poço de buffer de ensaio para as colunas 1 e 3 – 11 de uma microplaca de 96 poços, conforme representado na Figura 2o layout da placa.
- Pipetar 73.2 µ l dos compostos diluído a 50.76 µM (ver passo 1.1.2) na coluna 12 da placa.
- Diluir cada composto, usando uma progressão geométrica sobre 9 passos (1E-10 – 1E–06 M), com um volume de transferência µ l 23,12 e preenchimento de colunas 3-11. Homogeneiza a diluição. Mude a ponta após cada diluição.
-
Diluir as membranas celulares
- Descongelar as membranas celulares anteriormente isoladas de um receptor de GABAA humana overexpressing HEK293 (0.025-0,15 mg/mL) para obter 80 mL à temperatura ambiente (RT) e transferir a suspensão para o buffer de ensaio a 4 ° C.
- Ressuspender a solução de membrana ainda a 4 ° C com um homogeneizador de 30 – 40 s a 10.000 – 12.000 rpm.
-
Diluir o diazepam para o controle de ligação não-específica (NSB)
- Dilua uma solução stock de diazepam de 4mm com o buffer de ensaio a uma concentração de 40 µM em 5 mL.
-
Iniciar a reação
- Pipetar 50 µ l de 4 nM [3H] flumazenil para cada poço da placa de 96 poços e mantê-lo em um recipiente de água gelada.
- Adicione 100 µ l da preparação de membranas de subtipo de receptor GABAA ter uma concentração de proteína de 0,5 mg/mL.
- Pipete 50 µ l de 40 diazepam µM para coluna 2.
- Incube a placa por 1h no gelo.
- Adicionar 50 µ l de buffer de ensaio em cada poço de uma placa de 96 poços filtro para separação de membrana subsequentes e medição da radioactividade e parar a reação depois.
-
Parar a reação
- Prepare um tampão de lavagem com 50 mM Tris-HCl, pH 7,4.
- Filtre a solução usando uma colhedora de célula de 96 poços. Lavar a placa 3 x com 300 µ l de tampão de lavagem gelada por bem.
- Selar o fundo do prato com um filme plástico e adicionar 40 µ l de coquetel para líquido de cintilação cintilação contando em cada bem e limpe-a com etanol 70%.
- Agite suavemente a placa pelo menos 1 h no RT Deixe pelo menos mais uma hora no RT
- Medir a radioactividade (em CPM), colocando a placa em um contador de cintilação. Permita uma medição para 3 min por bem.
-
Análise de dados
- Determine que a média para o 8 repetições de ligação não-específica (NSB) e a total vinculação (TB) bem como quanto a duplicatas ou triplica das amostras. Calcule a % de ligação específica (SB) para a média de cada amostra de acordo com a seguinte equação:
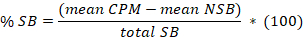
Aqui,
SB total = a TB significa menos a dizer NSB. - Lote em abcissa o SB % versus em ordenadas as concentrações do inibidor. Ajuste os dados usando a equação de análise de concorrência de único site:

Aqui,
y = o % do SB,
A = o mínimo de y,
B = o máximo de y,
C = o IC50,
X = log10 da concentração do composto concorrente,
D = o declive da curva (um coeficiente de Hill). - Calcular a afinidade de ligação (Ki) usando a meia concentração inibitória máxima (IC50), a constante de dissociação (Kd) de flumazenil [3H] sobre as respectivas membranas9e a concentração de [3H] flumazenil no ensaio de acordo com a seguinte equação de dados usando:
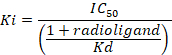
- Determine que a média para o 8 repetições de ligação não-específica (NSB) e a total vinculação (TB) bem como quanto a duplicatas ou triplica das amostras. Calcule a % de ligação específica (SB) para a média de cada amostra de acordo com a seguinte equação:
2. receptor expressão e gravações em oócitos de Xenopus
- Ovários de colheita e preparação do oócito
- Preparar a solução estéril de Barth com 88 mM de NaCl, 1 mM KCl, 2,4 mM NaHCO3, 10 mM HEPES, 0,82 mM MgSO4.7h2O, 0,33 mM Ca (NO3)2.4h2O e 0,41 mM CaCl2.6h2O, pH 7,4 , suplementado com 100 unidades/mL de penicilina, de 100 µ g/mL Estreptomicina e de 0,25 µ g/mL de anfotericina b.
- Prepare o suporte de x OR2 1 (não CaCl2) com 88,5 mM NaCl, KCl de 2,5 mM, 5 mM HEPES, 1 mM MgCl2.6h2O, pH 7,4.
- Sacrifício uma Xenopus Laevis fêmea por anestesia profunda por 20 min em refrigeração tricaina Metanossulfonato (em uma concentração de 150 mg/L, ajustada a pH 7,4) e bicarbonato de sódio (300 mg/L) seguido por decapitação.
- Colher os ovários rapidamente com uma tesoura limpa e fórceps e colocá-los em 2 pratos de Petri (10 cm) preenchido com 40 mL de 1x solução Barth e antibióticos/antimicótico.
- Armazenar os ovários não-dissociado por até 2 semanas em solução de Barth a 4 ° C.
- Para a dissociação, cortar os ovários com uma lâmina de barbear limpo em pequenas fracções (1 a 2 cm3) e incube-os em 50 mL de meio de OR2 sem CaCl2 (OR2-noCaCl2) contendo 0,2% colagenase (tipo I) 17 – 19 ° c em um girador de 100ml balão com uma agitação lenta para 4-5 h.. verificar se a Barra magnética está colocado a aproximadamente 3 a 5 cm acima do fundo do frasco para evitar o esmagamento de oócitos girador.
- Após 4-5 h, verificar que a maioria dos oócitos é libertada de seu folículo (ou seja, eles nadam ao redor individualmente). Lavá-los 5x com 200 mL de OR2 suplementado com 1,8 mM CaCl2.
- Transferi o defolliculated ovócitos para pratos de Petri (10 cm) preenchido com solução de Barth e antibióticos/antimicóticos e mantém-los pelo menos durante a noite a 17 ° C, antes da injeção do cDNA ou mRNA.
- No dia seguinte, selecione, no âmbito de um binóculo, um oócito saudável, apresentando uma clara e distinta animal contra um polo vegetal (marrom escuro para o polo animal contra luz amarela para o polo vegetal). Use limpas pipetas Pasteur e elimine-os oócitos um por um em um prato bem estéril de cônico 96-injeção.
Nota: Nenhum cuidado especial é necessário na colocação de oócitos para as injeções de mRNA; Considerando que, para as injeções de cDNA, é indispensável para orientar os oócitos com polo animal virado para cima.
- injeção automática do mRNA ou do cDNA
- Sintetiza os mRNAs usando um kit disponível comercialmente, seguindo as instruções recomendadas. Limpe os instrumentos e a mesa com RNase e utilize as luvas de proteção adequadas.
Nota: A qualidade do mRNA é determinante para render uma boa expressão, e é indispensável para evitar a degradação do mRNA durante o procedimento de injeção. - Preparar os cDNAs usando um kit disponível comercialmente e dissolver em água bidestilada uma concentração de 0,2 µ g / µ l, a quantidade desejada.
- Injetar nL 10 – 50 da solução do mRNA em uma concentração de 0,2 µ g / µ l ou 10 nL de cDNA solução em concentrações que variam de 0,02-0,2 µ g / µ l, de preferência em lotes de 95 ovócitos.
- Para a membrana proteínas que requerem múltiplas subunidades (ou seja, receptores de GABAA heteromeric α1β2γ2), misturar os mRNAs correspondentes ou cDNAs na proporção desejada (ou seja, 1:1:1 ou 1:10:1).
- Manter o oócito a 17 ° C para evitar a expressão de proteínas de choque do calor por oócitos; armazene a microplaca em uma área de armazenamento thermo-controlado.
- Dissolver os compostos de teste que foram testados positivo no ensaio de ligação em OR2 em 0.1 – 1.000 µM para gravações eletrofisiológicas e descartá-los fora em uma placa de polipropileno de fundo chato de 96 poços.
- Sintetiza os mRNAs usando um kit disponível comercialmente, seguindo as instruções recomendadas. Limpe os instrumentos e a mesa com RNase e utilize as luvas de proteção adequadas.
- Plasmídeos de expressão
- Siga os manuais de instrução de kits comercialmente disponíveis para a síntese de mRNA com promotores T7 ou T6 bacterianas e fazer 20 µ l de uma solução a 0,2 µ g / µ l em água livre de RNase.
- Prepare pelo menos 20 µ l de uma solução que contém um vetor de expressão eucariota para a expressão do cDNA, normalmente em 0,2 µ g / µ l dissolvido em água bidestilada.
- Microinjeção no oócito e visualização da sua qualidade
- Injetar nL 10 – 50 da solução contendo o plasmídeo (ver passo 2.3.1 ou 2.3.2) usar uma agulha de micro-injeção de vidro com um diâmetro de ponta que vão até 100 µm montado em um micromanipulador equipado com um sistema de ejeção de pressão ou com um sistema automatizado de injeção.
Nota: No exemplo discutido aqui, oócitos são injetados por lotes de 95 com um sistema automatizado adequado para uso com cDNA ou mRNA. - Enchem a agulha de injeção de 1 µ l de um corante como o azul de metileno a 1% e injetar os oócitos usando o procedimento padrão (ou no núcleo de cDNA ou no citoplasma de mRNA).
- Elimine os oócitos injetados por cerca de 1 min em água fervente. Corte os oócitos ao meio com uma lâmina de barbear sob um binóculo.
Nota: O corante permanece localizado, como mostrado na Figura 3E, permitindo uma observação precisa da injeção.
- Injetar nL 10 – 50 da solução contendo o plasmídeo (ver passo 2.3.1 ou 2.3.2) usar uma agulha de micro-injeção de vidro com um diâmetro de ponta que vão até 100 µm montado em um micromanipulador equipado com um sistema de ejeção de pressão ou com um sistema automatizado de injeção.
- Gravações de grampo de tensão de dois-eletrodo
- Coloque a placa bem, contendo os ovócitos no sistema automatizado, que utiliza o princípio ilustrado na Figura 4.
Nota: Em contraste com o sistema de braçadeira do remendo ilustrado na Figura 5, o potencial verdadeiro da membrana da célula é lido pelo eléctrodo de tensão. - O sistema de gravação automatizada usando o interface baseado em ícones com, por exemplo, o esquema ilustrado na Figura 6 para a determinação da relação atividade concentração do programa.
- Coloque a placa bem, contendo os ovócitos no sistema automatizado, que utiliza o princípio ilustrado na Figura 4.
- Encaixe de curva
- Analisar os resultados usando o software apropriado, utilizando a curva de ativação de concentração ilustrado, traçar a amplitude atual em função do logaritmo da concentração de agonista.
- Observe a curva sigmoidal que pode posteriormente ser equipada com a equação empírica de Hill na forma:
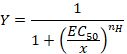
Aqui,
Y= a fração da corrente evocado,
CE 50 = a concentração para uma ativação de 50%,
x = concentração do composto,
nH = o coeficiente de Hill ou aparente cooperatividade. - Normalize as correntes de uma unidade, dividindo a amplitude de cada resposta contra o valor registado na concentração mais alta para analisar os dados obtidos de uma série de células.
- Determinar a média e erros padrão e perceber o encaixe de curva usando software canonicamente disponível.
3. eletrofisiológicas gravações em fatias de cérebro
Nota: Fatias Hippocampal do rato são preparadas em conformidade com as diretrizes nacionais e institucionais.
-
Preparação de fatias de hipocampo
- Preparar o dissecação artificial cerebro-líquido espinhal (dACSF) com 124 mM NaCl 124, 2.5 mM KCl, 1,25 mM KH2PO4, 2mm MgSO4.7h2O, 2,5 mM CaCl2 2 H2O, 26mm NaHCO3, glicose de 10 mM e 4 mM sacarose, câmara de gás na garrafa com uma mistura de 95% O2 e 5% de CO2.
- Preparar o gravação artificial cerebro-líquido espinhal (rACSF) com 124 mM NaCl, 5 mM KCl, 1,25 mM KH2PO4, 2mm MgSO4.7h2O, 2,5 mM CaCl2 2 H2O, 25mm NaHCO3e glicose 10 mM Câmara de gás na garrafa com uma mistura de 95% O2 e 5% de CO2.
- Anestesiar os ratos usando uma mistura de 2,5% de isoflurano e oxigênio puro e decapitá-los.
- Corte o couro cabeludo seguindo a linha mediana com um belo par de tesouras. Corte o crânio ao longo da linha mediana, sem danificar o tecido subjacente. Remover o crânio com uma pinça e use uma espátula bem para colher o cérebro.
- Coloque o cérebro na solução dACSF gaseados em RT e dissecar a formação hipocampo esquerda com uma espátula fina.
- Cortar fatias transversais (400 µm de espessura) da parte média do hipocampo com um helicóptero de tecido e transferi-los para a câmara de gravação com o uso de um pincel de pintura. Manter as fatias no RT por 45 min.
- Perfundir as fatias com o rACSF prontinha a 35 ° C e a uma taxa de 1,5 mL/min. bolha a solução com uma mistura de 95% O2 e 5% de CO2.
Nota: Após esta etapa, as fatias estão prontas para os experimentos eletrofisiológicos.
-
Gravação de pico de população
- Coloque uma fatia do cérebro para a câmara de microscópio-montado.
- Perfundir a fatia a uma taxa de 3 mL/min com rACSF.
- Puxe uma micropipeta de vidro borosilicato com o extrator de pipeta tendo uma resistência de ~ 2 MΩ.
Nota: Esta micropipeta é usada como um elétrodo de gravação e é eletricamente ligada ao amplificador. - Encha a micropipeta com uma solução contendo 2 M NaCl e coloque-o no suporte da pipeta do amplificador.
- Posição a micropipeta de gravação no estrato pyramidale na região CA1 da fatia hippocampal usando o micromanipulador certo.
Nota: A localização é representada esquematicamente na Figura 7. - Coloque um eletrodo bipolar isolado de platina/irídio no suporte da esquerda micromanipulador.
Nota: Este eletrodo é usado como o eletrodo de estimulação e é eletricamente conectado ao gerador de estímulo. - Posição do eletrodo de estimulação nas colaterais de Schaffer na região CA1 da fatia hippocampal usando o micromanipulador certo.
Nota: A localização é representada esquematicamente na Figura 7. - Entregar um pulso atual para o eletrodo de estimulação, usando o gerador de estímulo a cada 30 s (100 µs durações, começando em 10 µA) e aumentar gradualmente a força de estimulação até que apareça um pico de população (PS).
- Ajuste a força de estímulo para evocar um PS correspondente a 45% da amplitude máxima que pode ser obtido. PSs são filtrados de 2,4 KHz e digitalizados em 20 KHz usando o amplificador de sinal.
-
Inibição de pulso emparelhado
- Prepare as fatias de cérebro (passo 3.1) e prossiga conforme descrito anteriormente (passos 3.2.1–3.2.7).
- Entregar dois pulsos de corrente (100 µs durações em um intervalo de 20 ms) para o eletrodo de estimulação cada 30 s usando o gerador de estímulo. Defina a força de estímulo para evocar um PS correspondente a 45% da amplitude máxima.
-
Composto de teste
- Fazer diluições dos compostos a ser testado em ACSF prontinha para que a concentração final de DMSO não superior a 0,1%.
- Adicione DMSO para a solução de controle na mesma concentração do que na solução de composto.
- Gravar um single (passo 3.2) ou um PS emparelhado-pulso (passo 3.3) evocada por estímulos colaterais de Schaffer cada 30 s pelo menos 30 min. A forma de PS deve ser estável durante este período de base.
- Prepare um copo com gaseadas rACSF contendo uma concentração fixa do composto a ser testado.
- Perfundir a fatia hippocampal com esta solução enquanto ainda gravava PS único ou emparelhado-pulso.
- Avalie a recuperação do efeito composto por perfusing a fatia com gaseadas rACSF sem o composto.
Nota: Para efeitos reversíveis, o PS reverte à sua forma inicial observada durante o período de base antes da aplicação do composto.
-
Análise de dados
- Média os PS vestígios gravados durante o experimento em blocos de 4 usando o software de análise de dados.
- Medir as amplitudes de PS dos traços em média.
- Normalize as amplitudes em percentagem dos valores de base gravada 10 min antes de perfusing um composto.
- Expressar os dados como média ± SEM.
Resultados
Vinculação:
O ensaio em vitro com membranas celulares é usado para identificar seletiva humana GABAA α5β3γ2 ligandos de receptores vinculação no local alostérico do γ2 de BZD contendo receptores. Transitoriamente transfectadas células HEK293, expressando a humana GABAA α5β3γ2, α1β3γ2, α2β3γ2 e α3β3γ2 receptores são utilizadas para preparar as membranas para este ensaio. O efeito dos ligantes potenciais é detectado pela medição da cintilação de flumazenil [3H] vinculado aos receptores de membrana (uma inibição da ligação de flumazenil [3H]). Curvas de ligação de deslocamento são então geradas para avaliar a seletividade dos compostos para um específico do receptor GABAA como no exemplo com RO4938581 (Figura 8). Figura 9 resume o perfil de diversos compostos de referência, incluindo a do α5 seletiva GABAA modulador do receptor negativo alostérico, RO49385819, que foram gerados usando o ensaio de ligação.
Gravações em Xenopus ovócitos:
A expressão dos receptores GABAA , tais como o heteromer de α5β3γ2 produz correntes robustas em resposta à exposição de GABA. Gravações de grampo de tensão típicos obtidos em um oócito expressando a α5β3γ2 humana em resposta a impulsos de GABA breves (30 s) variando até 300 µM são mostrados na Figura 6. Neste experimento, as diferentes concentrações de GABA foram eliminadas na placa de 96 poços e as respostas foram evocadas, movendo o celular em um bem específico. O GABA foi minuciosamente lavado retornando a célula para a câmara de perfusão central e aplicando uma perfusão de solução de controle ativando a bomba peristáltica correspondente. A sequência do programa utilizada para a determinação da curva de concentração de ativação é ilustrada na Figura 6A. Realizado inteiramente automaticamente, esses dados ilustram a qualidade das gravações que podem ser obtidos em oócitos de Xenopus e o alto nível de expressão do receptor obtidos alguns dias após a injeção de mRNA. As experiências, conduzidas em combinações diferentes do receptor, produzem uma série de CE50s, que é a concentração do necessário activar metade dos receptores de GABA. Um terreno de CE50valores em um gráfico de aranha, como ilustrado na Figura 10, fornece uma rápida comparação das propriedades do receptor e a influência da composição da subunidade.
Para examinar o efeito de um modulador alostérico negativo ou positivo (NAM ou PAM), é necessário comparar a resposta evocada por um pulso de teste do agonista (GABA), primeiro no controle e, em seguida, na presença do modulador. Um protocolo experimental eficiente para realizar tal experiência é ilustrado na Figura 11. A resposta da célula a uma concentração de referência de GABA é determinada primeiro e a sequência é repetida, aplicando a mesma concentração de GABA e, em seguida, por uma aplicação co do GABA além do modulador. Uma trama das duas respostas sobrepostas revela neste exemplo uma marcada inibição causada pela presença do modulador. Uma quantificação do efeito modulador prontamente é obtida calculando-se a relação da resposta evocada na presença do modulador versus o controle e os resultados podem ser plotados sob a forma de uma parcela de calor. Os dados mostrados na Figura 12 ilustram o enredo de calor correspondente para as gravações de três conjuntos de dados obtidos por 96 compostos.
Após a identificação dos compostos que são suficientemente ativos, muitas vezes é indispensável para avaliar se estas moléculas são ativas em outras combinações de receptor. No caso do receptor GABAA , foram identificados 19 genes que codificam para diferentes subunidades, e é sabido que um receptor funcional pode resultar de um assembly multiméricas de subunidades diferentes (ver Knoflach, Hernandez e Bertrand10 para uma revisão). Embora o rendimento múltiplas subunidades e combinações de um vasto repertório do receptor subtipos que podem exigir um grande número de rastreio de contador para ser executada, muitas vezes é possível se concentrar primeiro no mais abundante de subtipo que, no caso do GABAA receptores, é a composição de α1β2γ2. Experimentos conduzidos a cabeça a cabeça com a expressão de, por exemplo, α5β3γ2 e α1β2γ2 no mesmo lote do oócito produzem uma boa comparação dos respectivos efeitos de uma determinada molécula. Os resultados típicos obtidos em três células para α5β3γ2 e α1β2γ2 são mostrados na Figura 13, que ilustra a modulação preferencial positiva de uma molécula no α5β3γ2.
O protocolo experimental, ilustrado na Figura 11 é bem adequado para a caracterização de uma atividade de PAM. Neste protocolo, o composto que é testado é aplicado co com o agonista em concentrações progressivamente crescentes. Para evitar os possíveis efeitos cumulativos causados por vários aplicativos na mesma célula, uma célula nova e ingênuo é medida para cada ponto de dados. Uma medida da amplitude da resposta gravada com o agonista sozinho e em seguida, durante a aplicação do composto produz uma relação que quantifica o efeito PAM ou NAM. Resultados típicos obtidos em α1β2γ2 e α5β3γ2 para o diazepam são mostrados na Figura 14, revelando uma sensibilidade aparente do α5β3γ2 que é aproximadamente 10-fold maior para esta combinação do receptor. Esses valores são em boa correlação com os dados publicados11. Como acredita-se que o site de benzodiazepínicos é constituído pela interface entre o γ2 e sua subunidade α adjacentes12-14, a sensibilidade do α5β3γ2 sugere uma afinidade de diazepam preferencial para γ2-α5 sobre γ2-α1. A possibilidade de expressar combinações diferentes do receptor, combinadas com uma eficiente caracterização funcional abre-se várias maneiras de explorar os determinantes da PAM Propriedades e sua implicação para efeitos fisiológicos e farmacológicos.
Fatias do hipocampo do cérebro:
Os experimentos com fatias hippocampal cérebro de rato são conduzidos para validar o perfil farmacológico dos compostos identificados em ensaios em vitro num modelo nativa do receptor. Os subtipos de receptores GABAA predominante expressados nas células piramidais do hipocampo são α1β2/3γ2, α2β2/3γ2 e α5β2/3γ2, que todos são moduladas por benzodiazepínicos (BDZs)15. Inibição de pulso pareado é um paradigma que pode revelar a excitabilidade do circuito hippocampal testando a mudança na resposta do segundo de dois estímulos elétricos emparelhados entregado separados 20 ms. A mudança da segunda resposta é devido a realimentação gabaérgica por interneurônios que inervam a camada de célula piramidal16-18. Como mostrado na Figura 7, a situação de controle, a segunda resposta de dois estímulos pareados é inibida devido a uma inibição GABAérgica. Quando esta inibição é reduzida pela perfusing a fatia com β-CCM, um não-seletivo NAM, a segunda resposta dos dois estímulos pareados é inibida em muito menor escala. Este paradigma experimental é sensível aos compostos seletivos para um receptor de GABAA contendo o α5 subunit.
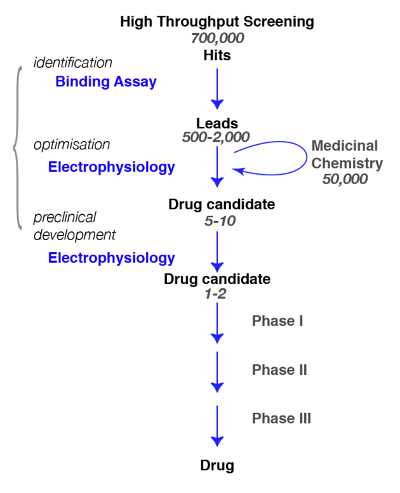
Figura 1 : Estratégia de rastreio. Uma droga típica de rastreio via começa com a triagem de alto rendimento em que grandes bibliotecas de compostos são selecionadas para um destino específico. Após a identificação do candidato principal, começa o trabalho de química medicinal. Durante esta fase, os químicos irão estudar e refinar as moléculas através da realização de uma modificação estrutural para atender aos critérios desejados, tais como a seletividade de alvo, penetrância de cérebro, estabilidade, degradação etc. durante esta fase crucial, é essencial para avaliar se as modificações químicas não alterei as propriedades da molécula e refinar para o melhor candidato. O passo seguinte é identificar alguns promissores compostos e trazê-los para as próximas etapas incluem segurança, tolerância, etc. nota que eletrofisiologia é indicado como o funcional do ensaio mas que outros métodos, incluindo a fluorescência de cálcio ensaios ou corantes sensíveis de tensão, pode ser usado como alternativas. Estes últimos métodos também são utilizados em ensaios de alta produtividade como uma substituição para ensaios obrigatórios. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Layout de um 96 poços chapeado utilizados para experiências de vinculação. Coluna 1 é usada para medições de total vinculação e coluna 2 para medições de ligação não-específica. Linhas A-H são preenchidos com 4 diferentes compostos em aumentar as concentrações (colunas 3-12), cada composto em duplicatas (ou seja, 1 composto em linhas A e E, 2 compostos em linhas B e F, etc) representado no layout com cores diferentes. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Usando um sistema automatizado de microinjection. (A), A XYZ sistema preciso, em que uma agulha de injeção de vidro enchida com o líquido que contém o plasmídeo de interesse, é automaticamente picado em oócitos. (B) este painel mostra a placa de 96 poços-fundo cónico no qual (C) Os oócitos são injetados automaticamente. (D), este painel ilustra o princípio de injeção. Para a injeção nuclear, a agulha penetra o ovócito ligeiramente mais profundo do que o núcleo, conforme é mostrado no painel B. Em seguida, a agulha é retirada do núcleo (ver painel C) antes da injeção (ver painel D). (E) para avaliar a qualidade da injeção, a agulha pode ser preenchido com uma tintura e oócitos "cozinhado" podem ser cortados ao meio. Clique aqui para ver uma versão maior desta figura.
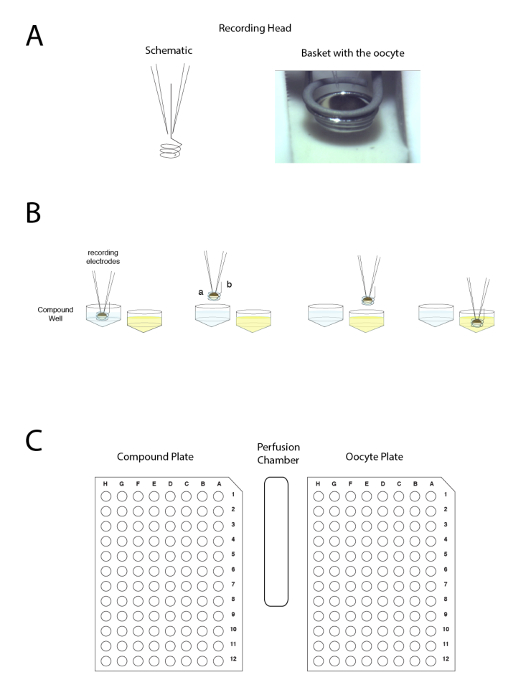
Figura 4 : O princípio de eletrodo de tensão-dois braçadeira automatizado. O princípio baseia-se mover a preparação entre poços, em vez de aplicar o líquido na perfusão. (A), do lado esquerdo do painel representa a disposição que permite a gravação em um oócito Xenopus com os dois eletrodos e a pequena cesta que irá manter uma gota de líquido em torno da preparação durante o movimento de uma amostra para outro. Uma foto do oócito colocado na cesta com os dois eletrodos é mostrada no lado direito. (B), este painel mostra uma representação esquemática de "cabeça para baixo" a eletrofisiologia princípio de gravação. (C), este painel mostra a disposição do oócito, placa composta e estação de lavagem sobre a mesa de gravação. Clique aqui para ver uma versão maior desta figura.

Figura 5 : Grampo de tensão de dois-eletrodo gravação contra braçadeira do remendo. Um grampo de tensão típica de dois-eletrodo gravação para oócitos (painel esquerdo) é comparado com a configuração de braçadeira do remendo usada para uma linha de celular (painel direito). Observe a diferença de tamanho entre os oócitos que são cerca de 1 mm de diâmetro, contra as células que são cerca de 20 µm. No grampo de tensão de dois-eletrodo, o potencial de membrana do oócito é comparado com a tensão de exploração desejada e a diferença de sinal é injectada o eletrodo atual. Em uma gravação de braçadeira do remendo, presume-se que a resistência do eletrodo de braçadeira do remendo é negligenciável contra a resistência da membrana e, portanto, que a tensão imposta pelo amplificador fielmente é alimentada para a membrana celular19. A figura ilustra uma perfusão de filamento líquido no qual os dois canais de um tubo de theta () são preenchidos com, por um lado, uma solução de controle e, por outro lado, com a solução contendo a droga20,21. Clique aqui para ver uma versão maior desta figura.
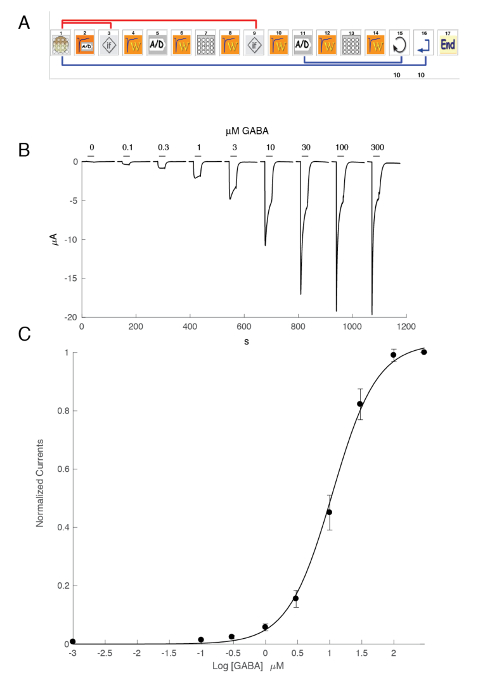
Figura 6 : Relação de ativação de concentração para os receptores da α5β3γ2 humana. (A), a sequência de controle o sistema automatizado consiste de uma série de ícones e define o protocolo experimental para a determinação da relação de ativação de concentração. Nas etapas 1-3, como mostrado neste painel, o sistema carrega o oócito da placa dentro da cesta de medição. A corrente de fuga é medida na etapa 2 e, deve esse valor exceder os critérios desejados, a célula é automaticamente alterada (etapa 3). Após um período de estabilização (etapa 4), a resposta do oócito de uma referência de concentração de GABA é medidas (as etapas 5-8). Oócitos exibindo correntes maiores que 1 µA são mantidos para a medição subsequente. Nos passos 11 a 13, a célula é desafiada por diferentes concentrações de GABAA e o processo repete-se para o número desejado de concentrações (etapa 14) e células (passo 15). (B) este painel mostra as correntes típicas evocadas por uma série de aplicações de GABA breves (30 s) aplicado em crescente ordem. O timing do aplicativo composto é indicado pelas barras. (C) A parcela da corrente de pico para dentro como uma função do logaritmo da concentração de GABA produz a curva de ativação de concentração que seja prontamente equipada pela equação empírica Hill, com uma curva contínua, um CE50 em cerca de 11 µM e uma colina coeficiente de 1.3. Correntes, gravadas em 8 células foram normalizadas para uma unidade para a máxima resposta evocada. As barras indicam o erro padrão da média. Clique aqui para ver uma versão maior desta figura.
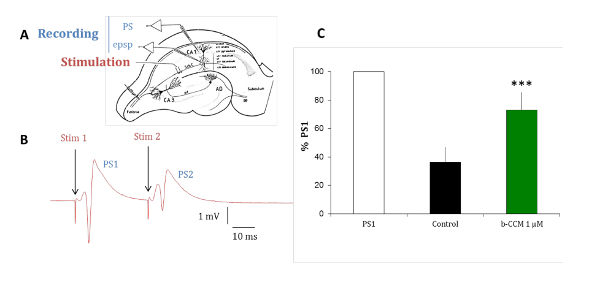
Figura 7 : Β-CCM, NAM uma GABAA reduz a inibição de pulso pareado em fatias hippocampal. (A), este painel mostra uma representação esquemática de uma fatia de hippocampal do rato. As garantias Schaffer (Sch C) provenientes do projeto CA3 célula piramidal axônios a arborização dendrítica dos neurônios piramidais CA1. Micropipetas foram colocadas no estrato pyramidale (str pyramidale) para registrar picos de população (PS) e no estrato radiatum (str radiatum) para gravações dendríticas de potenciais pós-sinápticos excitatórios (epsp) de campo. O eletrodo de estimulação foi colocado dentro da colaterais de Schaffer. (B) este painel mostra PSs evocadas por estímulos pareados aplicados através do eletrodo mesmo estimulante em um intervalo de 20 ms. A resposta da população para o segundo estímulo (PS2) é de menor amplitude do que a resposta ao estímulo do primeiro (PS1). PSs (C) foram gravadas na ausência (barra preta) e presença de β-CCM, uma NAM não-seletivo de receptores GABAA (barra verde). Β-CCM reforçada a amplitude do PS2 segundo bloqueando parcialmente qualquer inibição GABAérgica do feed-forward. As barras indicam o erro padrão da média e * * * que os dados são altamente significativos com p < 0,01. Clique aqui para ver uma versão maior desta figura.

Figura 8: ligação típica resultados obtidos em um ensaio (inibição ou deslocamento) competitivo. Curvas de ligação de deslocamento são geradas a partir de que o IC50 e o Ki podem ser determinado. IC50 é a concentração de um ligante concorrente que desloca 50% da ligação específica do radioligantes e Ki (a constante de inibição para uma droga) é a concentração de um ligante concorrente que pode ocupar 50% dos receptores de se não radioligantes estavam presentes. O Ki é calculado a partir do IC50 usando a equação de Cheng-Prusoff:
Por favor clique aqui para ver uma versão maior desta figura.
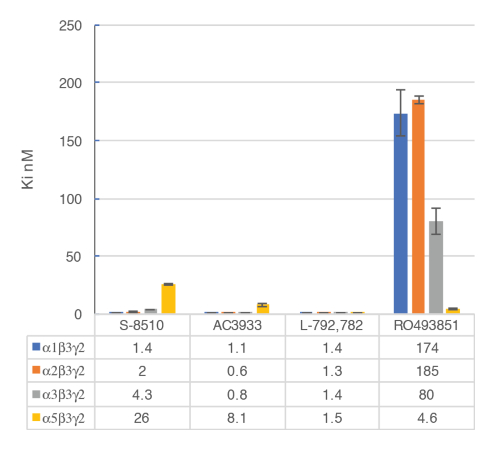
Figura 9 : Vinculação de deslocamento competitivo foi realizada com ligantes vinculação nos principais subtipos de receptores GABAA . Afinidades (nM) foram medidas utilizando um ensaio [3H] flumazenil e membranas de células HEK293 transitoriamente transfected com combinações diferentes de subunidade do receptor GABAA humana. A representação de histograma ilustra claramente a sensibilidade diferencial observada para o composto RO493851 com o Ki mais baixo para os receptores de α5β3γ2. Clique aqui para ver uma versão maior desta figura.
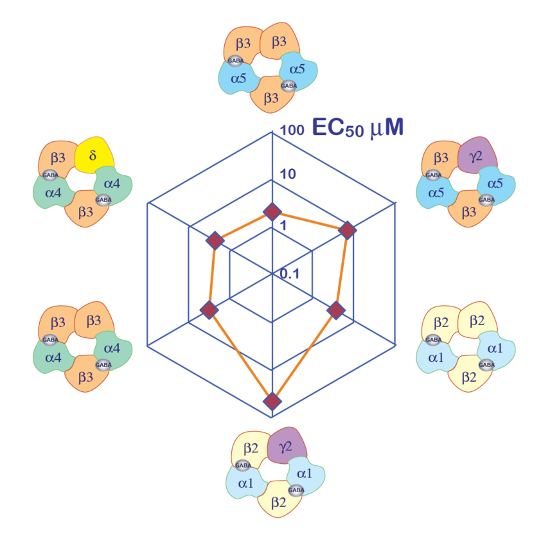
Figura 10 : Sensibilidade diferencial GABA receptores. Uma parcela do receptor GABA CE50 em um terreno de aranha e uma representação da composição da subunidade putativo fornecem maneiras eficientes para comparar o papel das diferentes subunidades. Observe que a introdução das subunidades γ2 é associada com uma diminuição da sensibilidade do receptor. Clique aqui para ver uma versão maior desta figura.
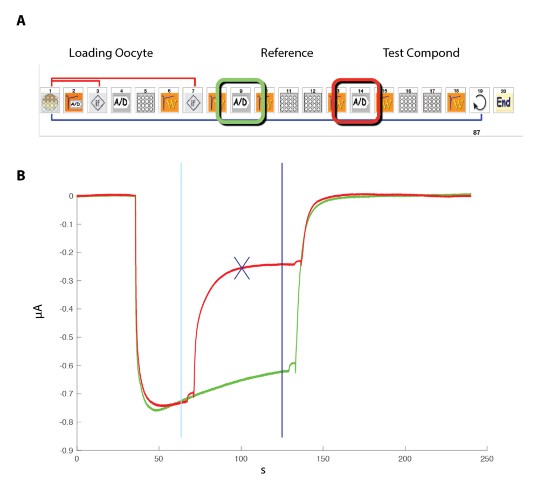
Figura 11 : O efeito de um modulador de sondagem. (A), este painel ilustra a sequência de ícone usada para controlar o sistema automatizado. Observe que os dois ícones (A/D) correspondem a gravação no controle (verde) e durante a exposição do modulador (vermelho). (B), este painel mostra correntes típicas gravadas numa cela expressando o receptor GABAA durante tal sequência. Para avaliar os efeitos de um modulador, realizou-se uma sequência de medir primeiro a resposta evocada pela exposição a uma concentração fixa de GABA (sinal verde), seguida pela exposição primeiro a GABA e em seguida para o modulador (traço vermelho), além de GABA. Os cursores de mira (ciano e azul) de posicionamento delimita as medições, e a cruz azul indica a diferença máxima entre as duas condições de gravação. A relação entre a condição de controle e modulador é calculada automaticamente o software de análise. Clique aqui para ver uma versão maior desta figura.

Figura 12 : Trama do calor com três repetições. Este painel mostra uma trama de calor correspondente a três repetições do modulador efeitos obtidos para 96 compostos para os receptores de GABAA α5β3γ2 humana. Os rácios da resposta sobre o controle que varia entre 0,5 e 1,2 teste foram considerados como não significativamente diferente do controle e são representados por um ponto verde. Rácios abaixo 0.5 foram considerados como representando um efeito inibitório e são representados pelos pontos azuis. Rácios acima 1.2 foram considerados como melhorar a resposta e são representados por pontos vermelhos. Observe a semelhança no padrão entre as três gravações independentes. Clique aqui para ver uma versão maior desta figura.
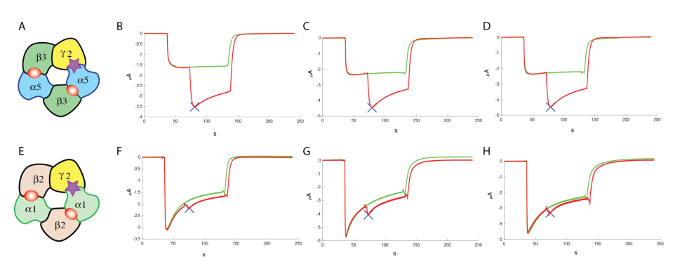
Figura 13 : Combater a triagem no α1β2γ2. (A), este painel mostra uma representação de uma organização de subunidade putativo. Os seguintes painéis mostram (B-D) uma avaliação dos efeitos de um modulador alostérico positivo no α5β3γ2 humano e (F-H) em α1β2γ2, usando concentrações comparáveis de GABA e concentrações semelhantes (100 µM) do modulador, que evidenciam a especificidade do composto testado nestas experiências. (E), este painel mostra também uma representação de uma organização de subunidade putativo. Clique aqui para ver uma versão maior desta figura.
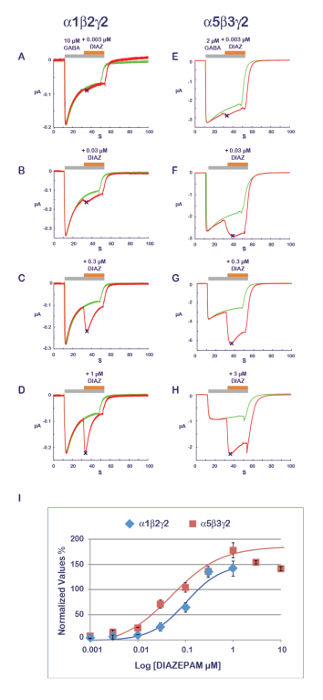
Figura 14 : Composição de sensibilidade e receptor de PAM. A determinação dos efeitos de uma série de concentrações dos efeitos do diazepam (A-D) em α1β2γ2 e (E-H) α5β3γ2 receptores revela quase 10 vezes diferença na afinidade aparente. Observe também a influência da composição do curso do tempo de resposta subunidade com uma dessensibilização mais rápida em receptores α1β2γ2 (ver, por exemplo, painéis D e H). Observe que, como o α1β2γ2 e α5β3γ2 receptores exibir diferentes afinidades para GABA (ver Figura 10), a concentração de agonista foi ajustada entre os dois receptores em um intervalo de ativação comparáveis. (I) este painel representa uma parcela da prega aumento em uma amplitude atual normalizado a unidade contra a condição de controle. Clique aqui para ver uma versão maior desta figura.
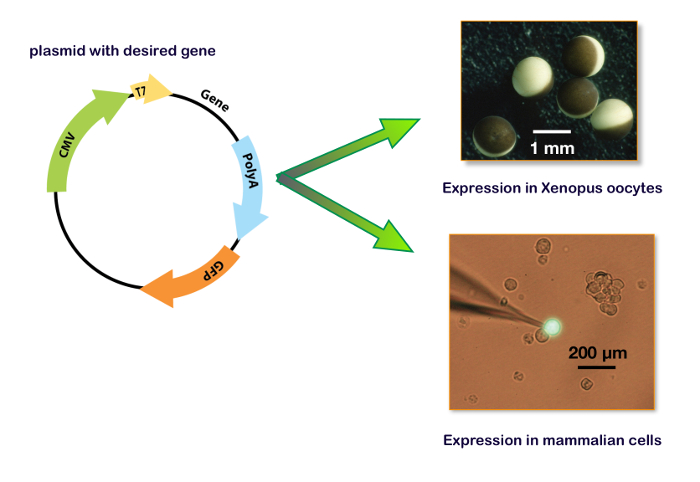
Figura 15 : Plasmídeo de expressão, incluindo o promotor T7 e CMV. Estes painéis mostram o plasmídeo para a expressão em um oócito Xenopus (painel superior direito) e em uma linha de celular. O painel direito inferior ilustra uma típica célula de HEK-293 transfectada com um plasmídeo que contém também o gene para uma proteína verde fluorescente (GFP) com o eletrodo gravação remendo-braçadeira. Clique aqui para ver uma versão maior desta figura.
Discussão
O desenvolvimento de novos compostos ativos em um canal de ligante iônicos como os receptores GABAA requer o uso de múltiplas abordagens. Normalmente, o primeiro passo é muitas vezes realizado utilizando ensaios obrigatórios; no entanto, tais medidas são insuficientes para caracterizar a atividade fisiológica de composto ou sua farmacologia precisa. Em particular, um composto que se liga a um receptor pode melhorar ou inibir sua função ou mesmo não produzir nenhum efeito funcional (ficar em silêncio) (ou seja, ligar o receptor sem modificar sua função). Assim, um teste funcional é necessário para uma caracterização completa composta.
Ensaios de vinculação:
A principal vantagem do ensaio de ligação é que pode ser conduzida eficientemente em um grande número de amostras que variam até vários milhares, e que fornece afinidades de ligação para as moléculas ativas. Conforme descrito neste documento, o primeiro passo consiste em estabelecer um método para a avaliação dos subtipos de receptor desejado. Ou seja, enquanto a ligação pode ser conduzida nos receptores nativos de frações ou cérebro inteiro, tal método impedirá a determinação das afinidades em subtipos de receptores específicos. É, portanto, necessário usar sistemas de recombinação de moléculas de tela para o alvo desejado. Hoje em dia, um transfection transitória ou estável de cDNAs de subunidade do receptor desejado em linhas celulares oferece um método eficiente e confiável para expressar os subtipos de receptores de interesse (por exemplo, GABAA α5β3γ2). Ligação tradicional ensaios fazem usar de radioligands, mas hoje em dia as técnicas estão disponíveis que evitar a inconveniência de manipulação de radioatividade (por exemplo, ligação de ligante quantitativa baseada em fluorescência).
Expressão funcional em um sistema host:
Para expressar genes em um sistema host, a sequência de codificação de interesse deve ser inserida em um plasmídeo que contém os promotores adequadas. Normalmente, para a síntese de mRNA em vitro , os promotores T7 ou T6 bacterianas são usados. Para uma expressão do cDNA, a transcrição do gene de interesse deve ser regulada por um promotor eucariota como CMV (Citomegalovírus) ou equivalente. Hoje em dia, vários plasmídeos, incluindo os dois promotores (i.e., pUNIV, pCMV-6AC, psf-CMV/T7, pCI-neo, pcDNA), estão disponíveis, permitindo uma síntese em vitro de mRNA ou uma expressão do cDNA, conforme mostrado na Figura 15. Uma expressão dos receptores de GABAA pode ser obtida fielmente em linhas celulares ou em oócitos de Xenopus . As vantagens principais deste último são a falta de uma expressão do receptor endógeno, a simplicidade de manipulações e a disponibilidade de um sistema automatizado para microinjeções e gravações. Os procedimentos descritos no presente protocolo ilustram a eficiência do sistema automatizado que permite a injeção de 96 oócitos em cerca de 7 min e não requer nenhuma habilidade de micromanipulação. Lembrando que um único ovário de uma Xenopus contém entre 10.000 – 30.000 ovócitos, é claro que um grande número de medições de célula pode ser realizado em uma única preparação. Além disso, como uma expressão pode ser realizada usando injeções de cDNA, o mesmo plasmídeo contendo os genes de interesse que são desenvolvidos para os experimentos de ligação pode ser usado para uma caracterização funcional sem a necessidade de mais biologia molecular manipulações.
Devido a seu grande tamanho e alta expressão de superfície, um único oócito produz um número de receptores que é aproximadamente equivalente as confluentes em uma placa de Petri de 35mm. No entanto, uma preparação de oócitos e injeção representa uma fração do custo de uma linha de celular, como os experimentos não necessitam de um meio de cultura específico e manipulações estéreis. A ativação de um único canal de GABAA produz alguns picoamperes (10-12) e correntes que variam até dezenas de microampere (10-6) registam-se facilmente em um único ovócito, que confirma a atividade concomitante de vários milhões de receptores durante uma única resposta.
Um primeiro passo para a caracterização de canais iônicos ligante é, muitas vezes, a determinação da afinidade dos receptores de aparente. As experiências que devem ser realizados consistem em aplicar uma série de pulsos de teste breve agonista e plotagem a amplitude do evocado atual ou, em certos casos, a área sob a curva (AUC) em função do logaritmo da concentração de agonista. Como é facilmente viável para microinjeção concentrações diferentes do plasmídeo e relação do mesmo lote de oócitos, este sistema de expressão é particularmente apropriado para tal uma caracterização. Além disso, uma comparação de lotes revelou um elevado grau de estabilidade para diferentes CE50s. A influência da composição na aparente afinidade do receptor, a subunidade é facilmente visualizada usando uma trama de aranha, como exemplificado na Figura 10.
Os resultados da mordaça dois-eletrodo tensão obtidos em oócitos de Xenopus são frequentemente comparados com gravações feitas usando eletrodos de braçadeira do remendo. Considerando que iria além do escopo deste trabalho entrar uma comparação detalhada entre esses dois sistemas, alguns pontos podem ser examinados. Enquanto uma braçadeira do remendo nas células oferece vantagens para uma caracterização biofísica com uma aplicação rápida da droga, seus requisitos são mais complexos do que as das gravações em oócitos de Xenopus dois-eletrodo. Uma dificuldade não negligenciável e primeira é a expressão de uma proteína dada com a necessidade de uma cultura de células, um transeunte ou transfection estável e a identificação das células que expressam a construção desejada. Além disso, é indispensável examinar a possível contribuição da expressão na célula considerada endógeno. Além disso, uma gravação de braçadeira do remendo exige uma pessoa qualificada realizar a micromanipulação sob um microscópio de alta ampliação, enquanto que a pessoa também precisa realizar uma análise adequada durante o experimento para avaliar, por exemplo, a qualidade do selo, a resistência de acesso etc , em contraste, um grampo de tensão de dois-eletrodo gravação, especialmente um usando um sistema automatizado eletrofisiológico, não requer nenhumas habilidades específicas e pode ser conduzida por técnicos de laboratório.
Ao adquirir um set-up eletrofisiológico, consideração de custo é certamente um fator importante que precisa ser analisado cuidadosamente. Por exemplo, enquanto o custo de um sistema automatizado é relativamente alto, uma comparação mais atento revela que a instalação de um equipamento completo de eletrofisiológico inclui a compra de equipamentos, tais como boas Micromanipuladores, uma lente binocular, um amplificador, uma perfusão sistema e uma tabela de antivibração, enquanto também a aquisição de dados e realizar uma análise. Uma comparação de custo entre uma tensão de dois elétrodos braçadeira set-up contra uma afinação de braçadeira do remendo revela discrepâncias ainda mais. Além disso, o sistema automatizado oferece a vantagem de equipamento totalmente automatizado e executado sem vigilância dia e noite.
As propriedades farmacológicas de um composto são determinadas pelo seu modo de ação no receptor. Por exemplo, inibidores do competidor são moléculas que podem entrar na mesma ligação de bolso, ou orthosteric local, como o agonista em si provoca uma competição. Inibidores não-competitivos são compostos que inibem os receptores interagindo em outro site e, no caso de um canal iônicos ligante, que podem entrar e bloquear o poro iônico, por exemplo. Vai além do escopo deste trabalho para examinar os diferentes mecanismos de interação, mas mais informações podem ser obtidas de um livro farmacológico e/ou de outros trabalhos como Bertrand e de Bertrand22.
No caso de moduladores alostéricos, o composto liga em um site que é distinto do site orthosteric, mas a presença da molécula modifica a barreira de energia entre os Estados ativos e outros. Moduladores alostéricos positivos (PAMs) são compostos que reduzem a barreira de energia da descansar para o estado ativo e, portanto, aumentar o efeito do agonista. Para caracterizar possíveis efeitos do PAM, é, portanto, necessário determinar se um risco sobre o composto melhora a resposta para o agonista e, em caso afirmativo, em qual concentração. Os experimentos apresentados na Figura 11 e Figura 14 ilustram os protocolos que podem ser usados com sucesso para a caracterização dos PAMs nos receptores GABAA .
Em alguns casos, a exposição para o PAM sozinho pode ser suficiente para ativar os receptores. Tal atividade pode ser determinada por uma ligeira modificação do protocolo experimental apresentado aqui. Ou seja, em vez de usar um aplicativo co do modulador durante a exposição para o GABA, o protocolo pode ser modificado para a aplicação do primeiro o composto sozinho e, em seguida, na presença do GABA. Uma caracterização da atividade agonista direta será feita pela determinação da amplitude da resposta evocada pelo composto em si e em comparação com a corrente de GABA-evocada.
Experimentos conduzidos em fatias do cérebro, tal como ilustrado na Figura 7, são usados para confirmar a atividade composta em receptores nativos em um circuito inibitório definitivo antes de prosseguir em modelos animais e ao longo da via para ensaios clínicos. O protocolo de gravação e análise de dados relativamente simples permite que o ranking de vários compostos, avaliando seu efeito diferencial moduladora na amplitude do PS. Efeitos não-específicos de compostos que não estão relacionados com o sistema GABA podem também ser detectado (por exemplo, quando são observadas alterações na forma PS). Direto, a neurotransmissão gabaérgica pode ser avaliada nestes casos medindo os efeitos dos compostos em correntes pós-sináptico inibitórios (IPSCs) usando a braçadeira de remendo de células inteiras técnica8.
Divulgações
Os autores Frédéric Knoflach e Maria-Clemencia Hernandez são empregados da F. Hoffmann-La Roche AG, 4070 Basel, na Suíça, uma empresa farmacêutica. O autor Daniel Bertrand é um empregado da HiQScreen Sàrl 6, rte de Compois, 1222 Vésenaz Genebra, Suíça, fornecimento de instalações de triagem às empresas farmacêuticas.
Agradecimentos
Os autores agradecer Judith Lengyel, Maria Karg, Grégoire Friz, Rachel Haab, Marie Claire Pflimlin da Roche e Tifany Schaer e Deborah Paolucci de HiQScreen por sua excelente assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| 96 well cell harvester -(Filtermate 196) | Packard | To filter membranes with bound radioligand | |
| Microtiter plate liquid scintillation counter (Top Count NXT) | Packard | Microplate Scintillation and Luminescence counter | |
| Vial liquid scintillation counter (Beta-Couter 2500 TR) | Packard | Vial Scintillation and Luminescence counter | |
| Liquid handler (Biomek 2000) | Beckman coulter | To prepare compound dilutions | |
| Vortex (Vortex Genie 2) | Scientific industries Inc. | To mix compound stock solutions | |
| Tissue homogenizer (Polytron PT1200E) | Kinematica AG | To resuspend the membrane preparations | |
| XLfit5 software | Microsoft Excel add-on by IDBS | Curve fitting software | |
| Smart Pull | UniPix | - | Electrode Puller |
| RoboInject | MultiChannel Systems | - | Automated Injection (Xenopus Oocytes) |
| HiClamp | MultiChannel Systems | - | Automated Voltage Clamp (Xenopus Ooocytes) |
| DataMining | MultiChannel Systems | - | Data Analysis Software |
| DataMerger | MultiChannel Systems | - | Data Processing Software |
| Digidata 1550 | Molecular Devices | Low noise data acquisition system | |
| CyberAmp 380 or equivalent | Axon Instruments | Programmable Signal Conditioner | |
| pClamp program suite | Molecular Devices | Software for data acquisition and analysis software | |
| Antivibraton table | TMC | To avoid microelectrode vibrations | |
| Patchstar Micromanipulators | Scientifica | To accurately position microelectrodes in brain slices | |
| Faraday Cage | Sutter Instruments | To isolate recordings from noise | |
| McIlwain Tissue Chopper | Campden Instruments LTD | To prepare brain slices | |
| Borosilicate glass micropipette | Warner Instruments | GC150TF-10 | To record extracellular potentials in brain slices |
| Twisted pair, platinum iridium wires stimulation electrode | World Precision Instruments | To stimulate the brain slices with current | |
| Stimulus generator for current and voltage driven stimulation | MultiChannel Systems | STG4000 | Delivers the current to the stimulation electrode |
| Plasticware | |||
| Microtiter plate round bottom | Corning | #3365 | Used for the binding assay |
| GF/C glassfibre filter-bottom 96-well microplate with 1.2 µm poresize, for cell harvesting assays using a vacuum manifoldwell filter | Packard | #6005174 | used for the binding assay |
| 50 mL Tubes | Falcon | #352070 | used for the binding assay |
| Safe-lock tubes 1.5 mL | Eppendorf | #0030 120086 | used for the binding assay |
| Safe-lock tubes 2 mL | Eppendorf | #0030 120094 | used for the binding assay |
| Shipping tubes 180 mL | Semadeni Europe AG | #3722 | used for the binding assay |
| Pony vial Polyethylene 6 mL | Perkin Elmer | #6013329 | used for the binding assay |
| Top Seal | Perkin Elmer | #60051859 | used for the binding assay |
| Spinner Flask | Bellco | BELLCO # 1965-00100 | Spinner Flask |
| 96 Well Plate (Conical) | Thermo Scientific Milian | 56368 | Injection plate for the oocytes |
| 96 Well Plate (Flat bottom) | Corning (Vitaris Switzerland) | 3364-cor | Compound Plate for the HiClamp |
| Glass capillary | Hilgenberg (Germany) | - | borosilicate glass 1.2 O.D. 0.76 I.D. with filament |
| RNA preparation | |||
| Ambion mMessage mMachine | Thermo Fisher Scientific | for the in vitro synthesis | |
| Chemicals | |||
| Assay buffer: KCl 5 mM; CaCl2 1.25 mM; MgCl2 1.25 mM; NaCl 120 mM; Tris 15 mM pH adjust with HCl to 7.4; store up to 3 months at 4 °C. | Used for binding assay | ||
| Washing buffer: Tris 50 mM -HCl pH 7.4; store at 4 °C. | Used for binding assay | ||
| Stock solution of test compounds 10 mM in DMSO | Used for binding assay | ||
| Flumazenil (RO0151788) 10 mM in DMSO | Used for binding assay | ||
| Diazepam 4 mM in DMSO | Used for binding assay | ||
| [3H]-Flumazenil 60-85 Ci/mmol in Ethanol; store at -20 °C | Used for binding assay | ||
| Microscint 40 | Packard | #6013641 | Used for binding assay |
| Ultima Gold | Perkin Elmer | #6013329 | Used for binding assay |
| MS-222 | Sigma | Sigma # A5040 | MS-222 |
| AB/AM | Sigma | Sigma # A5955 | antibiotics / antimycotics |
| Collagenase | Sigma | Sigma # C1030 | Collagenase Type I |
| Rnase | Sigma | Sigma # R2020-250 mL | RNaseZAP |
| EndoFree Plasmid maxi Kit | Qiagen | Qiagen # 12362 | |
| Salts for artificial cerebrospinal fluid (NaCl, KCl, etc.) | Sigma | ||
| Membranes | |||
| Frozen membrane preparations from transient or stably transfected HEK293 overexpressing different human GABAA receptor subtypes: α1β3γ2, α2β3γ2, α3β3γ2, α5β3γ2. See Ballard et al. 2009 for detailed methods. | Used for binding assay |
Referências
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nature Reviews Drug Discovery. 10, 685-697 (2011).
- Sieghart, W. Structure and pharmacology of g-aminobutyric acidA receptor subtypes. Pharmacological Reviews. 47, 181-234 (1995).
- Liu, J., et al. A high-throughput functional assay for characterization of g-aminobutyric acidA channel modulators using cryopreserved transiently transfected cells. ASSAY and Drug Development Technologies. 6, 781-786 (2008).
- Mennerick, S., et al. Diverse voltage-sensitive dyes modulate GABAA receptor function. Journal of Neuroscience. 30, 2871-2879 (2010).
- Hevers, W., Luddens, H. The diversity of GABAA receptors. Pharmacological and electrophysiological properties of GABAA channel subtypes. Molecular Neurobiology. 18, 35-86 (1998).
- Macdonald, R. L., Olsen, R. W. GABAA receptor channels. Annual Review of Neuroscience. 17, 569-602 (1994).
- Kemp, J. A., Marshall, G. R., Wong, E. H., Woodruff, G. N. The affinities, potencies and efficacies of some benzodiazepine-receptor agonists, antagonists and inverse-agonists at rat hippocampal GABAA-receptors. British Journal of Pharmacology. 91, 601-608 (1987).
- Prenosil, G. A., et al. Specific subtypes of GABAA receptors mediate phasic and tonic forms of inhibition in hippocampal pyramidal neurons. Journal of Neurophysiology. 96, 846-857 (2006).
- Ballard, T. M., et al. RO4938581, a novel cognitive enhancer acting at GABAA a5 subunit-containing receptors. Psychopharmacology. 202, 207-223 (2009).
- Knoflach, F., Hernandez, M. C., Bertrand, D. GABAA receptor-mediated neurotransmission: Not so simple after all. Biochemical Pharmacology. 115, 10-17 (2016).
- Gielen, M. C., Lumb, M. J., Smart, T. G. Benzodiazepines modulate GABAA receptors by regulating the preactivation step after GABA binding. Journal of Neuroscience. 32, 5707-5715 (2012).
- Bergmann, R., Kongsbak, K., Sorensen, P. L., Sander, T., Balle, T. A unified model of the GABAA receptor comprising agonist and benzodiazepine binding sites. PLoS One. 8, 52323 (2013).
- Richter, L., et al. Diazepam-bound GABAA receptor models identify new benzodiazepine binding-site ligands. Nature Chemical Biology. 8, 455-464 (2012).
- Rudolph, U., Crestani, F., Mohler, H. GABAA receptor subtypes: dissecting their pharmacological functions. Trends in Pharmacological Sciences. 22, 188-194 (2001).
- Wisden, W., Seeburg, P. H. GABAA receptor channels: from subunits to functional entities. Current Opinion in Neurobiology. 2, 263-269 (1992).
- Davies, C. H., Davies, S. N., Collingridge, G. L. Paired-pulse depression of monosynaptic GABA-mediated inhibitory postsynaptic responses in rat hippocampus. The Journal of Physiology. 424, 513-531 (1990).
- Karnup, S., Stelzer, A. Temporal overlap of excitatory and inhibitory afferent input in guinea-pig CA1 pyramidal cells. The Journal of Physiology. 516, 485-504 (1999).
- Turner, D. A. Feed-forward inhibitory potentials and excitatory interactions in guinea-pig hippocampal pyramidal cells. The Journal of Physiology. 422, 333-350 (1990).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. 391, 85-100 (1981).
- Adelsberger, H., Brunswieck, S., Dudel, J. Block by picrotoxin of a GABAergic chloride channel expressed on crayfish muscle after axotomy. European Journal of Neuroscience. 10, 179-187 (1998).
- Hapfelmeier, G., et al. Isoflurane slows inactivation kinetics of rat recombinant a1b2g2L GABAA receptors: enhancement of GABAergic transmission despite an open-channel block. Neuroscience Letters. 307, 97-100 (2001).
- Bertrand, S., Bertrand, D. Overview of electrophysiological characterization of neuronal nicotinic acetylcholine receptors. Current Protocols in Pharmacology. , 17 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados