Method Article
Methoden für die Entdeckung der neuartige Substanzen modulieren einen Gamma - Aminobuttersäure-Rezeptor geben eine Neurotransmission
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen Protokolle, um Verbindungen zu GABA-A -Rezeptoren von der Bindung an die Physiologie und Pharmakologie aktiv zu entdecken.
Zusammenfassung
Dieses Manuskript stellt eine schrittweise Protokoll für das Screening bei Gamma-Aminobuttersäure Verbindungen Säure geben eine Rezeptoren (GABA-A) und deren Verwendung zur Identifizierung der neuartige Moleküle aktiv in präklinischen Tests aus einer in-vitro- rekombinante Rezeptor auf ihre pharmakologischen Wirkungen auf native Rezeptoren im Nagetier Gehirnscheiben. Für Verbindungen, die Bindung an die Benzodiazepin-Standort des Rezeptors ist der erste Schritt zu einem primären Bildschirm einrichten, die darin besteht, entwickeln Radioligand Bindung Assays auf Zellmembranen mit dem Ausdruck der großen GABA-A -Subtypen. Dann unter Ausnutzung der heterologen Expression Nagetier und menschlichen GABA-A -Rezeptoren im Xenopus Eizellen oder HEK-293-Zellen, ist es möglich zu erkunden, in elektrophysiologische Tests, die physiologischen Eigenschaften der verschiedenen Rezeptor Subtypen und die pharmakologischen Eigenschaften der identifizierten Verbindungen. Das Xenopus Eizelle System präsentiert hier, beginnend mit der Isolierung von der Eizellen und die Mikroinjektion mit verschiedenen mRNAs, bis die pharmakologische Charakterisierung mittels zwei-Elektroden-Spannung Klemmen. Zu guter Letzt werden Aufnahmen im Nagetier Gehirnscheiben durchgeführt beschrieben, die als sekundäre physiologischen Test verwendet werden, um die Aktivität der Moleküle auf ihre native Rezeptoren in einem genau definierten neuronale Schaltkreis zu beurteilen. Extrazelluläre Aufnahmen mit Bevölkerung Antworten von mehreren Neuronen werden zusammen mit dem Zulassungsantrag demonstriert.
Einleitung
Hier präsentieren wir Ihnen Protokolle für die Entdeckung von aktiven Verbindungen am GABA-A -Rezeptoren von der Bindung an die Physiologie und Pharmakologie. Bei der Suche nach neuartigen Molekülen spezifisch für GABA-A -Rezeptoren, ist es wichtig, zu definieren, so genau wie möglich, den Untertyp des Interesses und der Bewertung der Besonderheit der neu identifizierten Verbindungen (z. B.für einen Beitrag sehen, Rudolph und Knoflach1oder Sieghart2). Ein typischer Pfad in der Wirkstoffforschung und die Schritte, die erreicht werden müssen sind in Abbildung 1dargestellt.
Bindung-Assays wurden und werden noch weitgehend als der erste Schritt in der Drogeentdeckung verwendet. Im Falle von GABA-A -Rezeptoren sind sie optimiert, um Verbindungen zu identifizieren, die an der Benzodiazepin-Bindungsstelle des Rezeptors binden wo therapeutisch nützlich und sicher Medikamente binden. Andere Techniken, mit fluorometrisch bildgebenden Platte Leser (FLIPR) Membran potenziellen roten Farbstoff basierende Assays3, erkennen Verbindungen wie Barbiturate, die Bindung an weitere Standorte, die aufgrund ihrer unerwünschten Nebenwirkung Profil weniger wünschenswert sind. Darüber hinaus können die eingesetzten Farbstoffe GABA-A -Rezeptoren, so Fragen die Nützlichkeit dieser Assays für Drug Discovery4direkt aktivieren. Verbindliche Tests können nur die Beweise, die eine bestimmte Verbindung an einen spezifischen Rezeptor Klassebinden kann. In-vitro- Assays mit Zellmembranen dienen zur selektiven menschlichen GABA-A α5β3γ2-Rezeptor Liganden zu identifizieren. Transient transfizierte HEK293 Zellen mit dem Ausdruck der menschlichen GABA-A -α5β3γ2, α1β3γ2, α2β3γ2 und α3β3γ2-Rezeptoren werden verwendet, um Membranen auf diese Tests vorbereiten. Die Wirkung der Liganden wird erkannt, indem Sie messen das Funkeln von [3H] Flumazenil an die Membranrezeptoren (Hemmung der [3H] Flumazenil Bindung) gebunden. Der Hauptvorteil dieser Technik ist, dass eine rasche und effiziente Bestimmung der Verbindung-Bindungsaffinität an den Rezeptor des Interesses an den Rezeptor von Interesse finden.
Funktionelle Studien sind notwendig, um die funktionelle Aktivität der Verbindungen zu bewerten und zu eine physiologischen und pharmakologische Erklärung der Mechanismen, die durch die Bindung der Verbindungen an den Rezeptoren verursacht vorschlagen. Es ist heute anerkannt, dass funktionelleA GABA-Rezeptoren von der Baugruppe aus fünf Untereinheiten um eine Achse des Pseudosymmetry von den Ionischen Pore und ergeben sich aus der Versammlung der fünf identischen Untereinheiten gebildet führen. Die meisten der GABA-A -Rezeptoren bestehen aus zwei oder mehr verschiedenen Untereinheiten. Der großen Gehirns GABA-A -Rezeptor, zum Beispiel besteht der α1, β2 und γ2 Untereinheiten in einer Stöchiometrie von 2, 2 und 1 bzw.5,6. Eine Wiederherstellung auf einem Host wie Xenopus Eizellen oder HEK293 Zellen bietet die Möglichkeit, schnell die pharmakologischen Eigenschaften der Rezeptoren zu erkunden.
Die pharmakologischen Eigenschaften der Verbindungen werden dann mit extrazellulären Aufnahmen im Gehirn Scheiben7untersucht. Diese Methode ermöglicht eine Auseinandersetzung mit der Wirkung der Verbindungen auf Neurotransmission und bietet eine effektive Möglichkeit, die funktionellen Auswirkungen der Verbindungen im heterologen Expressionssysteme auf der Ebene der native Rezeptoren in der Gesamtwertung bestimmt bestätigen neuronale Umfeld. Gabaerge Neurotransmission kann auch auf molekularer Ebene beurteilt werden, durch die Messung der Auswirkungen der Verbindungen auf die inhibitorischen postsynaptischen Ströme (IPSCs)8. Aber das Protokoll hier verwendet und anhand der gesamten Zelle Patch Clamp Aufnahmen in Gehirnscheiben ist aufwendiger und ergibt einen geringeren Durchsatz.
Abschließend werden die Stärken und Schwächen des in-vitro- screening-Kaskade, die zur Identifizierung des α5β3γ2-selektive Liganden im Hinblick auf die verschiedenen Techniken und ihre immanente Grenzen diskutiert. Diese Arbeit soll, Experten und Laien auf dem Gebiet der GABA-A -Rezeptoren eine hilfreiche Überprüfung der Kombination der verschiedenen in-vitro- Methoden verwendet, um die Entdeckung der neuen Modulatoren dieser Liganden-gated Ion-Kanäle zu bekämpfen.
Protokoll
Xenopus Laevis sind untergebracht und nach Genf Kanton Tier Richtlinien behandelt.
1. Radioligand Bindung
-
Vorbereitung der Assay-Platte
- 1,5 L testpuffer mit 1,25 mM CaCl2, 5 mM KCl, 1,25 mM MgCl2, 120 mM NaCl und 15 mM Tris vorzubereiten; Stellen Sie den pH-Wert mit HCl auf 7,4.
- Bereiten Sie die Verbindungen auf 50.76 µM (z.B. eine Verbindung bei 10 mM in einem 980 µL-Assay-Puffer in einem Microcentrifuge Schlauch 5 µL) getestet werden. Mischen Sie sie gut mit einem Vortex-Maschine mit hoher Geschwindigkeit für 2 – 5 s.
- Eine Vorverdünnung der Referenz zusammengesetzte Flumazenil 1.970 µL testpuffer durch pipettieren 1 µL der Verbindung (10 mM) vorbereiten. Mischen Sie sie gut mit einem Vortex-Maschine mit hoher Geschwindigkeit für 2 – 5 s.
- Verdünnen Sie eine [3H] Flumazenil Stammlösung mit dem Assay-Puffer bei 4 ° C bis 4 nM in einem 50 mL-Polypropylen-Rohr.
- Pipette 50 µL/Well von testpuffer in Spalten 1 und 3 / 11 von einer 96-Well-Mikrotestplatte wie in der Platte Layout dargestellt in Abbildung 2dargestellt.
- Pipette 73,2 µL der Verbindungen 50.76 µM verdünnt (siehe Schritt 1.1.2) in Spalte 12 der Platte.
- Verdünnen Sie jede Verbindung mit der geometrischen Progression über 9 Stufen (1E-10 -1E–06 M), mit einem 23,12 µL Transfervolumen und füllen Spalten 3 – 11. Mischen Sie die Verdünnung gründlich. Ändern Sie die Spitze nach jeder Verdünnung.
-
Verdünnen Sie die Zellmembranen
- Tauen Sie die Zellmembranen, die zuvor von einer HEK293 überexprimierenden menschlichen GABA-A Rezeptor isoliert (0,025 – 0,15 mg/mL), erhalten 80 mL bei Raumtemperatur (RT) und überträgt die Aussetzung auf der Assay-Puffer bei 4 ° c
- Die Membran-Lösung immer noch bei 4 ° C mit einer Gewebe-Homogenisator für 30-40 s bei 10.000 – 12.000 u/min aufzuwirbeln.
-
Verdünnen Sie Diazepam für die Kontrolle der unspezifischen Bindung (NSB)
- Verdünnen Sie eine 4 mM Diazepam Stammlösung mit dem Assay-Puffer zu einer Konzentration von 40 µM in 5 mL.
-
Starten Sie die Reaktion
- Pipette 50 µL 4 nM [3H] Flumazenil in jede Vertiefung der 96-Well-Platte und halten Sie es in einem Eis-Wasser-Behälter.
- Fügen Sie 100 µL der GABA-A Rezeptor Subtyp Membranen Vorbereitung eine Proteinkonzentration von 0,5 mg/mL haben.
- Pipette 50 µL 40 µM Diazepam in Spalte 2.
- Inkubieren Sie die Platte für 1 h auf dem Eis.
- 50 µL testpuffer in jede Vertiefung einer 96-Well-Filter-Platte für die anschließende Membran Trennung und Radioaktivität Messung hinzufügen und danach die Reaktion zu stoppen.
-
Die Reaktion zu stoppen
- Bereiten Sie einen Wasch-Puffer mit 50 mM Tris-HCl, pH 7.4.
- Filtern Sie die Lösung unter Verwendung einer 96-Well-Zelle-Erntemaschine. Waschen Sie die Platte 3 X mit 300 µL eiskalt waschen Puffer pro Bohrloch.
- Versiegeln Sie die Unterseite der Platte mit einer Kunststoff-Folie und fügen Sie 40 µL Funkeln cocktail für flüssige Funkeln zählen in jedem gut und wischen Sie es mit Ethanol 70 %.
- Schütteln Sie die Platte für mindestens 1 h bei RT Mindestens eine weitere Stunde bei RT stehen lassen
- Messen Sie die Radioaktivität (in CPM), indem Sie die Platte auf einem Szintillationszähler. Erlauben Sie eine Messung für 3 min pro Bohrloch.
-
Datenanalyse
- Bestimmen Sie der Mittelwert für die 8 unspezifischen Bindung (NSB) und die gesamte Bindung (TB) sowie für die Duplikate oder Triplicates der Proben repliziert. Berechnen Sie die % spezifische Bindung (SB) für den Mittelwert jeder Probe nach der folgenden Gleichung:
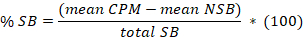
Hier,
insgesamt SB = mittlere TB minus die NSB bedeuten. - Baugrundstück in Abszisse % SB versus in koordinieren die Inhibitor-Konzentrationen. Passen Sie die Daten unter Verwendung der einzigen Website Wettbewerb Analyse Gleichung:

Hier,
y = % der SB,
A = das Minimum von y,
B = y, maximal
C = IC50,
X = Log10 des Zusammenschlusses der konkurrierenden Verbindung
D = die Steigung der Kurve (Hill-Koeffizient). - Berechnen der Bindungsaffinität (Ki) über die halbe maximale inhibitorischen Konzentration (IC50), die Dissoziationskonstante (Kd) von [3H] Flumazenil auf die jeweiligen Membranen9und die Konzentration von [3H] Flumazenil in der Probe nach der folgenden Gleichung Daten verwenden:
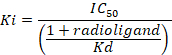
- Bestimmen Sie der Mittelwert für die 8 unspezifischen Bindung (NSB) und die gesamte Bindung (TB) sowie für die Duplikate oder Triplicates der Proben repliziert. Berechnen Sie die % spezifische Bindung (SB) für den Mittelwert jeder Probe nach der folgenden Gleichung:
(2) Rezeptor-Expression und Aufnahmen in Xenopus Eizellen
- Eierstöcke, die Ernte und Vorbereitung der Eizelle
- Bereiten Sie die sterile Barth-Lösung mit 88 mM NaCl, 1 mM KCl, 2,4 mM Nahco33, 10 mM HEPES, 0,82 mM MgSO4.7H2O, 0,33 mM Ca (NO3)2.4H2O und 0,41 mM CaCl2.6H2O, bei pH 7,4 , ergänzt mit 100 Einheit/mL Penicillin, 100 µg/mL Streptomycin und 0,25 µg/mL von Amphotericin b.
- Bereiten Sie das 1 x OR2 Medium (keine CaCl2) mit 88,5 mM NaCl, 2,5 mM KCl, 5 mM HEPES, 1 mM MgCl2.6H2O, bei pH 7,4.
- Opfer eine Xenopus Laevis weiblichen durch tiefe Narkose für 20 min in gekühlten Tricaine Methanesulfonate (bei einer Konzentration von 150 mg/L, bei pH 7,4 eingestellt) und Natriumbicarbonat (300 mg/L) durch Enthauptung gefolgt.
- Ernte der Eierstöcke schnell mit sauber Scheren und Pinzetten und legen Sie sie in 2 Petrischalen (10 cm) gefüllt mit 40 mL 1 x Barth Lösung und Antibiotika/antimykotikums.
- Speichern Sie die Eierstöcke nicht dissoziierten für bis zu 2 Wochen in Barth Lösung bei 4 ° C.
- Für die Dissoziation, schneiden die Eierstöcke mit einer sauberen Rasierklinge in kleinen Fraktionen (1 – 2 cm3) und inkubieren sie in 50 mL OR2 Medium ohne CaCl2 (OR2-NoCaCl-2) mit 0,2 % Kollagenase (Typ I) bei 17 – 19 ° C in einem 100 mL-Spinner Kolben mit einem langsamen Agitation für 4 – 5 h sicherstellen, dass die magnetischen Bar platziert ca. 3 – 5 cm über dem Boden des Kolbens zu vermeiden, brechen die Eizellen Spinner.
- Nach 4 – 5 h, stellen Sie sicher, dass die meisten die Eizellen von ihrer Follikel befreit sind (d. h., sie schwimmen einzeln). Waschen Sie sie 5 X mit 200 mL OR2 mit 1,8 mM CaCl2ergänzt.
- Defolliculated Eizellen Petrischalen (10 cm) gefüllt mit Barth Lösung und Antibiotika/Antimykotika und halten Sie sie mindestens über Nacht bei 17 ° C vor der cDNA oder mRNA Injektion zu übertragen.
- Am nächsten Tag, wählen Sie unter ein Fernglas, eine gesunde Eizelle präsentiert eine klare und eindeutige Tier im Vergleich zu einem Vegetal Pfosten (dunkelbraun für Tier Pole gegenüber hellgelb für die Vegetal-Pole). Verwenden Sie saubere Pasteur Pipetten und entsorgen Sie die Eizellen eins nach dem anderen in einem sterilen konische 96-Injektion-well-Platte.
Hinweis: Keine besonderer Sorgfalt ist auf die Vermittlung von Eizellen für die mRNA-Injektionen erforderlich; in der Erwägung, dass für die cDNA-Injektionen ist es unerlässlich, die Eizellen mit dem Tier-Pol nach oben zu orientieren.
- mRNA oder cDNA automatische Injektion
- Die mRNAs mit einem kommerziell erhältlichen Kit folgen Sie den empfohlenen Anweisungen zu synthetisieren. Reinigen Sie die Instrumente und die Tabelle mit RNase und tragen Sie die entsprechende schützende Handschuhe.
Hinweis: Die Qualität der mRNA ist Faktor für einen guten Ausdruck zu bringen, und es ist unerlässlich, um mRNA Abbau während der Injektion zu verhindern. - Bereiten Sie mit einem kommerziell erhältlichen Kit cDNAs und lösen Sie die gewünschte Menge in Bidistilled Wasser bei einer Konzentration von 0,2 µg/µL.
- Injizieren von 10 – 50 nL mRNA-Lösung mit einer Konzentration von 0,2 µg/µL oder 10 nL cDNA-Lösung mit einer Konzentration von 0,02-0,2 µg/µL, vorzugsweise in Chargen von 95 Eizellen.
- Mix für Membran Proteine erfordert mehrere Untereinheiten (d.h. heteromeren α1β2γ2 GABA-A -Rezeptoren), die entsprechenden mRNAs oder cDNAs im gewünschten Verhältnis (d.h., 1:1:1 oder 1:10:1).
- Halten Sie die Eizelle bei 17 ° C, die Expression von hitzeschockproteinen durch die Eizellen zu verhindern; Speichern Sie die Mikrotestplatte in einem Thermo-gesteuerte Speicherbereich.
- Auflösen der Testverbindungen, die in der Bindung Assay in OR2 bei 0,1 – 1.000 positiv getestet wurden µM für elektrophysiologische Aufnahmen und entsorgen sie Sie in einer 96-Well Flachboden Polypropylen-Platte.
- Die mRNAs mit einem kommerziell erhältlichen Kit folgen Sie den empfohlenen Anweisungen zu synthetisieren. Reinigen Sie die Instrumente und die Tabelle mit RNase und tragen Sie die entsprechende schützende Handschuhe.
- Plasmide für Ausdruck
- Folgen Sie die Bedienungsanleitungen der handelsüblichen Kits für die mRNA-Synthese mit bakteriellen T7 oder T6 Promotoren und 20 µL einer Lösung bei 0,2 µg/µL RNase-freies Wasser.
- Bereiten Sie mindestens 20 µL einer Lösung mit einem Eukaryote Expressionsvektor für den cDNA-Ausdruck, in der Regel bei 0,2 µg/µL in Bidistilled Wasser aufgelöst.
- Mikroinjektion in die Eizelle und Visualisierung seiner Qualität
- 10 – 50 nL der Lösung mit Plasmid zu injizieren (siehe Punkt 2.3.1 und 2.3.2) mit einer Glas-Mikro-Injektion-Nadel mit einem Tipp-Durchmesser reichen bis zu 100 µm auf einem Mikromanipulator, ausgestattet mit einer Druck-Auswurf-System oder mit einem automatisierten Einspritzsystem montiert.
Hinweis: In dem hier besprochenen Beispiel werden Eizellen von Chargen von 95 mit einem automatisierten System geeignet für den Einsatz mit cDNA oder mRNA injiziert. - Füllen Sie die Injektionsnadel mit 1 µL eines Farbstoffes wie Methylenblau bei 1 % und injizieren Sie die Eizellen mit dem Standardverfahren (entweder im Zellkern für cDNA oder im Zytoplasma für mRNA) zu.
- Die injizierten Eizellen für ungefähr 1 Minute in kochendes Wasser zu entsorgen. Halbieren Sie die Eizellen mit einer Rasierklinge unter ein Fernglas.
Hinweis: Der Farbstoff bleibt lokalisierte wie in Abbildung 3E, so dass eine genaue Beobachtung der Injektion.
- 10 – 50 nL der Lösung mit Plasmid zu injizieren (siehe Punkt 2.3.1 und 2.3.2) mit einer Glas-Mikro-Injektion-Nadel mit einem Tipp-Durchmesser reichen bis zu 100 µm auf einem Mikromanipulator, ausgestattet mit einer Druck-Auswurf-System oder mit einem automatisierten Einspritzsystem montiert.
- Zwei-Elektroden-Spannung Klemme Aufnahmen
- Legen Sie die well-Platte mit den Eizellen auf dem automatisierten System, das das in Abbildung 4dargestellten Prinzip nutzt.
Hinweis: Im Gegensatz zu den Patch-Clamp-System in Abbildung 5dargestellt, wird das wahre Membran-Potential der Zelle von der Elektrode Spannung gelesen. - Programmieren Sie die automatisierte Recording-System mit den Symbol-basierte Schnittstelle, beispielsweise die Regelung für die Bestimmung der Konzentration AKTIVITÄTSBEZIEHUNG in Abbildung 6 dargestellt.
- Legen Sie die well-Platte mit den Eizellen auf dem automatisierten System, das das in Abbildung 4dargestellten Prinzip nutzt.
- Kurvenanpassung
- Analysieren Sie die Ergebnisse mit der entsprechenden Software, mit der illustrierten Konzentrationskurve Aktivierung, zeichnen Sie die aktuelle Amplitude als Funktion des Logarithmus der Konzentration Agonist.
- Beobachten Sie die sigmoidale Kurve, die mit der empirischen Hill-Gleichung in der Form nachträglich eingebaut werden kann:
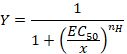
Hier,
Y= Anteil der evozierten Strom
EG 50 = die Konzentration für eine 50 %-Aktivierung
X = Konzentration der Substanz,
nH = der Hill-Koeffizient oder scheinbare Kooperativität. - Normalisieren Sie die Ströme zu einer Einheit dividiert die Amplitude der jede Antwort im Vergleich zu der Wert in der höchsten Konzentration zu analysieren, die Daten aus einer Reihe von Zellen aufgenommen.
- Bestimmen Sie die durchschnittliche und Standardfehler und realisieren Sie die Kurvenanpassung mit standardgemäß verfügbare Software zu.
(3) elektrophysiologische Aufnahmen in Hirnschnitten
Hinweis: Hippocampal Ratte Scheiben sind gemäß den nationalen und institutionellen Richtlinien bereit.
-
Vorbereitung des Hippocampus Scheiben
- Bereiten Sie die Dissektion künstliche Gehirn-Rückenmark-Flüssigkeit (dACSF) mit 124 mM NaCl 124, 2,5 mM KCl, 1,25 mM KH2PO4, 2 mM MgSO4.7H2O, 2,5 mM CaCl2 2 H2O, 26 mM Nahco33, 10 mM Glukose und 4 mM Saccharose in der Flasche mit einer Mischung aus 95 % O2 und 5 % CO2vergast.
- Bereiten Sie die Aufnahme künstliche Gehirn-Rückenmark-Flüssigkeit (rACSF) mit 124 mM NaCl 5 mM KCl, 1,25 mM KH2PO4, 2 mM MgSO4.7H2O, 2,5 mM CaCl2 2 H2O, 25 mM Nahco33und 10 mM Glukose in der Flasche mit einer Mischung aus 95 % O2 und 5 % CO2vergast.
- Die Ratten, die mit einer Mischung aus 2,5 % Isofluran und reinem Sauerstoff zu betäuben und sie zu enthaupten.
- Schneiden Sie die Kopfhaut nach der Mittellinie mit einer feinen Schere. Schneiden Sie entlang der Mittellinie des Schädels, ohne das darunter liegende Gewebe zu beschädigen. Entfernen Sie den Schädel mit einer Pinzette zu und mit einem feinen Spatel auf das Gehirn aushöhlen.
- Das Gehirn in die Vergaste dACSF Lösung bei RT und sezieren Sie die linken hippocampale Anordnung mit einem feinen Spachtel.
- Schnitt Quere Scheiben (400 µm dick) aus dem mittleren Teil des Hippocampus mit einem Gewebe-Chopper und übertragen Sie sie auf die Aufnahme-Kammer mit einem Pinsel malen. Pflegen Sie die Scheiben bei RT für 45 Minuten.
- Durchspülen der Scheiben mit den vergast rACSF bei 35 ° C und mit einer Rate von 1,5 mL/min Blase die Lösung mit einem Gemisch aus 95 % O2 und 5 % CO2.
Hinweis: Nach diesem Schritt sind die Scheiben für den elektrophysiologischen Experimenten bereit.
-
Einzelpopulation Spike Aufnahme
- Legen Sie eine Gehirn-Scheibe in die Kammer Mikroskop montiert.
- Durchspülen der Scheibe mit einer Rate von 3 mL/min mit rACSF.
- Ziehen Sie eine Borosilikat Glas Mikropipette mit der Pipette Abzieher mit einem Widerstand von ~ 2 MΩ.
Hinweis: Diese Mikropipette dient als Elektrode Aufnahme und elektrisch an den Verstärker angeschlossen ist. - Füllen Sie die Mikropipette mit einer Lösung, die 2 M NaCl und legen Sie sie in die Pipette Halterung des Verstärkers.
- Positionieren Sie die Aufnahme Mikropipette in Stratum Pyramidale in der CA1-Region des Hippokampus Slice mit der richtigen Mikromanipulator.
Hinweis: Die Lage ist schematisch in Abbildung 7dargestellt. - Legen Sie eine isolierte bipolar Platin/Iridium Elektrode in die Halterung am linken Mikromanipulator.
Hinweis: Diese Elektrode dient als die Stimulationselektrode und elektrisch mit Impuls-Generator verbunden ist. - Position der Stimulationselektrode im Schaffer Sicherheiten in der CA1-Region des Hippokampus Slice mit der richtigen Mikromanipulator.
Hinweis: Die Lage ist schematisch in Abbildung 7dargestellt. - Liefern einem Stromimpuls an die Stimulationselektrode mit dem Impuls-Generator alle 30 s (100 µs Dauer, beginnend bei 10 µA) und die Stärke der Stimulation schrittweise zu erhöhen, bis eine Bevölkerung Spitze (PS) angezeigt wird.
- Passen Sie die Impulse Stärke zu evozieren einen PS entspricht 45 % der maximalen Amplitude, die gewonnen werden können. PSs sind bei 2,4 KHz gefiltert und bei 20 KHz mit dem Signalverstärker digitalisiert.
-
Gepaart-Puls-Hemmung
- Bereiten Sie die Gehirnscheiben (Schritt 3.1) und gehen Sie wie zuvor beschrieben (Schritte 3.2.1–3.2.7).
- Liefern zwei Stromimpulsen (100 µs Dauer in einem Intervall von 20 ms) an die Stimulationselektrode alle 30 s mit dem Impuls-Generator. Legen Sie die Impuls-Stärke, einen PS entspricht 45 % der maximalen Amplitude zu erwähnen.
-
Verbindung testen
- Verdünnungen der Verbindungen in vergast ACFS zu testende machen damit die Endkonzentration von DMSO nicht höher als 0,1 %.
- Die Kontrolllösung in der gleichen Konzentration als der in der zusammengesetzten Lösung DMSO hinzufügen.
- Aufzeichnen einer einziges (Schritt 3.2) oder ein gepaart-Puls (Schritt 3.3) PS hervorgerufen durch Sicherheiten Stimulationen Schaffer alle 30 s für mindestens 30 Minuten. Die PS-Form sollte während dieser Basisperiode stabil sein.
- Bereiten Sie einen Becher mit vergast rACSF mit einer festen Konzentration der Verbindung getestet werden.
- Durchspülen des hippocampalen Slices mit dieser Lösung während der Aufnahme noch der Einzel- oder gepaart-Puls PS.
- Bewerten Sie die Erholung von der Verbundwirkung durch Vorrichtung den Slice mit vergast rACSF ohne Verbindung.
Hinweis: Für reversible Effekte kehrt die PS zu seiner ursprünglichen Form während der Basisperiode vor der zusammengesetzten Anwendung beobachtet.
-
Datenanalyse
- Durchschnittliche PS Spuren aufgezeichnet während des Experiments in Blöcken von 4 Verwenden der Datenanalyse-Software.
- Messen Sie die PS-Amplituden der gemittelten Spuren.
- Normalisieren Sie die Amplituden als prozentualer Anteil der Ausgangswerte 10 min vor Vorrichtung eine Verbindung aufgenommen.
- Die Daten zu äußern, wie ± SEM bedeuten
Ergebnisse
Bindung:
Die in-vitro- Tests mit Zellmembranen wird verwendet, um selektiv menschlichen GABA-A α5β3γ2-Rezeptor Liganden am BZD allosterische Standort von der γ2 mit Rezeptoren binden zu identifizieren. Transient transfizierte HEK293 Zellen mit dem Ausdruck der menschlichen GABA-A -α5β3γ2, α1β3γ2, α2β3γ2 und α3β3γ2-Rezeptoren werden verwendet, um die Membranen dieser Assay vorzubereiten. Die Wirkung der möglichen Liganden wird erkannt, indem Sie messen das Funkeln von [3H] Flumazenil an die Membranrezeptoren (Hemmung der [3H] Flumazenil Bindung) gebunden. Weg-Bindung-Kurven werden dann generiert, um die Selektivität der Verbindungen für einen spezifischen GABA-A Rezeptor wie im Beispiel mit RO4938581 zu beurteilen (Abbildung 8). Abbildung 9 fasst das Profil von mehreren Referenzverbindungen einschließlich derjenigen der α5 selektive GABA-A Rezeptor negative allosterische Modulator, RO49385819, die mit der verbindlichen Test erzeugt wurden.
Aufnahmen in Xenopus Eizellen:
Der Ausdruck der GABA-A -Rezeptoren wie α5β3γ2 Heteromer ergibt robuste Strömungen in Reaktion auf GABA-Exposition. Typische Spannung Klemme Aufnahmen in eine Eizelle mit dem Ausdruck der menschlichen α5β3γ2 als Reaktion auf kurze GABA Impulse erhalten (30 s) reichen bis zu 300 µM sind in Abbildung 6dargestellt. In diesem Experiment wurden die unterschiedlichen Konzentrationen von GABA in 96-Well-Platte entsorgt und die Antworten wurden hervorgerufen durch Verschieben der Zelle in einem bestimmten gut. Die GABA wurde gründlich gereinigt, durch Rücksendung der Zelle an die zentrale Perfusion Kammer und Anwendung einer Perfusion der Kontrolllösung durch Aktivierung der entsprechenden peristaltischen Pumpe. Der Programmablauf verwendet zur Bestimmung der Aktivierung Konzentrationskurve ist in Abbildung 6dargestellt. Vollautomatisch durchgeführt, diese Daten verdeutlichen sowohl die Qualität der Aufnahmen, die in Xenopus Eizellen gewonnen werden können und das hohe Niveau der Rezeptor-Expression erhalten wenige Tage nach der Injektion der mRNA. Die Experimente an verschiedene Rezeptor-Kombinationen ergeben eine Reihe von EG-50s, die die Konzentration von GABA erforderlich, die Hälfte der Rezeptoren zu aktivieren ist. Ein Grundstück von der EG-50Werte in einem Diagramm Spinne bietet wie in Abbildung 10dargestellt, einen schnellen Vergleich der Rezeptor-Eigenschaften und dem Einfluss der Untereinheit Komposition.
Um die Wirkung der eine negative oder positive allosterische Modulator (NAM oder PAM) zu untersuchen, ist es notwendig, die Reaktion hervorgerufen durch ein Agonist (GABA) testpuls, zuerst in das Steuerelement und dann im Beisein des Modulators zu vergleichen. Ein effizientes experimentelle Protokoll, ein solches Experiment durchzuführen ist in Abbildung 11dargestellt. Die Reaktion der Zelle auf eine Referenz-Konzentration von GABA wird zunächst ermittelt und die Sequenz wiederholt durch die Anwendung der gleichen GABA-Konzentration und dann durch eine Co-Anwendung die GABA plus der Modulator. Ein Grundstück von zwei übereinander liegenden Antworten zeigt in diesem Beispiel eine deutliche Hemmung verursacht durch die Anwesenheit des Modulators. Eine Quantifizierung der Modulator-Effekt erhält man leicht durch computing das Verhältnis der Reaktion hervorgerufen in Anwesenheit der Modulator im Vergleich zu der Kontrolle und die Ergebnisse können in Form von einer Wärme-Plot dargestellt. In Abbildung 12 dargestellten Daten veranschaulichen die Hitze Handlung entspricht die Aufnahmen von drei Datensätzen für 96 Verbindungen erhalten.
Nach der Identifizierung von Verbindungen, die ausreichend aktiv sind, ist es oft unerlässlich, um festzustellen, ob diese Moleküle aktiv bei anderen Rezeptor-Kombinationen sind. Im Falle der GABA-A -Rezeptor 19 Gene codieren für verschiedene Untereinheiten identifiziert worden, und es ist bekannt, dass eine Multimeric Montage von verschiedenen Untereinheiten ein funktionellen Rezeptor entstehen kann (siehe Knoflach, Hernandez und Bertrand10 für eine Überprüfung). Obwohl mehrere Untereinheiten und Kombinationen Ausbeute ein riesiges Repertoire an Rezeptor, die Subtypen möglicherweise eine große Anzahl von Counter-Screening durchgeführt werden, ist es oft möglich, Fokus zunächst auf die am häufigsten vorkommende Subtyp, die im Falle der GABAA Rezeptoren, setzt sich der α1β2γ2. Experimente, die Kopf an Kopf mit dem Ausdruck, ergeben z. B. α5β3γ2 und α1β2γ2 im selben Batch Eizelle einen guten Vergleich der jeweiligen Auswirkungen eines bestimmten Moleküls. Die typische Ergebnisse in drei Zellen für α5β3γ2 und α1β2γ2 ist in Abbildung 13, dargestellt die bevorzugte positive Modulation von einem Molekül auf α5β3γ2 veranschaulicht.
In Abbildung 11 dargestellten experimentellen Protokolls eignet sich gut für die Charakterisierung einer PAM-Aktivität. In diesem Protokoll ist die Verbindung, die getestet wird die Agonisten an progressiv steigenden Konzentrationen CO angewandt. Um die möglichen kumulativen Wirkungen verursacht durch mehrere Anwendungen auf dieselbe Zelle zu vermeiden, ist eine neue und naiv Zelle für jeden Datenpunkt gemessen. Ein Maß für die Amplitude der Antwort mit der Agonist allein festgehalten und dann während der zusammengesetzten Anwendung ergibt sich eine Verhältnis, die die PAM oder NAM Wirkung quantifiziert. Typische Ergebnisse, die bei α1β2γ2 und α5β3γ2 für Diazepam werden in Abbildung 14, enthüllt eine scheinbare Empfindlichkeit des α5β3γ2, die etwa 10-fach höher bei dieser Rezeptor-Kombination angezeigt. Diese Werte sind in gute Korrelation mit veröffentlichten Daten11. Es wird vermutet, dass die Benzodiazepin-Website von der Schnittstelle zwischen der γ2 und seine angrenzenden α Untereinheit12-14konstituiert ist, schlägt die Empfindlichkeit der α5β3γ2 eine bevorzugte Diazepam Affinität für γ2-α5 über γ2-α1. Die Möglichkeit, verschiedene Rezeptor-Kombinationen kombiniert mit einer effizienten funktionelle Charakterisierung express eröffnet vielfältige Möglichkeiten, Determinanten der PAM-Eigenschaften und ihre Auswirkungen auf die physiologischen und pharmakologischen Wirkungen zu erforschen.
Hippocampal Gehirnscheiben:
Die Experimente mit Ratten hippocampal Gehirnscheiben werden durchgeführt, um die pharmakologische Profil der Verbindungen identifiziert in in-vitro- Tests in einem native-Rezeptor-Modell zu validieren. Die vorherrschende GABA-A -Rezeptor-Subtypen in der Pyramidenzellen des Hippocampus ausgedrückt sind α1β2/3γ2, α2β2/3γ2 und α5β2/3γ2, die alle durch Benzodiazepin (BDZs)15moduliert werden. Gepaart-Puls-Hemmung ist ein Paradigma, die hippocampal Schaltung Erregbarkeit offenbaren kann, durch die Prüfung der Änderung in der Antwort des zweiten von zwei gekoppelten elektrischen reizen geliefert 20ms auseinander. Die Veränderung der zweiten Antwort ist auf Gabaergen Interneuronen innervieren die pyramidale Zelle Schicht16-18Rückmeldungen. Wie in Abbildung 7, in der Kontroll-Situation ist die zweite Antwort von zwei gepaarten Stimuli durch eine Hemmung der Gabaergen gehemmt. Wenn diese Hemmung durch die Vorrichtung des Slices mit β-CCM reduziert wird, ist eine nicht-selektiven NAM, die zweite Antwort der beiden gepaarten Stimuli in viel geringerem Maße gehemmt. Dieses experimentelle Paradigma ist empfindlich auf Substanzen, die selektiv für eine GABA-A -Rezeptor, enthält die α5-Untereinheit.
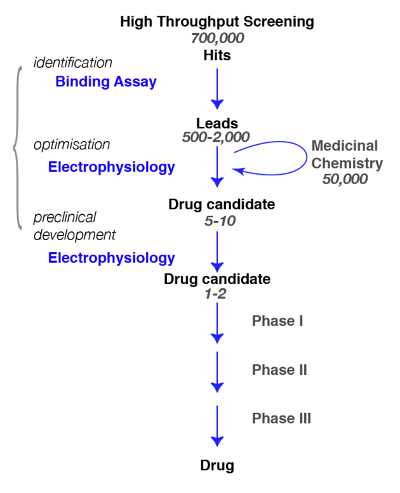
Abbildung 1 : Screening Strategie. Eine typische Drogen-screening-Weg beginnt mit dem Hochdurchsatz-Screening in dem großen Bibliotheken von Verbindungen für ein bestimmtes Ziel durchleuchtet werden. Nach der Identifizierung der Spitzenkandidat beginnt die Arbeit der medizinischen Chemie. Während dieser Phase Chemiker zu studieren und verfeinern die Moleküle durch die Durchführung einer strukturellen Änderung um den gewünschten Kriterien entsprechen, z. B. Ziel Selektivität, Gehirn Penetranz, Stabilität, Abbau etc. in dieser entscheidenden Phase unbedingt zu beurteilen, ob die chemischen Veränderungen der Molekül-Eigenschaften nicht verändert haben und für den besten Kandidaten zu verfeinern. Der folgende Schritt ist, zu identifizieren ein paar vielversprechende Verbindungen und bringen sie zu den nächsten Schritten gehören Sicherheit, Toleranz, usw. beachten Sie, dass Elektrophysiologie wird angegeben, wie die funktionale aber, dass andere Methoden Test, einschließlich Kalzium Fluoreszenz Assays oder Spannung empfindlichen Farbstoffen, kann als Alternative verwendet werden. Diese letztere Methoden sind auch im Hochdurchsatz-Assays als Ersatz für verbindliche Assays verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Layout einer 96-Well versilbert für verbindliche Experimente genutzt. Spalte 1 ist für insgesamt verbindliche Messungen und Spalte 2 für Messungen der unspezifischen Bindung verwendet. Zeilen A – H sind gefüllt mit 4 verschiedenen Verbindungen in steigenden Konzentrationen (Spalten 3 – 12), jede Verbindung zu Duplikaten (d. h. zusammengesetzte 1 in Reihen A und E, Compound 2 in den Reihen B und F, etc.) in das Layout mit unterschiedlichen Farben dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Mit einem automatisierten System Mikroinjektion. (A) A präzise XYZ-System, in dem ein Glas Injektionsnadel gefüllt mit der Flüssigkeit mit dem Plasmid von Interesse, wird automatisch in die Eizellen stieß. (B) zeigt dieses Fenster die 96-Well konisch-Bodenplatte, die in die (C) automatisch die Eizellen injiziert werden. (D) dieses Panel illustriert die Injektion-Prinzip. Für die nukleare Injektion dringt die Nadel etwas tiefer als der Kern die Eizelle im Bedienfeld " B" dargestellt. Dann wird die Nadel zurückgezogen, aus dem Zellkern (siehe C) vor der Injektion (siehe D). (E) zur Bewertung der Qualität der Injektion, die Nadel kann mit einem Farbstoff gefüllt werden und "gekocht" Eizellen können in zwei Hälften geschnitten werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
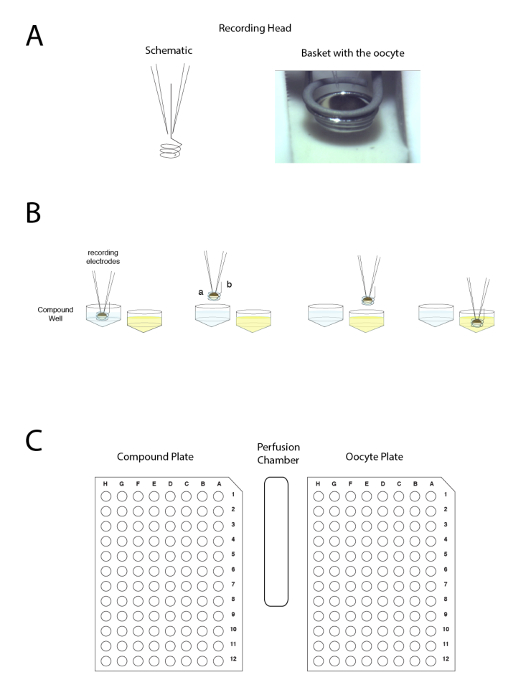
Abbildung 4 : Das automatisierte zwei Voltage-Clamp Elektrode Prinzip. Das Prinzip basiert auf Bewegung der Vorbereitungsprozess zwischen Brunnen, anstatt Auftragen der Flüssigkeit der Durchblutung. (A) der linken Seite des Fensters stellt die Anordnung, so dass die Aufnahme in eine Xenopus Eizelle mit zwei Elektroden und den kleinen Korb, der einen Tropfen um die Vorbereitung während der Bewegung von einer Probe zu erhalten zum anderen. Ein Bild von der Eizelle in den Korb mit den beiden Elektroden platziert ist auf der rechten Seite angezeigt. (B) dieses Panel zeigt eine schematische Darstellung der "upside down" Elektrophysiologie Aufnahme Prinzip. (C) dieses Panel zeigt die Anordnung der Eizelle, zusammengesetzte Platte und Waschstation auf den Schreibtisch. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Zwei-Elektroden Spannung Klemme Aufnahme im Vergleich zu Patch-Clamp. Eine typische zwei-Elektroden-Spannung Klemme Aufnahme für Eizellen (linken) ist im Vergleich zu der Patch Clamp Konfiguration für eine Zell-Linie (Rechte Abbildung). Beachten Sie den Unterschied in der Größe zwischen der Eizellen, die ca. 1 mm im Durchmesser im Vergleich zu den Zellen die ca. 20 µm. In der zwei-Elektroden-Spannung Klemme das Potenzial der Membran der Eizelle ist im Vergleich zu der gewünschten Betriebs-Spannung und die signaldifferenz ist in der aktuellen Elektrode eingespritzt. In einer Patch Clamp-Aufnahme, wird davon ausgegangen, dass der Widerstand der Patch-Clamp-Elektrode vernachlässigbar im Vergleich zu den Membran-Widerstand ist und daher, dass die Spannung vom Verstärker verhängt treu die Zellmembran19zugeführt. Das Bild illustriert eine flüssige Filament Perfusion, in denen die beiden Kanäle einer Theta-Rohr () mit, auf der einen Seite, eine Kontrolllösung und auf der anderen Seite mit der Lösung mit der Droge20,21gefüllt sind. Bitte klicken Sie hier für eine größere Version dieser Figur.
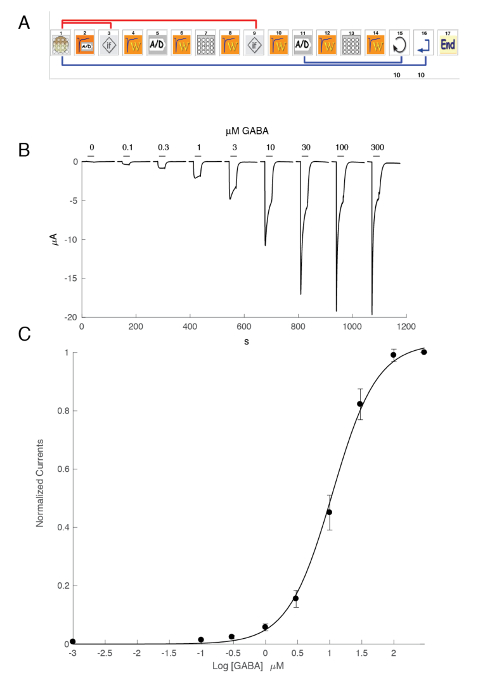
Abbildung 6 : Konzentration Aktivierung Beziehung an den Rezeptoren des menschlichen α5β3γ2. (A) die Reihenfolge steuern das automatisierte System besteht aus einer Reihe von Symbolen und setzt das experimentelle Protokoll für die Bestimmung der Konzentration Aktivierung Beziehung. In den Schritten 1 – 3 lädt wie gezeigt in diesem Bereich das System die Eizelle von der Platte in den Mess-Korb. Der Leck-Strom wird in Schritt 2 gemessen und sollte dieser Wert höher als die gewünschten Kriterien, die Zelle wird automatisch geändert (Schritt 3). Nach einer Stabilisierung (Schritt 4) reagiert die Eizelle mit einer Referenz GABA-Konzentration gemessen (Schritte 5-8). Für die Folgebewertung werden Eizellen anzeigen Ströme größer als 1 µA gehalten. In Stufen 11 – 13 die Zelle wird durch verschiedene Konzentrationen von GABA-A herausgefordert und der Vorgang wiederholt sich für die gewünschte Anzahl von Konzentrationen (Schritt 14) und Zellen (Schritt 15). (B) dieses Panel zeigt die typische Ströme, hervorgerufen durch eine Reihe von kurzen GABA-Anwendungen (30 s) in wachsenden Reihenfolge angewendet. Das Timing der zusammengesetzten Anwendung wird durch Balken angezeigt. (C) eine Darstellung des Peak nach innen Stromes als Funktion des Logarithmus der GABA-Konzentration ergibt die Konzentrationskurve Aktivierung, die leicht durch die empirische Hill-Gleichung, eine kontinuierliche Kurve, eine EG-50 bei ca. 11 µM und einem Hügel ausgestattet ist Koeffizient von 1,3. Strömungen in 8 Zellen aufgenommen wurden zu einer Einheit für die maximale evozierten Reaktion normalisiert. Die Balken zeigen den Standardfehler des Mittelwerts. Bitte klicken Sie hier für eine größere Version dieser Figur.
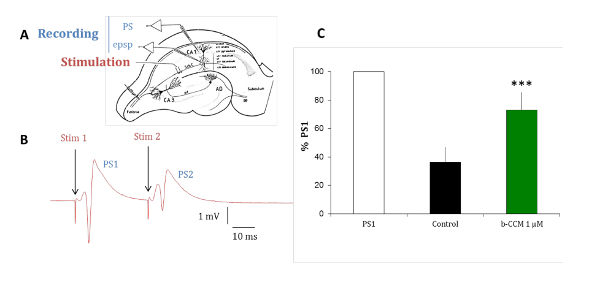
Abbildung 7 : Β-CCM, ein GABA-A -NAM reduziert gepaart-Puls-Hemmung in hippocampal Scheiben. (A) dieses Panel zeigt eine schematische Darstellung einer Ratte hippocampal Scheibe. Die Schaffer Sicherheiten (Sch C) mit Ursprung aus dem CA3 pyramidale Zelle Axone Projekt auf der dendritischen Arborization der CA1 pyramidalen Neuronen. Mikropipetten wurden in das Stratum Pyramidale (str-Pyramidale) Bevölkerung Spikes (PS) aufnehmen und in das Stratum Radiatum (str Radiatum) für dendritische Aufnahmen von Feld exzitatorischen postsynaptischen Potential (Epsp) gesetzt. Die Stimulationselektrode wurde innerhalb der Schaffer Sicherheiten gelegt. (B) zeigt dieses Panel PSs hervorgerufen durch gepaarten Stimuli, die durch die gleiche stimulierende Elektrode in einem Intervall von 20 ms angewendet. Die Reaktion der Bevölkerung auf den zweiten Reiz (PS2) ist der kleinere Amplitude als Reaktion auf den ersten Impuls (PS1). (C) PSs verzeichneten die Abwesenheit (schwarze Balken) und das Vorhandensein von β-CCM, eine nicht-selektive GABA-A Rezeptor NAM (grüner Balken). Β-CCM erweitert die Amplitude der zweiten PS2 teilweise blockiert jede feedforward Gabaergen Hemmung. Die Balken zeigen den Standardfehler des Mittelwerts und ***, dass Daten hoch signifikant mit p < 0,01. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 8: typische verbindliche Ergebnisse in einem wettbewerbsfähigen (Hemmung oder Verschiebung) Assay. Weg-Bindung-Kurven entstehen aus dem IC50 und die Ki bestimmt werden können. IC50 ist die Konzentration eines konkurrierenden Liganden, die 50 % der die spezifische Bindung der Radioligand verdrängt und Ki (die Hemmung Konstante für ein Medikament) ist die Konzentration eines konkurrierenden Liganden, die 50 % der Rezeptoren besetzen würde, wenn keine radioligand anwesend waren. Die Ki errechnet sich aus der IC-50 mit der Cheng-Prusoff Gleichung:
Bitte klicken Sie hier, um eine größere Version dieser Figur.
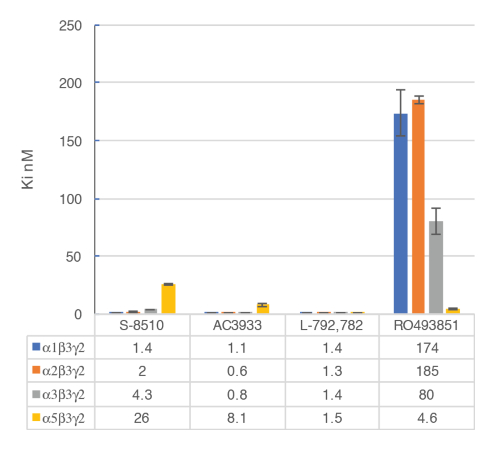
Abbildung 9 : Wettbewerbsfähigkeit Versetzung verbindlichen erfolgte mit Liganden binden an die großen GABA-A -Rezeptor-Subtypen. Affinitäten (nM) wurden mit einem [3H] Flumazenil-Bindung Assay gemessen und Membranen aus HEK293 Zellen mit verschiedenen menschlichen GABA-A Rezeptor Untereinheit Kombinationen vorübergehend transfiziert. Die Histogramm-Darstellung verdeutlicht die unterschiedliche Empfindlichkeit beobachtet für die Verbindung RO493851 mit der niedrigsten Ki an den α5β3γ2-Rezeptoren. Bitte klicken Sie hier für eine größere Version dieser Figur.
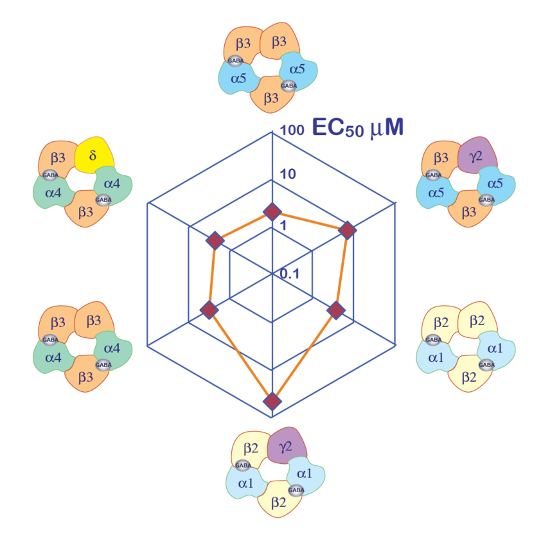
Abbildung 10 : Differential GABA Empfindlichkeit der Rezeptoren. Ein Plot des Rezeptors GABA EC50 auf einem Grundstück von Spinne und eine Darstellung der vermeintlichen Untereinheit Zusammensetzung bieten effiziente Möglichkeiten, um die Rolle der verschiedenen Untereinheiten zu vergleichen. Beachten Sie, dass die Einführung der γ2-Untereinheiten verbunden mit einem Rückgang der Rezeptor-Empfindlichkeit ist. Bitte klicken Sie hier für eine größere Version dieser Figur.
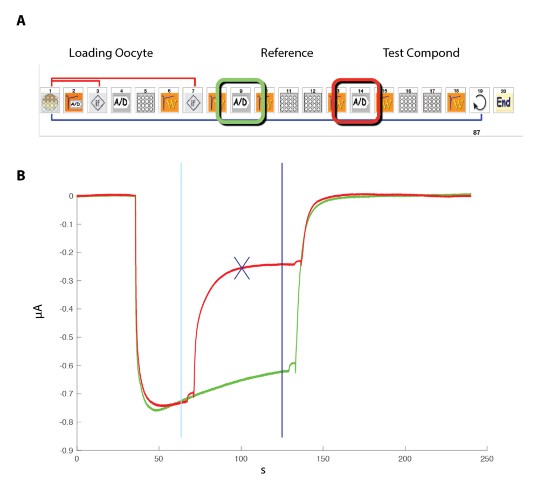
Abbildung 11 : Erforschung der Wirkung von einem Modulator. (A) dieses Panel zeigt die Symbol-Sequenz verwendet für die Steuerung des automatisierten Systems. Beachten Sie, dass die beiden Symbole (A/D) um die Aufnahme in das Steuerelement (grün) und während der Modulator Belichtung (rot) entsprechen. (B) dieses Panel zeigt typische Strömungen in einer Zelle mit dem Ausdruck des GABA-A Rezeptors während dieser Sequenz aufgezeichnet. Um die Auswirkungen der ein Modulator zu bewerten, wurde eine Abfolge von Messung zuerst die Reaktion hervorgerufen durch die Exposition gegenüber einer festen Konzentration von GABA (grüne Spur), gefolgt von der Exposition zunächst auf GABA und dann zu GABA plus der Modulator (rote Spur), durchgeführt. Positionierung der Fadenkreuz-Cursor (Cyan und blau) die Messungen abgrenzt, und das blaue Kreuz zeigt die maximale Differenz zwischen den zwei Aufnahmebedingungen. Das Verhältnis zwischen der Steuerung und Modulator Zustand wird in der Analysesoftware automatisch berechnet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 12 : Wärme-Grundstück mit drei Wiederholungen. Dieses Fenster zeigt ein Hitze-Grundstück entspricht drei Wiederholungen der Modulator Effekte für 96 Verbindungen an den menschlichen α5β3γ2 GABA-A -Rezeptoren erhalten. Die Verhältnisse der testantwort die Kontrolle zwischen 0,5 und 1,2 galten als nicht wesentlich verschieden von der Kontrolle und werden durch einen grünen Punkt dargestellt. Verhältnisse unter 0.5 galten als Vertreter eine hemmende Wirkung und werden durch blaue Punkte dargestellt. Kennzahlen über 1.2 galten als Verbesserung der Reaktion und werden durch rote Punkte dargestellt. Beachten Sie die Ähnlichkeit im Muster zwischen den drei unabhängigen Aufnahmen. Bitte klicken Sie hier für eine größere Version dieser Figur.
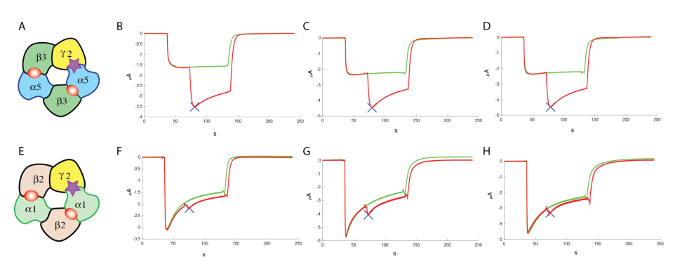
Abbildung 13 : Counter Screening bei α1β2γ2. (A) dieses Panel zeigt eine Darstellung einer vermeintlichen Untereinheit Organisation. Die folgenden Tafeln zeigen (B-D) eine Bewertung der Auswirkungen der eine positive allosterische Modulator an der menschlichen α5β3γ2 und (F-H) am α1β2γ2, mit vergleichbaren Konzentrationen von GABA und ähnliche Konzentrationen (100 µM) von der Modulator, die die Besonderheit der Verbindung markieren in diesen Experimenten getestet. (E) dieses Panel zeigt auch eine Darstellung einer vermeintlichen Untereinheit Organisation. Bitte klicken Sie hier für eine größere Version dieser Figur.
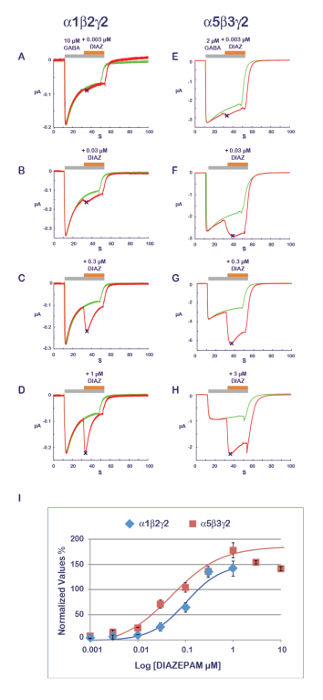
Abbildung 14 : PAM Empfindlichkeit und Rezeptor Zusammensetzung. Die Ermittlung der Auswirkungen einer Reihe von Konzentrationen von Diazepam Effekte (A-D) bei α1β2γ2 und (E-H) α5β3γ2 Rezeptoren zeigt fast einen 10-divisibel Unterschied in der scheinbaren Affinität. Beachten Sie auch den Einfluss der Untereinheit Zusammensetzung auf die Response-Zeit-Kurs mit einer schnelleren Desensibilisierung bei α1β2γ2 Rezeptoren (siehe z. B. Platten D und H). Beachten Sie, dass als die α1β2γ2 und α5β3γ2 Rezeptoren Display unterschiedliche Affinitäten für GABA (siehe auch Abbildung 10), die Konzentration der Agonist wurde zwischen die zwei Rezeptoren im Bereich eine vergleichbare Aktivierung ist angepasst. (I) dieses Panel stellt ein Grundstück der Falte Zunahme eine aktuelle Amplitude normiert auf Einheit im Vergleich zu der Kontrollgruppe. Bitte klicken Sie hier für eine größere Version dieser Figur.
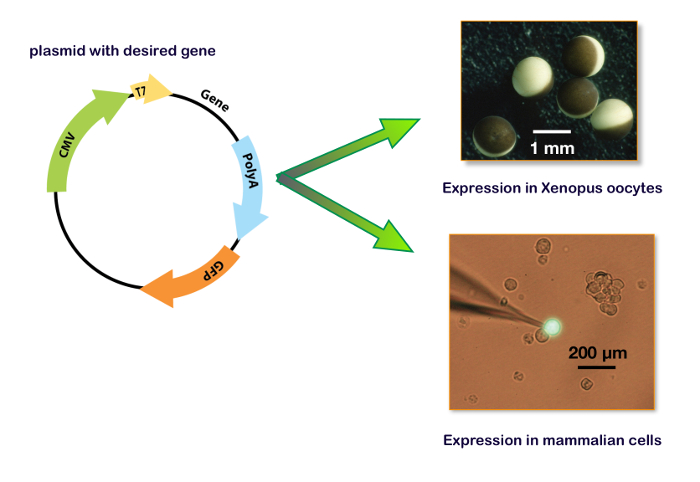
Abbildung 15 : Einschließlich T7 und CMV Promotor expressionsplasmid. Diese Platten zeigen das Plasmid für den Ausdruck in eine Eizelle Xenopus (obere rechte Abbildung) und in einer Zelllinie. Im unteren rechten Bereich zeigt eine typische HEK-293-Zelle mit einem Plasmid enthält auch das Gen für ein grün fluoreszierendes Protein (GFP) transfiziert mit der Patch-Clamp-Aufnahme-Elektrode. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die Entwicklung von neuartigen Verbindungen aktiv auf eine Liganden-gated Ion Channel wie die GABA-A -Rezeptoren erfordert den Einsatz von mehreren Ansätzen. In der Regel ist der erste Schritt oft mit verbindliche Tests durchgeführt; solche Messungen sind jedoch nicht ausreichend, um die physiologische Aktivität die Verbindung oder die genauen Pharmakologie zu charakterisieren. Insbesondere eine Verbindung, die an einen Rezeptor bindet verbessern kann oder hemmen die Funktion oder sogar produzieren keine funktionalen Auswirkungen (Schweig) (d.h.Bindung an den Rezeptor, ohne seine Funktion zu ändern). Somit ist eine Funktionsprüfung erforderlich für eine vollständige Verbindung Charakterisierung.
Assays verbindlich:
Der Hauptvorteil des Assays Bindung ist, dass es auf eine große Anzahl von Proben bis hin zu mehreren tausend effizient durchgeführt werden kann und dass es verbindliche Affinitäten für die aktiven Moleküle. Wie hierin beschrieben, besteht der erste Schritt eine Methode für die Bewertung der gewünschten Rezeptor-Subtypen zu etablieren. Nämlich, während Bindung auf native Rezeptoren aus Brüche oder ganze Gehirn durchgeführt werden kann, wird diese Methode die Bestimmung der Affinitäten zu bestimmten Rezeptor-Subtypen verhindern. Es ist daher notwendig, rekombinante Systeme auf Bildschirm Moleküle an das gewünschte Ziel zu verwenden. Heute bietet eine transiente und stabile Transfektion von gewünschten Rezeptor Untereinheit cDNAs in Zelllinien eine effiziente und zuverlässige Methode, um die Rezeptor-Subtypen von Interesse (z.B. GABA-A -α5β3γ2) zum Ausdruck bringen. Traditionelle Bindung Assays machen Verwenden von Radioligands, aber heute Techniken zur Verfügung, die Unannehmlichkeiten der Umgang mit Radioaktivität (z.B. quantitative Fluoreszenz basierende Ligand-Bindung) zu vermeiden.
Funktionaler Ausdruck in einem Host-System:
Gene in einem Host-System zum Ausdruck zu bringen, muss die kodierende Sequenz des Interesses in ein Plasmid eingefügt werden, die geeigneten Promotoren enthält. In der Regel werden für in-vitro- mRNA-Synthese der bakteriellen T7 oder T6 Promotoren verwendet. Für eine cDNA-Ausdruck muss ein Eukaryote Promotor wie CMV (Zytomegalievirus) oder Äquivalent der Transkription des Gens von Interesse geregelt werden. Heute sind mehrere Plasmide, einschließlich der zwei Promotoren (d. h., pUNIV, pCMV-6AC, Psf-CMV/T7, pCI-Neo, PcDNA), zur Verfügung ermöglicht entweder eine in-vitro- Synthese der mRNA oder eine cDNA-Ausdruck wie in Abbildung 15dargestellt. Ein Ausdruck der GABA-A -Rezeptoren erhalten Sie treu in Zell-Linien oder in Xenopus Eizellen. Die wichtigsten Vorteile des letzteren sind der Mangel an einer endogenen Rezeptor-Expression, die Einfachheit der Manipulationen und die Verfügbarkeit eines automatisierten Systems für Mikro-Injektionen und Aufnahmen. In diesem Protokoll beschriebenen Verfahren illustrieren die Effizienz des automatisierten Systems, das erlaubt der Injektion von 96 Eizellen innerhalb von 7 Minuten und erfordert keine Kenntnisse der Mikromanipulation. Daran erinnern, dass ein einziger Eierstock aus einem Xenopus zwischen 10.000 – 30.000 Eizellen enthält, ist es klar, dass eine große Anzahl von Zellen Messungen auf einer einzigen Vorbereitung durchgeführt werden kann. Darüber hinaus da ein Ausdruck mit cDNA-Injektionen durchgeführt werden kann, die gleichen Plasmide mit den Genen von Interesse, die für die verbindliche Experimente entwickelt werden für eine funktionelle Charakterisierung ohne die Notwendigkeit für weitere Molekulare Biologie einsetzbar Manipulationen.
Angesichts seiner Größe und hohen oberflächenexpression, ergibt eine einzelne Eizelle eine Reihe von Rezeptoren, die die konfluierende Zellen in einem 35 mm Petrischale ungefähr entspricht. Jedoch stellt eine Eizellen Vorbereitung und Injektion einen Bruchteil der Kosten einer Zelllinie, da die Experimente keinem speziellen Nährmedium und sterile Manipulationen erfordern. Die Aktivierung eines einzigen GABA-A -Kanal ergibt sich ein paar Picoamperes (10-12) und Ströme bis hin bis zu zehn Mikroampere (10-6) leicht in einer einzigen Eizelle, die bestätigt, die gleichzeitige Tätigkeit von mehreren Millionen aufgezeichnet Rezeptoren während einer einzigen Antwort.
Ein erster Schritt in der Charakterisierung der Liganden-gated Ionenkanäle ist oft die Bestimmung der scheinbaren Affinität der Rezeptoren. Die Experimente, die durchgeführt werden müssen bestehen aus Anwendung einer Reihe von kurzen Agonist Prüfimpulse und Plotten die Amplitude der evozierten aktuelle oder in bestimmten Fällen die Fläche unter der Kurve (AUC) als Funktion des Logarithmus der Konzentration Agonist. Da es leicht möglich, verschiedene Plasmid-Konzentrationen und Verhältnis in der gleichen Charge von Eizellen microinject ist, ist dieses System der Ausdruck besonders geeignet für eine solche Charakterisierung. Außerdem ergab ein Vergleich von Charge zu Charge ein hohes Maß an Stabilität für verschiedene EG50s. Der Einfluss der Untereinheit Zusammensetzung auf den Rezeptor scheinbare Affinität ist leicht mit einer Spinne Grundstück, wie in Abbildung 10veranschaulicht visualisiert.
Die Ergebnisse der zwei-Elektroden-Spannung Klemme in Xenopus Eizellen gewonnen werden oft mit Aufnahmen, die mit Patch-Clamp-Elektroden verglichen. Während es den Rahmen dieser Arbeit in einen detaillierten Vergleich zwischen diesen beiden Systemen gehen sprengen würde, können ein paar Punkte untersucht werden. Während eine Patch-Clamp in Zellen Vorteile für eine biophysikalische Charakterisierung mit einer schnellen Drug Application bietet, sind die Anforderungen komplexer als jene der zwei-Elektroden-Aufnahmen in Xenopus Eizellen. Eine erste und nicht zu vernachlässigenden Schwierigkeit ist der Ausdruck eines gegebenen Proteins mit der Notwendigkeit einer Zellkultur, eine transiente und stabile Transfektion und die Identifizierung der Zellen, die das gewünschte Konstrukt zum Ausdruck bringen. Darüber hinaus ist es unerlässlich, um den möglichen Beitrag des endogenen Ausdrucks in der betrachteten Zelle untersuchen. Darüber hinaus erfordert eine Patch-Clamp-Aufnahme einen Fachmann der Mikromanipulation unter dem Mikroskop hoher Vergrößerung durchzuführen, während diese Person auch eine angemessene Analyse während des Experiments zu bewerten, z. B. die Qualität der Dichtung durchführen muss, der Zugang Widerstand etc. im Gegensatz dazu ein zwei-Elektroden-Spannung Klemme Aufnahme, vor allem mit einem automatisierten elektrophysiologische System erfordert keine besonderen Fähigkeiten und von Laboranten durchgeführt werden kann.
Beim Erwerb einer elektrophysiologischen Set-up ist Kosten berücksichtigen sicherlich ein wichtiger Faktor, der muss sorgfältig analysiert werden. Zum Beispiel die Kosten eines automatisierten Systems relativ hoch ist, zeigt ein genauerer Vergleich, dass die Installation eines kompletten elektrophysiologische Rigs schließt Kauf von Geräten wie z. B. gute Mikromanipulatoren, ein Fernglas-Objektiv, ein Verstärker, ein perfusion System und eine Anti-Vibrationstisch, aber auch die Erfassung von Daten und Durchführung einer Analyse. Ein Kostenvergleich zwischen einer zwei-Elektroden-Spannung Klemme Set-up gegen ein Patch Clamp-Setup zeigt noch weitere Unterschiede. Darüber hinaus das automatisierte System bietet den Vorteil der vollautomatischen Anlagen und wird Tag und Nacht unbeaufsichtigt ausgeführt.
Die pharmakologischen Eigenschaften eines Stoffes werden durch seine Wirkungsweise am Rezeptor bestimmt. Zum Beispiel sind wettbewerbsfähige Inhibitoren Moleküle, die die gleichen bindungstasche oder Orthosteric Website eingeben können, wie der Agonist selbst bewirkt, einen Wettbewerb dass. Nicht-kompetitiver Hemmer sind Verbindungen, die die Rezeptoren durch die Interaktion an anderer Stelle und im Falle einer Liganden-gated Ionenkanal hemmen, die können geben Sie und blockieren die ionische Pore, zum Beispiel. Es würde den Rahmen dieser Arbeit, die verschiedenen Mechanismen der Interaktion zu untersuchen hinausgehen, aber weitere Informationen erhalten Sie aus einer pharmakologischen Lehrbuch und/oder andere Arbeiten wie Bertrand und Bertrands22.
Bei allosterische Modulatoren ändert die Verbindung bindet an einem Standort, der sich aus der Orthosteric-Website, aber die Anwesenheit des Moleküls unterscheidet der Energiebarriere zwischen den aktiven und anderen Staaten. Positive allosterische Modulatoren (PAMs) sind Verbindungen, die der Energiebarriere zu reduzieren, von der Ruhe in den aktiven Zustand und daher verstärken die Wirkung des Agonisten. Um mögliche Auswirkungen von PAM zu charakterisieren, ist es daher notwendig, um festzustellen, wenn eine Exposition gegenüber der Verbindung die Antwort auf Agonisten verbessert und, wenn ja, in welcher Konzentration. Die Experimente, dargestellt in Abbildung 11 und Abbildung 14 veranschaulichen Protokolle, die für die Charakterisierung von PAMs an den GABA-A -Rezeptoren erfolgreich eingesetzt werden können.
In einigen Fällen möglicherweise Exposition gegenüber der PAM allein ausreicht, um die Rezeptoren aktivieren. Diese Aktivität kann durch eine leichte Modifikation des hier vorgestellten experimentellen Protokolls ermittelt werden. Nämlich, kann statt mit einer Co-Anwendung des Modulators während der Exposition gegenüber der GABA, das Protokoll für die Anwendung der ersten Verbindung allein und dann im Beisein der GABA geändert werden. Eine Charakterisierung der direkten Agonist Tätigkeit wird durch die Bestimmung der Amplitude der Reaktion hervorgerufen durch die Verbindung selbst und im Vergleich zu den GABA-evozierten Strom erfolgen.
Experimente in Hirnschnitten, wie in Abbildung 7dargestellt werden verwendet, um die zusammengesetzte Aktivität auf native Rezeptoren in einem bestimmten hemmenden Kreislauf zu bestätigen, bevor wir weitermachen, in Tiermodellen und den Weg in Richtung klinischer Studien. Das relativ einfache Daten Erfassung und Analyse-Protokoll ermöglicht das Ranking von mehreren Verbindungen durch die Auswertung ihrer differentiellen modulierende Wirkung auf PS-Amplitude. Unspezifische Effekte von Verbindungen, die nicht auf das GABA-System beziehen kann auch erkannt (z. B., wenn Änderungen in der PS-Form eingehalten werden). Direkte, kann Gabaergen Neurotransmission in diesen Fällen beurteilt werden durch die Messung der Auswirkungen der Verbindungen auf die inhibitorischen postsynaptischen Ströme (IPSCs) über die ganze Zelle Patch Clamp Technik8.
Offenlegungen
Die Autoren Frédéric Knoflach und Maria Clemencia Hernandez sind Mitarbeiter der F. Hoffmann-La Roche AG, 4070 Basel, Schweiz, ein pharmazeutisches Unternehmen. Der Autor Daniel Bertrand ist Angestellter der HiQScreen Sàrl 6, Rte de Compois, 1222 Vésenaz Genf, Schweiz, Bereitstellung von Screening-Einrichtungen für Pharma-Unternehmen.
Danksagungen
Die Autoren danken Judith Lengyel, Maria Karg, Grégoire Friz, Rachel Haab und Marie Claire Pflimlin von Roche und Tifany Schaer und Deborah Paolucci aus HiQScreen für ihre hervorragenden technischen Betreuung.
Materialien
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| 96 well cell harvester -(Filtermate 196) | Packard | To filter membranes with bound radioligand | |
| Microtiter plate liquid scintillation counter (Top Count NXT) | Packard | Microplate Scintillation and Luminescence counter | |
| Vial liquid scintillation counter (Beta-Couter 2500 TR) | Packard | Vial Scintillation and Luminescence counter | |
| Liquid handler (Biomek 2000) | Beckman coulter | To prepare compound dilutions | |
| Vortex (Vortex Genie 2) | Scientific industries Inc. | To mix compound stock solutions | |
| Tissue homogenizer (Polytron PT1200E) | Kinematica AG | To resuspend the membrane preparations | |
| XLfit5 software | Microsoft Excel add-on by IDBS | Curve fitting software | |
| Smart Pull | UniPix | - | Electrode Puller |
| RoboInject | MultiChannel Systems | - | Automated Injection (Xenopus Oocytes) |
| HiClamp | MultiChannel Systems | - | Automated Voltage Clamp (Xenopus Ooocytes) |
| DataMining | MultiChannel Systems | - | Data Analysis Software |
| DataMerger | MultiChannel Systems | - | Data Processing Software |
| Digidata 1550 | Molecular Devices | Low noise data acquisition system | |
| CyberAmp 380 or equivalent | Axon Instruments | Programmable Signal Conditioner | |
| pClamp program suite | Molecular Devices | Software for data acquisition and analysis software | |
| Antivibraton table | TMC | To avoid microelectrode vibrations | |
| Patchstar Micromanipulators | Scientifica | To accurately position microelectrodes in brain slices | |
| Faraday Cage | Sutter Instruments | To isolate recordings from noise | |
| McIlwain Tissue Chopper | Campden Instruments LTD | To prepare brain slices | |
| Borosilicate glass micropipette | Warner Instruments | GC150TF-10 | To record extracellular potentials in brain slices |
| Twisted pair, platinum iridium wires stimulation electrode | World Precision Instruments | To stimulate the brain slices with current | |
| Stimulus generator for current and voltage driven stimulation | MultiChannel Systems | STG4000 | Delivers the current to the stimulation electrode |
| Plasticware | |||
| Microtiter plate round bottom | Corning | #3365 | Used for the binding assay |
| GF/C glassfibre filter-bottom 96-well microplate with 1.2 µm poresize, for cell harvesting assays using a vacuum manifoldwell filter | Packard | #6005174 | used for the binding assay |
| 50 mL Tubes | Falcon | #352070 | used for the binding assay |
| Safe-lock tubes 1.5 mL | Eppendorf | #0030 120086 | used for the binding assay |
| Safe-lock tubes 2 mL | Eppendorf | #0030 120094 | used for the binding assay |
| Shipping tubes 180 mL | Semadeni Europe AG | #3722 | used for the binding assay |
| Pony vial Polyethylene 6 mL | Perkin Elmer | #6013329 | used for the binding assay |
| Top Seal | Perkin Elmer | #60051859 | used for the binding assay |
| Spinner Flask | Bellco | BELLCO # 1965-00100 | Spinner Flask |
| 96 Well Plate (Conical) | Thermo Scientific Milian | 56368 | Injection plate for the oocytes |
| 96 Well Plate (Flat bottom) | Corning (Vitaris Switzerland) | 3364-cor | Compound Plate for the HiClamp |
| Glass capillary | Hilgenberg (Germany) | - | borosilicate glass 1.2 O.D. 0.76 I.D. with filament |
| RNA preparation | |||
| Ambion mMessage mMachine | Thermo Fisher Scientific | for the in vitro synthesis | |
| Chemicals | |||
| Assay buffer: KCl 5 mM; CaCl2 1.25 mM; MgCl2 1.25 mM; NaCl 120 mM; Tris 15 mM pH adjust with HCl to 7.4; store up to 3 months at 4 °C. | Used for binding assay | ||
| Washing buffer: Tris 50 mM -HCl pH 7.4; store at 4 °C. | Used for binding assay | ||
| Stock solution of test compounds 10 mM in DMSO | Used for binding assay | ||
| Flumazenil (RO0151788) 10 mM in DMSO | Used for binding assay | ||
| Diazepam 4 mM in DMSO | Used for binding assay | ||
| [3H]-Flumazenil 60-85 Ci/mmol in Ethanol; store at -20 °C | Used for binding assay | ||
| Microscint 40 | Packard | #6013641 | Used for binding assay |
| Ultima Gold | Perkin Elmer | #6013329 | Used for binding assay |
| MS-222 | Sigma | Sigma # A5040 | MS-222 |
| AB/AM | Sigma | Sigma # A5955 | antibiotics / antimycotics |
| Collagenase | Sigma | Sigma # C1030 | Collagenase Type I |
| Rnase | Sigma | Sigma # R2020-250 mL | RNaseZAP |
| EndoFree Plasmid maxi Kit | Qiagen | Qiagen # 12362 | |
| Salts for artificial cerebrospinal fluid (NaCl, KCl, etc.) | Sigma | ||
| Membranes | |||
| Frozen membrane preparations from transient or stably transfected HEK293 overexpressing different human GABAA receptor subtypes: α1β3γ2, α2β3γ2, α3β3γ2, α5β3γ2. See Ballard et al. 2009 for detailed methods. | Used for binding assay |
Referenzen
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nature Reviews Drug Discovery. 10, 685-697 (2011).
- Sieghart, W. Structure and pharmacology of g-aminobutyric acidA receptor subtypes. Pharmacological Reviews. 47, 181-234 (1995).
- Liu, J., et al. A high-throughput functional assay for characterization of g-aminobutyric acidA channel modulators using cryopreserved transiently transfected cells. ASSAY and Drug Development Technologies. 6, 781-786 (2008).
- Mennerick, S., et al. Diverse voltage-sensitive dyes modulate GABAA receptor function. Journal of Neuroscience. 30, 2871-2879 (2010).
- Hevers, W., Luddens, H. The diversity of GABAA receptors. Pharmacological and electrophysiological properties of GABAA channel subtypes. Molecular Neurobiology. 18, 35-86 (1998).
- Macdonald, R. L., Olsen, R. W. GABAA receptor channels. Annual Review of Neuroscience. 17, 569-602 (1994).
- Kemp, J. A., Marshall, G. R., Wong, E. H., Woodruff, G. N. The affinities, potencies and efficacies of some benzodiazepine-receptor agonists, antagonists and inverse-agonists at rat hippocampal GABAA-receptors. British Journal of Pharmacology. 91, 601-608 (1987).
- Prenosil, G. A., et al. Specific subtypes of GABAA receptors mediate phasic and tonic forms of inhibition in hippocampal pyramidal neurons. Journal of Neurophysiology. 96, 846-857 (2006).
- Ballard, T. M., et al. RO4938581, a novel cognitive enhancer acting at GABAA a5 subunit-containing receptors. Psychopharmacology. 202, 207-223 (2009).
- Knoflach, F., Hernandez, M. C., Bertrand, D. GABAA receptor-mediated neurotransmission: Not so simple after all. Biochemical Pharmacology. 115, 10-17 (2016).
- Gielen, M. C., Lumb, M. J., Smart, T. G. Benzodiazepines modulate GABAA receptors by regulating the preactivation step after GABA binding. Journal of Neuroscience. 32, 5707-5715 (2012).
- Bergmann, R., Kongsbak, K., Sorensen, P. L., Sander, T., Balle, T. A unified model of the GABAA receptor comprising agonist and benzodiazepine binding sites. PLoS One. 8, 52323 (2013).
- Richter, L., et al. Diazepam-bound GABAA receptor models identify new benzodiazepine binding-site ligands. Nature Chemical Biology. 8, 455-464 (2012).
- Rudolph, U., Crestani, F., Mohler, H. GABAA receptor subtypes: dissecting their pharmacological functions. Trends in Pharmacological Sciences. 22, 188-194 (2001).
- Wisden, W., Seeburg, P. H. GABAA receptor channels: from subunits to functional entities. Current Opinion in Neurobiology. 2, 263-269 (1992).
- Davies, C. H., Davies, S. N., Collingridge, G. L. Paired-pulse depression of monosynaptic GABA-mediated inhibitory postsynaptic responses in rat hippocampus. The Journal of Physiology. 424, 513-531 (1990).
- Karnup, S., Stelzer, A. Temporal overlap of excitatory and inhibitory afferent input in guinea-pig CA1 pyramidal cells. The Journal of Physiology. 516, 485-504 (1999).
- Turner, D. A. Feed-forward inhibitory potentials and excitatory interactions in guinea-pig hippocampal pyramidal cells. The Journal of Physiology. 422, 333-350 (1990).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. 391, 85-100 (1981).
- Adelsberger, H., Brunswieck, S., Dudel, J. Block by picrotoxin of a GABAergic chloride channel expressed on crayfish muscle after axotomy. European Journal of Neuroscience. 10, 179-187 (1998).
- Hapfelmeier, G., et al. Isoflurane slows inactivation kinetics of rat recombinant a1b2g2L GABAA receptors: enhancement of GABAergic transmission despite an open-channel block. Neuroscience Letters. 307, 97-100 (2001).
- Bertrand, S., Bertrand, D. Overview of electrophysiological characterization of neuronal nicotinic acetylcholine receptors. Current Protocols in Pharmacology. , 17 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten