Method Article
Metodi per la scoperta di nuovi composti modulando un recettore dell'acido Gamma - aminobutirrico tipo una neurotrasmissione
In questo articolo
Riepilogo
Qui, presentiamo protocolli per scoprire composti attivi sui recettori GABAA , dall'associazione alla fisiologia e alla farmacologia.
Abstract
Questa presenta manoscritto un protocollo dettagliato per lo screening composti a gamma-amminobutirrico acido digitare un recettori (GABAA) ed il relativo uso verso l'identificazione di nuove molecole attive nei saggi preclinici da un ricombinante in vitro recettore ai loro effetti farmacologici dei recettori nativi nelle fette del cervello del roditore. Per composti vincolante al sito del recettore delle benzodiazepine, il primo passo è quello di impostare una schermata principale che consiste di sviluppare analisi obbligatorie radioligand sulle membrane delle cellule che esprimono i principali sottotipi di GABAA . Poi, approfittando dell'espressione eterologa dei recettori GABAA roditore e umani in oociti di Xenopus o cellule HEK 293, è possibile esplorare, nelle analisi elettrofisiologiche, le proprietà fisiologiche del recettore diverso le proprietà farmacologiche dei composti identificati e sottotipi. Il sistema di ovociti di Xenopus sarà presentato qui, a partire con l'isolamento di ovociti e loro microiniezione con differenti mRNA, fino alla caratterizzazione farmacologica utilizzando due elettrodi tensione morsetti. Infine, le registrazioni condotte nelle fette del cervello del roditore saranno descritto utilizzati come secondario fisiologico test per valutare l'attività delle molecole alle loro recettori nativi in un circuito ben definito di un neurone. Registrazioni extracellulari utilizzando le risposte di popolazione dei neuroni multipli sono dimostrate unitamente alla domanda di droga.
Introduzione
Qui, presentiamo i protocolli per la scoperta di composti attivi sui recettori GABAA , dall'associazione alla fisiologia e alla farmacologia. Nella ricerca di nuove molecole specifiche per i recettori GABAA , è cruciale per definire, nel modo più preciso possibile, il sottotipo di interesse e la valutazione della specificità dei composti recentemente identificati (ad es., per una rassegna, Vedi Rudolph e Knoflach1o Sieghart2). Il percorso tipico in drug discovery e i passaggi che devono essere raggiunti sono illustrati nella Figura 1.
Analisi obbligatorie sono state e sono ancora in gran parte utilizzate come il primo passo nella scoperta della droga. Nel caso di recettori GABAA , sono ottimizzati per identificare i composti che si legano al sito di legame delle benzodiazepine, del recettore, dove associare farmaci terapeuticamente utili e sicuri. Altre tecniche, utilizzando fluorometrica imaging piastra lettore (FLIPR) membrana potenziale saggi basati su colorante rosso3, rilevano composti come i barbiturici che legano ad altri siti che sono meno desiderabili a causa del loro profilo di effetti collaterali indesiderato. Inoltre, i coloranti utilizzati direttamente possono attivare recettori GABAA , così in discussione l'utilità di questi saggi per drug discovery4. Analisi di associazione può fornire solo la prova che un determinato composto può essere associato a una classe di recettori specifici. In vitro saggi con le membrane cellulari sono utilizzati per identificare selettivo umani ligandi dei recettori GABAA α5β3γ2. Transitoriamente transfected le cellule HEK293 esprimendo l'umano GABAA α5β3γ2, α1β3γ2, α2β3γ2 e α3β3γ2 recettori vengono utilizzate per preparare le membrane per queste analisi. L'effetto dei ligandi è rilevata misurando la scintillazione di flumazenil [3H] associati a recettori di membrana (un'inibizione del legame di flumazenil [3H]). Il vantaggio principale di questa tecnica è che una determinazione rapida ed efficiente dell'affinità al recettore di interesse composto-associazione viene fornita presso il recettore di interesse.
Gli studi funzionali sono essenziali per valutare l'attività funzionale dei composti e di proporre una spiegazione fisiologica e farmacologica dei meccanismi causato dall'associazione dei composti ai recettori. Oggi, è incontestato che funzionale dei recettori GABAA risultato dall'assemblaggio di cinque subunità attorno a un asse di pseudosymmetry formata dal poro ionico e risultato dall'assembly di cinque subunità identiche. La maggior parte dei recettori GABAA sono composti da due o più unità secondarie differenti. Il recettore importante del cervello GABAA , per esempio, è composta delle subunità α1, β2 e γ2 in una stechiometria di 2, 2 e 1 rispettivamente5,6. Una ricostituzione in un sistema host come gli ovociti di Xenopus o cellule HEK293 offre la possibilità di esplorare rapidamente le proprietà farmacologiche dei recettori.
Le proprietà farmacologiche dei composti sono poi Esplorate con registrazioni extracellulari nel cervello fette7. Questo metodo permette un'esplorazione dell'effetto dei composti sulla neurotrasmissione e fornisce un modo efficace per confermare gli effetti funzionali dei composti determinati in sistemi eterologhi a livello dei recettori nativi in generale ambiente di un neurone. Neurotrasmissione GABAergica è valutabile anche a livello molecolare, misurando gli effetti dei composti su correnti postsinaptiche inibitorie (IPSCs)8. Ma il protocollo usato qui e basate sulle cellule intere patch morsetto registrazioni nelle fette del cervello è più elaborato e produce una velocità di trasmissione inferiore.
Infine, la forza e debolezza in vitro screening cascata utilizzato per l'identificazione di ligandi selettivi per α5β3γ2 è discussi nella prospettiva di diverse tecniche e i loro limiti intrinseci. Questo lavoro dovrebbe fornire esperti e non esperti nel campo dei recettori GABAA una recensione utile la combinazione di approcci diversi in vitro utilizzata per affrontare la scoperta di nuovi modulatori di questi canali ionici ligando.
Protocollo
Xenopus laevis sono ospitato e gestito secondo le direttive di animale del Canton Ginevra.
1. Radioligand Binding
-
Preparazione del piatto dosaggio
- Preparare 1,5 L di tampone di dosaggio con 5 mM KCl, 1,25 mM CaCl2, 1,25 mM MgCl2, 120 mM NaCl e 15 mM Tris; regolare il pH con HCl a 7,4.
- Preparare i composti da sottoporre a 50.76 µM (ad es., un composto a 10 mM in un 980 µ l di tampone di dosaggio in una microcentrifuga 5 µ l). Mescolare bene usando una macchina vortice ad alta velocità per 2 – 5 s.
- Preparare una pre-diluizione del flumazenil composto di riferimento di pipettaggio 1 µ l del composto (10 mM) a 1.970 µ l di tampone di dosaggio. Mescolare bene usando una macchina vortice ad alta velocità per 2 – 5 s.
- Diluire una soluzione di riserva di flumazenil [3H] con il tampone di dosaggio a 4 ° C a 4 nM in un tubo in polipropilene da 50 mL.
- Pipettare 50 µ l/pozzetto di tampone del saggio nelle colonne 1 e 3 – 11 di una micropiastra a 96 pozzetti come mostrato nel layout della piastra rappresentato nella Figura 2.
- 73,2 µ l dei composti diluito a 50.76 µM (Vedi punto 1.1.2) nella colonna 12 della piastra.
- Diluire ciascun composto, utilizzando una progressione geometrica sopra 9 gradini (1E-10 – 1E–06 M), con un 23,12 µ l di trasferimento e riempire colonne 3 – 11. Mescolare accuratamente la diluizione. Cambiare la punta dopo ogni diluizione.
-
Diluire le membrane cellulari
- Scongelare le membrane delle cellule precedentemente isolate da un overesprimenti HEK293 umano del recettore GABAA (0.025 – 0,15 mg/mL) per ottenere 80 mL a temperatura ambiente (TA) e trasferire la sospensione nel buffer di dosaggio a 4 ° C.
- Risospendere la soluzione di membrana ancora a 4 ° C con un omogeneizzatore del tessuto per 30 – 40 s a 10.000-12.000 giri/min.
-
Diluire il diazepam per il controllo di legame aspecifico (NSB)
- Diluire una soluzione di riserva di diazepam 4 mM con il tampone di dosaggio ad una concentrazione di 40 µM in 5 mL.
-
Avviare la reazione
- Pipettare 50 µ l di 4 nM [3H] flumazenil in ciascun pozzetto della piastra 96 pozzetti e conservarla in un contenitore di acqua ghiacciata.
- Aggiungere 100 µ l della preparazione di membrane sottotipo recettoriale GABAA per avere una concentrazione di proteina di 0,5 mg/mL.
- Pipettare 50 µ l di diazepam di 40 µM nella colonna 2.
- Incubare la piastra per 1h sul ghiaccio.
- Aggiungere 50 µ l di tampone di dosaggio in ciascun pozzetto di una piastra a 96 pozzetti filtro di separazione a membrana successive e misura di radioattività e interrompere la reazione in seguito.
-
Fermare la reazione
- Preparare un tampone di lavaggio con 50 mM Tris-HCl, pH 7.4.
- Filtrare la soluzione mediante un harvester cella 96 pozzetti. Lavare la piastra 3 x con 300 µ l di tampone di lavaggio ghiacciata per pozzetto.
- Sigillare il fondo del piatto con una pellicola di plastica e aggiungere 40 µ l di cocktail per il liquido di scintillazione scintillazione contando ogni bene e pulire con etanolo 70%.
- Scuotere delicatamente la piastra per almeno 1 h a TA. Lasciate riposare per almeno un'altra ora a TA.
- Misurare la radioattività (in CPM) inserendo la piastra su un contatore di scintillazione. Consentire una misurazione per 3 min per pozzetto.
-
Analisi dei dati
- Determinare che la media per le 8 replica di legame aspecifico (NSB) e l'associazione totale (TB) come pure per quanto riguarda i duplicati o triplici copie dei campioni. Calcolare il legame specifico % (SB) per la media di ogni campione secondo la seguente equazione:
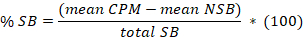
Qui,
totale SB = la media TB meno il dire NSB. - Trama in ascissa il SB % versus in ordinata le concentrazioni dell'inibitore. Inserire i dati utilizzando l'equazione di analisi concorrenza singolo sito:

Qui,
y = la % di SB,
A = minimo di y,
B = il numero massimo di y,
C = la IC50,
X = il log10 della concentrazione del composto concorrente,
D = la pendenza della curva (un coefficiente di Hill). - Calcolare l'affinità di legame (Ki) usando la mezza concentrazione inibitoria massima (IC50), la costante di dissociazione (Kd) di flumazenil [3H] sulle rispettive membrane9e la concentrazione di [3H] Flumazenil nell'analisi secondo la seguente equazione utilizzando dati:
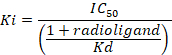
- Determinare che la media per le 8 replica di legame aspecifico (NSB) e l'associazione totale (TB) come pure per quanto riguarda i duplicati o triplici copie dei campioni. Calcolare il legame specifico % (SB) per la media di ogni campione secondo la seguente equazione:
2. recettore espressione e registrazioni in ovociti di Xenopus
- Ovaie di raccolta e preparazione degli ovociti
- Preparare la soluzione sterile di Barth con 88 mM NaCl, 1 mM KCl, 2,4 mM NaHCO3, 10 mM HEPES, 0,82 mM MgSO4.7h2O, 0,33 mM Ca (NO3)2.4h2O e 0,41 mM CaCl2.6h2O, a pH 7,4 , completati con 100 unità/mL di penicillina, 100 µ g/mL streptomicina e 0,25 µ g/mL di amfotericina b.
- Preparare il supporto di x OR2 1 (nessun CaCl2) con 88,5 mM NaCl, 2.5 mM KCl, 5 mM HEPES, 1 mM MgCl2.6h2O, a pH 7,4.
- Sacrificio una Xenopus Laevis femmina di anestesia profonda per 20 min in raffreddato Tricaina metansolfonato (ad una concentrazione di 150 mg/L, regolata a pH 7,4) e bicarbonato di sodio (300 mg/L) seguita dalla decapitazione.
- Raccogliere le ovaie rapidamente con pinze e forbici pulite e metterli in 2 di-Petri (10cm) riempito con 40 mL di soluzione di Barth e antibiotici/antimicotici: 1x.
- Conservare le ovaie non dissociato per fino a 2 settimane in soluzione di Barth a 4 ° C.
- Per la dissociazione, tagliare le ovaie con una lama di rasoio pulita in piccole frazioni (1 – 2 cm3) e incubare li in 50 mL di mezzo di OR2 senza CaCl2 (OR2-noCaCl2) contenente collagenasi di 0,2% (tipo I) alle 17 – 19 ° C in un filatore di 100 mL matraccio con un'agitazione lenta per 4 – 5 h. Verificare che la barra magnetica è posto circa 3 – 5 cm sopra il fondo del matraccio spinner per evitare di schiacciare gli ovociti.
- Dopo 4 – 5 h, verificare che la maggior parte degli ovociti sono liberata dal loro follicolo (cioè, che nuotano intorno individualmente). Lavare 5X con 200 mL di OR2 completati con 1,8 mM CaCl2.
- Trasferire la defolliculated ovociti di Petri (10cm) riempito con soluzione di Barth e antibiotici/antimicotici e tenerli almeno una notte a 17 ° C prima dell'iniezione di cDNA o mRNA.
- Il giorno successivo, seleziona, sotto un binocolo, un ovocita sano che presenta una chiara e distinta animale contro un palo vegetal (marrone scuro per il polo animale contro giallo chiaro per il palo vegetal). Utilizzare pipette Pasteur pulite e gettare gli ovociti uno per uno in una piastra ben di 96-iniezione conica sterile.
Nota: non è richiesta nessuna particolare attenzione nel posizionamento degli ovociti per le iniezioni di mRNA; considerando che, per le iniezioni di cDNA, è indispensabile per orientare gli ovociti con il polo animale rivolto verso l'alto.
- iniezione automatica mRNA o del cDNA
- Sintetizzare i mRNAs utilizzando un kit disponibile in commercio seguendo le istruzioni consigliate. Pulire gli strumenti e la tabella con RNAsi e indossare i guanti di protezione appropriati.
Nota: La qualità del mRNA è determinante per ottenere una buona espressione, ed è indispensabile per evitare la degradazione di mRNA durante la procedura di iniezione. - Preparare i cDNAs utilizzando un kit disponibile in commercio e sciogliere la quantità desiderata in acqua bidistillata ad una concentrazione di 0,2 µ g / µ l.
- Iniettare 10 – 50 nL di soluzione di mRNA ad una concentrazione di 0,2 µ g / µ l, o 10 nL di cDNA soluzione ad una concentrazione da 0,02 – 0,2 µ g / µ l, preferibilmente in lotti di 95 ovociti.
- Per membrana proteine che richiedono più subunità (cioè, i recettori eteromerici α1β2γ2 GABAA ), mescolare il corrispondente mRNA o cDNAs nel rapporto desiderato (cioè, 1:1:1 o 1:10:1).
- Mantenere l'ovocita a 17 ° C al fine di prevenire l'espressione di heat shock proteins gli ovociti; conservare la micropiastra in un'area di deposito termo-controllata.
- Sciogliere i residui della prova che erano risultati positivi nel test associazione a OR2 a 0,1 – 1.000 µM per registrazioni elettrofisiologiche e li smaltire in una lastra in polipropilene fondo piatto 96 pozzetti.
- Sintetizzare i mRNAs utilizzando un kit disponibile in commercio seguendo le istruzioni consigliate. Pulire gli strumenti e la tabella con RNAsi e indossare i guanti di protezione appropriati.
- Plasmidi per l'espressione
- Seguire i manuali di istruzioni dei kit disponibili in commercio per la sintesi di mRNA con promotori batterici T7 o T6 e fare 20 µ l di una soluzione a 0,2 µ g / µ l in acqua RNAsi-libera.
- Preparare almeno 20 µ l di una soluzione contenente un vettore di espressione dell'eucariota per l'espressione di cDNA, in genere a 0,2 µ g / µ l, disciolto in acqua bidistillata.
- Microiniezione nell'ovocita e la visualizzazione della sua qualità
- Iniettare 10 – 50 nL di soluzione contengono il plasmide (Vedi punto 2.3.1 o 2.3.2) utilizzando un ago di micro-iniezione di vetro con un diametro di punta che vanno fino a 100 µm montata su un micromanipolatore equipaggiato con un sistema di espulsione di pressione o con un sistema automatizzato ad iniezione.
Nota: Nell'esempio discusso qui, gli ovociti vengono iniettati con i lotti di 95 con un sistema automatizzato adatto ad uso con cDNA o mRNA. - Riempire l'ago per iniezione con 1 µ l di un colorante come il blu di metilene all'1% e iniettare gli ovociti mediante la procedura standard (sia nel nucleo per cDNA o nel citoplasma per mRNA).
- Smaltire gli ovociti iniettati per circa 1 minuto in acqua bollente. Tagliare gli ovociti a metà con una lama di rasoio sotto un binocolo.
Nota: Il colorante rimane localizzato come mostrato in Figura 3E, permettendo un'osservazione precisa dell'iniezione.
- Iniettare 10 – 50 nL di soluzione contengono il plasmide (Vedi punto 2.3.1 o 2.3.2) utilizzando un ago di micro-iniezione di vetro con un diametro di punta che vanno fino a 100 µm montata su un micromanipolatore equipaggiato con un sistema di espulsione di pressione o con un sistema automatizzato ad iniezione.
- Registrazioni di due elettrodi tensione morsetto
- Posizionare la piastra ben contenente gli ovociti sul sistema automatizzato, che utilizza il principio illustrato nella Figura 4.
Nota: In contrasto con il sistema del morsetto di patch illustrato nella Figura 5, il potenziale di membrana vero della cella viene letto tramite l'elettrodo di tensione. - Programmare il sistema di registrazione automatizzata utilizzando l'interfaccia basata su icone con, ad esempio, lo schema illustrato nella Figura 6 per la determinazione del rapporto di attività di concentrazione.
- Posizionare la piastra ben contenente gli ovociti sul sistema automatizzato, che utilizza il principio illustrato nella Figura 4.
- Adattamento alla curva
- Analizzare i risultati utilizzando il software appropriato, utilizzando la curva di attivazione illustrato concentrazione, trama l'ampiezza corrente in funzione del logaritmo della concentrazione dell'agonista.
- Osservare la curva sigmoidale che può successivamente essere equipaggiata con l'equazione empirica di collina nel modulo:
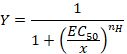
Qui,
Y= la frazione di corrente evocati,
CE 50 = la concentrazione per un 50% di attivazione,
x = la concentrazione del composto,
nH = il coefficiente di Hill o la cooperatività apparente. - Normalizzare le correnti ad un'unità dividendo l'ampiezza di ogni risposta contro il valore registrato al più alta concentrazione di analizzare i dati ottenuti da una serie di celle.
- Determinare la media e gli errori standard e realizzare l'adattamento delle curve utilizzando software come standard disponibili.
3. elettrofisiologiche registrazioni nelle fette del cervello
Nota: Fette Hippocampal del ratto sono preparati in conformità con le linee guida nazionali e istituzionali.
-
Preparazione delle fette dell'ippocampo
- Preparare il liquido cerebro-spinale artificiale dissezione (dACSF) con 124 mM NaCl 124, 2,5 mM KCl, 1,25 mM KH2PO4, 2mm MgSO4.7h2O, 2,5 mM CaCl2 2 H2O, 26mm NaHCO3, glucosio di 10 mM e 4 mM saccarosio gassificato in bottiglia con una miscela di 95% O2 e 5% CO2.
- Preparare il registrazione fluido cerebro-spinale artificiale (rACSF) con 124 mM NaCl, 5 mM KCl, 1,25 mM KH2PO4, 2mm MgSO4.7h2O, 2,5 mM CaCl2 2 H2O, 25mm NaHCO3e 10 millimetri di glucosio gassificato in bottiglia con una miscela di 95% O2 e 5% CO2.
- Anestetizzare i ratti utilizzando una miscela di 2,5% isoflurane e ossigeno puro e decapitare loro.
- Tagliare il cuoio capelluto seguendo la linea mediana con un bel paio di forbici. Tagliare il cranio lungo la linea mediana senza danneggiare il tessuto sottostante. Rimuovere il cranio con le pinzette e utilizzare una spatola fine per scavare il cervello.
- Posizionare il cervello nella soluzione dACSF gasati a RT e sezionare la formazione hippocampal di sinistra con una spatola fine.
- Tagliare in sezioni trasversali (spessore 400 µm) dalla parte media dell'ippocampo con un elicottero di tessuto e trasferirli alla camera di registrazione con l'uso di un pennello di pittura. Mantenere le fette a RT per 45 min.
- Irrorare le fette con la rACSF gasati a 35 ° C e a una velocità di 1,5 mL/min bolla la soluzione con una miscela di 95% O2 e 5% CO2.
Nota: Dopo questo passaggio, le fette sono pronte per gli esperimenti elettrofisiologici.
-
Registrazione di spike singola popolazione
- Mettete una fetta di cervello nella camera microscopio-montato.
- Irrorare la fetta a una velocità di 3 mL/min con rACSF.
- Tirare una micropipetta di vetro borosilicato con l'estrattore di pipetta avendo una resistenza di MΩ ~ 2.
Nota: Questa micropipetta è usata come un elettrodo di registrazione e viene collegata elettricamente all'amplificatore. - Riempire la micropipetta con una soluzione contenente 2 M NaCl e inserirlo nel supporto pipetta dell'amplificatore.
- Posizione la micropipetta di registrazione nel pyramidale corneum nella regione CA1 di fettine di ippocampo utilizzando il micromanipolatore giusto.
Nota: Il percorso è rappresentato schematicamente nella Figura 7. - Posizionare un elettrodo di platino/iridio bipolare isolato nel supporto sul micromanipolatore di sinistra.
Nota: Questo elettrodo viene utilizzato come l'elettrodo di stimolazione ed è collegato elettricamente al generatore di stimolo. - Posizionare l'elettrodo di stimolazione nei collaterali di Schaffer nella regione CA1 della fetta hippocampal utilizzando il micromanipolatore giusto.
Nota: Il percorso è rappresentato schematicamente nella Figura 7. - Fornire un impulso di corrente all'elettrodo di stimolazione utilizzando il generatore di stimolo ogni 30 s (durate 100 µs, a partire da 10 µA) e aumentare gradualmente l'intensità di stimolazione fino a un picco di popolazione (PS) viene visualizzato.
- Regolare l'intensità di stimolo per evocare un PS corrispondente al 45% dell'ampiezza massima che può essere ottenuta. PSs sono filtrati a 2,4 KHz e digitalizzati a 20 KHz utilizzando l'amplificatore di segnale.
-
Inibizione di accoppiare-impulso
- Preparare le fettine di cervello (punto 3.1) e procedere come descritto in precedenza (punti 3.2.1–3.2.7).
- Fornire due impulsi di corrente (100 µs durate a un intervallo di 20 ms) all'elettrodo di stimolazione ogni 30 s utilizzando il generatore di stimolo. Regolare l'intensità di stimolo per evocare un PS corrispondente al 45% dell'ampiezza massima.
-
Compound test
- Effettuare diluizioni dei composti da testare in ACSF gasati affinché la concentrazione finale di DMSO non superiore allo 0,1%.
- Aggiungere alla soluzione di controllo alla stessa concentrazione di quella nella soluzione composta DMSO.
- Registrare un singolo (punto 3.2) o un PS di accoppiare-impulso (punto 3.3) evocato da stimoli collaterali di Schaffer ogni 30 s per almeno 30 min. La forma di PS deve essere stabile durante questo periodo di previsione.
- Preparare un becher con gasati rACSF contenente una concentrazione fissa del composto da testare.
- Irrorare le fettine di ippocampo con questa soluzione mentre ancora registrando il singolo o accoppiare-impulso PS.
- Valutare il recupero dall'effetto composto irrorando la fetta con gasati rACSF senza il composto.
Nota: Per effetti reversibili, il PS Torna alla sua forma iniziale osservato durante il periodo della linea di base prima dell'applicazione di composto.
-
Analisi dei dati
- Media le tracce di PS registrata durante l'esperimento in blocchi di 4 utilizzando il software di analisi dati.
- Misurare le ampiezze di PS delle tracce media.
- Normalizzare le ampiezze come percentuale dei valori di baseline registrato 10 min prima che irrora un composto.
- Esprimere i dati come media ± SEM
Risultati
Rilegatura:
Il saggio in vitro con le membrane cellulari viene utilizzato per identificare selettivo umani ligandi di recettori di α5β3γ2 GABAA , legandosi al sito allosterico delle γ2 BZD contenente recettori. Transitoriamente transfected le cellule HEK293 esprimendo l'umano GABAA α5β3γ2, α1β3γ2, α2β3γ2 e α3β3γ2 recettori vengono utilizzate per preparare le membrane per questo test. L'effetto dei ligandi potenziali viene rilevata misurando la scintillazione di flumazenil [3H] associati a recettori di membrana (un'inibizione del legame di flumazenil [3H]). Curve di associazione di spostamento sono poi generate per valutare la selettività dei composti per uno specifico recettore GABAA , come nell'esempio con RO4938581 (Figura 8). Figura 9 riassume il profilo di diversi composti di riferimento tra cui quella del α5 selettiva GABAA recettore negativo allosterico modulatore, RO49385819, che sono stati generati usando l'analisi di associazione.
Registrazioni in Xenopus ovociti:
L'espressione dei recettori GABAA come il heteromer di α5β3γ2 produce robuste correnti in risposta all'esposizione di GABA. Tensione tipica morsetto registrazioni ottenute in un ovocita esprimendo il α5β3γ2 umano in risposta agli impulsi di GABA (30 s) che vanno fino a 300 µM sono illustrati nella Figura 6. In questo esperimento, le diverse concentrazioni di GABA erano disposti nella piastra 96 pozzetti e le risposte sono state evocate spostando la cella in un ben specifico. Il GABA è stato accuratamente lavato restituendo la cella alla camera centrale di aspersione e applicando un'aspersione di soluzione di controllo attivando la pompa peristaltica corrispondente. La sequenza di programma utilizzata per la determinazione della curva di attivazione di concentrazione è illustrata nella Figura 6A. Condotto in modo completamente automatico, questi dati illustrano sia la qualità delle registrazioni che possono essere ottenuti in ovociti di Xenopus e l'alto livello di espressione del recettore ottenuti pochi giorni dopo l'iniezione di mRNA. Gli esperimenti, condotti alle combinazioni differenti del ricevitore, resa di una serie di EC50s, che è la concentrazione di GABA necessario attivare metà dei recettori. Un terreno di CE50di valori su un grafico di ragno, come illustrato nella Figura 10, fornisce un rapido confronto delle proprietà del ricevitore e l'influenza della composizione in subunità.
Per esaminare l'effetto di un modulatore allosterico positivo o negativo (NAM o PAM), è necessario confrontare la risposta evocata da un impulso di prova agonista (GABA), prima nel controllo e quindi in presenza del modulatore. Un efficiente protocollo sperimentale per condurre un esperimento di questo tipo è illustrato nella Figura 11. La risposta della cellula ad una concentrazione di riferimento di GABA è determinata in primo luogo e la sequenza viene ripetuta applicando la stessa concentrazione di GABA e quindi da una co-applicazione del GABA plus il modulatore. Una trama delle due risposte sovrapposte rivela in questo esempio una profonda inibizione causata dalla presenza del modulatore. Una quantificazione dell'effetto modulatore è facilmente ottenuta calcolando il rapporto della risposta evocata in presenza del modulatore contro il controllo e i risultati possono essere rappresentati in forma di una trama di calore. I dati riportati nella Figura 12 illustrano la trama di calore corrispondente alle registrazioni di tre insiemi di dati acquisiti per 96 composti.
A seguito dell'identificazione di composti che sono sufficientemente attive, è spesso indispensabile per valutare se queste molecole sono attive alle altre combinazioni di recettore. Nel caso il recettore GABAA , sono stati identificati 19 geni che codificano per subunità diverse, ed è noto che un recettore funzionale può derivare da un assemblaggio di multimeric di diverse subunità (Vedi Knoflach, Hernandez e Bertrand10 per una recensione). Anche se il rendimento di subunità e combinazioni multiple un vasto repertorio del recettore i sottotipi che potrebbe richiedere un gran numero di screening contatore deve essere eseguita, è spesso possibile concentrarsi prima sul sottotipo più abbondanti che, nel caso il GABAA recettori, è la composizione di α1β2γ2. Esperimenti condotti testa a testa con l'espressione di, per esempio, α5β3γ2 e α1β2γ2 nello stesso batch dell'oocita produrre un buon confronto dei rispettivi effetti di una data molecola. I risultati tipici ottenuti in tre celle per α5β3γ2 e α1β2γ2 sono mostrati in Figura 13, che illustra la preferenziale modulazione positiva di una molecola di α5β3γ2.
Il protocollo sperimentale illustrato nella Figura 11 è adatto per la caratterizzazione di un'attività di PAM. In questo protocollo, il composto che è testato è co-applicato con l'agonista a concentrazioni progressivamente crescenti. Per evitare i possibili effetti cumulativi causati da più applicazioni sulla stessa cellula, un cellulare nuovo e ingenuo è misurato per ogni punto dati. Una misurazione dell'ampiezza della risposta registrata con l'agonista da solo e durante l'applicazione composto produce quindi un rapporto che quantifica l'effetto PAM o NAM. Risultati tipici ottenuti a α1β2γ2 e α5β3γ2 per diazepam sono mostrati in Figura 14, rivelando una sensibilità apparente di α5β3γ2 che è circa 10 volte superiore a questa combinazione del ricevitore. Questi valori sono in buona correlazione con i dati pubblicati11. Come si pensa che il sito di benzodiazepina è costituito dall'interfaccia tra le γ2 e sua subunità α adiacente12-14, la sensibilità della α5β3γ2 suggerisce un'affinità preferenziale diazepam per γ2-α5 sopra γ2-α1. La possibilità di esprimere combinazioni differenti del ricevitore combinati con una caratterizzazione funzionale efficiente apre più modi per esplorare determinanti delle proprietà PAM e loro implicazioni per gli effetti fisiologici e farmacologici.
Fette hippocampal del cervello:
Gli esperimenti con fette hippocampal del cervello del ratto sono condotti per convalidare il profilo farmacologico dei composti identificati nelle analisi in vitro in un modello di recettore nativo. I sottotipi di recettori GABAA predominante espressi nelle cellule piramidali dell'ippocampo sono α1β2/3γ2, α2β2/3γ2 e α5β2/3γ2, che sono tutti modulata da benzodiazepine (BDZ)15. Inibizione di accoppiare-impulso è un paradigma che può rivelare eccitabilità hippocampal circuito verificando il cambiamento nella risposta del secondo dei due stimoli elettrici accoppiati consegnato 20 ms apart. Il cambiamento della seconda risposta è a causa del feedback di GABAergic di interneuroni che innervano la cellula piramidale strato16-18. Come illustrato nella Figura 7, nella situazione di controllo, la seconda risposta di due stimoli appaiati è inibita a causa di un'inibizione GABAergica. Quando questa inibizione è ridotto irrorando la fetta con β-CCM, un non-selettivi NAM, la seconda risposta dei due stimoli appaiati è inibito in misura molto minore. Questo paradigma sperimentale è sensibile ai composti selettivi per un recettore GABAA contenente la subunità α5.
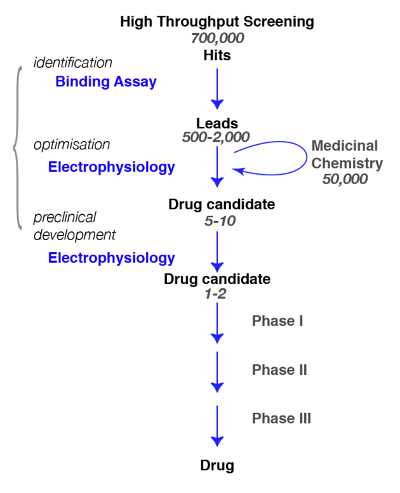
Figura 1 : Strategia di screening. Un tipico percorso di screening droga comincia con la proiezione di alto-rendimento in cui grandi librerie di composti sono proiettate per una destinazione specifica. Dopo l'identificazione del candidato piombo, comincia il lavoro di chimica farmaceutica. Durante questa fase, chimici saranno studiare e perfezionare le molecole eseguendo una modificazione strutturale per soddisfare i criteri desiderati, come ad esempio la selettività del bersaglio, penetranza di cervello, stabilità e degradazione ecc durante questa fase cruciale, è essenziale per valutare se le modifiche chimiche non hanno alterato le proprietà della molecola e perfezionare per il miglior candidato. Il passo successivo è quello di identificare alcuni promettenti composti e portarli ai passaggi successivi che includono sicurezza, tolleranza, ecc. nota che elettrofisiologia è indicato come analisi funzionale ma che altri metodi, tra cui la fluorescenza di calcio saggi o tensione coloranti sensibili, può essere utilizzato come alternative. Questi ultimi metodi sono anche utilizzati nelle analisi di alto-rendimento come una sostituzione per analisi obbligatorie. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Layout di un 96 pozzetti placcato utilizzati per esperimenti di associazione. Colonna 1 è utilizzato per misure di associazione totale e colonna 2 per le misure di legame non specifico. Righe A – H sono riempiti con 4 diversi composti in aumento delle concentrazioni (colonne 3 – 12), ogni composto in duplicati (cioè, composto 1 nella riga A ed E, composto 2 nelle righe B e F, ecc.) rappresentato nel layout con colori diversi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Utilizzando un sistema automatico di microinjection. (A) A sistema XYZ preciso, in cui un ago di iniezione di vetro riempito con il liquido che contengono il plasmide di interesse, è automaticamente infilò negli ovociti. (B) questo pannello mostra la piastra 96 pozzetti conico-parte inferiore in cui (C) gli ovociti sono inseriti automaticamente. (D), questo pannello illustra il principio di iniezione. Per l'iniezione di nucleare, l'ago penetra l'ovocita leggermente più profondo rispetto al nucleo, come è mostrato nel pannello B. Quindi, l'ago è ritirato dal nucleo (vedi pannello C) prima dell'iniezione (vedi pannello D). (E) per valutare la qualità dell'iniezione, l'ago può essere riempito con un colorante e "cotto" gli ovociti possono essere tagliati a metà. Clicca qui per visualizzare una versione più grande di questa figura.
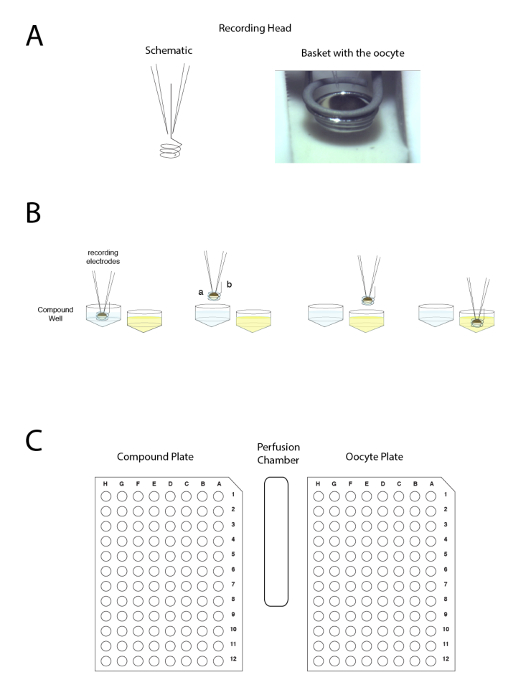
Figura 4 : Il principio di elettrodo due tensione-morsetto automatizzato. Il principio si basa sul movimento la preparazione tra pozzi, piuttosto che applicare il liquido di perfusione. (A), il lato sinistro del pannello rappresenta la disposizione che consente la registrazione in un oocita di Xenopus con i due elettrodi e il piccolo cestino che manterrà una goccia di liquido intorno la preparazione durante il movimento da un campione a un altro. Un'immagine dell'ovocita nel cestello con i due elettrodi viene visualizzata sul lato destro. (B), questo pannello mostra una rappresentazione schematica del principio di registrazione l'elettrofisiologia "upside down". (C), questo pannello mostra la disposizione dell'ovocita, composto di piastra e lavare stazione sul tavolo di registrazione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Morsetto di tensione del due-elettrodo registrazione contro toppa morsetto. Un morsetto di tensione tipica di due elettrodi di registrazione per ovociti (pannello sinistro) viene confrontato con la configurazione di morsetto di patch utilizzata per una linea cellulare (pannello di destra). Si noti la differenza di dimensioni tra gli ovociti che sono circa 1 mm di diametro contro le cellule che sono circa 20 µm. Nel morsetto tensione di due elettrodi, il potenziale di membrana dell'ovocita viene confrontato con la tensione desiderata della holding e la differenza di segnale viene iniettata l'elettrodo corrente. In una registrazione di patch clamp, si presume che la resistenza dell'elettrodo patch clamp è trascurabile rispetto alla resistenza di membrana e, pertanto, che la tensione imposto dall'amplificatore è alimentato fedelmente per la membrana cellulare19. La foto illustra un'aspersione di filamento liquido nel quale i due canali di un tubo di teta () vengono riempiti con, da un lato, una soluzione di controllo e, d'altra parte, con la soluzione contenente il farmaco20,21. Clicca qui per visualizzare una versione più grande di questa figura.
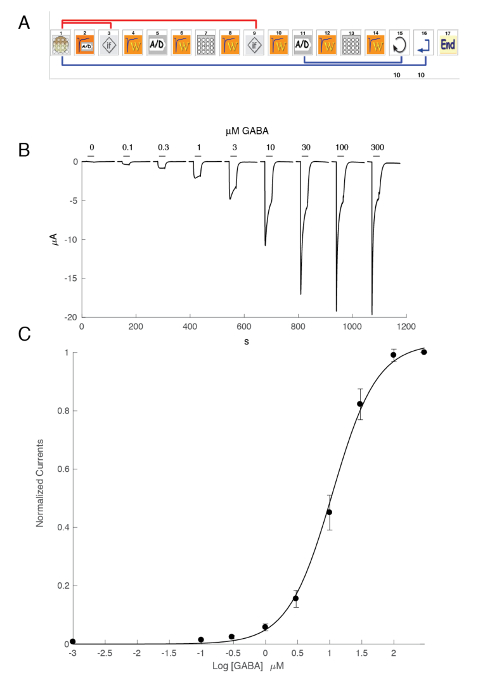
Figura 6 : Rapporto di attivazione di concentrazione presso i recettori umani α5β3γ2. (A), la sequenza di controllo il sistema automatizzato è costituito da una serie di icone e imposta il protocollo sperimentale per la determinazione del rapporto di attivazione di concentrazione. Nei passaggi 1-3, come illustrato in questo pannello, il sistema carica l'ovocita dalla piastra nel cestello per misura. La corrente di perdita è misurata nel passaggio 2 e, qualora questo valore superasse i criteri desiderati, la cella viene automaticamente modificata (passaggio 3). Dopo un periodo di stabilizzazione (fase 4), la risposta degli ovociti per fare riferimento a una concentrazione di GABA è misurati (punti 5-8). Ovociti visualizzati da correnti più grandi di 1 µA sono tenuti per la misurazione successiva. Nei passaggi 11 – 13, la cella viene sfidata da diverse concentrazioni di GABAA e il processo si ripete per il numero desiderato di concentrazioni (punto 14) e cellule (punto 15). (B) questo pannello mostra le correnti tipiche evocate da una serie di applicazioni di GABA breve (30 s) applicate in ordine in crescita. La tempistica dell'applicazione composto è indicata dalle barre. (C) A trama del picco di corrente verso l'interno in funzione del logaritmo della concentrazione di GABA fornisce la curva di attivazione di concentrazione che viene prontamente montata con l'equazione empirica di collina, con una curva continua, un CE50 a circa 11 µM e una collina coefficiente di 1,3. Registrata in 8 celle correnti sono state normalizzate ad un'unità per la massima risposta evocata. Le barre indicano l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
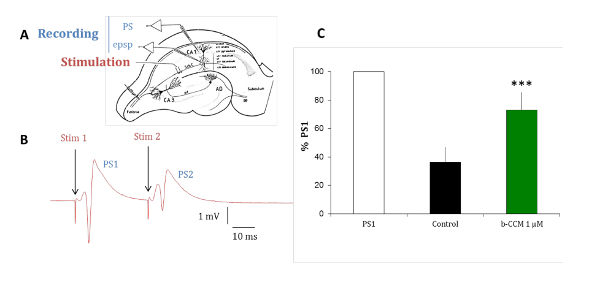
Figura 7 : Β-CCM, un GABAA NAM riduce l'inibizione di accoppiare-impulso nelle fette hippocampal. (A), questo pannello mostra una rappresentazione schematica di una fetta hippocampal del ratto. I collaterali di Schaffer (Sch C) provenienti dal progetto assoni delle cellule piramidali CA3 sul arborization dentritico dei neuroni piramidali CA1. Micropipette sono state collocate nel corneum pyramidale (str pyramidale) per registrare picchi di popolazione (PS) e la strato radiato (str radiato) per le registrazioni dendritiche dei potenziali postsinaptici eccitatori di campo (epsp). L'elettrodo di stimolazione era collocata dentro i collaterali di Schaffer. (B) questo pannello mostra PSs evocato da stimoli associati applicati attraverso lo stesso elettrodo stimolante a un intervallo di 20 ms. La risposta della popolazione allo stimolo secondo (PS2) è di minore ampiezza di quella della risposta per il primo stimolo (PS1). (C) PSs sono stati registrati in assenza (barra nera) e in presenza di β-CCM, un non-selettivi NAM di recettore GABAA (barra verde). Β-CCM ha migliorato l'ampiezza della PS2 secondo bloccando parzialmente qualsiasi inibizione GABAergica feed-forward. Le barre indicano l'errore standard della media e * * * che i dati sono altamente significativi con una p < 0.01. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: associazione tipici risultati ottenuti in una prova competitiva (inibizione o spostamento). Spostamento associazione curve sono generate da cui l'IC50 e Ki può essere determinato. IC50 è la concentrazione di un ligando concorrente che sposta il 50% del grippaggio specifico del radioligand, e Ki (la costante di inibizione per un farmaco) è la concentrazione di un ligando concorrente che occuperebbe il 50% dei recettori se nessun radioligand erano presenti. Il Ki è calcolato dal IC50 usando l'equazione di Cheng-Prusoff:
Clicca qui per visualizzare una versione più grande di questa figura.
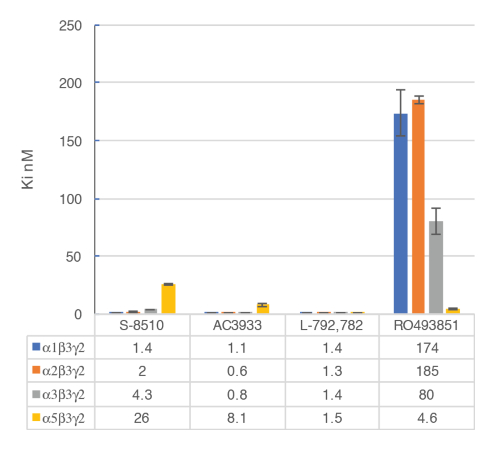
Figura 9 : Associazione di cilindrata competitivo è stato effettuato con ligandi vincolante presso i principali sottotipi di recettori GABAA . Affinità (nM) sono stati misurati usando un'analisi di flumazenil-associazione [3H] e membrane ottenute da cellule HEK293 transfected transitoriamente con diverse combinazioni di subunità di ricevitore di GABAA umano. La rappresentazione di istogramma illustra chiaramente la sensibilità differenziale osservata per il composto RO493851 con il più basso Ki presso i recettori α5β3γ2. Clicca qui per visualizzare una versione più grande di questa figura.
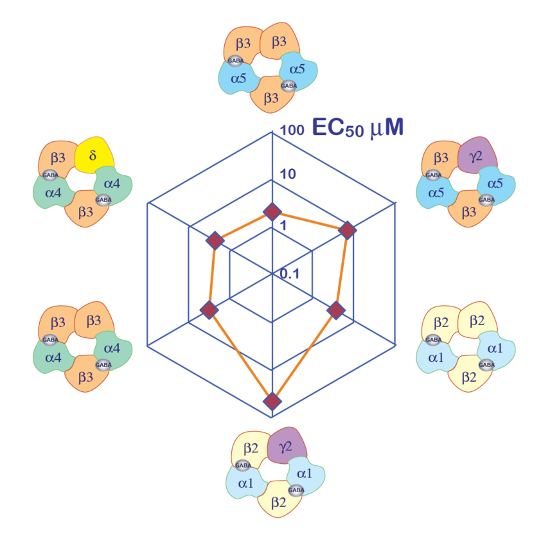
Figura 10 : Sensibilità differenziale GABA dei ricevitori. Un complotto del recettore GABA CE50 su un terreno di ragno e una rappresentazione della composizione in subunità putativo forniscono modi efficienti per confrontare il ruolo delle diverse subunità. Si noti che l'introduzione delle subunità γ2 è associata con una riduzione della sensibilità del ricevitore. Clicca qui per visualizzare una versione più grande di questa figura.
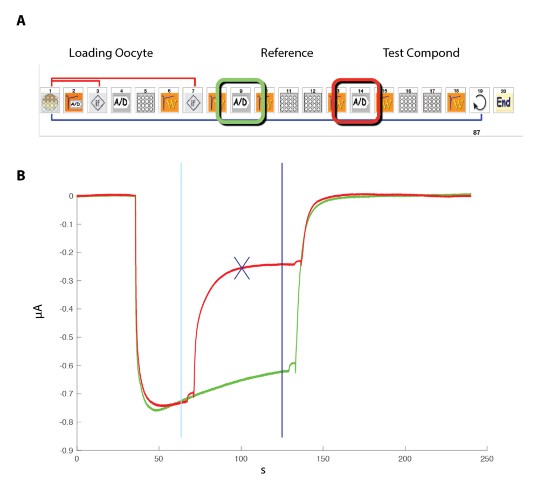
Figura 11 : L'effetto di un modulatore di sondaggio. (A), questo pannello illustra la sequenza di icona viene utilizzata per controllare il sistema automatizzato. Si noti che le due icone (A/D) corrispondono alla registrazione nel controllo (verde) e durante l'esposizione di modulatore (rosso). (B), questo pannello mostra tipiche correnti registrate in una cella che esprimono il recettore GABAA durante questa sequenza. Per valutare gli effetti di un modulatore, una sequenza di misurazione in primo luogo la risposta evocata tramite l'esposizione ad una concentrazione fissa di GABA (traccia verde), seguita dall'esposizione prima di GABA e quindi a GABA plus il modulatore (traccia rossa), è stato condotto. I cursori di mirino (ciano e blu) di posizionamento delimita le misurazioni, e la croce blu indica la massima differenza tra le due condizioni di registrazione. Il rapporto tra la condizione di controllo e modulatore viene calcolato automaticamente nel software di analisi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 12 : Trama di calore con tre replicati. Questo pannello mostra una trama di calore corrispondente a tre replicati del modulatore effetti ottenuti per 96 composti ai ricevitori di GABAA della α5β3γ2 umana. I rapporti della risposta prova sopra il controllo compresa tra 0.5 e 1.2 sono stati considerati come non significativamente diverso dal controllo e sono rappresentati da un puntino verde. Rapporti sotto 0.5 sono stati considerati come che rappresenta un effetto inibitorio e sono rappresentati da punti blu. Rapporti sopra 1.2 sono stati considerati come migliorando la risposta e sono rappresentati da punti rossi. Notare la similitudine nel modello tra le tre registrazioni indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
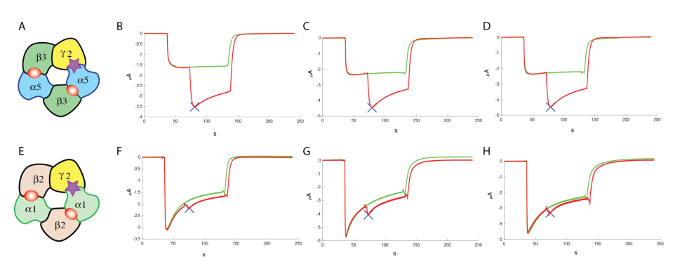
Figura 13 : Contatore screening al α1β2γ2. (A), questo pannello mostra una rappresentazione di un'organizzazione di presunti subunità. I pannelli seguenti mostrano (B-D) una valutazione degli effetti di un modulatore allosterico positivo al α5β3γ2 umana e (F-H) a α1β2γ2, utilizzando le concentrazioni comparabili di GABA e simili concentrazioni (100 µM) del modulatore, che mettono in evidenza la specificità del composto testato in questi esperimenti. (E), questo pannello mostra anche una rappresentazione di un'organizzazione di presunti subunità. Clicca qui per visualizzare una versione più grande di questa figura.
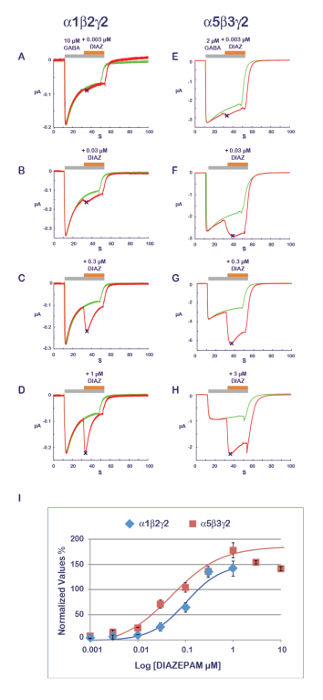
Figura 14 : Composizione di sensibilità e recettore PAM. La determinazione degli effetti di una serie di concentrazioni di effetti di diazepam (A-D) a α1β2γ2 e (E-H) α5β3γ2 recettori rivela quasi una differenza di 10 volte in apparente affinità. Si noti inoltre l'influenza della composizione in subunità sul corso di tempo di risposta con una più rapida desensibilizzazione dei recettori α1β2γ2 (Vedi, ad esempio, pannelli D e H). Si noti che come la α1β2γ2 e α5β3γ2 recettori display diverse affinità per il GABA (Vedi anche Figura 10), la concentrazione di agonista è stata registrata fra i due ricevitori in un intervallo di attivazione comparabili. (I) questo pannello rappresenta un complotto della piega aumento in un'ampiezza corrente normalizzata in unità contro la condizione di controllo. Clicca qui per visualizzare una versione più grande di questa figura.
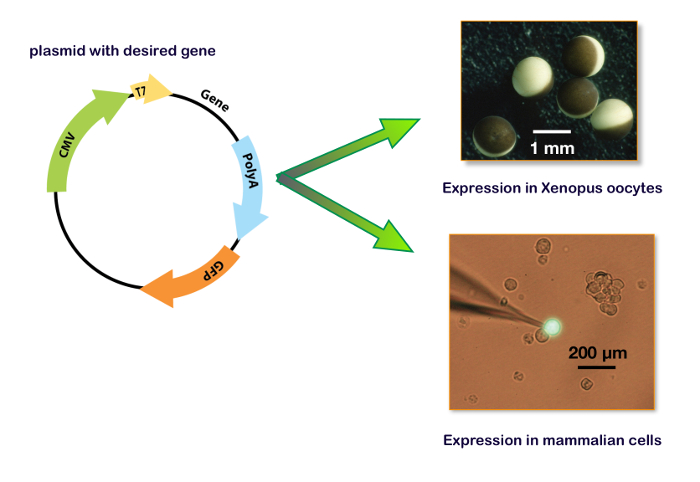
Figura 15 : Plasmidi di espressione tra cui promotore T7 e CMV. Questi pannelli mostrano il plasmide per l'espressione in un oocita di Xenopus (pannello superiore destro) e in una linea cellulare. Il pannello di destra inferiore illustra un tipico delle cellule HEK-293 trasfettato con un plasmide contenente anche il gene per una proteina fluorescente verde (GFP) con l'elettrodo di registrazione di patch-clamp. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Lo sviluppo di nuovi composti attivi a un canale ionico legante-gated come i recettori GABAA richiede l'utilizzo di approcci multipli. In genere, il primo passo è spesso condotto mediante analisi obbligatorie; Tuttavia, tali misure sono insufficienti per caratterizzare l'attività fisiologica del composto o sua farmacologia preciso. In particolare, un composto che si lega a un recettore può migliorare o inibire la sua funzione o anche non produrre alcun effetto funzionale (tacere) (cioè, legano al recettore senza modificare la sua funzione). Quindi, un test funzionale è necessario per una caratterizzazione completa composta.
Saggi di binding:
Il vantaggio principale del dosaggio associazione è che può essere condotta in modo efficiente su un gran numero di campioni che vanno fino a diverse migliaia e che fornisce affinità di legame per molecole attive. Come descritto nel presente documento, il primo passo consiste nello stabilire un metodo per la valutazione dei sottotipi del ricevitore desiderato. Vale a dire, mentre l'associazione può essere condotta su recettori nativi da frazioni o intero cervello, tale metodo impedirà la determinazione delle affinità a sottotipi recettoriali specifici. Pertanto, è necessario utilizzare sistemi ricombinanti per molecole schermo presso la destinazione desiderata. Al giorno d'oggi, una trasfezione transiente o stabile dei cDNA subunità del recettore desiderata in linee cellulari offre un metodo efficiente e affidabile per esprimere i sottotipi del ricevitore di interesse (ad es., GABAA α5β3γ2). Associazione tradizionale saggi fanno uso di radioligands, ma al giorno d'oggi le tecniche sono disponibili che evitare l'inconveniente di movimentazione radioattività (ad es., basati sulla fluorescenza quantitativa ligand-legantesi).
Espressione funzionale in un sistema host:
Per esprimere geni in un sistema host, la sequenza di codificazione di interesse deve essere inserita in un plasmide contenente i promotori adeguati. In genere, per la sintesi di mRNA in vitro , i promotori di T7 o T6 batterici vengono utilizzati. Per un'espressione di cDNA, la trascrizione del gene di interesse deve essere regolata da un promotore dell'eucariota come CMV (citomegalovirus) o equivalente. Al giorno d'oggi, diversi plasmidi, compresi i due promotori (cioè, pUNIV, pCMV-6AC, psf-CMV/T7, pCI-neo, pcDNA), sono disponibili permettendo una sintesi in vitro di mRNA o un'espressione di cDNA come mostrato in Figura 15. Un'espressione dei recettori GABAA possa essere ottenuta fedelmente nelle linee cellulari o in ovociti di Xenopus . I principali vantaggi di questi ultimi sono la mancanza di espressione del recettore endogeno, la semplicità di manipolazioni e la disponibilità di un sistema automatizzato per micro-iniezioni e registrazioni. Le procedure descritte in questo protocollo illustrano l'efficienza del sistema automatizzato che consente l'iniezione di 96 ovociti in circa 7 minuti e non richiede nessuna abilità di micromanipolazione. Ricordando che un unico ovario da una Xenopus contiene tra 10.000-30.000 ovociti, è chiaro che un gran numero di misurazioni delle cellule può essere condotta su una singola preparazione. Inoltre, come un'espressione può essere condotta mediante iniezioni di cDNA, lo stessi plasmidi contenenti i geni di interesse che sono stati sviluppati per gli esperimenti di associazione possono essere utilizzati per una caratterizzazione funzionale senza la necessità di ulteriore biologia molecolare manipolazioni.
Data la sua grande dimensione e alta espressione di superficie, un singolo ovocita produce un numero di recettori che è approssimativamente equivalente a cellule confluenti in una capsula di Petri da 35 mm. Tuttavia, un'iniezione e preparazione di ovociti rappresenta una frazione del costo di una linea cellulare, come gli esperimenti non richiedono un terreno di coltura specifico e manipolazioni sterili. L'attivazione di un singolo canale di GABAA produce pochi picoamperes (10-12) e le correnti che vanno fino a decine di microampere (10-6) sono facilmente registrate in un singolo oocita, che conferma l'attività concomitante di diversi milioni di recettori durante una singola risposta.
Un primo passo nella caratterizzazione dei canali ionici ligando è spesso la determinazione dell'apparente affinità dei recettori. Gli esperimenti che devono essere condotte sono costituiti da applicando una serie di impulsi di prova breve agonista e tramando l'ampiezza dell'evocati corrente o, in alcuni casi, l'area sotto la curva (AUC) in funzione del logaritmo della concentrazione dell'agonista. Come è facilmente fattibile da microinject plasmide diverse concentrazioni e rapporto nello stesso batch di ovociti, questo sistema di espressione è particolarmente appropriato per tale caratterizzazione. Inoltre, un confronto lotto ha rivelato un alto grado di stabilità per diversi CE50s. L'influenza della composizione in subunità su affinità apparente del ricevitore è visualizzato prontamente usando una trama di ragno, come esemplificato nella Figura 10.
I risultati del morsetto tensione due elettrodi ottenuti in ovociti di Xenopus sono spesso confrontati con le registrazioni effettuate usando elettrodi di patch clamp. Considerando che andrebbe oltre lo scopo di questo lavoro per andare in un confronto dettagliato tra questi due sistemi, possono essere esaminati alcuni punti. Mentre un morsetto di patch in cellule offre vantaggi per una caratterizzazione biofisica con un'applicazione veloce di droga, i requisiti sono più complessi di quelli delle registrazioni del due-elettrodo in ovociti di Xenopus . Una difficoltà prima e non trascurabile è l'espressione di una data proteina con la necessità di una coltura cellulare, un transitorio o trasfezione stabile e l'identificazione delle cellule che esprimono il costrutto desiderato. Inoltre, è indispensabile esaminare il possibile contributo dell'espressione endogena nella cella considerata. Inoltre, una registrazione di morsetto di patch richiede una persona esperta per condurre la micromanipolazione sotto un microscopio ad alto ingrandimento, mentre quella persona deve anche eseguire un'analisi adeguata durante l'esperimento per valutare, ad esempio, la qualità della guarnizione, la resistenza di accesso ecc In contrasto, un morsetto di tensione del due-elettrodo registrazione, specialmente uno utilizzando un sistema elettrofisiologico automatico, non richiede competenze specifiche e può essere condotta dai tecnici di laboratorio.
Quando l'acquisizione di un set-up elettrofisiologico, costo considerazione è certamente un fattore importante che deve essere attentamente analizzati. Ad esempio, mentre il costo di un sistema automatizzato è relativamente alto, un confronto più vicino rivela che l'installazione di un rig elettrofisiologico completo include l'acquisto di attrezzature quali buone micromanipolatori, una lente binoculare, un amplificatore, una perfusione sistema e un tavolo antivibrazione, mentre anche l'acquisizione di dati e l'esecuzione di un'analisi. Un confronto dei costi tra un due-elettrodo tensione morsetto set-up contro un set-up di patch clamp rivela ulteriormente discrepanze. Inoltre, il sistema automatizzato offre il vantaggio di attrezzature completamente automatizzate e viene eseguito in automatico giorno e notte.
Le proprietà farmacologiche di un composto sono determinate dalla relativa modalità di azione sui recettori. Ad esempio, inibitori competitivi sono molecole che possono immettere la stessa associazione tasca, o ortosterici sito, come l'agonista stessa provoca un concorso. Inibitori non-competitivi sono composti che inibiscono i recettori interagendo in un altro sito e, nel caso di un canale ionico legante-gated, che possono inserire e bloccare il poro ionico, ad esempio. Andrebbe oltre lo scopo di questo lavoro per esaminare i diversi meccanismi di interazione, ma ulteriori informazioni possono essere ottenute da un libro di testo farmacologico e/o da altri lavori come Bertrand e di Bertrand22.
Nel caso di modulatori allosterici, il composto si lega a un sito che è distinto dal sito ortosterici, ma la presenza della molecola modifica la barriera energetica tra gli Stati attivi e altri. Modulatori allosterici positivi (PAMs) sono composti che riducono la barriera energetica da riposo allo stato attivo e, di conseguenza, migliorano l'effetto dell'agonista. Per caratterizzare gli effetti possibili di PAM, è, pertanto, necessario per determinare se un'esposizione al composto migliora la risposta per l'agonista e, in caso affermativo, a quale concentrazione. Gli esperimenti presentati in Figura 11 e Figura 14 illustrano protocolli che possono essere utilizzati con successo per la caratterizzazione di PAMs presso i recettori GABAA .
In alcuni casi, l'esposizione a PAM da solo potrebbe essere sufficiente per attivare i recettori. Tale attività può essere determinata da una leggera modifica del protocollo sperimentale presentato qui. Vale a dire, invece di utilizzare una co-applicazione del modulatore durante l'esposizione al GABA, il protocollo può essere modificato per l'applicazione di primo il composto da solo e quindi in presenza di GABA. Una caratterizzazione dell'attività agonista diretto avverrà tramite la determinazione dell'ampiezza della risposta evocata dal composto stesso e rispetto all'attuale GABA-evocati.
Esperimenti condotti nelle fette del cervello, come illustrato nella Figura 7, vengono utilizzati per confermare l'attività del composto a recettori nativi in un circuito inibitorio definitivo prima di andare avanti nei modelli animali e lungo il sentiero verso sperimentazioni cliniche. Il protocollo di registrazione e analisi di dati relativamente semplice permette la classifica dei più composti valutando il loro effetto modulatory differenziale sull'ampiezza di PS. Non specifici effetti di composti che non sono legati al sistema GABA possono anche essere rilevato (per esempio, quando sono osservati cambiamenti nella forma PS). Diretto, neurotrasmissione GABAergica può essere valutata in questi casi di misurare gli effetti dei composti su correnti postsinaptiche inibitorie (IPSCs) utilizzando le cellule intere patch clamp tecnica8.
Divulgazioni
Gli autori Frédéric Knoflach e Maria-Clemencia Hernandez sono dipendenti di F. Hoffmann-La Roche AG, 4070 Basilea, Svizzera, una società farmaceutica. L'autore Daniel Bertrand è un dipendente di 6 HiQScreen Sàrl, rte de Compois, 1222 Vésenaz Ginevra, fornendo servizi di screening per le aziende farmaceutiche.
Riconoscimenti
Gli autori ringraziano Judith Lengyel, Maria Karg, Grégoire Friz, Rachel Haab e Marie Claire Pflimlin da Roche e Tifany Schaer e Deborah Paolucci da HiQScreen per la loro eccellente assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| 96 well cell harvester -(Filtermate 196) | Packard | To filter membranes with bound radioligand | |
| Microtiter plate liquid scintillation counter (Top Count NXT) | Packard | Microplate Scintillation and Luminescence counter | |
| Vial liquid scintillation counter (Beta-Couter 2500 TR) | Packard | Vial Scintillation and Luminescence counter | |
| Liquid handler (Biomek 2000) | Beckman coulter | To prepare compound dilutions | |
| Vortex (Vortex Genie 2) | Scientific industries Inc. | To mix compound stock solutions | |
| Tissue homogenizer (Polytron PT1200E) | Kinematica AG | To resuspend the membrane preparations | |
| XLfit5 software | Microsoft Excel add-on by IDBS | Curve fitting software | |
| Smart Pull | UniPix | - | Electrode Puller |
| RoboInject | MultiChannel Systems | - | Automated Injection (Xenopus Oocytes) |
| HiClamp | MultiChannel Systems | - | Automated Voltage Clamp (Xenopus Ooocytes) |
| DataMining | MultiChannel Systems | - | Data Analysis Software |
| DataMerger | MultiChannel Systems | - | Data Processing Software |
| Digidata 1550 | Molecular Devices | Low noise data acquisition system | |
| CyberAmp 380 or equivalent | Axon Instruments | Programmable Signal Conditioner | |
| pClamp program suite | Molecular Devices | Software for data acquisition and analysis software | |
| Antivibraton table | TMC | To avoid microelectrode vibrations | |
| Patchstar Micromanipulators | Scientifica | To accurately position microelectrodes in brain slices | |
| Faraday Cage | Sutter Instruments | To isolate recordings from noise | |
| McIlwain Tissue Chopper | Campden Instruments LTD | To prepare brain slices | |
| Borosilicate glass micropipette | Warner Instruments | GC150TF-10 | To record extracellular potentials in brain slices |
| Twisted pair, platinum iridium wires stimulation electrode | World Precision Instruments | To stimulate the brain slices with current | |
| Stimulus generator for current and voltage driven stimulation | MultiChannel Systems | STG4000 | Delivers the current to the stimulation electrode |
| Plasticware | |||
| Microtiter plate round bottom | Corning | #3365 | Used for the binding assay |
| GF/C glassfibre filter-bottom 96-well microplate with 1.2 µm poresize, for cell harvesting assays using a vacuum manifoldwell filter | Packard | #6005174 | used for the binding assay |
| 50 mL Tubes | Falcon | #352070 | used for the binding assay |
| Safe-lock tubes 1.5 mL | Eppendorf | #0030 120086 | used for the binding assay |
| Safe-lock tubes 2 mL | Eppendorf | #0030 120094 | used for the binding assay |
| Shipping tubes 180 mL | Semadeni Europe AG | #3722 | used for the binding assay |
| Pony vial Polyethylene 6 mL | Perkin Elmer | #6013329 | used for the binding assay |
| Top Seal | Perkin Elmer | #60051859 | used for the binding assay |
| Spinner Flask | Bellco | BELLCO # 1965-00100 | Spinner Flask |
| 96 Well Plate (Conical) | Thermo Scientific Milian | 56368 | Injection plate for the oocytes |
| 96 Well Plate (Flat bottom) | Corning (Vitaris Switzerland) | 3364-cor | Compound Plate for the HiClamp |
| Glass capillary | Hilgenberg (Germany) | - | borosilicate glass 1.2 O.D. 0.76 I.D. with filament |
| RNA preparation | |||
| Ambion mMessage mMachine | Thermo Fisher Scientific | for the in vitro synthesis | |
| Chemicals | |||
| Assay buffer: KCl 5 mM; CaCl2 1.25 mM; MgCl2 1.25 mM; NaCl 120 mM; Tris 15 mM pH adjust with HCl to 7.4; store up to 3 months at 4 °C. | Used for binding assay | ||
| Washing buffer: Tris 50 mM -HCl pH 7.4; store at 4 °C. | Used for binding assay | ||
| Stock solution of test compounds 10 mM in DMSO | Used for binding assay | ||
| Flumazenil (RO0151788) 10 mM in DMSO | Used for binding assay | ||
| Diazepam 4 mM in DMSO | Used for binding assay | ||
| [3H]-Flumazenil 60-85 Ci/mmol in Ethanol; store at -20 °C | Used for binding assay | ||
| Microscint 40 | Packard | #6013641 | Used for binding assay |
| Ultima Gold | Perkin Elmer | #6013329 | Used for binding assay |
| MS-222 | Sigma | Sigma # A5040 | MS-222 |
| AB/AM | Sigma | Sigma # A5955 | antibiotics / antimycotics |
| Collagenase | Sigma | Sigma # C1030 | Collagenase Type I |
| Rnase | Sigma | Sigma # R2020-250 mL | RNaseZAP |
| EndoFree Plasmid maxi Kit | Qiagen | Qiagen # 12362 | |
| Salts for artificial cerebrospinal fluid (NaCl, KCl, etc.) | Sigma | ||
| Membranes | |||
| Frozen membrane preparations from transient or stably transfected HEK293 overexpressing different human GABAA receptor subtypes: α1β3γ2, α2β3γ2, α3β3γ2, α5β3γ2. See Ballard et al. 2009 for detailed methods. | Used for binding assay |
Riferimenti
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nature Reviews Drug Discovery. 10, 685-697 (2011).
- Sieghart, W. Structure and pharmacology of g-aminobutyric acidA receptor subtypes. Pharmacological Reviews. 47, 181-234 (1995).
- Liu, J., et al. A high-throughput functional assay for characterization of g-aminobutyric acidA channel modulators using cryopreserved transiently transfected cells. ASSAY and Drug Development Technologies. 6, 781-786 (2008).
- Mennerick, S., et al. Diverse voltage-sensitive dyes modulate GABAA receptor function. Journal of Neuroscience. 30, 2871-2879 (2010).
- Hevers, W., Luddens, H. The diversity of GABAA receptors. Pharmacological and electrophysiological properties of GABAA channel subtypes. Molecular Neurobiology. 18, 35-86 (1998).
- Macdonald, R. L., Olsen, R. W. GABAA receptor channels. Annual Review of Neuroscience. 17, 569-602 (1994).
- Kemp, J. A., Marshall, G. R., Wong, E. H., Woodruff, G. N. The affinities, potencies and efficacies of some benzodiazepine-receptor agonists, antagonists and inverse-agonists at rat hippocampal GABAA-receptors. British Journal of Pharmacology. 91, 601-608 (1987).
- Prenosil, G. A., et al. Specific subtypes of GABAA receptors mediate phasic and tonic forms of inhibition in hippocampal pyramidal neurons. Journal of Neurophysiology. 96, 846-857 (2006).
- Ballard, T. M., et al. RO4938581, a novel cognitive enhancer acting at GABAA a5 subunit-containing receptors. Psychopharmacology. 202, 207-223 (2009).
- Knoflach, F., Hernandez, M. C., Bertrand, D. GABAA receptor-mediated neurotransmission: Not so simple after all. Biochemical Pharmacology. 115, 10-17 (2016).
- Gielen, M. C., Lumb, M. J., Smart, T. G. Benzodiazepines modulate GABAA receptors by regulating the preactivation step after GABA binding. Journal of Neuroscience. 32, 5707-5715 (2012).
- Bergmann, R., Kongsbak, K., Sorensen, P. L., Sander, T., Balle, T. A unified model of the GABAA receptor comprising agonist and benzodiazepine binding sites. PLoS One. 8, 52323 (2013).
- Richter, L., et al. Diazepam-bound GABAA receptor models identify new benzodiazepine binding-site ligands. Nature Chemical Biology. 8, 455-464 (2012).
- Rudolph, U., Crestani, F., Mohler, H. GABAA receptor subtypes: dissecting their pharmacological functions. Trends in Pharmacological Sciences. 22, 188-194 (2001).
- Wisden, W., Seeburg, P. H. GABAA receptor channels: from subunits to functional entities. Current Opinion in Neurobiology. 2, 263-269 (1992).
- Davies, C. H., Davies, S. N., Collingridge, G. L. Paired-pulse depression of monosynaptic GABA-mediated inhibitory postsynaptic responses in rat hippocampus. The Journal of Physiology. 424, 513-531 (1990).
- Karnup, S., Stelzer, A. Temporal overlap of excitatory and inhibitory afferent input in guinea-pig CA1 pyramidal cells. The Journal of Physiology. 516, 485-504 (1999).
- Turner, D. A. Feed-forward inhibitory potentials and excitatory interactions in guinea-pig hippocampal pyramidal cells. The Journal of Physiology. 422, 333-350 (1990).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. 391, 85-100 (1981).
- Adelsberger, H., Brunswieck, S., Dudel, J. Block by picrotoxin of a GABAergic chloride channel expressed on crayfish muscle after axotomy. European Journal of Neuroscience. 10, 179-187 (1998).
- Hapfelmeier, G., et al. Isoflurane slows inactivation kinetics of rat recombinant a1b2g2L GABAA receptors: enhancement of GABAergic transmission despite an open-channel block. Neuroscience Letters. 307, 97-100 (2001).
- Bertrand, S., Bertrand, D. Overview of electrophysiological characterization of neuronal nicotinic acetylcholine receptors. Current Protocols in Pharmacology. , 17 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon