Method Article
Γ-アミノ酪酸受容体をモジュレート新規化合物の探索の方法を入力、神経伝達
要約
ここでは、生理・薬理のバインドからの GABAAの受容器のアクティブな化合物を発見するためのプロトコルを提案する.
要約
この原稿では、ガンマ-アミノ酪で化合物のスクリーニングのためのステップバイ ステップのプロトコル酸型 (GABAA) 受容体とその体外遺伝子組換えから前臨床アッセイでアクティブな新規分子の同定への試み受容体齧歯動物脳スライスにおけるネイティブ受容体の薬理学的影響。最初のステップは、化合物が受容体のベンゾジアゼピン系サイトのバインド、GABAAの主要なサブタイプを表現する細胞膜上の放射性リガンド結合アッセイの開発で構成されるプライマリ画面を設定するに。その後、HEK 293 細胞やアフリカツメガエル卵母細胞における齧歯動物および人間 GABAAの受容体の異種表現を活かし、異なる受容体の生理学的性質を電気生理学的アッセイに探索することが可能です。サブタイプと同定された化合物の薬理学的特性。アフリカツメガエル卵母細胞システムは卵母細胞、2 電極電圧クランプを用いた薬理学的解析までの異なる Mrna と彼らのマイクロインジェクションの分離から始まるここでは、表示されます。最後に、明確に定義された神経回路ネイティブ受容体分子の活動を評価するためにセカンダリの生理学的なテストとして使用される齧歯動物の脳のスライスで行われた録音を説明します。人口に対する複数のニューロン細胞外記録は、薬物のアプリケーションと共に示されています。
概要
ここでは、生理学や薬理学へのバインドから GABAAの受容器のアクティブな化合物の検出のためのプロトコルを提案します。新規分子 GABAAの受容器の特定の検索では、定義することが重要、できるだけ正確に、関心と新たに同定された化合物の特異性の評価のサブタイプ (例えばレビューのルドルフを見るとKnoflach1または Sieghart2)。創薬の実現に必要な手順の一般的なパスは、図 1で示されます。
結合の試金はされているし、まだほとんど創薬における最初のステップとして使用されます。GABAAの受容器の場合に、治療上有用で安全な薬が結合受容体のベンゾジアゼピン結合部位に結合する化合物を同定に最適化されています。蛍光イメージング プレート リーダー (FLIPR) 膜潜在的な赤い色素に基づく試金3を使用して他の技術は、不要な副作用のプロフィールのためにより少なく好ましいが他のサイトに結合するバルビツール酸のような化合物を検出します。さらに、使用染料は直接 GABAAの受容器、従って薬物発見4のこれらのアッセイの有用性を疑問をアクティブ化できます。結合アッセイのみ与えられた化合物が特定の受容体クラスにバインドできるという証拠を提供できます。培養細胞膜の試金を使用して人間の選択の GABAA α5β3γ2 受容体リガンドを識別します。一時的に transfected HEK293 細胞人間の GABA、 α5β3γ2、α1β3γ2、α2β3γ2、α3β3γ2 受容体は、これらの試金のための膜を準備する使用されます。リガンドの効果は、膜受容体 ([3H] フルマゼニル結合阻害) するバインド [3H] フルマゼニルのシンチレーションを測定することによって検出されます。この手法の主な利点は、関心の受容体に結合化合物の迅速かつ効率的な測定が関心の受容体に用意されていることです。
化合物の機能的活動を評価し、受容体に化合物の結合によって引き起こされる機構の生理学的および薬理学的説明を提案する機能の研究が欠かせない。今日、イオン間隙と 5 つの同一サブユニットのアセンブリから結果によって形成される pseudosymmetry の軸線のまわりの 5 つのサブユニットのアセンブリに起因機能 GABAAの受容器は良く知られています。GABAAの受容器のほとんどは、2 つ以上の異なるサブユニットで構成されます。主要な脳のGABA 受容体、例えば、される α 1、β 2、γ2 2、2、および 1 の化学量論のサブユニットのそれぞれ5,6。アフリカツメガエル卵母細胞 HEK293 細胞などのホスト システムの再構築では、急速に受容体の薬理学的特性を探索の可能性を提供しています。
化合物の薬理学的特性は、脳スライス7で細胞外記録で検討されます。このメソッドにより、神経伝達に及ぼす化合物の探査と全体のネイティブ受容体のレベルでの異種発現システムで決定された化合物の機能の効果を確認する効果的な方法を提供します神経細胞の環境。Gaba 作動性神経伝達は、抑制性シナプス電流 (Ips)8化合物の効果を測定することにより分子レベルで評価できます。しかし、ここで使用され、脳スライスにおける全細胞パッチ クランプ録音に基づいてプロトコルはより精巧な低いスループットが得られます。
最後に、長所と短所の in vitroスクリーニング カスケード α5β3γ2 選択的リガンド識別に使用されるは、さまざまなテクニックと本質的な制限の観点から説明します。この作品は、専門家と非専門家がこれらのリガンド依存性イオン チャネルの新しい変調器の発見に取り組むために使用される別の in vitroアプローチの組み合わせの参考になったレビュー GABAAの受容器の分野で提供しなければなりません。
プロトコル
アフリカツメガエルは建物、ジュネーブのカントン動物ガイドラインに従って処理されます。
1. 放射性リガンド結合
-
アッセイ プレートの準備
- 5 mM KCl、1.25 mM CaCl21.25 mM MgCl2, 120 mM, NaCl と 15 mM; トリス アッセイバッファーの 1.5 L を準備します。7.4 に塩酸で pH を調整します。
- (例えば、5 μ L の微量遠心チューブで 980 μ L アッセイバッファーに 10 ミリメートルで化合物) 50.76 μ M でテストする化合物を準備します。まあ 2-5 s の高速で渦マシンを使用してそれらをミックスします。
- アッセイバッファー 1,970 μ に化合物 (10 mM) の 1 μ L 分注参照化合物フルマゼニルの前希釈を準備します。まあ 2-5 s の高速で渦マシンを使用してそれらをミックスします。
- 4 に 4 ° c アッセイバッファーで [3H] フルマゼニル原液を希釈 50 mL ポリプロピレン チューブに nM。
- ピペット 50 μ L/ウェル アッセイバッファー列 1 と 3-11 96 ウェル マイクロ プレートの図 2で表されるプレート レイアウトのように。
- 50.76 μ M で希釈した化合物の 73.2 μ L をピペット (手順 1.1.2 参照) プレートの 12 列に。
- 9 ステップの上の幾何学的な進行を使用してそれぞれの化合物を希釈 (1E-10 -1E-06 M), 23.12 μ L のデータ転送量と塗りつぶし列 3-11。希釈を徹底的にミックスします。すべて希釈後、ヒントを変更します。
-
細胞膜を希釈します。
- 以前 HEK293 過剰人間 GABAの受容から分離された細胞膜を融解 (0.025-0.15 mg/mL) 常温 (RT) 80 mL を取得して懸濁液を 4 ° C でアッセイバッファーに移転
- 10,000-12,000 rpm で 30-40 s の組織ホモジナイザーを用いた膜液を 4 ° C でまだ再懸濁します。
-
非特異的結合 (NSB) コントロールの希薄ジアゼパム
- 5 mL で 40 μ M の濃度にアッセイバッファーで 4 mM ジアゼパム原液を希釈します。
-
反応を開始します。
- 96 ウェル プレートの各ウェルに 4 nM [3H] フルマゼニルの 50 μ L をピペットし、氷の水容器で保ちます。
- 0.5 mg/mL のタンパク質濃度を持っている GABAAの受容体サブタイプ膜準備の 100 μ L を追加します。
- 2 列に 40 μ M のジアゼパムの 50 μ L をピペットします。
- 氷の上に 1 時間プレートを孵化させなさい。
- 後膜分離と放射能測定のための 96 ウェル フィルター プレートの各ウェルにアッセイバッファーの 50 μ L を追加し、その後の反応を停止します。
-
反応を停止します。
- 50 mM トリス-HCl、pH 7.4 に洗浄バッファーを準備します。
- 96 ウェルの細胞収穫を使用して、ソリューションをフィルター処理します。3、洗浄 300 μ L/ウェル冷たい洗浄液の x。
- プラスチック フィルムとプレートの底をシールし、シンチレーション液体のカクテルの 40 μ L を追加各シンチレーションも、70% エタノールで拭いてください。
- 室温 1 時間少なくともプレートを軽く振る少なくとも別の時間室温放置します。
- シンチレーション カウンターに皿を置くことによって (CPM) の放射能を測定します。ウェルあたり 3 分の測定を許可します。
-
データ分析
- 8 の意味を非特異的結合 (NSB) と合計のバインド (TB) も重複またはサンプルのトリプリケートのレプリケートを確認します。次の式に従って各サンプルの平均 % 特定のバインド (SB) を計算します。
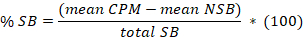
ここは
合計 SB NSB を意味マイナス平均 TB を =。 - 横座標 %sb対座標での阻害剤の濃度をプロットします。単一サイトの競争分析数式を使用してデータをフィットします。

ここは
y = sb、%
A = yの最小値
B = yの最大値
C = IC50、
X = 競合する化合物の濃度のログ10
D = (ヒル係数) 曲線の傾き。 - 半最大阻害濃度 (IC50) を使用して結合親和性 (Ki) を計算 [3H] の濃度とそれぞれの膜9の [3H] フルマゼニルの解離定数 (Kd)次のデータを使用して同等化に従ってアッセイのフルマゼニル:
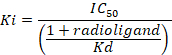
- 8 の意味を非特異的結合 (NSB) と合計のバインド (TB) も重複またはサンプルのトリプリケートのレプリケートを確認します。次の式に従って各サンプルの平均 % 特定のバインド (SB) を計算します。
2 受容体の発現とアフリカツメガエル卵母細胞での録音
- 収穫の卵巣と卵の準備
- 88 mM の NaCl、KCl 1 mM、2.4 mM NaHCO3、10 mM HEPES、0.82 mM MgSO4.7H2O、0.33 mM Ca (3)2.4H2O、0.41 mM CaCl2.6H2O、pH 7.4 でと滅菌バルト ソリューションを準備します。、0.25 μ g/mL アムホテリシン b の 100 μ g/mL ストレプトマイシン、ペニシリンの 100 単位/ml を添加しました。
- 88.5 mM NaCl、KCl 2.5 mM、5 mM HEPES、1 ミリメートル MgCl2.6H2O、pH 7.4 で x OR2 1 (CaCl2) 培地を準備します。
- アフリカツメガエルの冷却 (pH 7.4 に調整 150 mg/L の濃度) でトリカインメタネスルフォネイトと炭酸水素ナトリウム (300 mg/L) で 20 分間の深麻酔によって女性に続いて斬首の犠牲。
- きれいなハサミ、鉗子で急激に卵巣を収穫し、40 ml バルト ソリューションと抗生物質/抗真菌薬 x 1 の 2 ペトリ皿 (10 cm) でそれらを置きます。
- 4 ° C でバルト ソリューション内に最大 2 週間の非解離卵巣を格納します。
- 解離、小さな分数 (1-2 cm3) できれいなかみそりの刃で卵巣をカットし、CaCl2 (OR2 noCaCl2) なし OR2 媒体の 50 mL で 0.2% コラゲナーゼを含んでいるそれらを孵化させなさい (I 型) 100 mL スピナーで 17-19 ° c4-5 磁気棒は確認のため低速撹拌フラスコでは、卵母細胞を粉砕避けるためにスピナー フラスコの下に上記の約 3-5 cm に配置されます。
- 4-5 時間後、卵胞から卵母細胞のほとんどが開放されていることを確認 (すなわちのまわりで泳ぐ個別に)。洗って OR2 1.8 mm CaCl2補足の 200 mL の 5 倍。
- ペトリ皿 (10 cm) に卵いっぱいバルト ソリューションと抗生物質/抗と cDNA または mRNA の注入前に 17 ° C で一晩、少なくともそれらを維持 defolliculated を転送します。
- 次の日は、双眼鏡、健康卵植物極 (植物極の淡黄色対動物極の暗いブラウン)、はっきりと明確な動物対提示することで、選択。きれいなパスツール ピペットを使用し、滅菌円錐形 96 インジェクションのウェル プレートに 1 つずつ卵を処分します。
注: 特別なケアは必要ありません; mRNA 注射用の卵子の配置の一方、cDNA 注射用じゃはない上向き動物極と卵母細胞の向きに必要不可欠であります。
- mRNA または cDNA の自動注入
- 次の推奨手順市販のキットを使用して Mrna を合成します。楽器と RNase とテーブルをきれいにし、適切な保護手袋を着用します。
注: mRNA の品質は良い式をもたらすための決定要因と射出中の mRNA 分解を防ぐために不可欠です。 - 市販のキットを使用して Cdna を準備し、0.2 μ g/μ L の濃度で bidistilled 水に希望の金額を解散します。
- CDNA 液 0.02-0.2 に至る濃度での 0.2 μ g/μ L、または 10 nL の濃度で mRNA ソリューションの 10-50 nL を注入できれば 95 卵母細胞のバッチで、μ g/μ L。
- 膜蛋白質 (すなわち、テキサスサンゴヘビ α1β2γ2 GABAAの受容器)、複数のサブユニットが必要なミックス対応する Mrna または任意の比率で Cdna (すなわち1:1:1 または 1時 10分: 1)。
- 卵母細胞の熱ショック蛋白質の発現を防ぐために 17 ° C で卵母細胞を保つマイクロ プレートを熱制御ストレージ領域に格納します。
- 0.1-1000 で OR2 の結合の試金に陽性を示した試験化合物を溶かす電気生理学的記録の μ M 96 ウェル平底ポリプロピレン板にそれらを処分し、。
- 次の推奨手順市販のキットを使用して Mrna を合成します。楽器と RNase とテーブルをきれいにし、適切な保護手袋を着用します。
- 式のプラスミド
- 細菌の T7 または T6 の休眠打破による mRNA 合成のための市販キットの取扱説明書に従ってください、ソリューションの 20 μ L で 0.2 μ g/μ L RNase 自由な水にします。
- 通常は 0.2 μ g/μ L bidistilled 水に溶解し、cDNA 表現の真核生物発現ベクターを含むソリューションの少なくとも 20 μ L を準備します。
- マイクロインジェクション卵子とその品質の可視化
- 10-50 nL プラスミド溶液を注入 (2.3.1 又は 2.3.2 手順参照) 圧力放出システムまたは自動注入システム設置しておりますマイクロマニピュレーターにマウントされているガラス マイクロ注射針を用いた先端径最大 100 μ m に至るまで。
注: ここで説明した例では、卵母細胞は自動システムにより cDNA または mRNA の使用に適した 95 のバッチによって挿入されます。 - 1% メチレン ブルーなどの色素の 1 μ L で注射針を入力し、(または cDNA の核または mRNA の細胞質で) 標準的な手順を使用して卵を注入します。
- 沸騰したお湯で約 1 分の注入された卵を破棄します。卵母細胞を双眼鏡でかみそりの刃で半分にカットします。
注: 染料の図 3E射出の正確な観察のようにローカライズされたまま。
- 10-50 nL プラスミド溶液を注入 (2.3.1 又は 2.3.2 手順参照) 圧力放出システムまたは自動注入システム設置しておりますマイクロマニピュレーターにマウントされているガラス マイクロ注射針を用いた先端径最大 100 μ m に至るまで。
- 2 電極電圧クランプ録音
- 図 4に示す原則を使用して自動システムで卵母細胞を含むウェル プレートを配置します。
注:図5 パッチ クランプ システムと対照をなして、セルの真の膜電位は、電圧電極によって読み取られます。 - 集中活動関係の決定のための図 6に示す方式などでアイコン ベースのインターフェイスを使用して自動録音システムをプログラムします。
- 図 4に示す原則を使用して自動システムで卵母細胞を含むウェル プレートを配置します。
- 曲線のあてはめ
- 図解濃度活性化曲線を使用して、適切なソフトウェアを使用して結果を分析、現在の振幅をアゴニスト濃度の対数の関数としてプロットします。
- 形で経験的なヒルの式とその後に合うことができる s 字型のカーブを観察します。
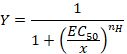
ここは
Y= 誘発電流の割合
EC50 = 50% の活性化のため濃度
x = 化合物の濃度
nH = ヒル係数または明白な協同性。 - 各応答に対する一連のセルから得られたデータを分析する最も高い濃度で記録された値の振幅を割って統一へ電流を正常化します。
- 平均と標準誤差を決定し、標準利用可能なソフトウェアを使用してカーブ フィットを実現します。
3. 脳スライスの記録
注: ラット海馬スライスは、国および教育機関の指針に則って準備されました。
-
海馬スライスの準備
- 124 mM NaCl 124、2.5 mM KCl、1.25 mM KH2PO4O2MgSO4.7H 2 mM、2.5 mM CaCl2 2 H2O、26 mM NaHCO3、10 mM グルコース 4 mM と郭清人工脳脊髄液 (dACSF) を準備します。庶糖 95% O2と 5% CO2の混合物をボトルに毒ガスします。
- 124 mM の NaCl、5 mM KCl、1.25 mM KH2PO4O2MgSO4.7H 2 mM、2.5 mM CaCl2 2 H2O、25 mM NaHCO3、10 mM グルコースと記録人工脳脊髄液 (rACSF) を準備します。95% O2と 5% CO2の混合物をボトルで毒ガスで死亡。
- 2.5% イソフルランと純酸素の混合物を用いたラットを麻酔し、それらの首をはねます。
- はさみの罰金ペアで正中線に続く頭皮をカットします。基になる組織を損傷することがなく正中線に沿って頭蓋骨をカットします。ピンセットで頭蓋骨を外し脳をえぐり細かいヘラを使用します。
- 脳が RT で包まれた dACSF ソリューション、そして高級ヘラで左の海馬を解剖します。
- 組織チョッパーと海馬の中の部分から横スライス (400 μ m 厚) をカットし、ペイント ブラシを使って記録室に転送します。45 分の RT でスライスを保持します。
- 35 ° C で包まれた rACSF とスライスを灌流し、1.5 mL/分の速度でバブル 95% O2と 5% CO2の混合物ソリューション。
注: この手順の後、スライス、電気生理学的実験のための準備ができています。
-
単一の母集団のスパイクの記録
- 顕微鏡に取り付けられた室に脳のスライスを配置します。
- RACSF 3 mL/分の割合でスライスを灌流します。
- 〜 2 MΩ の抵抗を持つピペット引き手とホウケイ酸ガラス ピペットを引き出します。
注: このマイクロ ピペットは記録電極として使用され、電気アンプに接続されています。 - 2 M の NaCl を含む溶液をマイクロ ピペットを埋めるし、アンプのピペット ホルダーに入れます。
- 右マニピュレーターを使用して海馬の ca1 における地層属三角骨に記録マイクロ ピペットを配置します。
注: 場所は図 7で潰した。 - 左のマイクロマニピュレーターのホルダーに絶縁バイポーラ プラチナ/イリジウム電極を配置します。
注: この電極は刺激電極として使用され、電気的刺激発生器に接続されています。 - 右のマニピュレーターを用いた海馬スライスの ca1 でシャファー担保に刺激電極を配置します。
注: 場所は図 7で潰した。 - すべて 30 刺激発生器を用いた刺激電極に電流パルスを配信 s (100 μ 秒の期間、10 μ A で始まる) 人口の急増 (PS) が表示されるまで徐々 に刺激強度を増加。
- 45% 得ることができる最大の振幅に対応する PS を喚起する刺激の強さを調整します。PSs は 2.4 KHz でフィルターされ、信号増幅器を用いた 20 KHz でデジタル化します。
-
ペアパルス抑制
- 脳スライス (ステップ 3.1) を準備し、前述のように進む (ステップ 3.2.1–3.2.7)。
- すべて 30 刺激電極に 2 つの電流パルス (20 ms 間隔で 100 μ 秒の期間) を配信 s 刺激発生器を使用して。最大振幅の 45% に対応する PS を喚起する刺激強度を設定します。
-
化合物のテスト
- 熟れたアプライドでテストされる化合物の希釈液を作るので、最終濃度 DMSO 0.1% より高くないです。
- 複合ソリューションよりも同じ濃度で制御ソリューションに DMSO を追加します。
- シングル (ステップ 3.2) を記録またはすべて 30 シャファー担保刺激により誘発される対パルス (ステップ 3.3) PS、少なくとも 30 分のための s。PS 形は、この基準期間中に安定する必要があります。
- 酔った rACSF 固定テストする化合物濃度とビーカーを準備します。
- シングルまたはペア パルス PS を記録しながらこのソリューションで海馬スライスを灌流します。
- 酔った rACSF 化合物なしでスライスを灌によって化合物の影響からの回復を評価します。
注: リバーシブルの効果のため、PS は複合アプリケーションの前に基準期間中に観察された初期形に戻ります。
-
データ分析
- 平均 PS トレース データ解析ソフトウェアを使用して 4 ブロックで実験中に記録されます。
- 平均のトレースの PS 変換波の振幅を測定します。
- 化合物を灌前に 10 分を記録された基準計画の値の割合として振幅を正規化します。
- ± SEM. を意味データを表現します。
結果
バインディング:
細胞膜との in vitroアッセイを使用して、選択的人間 GABAA α5β3γ2 受容体リガンド、γ2 の BZD アロステリック サイト受容体を含むバインドを識別します。一時的に transfected HEK293 細胞人間の GABA、 α5β3γ2、α1β3γ2、α2β3γ2、α3β3γ2 受容体は、この試金のための膜を準備する使用されます。潜在的な配位子の影響は、膜受容体 ([3H] フルマゼニル結合阻害) するバインド [3H] フルマゼニルのシンチレーションを測定することによって検出されます。RO4938581 の例のように特定の GABAAの受容体の化合物の選択性を評価するために変位結合曲線が生成されます (図 8)。図 9は、いくつかの参照化合物の α 5 選択的 GABAA受容体陰性アロステリック変調器、RO49385819のそれを含む結合の試金を使用して生成されたプロファイルをまとめたものです。
録音アフリカツメガエル卵母細胞:
Α5β3γ2 heteromer など GABAAの受容体の発現には GABA 露出に対して堅牢な電流が得られます。簡単な GABA パルスに対して人間の α5β3γ2 を表現する卵母細胞で得られた典型的な電圧クランプ録音 (30 秒)図 6に示すように、最大 300 μ M に至るまで。この実験では、96 ウェル プレートで処分された GABA 濃度の異なる、特定の井戸にセルを移動することによって、応答を誘発しました。GABA は、中央の灌流チェンバにセルを返すと対応する蠕動性ポンプを活性化して血流制御ソリューションを適用することによって徹底的に洗われました。濃度活性化曲線の測定に使用されるプログラムのシーケンスを図 6に示します。完全に自動的に行われて、これらのデータを示してアフリカツメガエル卵母細胞で得られる録音の両方の品質と受容体の発現の高レベル取得 mRNA 注射後数日。異なる受容器の組み合わせで実験は、GABA 受容体の半分をアクティブに必要な濃度である EC50s のシリーズを生成します。スパイダー グラフ上の EC50値のプロット図 10で示すようサブユニット組成の影響と受容体プロパティの迅速な比較を提供します。
(ナムまたは PAM) 正または負アロステリック変調の効果を検討するためアゴニスト (GABA) テスト パルス最初コントロールし、変調器の存在により誘発される応答を比較する必要は。このような実験を実施する効率的な実験的プロトコルを図 11に示します。参照濃度の GABA への細胞の応答は最初に決定され、同じ GABA 濃度を適用し、GABA プラス変調器の共同アプリケーションによってシーケンスが繰り返されます。2 つの重畳応答のプロットは、この例では変調器の存在によって引き起こされる著しい阻害を明かします。変調効果の定量化を用いて容易に計算コントロールと変調器の存在下で誘発される応答の比と熱プロットの形で結果をプロットできます。図 12に示すデータは、96 化合物を取得した 3 つのデータ セットの録音に対応する熱プロットを示しています。
次の十分にアクティブな化合物の同定、しばしばこれらの分子は他の受容体の組み合わせでアクティブである場合を評価するために不可欠であるないです。ギャバA受容体の場合異なるサブユニットの 19 遺伝子が同定されているし、機能的受容体可能性がある (の Knoflach ・ ヘルナンデス、バートランドの10を参照してください異なるサブユニットのポリコームタンパク アセンブリから知られています。レビュー)。複数のサブユニットとの組み合わせの収量受容体の膨大なレパートリーは、サブタイプが実行されるカウンター スクリーニングの多数を必要とする可能性があります、それはしばしばピント合わせする最初の最も豊富なサブタイプでの GABAA の場合受容体、α1β2γ2 の組成物であります。式を頭に頭を行った実験、たとえば、α5β3γ2 卵母細胞の同じバッチの α1β2γ2 生成任意の分子のそれぞれの効果の良い比較です。Α5β3γ2 と α1β2γ2 の 3 つのセルの典型的な結果は、図 13α5β3γ2 で 1 つの分子の優遇の正の調節を示すに表示されます。
図 11に示す実験的プロトコルは、PAM 活動の評価に適しています。このプロトコルでテストされる化合物は徐々 に濃度の増加でアゴニストを共同適用です。同じセルで複数のアプリケーションによる累積的な影響を避けるためには、各データ ポイントの新しい、素朴なセルを測定します。応答の振幅の測定はアゴニスト単独で記録し、アプリケーションの化合物中に PAM または南の効果を定量化する比率が生成されます。Α1β2γ2 とジアゼパムの α5β3γ2 で得られた典型的な結果は、明らかにこの受容体結合の約 10 倍高い α5β3γ2 の明白な感度図 14のとおりです。これらの値は、パブリッシュされたデータ11と良い相関。ベンゾジアゼピン系サイト、γ2 とその隣接する α サブユニット12-14間のインターフェイスによって構成されていると考えられて、α5β3γ2 の感度 γ2 α 1 に γ2 α 5 優遇ジアゼパムの親和性を示唆しています。効率的な機能解析と組み合わせる異なる受容体の組み合わせを表現する可能性は、PAM プロパティとその生理学的および薬理学的効果の決定要因を探検する複数の方法を開きます。
海馬脳スライス:
ラット脳海馬スライスの実験はネイティブ受容体モデルの生体外の試金で同定された化合物の薬理学的プロファイルを検証します。海馬の錐体細胞で発現優勢な GABAAの受容体サブタイプがベンゾジアゼピン (代表)15変調 α1β2/3γ2、α2β2/3γ2、α5β2/3γ2。ペアパルス抑制は、20 ms 間隔を配信 2 対電気刺激の 2 番目の反応の変更をテストすることによって海馬神経回路の興奮性を明らかにすることができますパラダイムです。2 番目の反応の変化は、錐体細胞層16-18を支配する介在ニューロンによって gaba 作動性のフィードバックによるものです。制御では、図 7に示すように、2 つの対になった刺激の 2 番目の応答、gaba 作動性抑制抑制されます。Β CCM でスライスを灌によりこの抑制が減少、非選択的南、2 つの対になった刺激の 2 番目の応答は、はるかに低い程度に抑制されます。この実験パラダイムは α 5 サブユニットを含む GABAAの受容体の選択的な化合物に敏感です。
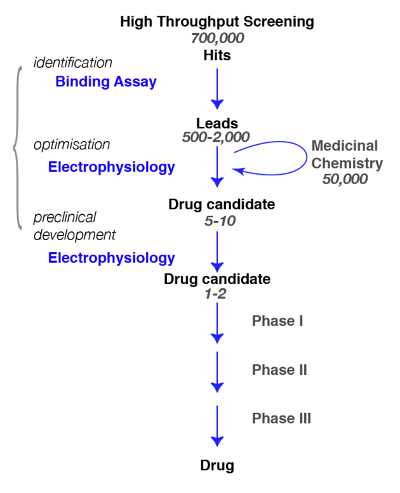
図 1: スクリーニング戦略。典型的な薬剤のスクリーニングの経路は化合物の大規模なライブラリが特定のターゲットの選別、高スループット スクリーニングを開始します。次のリード候補の同定、薬効がある化学の仕事を開始します。このフェーズでは、化学者が研究や分子を絞り込むターゲット選択性、脳浸透度、安定性、この重要な段階で、劣化などなど、必要な条件を満たすために構造変更を実行することによってそれが欠かせません化学修飾した分子プロパティを変更していないかどうかを評価し、最高の候補者を絞り込みます。次のステップは、識別するためにカルシウム蛍光を含む他の方法が機能試金、化合物および安全、許容範囲は、次のステップにそれらをもたらすいくつかの有望な等メモその電気生理学が示されます試金または電圧敏感な染料は、代替手段として使用できます。これら後者のメソッドは、結合の試金のための代用として高スループット試金を使用します。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 96 ウェルのレイアウト メッキ実験をバインドするために利用します。1 列は、合計結合測定と非特異的結合測定のため 2 列に使用されます。行 A-H は重複の各化合物の濃度 (3-12 の列) の増加で 4 さまざまな化合物で満ちている (すなわち、化合物 1 行 A と E、化合物 2 B および F の行など) 異なる色とレイアウトで表されます。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 自動システムを用いたマイクロインジェクション。(A) A 高精度 XYZ システム、卵母細胞に、関心のプラスミッドを含んでいる液体で満たされたガラス注射針でつついては自動的に。(B) このパネルは、卵母細胞 (C) で自動的に注入される 96 ウェル円錐形の底板を示しています。(D) このパネルは、インジェクションの原理を示しています。原子力の注入の針は、パネルBに示すように、卵母細胞、核よりも少し深くを浸透します。核から針を撤回する、(パネルCを参照)、注入前に (パネルDを参照)。(E) 注入針の品質を評価するために満たすことができる染料と「調理」の卵は半分にカットすることができます。この図の拡大版を表示するのにはここをクリックしてください。
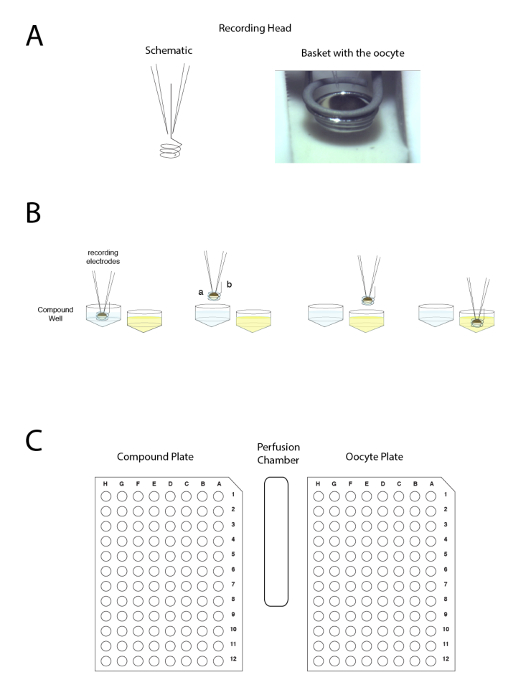
図 4: 自動の 2 つの電圧クランプ電極原理。原則は、灌流液を適用するのではなく、井戸の間準備を移動に基づいています。(A) パネルの左側にある 2 つの電極と 1 つのサンプルからの移動中に準備のまわりの液滴を維持する小さなバスケットアフリカツメガエル卵母細胞における記録をできるように配置を表します別のです。2 つの電極をバスケットに入れた卵の画像が右側に表示されます。(B) このパネルは、原理を記録「逆さま」生理学の概略図を示しています。(C) このパネルは、記録テーブルの卵、複合板、手洗い所の処分を示しています。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 2 電極電圧クランプ対パッチク ランプ記録します。典型的な 2 電極電圧クランプ卵母細胞 (左側のパネル) の記録は、細胞株 (右側のパネル) 用パッチ クランプ構成と比較されます。対直径で約 1 mm 約 20 μ m の細胞である卵のサイズの違いに注意してください。2 電極電圧クランプで卵母細胞の膜電位が必要な保持電圧と比較し、信号差が注入される電流の電極。パッチ ・ クランプ記録のパッチ クランプ電極の抵抗は無視できると膜抵抗と、したがって、電圧がアンプによって課されたことは忠実に供給細胞膜19に見做されます。画像は、シータ チューブ () の 2 つのチャンネルが、一方で、制御ソリューションと、その一方で、薬20,21を含むソリューションに満ちている液体フィラメント灌流を示しています。この図の拡大版を表示するのにはここをクリックしてください。
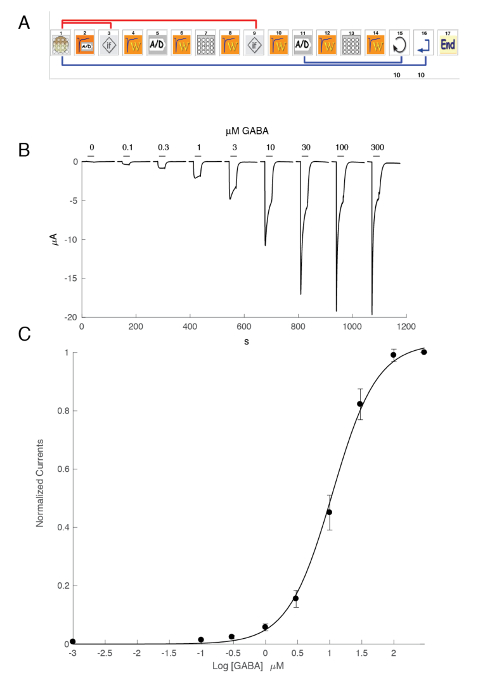
図 6: 人間 α5β3γ2 受容体濃度活性化関係。(A) シーケンス制御自動化されたシステム アイコンのシリーズで構成され、濃度活性化関係の定量実験のプロトコルを設定します。1-3 の手順では、システムはこのパネルで示すように、測定のバスケットにプレートから卵母細胞を読み込みます。手順 2 で漏れ電流を測定し、この値が目的の基準を超えた場合、セルが自動的に変更 (ステップ 3)。安定化期間 (ステップ 4)、参照 GABA 濃度に卵母細胞応答は測定 (手順 5 ~ 8)。1 μ A を超える電流を表示する卵子はそれに続く測定のため保持されます。手順 11-13 で GABAAの異なる濃度でセルに挑戦し、希望の数濃度 (手順 14) のためのそれ自身と (手順 15) の細胞プロセスが繰り返されます。(B) このパネルは一連の簡単な GABA アプリケーションにより誘発される典型的な流れを示しています (30 s) 成長の順序で適用されます。複合アプリケーションのタイミングは、バーで示されます。(C) A プロット GABA 濃度の対数の関数としてピークの内向きの流れの生成濃度活性化曲線が連続した曲線、約 11 μ M で EC50と丘の経験的なヒルの式によって容易に装備されて1.3 の係数。8 セルに記録された電流は、最大の誘発反応の団結を正規化されました。バーは、平均値の標準誤差を示します。この図の拡大版を表示するのにはここをクリックしてください。
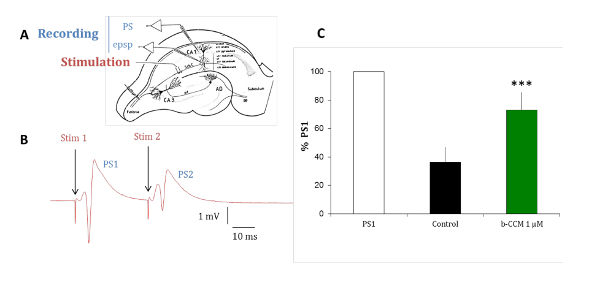
図 7: Β-CCM、GABAAナム削減海馬スライスにおけるペアパルス抑制します。(A) このパネルはラット海馬スライスの概略を示しています。CA1 錐体細胞の樹状突起の楔形の CA3 錐体細胞の軸索プロジェクトから発信されたシャファーの担保 (Sch C)。マイクロ ピペットは、地層属三角骨 (str 属三角骨) 人口スパイク (PS) を記録するため、興奮性シナプス後電位 (epsp) の樹状の録音の層結腸寄生虫 (str 結腸寄生虫) に置かれました。刺激電極は、シャファー側枝内に置かれました。(B) このパネルは 20 ms 間隔で同じ刺激電極を使用して適用対音刺激に対する誘発 PSs を示しています。2 番目の刺激 (PS2) に人口応答 (PS1) の最初の刺激への応答よりも小さな振幅のです。(C) PSs は不在 (黒いバー) と β-CCM、非選択的ギャバA受容体ナム (緑色のバー) の存在で記録されました。Β CCM は、任意のフィード フォワードの gaba を部分的にブロックすることによって 2 番目の PS2 の振幅を強化しました。バーは、平均値の標準誤差を示すと * * * データがpで非常に重要である < 0.01。この図の拡大版を表示するのにはここをクリックしてください。

図 8:競争 (抑制または変位) 試金の典型的なバインディング結果します。変位結合曲線は、IC50と氣決定できるから生成されます。競合するリガンド、リガンドの特定のバインディングの 50% の濃度であり、Ki (薬物の阻害定数) は場合ない放射性リガンド受容体の 50% を占める競合リガンドの濃度 IC50存在していた。氣は、チェン プルソフ式を用いた IC50から計算されます。
この図の拡大版を表示するのには、ここをクリックしてください。
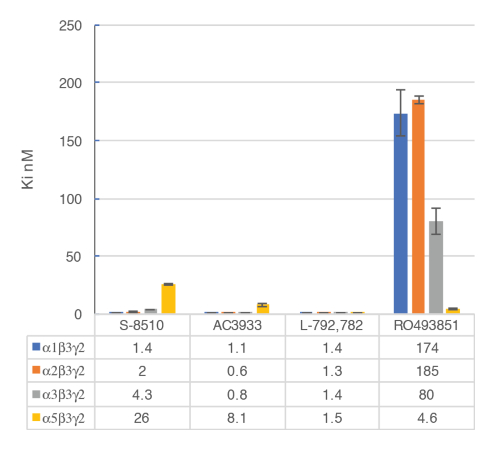
図 9: 競合製品の排除バインディングは配位子の主要な GABAAの受容体サブタイプのバインディングを実行します。[3H] フルマゼニル結合の試金を使用してアフィニティ (nM) を測定し、HEK293 細胞から膜は異なる人間 GABAA受容体のサブユニットの組み合わせで一過性トランスフェクションします。ヒストグラム表示は、明らかに差動感度 α5β3γ2 受容器の最も低い Ki と化合物 RO493851 の観察を示しています。この図の拡大版を表示するのにはここをクリックしてください。
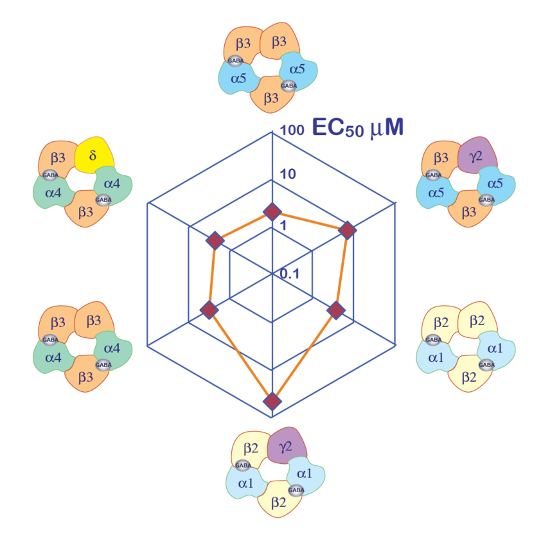
図 10: 差分 GABA 受容体の感度。レセプター GABA EC50クモ プロットのプロットと推定サブユニット組成の表現は、異なるサブユニットの役割を比較する効率的な方法を提供します。Γ2 サブユニットの導入は受容体の感受性の減少に関連付けられている注意してください。この図の拡大版を表示するのにはここをクリックしてください。
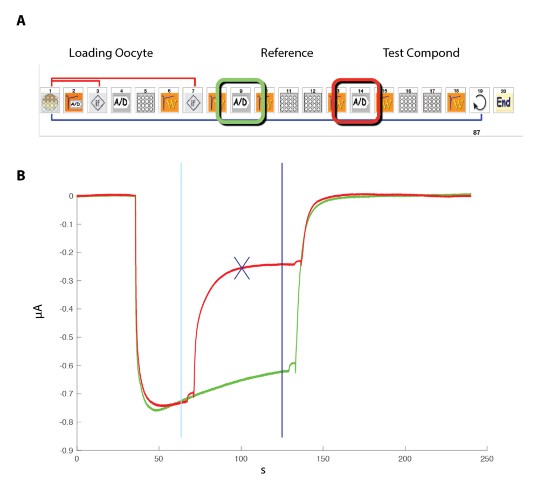
図 11: 変調器の効果を調査します。(A) このパネルは、自動化されたシステムの制御用アイコン シーケンスを示しています。2 つの (A/D) アイコンがコントロール (緑) と変調器露出 (赤) の間に記録に対応しているに注意してください。(B) このパネルは、このようなシーケンス中に GABAAの受容器を表現するセルに記録されている一般的な流れを示しています。変調器の効果を評価するには、GABA プラス (赤のトレース)、変調器にし、GABA に最初の暴露に続いて固定 (緑トレース)、GABA 濃度への露出によって誘発される応答を計測のシーケンスを行った。測定を区切ります (水色と青) 十字型のカーソルを位置決め、青い十字が 2 つの録音条件の最大の違いを示します。調節器、変調器の条件間の比率は、解析ソフトウェアで自動的に計算されます。この図の拡大版を表示するのにはここをクリックしてください。

図 12: 3 つの複製と熱プロットします。このパネルは、人間 α5β3γ2 GABAAの受容器の 96 化合物の得られる変調効果の 3 つの複製に対応する熱プロットを示しています。0.5 と 1.2 の間で及ぶ統制テスト応答の比率は、コントロールから有意差はないと考えられていた、緑色のドットで表されます。比 0.5 以下は抑制効果を表すと考えられていた、青いドットで表されます。1.2 上の比率は、応答の向上として考慮された、赤いドットで表されます。3 つの独立した録音の間のパターンの相似性に注意してください。この図の拡大版を表示するのにはここをクリックしてください。
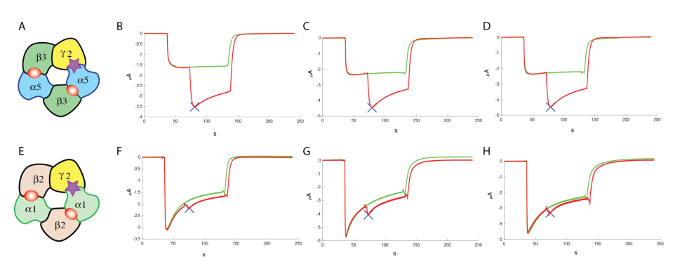
図 13: Α1β2γ2 で上映をカウンターします。(A) このパネル推定サブユニット構造の表現を示しています。次のパネル表示 (B・D) 人間 α5β3γ2 (F・H) で正のアロステリック変調器の効果の評価の GABA の濃度と同様の濃度 (100 μ M) を使用して、α1β2γ2 で、変調器は、化合物の特異性を強調は、これらの実験でテスト。(E) このパネルは、推定のサブユニット構造の表現を示しています。この図の拡大版を表示するのにはここをクリックしてください。
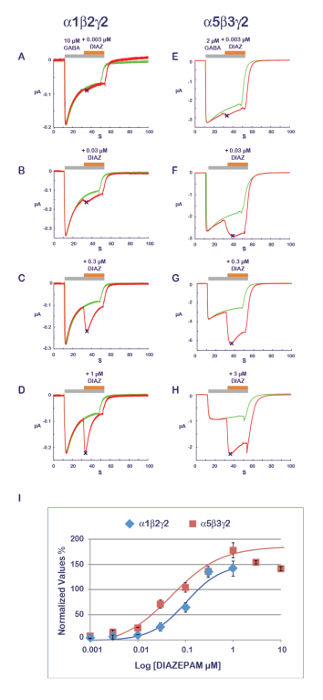
図 14: PAM 感度と受容体組成します。ジアゼパムの効果 (A~D) α1β2γ2、(E・H) での濃度のシリーズの効果の定量 α5β3γ2 受容体は、見かけの親和性のほぼ 10 倍の違いを明らかにします。なお高速 α1β2γ2 受容器の減感と応答時間コース サブユニット組成の影響 (たとえば、 DとHのパネルを参照)。Α1β2γ2 として注意してください、 GABA の α5β3γ2 受容体表示異なる親和性 (また図 10を参照)、アゴニストの濃度は匹敵する活発化の範囲にある 2 つの受容体の間で調整します。プロットを表します (I) このパネル倍の電流振幅の増加は対統一に正規化条件を制御します。この図の拡大版を表示するのにはここをクリックしてください。
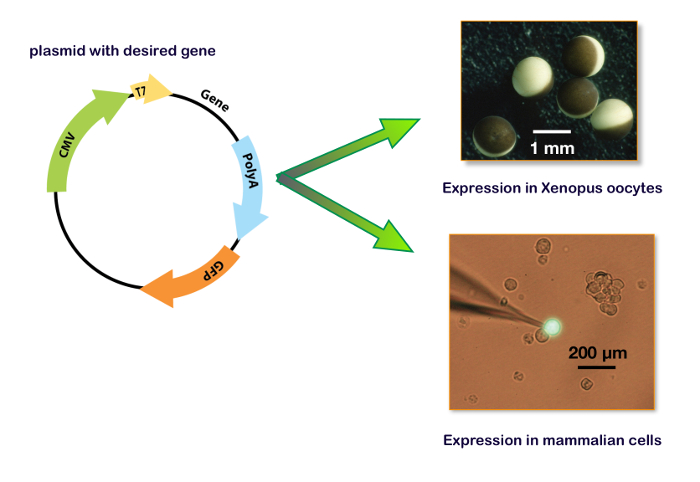
図 15: T7 と CMV プロモーターを含む発現プラスミド。これらのパネルは、アフリカツメガエルの卵母細胞 (右上のパネル) および細胞ライン式のプラスミドを表示します。下の右側のパネルは、パッチク ランプ記録電極とも緑色蛍光蛋白質 (GFP) 遺伝子を含むプラスミドをトランスフェクトした典型的な HEK 293 細胞を示しています。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
GABAAの受容体などのリガンド依存性イオン チャネルでアクティブな新規化合物の開発には、複数のアプローチが必要です。通常、最初のステップはしばしば用いて結合の試金;しかし、そのような測定は、化合物またはその正確な薬理学の生理活性の特性を十分ではありません。特に、受容体に結合する化合物が強化またはその機能を阻害するまたはも効果がない機能 (静かになる) (すなわち、その機能を変更することがなく受容体にバインド)。したがって、機能テストは、フル コンパウンドの特性評価のため必要です。
結合アッセイを:
結合の試金の主な利点は数千までのサンプル数が多いに効率的に行うことができる、アクティブな分子の結合親和性を提供すること。ここに記載されている、必要な受容体サブタイプの評価手法を確立する最初のステップで構成されます。すなわち、分数または全体の脳からネイティブ受容体の結合を行うことができる、そのようなメソッドが特定の受容体サブタイプで親和性の定量を防ぐ。したがって、目的のターゲットに画面分子組換えシステムを使用する必要は。今日では、一時的または安定したトランスフェクション細胞に必要な受容体サブユニット Cdna の目的 (例えばGABAA α5β3γ2) の受容体サブタイプを表現する効率的かつ信頼性の高い方法を提供しています。伝統的な結合の試金作るイメージングに関する基礎的、しかし最近の技術を使用可能であり、処理 (例えば、定量的蛍光ベースのリガンド) 放射能の不便を避けるため。
ホスト システムの機能発現は:
ホスト システムの遺伝子を表現するため十分な休眠打破を含むプラスミドに興味のコーディング シーケンスを挿入する必要があります。通常、mRNA 合成培養で細菌の T7 または T6 休眠打破が使用されます。CDNA 表現の興味の遺伝子の転写は、CMV (サイトメガロ ウイルス) などと同じ真核生物プロモーターによって調整されなければなりません。今日 2 つの休眠打破 (すなわちpUNIV、pCMV 6AC、psf CMV/T7、pCI ネオ、pcDNA) を含むいくつかのプラスミド mRNA の体外で合成または cDNA 式図 15に示すように、利用できるようにしています。細胞やアフリカツメガエル卵母細胞における GABAAの受容器の表現が忠実に得られます。後者の主な利点は、内因性受容体式、操作のシンプルさとマイクロ注射と録音のための自動化されたシステムの可用性の欠如です。このプロトコルで説明する手順は、約 7 分で 96 卵母細胞の注入が可能し、顕微操作スキルを必要としない自動システムの効率を示しています。アフリカツメガエルから単一の子房が 10,000-30,000 卵母細胞間含まれていることを思い出し、単一の準備の多数のセル測定を行うことができるは明らかです。また、cDNA の注射を使用して、式を行うことができる、バインドの実験用に開発された興味の遺伝子を含んでいる同じプラスミッド使用できますさらに分子生物学を必要とせず機能解析のため操作。
その大きさと高い表面表現を与え、単一卵子は約 35 mm ペトリ皿の合流のセルに相当する受容体の数を得られます。ただし、卵母細胞の準備と注入は、実験は、特定の文化媒体と無菌操作を必要としない、細胞ラインのコストのほんの一部を表します。単一の GABAAチャネルの活性化をもたらす数 picoamperes (10-12) と最大数万アンペア (10-6) に至るまでの流れが簡単の数百万の併用の活動を確認する 1 つの卵子に記録されます。1 つの応答の中に受容体。
リガンド依存性イオン チャネルの特性の最初のステップは、受容器の見かけの親和性の決定である頻繁。実施する必要がある実験は、一連の簡単なアゴニスト テスト パルスを適用して、振幅、誘発の現在や、場合によっては、アゴニスト濃度の対数の関数として (AUC) 曲線の下の領域をプロットで構成されます。異なるプラスミド濃度と卵母細胞の同じバッチの比 microinject を簡単に実現可能な式のこのシステムはそのような特性に特に適した。さらに、バッチ間の比較は別の EC50s の安定性を高度を明らかにしました。受容体の見かけの親和性サブユニット組成の影響は、図 10に例示としてスパイダー プロットを使用して容易に視覚化します。
アフリカツメガエル卵母細胞で得られた 2 電極電圧クランプの結果はしばしばパッチ クランプ電極を使用した録音と比較されます。一方、それは、これらの 2 つのシステム間の詳細な比較に行くにこの仕事の範囲を超えて行くだろう、いくつかのポイントを調べることができます。細胞パッチク医薬品迅速アプリケーション生物物理特性のための利点を提供しています、その要件、アフリカツメガエル卵母細胞に 2 つ電極の録音のものよりも複雑です。最初と無視できない難易度安定のトランスフェクションや一時的な細胞培養の必要性と目的の構造を表現しているセルの識別特定の蛋白質の表現であります。さらに、考えられる細胞の内因性表現の貢献の可能性を調べるため欠かせません。また、パッチク ランプはその人も、シールの質を評価するのに実験中に十分な分析を実行する必要がある高倍率顕微鏡下におけるマイクロマニピュレーションを実施する熟練者を必要とします。アクセス抵抗など対照的に、2 電極電圧クランプ記録、特に 1 つの自動化された電気生理学的システムを使用して任意の特定のスキルを必要としないし、検査技師が行うことができます。
、電気生理学的設定を取得する際、コスト意識は確かに慎重に分析する必要がある重要な要素です。たとえば、自動化されたシステムのコストは比較的高いが、詳しく比較を明らかに完全な電気生理学的リグのインストールは良いマイクロマニピュレーター、両眼のレンズ、アンプ、血流などの機器を購入、システムともデータの取得と分析を実行しながら、防振テーブル。2 電極電圧クランプ セットアップ対パッチ クランプ セットアップのコスト比較では、さらに矛盾を明らかにします。また、自動化されたシステムは完全に自動化された装置の利点を提供しています、昼と夜無人実行されます。
化合物の薬理学的特性は、受容体の処置のモードによって決まります。たとえば、競争の抑制剤はアゴニスト自体が競争を原因として同じ結合ポケット、または orthosteric サイトが入力できる分子であります。非競争の抑制剤は、入力でき、たとえばイオンの毛穴をブロック別サイトと、リガンド依存性イオン チャネルの場合の相互作用によって受容体を阻害する化合物です。それは、相互作用のさまざまなメカニズムを調べるためこの作業の範囲を超えて行くだろうが、薬理の教科書または Bertrand とベルトランの22など他の作業からさらに情報を入手できます。
アロステリック変調器の場合は、化合物の結合分子の存在は orthosteric サイトとは異なるサイトではアクティブなその他の状態の間のエネルギー障壁を変更します。正のアロステリック変調 (Pam) は、アクティブ状態に休んでからエネルギー障壁を軽減する化合物であるし、したがって、アゴニストの効果を高めます。PAM の影響を評価するには、必要がある、したがって、化合物への露出を高めるアゴニストへの応答、および、どの濃度で、それを判別図 11 図 14に示した実験は、GABAAの受容器の PAMs の特性が正しく使用できるプロトコルを示しています。
場合によっては、単独での PAM への露出受容器をアクティブにするための十分な可能性があります。このような活動は、ここで提示された実験的プロトコルのわずかな変更によって決定できます。すなわち、GABA に露光中に変調器の共同アプリケーションを使用する代わりにプロトコル変更できます最初のアプリケーションのだけと、GABA 存在下での化合物。化合物自体によって誘発し、GABA 誘発電流と比較して応答の振幅の測定による直接アゴニスト活性の評価になります。
図 7に示すよう脳切片での実験は、動物モデルや臨床試験に向けての経路に沿ってさらに行く前に明確な抑制性回路でネイティブの受容器の複合アクティビティを確認する使用されます。比較的単純なデータの記録と解析プロトコルは、PS 振幅差動変調効果を評価することによって複数の化合物のランキングをできます。GABA のシステムに関連していない化合物の非特異的効果は検出された (例えばPS 形の変化が観察されるとき) もあります。直接、Gaba 神経伝達によって評価されるこれらのケースで全細胞パッチ クランプ技術8を使用して抑制性シナプス電流 (Ips) の化合物の効果を測定します。
開示事項
著者フレデリック ・ Knoflach、マリア ・ Clemencia ・ ヘルナンデス F. ホフマン ・ ラ ・ ロシュ AG、4070 バーゼル、スイス連邦共和国、製薬会社の従業員であります。著者ダニエル ベルトランは HiQScreen Sàrl 6、rte の従業員・ デ ・ Compois、1222 Vésenaz ジュネーブ、スイス、検診施設を製薬会社に提供すること。
謝辞
著者は、その優秀な技術支援のジュディス Lengyel、マリア カルク、グルゴワール Friz、レイチェル ハアブとロシュからマリー クレア Pflimlin、Tifany Schaer と HiQScreen からデボラ Paolucci をありがとうございます。
資料
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| 96 well cell harvester -(Filtermate 196) | Packard | To filter membranes with bound radioligand | |
| Microtiter plate liquid scintillation counter (Top Count NXT) | Packard | Microplate Scintillation and Luminescence counter | |
| Vial liquid scintillation counter (Beta-Couter 2500 TR) | Packard | Vial Scintillation and Luminescence counter | |
| Liquid handler (Biomek 2000) | Beckman coulter | To prepare compound dilutions | |
| Vortex (Vortex Genie 2) | Scientific industries Inc. | To mix compound stock solutions | |
| Tissue homogenizer (Polytron PT1200E) | Kinematica AG | To resuspend the membrane preparations | |
| XLfit5 software | Microsoft Excel add-on by IDBS | Curve fitting software | |
| Smart Pull | UniPix | - | Electrode Puller |
| RoboInject | MultiChannel Systems | - | Automated Injection (Xenopus Oocytes) |
| HiClamp | MultiChannel Systems | - | Automated Voltage Clamp (Xenopus Ooocytes) |
| DataMining | MultiChannel Systems | - | Data Analysis Software |
| DataMerger | MultiChannel Systems | - | Data Processing Software |
| Digidata 1550 | Molecular Devices | Low noise data acquisition system | |
| CyberAmp 380 or equivalent | Axon Instruments | Programmable Signal Conditioner | |
| pClamp program suite | Molecular Devices | Software for data acquisition and analysis software | |
| Antivibraton table | TMC | To avoid microelectrode vibrations | |
| Patchstar Micromanipulators | Scientifica | To accurately position microelectrodes in brain slices | |
| Faraday Cage | Sutter Instruments | To isolate recordings from noise | |
| McIlwain Tissue Chopper | Campden Instruments LTD | To prepare brain slices | |
| Borosilicate glass micropipette | Warner Instruments | GC150TF-10 | To record extracellular potentials in brain slices |
| Twisted pair, platinum iridium wires stimulation electrode | World Precision Instruments | To stimulate the brain slices with current | |
| Stimulus generator for current and voltage driven stimulation | MultiChannel Systems | STG4000 | Delivers the current to the stimulation electrode |
| Plasticware | |||
| Microtiter plate round bottom | Corning | #3365 | Used for the binding assay |
| GF/C glassfibre filter-bottom 96-well microplate with 1.2 µm poresize, for cell harvesting assays using a vacuum manifoldwell filter | Packard | #6005174 | used for the binding assay |
| 50 mL Tubes | Falcon | #352070 | used for the binding assay |
| Safe-lock tubes 1.5 mL | Eppendorf | #0030 120086 | used for the binding assay |
| Safe-lock tubes 2 mL | Eppendorf | #0030 120094 | used for the binding assay |
| Shipping tubes 180 mL | Semadeni Europe AG | #3722 | used for the binding assay |
| Pony vial Polyethylene 6 mL | Perkin Elmer | #6013329 | used for the binding assay |
| Top Seal | Perkin Elmer | #60051859 | used for the binding assay |
| Spinner Flask | Bellco | BELLCO # 1965-00100 | Spinner Flask |
| 96 Well Plate (Conical) | Thermo Scientific Milian | 56368 | Injection plate for the oocytes |
| 96 Well Plate (Flat bottom) | Corning (Vitaris Switzerland) | 3364-cor | Compound Plate for the HiClamp |
| Glass capillary | Hilgenberg (Germany) | - | borosilicate glass 1.2 O.D. 0.76 I.D. with filament |
| RNA preparation | |||
| Ambion mMessage mMachine | Thermo Fisher Scientific | for the in vitro synthesis | |
| Chemicals | |||
| Assay buffer: KCl 5 mM; CaCl2 1.25 mM; MgCl2 1.25 mM; NaCl 120 mM; Tris 15 mM pH adjust with HCl to 7.4; store up to 3 months at 4 °C. | Used for binding assay | ||
| Washing buffer: Tris 50 mM -HCl pH 7.4; store at 4 °C. | Used for binding assay | ||
| Stock solution of test compounds 10 mM in DMSO | Used for binding assay | ||
| Flumazenil (RO0151788) 10 mM in DMSO | Used for binding assay | ||
| Diazepam 4 mM in DMSO | Used for binding assay | ||
| [3H]-Flumazenil 60-85 Ci/mmol in Ethanol; store at -20 °C | Used for binding assay | ||
| Microscint 40 | Packard | #6013641 | Used for binding assay |
| Ultima Gold | Perkin Elmer | #6013329 | Used for binding assay |
| MS-222 | Sigma | Sigma # A5040 | MS-222 |
| AB/AM | Sigma | Sigma # A5955 | antibiotics / antimycotics |
| Collagenase | Sigma | Sigma # C1030 | Collagenase Type I |
| Rnase | Sigma | Sigma # R2020-250 mL | RNaseZAP |
| EndoFree Plasmid maxi Kit | Qiagen | Qiagen # 12362 | |
| Salts for artificial cerebrospinal fluid (NaCl, KCl, etc.) | Sigma | ||
| Membranes | |||
| Frozen membrane preparations from transient or stably transfected HEK293 overexpressing different human GABAA receptor subtypes: α1β3γ2, α2β3γ2, α3β3γ2, α5β3γ2. See Ballard et al. 2009 for detailed methods. | Used for binding assay |
参考文献
- Rudolph, U., Knoflach, F. Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nature Reviews Drug Discovery. 10, 685-697 (2011).
- Sieghart, W. Structure and pharmacology of g-aminobutyric acidA receptor subtypes. Pharmacological Reviews. 47, 181-234 (1995).
- Liu, J., et al. A high-throughput functional assay for characterization of g-aminobutyric acidA channel modulators using cryopreserved transiently transfected cells. ASSAY and Drug Development Technologies. 6, 781-786 (2008).
- Mennerick, S., et al. Diverse voltage-sensitive dyes modulate GABAA receptor function. Journal of Neuroscience. 30, 2871-2879 (2010).
- Hevers, W., Luddens, H. The diversity of GABAA receptors. Pharmacological and electrophysiological properties of GABAA channel subtypes. Molecular Neurobiology. 18, 35-86 (1998).
- Macdonald, R. L., Olsen, R. W. GABAA receptor channels. Annual Review of Neuroscience. 17, 569-602 (1994).
- Kemp, J. A., Marshall, G. R., Wong, E. H., Woodruff, G. N. The affinities, potencies and efficacies of some benzodiazepine-receptor agonists, antagonists and inverse-agonists at rat hippocampal GABAA-receptors. British Journal of Pharmacology. 91, 601-608 (1987).
- Prenosil, G. A., et al. Specific subtypes of GABAA receptors mediate phasic and tonic forms of inhibition in hippocampal pyramidal neurons. Journal of Neurophysiology. 96, 846-857 (2006).
- Ballard, T. M., et al. RO4938581, a novel cognitive enhancer acting at GABAA a5 subunit-containing receptors. Psychopharmacology. 202, 207-223 (2009).
- Knoflach, F., Hernandez, M. C., Bertrand, D. GABAA receptor-mediated neurotransmission: Not so simple after all. Biochemical Pharmacology. 115, 10-17 (2016).
- Gielen, M. C., Lumb, M. J., Smart, T. G. Benzodiazepines modulate GABAA receptors by regulating the preactivation step after GABA binding. Journal of Neuroscience. 32, 5707-5715 (2012).
- Bergmann, R., Kongsbak, K., Sorensen, P. L., Sander, T., Balle, T. A unified model of the GABAA receptor comprising agonist and benzodiazepine binding sites. PLoS One. 8, 52323 (2013).
- Richter, L., et al. Diazepam-bound GABAA receptor models identify new benzodiazepine binding-site ligands. Nature Chemical Biology. 8, 455-464 (2012).
- Rudolph, U., Crestani, F., Mohler, H. GABAA receptor subtypes: dissecting their pharmacological functions. Trends in Pharmacological Sciences. 22, 188-194 (2001).
- Wisden, W., Seeburg, P. H. GABAA receptor channels: from subunits to functional entities. Current Opinion in Neurobiology. 2, 263-269 (1992).
- Davies, C. H., Davies, S. N., Collingridge, G. L. Paired-pulse depression of monosynaptic GABA-mediated inhibitory postsynaptic responses in rat hippocampus. The Journal of Physiology. 424, 513-531 (1990).
- Karnup, S., Stelzer, A. Temporal overlap of excitatory and inhibitory afferent input in guinea-pig CA1 pyramidal cells. The Journal of Physiology. 516, 485-504 (1999).
- Turner, D. A. Feed-forward inhibitory potentials and excitatory interactions in guinea-pig hippocampal pyramidal cells. The Journal of Physiology. 422, 333-350 (1990).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. 391, 85-100 (1981).
- Adelsberger, H., Brunswieck, S., Dudel, J. Block by picrotoxin of a GABAergic chloride channel expressed on crayfish muscle after axotomy. European Journal of Neuroscience. 10, 179-187 (1998).
- Hapfelmeier, G., et al. Isoflurane slows inactivation kinetics of rat recombinant a1b2g2L GABAA receptors: enhancement of GABAergic transmission despite an open-channel block. Neuroscience Letters. 307, 97-100 (2001).
- Bertrand, S., Bertrand, D. Overview of electrophysiological characterization of neuronal nicotinic acetylcholine receptors. Current Protocols in Pharmacology. , 17 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved