Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Microscopía espectral reflectométrico en axones mielinizados en Situ
En este artículo
Resumen
Aquí, presentamos un protocolo paso a paso de axones myelinated en un trozo de cerebro fija usando una nanoescala libre etiqueta técnica basado en reflectometría spectral de la proyección de imagen de la proyección de imagen.
Resumen
En un mamífero sistema nervioso, mielina proporciona un aislamiento eléctrico enwrapping las fibras del axón en una espiral de varias capas. Inspirado por su arquitectura subcelular altamente organizado, recientemente desarrollamos una nueva modalidad de imágenes, llamada reflectometría espectral (SpeRe), que permite la proyección de imagen de nanoescala etiqueta-libre sin precedentes de los axones myelinated vivo in situ. El principio subyacente es obtener información nano-estructural analizando el espectro de reflectancia de la estructura subcelular de varias capas. En este artículo se describe un protocolo detallado paso a paso para realizar una básica SpeRe la proyección de imagen de los tejidos nerviosos mediante un sistema microscopio confocal comercial, equipado con un láser de luz blanca y un filtro sintonizable. Cubrimos los procedimientos de preparación de muestras, adquisición de datos espectrales y procesamiento de imagen para obtener información de nano-estructural.
Introducción
En el mamífero sistema nervioso, mielina proporciona integridad axonal y conducción nerviosa rápida enwrapping las fibras de axones con varias capas envolturas membranosas. Su estructura multicapa se compone de alterna de nanoescala películas delgadas compuestas de membranas del plasma (~ 5 nm), citosol (~ 3 nm) y espacios extracelulares (~ 7 nm)1,2. Microscopía óptica, incluyendo la microscopía de superresolución recientes, no son adecuados para la observación de la dinámica de la mielina de escala nanométrica debido a su insuficiente resolución debido a la difracción óptica3,4,5. Aunque la microscopía electrónica puede proporcionar detalles finos de la nanoestructura de la mielina, no es compatible con los sistemas biológicos vivos debido a preparaciones de muestra altamente invasiva que involucra la fijación química y ultrasectioning6,7 . Hasta hace poco, no se ha producido ninguna técnica aplicable para observar dinámicas de nanoescala de axones myelinated en situ.
Schain Ciencias et al había divulgado previamente que axones myelinated exhiben colores reflectancia luz8. Adoptando el análisis espectroscópico de la luz reflejada, hemos ideado una nueva modalidad de imagen para imágenes a nanoescala de axones myelinated, llamado reflectometría espectral (SpeRe)9. SpeRe se basa en la interferencia de película delgada que ocurre en la estructura de varias capas de la vaina de mielina (figura 1). Por simulación óptica en varios axones, ha revelado que el espectro de reflectancia es una función periódica del número y su periodicidad (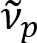 ) es inversamente proporcional al diámetro del axón (d). Esta relación simple (
) es inversamente proporcional al diámetro del axón (d). Esta relación simple ( ) ofrece fácil cuantificación de diámetro de axón de los datos de SpeRe. Utilizando esto, nos reveló el frecuente axón abultamiento bajo craneoencefálico leve en nuestro informe anterior.
) ofrece fácil cuantificación de diámetro de axón de los datos de SpeRe. Utilizando esto, nos reveló el frecuente axón abultamiento bajo craneoencefálico leve en nuestro informe anterior.
El sistema SpeRe está basado en la microscopia confocal y consiste en una fuente de láser especializado y filtros (figura 2). La fuente de entrada es un láser de luz blanca, proporciona banda ancha salida espectral visible a infrarrojo regiones. Para el análisis espectral, el sistema está equipado con dos dispositivos de acusto-óptica: un filtro sintonizable de acusto-óptica (AOTF) para la entrega de una longitud de onda seleccionada de la fuente de entrada de banda ancha y un divisor de viga de acusto-óptico (AOBS) para orientar el seleccionado refleja longitud de onda del detector. El software para microscopía confocal hiperespectral (véase Tabla de materiales) ofrece una opción de análisis espectral personalizable para adquirir secuencialmente las imágenes de reflectividad en distintas longitudes de onda en la entrada. Además, la aberración cromática críticamente puede interferir en la medición espectral; por lo tanto, se recomienda el uso de una lente de objetivo de apochromat.
De nota, láseres de luz blanca producen una salida espectral desigual y los componentes ópticos también afectan el perfil espectral. Por lo tanto, los espectros adquiridos deben ser calibrados para el posterior análisis cuantitativo. Un espejo de plata protegido se utiliza normalmente como una referencia, que proporciona una reflexión casi constante (> 97%) en la región visible completo. Luego se dividen los espectros adquiridos por los espectros de referencia desde el espejo.
El tamaño de paso espectral para el análisis espectral determina la velocidad de adquisición; por lo tanto, debe ser optimizado. Como un axon más grande tiene un mayor periodo espectral, requiere más espectral muestreo. Por ejemplo, un axón con un diámetro de 10 μm, uno de los más grandes axones fisiológicos, tiene un periodo espectral de 8 nm. Mediante la aplicación de criterios de muestreo de Nyquist, se empleó el intervalo de muestreo espectral de 4 nm para cubrir todos los axones fisiológicos en los tejidos nerviosos de ratón. Este enfoque por lo general toma varios segundos para un análisis espectral completo y así no es adecuado para aplicaciones en vivo , donde el movimiento fisiológico (por ejemplo, la respiración y del latido del corazón) interfiere adquisición espectral estable. Ya resolvimos esta cuestión por equipar un microscopio vertical personalizado, diseñado para adquirir la gama completa para cada punto usando un espectrómetro de matriz (adquisición velocidad ≈ 30 m por píxel).
En este informe, describimos un protocolo detallado en la proyección de imagen de SpeRe en una rebanada del cerebro fija, que puede realizarse en un microscopio hiperespectral comercial (véase Tabla de materiales). Así, el protocolo puede ser completado por experimentadores sin conocimientos en instrumentación óptica. También cubrimos los posibles problemas y solución de problemas para la adquisición y análisis de datos SpeRe.
Protocolo
Todos los procedimientos quirúrgicos fueron aprobados por el institucional Animal Care y el Comité uso (IACUC) de la Universidad de Sungkyunkwan.
1. preparación de la muestra
Nota: Autoclave todos los instrumentos quirúrgicos antes de manejo de animales. Llevar a cabo todos actuación quirúrgica en una sala dedicada a procedimientos quirúrgicos. Guantes y batas quirúrgicas estériles deben llevarse por todo el personal en la sala quirúrgica en todo momento.
-
Fijación del tejido
- Preparar dos jeringas de 10 mL, que cada uno relleno con solución salina tamponada con fosfato (PBS) y 4% paraformaldehido (PFA) en PBS.
- Anestesiar un ratón de 7-12 semanas de edad, (C57BL/6J o las líneas de ratón con ambos sexos) mediante la administración de una mezcla de zoletil y xilacina (1:1, 20 mg/kg cada uno) o un régimen de anestesia conveniente alternativa (por ejemplo, mezcla de 80 mg/kg ketamina y 10 mg/kg xilacina) con una inyección intraperitoneal.
- Una vez que el ratón ha alcanzado un plano quirúrgico de anestesia (uso el método de respuesta a la pizca del dedo del pie), exponer el corazón cortando la piel y la caja torácica con las tijeras.
- Cortar la aurícula derecha con pequeñas tijeras para drenar la sangre y la perfusión de la solución PBS y PFA secuencialmente a través del ventrículo izquierdo con una aguja (tasa de perfusión = 4 mL/min, volumen = 10 mL de cada solución).
Nota: El ratón se convierte en duro si el procedimiento se ha completado con éxito. El uso de ungüento oftálmico o esterilización no es necesario ya que el procedimiento es terminal. El procedimiento de fijación puede ser saltado. Sin embargo, este paso se recomienda para reducir las deformaciones estructurales incluyendo daño a los tejidos mecánicos e hinchazón axonal isquémico. Para más detalles sobre la fijación de tejido, consulte el artículo de Gage, G. J. et al. 10
-
Preparación de la rebanada del cerebro
- Decapitar el ratón con tijeras quirúrgicas a través del tórax ventral y el abdomen.
- Quitar el cuero cabelludo y el periostio con una tijeras convenientemente pequeña hasta exponer completamente el cráneo.
- Romper el hueso frontal y cortar el cráneo a lo largo de la sutura sagital del hueso occipital con pequeñas tijeras con cuidado de no para dañar el cerebro.
- Retire suavemente el cráneo y la duramadre secuencialmente con unas pinzas finas.
- Extraer el cerebro con una cuchara de plástico suave, teniendo cuidado de no para dañar el tejido.
- Enjuagar y remojar el cerebro extraído en una solución PFA 4% durante 30 min a 4 ° C.
- Cortar el cerebro fijado en 100 – 150 μm secciones con un vibratome.
Nota: Para más detalles sobre la preparación del tejido, consulte el artículo de Segev et al. 11. para los procedimientos posteriores, el tejido debe ser cortado en secciones más fino que el espesor del espaciador.
-
Montaje de la rebanada del cerebro
- Preparar 1 diapositiva de cristal y 2 vasos cuadrados de cubierta (22 × 22 × 0,17 mm) para cada rebanada de tejido.
- Cortar uno de los vidrios de cubierta cuadrados en la mitad (dos piezas rectangulares) usando un cortador de vidrio.
- Conecte los dos de los vidrios de cubierta a la mitad utilizando un pegamento en el cristal de la diapositiva.
Nota: El espacio entre los dos vasos a la mitad debe ser ligeramente mayor que el tamaño de la rodaja de tejido. - Cosecha de la rebanada del cerebro utilizando un cepillo o una pipeta y coloque el tejido en el cristal deslizante entre el espaciador. Tenga cuidado de no para doblar el tejido.
- Dispensar 100 μL de PBS en la superficie del tejido.
- Lugar el otros cuadrada cubierta de vidrio en la parte superior del tejido. Evitar la inclusión de burbujas de aire durante esta etapa.
- Selle alrededor del vidrio de cubierta con un esmalte de uñas (o adhesivos como alternativa adecuados) para evitar la evaporación de PBS y la contaminación por el polvo durante la sesión de imágenes posteriores.
Nota: El experimentador puede detenerse en esta etapa.
2. calibración
- Encienda el microscopio al menos 1 h antes de la proyección de imagen para permitir la estabilización térmica del láser (véase Tabla de materiales) de la fuente. A continuación, abra el software de análisis espectral (véase Tabla de materiales) y haga clic en el botón adquirir GUI (figura 3a).
- Abra el software de disparo para el láser de luz blanca (WLL) y tubo fotomultiplicador (PMT) (figura 3a).
- Seleccione el modo xyΛ en la lista desplegable en el Modo de adquisición, entonces, el modo de entrada de láser automáticamente cambia de porcentaje constante a Potencia constante. Desactive la casilla de verificación de Movimiento automático de SP. Y a continuación, establezca la ventana espectral del láser de entrada 470-670 nm y el tamaño de paso espectral a 4 nm en Λ-excitación Lambda Scan configuración (figura 3b).
- ESTABLECER el rango espectral del PMT a 450 690 doble clic o mover la barra de ajuste para la gama espectral (Figura 3C).
Nota: Este espectro debe incluir el ancho de banda completo de la fuente de entrada. - Seleccione un objetivo de inmersión en agua, convenientemente con una alta apertura numérica (NA > 0,7) y dar cualquier valor a poder PMT y láser para activar el botón de configuración AOBS y Live Scan . Cambiar la trayectoria óptica control de reflejo en la Configuración AOBS (Figura 3d).
- Montar un espejo de referencia (véase Tabla de materiales) en la platina del microscopio. La superficie del espejo debe encararse contra la lente del objetivo. Si no es fácil de poner el espejo en la platina del microscopio, enlazar un espejo sobre la placa plana (e.g. cristal de la diapositiva).
- Control de la platina del microscopio para alinear el plano focal a la superficie del espejo.
- Ajustar la ganancia de la PMT y la potencia del láser teniendo en cuenta el rango dinámico de los detectores y luego cambiar el modo de entrada de láser por ciento constante a Potencia constante.
Nota: Como es típico, un PMT ganancia de 500 (V) y una potencia de láser relativa de 0,1% utilizan a 570 nm. - Confirmar en modo pseudo-color para comprobar que no hay ninguna saturación en toda la gama de longitud de onda. Si se observa saturación, bajar la potencia del láser (figura 3a).
- Ejecutar la adquisición Lambda Scan .
- Quite el espejo de la etapa y repetir la misma adquisición sin una muestra para obtener la referencia (es decir, offset oscuro).
- Guardar los datos en un formato TIF Multistacked .
3. adquisición de la imagen SpeRe
- Coloque el tejido montado en la platina del microscopio. Áspero alinear el tejido para el plano focal de la lente del objetivo, utilice el modo de campo amplio de la fluorescencia a través de un ocular.
- Con la Live Scan en control de la platina del microscopio para alinear el plano focal para la región de interés en el tejido. Para evitar el ruido de fondo de la hoja de cubierta, seleccione la región de destino de al menos 15 de μm de profundidad desde la interfaz de tejido de vidrio.
- Adquirir la pila de imagen espectral para la región de destino utilizando el mismo procedimiento como se describe en los pasos 2.1-2.10.
- Guardar los datos para el tejido y el oscuro offset en formato TIF Multistacked .
Nota: El experimentador puede detenerse en esta etapa.
4. procesamiento y análisis de imágenes
5. línea base corrección y análisis de señales SpeRe
- Reste los espectros de desplazamiento de los espectros del espejo de referencia y los tejidos del cerebro.
- Normalizar cada espectro dividiendo la intensidad máxima del espectro.
- Dividir el espectro normalizado del axón por el espectro normalizado del espejo de referencia y restar el offset de DC del espectro normalizado.
- Medir la frecuencia de wavenumber ajustando el espectro adquirido a una sinusoidal (véase Tabla de materiales) de la curva y luego convertir el número adquirido a periodicidad por tomando recíproco.
- Convertir la periodicidad proporción al diámetro del axón mediante la ecuación en la figura 4C.
Resultados
Según el protocolo, un trozo de cerebro fija fue preparado con coloración exógena, un fluoróforo dirigidos a la mielina (véase Tabla de materiales). SpeRe la proyección de imagen se realizó en el segmento del cerebro con un microscopio confocal comercial hiperespectral en conjunto (figura 4a) la proyección de imagen confocal de la fluorescencia. SpeRe, entrada intensidad óptica fue establecido como 5 μW/μm2 con un tiempo...
Discusión
SpeRe es una modalidad de etiqueta-libre nuevo basada en interferometría espectral, que por primera vez, ofrece la información de nanoescala en axones mielinizados energizados. En el actual protocolo de adquisición, la resolución espacial para el diámetro del axon es del orden de 10 nm. Por otra parte, SpeRe utiliza órdenes de la magnitud dosis más baja de luz en comparación con otras Microscopías de súper-resolución; por lo tanto, es libre de fototoxicidad y photobleaching. SpeRe proporcionaría una nueva ví...
Divulgaciones
Los autores declaran que compiten intereses financieros: Kwon J. y M. Choi son inventores de la tecnología pendiente de patente se describe en este artículo.
Agradecimientos
Este trabajo fue financiado por el Instituto de ciencias básicas (IBS-R015-D1) y programa de investigación de ciencia básica a través de la nacional investigación Fundación de Corea (NRF) financiado por el Ministerio de Educación (2017R1A6A1A03015642).
Materiales
| Name | Company | Catalog Number | Comments |
| Glass cutter | - | - | Can be purchased in a local convenience store or online stores. |
| Nail polish | - | - | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | - |
| Matlab | MathWorks | - | - |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | - |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | - |
| Vibratome | Leica Biosystems | VT1200S | - |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
Referencias
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados