Method Article
Oclusión de la arteria Cerebral Media permitiendo la reperfusión mediante la reparación de la arteria carótida común en ratones
En este artículo
Resumen
Obstrucción de filamento intraluminal de la arteria cerebral media es el modelo más frecuentemente utilizado en vivo del movimiento experimental en roedores. Una alternativa quirúrgica para permitir la reparación de la arteria carótida común se realiza aquí, lo que permite la reperfusión de la arteria carótida común y una reperfusión completa para el territorio de la arteria cerebral media.
Resumen
El ictus isquémico es una causa importante de discapacidad a largo plazo de adultos y la muerte en todo el mundo. Los tratamientos actuales disponibles son limitados, con sólo activador del plasminógeno tisular (tPA) como un tratamiento farmacológico aprobado a accidentes cerebrovasculares isquémicos. La investigación actual en el campo del ictus isquémico se centra en la mejor comprensión de la patofisiología del accidente cerebrovascular, para desarrollar e investigar nuevas dianas farmacéuticas. Modelos de movimiento experimental confiable son cruciales para la progresión de tratamientos potenciales. El modelo de arteria cerebral media oclusión (MCAO) es clínicamente relevante y lo más frecuentemente usado modelo quirúrgico de ictus isquémico en los roedores. Sin embargo, los resultados de este modelo, tales como volumen de la lesión, están asociados con altos niveles de variabilidad, especialmente en ratones. El modelo alternativo de MCAO se describe aquí permite la reperfusión de la arteria carótida común (CCA) y la mayor perfusión del territorio arteria cerebral media (MCA), usar una almohadilla de tejido con sellador a base de fibrinógeno para reparar el buque y la mejor bienestar de los ratones al evitar la ligadura de la arteria carótida externa (CEPA). Esto reduce la dependencia del círculo de Willis, que se sabe para ser altamente anatómico variable en ratones. Datos representativos demuestran que utilizando esta alternativa quirúrgica disminuye la variabilidad en el volumen de la lesión entre el enfoque tradicional de MCAO y el enfoque alternativo descrito aquí.
Introducción
Una de las principales causas de infarto cerebral son la isquemia focal en el territorio de la arteria cerebral media. Activador del plasminógeno tisular (tPA) es el tratamiento sólo farmacológico con eficacia demostrada, a pesar de numerosos ensayos clínicos de drogas dirigido a ictus isquémico1,2. Sin embargo, debido a preocupaciones de seguridad y una estrecha ventana terapéutica (< 4.5 h), sólo el ~ 15% de los pacientes con accidente cerebrovascular son elegible para recibir tPA, y las tasas de recanalización pueden ser < 50%3,4.
Reproducibles y clínicamente relevantes los modelos animales de accidente cerebrovascular se consideran esenciales para informar el desarrollo de tratamientos terapéuticos de tiempos nuevos y potenciales. Sin embargo, debido a las preocupaciones en cuanto a consistencia y variabilidad en los resultados con modelos animales, sigue siendo importante refinar en vivo los modelos existentes para mejorar la traducción de preclínica a la clínica. La falta de traducción de la eficacia preclínica experimental de tratamientos potenciales para uso clínico es una preocupación constante para el movimiento de investigación5. Razones de falta de traducción suelen ser múltiples y pueden estar relacionadas con, por ejemplo, el diseño del ensayo, tratamiento retrasos, heterogeneidad del movimiento clínico, y las limitaciones de los modelos animales utilizan6. Un desafío clave para la investigación del movimiento sigue siendo el desarrollo de tratamientos seguros y eficaces.
Oclusión de la arteria cerebral media (MCAO) por la inserción del filamento de intramural es el modelo roedor más frecuentemente usado en vivo del movimiento experimental. Este modelo permite la restauración del flujo sanguíneo después de una inducción de isquemia, imitando los sucesos que ocurren en el movimiento humano7. Sin embargo, en particular en los ratones, volúmenes de lesión heterogénea con diferentes desviaciones estándar se producen aunque protocolos quirúrgicos son aplicadas8,9,10. Es típico ver una distribución bimodal de estriado pequeño y grande la lesión cortical striato volúmenes11. Para inducir isquemia, el filamento generalmente se inserta a través de una incisión de la CCA o cepa que luego permanecen permanentemente ligados12. La ligadura permanente de la CCA evita el restablecimiento del flujo sanguíneo en la arteria carótida interna (ACI) y, posteriormente, el territorio del MCA. Esto hace que la reperfusión que dependen de la fuente colateral dentro de círculo de Willis (vaca). La estructura de la vaca tiene variabilidad anatómica entre animales individuales, particularmente en C57BL/6 ratones una cepa típicamente usadas en vivo tiempos investigación13. Un método alternativo de inserción del filamento a través de la ECA, permitir la perfusión continua a través de la CCA, pero compromisos de este método la fuente arterial en el territorio de la cepa, que se ha demostrado, en ratas, a tener un efecto perjudicial sobre el animal bienestar,14.
La dependencia de la vaca para fuente colateral y reperfusión en el modelo establecido de MCAO puede, en parte, explicar la variabilidad del volumen de lesión después de la oclusión. Describimos un procedimiento quirúrgico murino alternativo donde se evita la ligadura de la cepa y la incisión de la CCA se repara, lo que permite reperfusión a través de la CCA, independiente de la vaca. La reparación de la incisión de la CCA ha demostrado previamente en ratas como resultado una reperfusión exitosa a través de la CCA15. Han aplicado este enfoque con éxito en ratones11 y presenta aquí el protocolo que se traduce en una menor variabilidad en el volumen de la lesión, la principal medida de resultado usada en estudios experimentales de la carrera.
En este protocolo, demostramos cómo MCAO se comprometen a través de la inserción de filamento CCA recipiente seguido de CCA buque reparación, que consiste en una aplicación de almohadilla y sellador de tejido para permitir la reperfusión.
Protocolo
Presente Protocolo y los datos reportados se llevaron a cabo con arreglo a la ley de Reino Unido los animales (procedimientos científicos), 1986 (licencia de proyecto 60/4315) y tras la aprobación ética institucional. Todos los experimentos están registrados conforme a la investigación Animal: Reporting In Vivo experimentos (llegar) directrices16.
1. preparación
- Familiarizar a adultos masculinos ratones C57BL/6 cuidados postoperatorios (p. ej., medio ambiente, ropa de cama, alimentos de recuperación) al menos 48 h antes de la cirugía.
Nota: Post-MCAO animales a menudo tienen dificultad para comer y beber después de la cirugía.- Para evitar la pérdida excesiva de peso después de la cirugía, aclimatarse a los animales a cualquier dieta post-MCAO, por ejemplo, poner gel de rehidratación, alimentos de gel y pastillas de dieta normal empapado y húmedos directamente sobre el piso de la jaula.
- Cambiar las camas jaula cama posoperatoria, como viruta de papel blanco.
- Esterilización quirúrgicas todas las herramientas antes de comenzar la instalación quirúrgica o procedimientos.
- Hacer esto en autoclave las herramientas (con un mínimo de 121 ° C, 15 psi, por 15 min) o mediante el uso de óxido de etileno (siguiendo las instrucciones del fabricante de la correcta, para 8-10 h).
- Desinfectar todas las superficies antes de establecer el procedimiento. Cubrir todas las superficies con aluminio esterilizado para artículos que necesiten manipulación durante la cirugía o cortinas quirúrgicas estériles. Utilizar técnica aséptica para la duración del procedimiento.
Nota: Puede utilizarse papel de autoclave para cubrir los instrumentos o equipos que deban realizarse durante la cirugía. Utilizando técnicas y guantes estériles, la lámina puede ser aplicada y, entonces, se puede colocar el elemento en el campo estéril. Después de esto, se requerirá un cambio de guante estéril.
2. cirugía de oclusión de Arteria Cerebral Media
- Utilizar ratones C57BL/6 machos adultos 24-31 g de peso en el momento de la cirugía. Inducir la anestesia mediante 5% isoflurano en 2 L/min de O2, en una cámara de plástico rojo de la anestesia.
- Después de la inducción, reducen el isoflurano para mantener una profundidad adecuada anestesia para la cirugía (e.g., 1.5 – 2% en 70% N2O2230% O) por mascarilla combinada con un sistema de búsqueda para bajar el cirujano exposición al isoflurano.
Nota: el óxido nitroso (N2O2) puede utilizarse en combinación con el oxígeno (O2) para reducir la cantidad necesaria de isoflurano para una profundidad de anestesia adecuada. - Administrar analgesia sistémica preoperatoria [carprofen, 10 mg/kg subcutánea (SC.)] y anestesia local para la incisión del sitio (bupivacaína, SC. de 2 mg/kg, diluido 1:10 en solución salina 0.9%) peri-operatorio.
- Administrar fluidos por inyecciones intraperitoneales (ip.) de 200 μL de solución de NaCl 0,9% precalentada estéril pre-operatively.
- Afeitar el pelo de la derecha región temporal y región del cuello ventral usando cortapelos pequeño para exponer la piel. Desinfectar la zona de la piel, utilizando una solución de clorhexidina 5% durante 3 minutos Aplicar lubricante ocular en ambos ojos, para evitar que se sequen durante la cirugía.
Nota: Si es necesario para lecturas de oximetría de pulso para monitor saturación de oxígeno de la sangre, ritmo cardíaco y ritmo respiratorio, use crema depilatoria para la pierna trasera del pelo. Aplicar la crema con algodón limpio brotes y, después de la depilación, lave el área con la solución de clorhexidina diluida. Realizar este paso en un área preoperatorio para reducir al mínimo el riesgo de contaminar el campo quirúrgico estéril de piel suelta. Los investigadores pueden preferir utilizar otras preparaciones de sitio quirúrgico según las prácticas locales. - Transferir el ratón a la zona quirúrgica y colóquelo en la posición prona en una estera de calor homeotérmicos cubierta por un paño estéril. Mantener anestesia a través de un cono de nariz. Inserte una sonda rectal para monitorear la temperatura del cuerpo del ratón y mantener a 37.0 ± 0,6 ° C.
- Antes de incisiones quirúrgicas, comprobar el reflejo de retirada de patas traseras y parpadeo reflejo para confirmar la profundidad de la anestesia.
- Conecte una sonda de flujometría Doppler (LDF) de láser para grabar el flujo de sangre al territorio MCA.
- Uso de un estereoscopio de disección, hacer una incisión de < 1 cm en el punto medio entre el ojo derecho y el oído de la piel temporal con un bisturí no. 15. Sin rodeos, disecar el tejido subyacente que cubre el cráneo, suavemente esta raspado de hueso y secado de la superficie con torundas de algodón estériles.
Nota: Se debe tener cuidado de no dañar el músculo de los temporalis. - Echar mano de la 0.7m m, flexible única sonda de fibra óptica conectado al monitor de LDF, corte su extremo usando un bisturí afilado para ganar un borde plano, esto empuje a través del soporte de la sonda en forma de Dona y coloque una pequeña cantidad de gel juego óptico en el extremo de la fibra.
- Coloque una pequeña cantidad de pegamento impermeable súper adhesivo alrededor del borde inferior del soporte de sonda; permita secar parcialmente y ser pegajosa.
- Seco el cráneo por encima del hueso temporal y una pequeña cantidad de adhesivo tisular tópico en un círculo para el hueso, lo suficiente como para el soporte de la sonda.
- Coloque el soporte de la sonda, con la sonda de fibra óptica ya está en marcha, en esta área (lateral de 6 mm y 2 mm distal desde el vértice).
- Deje que el pegamento se seque; una vez seco y Unido, comenzar a grabar los datos LDF.
- Uso de un estereoscopio de disección, hacer una incisión de < 1 cm en el punto medio entre el ojo derecho y el oído de la piel temporal con un bisturí no. 15. Sin rodeos, disecar el tejido subyacente que cubre el cráneo, suavemente esta raspado de hueso y secado de la superficie con torundas de algodón estériles.
- Suavemente hacia el animal una posición supina, procurando apoyar la sonda Doppler de láser y evitar su desprendimiento. Suavemente sellen las dos patas delanteras con cinta adhesiva médica microporosa, deslizando un par de algodón brotes (o algo similar, tales como pinzas cerradas) bajo el cuello para levantar la zona y crear tensión. Cubre el ratón con un paño estéril para mantener la cobertura aséptica.
- Comenzar la disección y exposición del CCA.
- Hacer una incisión de línea media de 1,5 cm en el cuello ventral expuesto mediante una hoja de bisturí Nº 15.
- Mediante técnicas de disección Roma suave, suavemente retraiga las glándulas salivales a los lados, exponiendo la tráquea.
- Mediante disección Roma, diseccionar la CCA libre del tejido circundante y del nervio vago.
Nota: Evite tocar el nervio vagal directamente, como daños en el nervio vagal pueden deteriorar la movilidad, alimentación y respiración.
- Pasar dos secciones pequeñas (2 cm) de una no absorbibles suturas 6-0 por debajo de la CCA dorsal y el vaso ventral del nervio vagal. Dibujar una corbata de seda más cerca al cirujano y atarlo firmemente alrededor de la CCA (empate proximal). Sin apretar atar la corbata de seda de segundo (empate distal) hacia la bifurcación de la ICA y la cepa.
- Para comenzar a aislar una sección del CCA, aplicar un clip microvascular justo por encima de la ligadura distal pero no obstruir la bifurcación. Usando las tijeras de Vannas micro, hacer un pequeño hueco en el CCA.
Nota: La cepa debe permanecer patente en todo momento. La incisión de la CCA debe ser no más de 40% de la anchura de la nave y en posición ventral fácilmente accesible; Esto jugará un papel importante en la etapa de reparación buque post-MCAO. - Inserte un monofilamento de silicona recubierto de 7-0 en el CCA, avanzando hacia el clip microvascular.
Nota: El tamaño del filamento debe establecerse basándose en peso del ratón antes de la cirugía; Consulte las instrucciones del fabricante.- Apriete el lazo distal, suficiente para fijar el filamento en su lugar sin dañarlo. Retire el clip microvascular mediante soportes de clip.
Nota: No hay pérdida de sangre puede considerarse en este punto. Si hay un reflujo de sangre, el empate que el filamento no es lo suficientemente apretado.
- Apriete el lazo distal, suficiente para fijar el filamento en su lugar sin dañarlo. Retire el clip microvascular mediante soportes de clip.
- Avanzar el filamento en el ICA.
- Asegúrese de que el filamento se mantiene dentro de la ICA y no en la arteria pterigopalatina (PPA). Hacer esto un poco levantando y tirando de la CCA, usando uno de los lazos de seda, hacia el exterior del cuerpo del animal, y dirigir el filamento para doblar más allá de la abertura interna frente a de la PPA.
Nota: Una vez avanzado el origen de la rama MCA, una caída en el flujo sanguíneo relativo al territorio suministrado será visible en los valores LDF; Esto confirma la colocación del filamento.
- Asegúrese de que el filamento se mantiene dentro de la ICA y no en la arteria pterigopalatina (PPA). Hacer esto un poco levantando y tirando de la CCA, usando uno de los lazos de seda, hacia el exterior del cuerpo del animal, y dirigir el filamento para doblar más allá de la abertura interna frente a de la PPA.
- Garantizar el filamento en el lugar con la corbata de seda de distal, atar esta más apretado. Deje en su lugar durante la duración de la oclusión, el período de tiempo.
Nota: Dependiente en protocolos individuales, el animal puede moverse a una jaula de recuperación, sigue herida de sutura, para recuperar, o permanece bajo anestesia para la duración de la oclusión. En este último caso, asegúrese de que se impide que la herida seque usando precalentado 0.9% NaCl salina.
3. oclusión posterior
- Al final del período de MCAO, inmediatamente retraiga el filamento hasta la cabeza del filamento blanco es claramente visible.
- Luego, afloje el CCA distal atar lo suficiente como para quitar el filamento más cabeza de la salida de la embarcación.
Nota: El filamento es completamente retirable en este punto si el cirujano está seguro con velocidad al nudo de la corbata distal para evitar la pérdida de sangre. - Coloque un clip microvascular en posición horizontal hacia la bifurcación de la CCA al lado de la ligadura distal. La ligadura distal y quitar el filamento completamente. Añadir otro clip microvascular por debajo de la corbata CCA proximal hacia el cirujano.
Nota: Asegúrese de que el vaso es lo suficiente en las puntas de la abrazadera para evitar cualquier desliz. La colocación de los clips es esencial para asegurar a productos clip fácil acceso durante los pasos posteriores. Los clips pueden utilizarse para ayudar a levantar el vaso para permitir una mejor separación y colocación de parche de tejido, coloque los clips horizontalmente a través de los músculos circundantes. - Cuidadosamente retire ambos lazos de seda con pinzas Dumont #5 o micro tijeras Vannas y secar el área con bastoncillos de algodón estériles.
Nota: Se debe tener cuidado de no cortar a través/en el recipiente. - En una placa Petri estéril, añadir fibrinógeno y trombina sellador soluciones 1 y 2 (véase la Tabla de materiales), asegurando las dos sustancias permanecen separadas, listo para mezcla más adelante.
Nota: Sólo muy pequeñas cantidades de los agentes son necesario (< 0,25 mL cada uno). Mantener separadas las soluciones impide una reacción prematura entre los dos componentes. Asegúrese de que la tapa se sustituye la misma manera como fue quitado para prevenir la contaminación cruzada de las dos jeringas, que causaría el agente a reaccionar y dentro de la jeringa. Antes de su uso, almacenar las soluciones a-20 ° C. Cuando sea necesario para la primera cirugía, descongelar el sellador a la temperatura ambiente. No congele de nuevo el sellador; debe permanecer a temperatura ambiente y puede almacenarse de esta forma. La jeringa puede ser utilizada a través de múltiples cirugías, lo que es rentable; sin embargo, recomendamos no utilizar el mismo frasco por más de 1 semana para evitar la contaminación. - Realice una disección Roma a lo largo del músculo con pinzas Dumont no 5 y micro tijeras Vannas para obtener una fina rebanada ventral del músculo esternocleidomastoideo para la almohadilla de tejido, asegurando la rebanada es no más de 1 mm de espesor y corre a lo largo de las fibras superiores del músculo.
Nota: No corte a través, atraviesa el músculo, como esto afectará significativamente su función. El tejido debe ser lo suficientemente grande como para cubrir la incisión CCA cómodamente. - Con unas pinzas Dumont #5, tome el cojín de tejido y mezcle el tejido uniformemente a través de los dos de fibrinógeno y trombina sellador soluciones, formando un canal entre los dos reactivos. La coagulación se produce rápidamente; tan pronto como comience la coagulación, retire la almohadilla de tejido para la incisión de la CCA. Coloque la almohadilla de tejido plano hacia abajo con una media presión firme y pinzas abiertas.
- Rápidamente Quite el clip microvascular distal mientras que todavía sostiene suavemente la almohadilla de tejido en su lugar.
Nota: Esto permite un reflujo de sangre para activar más los reactivos sellador de fibrinógeno y trombina. Suficiente presión se requiere para mantener la almohadilla en su lugar pero no para bloquear completamente el recipiente. - Poco a poco aliviar la presión de la almohadilla de tejido, permitiendo que la sangre fluya en el área de incisión. Ahora, lenta y suavemente suelte la presión de la pinza proximal microvascular y remover completamente.
- Nota: Para garantizar que el buque se hace totalmente patente, la colocación de la almohadilla de tejido y la eliminación de los clips microvasculares deben ocurrir rápidamente para evitar que la almohadilla de tejido sellado en el interior del CCA. Sin embargo, si hay una pequeña cantidad de fuga de sangre, volver a colocar algunos ligera presión sobre la almohadilla de tejido para permitir más tiempo para la formación de coágulos y el lacre que se produzca. Si la salida de sangre es considerable o la almohadilla de tejido parece no ser sellado, mantener la presión para evitar la pérdida de sangre y colocar dos pinzas microvasculares de CCA para aislar la incisión y evitar más pérdida de sangre.
- Rápidamente Quite el clip microvascular distal mientras que todavía sostiene suavemente la almohadilla de tejido en su lugar.
- En el caso de la almohadilla de tejido no sello al recipiente, un segundo intento se puede hacer, siguiendo pasos 3.3-3.7.3.
- Una vez que se sella el recipiente, sutura la herida con suturas solubles 6-0. Grabación de LDF fue continuado a lo largo de la cirugía, quitar el LDF del cráneo y sutura de la herida usando soluble sutura 6-0.
4. postoperatorio cuidado
- Coloque el animal en una jaula de recuperación precalentado (situada en una estante/estera caliente a 35 ° C, o dentro de una cámara climatizada).
Nota: Los investigadores pueden preferir utilizar otras temperaturas y duraciones según práctica local. - Prever todos los animales con 200 μL de SC. precalentado 0.9% NaCl solución salina inmediatamente posterior a la operación, post operación de 4 h y 2 x diario 72 h.
Nota: La administración de precalentado 0.9% NaCl es animal conducido. Si más se requiere, se pueden administrar más líquidos para asegurar una buena recuperación. - En la jaula de recuperación, dar el acceso irrestricto de los animales a dieta húmeda pellets, pastillas de dieta seco, gel de rehidratación y gel de alimentos, junto con acceso ad libitum al agua.
- Repetir la inyección de carprofeno SC. en después de la operación 24 h (véase el paso 2.3).
Nota: Todos los animales recibieron la misma dosis de carprofeno; cualquier efecto neuroprotector es probable que sea insignificante. - A intervalos regulares durante 48 h, realizar mueca después de la operación ratón anotando17 para evaluar los niveles de dolor para ayudar a la decisión de administrar más analgesia.
- Pesar los animales inmediatamente antes de la cirugía y luego diariamente siguiendo el procedimiento. Realizar observaciones diarias y hojas de bienestar completa para controlar su alimentación y la ingesta de agua y signos clínicos.
- Realizar observaciones funcionales en 24 h y 48 h post operación. Evaluar los ratones en una escala de déficit focal. Evaluar su simetría corporal obligatorio dando vueltas, paso, rejilla de 45 º escalada, que comportamiento, asimetría de extremidad delantera y barba touch respuesta18,19,20.
5. resonancia magnética nuclear y tratamiento de la imagen
- Medir el volumen de la lesión (LV) con la proyección de imagen de resonancia magnética estructural (MRI).
Nota: Métodos alternativos, como tinción histológica con el cloruro de triphenyltetrazolium (TTC), se han utilizado previamente y se correlacionan con datos estructurales de MRI. Sin embargo, este método puede ser utilizado al final de un estudio y no longitudinalmente. Uso de resonancia longitudinal reducirá el número de animales requeridos para un estudio.- Después de 48 h, después de la inducción de MCAO, anestesiar el ratón con isoflurano (5% de isoflurano en 1 L/min de O2 de inducción), isoflurane 1.5 – 2% para mantenimiento.
- Transferir el ratón a la cuna de MRI, coloque el sensor de respiración para el control de su ritmo respiratorio e implantar la sonda de temperatura rectal para monitorear la temperatura durante la exploración. Lugar la RF de 2 canales ratón cerebro recibir bobina sobre el cerebro una señal y lugar la cuna en un 9.4 T horizontal agujero del escáner.
Nota: Aquí, una bobina de volumen con un diámetro de 72 mm interno fue utilizada para la transmisión de RF. - Adquirir escaneos de T2-weighted con una secuencia de eco de la vuelta rápida. Configurar el tiempo de repetición (TR) a 3.000 ms y el tiempo de Eco (TE) a 40 Sra. uso 18 mm x 18 mm como el campo de visión (FOV) y obtener una matriz de 256 x 256 adquisición con láminas de 18 mm x 0,8 mm y los tres promedios de señal en aproximadamente 10 minutos.
- Adquirir imágenes de tensor de difusión (DTI) utilizando una secuencia de eco de la vuelta rápida. Establecer el TR a 1.730 m, el TE a 35 ms, el FOV de 20 mm x 20 mm y obtener una matriz de 128 x 128 adquisición con láminas de 16 mm x 1 mm, dos promedios de señal, 14 direcciones codificación de difusión y una máxima b-valor de 1.024 s/mm2.
- Medida de el LV en las imágenes de T2-weighted con una pantalla de imagen y paquete de software de medición. Medir el área de lesionados, cotejando los valores para calcular el volumen total de la lesión teniendo en cuenta el grosor de corte de MRI (establecido durante la exploración de MRI).
- Tener en cuenta cualquier hinchazón y el porcentaje de volúmenes de lesión del área durante la medición los hemisferios completo contralaterales e ipsolaterales. Correcta para cualquier cerebro inflamación debido al edema utilizando un método indirecto para medir el volumen de la lesión como se ha descrito anteriormente21,22. Sólo incluir sectores que contienen tejido de la corteza y no del lóbulo frontal o tejido del cerebelo según un atlas del cerebro de ratón estándar para evitar la sobrecorrección.
- Medir los parámetros de difusión de la lesión y obtener las regiones central y penumbra de interés.
- Generar los mapas de anisotropía fraccional (FA) y del coeficiente de difusión aparente (ADC) de las imágenes de tensor de difusión usando software apropiado de análisis de MRI.
- Alinear las imágenes DTI con las imágenes de T2-weighted usando software de análisis de imagen apropiada capaz de realizar un registro lineal de imágenes. Tras el registro, restar las máscaras de la lesión de difusión-cargada (núcleo isquémico) las máscaras de lesión T2-weighted (núcleo isquémico y penumbra) para estimar la región de penumbra. Se aplican las máscaras resultantes (base y penumbra) a los mapas de ADC y FA para cuantificar los parámetros de difusión dentro de la base y la penumbra.
- Traducir el núcleo ipsilateral y las máscaras de penumbra sobre la línea media del cerebro con el fin de obtener los valores de ADC y FA contralaterales para la comparación.
Resultados
Un total de 24 adultos C57BL/6 ratones machos, pesan entre 24-31 g en el momento de la cirugía, fueron utilizados en el estudio. Un animal murió tras oclusión de la arteria cerebral media (MCAO) y uno fue excluido debido a complicaciones quirúrgicas. Los datos presentados aquí son tomados de un trabajo previamente publicado por los autores. Éstos fueron utilizados para ilustrar el efecto de la reparación del buque en MCAO resultados11. Todos los datos se expresan como media ± desviación típica thr. Los datos fueron evaluados estadísticamente para la normalidad mediante la prueba de normalidad de omnibus D'Agostino-Pearson. Datos paramétricos se compararon mediante de Student t-test (para dos medios) y una vía ANOVA con la prueba de Sidak (múltiples medios). Datos no-paramétricos se compararon mediante la prueba U de Mann-Whitney. La variabilidad de los datos paramétricos se evaluó mediante una F-ensayo, y variabilidad de los datos no paramétricos se evaluó mediante la prueba de Levene.
Por lo general, en procedimientos MCAO, el filamento de oclusión se inserta en el CCA y la cepa es ligarse para impedir este filamento que paso en el ECA, en lugar de la ACI. Una evitación de la ligadura de la cepa y la adición de analgesia mostraron una tendencia hacia la pérdida de peso reducida a 48 h post-MCAO, comparados con datos de anteriores estudios realizados por el mismo cirujano para el mismo tiempo MCAO con ligadura de la cepa no analgesia, mientras que el LV aparecían inafectados, vea la figura 1.
Ratones experimentaron una isquemia inducida por MCAO 60 min., seguida de reperfusión con reparación de buque CCA o con la ligadura típica del enfoque CCA. En figura 2se muestra un esquema del CCA reparado ligado y unligated.
Flujometría Doppler láser fue utilizada para confirmar el flujo perfusión de la sangre en el territorio de la MCA en MCAO, antes y después de la reparación del buque CCA. Figura 3 muestra 5 minutos después de la extirpación del filamento, el flujo de sangre cerebral regional (rCBF) aumentado significativamente en la región del cerebro de la MCA. La perfusión se mantuvo hasta la reparación de buques, con un aumento en la perfusión en el territorio del MCA que se muestra después de la reparación del buque CCA, lo que sugiere que la reparación CCA permite una perfusión de sangre creciente al territorio isquémico frente a la dependencia en el círculo de Willis solo.
T2-weighted MRI se utilizó para determinar el total LV, y DTI exploraciones fueron utilizadas para determinar la base del LV, 48 h después de la MCAO. Figura 4A no muestra ninguna diferencia significativa en el LV total o núcleo entre los grupos de procedimiento ligados y reparación. Sin embargo, la variabilidad de los datos para ambos total y base LV, evaluada mediante test de Lavene para no paramétrica o el F-test para datos paramétricos, se redujo significativamente en el grupo de reparación CCA. El LV total se desglosan en LV cortical y subcortical, como se muestra en la Figura 4B. La porción cortical fue significativamente menos variable en el grupo de reparación CCA, mientras que la porción sub cortical de la lesión fue afectada entre los dos grupos de procedimientos.
Un análisis indica que menos animales por grupo de tratamiento sería necesarios para demostrar una reducción del 30% en VI después de MCAO utilizando CCA reparación versus el procedimiento típico de ligarse por el CCA, vea la tabla 1. Una asunción de la energía 1-β = 0.8 y nivel de significación α = 0.05 y una predicción de la reducción de 30% en VI entre el hipotético control y prueba de grupos fueron utilizados para el análisis de poder. Además, se asumió una varianza igual entre los grupos. La tabla 1 muestra el número de animales necesarios para la prueba y los grupos de control cuando se utiliza o el método CCA ligada típico o el método de reparación CCA actualizado, como se describe aquí, se utiliza. Tenga en cuenta que el grupo de prueba se refiere a un hipotético grupo tratado de animales y el grupo de control se refiere a un grupo hipotético control; ambos grupos experimentaría MCAO.
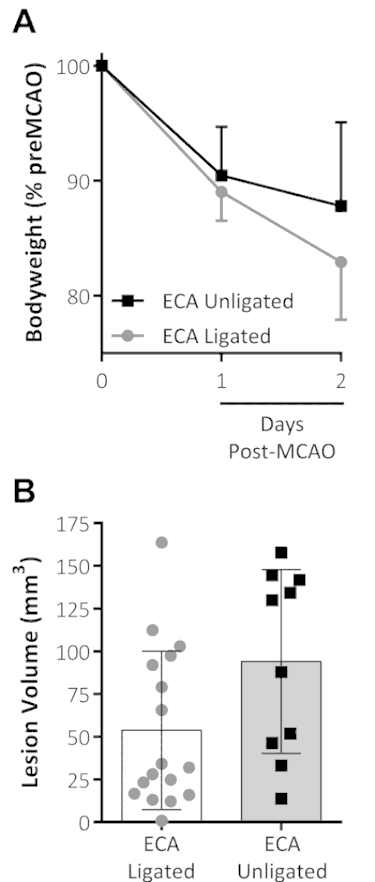
Figura 1: combinado tratamiento analgesia y la omisión de la ligadura de la cepa en los resultados después de MCAO. (A) de peso corporal, se muestra como un porcentaje del peso pre-MCAO, disminuyó los primeros 2 d después de MCAO para ambos grupos. El grupo cepa unligated (tratados con analgesia con ninguna ligadura de cepa en MCAO) mostró una tendencia hacia la pérdida de peso reducido en el segundo día tras el MCAO. (B) este panel muestra el volumen de la lesión (mm3) medido por el estándar triphenyltetrazolium cloruro (TTC) coloración 48 h después de la MCAO. Los datos son la media ± desviación estándar. Ligada de ECA: n = 17, cepa unligated: n = 10. Esta figura ha sido modificada desde Lucas Trotman et al. 11. por favor haga clic aquí para ver una versión más grande de esta figura.
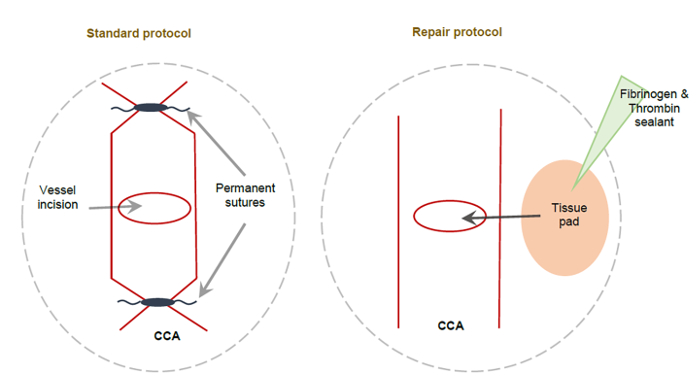
Figura 2: esquema que muestra el método estándar de la CCA y la CCA alternativo reparación método MCAO. (A) este esquema representa un CCA permanentemente ligado utilizando suturas no absorbibles aplicadas a ambos lados de la incisión de la CCA, dando por resultado la ligadura permanente de la CCA derecha. (B) este esquema describe el método de reparación alternativo de CCA. Una almohadilla de tejido pequeño cubierto con el fibrinógeno y sellador de trombina se utiliza para cubrir la incisión de la CCA, sellándolo para permitir la perfusión completa del derecho de CCA. Esta figura ha sido modificada desde Lucas Trotman et al. 11. por favor haga clic aquí para ver una versión más grande de esta figura.
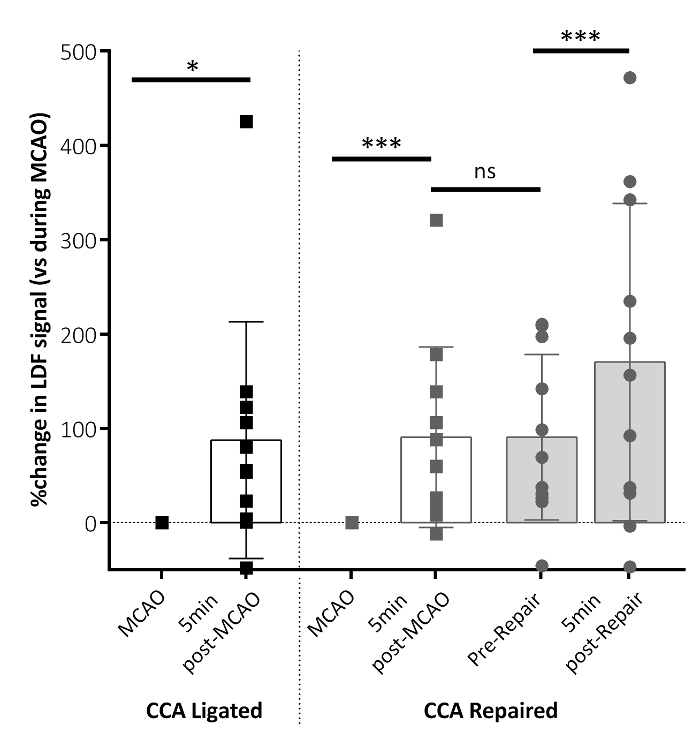
Figura 3: parámetros de flujo (rCBF) de sangre cerebral Regional después de MCAO. El rCBF cambió 5 min después de la retirada del filamento MCAO para ambos el ligarse de CCA y reparado CCA grupos (post-MCAO), en relación con el rCBF medido durante MCAO. Este panel muestra los datos de rCBF inmediatamente antes de la reparación de buque CCA (la reparación) y 5 min después de la reparación de la CCA (reparación posterior). Aumentos significativos en el rCBF aparecen 5 min después del retiro del filamento (post-MCAO) en ambos grupos. Un incremento adicional en el rCBF aparece después de la reparación de la CCA (reparación posterior) en el grupo de reparación CCA. Ninguna diferencia en el rCBF aparece entre 5 min post-MCAO y reparación previa. Los datos mostrados se condensan desde el curso del tiempo datos informes momentos clave, aquí como la media ± desviación estándar. CCA ligada: n = 10, CCA reparado: n = 10; P < 0.01, ***P < 0.001, ns: no significativo. Esta figura ha sido modificada desde Lucas Trotman et al. 11. por favor haga clic aquí para ver una versión más grande de esta figura.
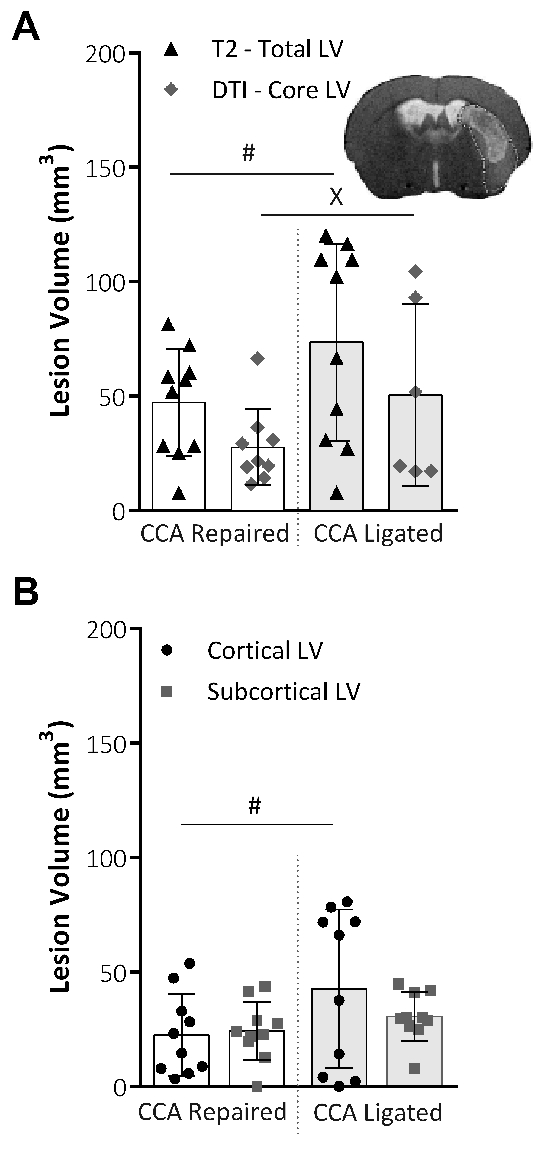
Figura 4: análisis del volumen de lesión obtienen por técnicas de MRI. (A) este panel muestra el volumen de la lesión (LV; mm3) a las 48 h después de MCAO, LV total tomado de imágenes de T2-weighted MRI (LV Total) y el LV de núcleo de DTI exploraciones y análisis (LV base). Imágenes representativas muestran el volumen total de la lesión de una exploración T2 slice imagen con la máscara de volumen de lesión núcleo DTI aplicada. La variabilidad dentro de los grupos se redujo significativamente para ambas total LV (P = 0.015, reparación CCA: n = 10, CCA ligada: n = 10, F-test) y el núcleo del LV (P = 0.043, reparación CCA: n = 9, CCA ligada: n = 6, prueba de Lavene), evaluó mediante una F-ensayo para datos paramétricos o prueba de Levene para datos no paramétricos. (B) este panel muestra el LV a las 48 h después de MCAO, tomado de las imágenes de T2-weighted MRI y dividida en zonas de lesión cortical y subcortical. La reparación CCA redujo significativamente la variabilidad de los datos (P = 0,03, F-test) en la porción cortical de la lesión, pero ningún efecto sobre los datos se muestra variabilidad en la porción subcortical de la lesión. Reparación CCA: n = 10, CCA ligada: n = 10. Los datos son la media ± desviación estándar. # P < 0.05 (F-test), xP < 0.05 (prueba de Lavene). Esta figura ha sido modificada desde Lucas Trotman et al. 11. por favor haga clic aquí para ver una versión más grande de esta figura.
| Enfoque | Volumen de la lesión (Mm3, LV; media ± d.e.) | Energía | Nivel de significancia | Anticiapted diferencia | Tamaño de grupo necesaria |
| CCA ligada (enfoque tradicional) | 94.08 ± 53.79 | 0,8 | 0.05 | 30% | n = 58 |
| CCA reparado (nuevo enfoque) | 51.73 ± 22.78 | 0,8 | 0.05 | 30% | n = 35 |
Tabla 1: Representante análisis comparando la ligadura CCA tradicional con la alternativa CCA reparación método explicado aquí. Esta tabla muestra la potencia del análisis realizado para calcular el tamaño de grupo anticipado requerido para detectar una diferencia significativa en el LV entre un grupo de control, el enfoque tradicional o alternativo (nuevo) y un grupo de prueba (predicho). La tabla muestra los tamaños del grupo como necesaria si se supone una potencia de 0,8, se aplica un nivel de significancia de 0.05, y si el grupo de prueba prevista muestra una diferencia de 30% en el LV en comparación con el grupo de control. La tabla muestra los resultados de ambos enfoques MCAO (CCA-ligarse y reparado el CCA) para determinar si existe una diferencia en el número de animales necesarios para obtener una diferencia de 30% en VI. Para ambos métodos, se supone una varianza igual entre la prueba y el grupo control. Esta figura ha sido modificada desde Lucas Trotman et al. 11.
Discusión
Inducción de filamento de MCAO transitorio en roedores es el más frecuentemente usado modelo experimental de movimiento, ya que permite reperfusión en el área afectada, mímico la ocurrencia de eventos de accidente cerebrovascular isquémico clínico7. Aquí es una alternativa quirúrgica para el método tradicional de MCAO transitorio filamento-inducida en ratones. El enfoque alternativo, con tratamiento de analgesia, cepa ligadura evitación y reparación de la incisión del CCA, se traduce en una variabilidad reducida de LV cuando se evaluó mediante resonancia magnética y de métodos tinción histológica11.
Los enfoques tradicionales para inducir MCAO en gran medida se basan en el corte transversal, o en la ligadura por lo menos, de la cepa, que se ha demostrado, en ratas, que afectan el comportamiento de beber y un aumento en la pérdida de peso después de la MCAO14. El protocolo definido aquí, en ratones, con la evitación de la ligadura de la cepa y además analgesia, sugirió una reducción en la pérdida de peso después de MCAO con ningún efecto sobre el volumen de la lesión. El uso de la analgesia es evitar, o al menos no registrado, en la mayoría de los estudios experimentales de la carrera, debido a posibles efectos de confusión sobre los resultados experimentales. Sin embargo, evitando completamente la analgesia no siempre está justificado y es necesario para equilibrar las necesidades de bienestar de los animales con el logro de los objetivos científicos.
Diferencias en el tamaño del animal, cepa y anatomía cerebrovascular, además de variaciones de tamaño y el tipo de filamento, se proponen influir en tiempos resultados23,24. El enfoque alternativo descrito aquí evita la dependencia de la vaca durante la reperfusión, reduciendo así, al menos en parte, la variabilidad entre animales en el volumen de la lesión. Anatomía de la vaca es muy variable en los ratones, en particular en la C57BL /6 cepa, que a menudo se utiliza en estudios experimentales de la carrera. 90% de ratones C57BL/6 tienen una vaca incompleta debido a una variada posterior comunicación arteria (PcomA) la permeabilidad, que puede tener un efecto sobre el volumen de daño isquémico debido a la insuficiente perfusión de estructuras fuera del territorio MCA13, 25. reparación de la CCA en los ratones, como se muestra aquí, se traduce en el restablecimiento de la sangre flujo a través de la CCA en el área isquémico, como se ha descrito en ratas15. Los datos representativos aquí muestran que la reparación de la CCA aumenta la reperfusión, aunque el flujo de sangre en el CCA no se midió directamente. Sin embargo, es posible que el cirujano pueda visualizar la reperfuse CCA con sangre después de la reparación del buque, como vuelve a un estado completo y pulsante a lo largo del tronco, proximal y distal a la localización de la reparación. Esta confirmación visual, junto con las lecturas de flujometría Doppler láser de la zona isquémica, puede utilizarse para confirmar la reparación exitosa de la nave. El tiempo entre la aplicación de la almohadilla de tejido y la eliminación del gancho del buque de la CCA puede tener un impacto sobre la permeabilidad resultante de la CCA, como reducir el tiempo entre la aplicación de la almohadilla de tejido y la eliminación de clip evitará la almohadilla de tejido adherido o frente lado del CCA. Aunque técnicamente difícil, el procedimiento alternativo de MCAO explicado aquí no requiere de ninguna habilidad adicional que los requeridos para llevar a cabo la inducción quirúrgica de MCAO en ratones.
Tradicionalmente asociados con una alta variabilidad en las medidas de resultado, los estudios experimentales de la carrera tenga una tendencia a ser underpowered. Requisitos éticos y de bienestar en combinación con las preocupaciones económicas y práctica pueden contribuir a estudios siendo underpowered. Reduciendo la variabilidad en el resultado y, por lo tanto, producir resultados de lesión más consistentes a través de un grupo experimental, se pueden realizar cálculos de energía más eficaces con el objetivo de los estudios adecuadamente alimentada.
En conclusión, este procedimiento de reparación alternativo del CCA, en ratones, produce menos variabilidad en el volumen de la lesión siguiendo el trazo experimental y cálculos de energía más pequeños grupos experimentales permite que se requerirán para las pruebas de un efecto del tratamiento cuando corresponda se utilizan.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el centro nacional para el reemplazo, el refinamiento y la reducción de animales en investigación (NC3Rs; NC/M000117/1 a CG). Los autores agradecen al personal de la división de servicios biomédicos de la Universidad de Leicester, por su cuidado de los animales de experimentación y Maria Viskaduraki por su asesoría estadística. Resultados representativos están adaptados con autorización de modelos de la enfermedad y mecanismos de11.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.7 mm flexible single fibre optic probe | Moor Instruments, UK | P10d | Use with master probe code: VP10M200ST |
| 7-0 silicone coated monofilament | Doccol, USA | 701956PKRe | Item dependent on animal size and weight - use manufacteurer guidelines. Product code here was used for representative results shown in article. |
| 9.4T Preclinical MRI system | Agilent Technologies, Santa Clara, California, USA | MY11520101 | Equipped with gradient and RF coils suitable for mouse brain imaging |
| Animal monitoring and gating equipment | SA Instruments, Stony Brook, New York, USA | 22124005 | MRI compatible temperature and respiration monitoring |
| Bupivacaine | National Veterinary Services, Stoke-on-trent, UK | 512345 | Marcaine |
| C57BL/6 Mice | Charles River, Oxford, UK | B6JSIMA49D | |
| Carprofen | Norbrook Laboratories | 143658 | Carprieve 5% w/v Small animal solution for injection |
| Chlorhexidine 4% hand cleanser solution | VWR International Ltd, Lutterworth, UK | MOLN10008780 | HibiScrub Antimicrobial hand cleanser, Molnlycke Health Care |
| Cotton buds | National Veterinary Services, Stoke-on-trent, UK | 213512 | Any plastic body, cotton bud tip are suitable once made sterile by autoclaving. |
| Dissecting stereoscope | Carl Zeiss | OPMI99 | Resident piece of equipment. Any binocular dissecting stereoscope capable of x1-x5 magnification will be suitable. |
| dissolvable 6-0 sutures | National Veterinary Services, Stoke-on-trent, UK | 9544 | Absorbable Sutures Ethicon Coated Vicryl 6/0 (Ethicon code: W9981) |
| Donut probe holder | Moor Instruments, UK | PHDO | Probe holder for mouse, required to be used with single fibre optic probe when used with laser doppler flowmtry machine. |
| dumont #5 forceps | World Precision Instruments, Hertfordshire, UK | 500342 | |
| Fibrinogen and thrombin sealant | Baxter, Berkshire, UK | 1502243 | TISSEEL Ready to use solutions for Sealant 2 mL |
| Gel food | Datesand group, Manchester, UK | 72065022 | Diet Gel Recovery |
| Image display and measuring software package | 3D Slicer | https://www.slicer.org/ | Version 4.0 |
| Image display and measuring software package | NIH, Maryland, USA | https://imagej.nih.gov/ij/index.html | NIH/ImageJ |
| LDF monitor | Moor Instruments, UK | moorVMS-LDF | |
| micro vannas scissors | InterFocus Ltd, Linton, UK | 15000-08 | Other microvannas spring scissors can be used as an alternative, although fine tips are required. |
| Microvascular clip | World Precision Instruments, Hertfordshire, UK | 15911 | 10 G Vessel Clip |
| microvascular clip holders | World Precision Instruments, Hertfordshire, UK | 14189 | |
| MRI acquisition and analysis software | Agilent Technologies, Santa Clara, California, USA | VnmrJ Version 4.2 | Revision A |
| no. 15 scalpel | Scientific Laboratory Supplies, Nottingham, UK | INS4678 | Sterile No15 Scalpel - manufactuer number P305. Other suppliers are available. |
| Non-disolvable 6-0 suture | National Veterinary Services, Stoke-on-trent, UK | W529 | Ethicon Mersilk Sutures |
| Ocular lubricant | National Veterinary Services, Stoke-on-trent, UK | 847288 | Lacrilube (5100G13) |
| Optical matching gel | Moor Instruments, UK | PMG | |
| Pulse Oximetry Reader | Starr Life Sciences Corp., Oakmont, PA, USA | MouseOx | MouseOx - rat & mouse pulse oximeter & physiological monitor Use with mouse thigh sensor. |
| Rehydration gel | Datesand group, Manchester, UK | 70015022 | HydroGel |
| Small hair clippers | vetproductsuk.com | HS61 | Contura Cordless trimmer/clippers |
| Sterile 0.9 % NaCl Solution | VWR International Ltd, Lutterworth, UK | LOCA3528286 | SODIUM CHLORIDE 0.9% W/V INTRAVENOUS INFUSION BP 500 ML IN ECOFLAC½ PLUS |
| sterile Petri dish | VWR International Ltd, Lutterworth, UK | 5168021 | 50 mm sterile Petri dish. Any brand is suitable. Minimum 50 mm diameter is required. |
| Topical tissue adhesive | World Precision Instruments, Hertfordshire, UK | 503763 | GLUture topical Tissue Adhesive |
| Waterproof superglue | Loctite | Loctite Superglue Precision Max | Available at most hardware shops. |
| White paper chip | Datesand group, Manchester, UK | CS1BPB | Pure-O'Cel |
Referencias
- O'Collins, V. E., et al. 1,026 Experimental treatments in acute stroke. Annals of Neurology. 59 (3), 467-477 (2006).
- Sutherland, B. A., et al. Neuroprotection for Ischaemic Stroke: Translation from the Bench to the Bedside. International Journal of Stroke. 7 (5), 407-418 (2012).
- Reeves, M. J., et al. Acute Stroke Care in the US: Results from 4 Pilot Prototypes of the Paul Coverdell National Acute Stroke Registry. Stroke. 36 (6), 1232-1240 (2005).
- Wardlaw, J. M., Murray, V., Berge, E., del Zoppo, G. J. Thrombolysis for acute ischaemic stroke. Cochrane Database of Systematic Reviews. (7), CD000213 (2014).
- Pangalos, M. N., Schechter, L. E., Hurko, O. Drug development for CNS disorders: strategies for balancing risk and reducing attrition. Nature Reviews Drug Discovery. 6 (7), 521-532 (2007).
- Hossmann, K. A. Pathophysiological basis of translational stroke research. Folia Neuropathologica. 47 (3), 213-227 (2009).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-289 (1992).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRX. 2 (3), 396-409 (2005).
- Dirnagl, U. Bench to Bedside: The Quest for Quality in Experimental Stroke Research. Journal of Cerebral Blood Flow & Metabolism. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: a meta-analysis. Scientific Reports. 6, 21086 (2016).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Macrae, I. M. Preclinical stroke research - advantages and disadvantages of the most common rodent models of focal ischaemia. British Journal of Pharmacology. 164 (4), 1062-1078 (2011).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Research. 997 (1), 15-23 (2004).
- Trueman, R. C., et al. A Critical Re-Examination of the Intraluminal Filament MCAO Model: Impact of External Carotid Artery Transection. Translational Stroke Research. 2 (4), 651-661 (2011).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Experimental Neurology. 195 (2), 372-378 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. Plos Biology. 8 (6), e1000412 (2010).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-479 (2010).
- Orsini, F., et al. Targeting Mannose-Binding Lectin Confers Long-Lasting Protection With a Surprisingly Wide Therapeutic Window in Cerebral Ischemia. Circulation. 126 (12), 1484-1494 (2012).
- Simoni, M. G. D., et al. Neuroprotection by Complement (C1) Inhibitor in Mouse Transient Brain Ischemia. Journal of Cerebral Blood Flow & Metabolism. 23 (2), 232-239 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline Treatment for Experimental Intracerebral Hemorrhage in Mice. Stroke. 29 (10), 2136-2140 (1998).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of Brain Edema on Infarct Volume in a Focal Cerebral-Ischemia Model in Rats. Stroke. 24 (1), 117-121 (1993).
- Loihl, A. K., Asensio, V., Campbell, I. L., Murphy, S. Expression of nitric oxide synthase (NOS)-2 following permanent focal ischemia and the role of nitric oxide in infarct generation in male, female and NOS-2 gene-deficient mice. Brain Research. 830 (1), 155-164 (1999).
- Connolly, E. S., Winfree, C. J., Stern, D. M., Solomon, R. A., Pinsky, D. J. Procedural and strain-related variables significantly affect outcome in a murine model of focal cerebral ischemia. Neurosurgery. 38 (3), 523-531 (1996).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse Strain Differences in Susceptibility to Cerebral Ischemia are Related to Cerebral Vascular Anatomy. Journal of Cerebral Blood Flow & Metabolism. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral Ischemia after Bilateral Carotid Artery Occlusion and Intraluminal Suture Occlusion in Mice: Evaluation of the Patency of the Posterior Communicating Artery. Journal of Cerebral Blood Flow & Metabolism. 18 (5), 570-579 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados