Method Article
Occlusion de l’artère cérébrale moyenne permettant une Reperfusion par l’intermédiaire de réparation de l’artère carotide commune chez les souris
Dans cet article
Résumé
Intraluminale filament une occlusion de l’artère cérébrale moyenne est le modèle le plus souvent utilisé en vivo d’accidents cérébrovasculaires chez les rongeurs. Une autre approche chirurgicale pour permettre la réparation de l’artère carotide commune est effectuée ici, qui permet à la reperfusion de l’artère carotide commune et une reperfusion intégrale sur le territoire de l’artère cérébrale moyenne.
Résumé
L’accident vasculaire cérébral ischémique est une cause majeure d’invalidité de longue durée adulte et de décès dans le monde. Les traitements actuels disponibles sont limités, avec seulement activateur tissulaire du plasminogène (tPA) comme un traitement de médicament approuvé pour cibler les accidents vasculaires cérébraux ischémiques. Les recherches actuelles dans le domaine des AVC ischémique met l’accent sur la meilleure compréhension de la physiopathologie des accidents vasculaires cérébraux, de développer et d’enquêter sur nouvelles cibles pharmaceutiques. Modèles temps expérimentales fiables sont indispensables à la progression des traitements potentiels. Le modèle de l’occlusion (OACM) artère cérébrale moyenne est cliniquement significatif et le plus fréquemment utilisé modèle chirurgical d’AVC ischémique chez les rongeurs. Toutefois, les résultats de ce modèle, comme le volume de la lésion, sont associés à des niveaux élevés de variabilité, notamment chez les souris. L’autre modèle OACM décrit ici permet la reperfusion de l’artère carotide commune (CCA) et la perfusion accrue du territoire artère cérébrale moyenne (MCA), à l’aide d’un tampon de tissu avec mastic axée sur le fibrinogène pour réparer le navire et l’amélioration bien-être des souris en évitant la ligature de l’artère carotide externe (CEA). Cela réduit la dépendance sur le cercle de Willis, qui est connu pour être très anatomiquement variable chez les souris. Données représentatives montrent que l’utilisation de cette approche chirurgicale alternative diminue la variabilité des volumes de lésion entre l’approche traditionnelle d’OACM et l’approche alternative décrite ici.
Introduction
Une cause majeure de maladies cérébrales est l’ischémie dans le territoire de l’artère cérébrale moyenne. L’activateur tissulaire du plasminogène (tPA) est le traitement pharmacologique uniquement disponible avec une efficacité prouvée, malgré de nombreux essais cliniques de médicaments destinés aux accidents vasculaires cérébraux ischémiques1,2. Toutefois, en raison de problèmes de sécurité et une fenêtre thérapeutique étroite (4,5 h <), seulement environ 15 % de tous les AVC sont admissibles à recevoir le tPA, et le taux de reperméabilisation peut être < 50 %3,4.
Reproductibles et cliniquement pertinentes des modèles animaux de trait sont jugés essentiels pour éclairer l’élaboration de traitements thérapeutiques nouveaux et potentiels accidents vasculaires cérébraux. Toutefois, en raison de préoccupations au sujet de la cohérence et de la variabilité dans les résultats avec des modèles animaux, il demeure important d’affiner les modèles in vivo existants afin d’améliorer la traduction des études précliniques à la clinique. L’absence de traduction de l’efficacité expérimentale préclinique des traitements potentiels à usage clinique est une préoccupation constante pour les accidents vasculaires cérébraux recherche5. Raisons de l’échec de la traduction sont susceptibles d’être multiples et peuvent concerner, par exemple, la conception d’essais, les retards de traitement, hétérogénéité clinique de course, et les limitations des modèles animaux utilisés6. Un défi majeur pour la recherche sur les AVC reste le développement de traitements sûrs et efficaces.
Occlusion de l’artère cérébrale moyenne (OACM) par insertion de filaments intraluminale est le modèle rongeur le plus souvent utilisé en vivo d’accidents cérébrovasculaires. Ce modèle permet la restauration de la circulation sanguine après une induction de l’ischémie, imitant les événements qui surviennent en course humaine7. Cependant, en particulier chez les souris, volumes de lésion hétérogène avec des écarts-types variés se produisent bien que défini protocoles chirurgicaux sont appliquées8,9,10. Il est courant de voir une distribution bimodale de striatale petit et grands circuits striato-cortical lésion volumes11. Pour provoquer une ischémie, le filament est généralement inséré par une incision du CCA ou du CEA qui restent ensuite ligaturé en permanence12. La ligature permanente du CCA empêche le rétablissement du flux sanguin dans l’artère carotide interne (ICA) et, par la suite, le territoire MCA. Cela provoque une reperfusion être tributaire de l’alimentation collatérale dans le cercle de Willis (vache). La structure de la vache a une variabilité anatomique entre individus, en particulier chez C57BL/6 souris-a souche typiquement utilisé dans in vivo AVC recherche13. Une autre méthode, de l’insertion du filament par le biais de la Cour des comptes, permet la perfusion continue par le biais de la CCA, mais ce compromis méthode l’apport artériel vers le territoire de la CEA, qui a été montré, chez le rat, d’avoir un effet néfaste sur l’animal 14de bien-être.
La dépendance sur la vache pour fourniture collatéraux et reperfusion dans le modèle OACM établie pourrait expliquer en partie la variabilité de volume de lésion suite à l’occlusion. Nous décrivons une procédure chirurgicale murine alternative où la ligature de la CEA est évitée et l’incision de la CCA est réparée, ce qui permet de ré-perfusion par le biais de la CCA, indépendante de la vache. La réparation de l’incision de la CCA a été précédemment démontrée chez le rat causera une reperfusion avec succès par le biais de la CCA15. Nous ont appliqué cette approche avec succès à souris11 et rapportons le protocole qui se traduit par une variabilité réduite en volume de la lésion, le critère d’évaluation principal utilisé dans les études d’accidents cérébrovasculaires.
Dans ce protocole, nous montrent comment entreprendre OACM par insertion de filaments de navire CCA suivie de réparation de navire CCA, qui implique une application de tissu pad et mastic pour permettre de reperfusion.
Protocole
Le présent protocole et les données rapportées ont été effectuées conformément à la loi sur les animaux UK (procédures scientifiques), 1986 (Project license 60/4315) et suite à l’approbation éthique institutionnelle. Toutes les expériences sont déclarés conformément aux dispositions de l’Animal Research : signalement des In Vivo des expériences (arrivée) lignes directrices16.
1. préparation
- Familiariser les souris C57BL/6 mâles adultes aux soins postopératoires (p. ex., environnement, literie, aliments de récupération) au moins 48 h avant la chirurgie.
NOTE : Les animaux Post-OACM ont souvent du mal à manger et à boire après la chirurgie.- Pour éviter la perte de poids excessif après la chirurgie, acclimater les animaux à n’importe quel régime post-OACM par, par exemple, placer la réhydratation gel, gel alimentaire et boulettes de régime alimentaire normal/humide imbibé directement sur le plancher de la cage.
- Changer la litière de la cage pour la literie postopératoire, comme le morceau de papier blanc.
- Stériliser tous les instruments chirurgicaux avant de commencer la mise en place chirurgicale ou procédures.
- Ce faire à l’autoclave, les outils (avec un minimum de 121 ° C, pression de 15 psi, pendant 15 min) ou par l’utilisation de l’oxyde d’éthylène (en suivant les instructions du fabricant correct, pendant 8 à 10 h).
- Désinfecter toutes les surfaces avant mise en place de la procédure. Couvrir toutes les surfaces avec des draps chirurgicaux stériles ou autoclavé fleuret pour les éléments qui nécessitent un traitement pendant la chirurgie. Utiliser une technique aseptique pour la durée de la procédure.
NOTE : Autoclavé fleuret peut être utilisé pour couvrir les instruments ou les équipements qui doivent être tenus pendant la chirurgie. Utilisant des techniques et des gants stériles, la feuille peut être appliquée et, ensuite, l’élément peut être placé dans le champ stérile. Suite à cela, un changement de gant stérile sera nécessaire.
2. chirurgie d’Occlusion artère cérébrale moyenne
- Utilisez la souris C57BL/6 mâles adultes pesant 24 – 31 g au moment de la chirurgie. Induire l’anesthésie à l’isoflurane de 5 % à 2 L/min d’O2, dans une chambre de l’anesthésie en plastique rouge.
- Après l’induction, réduire l’isoflurane pour maintenir une profondeur adéquate de l’anesthésie pour la chirurgie (par exemple, 1,5 à 2 % à 70 % N2O230 % O2), envoyée par masque facial, combiné avec un système de piège pour abaisser le chirurgien exposition à l’isoflurane.
NOTE : l’oxyde nitreux (N2O2) utilisable en combinaison avec l’oxygène (O2) afin de réduire la quantité requise d’isoflurane pour une profondeur de l’anesthésie adéquate. - Administrer une analgésie systémique pré-opératoire [carprofène, 10 mg/kg sous-cutanée (SC)] et une anesthésie locale à l’incision du site peri-per-opératoire (bupivacaïne, sc. 2 mg/kg, dilués 01:10 dans la solution saline à 0,9 %).
- Administrer des fluides par voie intrapéritonéale (ip.) des injections de 200 µL de solution de NaCl 0,9 % stérile préchauffée pré-opératoire.
- Raser la fourrure du droit région temporale et la région ventrale cou à l’aide de petites tondeuses à exposer la peau. Désinfecter la zone chirurgicale de la peau, à l’aide d’une solution de chlorhexidine 5 % pendant 3 min. appliquer du lubrifiant oculaire sur les deux yeux, pour les empêcher de sécher pendant la chirurgie.
Remarque : Si nécessaire pour les lectures oxymétrie pulse à moniteur sang saturation en oxygène, la fréquence cardiaque et rythme respiratoire, utilisez crème dépilatoire pour effacer la patte des cheveux. Appliquer la crème à l’aide de coton propre des bourgeons et, après l’épilation, laver la zone avec la solution de chlorhexidine diluée. Effectuez cette étape dans une zone préopératoire pour minimiser le risque de la fourrure en vrac contamine le champ opératoire stérile. Les chercheurs préfèrent utiliser les autres préparations opératoire selon les usages locaux. - Transférer la souris dans la zone chirurgicale et placez-le en position couchée sur un tapis de chaleur homéothermes couvert par un drap stérile. Maintenir l’anesthésie par un cône de nez. Insérer une sonde rectale pour surveiller la température du corps de la souris et maintenir à 37,0 ± 0,6 ° C.
- Avant toute incisions chirurgicales, vérifier le réflexe de retrait de patte arrière et clignoter réflexe pour confirmer la profondeur de l’anesthésie.
- Attacher une sonde laser de débitmétrie Doppler (LDF) pour enregistrer le flux sanguin vers le territoire MCA.
- À l’aide d’un stéréoscope de dissection, faites une incision < 1 cm au point médian entre le œil droit et l’oreille sur la peau exposée de temporelle à l’aide d’un bistouri n ° 15. Carrément disséquer les tissus sous-jacents couvrant le crâne, doucement ce grattage de l’os et le séchage de la surface avec des coton-tiges stériles.
Remarque : Il faut ne pas d’endommager le muscle temporal. - S’emparer de la 0.7 mm, sonde unique fibre optique relié au moniteur LDF, couper son extrémité à l’aide d’un scalpel tranchant pour obtenir un bord plat, cela pousser au travers du support de sonde en forme de beignet et placez une petite quantité de gel de contrepartie optique à la fin de la fibre.
- Placez une petite quantité de colle super-adhésive imperméable autour du bord inférieur de la titulaire de la sonde ; permettre à ceci de partiellement sécher et devenir collante.
- Sécher le crâne au-dessus de l’os temporal et placez une petite quantité de colle tissu topique dans un cercle à l’os, juste assez pour que le titulaire de la sonde.
- Placez le support de sonde, avec la sonde optique de fibre déjà en place, sur ce domaine (latérale 6 mm et 2 mm distal de la bregma).
- Laisser la colle sécher ; une fois sec et attaché, commence l’enregistrement des données de la LDF.
- À l’aide d’un stéréoscope de dissection, faites une incision < 1 cm au point médian entre le œil droit et l’oreille sur la peau exposée de temporelle à l’aide d’un bistouri n ° 15. Carrément disséquer les tissus sous-jacents couvrant le crâne, doucement ce grattage de l’os et le séchage de la surface avec des coton-tiges stériles.
- Retournez délicatement l’animal pour une position en décubitus dorsal, en prenant soin d’appuyer la sonde Doppler laser et empêcher son détachement. Ruban adhésif doucement les deux pattes de devant vers le bas avec sparadrap microporeux, glisser une paire de coton bourgeons (ou quelque chose de similaire, tels que les pinces fermées) sous le cou pour soulever la région et créer des tensions. Couvrir la souris avec un drap stérile pour maintenir une couverture aseptique.
- Commencer la dissection et l’exposition du CCA.
- Faire une incision médiane de 1,5 cm sur le cou ventral exposé à l’aide d’une lame de bistouri Swann-Morton n° 15.
- À l’aide de techniques douces par dissection par clivage, rétracter doucement les glandes salivaires sur les côtés, exposant la trachée.
- Par dissection, disséquer la CCA contre les tissus environnants et le nerf vagal.
Remarque : Évitez de toucher le nerf vagal directement, comme des dommages au nerf vagal peuvent nuire à la mobilité, d’alimentation et de respiration.
- Passez deux sections de petite taille (2 cm) d’un non-dissolvable suture 6-0 au-dessous de la CCA, dorsale au navire et ventrale du nerf vagal. Dessiner une cravate de soie plus près au chirurgien et attacher solidement autour de la CCA (cravate proximal). Vaguement nouer la cravate de soie seconde (tie distale) vers la bifurcation de l’ICA/Cour des comptes.
- Pour commencer à isoler un article de la LCC, appliquer un clip microvasculaire juste au-dessus de la cravate distale mais n’entrave ne pas la bifurcation. À l’aide de micro ciseaux de Vannas, faire un petit trou dans le CCA.
Remarque : La Cour des comptes doivent rester brevet à tout moment. L’incision de la CCA doit être pas plus de 40 % de la largeur du navire et en position ventrale facilement accessible ; cela jouera un rôle important dans la réparation de navire stade post-OACM. - Insérez un monofilament de revêtement silicone 7-0 dans le CCA, avance vers le clip microvasculaire.
Remarque : La taille du filament doit être établie selon le poids de la souris avant la chirurgie ; se référer aux directives du fabricant.- Serrez l’attache distale, assez pour fixer le filament en place sans l’endommager. Retirer le clip microvasculaire en utilisant les supports de pince.
Remarque : Aucune perte de sang ne doit être considérée à ce stade. S’il y a un reflux sanguin, la cravate tenant le filament n’est pas assez serrée.
- Serrez l’attache distale, assez pour fixer le filament en place sans l’endommager. Retirer le clip microvasculaire en utilisant les supports de pince.
- Avancer le filament dans l’ICA.
- S’assurer que le filament demeure au sein de l’ICA et ne passe pas dans l’artère de pterygopalatine (PPA). Cela en soulevant légèrement et en tirant le bilan commun de pays, utilisant l’un des cravates en soie, à la face externe du corps de l’animal, et d’orienter le filament se plier devant l’ouverture face à l’interne de la LPP.
Remarque : Une fois avancée à l’origine de branche MCA, une baisse de la circulation sanguine relative dans le territoire de fournie sera visible sur les valeurs de la LDF ; Cela confirme le positionnement du filament.
- S’assurer que le filament demeure au sein de l’ICA et ne passe pas dans l’artère de pterygopalatine (PPA). Cela en soulevant légèrement et en tirant le bilan commun de pays, utilisant l’un des cravates en soie, à la face externe du corps de l’animal, et d’orienter le filament se plier devant l’ouverture face à l’interne de la LPP.
- Sécuriser le filament en place avec la cravate de soie distale, lier cela plus serré. Laissez-le en place pendant la durée de la période de l’occlusion.
NOTE : Dépendant sur les protocoles individuels, l’animal peut être déplacée à une cage de récupération, qui suit plaie à suturer, pour récupérer, ou reste sous anesthésie pendant la durée de la période de l’occlusion. Dans ce dernier cas, s’assurer que la plaie est empêchée de se dessécher à l’aide de 0,9 % NaCl physiologique préchauffée.
3. après occlusion
- À la fin de la période OACM, immédiatement se rétracter le filament, jusqu'à ce que la tête de filaments blancs est clairement visible.
- Ensuite, desserrez la CCA distale cravate juste assez pour retirer le filament tête plus grande partie de la voie hors du récipient.
Remarque : Le filament peut être entièrement enlevé à ce stade si le chirurgien est confiant avec vitesse de nouer la cravate distale pour éviter toute perte de sang. - Placez un clip microvasculaire en position horizontale vers la bifurcation de la CCA à côté de la cravate distale. Desserrer la cravate distale et retirez le filament entièrement. Ajouter un autre élément microvasculaire au-dessous de la cravate CCA proximal vers le chirurgien.
NOTE : S’assurer que le navire est assez loin dans les griffes de la pince afin d’éviter tout glissement. Le placement des clips est essentiel pour dissolvants de clip accès facile lors des étapes ultérieures. Les clips peuvent être utilisés pour aider à lever le navire afin de permettre un meilleur dégagement et mise en place du patch tissu, placer les clips horizontalement à travers les muscles environnants. - Retirer les deux cravates en soie à l’aide de pinces Dumont #5 ou micro ciseaux de Vannas soigneusement et séchez la zone à l’aide de bourgeons de coton stérile.
Remarque : Il faut ne pas de couper à travers/dans le vaisseau. - Dans une boîte de Petri stérile, ajouter fibrinogène et thrombine mastic solutions 1 et 2 (voir la Table des matières), assurant les deux substances restent séparées, prêt pour le mélange plus tard.
Remarque : Que de très faibles volumes des agents sont requis (< 0,25 mL chacune). Garder les solutions distinctes empêche une réaction prématurée entre les deux constituants. S’assurer que le bouchon est remplacé la même manière qu’elle a été enlevée pour éviter la contamination croisée des deux seringues, qui provoquerait l’agent à réagir et à définir dans la seringue. Avant utilisation, ranger les solutions à-20 ° C. Lorsque requis pour la première intervention chirurgicale, décongeler le produit d’étanchéité à la température ambiante. Ne pas recongeler le mastic ; Il doit rester à la température ambiante et peut être stocké de cette façon. La seringue peut être utilisée dans plusieurs chirurgies rendant rentable ; Cependant, nous recommandons de ne pas utiliser le même flacon pendant plus de 1 semaine pour éviter la contamination. - Utilisez une dissection émoussée le long du muscle avec pinces Dumont aucun 5 et micro ciseaux de Vannas pour obtenir une fine tranche ventrale du muscle sternocléidomastoïdien à utiliser pour la garniture de tissu, assurer la tranche est pas plus de 1 mm d’épaisseur et longe les fibres supérieurs du muscle.
Remarque : Ne pas couper à travers/à travers le muscle, car ceci nuira considérablement à sa fonction. Le tissu doit être assez grand pour couvrir l’incision de la CCA confortablement. - À l’aide de pinces Dumont #5, prendre la garniture tissu et mélanger le tissu uniformément à travers le fibrinogène et de thrombine deux solutions d’étanchéité, formant un canal entre les deux réactifs. La coagulation se produira rapidement ; dès que la coagulation commence, enlever la garniture de tissu à l’incision de la CCA. Placer le coussin tissu plat vers le bas avec une moyenne pression ferme et la pince ouverte.
- Rapidement enlever le clip microvasculaire distal tout en tenant délicatement la garniture de tissu en place.
Remarque : Cela permet à certains reflux sanguin pour activer davantage les réactifs de mastic de fibrinogène et de thrombine. Juste assez de pression est nécessaire pour maintenir le coussin en place, mais ne pas pour bloquer totalement le navire. - Lentement, alléger la pression de la garniture de tissu, permettant au sang de circuler dans la zone de l’incision. Maintenant, lentement et doucement, relâcher la pression du clip microvasculaire proximale et enlever complètement.
- NOTE : Afin d’assurer que le navire devient entièrement brevet, le placement de la garniture de tissu et le retrait des agrafes microvasculaires doivent avoir lieu rapidement pour empêcher la garniture tissu d’étanchéité à l’intérieur de la CCA. Toutefois, s’il y a une petite quantité de fuite de sang, replacer une légère pression sur le bloc de tissu pour laisser le temps pour la formation de caillots et étanchéité de se produire. Si la fuite de sang est importante ou le tampon de tissu ne semble pas être d’étanchéité, maintenir la pression pour éviter toute perte de sang et de remplacer les deux clips microvasculaires CCA pour isoler l’incision et de prévenir la perte de sang.
- Rapidement enlever le clip microvasculaire distal tout en tenant délicatement la garniture de tissu en place.
- Dans le cas où le coussin tissu ne pas assurer l’étanchéité du navire, une deuxième tentative est possible, suivant étapes 3.3 – 3.7.3.
- Une fois que le navire est scellé, suture de la plaie à l’aide de sutures dissolvable 6-0. Si l’enregistrement de la LDF s’est poursuivi tout au long de la chirurgie, retirez le crâne de la LDF et suture plaie à l’aide de dissolvable suture 6-0.
4. soins postopératoires
- Placer l’animal dans une cage de récupération préchauffée (située sur un plateau/mat chauffé à 35 ° C, ou dans une chambre chauffée).
Remarque : Les chercheurs préfèrent utiliser les autres températures et durées selon les usages locaux. - Fournir tous les animaux avec 200 µL de préchauffée sc. de saline NaCl à 0,9 % immédiatement après l’opération, à l’opération après 4 h et 2 x par jour pendant 72 h.
Remarque : L’administration de préchauffée 0,9 % NaCl est animal conduit. Si davantage est nécessaire, plus fluides peuvent être administrés afin d’assurer une bonne récupération. - Dans la cage de récupération, donne l’accès illimité des animaux à détrempé alimentation pellets, granulés de régime sec, gel de réhydratation et gel alimentaire, aux côtés de ad libitum accès à l’eau.
- Répéter l’injection sc. carprofène post-opération 24h (voir étape 2.3).
Remarque : Tous les animaux ont reçu la même dose de carprofen ; n’importe quel effet neuroprotecteur est susceptible d’être négligeable. - À intervalles réguliers pendant 48 h, effectuer la grimace post-opératoire souris marquant17 en vue d’évaluer les niveaux de douleur pour faciliter la décision d’administrer d’autres analgésie.
- Peser les animaux immédiatement avant la chirurgie et puis tous les jours suivant la procédure. Effectuer des observations quotidiennes et les feuilles de protection complète pour surveiller leur alimentation et de prise d’eau et de signes cliniques.
- S’engagent à 24h et 48 h après les opérations, les observations fonctionnelles. Évaluer les souris sur une échelle de déficit focal. Évaluer leur symétrie corps encerclant obligatoire, démarche, grille de 45°, escalade, encerclant le comportement, l’asymétrie de la branche avant et moustaches touch réponse18,19,20.
5. l’imagerie par résonance magnétique et traitement d’Image
- Mesurer le volume de la lésion (LV) à l’aide structurelle d’imagerie par résonance magnétique (IRM).
Remarque : Les méthodes alternatives, telles que la coloration histologique avec chlorure de triphényltétrazolium (CTT), avaient déjà été utilisés et sont corrélées aux données de l’IRM structurelles. Toutefois, cette méthode peut seulement être utilisée au point de terminaison d’une étude et pas longitudinalement. En utilisant longitudinal IRM permettra de réduire le nombre d’animaux requis pour une étude.- Après 48 h, après l’induction de l’OACM, anesthésier la souris à l’isoflurane (5 % isoflurane dans 1 L/min d’O2 pour l’induction), isoflurane de 1,5 à 2 % pour l’entretien.
- Transférer la souris vers le berceau de MRI, placez-le sur le capteur de respiration pour surveiller son rythme de la respiration et la sonde de température rectale pour surveiller sa température lors de la numérisation de l’implant. Place le cerveau de souris de 2 canaux RF recevoir bobine sur le cerveau un signal et place le berceau dans un 9,4 T horizontale alésage scanner.
NOTE : Ici, une bobine de volume avec un diamètre intérieur de 72 mm a été utilisée pour la transmission RF. - Acquérir les analyses pondérées en T2 à l’aide d’une séquence d’écho de spin rapide. Régler l’heure de répétition (TR) à 3 000 ms et le temps d’écho (TE) à Mme 40 utilisation 18 mm x 18 mm comme le champ de vision (FOV) et obtenir une matrice 256 x 256 acquisition avec des tranches de 18 mm x 0,8 mm et trois moyennes de signal en environ 10 min.
- Acquérir des images de tenseur de diffusion (DTI) en utilisant une séquence d’écho de spin rapide. Définir le TR à 1 730 ms, la TE à 35 ms, le champ de vision 20 mm x 20 mm et d’obtenir une matrice 128 x 128 acquisition avec des tranches de signal moyennes de 16 mm x 1 mm, deux 14 directives de codage de diffusion et un maximum de b-valeur de 1 024 s/mm2.
- Mesurer le LV sur les images pondérées en T2 utilisant un affichage de l’image et le progiciel de mesure. Mesurer l’aire lésé, collationner les valeurs ensemble pour calculer le volume de la lésion totale tout en tenant compte de l’épaisseur de tranche de MRI (fixé au cours de l’IRM).
- Prendre en compte toute enflure et le pourcentage du volume de la lésion zone tout en mesurant les hémisphères complet controlatérales et ipsilatéral. Correcte pour n’importe quel cerveau enflure due à un oedème à l’aide d’une méthode indirecte pour mesurer le volume de la lésion comme décrit précédemment21,22. Inclure uniquement les tranches qui contiennent des tissus du cortex et pas lobe frontal ou tissu cervelet selon un atlas de cerveau de souris standard afin d’éviter la sur-correction.
- Mesurer les paramètres de diffusion de lésion et obtenir les noyau et la pénombre des régions d’intérêt.
- Anisotropie fractionnaire (FA) cartes à partir des images de tenseur de diffusion à l’aide de logiciels d’analyse appropriés MRI et générer le coefficient apparent de diffusion (ADC).
- Aligner les images DTI avec les images pondérées en T2 à l’aide de logiciels d’analyse d’image appropriée capable d’effectuer un enregistrement linéaire des images. Suite à l’enregistrement, soustraire les masques de lésion pondérées en T2 (core ischémique et pénombre) pour estimer la région pénombre les masques de lésion diffusion-pesée (coeur ischémique). Appliquer les masques qui en résulte (core et pénombre) aux cartes ADC et FA pour quantifier les paramètres de diffusion au sein du noyau et de la pénombre.
- Traduire le noyau ipsilateral et les masques de pénombre sur la ligne médiane du cerveau afin d’obtenir des valeurs ADC et FA controlatérales à titre de comparaison.
Résultats
Un total de 24 souris C57BL/6 mâles adultes, pesant entre 24 et 31 g au moment de la chirurgie, ont été utilisés dans l’étude. Un animal meurt après occlusion de l’artère cérébrale moyenne (OACM) et a été exclue en raison de complications chirurgicales. Les données présentées ici sont tirées d’une œuvre précédemment publiée par les auteurs. Elles étaient utilisées pour illustrer l’effet de réparation de navire sur OACM résultats11. Toutes les données sont exprimées en moyenne ± écart-type thr. Les données ont été évaluées statistiquement pour la normalité en utilisant le test de normalité omnibus D'Agostino-Pearson. Données paramétriques ont été comparées à l’aide de Student t-test (pour deux moyens) et ANOVA à avec le test de Sidak (plusieurs moyens). Données non paramétriques ont été comparées en utilisant le test U de Mann-Whitney. La variabilité des données paramétriques ont été évaluée par un F-test, et la variabilité des données non paramétrique a été évaluée à l’aide du test de Levene.
En général, dans les procédures OACM, le filament occlusion est inséré dans le CCA et la Cour des comptes sont ligaturé pour empêcher ce filament de passer dans la Cour des comptes, plutôt que l’ICA. Un évitement de la ligature de la CEA et l’ajout d’analgésie ont montré une tendance à la perte de poids réduit à 48 h post-OACM, comparativement aux données provenant d’études antérieures menées par le même chirurgien lors de la même OACM utilisation ligature CEA avec aucune analgésie, tandis que le LV ne semblait pas touchée, voir la Figure 1.
Souris a subi une ischémie induite par OACM 60 min, suivie d’une reperfusion avec réparation de navire CCA ou avec la ligature typique de l’approche de la CCA. Un schéma du CCA réparé ligaturé et unligated est illustré à la Figure 2.
Débitmétrie Doppler laser a été utilisé pour confirmer l’écoulement perfusion sanguine dans le territoire de la MCA à OACM, avant et après la réparation de navire CCA. La figure 3 montre que 5 min après l’enlèvement de filament, le débit sanguin cérébral régional (DSCR) a augmenté considérablement dans la région du cerveau de la MCA. La perfusion a été maintenue jusqu'à la réparation de bateau, avec une augmentation de la perfusion au territoire MCA montré après la réparation de navire CCA, suggérant que la réparation de la CCA a permis une perfusion de sang accru au territoire ischémique comparée à s’appuyer sur le seul cercle de Willis.
T2-weighted MRI a été utilisé pour déterminer le total LV et DTI scans ont servi à déterminer le noyau LV, 48 h après l’OACM. Figure 4 a ne montre aucune différence significative dans le VG total ou core entre la réparation et les groupes de procédures ligaturé. Cependant, la variabilité des données pour les deux total et LV, de base, tel qu’évalué à l’aide du test de Lavene pour non paramétrique ou le F-test pour les données paramétriques, a été significativement réduite au sein du groupe de réparation CCA. Le LV total a été décomposé en LV cortical et sous-corticales, comme illustré à la Figure 4 b. La partie corticale était significativement moins variables dans le groupe de réparation CCA, tandis que la partie sous-corticaux de la lésion était inchangée entre les deux groupes procédurales.
Une analyse de puissance a indiqué qu’il faudrait moins d’animaux par groupe de traitement pour démontrer une réduction de 30 % dans le VG suite OACM utilisant CCA réparation par rapport à la procédure CCA-ligaturé typique, voir le tableau 1. Une hypothèse de puissance 1-β = 0,8 et seuil de signification α = 0,05 et une prévision de réduction de 30 % dans le VG entre l’hypothétique contrôle et essai des groupes ont été utilisés pour l’analyse de la puissance. En outre, une variance égale a supposé entre les groupes. Le tableau 1 montre le nombre d’animaux requis pour le test et les groupes témoins lorsqu’on utilise soit la typique CCA-ligaturé méthode ou la méthode de réparation CCA mise à jour, tel que décrit ici, est utilisée. Noter que le groupe se réfère à un groupe traité hypothétique des animaux et le groupe témoin se réfère à un groupe contrôle hypothétique ; les deux groupes subirait OACM.
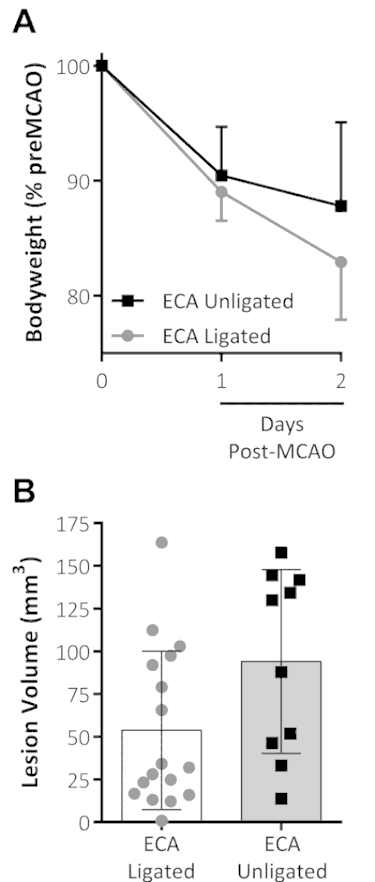
Figure 1 : combiné de traitement de l’analgésie et l’omission de la ligature de la CEA sur OACM issue. (A) de poids corporel, indiqué en pourcentage du poids de pré-OACM, diminué les premiers 2 jours après l’OACM pour les deux groupes. Le groupe CEA-unligated (analgésie imprégnées avec aucune ligature CEA à OACM) a montré une tendance à la perte de poids réduite sur le deuxième jour suivant l’OACM. (B), ce panneau indique le volume de la lésion (mm3) mesuré par le chlorure de triphényltétrazolium standard (TTC) coloration 48 h après l’OACM. Les données présentées sont la moyenne ± écart-type. CEA ligaturée : n = 17, CEA unligated : n = 10. Ce chiffre a été modifié par Trotman-Lucas et al. 11. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
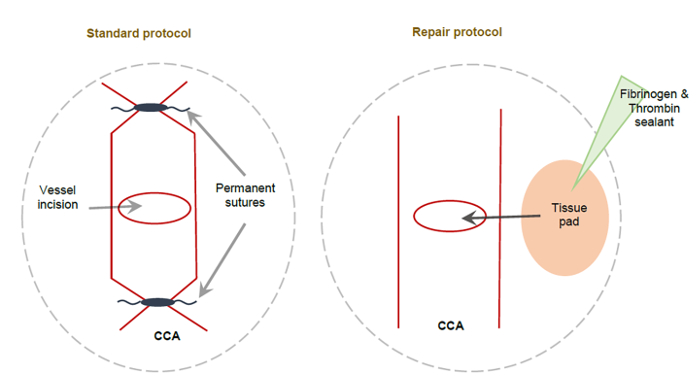
Figure 2 : schéma montrant la méthode standard de la CCA et la CCA alternative réparer méthode suivant OACM. (A) ce schéma représente un CCA en permanence ligaturé à l’aide de sutures non dissolvable appliquées à chaque côté de l’incision de la CCA, ayant pour résultat la ligature permanente du CCA droite. (B), ce schéma représente la méthode de réparation alternative CCA. Une garniture de petits tissus recouverts de fibrinogène et mastic de thrombine est utilisé pour couvrir l’incision de la CCA, scelle pour permettre la perfusion complet du droit CCA. Ce chiffre a été modifié par Trotman-Lucas et al. 11. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
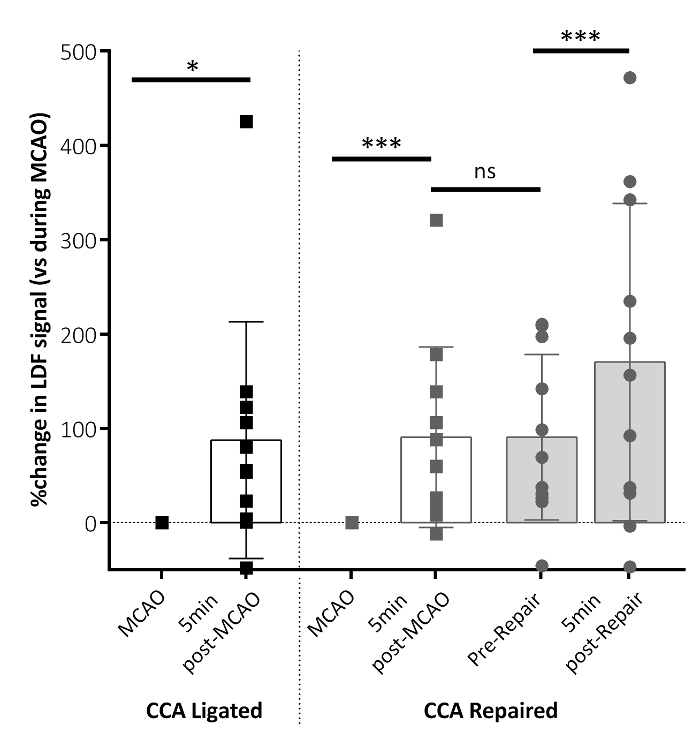
Figure 3 : paramètres de débit (DSCR) sanguin cérébral régional suite OACM. La DSCR changé 5 min après que l’enlèvement de filament OACM pour les CCA-ligaturé et CCA-réparé anglophones (post-OACM), par rapport à la DSCR mesuré pendant OACM. Ce panneau montre les données DSCR immédiatement avant la réparation de navire CCA (avant réparation) et 5 min après la réparation de la CCA (après réparation). Augmentations significatives de la DSCR figurent 5 min après l’enlèvement de filament (post-OACM) dans les deux groupes. Une augmentation supplémentaire de la DSCR est indiquée à la suite de la réparation de la CCA (après réparation) dans le groupe de réparation CCA. Aucune différence dans la DSCR n’apparaît entre 5 min post-OACM et réparation préalable. Les données présentées sont condensées d’après les données de temps analysées temps clé points, de compte rendu ici comme la moyenne ± écart-type. CCA ligaturé : n = 10, DPA réparé : n = 10 ; P < 0,01, ***P < 0,001, ns: non significatif. Ce chiffre a été modifié par Trotman-Lucas et al. 11. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
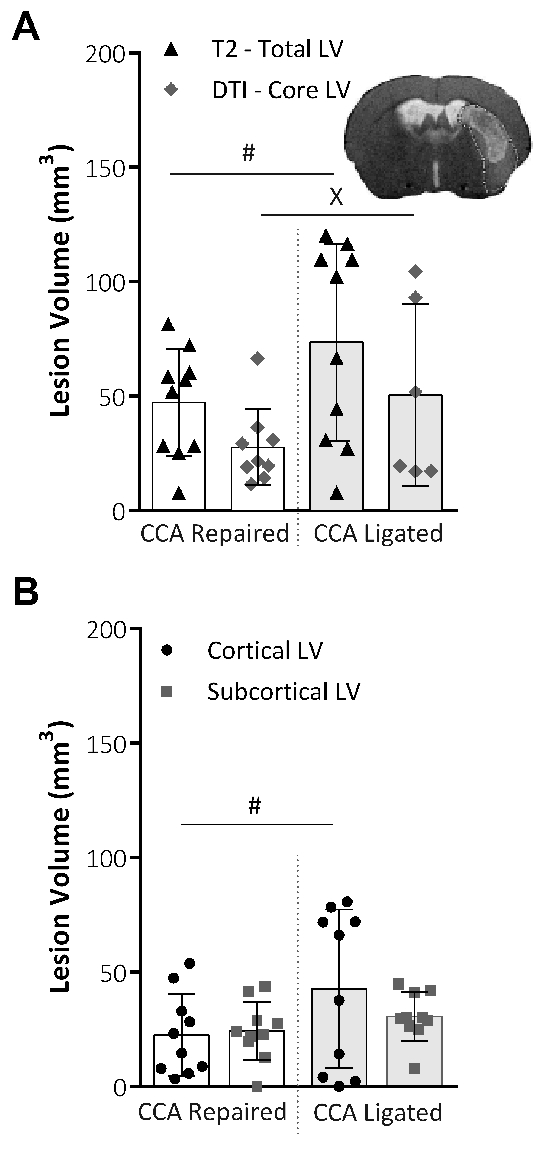
Figure 4 : analyse du volume lésion obtenues par des techniques d’IRM. (A) ce panneau montre le volume de la lésion (LV ; mm3) 48 h après OACM, le LV total tirées d’images d’IRM pondérées en T2 (LV Total) et le noyau LV tirées de DTI scanne et analyse (Core LV). Images représentatives montrent le volume de la lésion totale d’une image de tranche T2 scan avec le DTI core lésion volume masque appliqué. La variabilité au sein des groupes a été significativement réduite pour les deux le BT total (P = 0,015, réparation de la CCA : n = 10, DPA ligaturé : n = 10, F-test) et le noyau LV (P = 0,043, réparation de la CCA : n = 9, CCA ligaturé : n = 6, test de Lavene), évaluée à l’aide d’un F-test pour les données paramétriques ou test de Levene pour les données non paramétrique. (B) ce panneau montre la LV 48 h après OACM, tirés des images d’IRM pondérées en T2 et divisé en zones de lésions corticales et sous-corticales. La réparation de la CCA a considérablement réduit la variabilité des données (P = 0,03, F-test) dans la partie corticale de la lésion, mais aucun effet sur les données a montré la variabilité dans la portion sous-cortical de la lésion. Réparation de la CCA : n = 10, DPA ligaturé : n = 10. Les données présentées sont la moyenne ± écart-type. # P < 0,05 (F-test), xP < 0,05 (test de Lavene). Ce chiffre a été modifié par Trotman-Lucas et al. 11. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Approche | Volume de la lésion (LV ; mm3; moyenne ± s.d.) | Puissance | Seuil de signification | Anticiapted différence | Taille du groupe requis |
| CCA ligaturé (approche traditionnelle) | 94.08 ± 53.79 | 0,8 | 0.05 | 30 % | n = 58 |
| CCA réparé (nouvelle approche) | 51,73 ± 22.78 | 0,8 | 0.05 | 30 % | n = 35 |
Tableau 1 : analyse de la puissance représentative en comparant la ligature CCA traditionnelle avec l’alternative CCA réparer la méthode expliquée ici. Ce tableau indique la puissance d’analyse effectué pour calculer la taille de groupe prévus pour détecter une différence significative dans le VG entre un groupe témoin, la (nouvelle) approche traditionnelle ou alternative et un groupe de tests (prévu). Le tableau montre le groupe tailles comme nécessaire si une puissance de 0,8 est supposée, un seuil de signification de 0,05 est appliqué, et si le groupe prédit test montre une différence de 30 % dans le LV comparée à du groupe témoin. Le tableau présente les résultats pour les deux approches OACM (le CCA-ligaturé et la CCA-réparé) afin de déterminer s’il existe une différence dans le nombre d’animaux requis pour obtenir une différence de 30 % dans le LV. Pour les deux méthodes, une variance égale est supposée entre le test et le groupe témoin. Ce chiffre a été modifié par Trotman-Lucas et al. 11.
Discussion
Induction de filament d’OACM transitoire chez les rongeurs est la plus fréquemment utilisée modèle accidents cérébrovasculaires, car elle permet de ré-perfusion à la zone touchée, imitant l’apparition des manifestations cliniques ischémiques7. Présentés ici, est une approche chirurgicale alternative à la méthode traditionnelle d’OACM transitoire induite par le filament chez la souris. L’autre approche, impliquant le traitement de l’analgésie, l’évitement de ligature CEA et réparation d’incision CCA, se traduit par une variabilité réduite de LV lorsque évalué à l’aide de l’IRM et de méthodes coloration histologique11.
Les approches traditionnelles induisent OACM largement s’appuyer sur la transection, ou au moins de la ligature, de la Cour des comptes, qui a été montré, chez des rats, d’influer sur le comportement de consommation et une augmentation de la perte de poids après l' OACM14. Le protocole défini ici, chez la souris, avec l’évitement de la ligature de la CEA et ajout de l’analgésie, a proposé une réduction de perte de poids après l’OACM sans effet sur le volume de la lésion. L’utilisation d’analgésiques est évitée, ou au moins non détectée, dans la majorité des études expérimentales accident vasculaire cérébral, en raison des effets confusionnels possibles sur les résultats expérimentaux. Toutefois, en évitant une analgésie complètement n’est pas toujours justifiée et il est nécessaire d’équilibrer les besoins de bien-être des animaux avec la réalisation des objectifs scientifiques.
Différences dans la taille de l’animal, souche et anatomie vasculaire cérébrale, outre les variations de taille et le type de filament, toutes sont suggérées pour influencer les résultats de course23,24. L’approche alternative décrite ici permet d’éviter le recours à la vache durant la reperfusion, réduisant ainsi, au moins en partie, la variabilité observée entre animaux en volume de la lésion. Anatomie de la vache est très variable chez les souris, en particulier dans le C57BL /6 souche, qui est souvent utilisée dans les études d’accidents cérébrovasculaires. 90 % des souris C57BL/6 ont une vache incomplète en raison d’une varié postérieure communicants artère (PcomA) perméabilité, qui peut-être avoir un effet sur le volume des lésions ischémiques à cause de la perfusion insuffisante des structures en dehors de la MCA territoire13, 25. réparer le CCA chez la souris, comme illustré ici, résultats dans le rétablissement du sang coulent via la DPA à la zone ischémique, comme décrite dans les rats15. Les données représentatives ici prouvent que la réparation du CCA augmente de reperfusion, bien que le flux sanguin dans le CCA n’a pas été mesuré directement. Toutefois, il est possible pour le chirurgien de visualiser la CCA naviguent avec sang après la réparation de bateau, qu’il retourne à un état "pulsé" et complète tout le long du tronc, proximal et distal par rapport à l’emplacement de la réparation. Cette confirmation visuelle, ainsi que des lectures de débitmétrie Doppler laser de la zone ischémique, peut être utilisée pour confirmer la réparation réussie du navire. Le délai entre l’application de tissu pad et le retrait de l’attache de bateau du CAC peut avoir un impact sur la perméabilité résultante de la CCA, en réduisant le délai entre l’application de tissu pad et le retrait du clip empêchera la garniture tissu d’adhérer à l’o n côté du CCA. Bien que techniquement difficile, la procédure alternative d’OACM expliquée ici ne nécessite pas des compétences supplémentaires que celles requises pour effectuer l’induction chirurgicale d’OACM chez la souris.
Traditionnellement associé à une forte variabilité des mesures de résultats, des études expérimentales AVC peuvent avoir tendance sous-motorisé. Les exigences éthiques et de bien-être en combinaison avec les préoccupations économiques et pratiques peuvent contribuer aux études étant de faible puissance. En réduisant la variabilité des résultats et, par conséquent, produisant des résultats plus cohérents de lésion dans un groupe expérimental, des calculs de puissance plus efficaces peuvent être effectuées dans le but ultime des études correctement alimentée.
En conclusion, cette procédure de réparation alternative CCA, chez les souris, se traduit par moins de variabilité dans le volume de lésion à la suite d’accidents cérébrovasculaires et les calculs de puissance permet des petits groupes expérimentaux nécessaires pour tester l’effet d’un traitement lorsque cela est approprié sont utilisés.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par le Centre National pour le remplacement, le raffinement et la réduction des animaux en recherche (NC3Rs ; NC/M000117/1 à CG). Les auteurs remercient le personnel de la Division des Services biomédicaux, de l’Université de Leicester, pour leurs soins des animaux de laboratoire et Maria Viskaduraki pour ses conseils en matière statistique. Les résultats représentatifs sont adaptées avec la permission de Disease Models & mécanismes11.
matériels
| Name | Company | Catalog Number | Comments |
| 0.7 mm flexible single fibre optic probe | Moor Instruments, UK | P10d | Use with master probe code: VP10M200ST |
| 7-0 silicone coated monofilament | Doccol, USA | 701956PKRe | Item dependent on animal size and weight - use manufacteurer guidelines. Product code here was used for representative results shown in article. |
| 9.4T Preclinical MRI system | Agilent Technologies, Santa Clara, California, USA | MY11520101 | Equipped with gradient and RF coils suitable for mouse brain imaging |
| Animal monitoring and gating equipment | SA Instruments, Stony Brook, New York, USA | 22124005 | MRI compatible temperature and respiration monitoring |
| Bupivacaine | National Veterinary Services, Stoke-on-trent, UK | 512345 | Marcaine |
| C57BL/6 Mice | Charles River, Oxford, UK | B6JSIMA49D | |
| Carprofen | Norbrook Laboratories | 143658 | Carprieve 5% w/v Small animal solution for injection |
| Chlorhexidine 4% hand cleanser solution | VWR International Ltd, Lutterworth, UK | MOLN10008780 | HibiScrub Antimicrobial hand cleanser, Molnlycke Health Care |
| Cotton buds | National Veterinary Services, Stoke-on-trent, UK | 213512 | Any plastic body, cotton bud tip are suitable once made sterile by autoclaving. |
| Dissecting stereoscope | Carl Zeiss | OPMI99 | Resident piece of equipment. Any binocular dissecting stereoscope capable of x1-x5 magnification will be suitable. |
| dissolvable 6-0 sutures | National Veterinary Services, Stoke-on-trent, UK | 9544 | Absorbable Sutures Ethicon Coated Vicryl 6/0 (Ethicon code: W9981) |
| Donut probe holder | Moor Instruments, UK | PHDO | Probe holder for mouse, required to be used with single fibre optic probe when used with laser doppler flowmtry machine. |
| dumont #5 forceps | World Precision Instruments, Hertfordshire, UK | 500342 | |
| Fibrinogen and thrombin sealant | Baxter, Berkshire, UK | 1502243 | TISSEEL Ready to use solutions for Sealant 2 mL |
| Gel food | Datesand group, Manchester, UK | 72065022 | Diet Gel Recovery |
| Image display and measuring software package | 3D Slicer | https://www.slicer.org/ | Version 4.0 |
| Image display and measuring software package | NIH, Maryland, USA | https://imagej.nih.gov/ij/index.html | NIH/ImageJ |
| LDF monitor | Moor Instruments, UK | moorVMS-LDF | |
| micro vannas scissors | InterFocus Ltd, Linton, UK | 15000-08 | Other microvannas spring scissors can be used as an alternative, although fine tips are required. |
| Microvascular clip | World Precision Instruments, Hertfordshire, UK | 15911 | 10 G Vessel Clip |
| microvascular clip holders | World Precision Instruments, Hertfordshire, UK | 14189 | |
| MRI acquisition and analysis software | Agilent Technologies, Santa Clara, California, USA | VnmrJ Version 4.2 | Revision A |
| no. 15 scalpel | Scientific Laboratory Supplies, Nottingham, UK | INS4678 | Sterile No15 Scalpel - manufactuer number P305. Other suppliers are available. |
| Non-disolvable 6-0 suture | National Veterinary Services, Stoke-on-trent, UK | W529 | Ethicon Mersilk Sutures |
| Ocular lubricant | National Veterinary Services, Stoke-on-trent, UK | 847288 | Lacrilube (5100G13) |
| Optical matching gel | Moor Instruments, UK | PMG | |
| Pulse Oximetry Reader | Starr Life Sciences Corp., Oakmont, PA, USA | MouseOx | MouseOx - rat & mouse pulse oximeter & physiological monitor Use with mouse thigh sensor. |
| Rehydration gel | Datesand group, Manchester, UK | 70015022 | HydroGel |
| Small hair clippers | vetproductsuk.com | HS61 | Contura Cordless trimmer/clippers |
| Sterile 0.9 % NaCl Solution | VWR International Ltd, Lutterworth, UK | LOCA3528286 | SODIUM CHLORIDE 0.9% W/V INTRAVENOUS INFUSION BP 500 ML IN ECOFLAC½ PLUS |
| sterile Petri dish | VWR International Ltd, Lutterworth, UK | 5168021 | 50 mm sterile Petri dish. Any brand is suitable. Minimum 50 mm diameter is required. |
| Topical tissue adhesive | World Precision Instruments, Hertfordshire, UK | 503763 | GLUture topical Tissue Adhesive |
| Waterproof superglue | Loctite | Loctite Superglue Precision Max | Available at most hardware shops. |
| White paper chip | Datesand group, Manchester, UK | CS1BPB | Pure-O'Cel |
Références
- O'Collins, V. E., et al. 1,026 Experimental treatments in acute stroke. Annals of Neurology. 59 (3), 467-477 (2006).
- Sutherland, B. A., et al. Neuroprotection for Ischaemic Stroke: Translation from the Bench to the Bedside. International Journal of Stroke. 7 (5), 407-418 (2012).
- Reeves, M. J., et al. Acute Stroke Care in the US: Results from 4 Pilot Prototypes of the Paul Coverdell National Acute Stroke Registry. Stroke. 36 (6), 1232-1240 (2005).
- Wardlaw, J. M., Murray, V., Berge, E., del Zoppo, G. J. Thrombolysis for acute ischaemic stroke. Cochrane Database of Systematic Reviews. (7), CD000213 (2014).
- Pangalos, M. N., Schechter, L. E., Hurko, O. Drug development for CNS disorders: strategies for balancing risk and reducing attrition. Nature Reviews Drug Discovery. 6 (7), 521-532 (2007).
- Hossmann, K. A. Pathophysiological basis of translational stroke research. Folia Neuropathologica. 47 (3), 213-227 (2009).
- Ringelstein, E. B., et al. Type and extent of hemispheric brain infarctions and clinical outcome in early and delayed middle cerebral artery recanalization. Neurology. 42 (2), 289-289 (1992).
- Carmichael, S. T. Rodent models of focal stroke: Size, mechanism, and purpose. NeuroRX. 2 (3), 396-409 (2005).
- Dirnagl, U. Bench to Bedside: The Quest for Quality in Experimental Stroke Research. Journal of Cerebral Blood Flow & Metabolism. 26 (12), 1465-1478 (2006).
- Ingberg, E., Dock, H., Theodorsson, E., Theodorsson, A., Ström, J. O. Method parameters' impact on mortality and variability in mouse stroke experiments: a meta-analysis. Scientific Reports. 6, 21086 (2016).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Macrae, I. M. Preclinical stroke research - advantages and disadvantages of the most common rodent models of focal ischaemia. British Journal of Pharmacology. 164 (4), 1062-1078 (2011).
- McColl, B. W., Carswell, H. V., McCulloch, J., Horsburgh, K. Extension of cerebral hypoperfusion and ischaemic pathology beyond MCA territory after intraluminal filament occlusion in C57Bl/6J mice. Brain Research. 997 (1), 15-23 (2004).
- Trueman, R. C., et al. A Critical Re-Examination of the Intraluminal Filament MCAO Model: Impact of External Carotid Artery Transection. Translational Stroke Research. 2 (4), 651-661 (2011).
- Dittmar, M. S., et al. The role of ECA transection in the development of masticatory lesions in the MCAO filament model. Experimental Neurology. 195 (2), 372-378 (2005).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. Plos Biology. 8 (6), e1000412 (2010).
- Langford, D. J., et al. Coding of facial expressions of pain in the laboratory mouse. Nature Methods. 7 (6), 447-479 (2010).
- Orsini, F., et al. Targeting Mannose-Binding Lectin Confers Long-Lasting Protection With a Surprisingly Wide Therapeutic Window in Cerebral Ischemia. Circulation. 126 (12), 1484-1494 (2012).
- Simoni, M. G. D., et al. Neuroprotection by Complement (C1) Inhibitor in Mouse Transient Brain Ischemia. Journal of Cerebral Blood Flow & Metabolism. 23 (2), 232-239 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline Treatment for Experimental Intracerebral Hemorrhage in Mice. Stroke. 29 (10), 2136-2140 (1998).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of Brain Edema on Infarct Volume in a Focal Cerebral-Ischemia Model in Rats. Stroke. 24 (1), 117-121 (1993).
- Loihl, A. K., Asensio, V., Campbell, I. L., Murphy, S. Expression of nitric oxide synthase (NOS)-2 following permanent focal ischemia and the role of nitric oxide in infarct generation in male, female and NOS-2 gene-deficient mice. Brain Research. 830 (1), 155-164 (1999).
- Connolly, E. S., Winfree, C. J., Stern, D. M., Solomon, R. A., Pinsky, D. J. Procedural and strain-related variables significantly affect outcome in a murine model of focal cerebral ischemia. Neurosurgery. 38 (3), 523-531 (1996).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse Strain Differences in Susceptibility to Cerebral Ischemia are Related to Cerebral Vascular Anatomy. Journal of Cerebral Blood Flow & Metabolism. 13 (4), 683-692 (1993).
- Kitagawa, K., et al. Cerebral Ischemia after Bilateral Carotid Artery Occlusion and Intraluminal Suture Occlusion in Mice: Evaluation of the Patency of the Posterior Communicating Artery. Journal of Cerebral Blood Flow & Metabolism. 18 (5), 570-579 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon