Method Article
Contracciones de cardiomiocitos humanos derivados de iPSC sincicios medición con un colorante fluorescente sensible al Ca en placas de 384 pocillos temperatura controlada
En este artículo
Resumen
Contratación espontáneamente sincicios de cardiomiocitos derivados de humanas pluripotentes células madre son modelos útiles de la fisiología cardiaca humana y farmacología. Aquí presentamos un sistema de proyección de alto rendimiento para cuantificar los efectos de compuestos exógenos sobre la frecuencia de golpes, utilizando un colorante fluorescente sensible al Ca y un lector de placas de varios pocillos imagen con control de temperatura.
Resumen
Contratación espontáneamente sincicios de cardiomiocitos derivados de humanas pluripotentes células madre (hiPSC-CM) son un modelo útil de fisiología cardiaca humana y farmacología. Se han propuesto varios métodos para registrar la actividad espontánea y para evaluar los efectos de drogas, pero muchos de estos métodos sufren de rendimiento limitado o relevancia fisiológica. Hemos desarrollado un sistema de proyección de alto rendimiento para cuantificar los efectos de compuestos exógenos en la frecuencia de golpeo de hiPSC-CM, utilizando un colorante fluorescente sensible al Ca y un lector de placas de varios pocillos imagen con control de temperatura. Describimos cómo preparar las placas de la célula y las placas compuestas y cómo ejecutar el ensayo automatizado para lograr reproducibilidad y alta sensibilidad. También describimos cómo transformar y analizar los datos de fluorescencia para proporcionar medidas confiables de los efectos de la droga en ritmo espontáneo. Este ensayo puede utilizarse en programas de descubrimiento de drogas para guía optimización química de, o hacia, compuestos que afectan la función cardiaca humana.
Introducción
El presente Protocolo describe un método para medir los efectos de la droga sobre la frecuencia de latidos espontáneos de sincicios hiPSC-cm a ritmos fisiológicamente relevantes. Células madre pluripotentes humanas pueden diferenciarse en cardiomiocitos funcionales que establecen espontáneamente paliza sincicios en vitro1,2,3,4. Estos hiPSC CM puede obtenerse en grandes cantidades a través de proveedores comerciales o a través de la producción en el laboratorio, y son una fuente útil de las células para generar modelos de fisiología cardiaca humana y farmacología. En particular, pueden ser utilizados para predecir y caracterizar efectos cardíacos que pueden aparecer cuando un fármaco se administra a los seres humanos5.
La frecuencia de golpeo de sincicios hiPSC CM puede medirse bajo condiciones fisiológicas con arreglos de microelectrodos o impedancia detección1: estas técnicas no invasivas proporcionan información muy detallada sobre los efectos de drogas, pero son más bien bajo rendimiento y no comprobar grandes bibliotecas compuestas en tiempo realista y restricciones presupuestarias. Un sistema más eficaz puede elaborarse con una fluorescencia de 384 pozos lector de placas de la proyección de imagen y sensible a la Ca-tinte6, pero los lectores de placa clásica se ven obstaculizados por la frecuencia de adquisición y control de temperatura subóptima. Estas limitaciones son ilustradas por paliza unphysiological tarifas (~ 15 bpm, en comparación con el 35-55 bpm en ambientes controlados1) y la pobre resolución de señal de Ca (es de una frecuencia de adquisición de 8 Hz en el límite inferior a las tasas de registro que puede llegar a 120 bpm en condiciones estimuladas, y no puede extraer información como pendiente o duración). El método descrito aquí combina la grabación de vencer a los patrones a ritmos fisiológicos y con suficiente resolución para impedir estas preocupaciones.
En el lado positivo, este método es simple, confiable y alto rendimiento, que permite la prueba rápida de un gran número de compuestos a costos razonables. En el lado negativo, este método requiere un lector rápido con control de temperatura efectiva, que es una inversión costosa, y proporciona información poco mecanicista sobre los efectos de la droga observados, que pueden requerir pruebas adicionales más detallados métodos.
Se necesitan aproximadamente 6 x 106 hiPSC CM para una medición en una placa de 384 pozos celular. hiPSC CM generalmente se suministran comercialmente como alícuotas congeladas de ~ 4 x 106 células en 1 mL. Por lo tanto, es conveniente preparar dos placas de células con tres alícuotas congeladas. En la mayoría de los casos, debido a la poca variabilidad de este ensayo, es suficiente para realizar mediciones duplicadas de los compuestos de prueba y, en cada placa de la célula, multiplicara las mediciones de los controles positivos (forskolin, N6-cyclopentyl-adenosina y E-4031), y Apéndice 20 mediciones de control negativo (DMSO solamente). Por lo tanto, un máximo de 352 pares compuesto o concentración puede ser evaluado con dos placas de 384 pozos de la célula. El siguiente protocolo considera tal experimento realizado con compuestos de prueba 352, dos placas de células y células 12 millones como tres alícuotas congeladas; puede ser escalado-para arriba fácilmente si los puntos de datos adicionales son necesarios.
Protocolo
1. preparación de placas de células
Nota: Preparar las placas de la celda 3–4 semanas antes de la medición de los efectos de drogas.
- Día 0 del experimento
Nota: para propósitos de planificación, la aplicación compuesto de prueba puede realizarse en cualquier día entre los días 22–28 del experimento.- Encender el baño de agua a 37 ° C y caliente a 40 mL de medio de galjanoplastia (como viene suministrado por el fabricante).
Nota: Utilice las células con su media cultura y mantenimiento correspondiente proporcionado por el proveedor. - Descongelar el hiPSC-CM mediante la colocación de los criotubos que contiene las células en el baño de agua durante 2 minutos.
- Transferir cuidadosamente las suspensiones celulares de 1 mL a un tubo cónico de 50 mL.
- Lave cada criotubo con 1 mL de medio caliente de la galjanoplastia para recuperar las células sobrantes y añadir los medios de lavado en el mismo tubo cónico de las células que contienen paso 1.1.3.
- Mezcle cuidadosamente otro 8 mL de medio caliente de la galjanoplastia en la suspensión de células.
- Cuenta de células vivas usando el método de exclusión del azul tripán y un hematocitómetro8.
Nota: el requisito de 6 x 106 células por una placa de 384 pozos celular considera la posibilidad de hasta 20% de células muertas entre las células congeladas, que es un máximo en nuestra experiencia. - Ajustar la suspensión celular a 5 x 105 en células/mL con el medio caliente de la galjanoplastia.
- Distribuir la suspensión de células en dos placas de 384 pozos celular añadiendo 25 μl a cada pozo (aproximadamente 12.500 células por pocillo).
Nota: Las placas de la celda no es necesario ser cubierto primero con cualquier matriz (ver discusión). - Mantener las células a 37 ° C en una atmósfera humidificada con 5% CO2.
- Encender el baño de agua a 37 ° C y caliente a 40 mL de medio de galjanoplastia (como viene suministrado por el fabricante).
- Día 1 del experimento
- Encender el baño de agua a 37 ° C y caliente 50 mL de medio de mantenimiento suplementado con solución al 1% v/v penicilina-estreptomicina.
- Reemplazar el medio forro con 50 μl de medio de mantenimiento caliente en cada pocillo de las placas de la célula.
- Días 2–21 (hasta día 27) de la experiencia
Nota: hiPSC-CMs no necesita cualquier pases durante este período, como son no-dividir las células.- Renovar la mitad de la media de mantenimiento cada 2–3 días y renovar íntegramente en los días 7, 14 y 21.
Nota: La medición de la fluorescencia puede realizarse entre los días 22 y 28 del experimento. Duraciones más largas no han sido juzgadas pero todavía pueden estar bien.
- Renovar la mitad de la media de mantenimiento cada 2–3 días y renovar íntegramente en los días 7, 14 y 21.
2. preparación de instrumentos, compuestas placas y placas de ensayo
Nota: preparar el instrumento, compuestas placas y las placas de ensayo en el día de la medición de los efectos de la droga, entre los días 22 y 28 del experimento. Utilice un lector de placas fluorescentes equipado con control de temperatura y una luz de excitación y kit de filtro de fluorescencia apropiado fuente. Por ejemplo, utilizar un kit de filtro de Fluo-3/Fluo-4/Fluo-8 fluorescencia (excitación: 472 nm, emisión: 520–560 nm) y una unidad de fuente de luz 150 W excitación.
- Por lo menos 2 h antes de la primera placa de la célula debe ser colocado dentro del lector de placas para la medición, encender el lector y el sistema de calentamiento a 37 ° C.
Nota: esto también se puede hacer la víspera. - Preparar los controles positivos, forskolin, N6-cyclopentyl-adenosina y E-4031 como soluciones de 0,33 mM en DMSO, 10 mM en DMSO y 3,33 mM de H2O, respectivamente.
Nota: las soluciones Stock se diluira 333-fold por el tiempo que se agregan a las células, y el objetivo es alcanzar concentraciones de prueba final de forskoline de 1 μm, 30 μm N6-cyclopentyl-adenosina y 10 μm E-4031, que producen efectos fiables y reproducibles. - Preparar los compuestos de prueba 352 como soluciones stock de DMSO en 333-fold las concentraciones de ensayo previsto (p. ej., 10 mM para una prueba en 30 μm).
Nota: El objetivo es alcanzar una concentración final de 0.3% (v/v) DMSO en la placa de la célula después de la aplicación compuesta; se trata de la mayor concentración de DMSO que no afecta a la actividad rítmica de los cardiomiocitos. Las soluciones stock también pueden prepararse el día anterior. Un mínimo de 5 μl de la solución madre se requiere para cada medición duplicado. - Preparar las placas compuestas.
- Caliente 40 mL de medio de mantenimiento suplementado con solución de penicilina-estreptomicina 1% v/v a la temperatura ambiente.
- Distribuir en dos placas de 384 pozos compuestas mediante la adición de 1,5 μl de la solución madre por pozo: i) los compuestos de prueba (dos pozos), ii) los controles positivos (forskolin, N6-cyclopentyl-adenosina y E-4031, cuatro pocillos por placa compuesta) y iii) negativo control (DMSO, 20 pocillos por placa compuesta).
- Centrifugue las placas compuestas a 100 x g durante 1 minuto.
- Añadir 37 μl de medio de mantenimiento a temperatura ambiente a cada pozo (3.9% DMSO en 38.5 μL en ese momento).
- Centrifugue las placas compuestas a 100 x g durante 1 minuto.
- Cargar las placas compuestas en el lector de placas.
Nota: Los pasos siguientes deben realizarse tan pronto como sea posible para minimizar la evaporación de las placas compuestas.
- Preparar el colorante fluorescente.
- Encender el baño de agua a 37 ° C y caliente 100 mL de medio de mantenimiento suplementado con solución al 1% v/v penicilina-estreptomicina.
- Reconstituir el colorante fluorescente sensible al Ca y extintor con 10 mL de medio de mantenimiento caliente con antibióticos.
Nota: este medio de fluorescencia común contiene el colorante fluorescente sensible al Ca, generalmente Fluo-4 y un extintor, y cualquier sobra puede guardarse a 4 ° C durante al menos 5 días.
3. adquisición de datos
Nota: realizar la adquisición de datos en el día de la medición de los efectos de la droga. Realice los pasos 3.1–.10 totalmente la placa de la primera celda, luego repetir para la segunda placa de la célula.
- Inicie el software de lector de placa (si es necesario) y las puntas de pipeta de carga.
- Ajustar la configuración de software para grabar un segmento de 2 minutos de las ondas de calcio con una frecuencia de adquisición de al menos 10 Hertz para definir la tasa inicial de golpeo para cada pozo.
- Para una placa de la célula, diluir 3 mL de medio de stock de la fluorescencia en 12 mL de medio de mantenimiento caliente con antibióticos para hacer el medio de fluorescencia.
- Vuelva a colocar 20 μl de medio en cada pocillo de la placa celular con 30 μl de medio de fluorescencia.
- Pipetear arriba y abajo 1 x para mezclar.
- Coloque la placa de la célula en el lector de la placa lo antes posible para dejar el CM hiPSC aclimatarse a la temperatura.
- Espere 60 minutos antes de comenzar la adquisición de datos.
- Iniciar la adquisición de datos en el software de lector de placa para grabar un segmento de 2 minutos de ondas de Ca con una frecuencia de adquisición de al menos 10 Hz, para definir la línea de fondo a tasa para cada pozo.
Nota: para cada secuencia de la grabación, asegúrese de que la placa de la célula no es transferida automáticamente por el dispositivo después de la adquisición de datos. Esto evita que la placa de la célula de enfriamiento a temperatura ambiente. Con algunas versiones de software del lector de la placa, puede ser necesario detener la cada grabación antes de que termine totalmente para ello. - Agregue los compuestos de prueba y de referencia con el robot lector de placa mediante pipeteo pozo a pozo 5 μl de la placa compuesta en la placa de la célula (después de la adición, la concentración de DMSO es 0.3% [v/v]).
- Iniciar la adquisición de datos en el software de lector de placa para segmentos de registro de 2 minutos de ondas de Ca a partir de 5, 15, 30, 45 y 60 min después de la adición compuesta (Asegúrese de que cada vez que la placa de la célula permanece en el dispositivo).
4. Análisis de datos
Nota: el análisis de datos se puede realizar en cualquier momento después de la medición.
- Exportar los datos en bruto para cada período de grabación desde el software de lector de placa como archivos de texto ASCII.
- Importar los datos sin procesar en el software de análisis de datos.
- Para cada bien y todos los puntos de tiempo, extraiga la frecuencia de latido primario.
Nota: Con el software de análisis de los datos enumerado en la Tabla de materiales, superando a las frecuencias se puede calcular con una rutina de análisis personalizada utilizando la función LombPeriodogram, basada en el método de Lomb-Scargle de análisis espectral de mínimos cuadrados7 . El periodograma debe calcularse para un rango de frecuencias entre 0.01 y 5 Hz. Puede extraerse la frecuencia primaria periodograma usando las rutinas de PeakAutoFind. Este método de análisis proporciona medidas más precisas de vencer a las frecuencias que el método como una opción con el software de lector de la placa. Sin embargo, estos últimos pueden seguir utilizándose si personalización de software no es una opción. - Exportación de las frecuencias de latido primario para cada período de grabación desde el software de análisis de datos como portapapeles copias o archivos de texto ASCII.
- Importar las frecuencias de latido primario en un software de hoja de cálculo por pegar del portapapeles o importación de archivos de texto.
Nota: medidas 4.5–4.9 se pueden realizar en cualquier software de hoja de cálculo moderno. - Para cada pozo, normalizar a la instantánea la frecuencia de golpeo en cada momento después de la aplicación de la droga (5, 15, 30, 45 y 60 min) dividiendo la frecuencia de golpeo principal en aquel momento el punto por la frecuencia de latido primario al inicio del estudio.
- Calcular el efecto promedio de DMSO en cada momento después de la aplicación de la droga (5, 15, 30, 45 y 60 min) promediando los valores normalizados para los 20 pozos de donde se aplicó DMSO.
- Cada bien y cada vez el punto después de la aplicación de la droga (5, 15, 30, 45 y 60 min), restan el efecto medio del DMSO (mismo tiempo) para la misma placa.
- Promedio de las mediciones duplicadas.
Nota: Si un compuesto cambia de frecuencia o el software no puede encontrar una frecuencia primaria después de la adición compuesta, un examen visual del patrón de golpeo puede evaluar si el compuesto producido arritmias.
Resultados
La figura 1 muestra una grabación representativa de las ondas de la Ca en base a través de una placa de 384 pozos. En la mayoría de los casos, todos los pozos revelan una tasa de golpes regulares con poca variabilidad en la placa (media ± SD = bpm 40,1 ± 3.5; rango = 34 – 54 bpm). Muy ocasionalmente (menos de 1 de cada 10 experimentos), pozos de unos pocos (menos de 5) tienen arritmia o ausencia de ritmo. En tres placas de 384 pocillos, también hemos intentado cardiomiocitos de otro proveedor (véase Tabla de materiales) y obtiene valores muy similares de base para el latido espontáneo.
Bloqueadores de los canales iónicos cardiacos afectan el ritmo de los cardiomiocitos en una forma reproducible5. Amlodipino, un bloqueador de la lenta Ca canales9, acelera el ritmo a más de 100% de una manera dependiente de la concentración hasta 1 μm (figura 2A). El efecto está bien desarrollado dentro de los primeros 5 minutos, pero todavía aumenta aproximadamente 50% dentro de los próximos 30 minutos antes de que se estabilice. Por encima de 1 μm, Amlodipino arresta la paliza (líneas discontinuas), como se puede esperar del hecho de que Ca ciclismo es fundamental para las contracciones espontáneas. Otros antagonistas del Ca dihidropiridínico selectivos producen efectos muy similares.
E-4031, un bloqueador de los canales de rápida rectificador retrasado K10, desacelera el ritmo unos 65–70% de una manera dependiente de la concentración hasta 10 μm (figura 2B). El efecto se desarrolla dentro de los primeros 5 minutos y no varía dentro de los próximos 60 minutos. Otros bloqueadores selectivos de IKr producen efectos similares, aunque la máxima reducción en la tasa puede variar (por ejemplo, 35–40% de la cisaprida, 70% para E-4031 y 90% - 95% de dofetilida). No se conoce la base para esta disparidad.
Tetrodotoxina, un bloqueador de la rápida Na canales11, desacelera el ritmo alrededor del 15% de una manera dependiente de la concentración, hasta 1–30 μm (figura 2). El efecto está bien desarrollado dentro de los primeros 5 minutos y no variar mucho dentro de los próximos 60 minutos. Sin embargo, por encima de 30 μm, tetrodotoxin arresta la paliza dentro de los primeros 5 minutos, mientras que después de 30 min, lo arresta por encima de 1 μm. Otros bloqueadores del canal de Na, como la lidocaína o la mexiletina, producen efectos similares de todo o nada.
Bepridil, un bloqueador mixto de cardiaca Na, Ca y K canales9, también produce un efecto de todo o nada (Figura 2D). Esto sugiere que en esta preparación, un bloque de canales de Na es la acción principal de bepridil. No se ve una aceleración por bloqueo de canales de Ca, y el más progresivo enlentecimiento por bloqueo de IKr aparece enmascarada por el efecto de canal de Na.
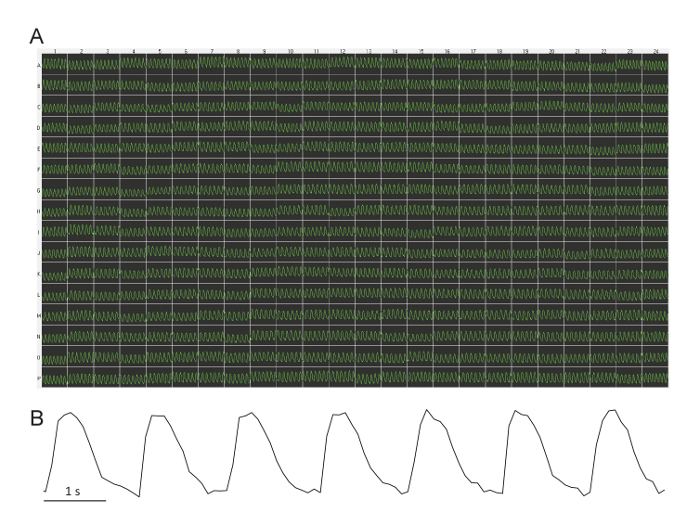
Figura 1: ondas de referencia representativa Ca a través de una placa de 384 pozos. (A) todos los pozos a través de la placa demuestran una tasa de golpes regulares con poca variabilidad. Esta imagen es capturada directamente desde el software de lector de la placa. Cada traza es de 10 s de duración. La intensidad de fluorescencia es arbitrarias (unidades relativas de luz derivadas de la cámara de video en escala de grises). (B) este Blow-up de un 10 rastro de s muestra el poco ruido de la señal. Haga clic aquí para ver una versión más grande de esta figura.
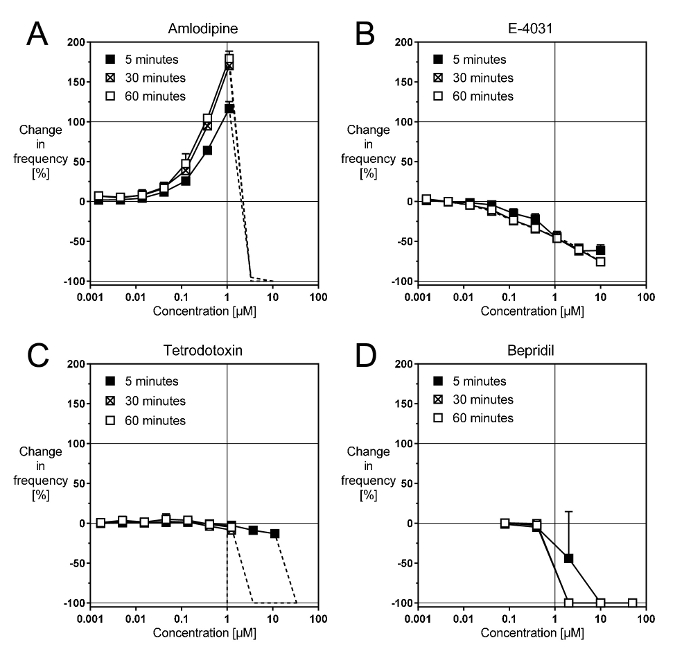
Figura 2: bloqueadores de los canales de efectos representativos de ión cardiaca. Estos paneles muestran las curvas de concentración-respuesta con (A) el selectivo Ca canal bloqueador amlodipino, (B) la IKr selectivo blocker E-4031, (C) el bloqueador selectivo de canales de Na TTX y (D) el canal no selectivo bloqueador bepridil. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Dos aspectos son más importantes para la exitosa grabación de vencer a las frecuencias. El primero es tener cuidado con la galjanoplastia de la célula y la cultura. En particular, es importante tratar de evitar rayar la capa de células en la parte inferior de los pozos al cambiar el medio. Es aceptable tocar el fondo de los pozos con las pipetas, pero debe utilizarse el mismo ángulo cada vez, produciendo sólo un diminuto rasguño en la capa de células y no afectar al rendimiento del ensayo. El segundo aspecto crítico de obtener ritmos homogéneos reproducibles es proporcionar control de temperatura a 37 ° C en la placa de la célula para la duración de la medida. No pudimos obtener esta homogeneidad mediante dispositivos que no sean el lector utilizado aquí, pero puede ser factible con modificaciones especiales para la regulación de la temperatura: sería el protocolo presentado aquí más ampliamente usable más allá de una sola marca de la placa de lector. Para lograr estabilidad de la temperatura para la duración del experimento con el dispositivo usado aquí, era necesario parar cada grabación antes de que terminara; de lo contrario, el robot expulsar la medida placa celular. Este problema técnico puede desaparecer con la próxima versión del software del lector de la placa, pero sigue siendo crítica por ahora. Si una placa celular es transferida por error fuera el lector de placas, se debe cargar dentro de tan rápido como sea posible. Sin embargo, se deteriorará la calidad del experimento, debido a cambios de temperatura afectan la tasa de golpes muy rápidamente.
Algunos aspectos que no han sido probados exhaustivamente, pueden ser menos importantes. Por ejemplo, CM hiPSC fabricantes recomiendan las placas de cultivo celular de la capa antes de sembrar las células, pero en este análisis específico, la capa no fue utilizada, porque las células se adhieren fácilmente sobre varias superficies, y es muy difícil correctamente capa 384-bien placas. Sin embargo, placa celular capa aún puede ser permitida, o incluso puede mejorar la calidad del ensayo. Nunca Probamos si disolventes que no sean de DMSO sería aceptables, pero se espera de la experiencia con otras tecnologías de grabación que similares concentraciones de EtOH o MeOH también sería tolerables. Generalmente utilizamos hiPSC CMs del mismo fabricante, y las células de un único proveedor adicional fueron probadas, que apareció a trabajar de una manera similar. Asimismo, hemos utilizado sólo un pequeño número de diferentes lotes de hiPSC-CMs que fueron seleccionados por los preinspección para verificar que se comportaron de manera similar al lote inicial. Uno o dos lotes se consideraban inadecuado porque los sincicios tuvieron estabilidad pobre o reproducibilidad bajo las condiciones de cultivo utilizado aquí. De lo contrario, la farmacología apareció muy similar a través de lotes cuando se prueba un panel limitado de compuestos "típicos" (forskolin, N6-cyclopentyl-adenosina y E-4031, así como endotelina, isoproterenol, Amlodipino y ponesimod). Sólo utilizamos hiPSC-CM derivado de donantes sanos. Puede ser que vale la pena evaluar si hiPSC-CM derivada de pacientes con enfermedad cardíaca proporcionaría resultados diferentes, aunque no diferencia entre donantes sanos y pacientes se observó al evaluar la toxicidad cardíaca de los inhibidores de tirosina quinasa 12. por último, normalmente esperamos 22 – 28 días en la cultura antes de medir los efectos de drogas: en nuestra experiencia con las grabaciones de la impedancia de las células del mismo, un estado estacionario para lento impedancia (un indicador de estabilidad de la capa de células) y la impedancia rápido (un indicador de frecuencia de golpes) se alcanzaron después de 12–15 días en la cultura. Sin embargo, hemos decidido esperar 22–28 días, porque es el momento cuando el perfil de expresión de los canales cardiacos y marcadores de maduración ha estabilizado13. No fue examinado si se obtendrían resultados comparables, si las células fueron utilizadas antes o después.
El protocolo descrito aquí utiliza una medida muy simple de la tasa de latidos espontáneos de hiPSC CM para evaluar posibles efectos de la droga en electrofisiología cardíaca humana. Sus principales ventajas sobre otras metodologías son que i) que es sensible a un ambiente de proyección de alto rendimiento, ii) registra la actividad de los cardiomiocitos y los efectos de las drogas a temperaturas fisiológicas, y iii) no requiere electrofisiológicos conocimientos para la ejecución o evaluación de resultados.
En un estudio de validación realizado con muchos fármacos aprobados para el uso humano, demostró que el ensayo reacciona a los fármacos utilizados en medicina humana como de los datos clínicos existentes5. Porque este método considera todos los efectos potenciales en el ritmo cardiaco, es un complemento integral en vitro Proarrhythmic ensayo (CiPA) iniciativa14 que evalúa específicamente el potencial pro arrítmico.
En el futuro, este método podría proporcionar una mayor comprensión del modo de acción de drogas demostrado que afectan la tasa de latidos espontáneos. Es probable que solicite mecanicista está presente en las grabaciones de la fluorescencia de transitorios de Ca (p. ej., en su amplitud o la forma). Si se realizan las grabaciones de fluorescencia a tasas más altas de adquisición (por ejemplo, 30 Hz), estos parámetros se extraen fácilmente además de vencer a tarifa, y puede ser interesante para los cambios en estos parámetros se correlacionan con los efectos conocidos de clínico utilizado drogas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores no tienen ninguna agradecimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| FDSS7000 fluorescent plate reader | Hamamatsu Photonics (Massy, France) | not a catalog item | |
| FDSS7000 Fluo-3/Fluo-4/Fluo-8 fluorescence filter kit | Hamamatsu Photonics (Massy, France) | installed initially in the device | |
| FDSS7000 temperature control | Hamamatsu Photonics (Massy, France) | A10118-09 | |
| FDSS7000 150-W Excitation Light Source Unit | Hamamatsu Photonics (Massy, France) | C11653-11 | |
| FDSS7000 pipet tips for 384-well plates | Hamamatsu Photonics (Massy, France) | A8687-62 | |
| Waveform Analysis Software for Cardiomyocytes | Hamamatsu Photonics (Massy, France) | U8524-12 | optional alternative to the Igor Pro software |
| Igor Pro data analysis software | Wavemetrics (Portland, Oregon, USA) | Latest version | |
| iCell-Cardiomyocytes Kit | Cellular Dynamics International (Madison, WI) | R1106 | includes cells, plating and maintenance media |
| Cor.4U Cardiomyocyte Kit | Ncardia Germany (Cologne, Germany) | Ax-B-HC02-4M | includes cells, plating and maintenance media alternative to the iCell-Cardiomyocytes |
| 384-well cell culture plates | Greiner-Bio-One (Frickenhausen, Germany) | 781091 | |
| 384-well compound plates | Greiner-Bio-One (Frickenhausen, Germany) | 781280 | |
| FLIPR Calcium 4 Assay Kit | Molecular Devices (Sunnyvale, California) | R8142 | |
| Forskolin | Sigma-Aldrich (Buchs, Switzerland) | F6886 | |
| N6-cyclopentyl-adenosine | Sigma-Aldrich (Buchs, Switzerland) | C8031 | |
| E-4031 | Enzo Life Sciences (Lausen, Switzerland) | BML-KC158 | |
| Penicillin-Streptomycin solution | Gibco/ThermoFisher (Reinach, Switzerland) | 15140-122 | |
| Trypan Blue Solution, 0.4% | Gibco/ThermoFisher (Reinach, Switzerland) | 15250061 |
Referencias
- Guo, L. Estimating the risk of drug-induced proarrhythmia using human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 123, 281-289 (2011).
- Jonsson, M. K., Wang, Q. D., Becker, B. Impedance-based detection of beating rhythm and proarrhythmic effects of compounds on stem cell-derived cardiomyocytes. Assay and Drug Development Technologies. 9, 589-599 (2011).
- Kattman, S. J., Koonce, C. H., Swanson, B. J., Anson, B. D. Stem cells and their derivatives: a renaissance in cardiovascular translational research. Journal of Cardiovascular Translational Research. 4 (1), 66-72 (2011).
- Ma, J. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sube, R., Ertel, E. A. Cardiomyocytes Derived from Human Induced Pluripotent Stem Cells: An In-Vitro Model to Predict Cardiac Effects of Drugs. Journal of Biomedical Science and Engineering. 10 (11), 23 (2017).
- Sirenko, O. Multiparameter in vitro assessment of compound effects on cardiomyocyte physiology using iPSC cells. Journal of Biomolecular Screening. 18, 39-53 (2013).
- VanderPlas, J. T. Understanding the Lomb-Scargle Periodogram. Cornell Univeristy Library. , (2017).
- Strober, W. Trypan Blue Exclusion Test of Cell Viability. Current Protocols in Immunology. 111, (2015).
- Ertel, E. A., Godfraind, T., Godfraind, T. Calcium channel blockers and calcium channels. Calcium Channel Blockers. , 11-80 (2004).
- Sanguinetti, M. C. Modulation of potassium channels by antiarrhythmic and antihypertensive drugs. Hypertension. 19, 228-236 (1992).
- Duran-Riveroll, L. M., Cembella, A. D. Guanidinium Toxins and Their Interactions with Voltage-Gated Sodium Ion Channels. Marine Drugs. 15 (10), (2017).
- Sharma, A. High-throughput screening of tyrosine kinase inhibitor cardiotoxicity with human induced pluripotent stem cells. Science Translational Medicine. 9 (377), (2017).
- Puppala, D. Comparative gene expression profiling in human-induced pluripotent stem cell--derived cardiocytes and human and cynomolgus heart tissue. Toxicological Sciences. 131 (1), 292-301 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados