Method Article
Contrações do citoplasma de casos humanos-iPSC-derivado medida com um corante fluorescente de Ca-sensíveis em placas de 384 poços de temperatura controlada
Neste Artigo
Resumo
Espontaneamente, contratantes citoplasma dos cardiomyocytes derivado pluripotentes induzidas pelo homem as células estaminais são modelos úteis de fisiologia cardíaca humana e farmacologia. Aqui nós apresentamos um sistema de rastreio com throughput alto para quantificar os efeitos de compostos exógenos sobre batendo frequência, usando uma tintura fluorescente Ca-sensível e um leitor de placa multi bem imagem com temperatura controlada.
Resumo
Espontaneamente, contratantes citoplasma dos cardiomyocytes derivado pluripotentes induzidas pelo homem (hiPSC CM) as células-tronco são um modelo útil de fisiologia cardíaca humana e farmacologia. Vários métodos têm sido propostos para registrar esta atividade espontânea e para avaliar os efeitos da droga, mas muitos destes métodos sofrem de throughput limitado e/ou relevância fisiológica. Desenvolvemos um sistema de rastreio com throughput alto para quantificar os efeitos dos compostos exógenos na frequência de batida do hiPSC-CM, usando uma tintura fluorescente Ca-sensível e um leitor de placa multi bem imagem com temperatura controlada. Descrevemos como preparar as placas de célula e as placas de composto e como executar o ensaio automatizado para atingir alta sensibilidade e reprodutibilidade. Descrevemos também como transformar e analisar os dados de fluorescência para fornecer medidas confiáveis de efeitos de drogas em ritmo espontâneo. Este ensaio pode ser usado em programas de descoberta de drogas para orientar a otimização química longe do centro, ou na direção, compostos que afetam a função cardíaca humana.
Introdução
O presente protocolo descreve um método para medir os efeitos da droga sobre a frequência de espancamento espontânea de citoplasma de hiPSC-CM em ritmos fisiologicamente relevantes. Células-tronco pluripotentes induzidas pelo homem pode diferenciar em cardiomyocytes funcionais que estabelecem espontaneamente surra citoplasma em vitro1,2,3,4. Estes hiPSC-CM pode ser obtido em grandes números, através de provedores comerciais ou através da produção em laboratório, e eles são uma fonte útil de células para gerar modelos de fisiologia cardíaca humana e farmacologia. Em particular, pode ser usados para prever ou para caracterizar os efeitos cardíacos que podem ocorrer quando uma droga é administrada a humanos5.
A frequência de batimento de citoplasma hiPSC-CM pode ser medida sob condições fisiológicas, usando matrizes de microeletrodos ou impedância sensoriamento1: estas técnicas não invasivas fornecem informações muito detalhadas sobre efeitos de drogas, mas eles são bastante baixa produtividade e eles não permitem o teste grandes bibliotecas compostas dentro de tempo realista e restrições orçamentárias. Um sistema mais eficaz pode ser elaborado utilizando uma fluorescência 384-bem leitor de placa de imagem e um Ca-sensível tingir6, mas leitores de placa clássica são prejudicados pela frequência de aquisição e controle de temperatura subótima. Estas limitações são ilustradas por espancamento unphysiological taxas (~ 15 bpm, em comparação com 35 – 55 bpm em ambientes controlados1) e resolução de sinal Ca pobre (uma frequência de aquisição de 8 Hz é o limite inferior para taxas de registro que pode chegar a 120 bpm sob condições estimuladas, e ele não pode extrair informações como inclinação ou duração). O método descrito aqui combina a gravação de bater padrões em ritmos fisiológicos e em resolução suficiente para impedir que estas preocupações.
No lado positivo, esse método é simples, confiável e de alta taxa de transferência, que permite a testes rápidos de um grande número de compostos a custos razoáveis. Do lado negativo, este método requer um leitor rápido com controle de temperatura efetiva, que é um investimento caro, e fornece informações pouco mecanicistas sobre efeitos de droga observados, que podem exigir novos testes com mais detalhada métodos.
Cerca de 6 x 106 CM hiPSC são necessários para uma medição em uma placa de células de 384 poços. hiPSC-CM são geralmente fornecidos comercialmente como alíquotas congeladas de ~ 4 x 106 células em 1 mL. Portanto, é conveniente preparar duas placas de célula com três alíquotas congeladas. Na maioria dos casos, devido à baixa variabilidade deste teste, é suficiente realizar medições duplicadas dos compostos teste e, em cada placa de células, quadruplicado medições de controlo positivo (forskolina, adenosina-N6-ciclopentílico e E-4031), e 20-plicate medições do controle negativo (DMSO sozinho). Portanto, um máximo de 352 composto/concentração de pares pode ser avaliado com duas placas de célula de 384 poços. O seguinte protocolo considera tal experiência realizada com 352 teste compostos, duas placas de célula e 12 milhões células fornecidas como três alíquotas congeladas; pode ser facilmente dimensionada-se se os pontos de dados adicionais são necessários.
Protocolo
1. preparação das placas da célula
Nota: Prepare as placas de célula 3–4 semanas antes da medição dos efeitos de drogas.
- Dia 0 do experimento
Nota: para fins de planejamento, a aplicação de compostos de teste pode ser realizada em qualquer dia entre os dias 22–28 do experimento.- Prepara o banho de água a 37 ° C e aquecer a 40 mL de meio de chapeamento (conforme fornecido pelo fabricante).
Nota: Use as células com seus meios cultura e manutenção correspondentes fornecido pelo fornecedor. - Descongele o hiPSC-CM, colocando o cryotubes contendo células congeladas em banho-maria por 2 min.
- Transferi cuidadosamente as suspensões celulares de 1 mL para um tubo cónico de 50 mL.
- Lave cada criotubo com 1 mL de meio de chapeamento quente para recuperar as células restantes e adicionar a mídia de lavagem para o mesmo tubo cónico de células contendo passo 1.1.3.
- Misture cuidadosamente outro 8 mL de meio de chapeamento quente para a suspensão de eritrócitos.
- Contagem de células vivas, usando o método de exclusão trypan azul e um hematocytometer8.
Nota: O requisito de 6 x 106 células para uma placa de células 384-bem considera a possibilidade de até 20% de células mortas entre as células congeladas, que é um máximo em nossa experiência. - Ajuste a suspensão de eritrócitos a 5 x 105 ao vivo células/mL com o chapeamento quente médio.
- Distribua a suspensão de células em duas placas de célula 384-bem adicionando 25 µ l de cada poço (aproximadamente 12.500 células por poço).
Nota: As placas de célula não precisam ser revestidos com qualquer matriz (ver discussão). - Manter as placas de célula a 37 ° C numa atmosfera umidificada contendo 5% de CO2.
- Prepara o banho de água a 37 ° C e aquecer a 40 mL de meio de chapeamento (conforme fornecido pelo fabricante).
- 1 dia do experimento
- Transformar-se em banho-maria a 37 ° C e quente 50 mL de meio de manutenção suplementado com solução de penicilina-estreptomicina 1% v/v.
- Substitua o meio de chapeamento com 50 µ l de meio de manutenção quente em cada poço das placas da célula.
- Dias 2–21 (até dia 27) do experimento
Nota: O hiPSC-CMs não precisam qualquer passagem ao longo deste período, como eles são não-dividindo as células.- Metade do meio de manutenção renovar cada 2–, 3 dias e renová-lo inteiramente nos dias 7, 14 e 21.
Nota: A medição de fluorescência pode ser realizada entre os dias 22 e 28 do experimento. Durações mais longas não foram tentadas, mas ainda podem ficar bem.
- Metade do meio de manutenção renovar cada 2–, 3 dias e renová-lo inteiramente nos dias 7, 14 e 21.
2. preparação do instrumento, composto de chapas e placas de ensaio
Nota: preparar o instrumento, placas compostas e ensaio de placas no dia da medição dos efeitos de drogas, entre os dias 22 e 28 do experimento. Usar um leitor de placa fluorescente, equipado com controle de temperatura e uma luz de kit e excitação de filtro apropriado fluorescência fonte. Por exemplo, usar um kit de filtro de fluorescência Fluo-3/Fluo-4/Fluo-8 (excitação: 472 nm; emissão: 520–560 nm) e uma unidade de fonte de luz de excitação W 150.
- Pelo menos 2 h antes da primeira placa de celular é para ser colocado dentro o leitor para a medição, ligue o leitor e definir o sistema de aquecimento a 37 ° C.
Nota: isto também pode ser feito na noite anterior. - Prepare os controlos positivos, forskolin, adenosina-N6-ciclopentílico e E-4031 como as soluções de 0,33 mM em DMSO, 10mm em DMSO e 3,33 mM de H2O, respectivamente.
Nota: soluções de estoque serão diluídas 333-fold quando eles são adicionados às células, e o objetivo é alcançar concentrações de teste final de 1 µM forskolin, 30 µM N6-ciclopentílico-adenosina e 10 µM E-4031, que produzem efeitos confiáveis e reproduzíveis. - Prepare os 352 compostos de teste como soluções estoque de DMSO em 333-fold as concentrações de ensaio planejado (por exemplo, 10 mM para um teste de 30 µM).
Nota: O objectivo é conseguir uma concentração final de 0,3% (v/v) DMSO na placa celular após a aplicação do composto; Esta é a maior concentração de DMSO que não afeta a atividade rítmica do cardiomyocytes. As soluções estoque também podem ser preparadas no dia anterior. Um mínimo de 5 µ l da solução estoque é necessário para cada medição duplicada. - Prepare os pratos compostos.
- Quente 40 mL de meio de manutenção suplementado com solução de penicilina-estreptomicina 1% v/v a temperatura ambiente.
- Distribuir em duas placas 384-bem compostas adicionando 1,5 µ l de solução-mãe por alvéolo: i) os compostos de teste (dois poços cada), ii) controlo positivo (forskolina, adenosina-N6-ciclopentílico e E-4031, quatro poços por placa composta) e iii) e o negativo controle (DMSO, 20 poços por placa composta).
- Centrifugue os pratos compostos a 100 x g por 1 min.
- Adicione 37 µ l de meio de manutenção à temperatura ambiente para cada poço (3,9% DMSO em 38,5 µ l nessa fase).
- Centrifugue os pratos compostos a 100 x g por 1 min.
- Carrega as placas compostas para o leitor.
Nota: As próximas etapas devem ser realizadas logo que possível para minimizar a evaporação nas placas de composto.
- Prepare o corante fluorescente.
- Transformar-se em banho-maria a 37 ° C e quente 100 mL de meio de manutenção suplementado com solução de penicilina-estreptomicina 1% v/v.
- Reconstitua a tintura fluorescente de Ca-sensíveis e quencher com 10 mL de meio de manutenção quente com antibióticos.
Nota: este meio de fluorescência estoque contém o corante fluorescente Ca-sensível, geralmente Fluo-4 e um quencher e qualquer sobra pode ser armazenada a 4 ° C durante pelo menos 5 dias.
3. aquisição de dados
Nota: realizar a aquisição de dados no dia da medição dos efeitos de drogas. Executar etapas 3.1–.10 inteiramente para a primeira célula de chapa, em seguida, repeti-los para a segunda placa de células.
- Inicie o software de leitor de placa (se necessário) e carregar as pontas de pipeta.
- Ajuste as configurações de software para gravar um segmento de 2 min de ondas de cálcio com uma frequência de aquisição de pelo menos 10 Hertz para definir a taxa de batida de linha de base para cada poço.
- Para uma placa de células, dilua 3 mL do meio de estoque de fluorescência em 12 mL de meio de manutenção quente com antibióticos para fazer o meio de fluorescência.
- Substitua a 20 µ l de meio em cada poço da placa de célula 30 µ l de meio de fluorescência.
- Pipetar e descer 1 x para misturar.
- Coloque a placa de celular para o leitor mais rápido possível para deixar o hiPSC-CM aclimatar à temperatura.
- Espere por 60 min antes de iniciar a aquisição de dados.
- Inicie a aquisição de dados do software de leitor de placa para gravar um segmento de 2 min de ondas de Ca com uma frequência de aquisição de pelo menos 10 Hz, para definir a linha de base batendo a taxa para cada poço.
Nota: para cada sequência de gravação, certifique-se que a placa de célula não é transferida automaticamente fora o dispositivo após a aquisição de dados. Isso impede que a placa de células de arrefecimento à temperatura ambiente. Com algumas versões do software de leitor de placa, pode ser necessário parar a cada gravação antes que termine completamente para conseguir isso. - Adicionar os compostos de teste e de referência com o robô de leitor de placa pipetando para-bem 5 µ l do prato composto na placa da célula (após a adição, a concentração de DMSO é 0,3% [v/v]).
- Iniciar a aquisição de dados do software de leitor de placa para registro min 2 segmentos de ondas de Ca, começando com 5, 15, 30, 45 e 60 min após a adição de composto (certifique-se cada vez que a placa de células permanece no dispositivo).
4. análise de dados
Nota: A análise de dados pode ser executada a qualquer momento após a medição.
- Exporte os dados brutos para cada período de gravação a partir do software de leitor de placa como arquivos de texto ASCII.
- Importe os dados brutos para o software de análise de dados.
- Para cada poço e todos os pontos de tempo, extrair a frequência de batida principal.
Nota: Com o software de análise de dados listado na Tabela de materiais, bater as frequências pode ser calculado com uma rotina de análise personalizada usando a função LombPeriodogram, baseada no método de análise espectral de mínimos quadrados7 Lomb – Scargle . A periodograma deve ser calculada para uma gama de frequências entre 0,01 e 5 Hz. A frequência principal pode ser extraída da periodograma usando as rotinas de PeakAutoFind. Este método de análise fornece medições mais precisas de bater as frequências que o método fornecido como uma opção com o software de leitor de placa. No entanto, este último pode ainda ser usado se a personalização do software não é uma opção. - Exporte as frequências de espancamento primário para cada período de gravação a partir do software de análise de dados como cópias de transferência ou como arquivos de texto ASCII.
- Importe as frequências de espancamento primário para um software de planilha por colar da área de transferência ou importação de arquivos de texto.
Nota: etapas 4.5–4.9 podem ser executadas em qualquer software de planilha eletrônica moderna. - Para cada poço, normalizar a linha de base a frequência pulsante em cada ponto de tempo após a aplicação da droga (5, 15, 30, 45 e 60 min), dividindo a frequência principal batendo naquela época apontar pela frequência primária batendo na linha de base.
- Calcular o efeito de DMSO médio em cada ponto de tempo após a aplicação da droga (5, 15, 30, 45 e 60 min) calculando os valores normalizados para 20 poços onde DMSO foi aplicado.
- Para cada bem e cada vez ponto após a aplicação da droga (5, 15, 30, 45 e 60 min), subtrair o efeito médio DMSO (tempo-combinadas) para o mesmo prato.
- Média das medições duplicadas.
Nota: se um composto altera a frequência ou o software não consegue encontrar uma frequência primária após a adição de composto, um exame visual do padrão surra pode avaliar se o composto produzido arritmias.
Resultados
A Figura 1 mostra uma gravação representativa das ondas de Ca na linha de base através de uma placa de 384. Na maioria dos casos, todos os poços revelam uma taxa de batida regular com pouca variabilidade através da placa (média ± DP = 40.1 ± 3,5 bpm; intervalo = 34 – 54 bpm). Muito ocasionalmente (menos de 1 em 10 experimentos), alguns poços (menos de 5) tem arritmia ou ausência de ritmo. Em três placas de 384-bem, nós também tentamos cardiomyocytes de outro fornecedor (ver Tabela de materiais) e obteve valores de linha de base muito semelhante a surra espontânea.
Bloqueadores de canais iônicos cardíacos afetam o ritmo do cardiomyocytes em uma maneira reprodutível5. Amlodipina, um bloqueador do lento Ca canais9, acelera o ritmo mais do que 100% de forma concentração-dependente até 1 µM (Figura 2A). O efeito é bem desenvolvido dentro o primeiro 5 min, mas ainda aumenta aproximadamente 50% nos próximos 30 min antes de estabiliza. Acima de 1 µM, amlodipina prende a surra (linhas tracejadas), como pode ser esperado do fato de que Ca ciclismo é fundamental para as contrações espontâneas. Outros bloqueadores de canais de Ca do dihydropyridine seletiva produzam efeitos muito semelhantes.
E-4031, um bloqueador dos canais de retificador retardado rápida K10, desacelera o ritmo, cerca de 65–70% de forma concentração-dependente até 10 µM (Figura 2B). O efeito desenvolve-se dentro o primeiro 5 min e isso não varia dentro próximos 60 min. Outros bloqueadores seletivos de IKr produzem efeitos semelhantes, embora a redução máxima taxa pode variar (por exemplo, 35–40% para cisapride, 70% para E-4031 e 90% - 95% para dofetilida). A base para esta disparidade não é conhecida.
Tetrodotoxina, um bloqueador do rápido at canais11, desacelera o ritmo, cerca de 15% de forma concentração-dependente, até 30 de–1 µM (Figura 2). O efeito é bem desenvolvido dentro o primeiro 5 min... e isso não varia muito nos próximos 60 min. No entanto, acima de 30 µM, tetrodotoxina prende o espancamento dentro o primeiro 5 min, Considerando que, após 30 min, prende-lo acima de 1 µM. Outros bloqueadores de canais de Na, tais como a lidocaína ou mexiletina, produzam efeitos similares do tudo ou nada.
Bepridil, um bloqueador misto de cardíacos Na, Ca e K canais9, também produz um efeito de tudo ou nada (Figura 2D). Isto sugere que nesta preparação, um bloco de canais at é a ação principal de bepridil. Uma aceleração devido ao bloqueio do canal de Ca não é vista, e o mais progressivo abrandar devido IKr bloco aparece mascarado pelo efeito Na canal.
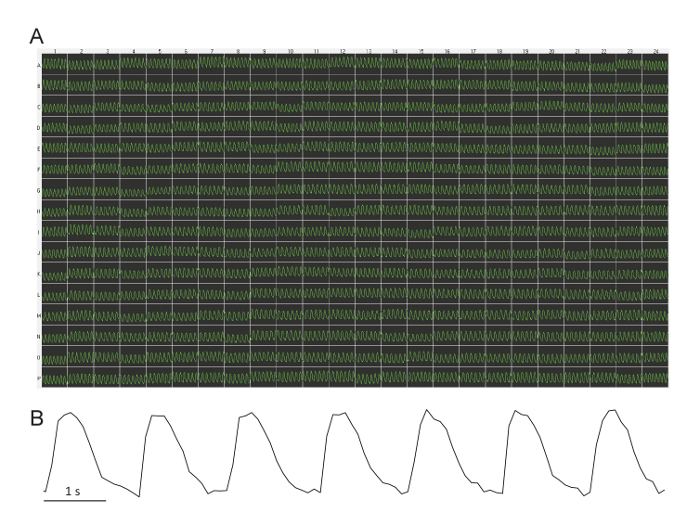
Figura 1: representante de base Ca ondas através de uma placa de 384. (A) todos os poços de uma placa de demonstram uma taxa de batida regular com pouca variabilidade. Esta imagem é capturada diretamente a partir do software de leitor de placa. Cada traço é 10 s em duração. A intensidade da fluorescência é arbitrárias (luz unidades relativas derivadas a câmera de vídeo em tons de cinza). (B) esta Blow-up de um 10 rastreamento de s mostra o baixo ruído do sinal. Clique aqui para ver uma versão maior desta figura.
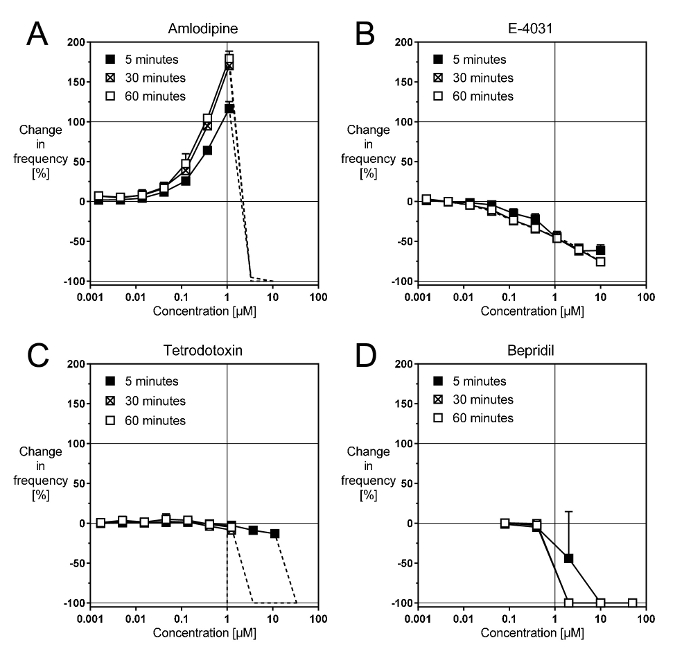
Figura 2: efeitos representativos do íon cardíaco canal bloqueadores. Estes painéis mostram curvas concentração-resposta com o (A), a seletiva Ca Canal bloqueador amlodipina, bloqueador (B) a seletiva IKr E-4031, (C) o bloqueador de canal de Na seletiva TTX e (D), o canal não-seletivo bloqueador bepridil. Clique aqui para ver uma versão maior desta figura.
Discussão
Dois aspectos são mais críticos para a gravação bem sucedida de frequências a bater. A primeira é ter alguma cautela com chapeamento de célula e cultura. Em particular, é importante tentar evitar riscar a camada de células no fundo dos poços quando o meio de troca. É aceitável para tocar no fundo dos poços com a pipeta, mas deve ser usado o mesmo ângulo, cada vez, produzindo, assim, só um pequeno arranhão na camada de células e não afetando o desempenho. O segundo aspecto crítico da obtenção reprodutíveis ritmos homogêneos é fornecer controle de boa temperatura a 37 ° C em toda a placa de células para a duração da medição. Não poderíamos obter esta homogeneidade usando dispositivos que não sejam o leitor usado aqui, mas ela pode ser viável com modificações especiais para a regulação da temperatura: faria o protocolo aqui apresentado mais amplamente utilizáveis para além de uma única marca de placa leitor. Para alcançar estabilidade de temperatura para a duração da experiência com o dispositivo utilizado aqui, foi necessário parar a cada gravação antes de que terminou; caso contrário, o robô que ejetar a placa celular medida. Esta questão técnica pode desaparecer com a próxima versão do software de leitor de placa, mas continua a ser crítica agora. Se uma placa de células por engano é transferida fora o leitor, deve ser carregado para dentro tão rapidamente como possível. No entanto, a qualidade da experiência irá deteriorar-se, porque as mudanças de temperatura afetam a taxa de batida extremamente rápida.
Alguns outros aspectos, que não tenham sido testados exaustivamente, podem ser menos importantes. Por exemplo, os fabricantes de hiPSC-CM recomendam placas de cultura de células de revestimento antes da semeadura das células, mas neste ensaio específico, revestimento não foi usado, porque as células aderem facilmente em várias superfícies, e é muito difícil corretamente casaco 384-bem placas. Ainda, placa de células de revestimento ainda pode ser permitido, ou mesmo pode melhorar a qualidade do ensaio. Também nunca testamos se solventes além de DMSO seria aceitáveis, mas espera-se da experiência com outras tecnologias de gravação que concentrações semelhantes de EtOH ou MeOH também seria toleráveis. Geralmente usamos hiPSC-CMs do mesmo fabricante, e células de apenas um fornecedor adicional foram testadas, que apareceu para trabalhar de forma semelhante. Do mesmo modo, usamos apenas um pequeno número de diferentes lotes de hiPSC-CMs que foram selecionados pelo prechecking-los para verificar que eles se comportaram da mesma forma para o lote inicial. Um ou dois lotes foram considerados inadequados porque seu citoplasma tinha estabilidade pobre ou reprodutibilidade sob as condições de cultura usado aqui. Caso contrário, a farmacologia apareceu muito semelhante em lotes ao testar um painel limitado de compostos "típicos" (forskolina, adenosina-N6-ciclopentílico e E-4031, bem como endotelina, isoproterenol, amlodipina e ponesimod). Só usamos hiPSC-CM derivado de doadores saudáveis. Pode ser útil para avaliar se as derivadas de pacientes com doença cardíaca hiPSC-CM forneceria resultados diferentes, embora não entre os doadores saudáveis e pacientes foi observada diferença ao avaliar a cardiotoxicidade dos inibidores de tirosina quinase 12. finalmente, normalmente esperamos 22 – 28 dias na cultura antes de medir os efeitos de drogas: em nossa experiência com gravações de impedância das mesmas células, um estado estacionário para lento impedância (um indicador de estabilidade de camada de células) e impedância rápida (um indicador de batendo a frequência) é atingido após 12–15 dias em cultura. No entanto, decidimos esperar 22–28 dias, porque este é o momento quando o perfil de expressão de marcadores de maturação e canais cardíacos estabilizou13. Não foi averiguado se resultados comparáveis seria obtidos se as células foram usadas mais cedo ou mais tarde.
O protocolo descrito aqui usa uma muito simples medição da taxa de espancamento espontânea do hiPSC-CM para avaliar os potenciais efeitos de droga na Eletrofisiologia Cardíaca humana. Suas principais vantagens sobre outras metodologias são i) é passível de um ambiente de seleção da elevado-produção, ii) registra a atividade do cardiomyocytes e os efeitos das drogas em temperaturas fisiológicas, e iii) não exige eletrofisiológicos conhecimentos especializados para a execução ou para uma avaliação dos resultados.
Em um estudo de validação realizado com muitos medicamentos aprovados para uso humano, mostramos que o ensaio reage aos medicamentos usados na medicina humana como previsto pelos actuais dados clínicos5. Porque este método considera todos os potenciais efeitos no ritmo cardíaco, complementa o abrangente em vitro pró-arrítmica ensaio (CiPA) iniciativa14 que especificamente avalia potencial pro-arrítmicos.
No futuro, esse método poderia fornecer uma compreensão ainda mais do modo-de-ação de drogas mostrado para afetar a taxa de espancamento espontânea. É provável que informações adicionais mecanicistas estão presentes nas gravações da fluorescência de transientes de Ca (por exemplo, em sua amplitude ou forma). Se as gravações de fluorescência são executadas em maiores taxas de aquisição (por exemplo, 30 Hz), esses parâmetros são facilmente extraídos além de bater a taxa, e pode ser interessante correlacionar alterações nesses parâmetros com os efeitos conhecidos de clinicamente usado drogas.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores têm sem confirmações.
Materiais
| Name | Company | Catalog Number | Comments |
| FDSS7000 fluorescent plate reader | Hamamatsu Photonics (Massy, France) | not a catalog item | |
| FDSS7000 Fluo-3/Fluo-4/Fluo-8 fluorescence filter kit | Hamamatsu Photonics (Massy, France) | installed initially in the device | |
| FDSS7000 temperature control | Hamamatsu Photonics (Massy, France) | A10118-09 | |
| FDSS7000 150-W Excitation Light Source Unit | Hamamatsu Photonics (Massy, France) | C11653-11 | |
| FDSS7000 pipet tips for 384-well plates | Hamamatsu Photonics (Massy, France) | A8687-62 | |
| Waveform Analysis Software for Cardiomyocytes | Hamamatsu Photonics (Massy, France) | U8524-12 | optional alternative to the Igor Pro software |
| Igor Pro data analysis software | Wavemetrics (Portland, Oregon, USA) | Latest version | |
| iCell-Cardiomyocytes Kit | Cellular Dynamics International (Madison, WI) | R1106 | includes cells, plating and maintenance media |
| Cor.4U Cardiomyocyte Kit | Ncardia Germany (Cologne, Germany) | Ax-B-HC02-4M | includes cells, plating and maintenance media alternative to the iCell-Cardiomyocytes |
| 384-well cell culture plates | Greiner-Bio-One (Frickenhausen, Germany) | 781091 | |
| 384-well compound plates | Greiner-Bio-One (Frickenhausen, Germany) | 781280 | |
| FLIPR Calcium 4 Assay Kit | Molecular Devices (Sunnyvale, California) | R8142 | |
| Forskolin | Sigma-Aldrich (Buchs, Switzerland) | F6886 | |
| N6-cyclopentyl-adenosine | Sigma-Aldrich (Buchs, Switzerland) | C8031 | |
| E-4031 | Enzo Life Sciences (Lausen, Switzerland) | BML-KC158 | |
| Penicillin-Streptomycin solution | Gibco/ThermoFisher (Reinach, Switzerland) | 15140-122 | |
| Trypan Blue Solution, 0.4% | Gibco/ThermoFisher (Reinach, Switzerland) | 15250061 |
Referências
- Guo, L. Estimating the risk of drug-induced proarrhythmia using human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 123, 281-289 (2011).
- Jonsson, M. K., Wang, Q. D., Becker, B. Impedance-based detection of beating rhythm and proarrhythmic effects of compounds on stem cell-derived cardiomyocytes. Assay and Drug Development Technologies. 9, 589-599 (2011).
- Kattman, S. J., Koonce, C. H., Swanson, B. J., Anson, B. D. Stem cells and their derivatives: a renaissance in cardiovascular translational research. Journal of Cardiovascular Translational Research. 4 (1), 66-72 (2011).
- Ma, J. High purity human-induced pluripotent stem cell-derived cardiomyocytes: electrophysiological properties of action potentials and ionic currents. American Journal of Physiology Heart and Circulatory Physiology. 301 (5), H2006-H2017 (2011).
- Sube, R., Ertel, E. A. Cardiomyocytes Derived from Human Induced Pluripotent Stem Cells: An In-Vitro Model to Predict Cardiac Effects of Drugs. Journal of Biomedical Science and Engineering. 10 (11), 23 (2017).
- Sirenko, O. Multiparameter in vitro assessment of compound effects on cardiomyocyte physiology using iPSC cells. Journal of Biomolecular Screening. 18, 39-53 (2013).
- VanderPlas, J. T. Understanding the Lomb-Scargle Periodogram. Cornell Univeristy Library. , (2017).
- Strober, W. Trypan Blue Exclusion Test of Cell Viability. Current Protocols in Immunology. 111, (2015).
- Ertel, E. A., Godfraind, T., Godfraind, T. Calcium channel blockers and calcium channels. Calcium Channel Blockers. , 11-80 (2004).
- Sanguinetti, M. C. Modulation of potassium channels by antiarrhythmic and antihypertensive drugs. Hypertension. 19, 228-236 (1992).
- Duran-Riveroll, L. M., Cembella, A. D. Guanidinium Toxins and Their Interactions with Voltage-Gated Sodium Ion Channels. Marine Drugs. 15 (10), (2017).
- Sharma, A. High-throughput screening of tyrosine kinase inhibitor cardiotoxicity with human induced pluripotent stem cells. Science Translational Medicine. 9 (377), (2017).
- Puppala, D. Comparative gene expression profiling in human-induced pluripotent stem cell--derived cardiocytes and human and cynomolgus heart tissue. Toxicological Sciences. 131 (1), 292-301 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados