Method Article
Técnicas Reproductivas para el Monitoreo y Control de La Ovacada en Anfibios
En este artículo
Resumen
El estudio de la biología de los anfibios proporciona información valiosa sobre los procesos reproductivos, fisiológicos, embrionarios y de desarrollo que impulsan los organismos de muchos grupos taxonómicos. Aquí, presentamos una guía completa sobre diferentes metodologías que se pueden utilizar para estudiar el control y monitoreo ovárico en anfibios.
Resumen
El control y monitoreo ovárico en anfibios requieren un enfoque multifacético. Existen varias aplicaciones que pueden inducir con éxito comportamientos reproductivos y la adquisición de gametos y embriones para la investigación fisiológica o molecular. Los anfibios contribuyen a una cuarta parte a un tercio de la investigación de vertebrados, y de interés en este contexto es su contribución al conocimiento de la comunidad científica sobre los procesos reproductivos y el desarrollo embrionario. Sin embargo, la mayor parte de este conocimiento se deriva de un pequeño número de especies. En los últimos tiempos, la diezma de los anfibios en todo el mundo ha requerido una mayor intervención de los conservacionistas. Las colonias cautivas de recuperación y aseguramiento que siguen surgiendo en respuesta al riesgo de extinción hacen que la investigación existente y las aplicaciones clínicas sean invaluables para la supervivencia y reproducción de anfibios mantenidos bajo cuidados humanos. El éxito de cualquier población cautiva se basa en su salud y reproducción y la capacidad de desarrollar descendencia viable que lleva adelante la más diversa representación genética de su especie. Para los investigadores y veterinarios, la capacidad de monitorear y controlar el desarrollo ovárico y la salud es, por lo tanto, imperativo. El objetivo de este artículo es destacar las diferentes técnicas de reproducción asistida que se pueden utilizar para monitorear y, cuando sea apropiado o necesario, controlar la función ovárica en los anfibios. Idealmente, cualquier problema reproductivo y de salud debe reducirse a través de una correcta cría cautiva, pero, como con cualquier animal, los problemas de salud y patologías reproductivas son inevitables. Las técnicas no invasivas incluyen evaluaciones conductuales, inspección visual y palpación y mediciones morfométricas para el cálculo de índices de condición corporal y ultrasonido. Las técnicas invasivas incluyen inyecciones hormonales, muestreo de sangre y cirugía. El control ovárico se puede ejercer de varias maneras dependiendo de la aplicación requerida y las especies de interés.
Introducción
Los anfibios han sido reconocidos durante mucho tiempo como modelos biológicos y médicos importantes por una amplia gama de disciplinas de investigación. Los datos obtenidos mediante el estudio de especies particulares como Xenopus laevis y X. tropicalis, la rana Leopard (Lithobates (anteriormente Rana) pipiens) y el axolotl (Ambystoma mexicanum) se han aplicado a otras especies de vertebrados, incluidos los humanos. Las técnicas veterinarias, de cría y de reproducción asistida que han surgido del estudio de estos y otros anfibios proporcionan asistencia a aquellos encargados de desarrollar cuidado, mantenimiento y sostenibilidad exitosos de poblaciones más raras en cautiverio 1 , 2 , 3 , 4.
Se está ganando interés por el uso simultáneo de enfoques basados en la conservación in y ex situ para revertir la marea de extinción para muchos en riesgo de las especies de anfibios1,2. Este artículo proporciona las metodologías actualmente disponibles para monitorear y controlar la función ovárica de anfibios en especies modelo de anananos y caudáneos. Además, se presentan las técnicas existentes para abordar una patología reproductiva común de la retención de óvulos.
Como en muchos grupos taxonómicos, el control ovárico de anfibios implica una serie de interacciones estrechamente sincronizadas entre el medio ambiente y la fisiología. La temperatura y el fotoperiodo (conocidos como señales próximas) son decodificados por el ojo y elcerebro donde se convierten rápidamente en procesos genéticos, hormonales y circadianos (señales finales) 3,4. Los métodos para supervisar y controlar la función ovárica que se tratan en este artículo incluyen técnicas invasivas y no invasivas. Los requisitos institucionales de investigación y enseñanza del Comité Institucional de Cuidado y Uso de Animales (IACUC) definen las técnicas no invasivas como aquellas que no causarán un mínimo o ningún dolor físico o angustia mental y no requieren medicamentos para aliviar el dolor5. Aquí, las técnicas no invasivas incluyen inspección visual y palpación, observaciones conductuales, evaluaciones morfométricas y ultrasonido. Por el contrario, las técnicas de recolección de sangre, administración de hormonas y cirugía (ovariectomía y eliminación de óvulos retenidos) se clasifican como invasivas ya que pueden resultar en algún dolor o malestar y requieren anestesia o terapia farmacológica post-procesal.
Las técnicas de monitoreo ovárico no invasivo se pueden incorporar fácilmente a la rutina de cuidado diario para la mayoría de los anfibios cautivos. Dependiendo de la especie, la gravedad ovárica a menudo se puede determinar mediante una simple inspección visual (rana de vidrio). En otros casos, la palpación puede indicar si una hembra está gravitada. Varios índices de condición corporal (ICC) tales como peso, longitud de uroestilo de hocico (SUL), longitud de salida-ventilación (SVL) e índice de masa estándar (SMI) están disponibles para predecir la presencia o ausencia de huevos4,6,7, 8,9. Sin embargo, se debe tener cuidado con la interpretación de los resultados, ya que la mayoría no tiene en cuenta la edad, la forma del cuerpo o la composición (por ejemplo, agua retenida frente a la masa ovárica o grasa)6. Los diagnósticos reproductivos definitivos se pueden lograr a través de ultrasonidoscon un conocimiento más profundo adquirido con respecto al desarrollo del óvulo y la puesta en escena del ciclo de ovario 4,7. El ultrasonido también proporciona un medio para confirmar ymonitorear las patologías reproductivas y las condiciones fisiológicas asociadas 4,8.
Además de proporcionar información sobre el estado de salud, el muestreo de sangre se puede utilizar para medir las hormonas reproductivas. Si el perfil hormonal es el objetivo final, es importante evitar las influencias relacionadas con el estrés que pueden confundir datos de esteroides sistémicos. Mientras que una herramienta de monitoreo potencialmente poderosa, todavía no hay un estudio que demuestre respuestas endocrinológicas innatas a la administración de hormonas exógenas en cualquier especie de anfibio. La sangre se puede tomar con seguridad de varios sitios; en las ranas esto incluye la vena abdominal ventral,plexo lingual, vena femoral y corazón 9,10. En Caudates, se recoge sangre de la vena de la cola ventral. El grado de invasividad, la cantidad de restricción requerida, la necesidad de anestesia, la delicadeza del órgano al que se dirige y el tamaño del animal son factores a tener en cuenta a la hora de elegir una técnica de recolección para el paciente anfibio. Este artículo presentará la técnica de recolección de sangre de la vena maxilar facial o musculocutánea de las ranas como se describió originalmente por Forzan et al.9.
El control ovárico es específico de la especie y, como tal, los protocolos hormonales deben ser probados y optimizados. Aparte de la estacionalidad y el entorno de la hormona circulante asociado, el control ovárico también puede estar estrechamente relacionado con la edad, el tiempo dedicado al cautiverio y la exposición a la administración repetida de hormonas, para lo cual hay poca información en la literatura11 , 12 , 13. La implementación de terapias hormonales para obtener comportamientos reproductivos, producción de gametos, maduración y oviposición se ha convertido en un enfoque ampliamente informado para resolver problemas reproductivos comunes asociados con el cautiverio4, 8,14,15,16. Debido a que los mecanismos que controlan la reproducción en los vertebrados están altamente conservados, hay una serie de hormonas, neuropéptidos y fármacos disponibles comercialmente utilizados terapéuticamente en otros grupos taxonómicos que también se pueden utilizar de forma fiable en una serie de especies de anfibios (Tabla 1). Hormona liberadora de gonadotropina (GnRH) y gonadotropina coriónica humana (hCG) (o variaciones de la misma, es decir, PMSG y eCG)17,18, ya sea individualmente o en combinación, se han utilizado extensamente en anfibios cautivos programas de cría que incluyen: el boreal de las Montañas Rocosas del Sur (Anaxyrus boreas boreas)4,19,20; el sapo, rana Dusky Gopher, Rana sevosa (Langhorne et al., inédito)7; el Gulf Coast Waterdog, Necturus beyeri20; Sapo Wyoming, Anaxyrus baxteri18; la rana toro, Rana catesbiana21; el sapo americano, Anaxyrus americanus22; la rana de hierba, Lymnodyaster tasmaniensis23; el Coqui, Eleutherodactylus coqui24; el Xenopus, Xenopus laevis25; el sapo de Gunther, Pseduophryne guentheri26; la rana del Leopardo del Norte, Lithobates pipiens; la rana con cuernos argentina, Ceratophrys adornada; rana corneta del Cranwell, C. cranwelli; la rana terrestre americana, Odontophrynus americanus27; y la salamandra de fuego (Salamandra)228. Hormonas esteroides, como la progesterona (P4), se divulgan con menos frecuencia pero han demostrado buena eficacia en la eliminación de la ovulación y la oviposición en algunas especies de ananos16,18,29. Las prostaglandinas (especialmente Prostaglandina 2-alfa (PGF2o))están involucradas en la ovulación junto con corticosteroides30,31,32,34 y alcanzan niveles altos durante la fase ovulatoria31.
En estudios in vitro, el PGF 2o es un potente inductor de la ovulación31,mientras que in vivo puede inducir la oviposición de los huevos retenidos en Rana muscosa4,30,32. Extractos de la hipófisis son también inductores eficaces de la ovulación15,16,34; sin embargo, las preocupaciones en torno a la bioseguridad y el potencial de transmisión de enfermedades son a menudo un elemento disuasorio para las colonias de cría en cautividad al considerar este enfoque35.
La última sección de este artículo detalla los procedimientos quirúrgicos y proporciona enfoques alternativos para ampliar los estudios ováricos o ayudar con la resolución de patologías reproductivas. Las ovariectomías se realizan con mayor frecuencia en anfibios para obtener ovocitos para la investigación embriológica. Sin embargo, también puede proporcionar un remedio para los huevos retenidos cuando otras opciones fallan. Aunque este procedimiento es invasivo, requiriendo anestesia completa e incisiones para exponer las masas de óvulos, no requiere eutanasia. Además, después de la ovariectomía parcial, los animales pueden hacer una recuperación completa y continuar siendo reproductivamente activos después de la cirugía8,36.
Los protocolos descritos a continuación describen los métodos invasivos y no invasivos de control y monitoreo ováricos en anurans y Caudates. Las especies específicas elegidas para ilustrar las técnicas en Anurans incluyen R. mucosa y X. laevis. Necturus maculosus, N. beyeri, N. alabamensis,y A. mexicanum comprenden las especies utilizadas para describir de manera similar las técnicas en Caudates.
Protocolo
Los procedimientos de salamandra fueron aprobados por los protocolos 11-106, 13-110, 14-133 y 15-138 del Comité de Cuidado y Uso Institucional del Zoológico y Jardín Botánico de Cincinnati (CZBG). Todos los procedimientos de rana y sapo fueron aprobados por los protocolos del San Diego Zoo Global (SDZG), Institutional Care and Use Committee (IACUC): 15-001, 16-005 y 18-003.
El cuidado y tratamiento de los animales fue aprobado por el Comité Ético del Museo Nacional de Historia Natural (París) (Museo Nacional de Historia Natural-Ménagerie du Jardin des Plantes (MNHN)), de acuerdo con las Directrices Institucionales y Nacionales (Comisión de Génie Génétique, Direction Départementale des Services Vétérinaires, Directiva 2010/63/UE de la Unión Europea, Decisión de acuerdo No. C75-05-01-2 del Convenio Europeo para los animales vertebrados utilizados con fines experimentales y otros fines científicos. Todos los protocolos utilizados en este estudio fueron aprobados con el número de referencia 68-037.
1. Técnicas de monitoreo ovárico no invasivo
- Inspección visual y palpación
- Sostenga a la hembra Anuran de una de las tres maneras que se describen a continuación.
- Asegure las patas de la rana o del sapo con el anillo y el dedo meñique, apoyando el lado dorsal (abdomen) del cuerpo de la rana con el índice y el dedo medio y el lado ventral con el pulgar (Figura1A).
- Sostenga la rana o el sapo en la mano dominante con un pulgar en el abdomen y el resto de los dedos asegurando la parte posterior del animal. Usando la mano no dominante para palpar el abdomen del animal, siente si hay protuberancias subdémicas (Figura1B).
- Descansa el abdomen de la rana o del sapo en la palma de la mano, los brazos delanteros cubiertos sobre el dedo índice y un pulgar en la parte superior de la espalda.
- Dado que los cáudos son de naturaleza totalmente acuática, realice una inspección visual mediante uno de los dos métodos descritos a continuación.
- Mueva al animal a un recipiente separado de 4 L que contenga agua del tanque. Sostenga el recipiente (tapa asegurada) y encienda la linterna en la parte inferior para visualizar la presencia/ausencia de huevos.
- Anestesia en MS222 (0,5 g/L; Metanosulfonato de tricaína, amortiguado con 0,5 M NaHCO3). Después de la inducción, gire el animal sobre su espalda y examine el abdomen.
- Sostenga a la hembra Anuran de una de las tres maneras que se describen a continuación.
- Evaluaciones morfométricas
- Anuros
NOTA: No se requiere anestesia.- Usando pinzas, mida el animal desde la punta de la boca, a lo largodel centro del cuerpo hasta la punta de la cola para obtener SUL y SVL (Figura 2A,B).
- Tare un contenedor de plástico en una escala de precisión digital. Coloque el animal en un recipiente tarado y pese (Figura2C).
- Para animales más grandes, como ranas toro, o al obtener pesos en el campo, utilice una escala colgante (Figura2D).
- Como en muchas especies anuvienes, distinguir r. muscosa hembras adultas de los machos por su mayor tamaño y la falta de almohadillas nupciales (thumb) en las manos (Figura3).
- Calcular la condición corporal, como una evaluación básica de la salud general mediante la siguiente fórmula:
Indice de Fulton: K - masa - longitud3
NOTA: El índice de Fulton utiliza un equilibrio dimensional de volumen relacionado con la masa y la longitud donde 3 es el exponente de escala que relaciona la masa y la longitud isométricamente.
- Caudates
- Escamas de tela con una bolsa vacía antes de colocar el animal no anestesiado en su interior. Tenga cuidado de no introducir el exceso de agua (Figura2D)y actúe rápidamente como los animales secretan moco como respuesta de estrés a ser restringido.
- Obtenga medidas para adultos inmovilizando a individuos en una posición recta en la parte inferior de una bolsa de plástico resellable o en un recipiente de plástico separado que pueda acomodar pinzas expandidas.
- Mida la longitud del cuerpo con pinzas (Figura 2E).
- Mida la cauda desde la punta del hoción hasta la punta de la cola (SVL) para monitorear el crecimiento.
- Anuros
- Observaciones conductuales
- Observe físicamente a los animales en tiempo real o utilice una cámara de video para grabar el comportamiento.
- Registrar observaciones de animales categorizar comportamientos y construir un etograma (Figura 4).
- Clasificar los comportamientos reproductivos
NOTA: La Figura 4 ejemplifica un tipo de comportamiento reproductivo observado en los anananos.
- Ultrasonido
NOTA: El transductor de ultrasonido de elección, en este caso, 7,5 mHz lineal o un micro-convexo multifrecuencia (10-6 mHz), se recomienda para Necturus y una sonda de 10 MHz y gel soluble en agua, sin sal para R. muscosa. La realización de ultrasonidos en salamandras puede requerir anestesia (ver sección 1.5 para obtener instrucciones).- Anuros
- Realizar ultrasonido en R. muscosa usando dos personas (Figura5A).
- Primera persona: Sostenga al animal con la mano dominante y aplique el gel soluble en agua y sin sal en el abdomen del animal.
- Segunda persona (ultra-sonógrafo): Tome la sonda de 10 MHz en la mano dominante y aplíquela al abdomen asegurándose de hacer un buen contacto entre la sonda y el gel.
- Deslice hacia adentro desde justo debajo de la fosa del brazo hacia el centro de la línea media abdominal del animal para visualizar todo el ovario.
- Ultra-sonógrafo: Utilice la mano no dominante para congelar el marco y capturar las imágenes deseadas en el ultrasonido.
- Clasificar la etapa del ciclo ovárico por el sistema de clasificación establecido para el género4 (Tabla2, Figura 5B-F).
- Enjuague cualquier gel de animal al final del procedimiento.
- Caudates
- Transfiera Necturus no anestesiado a un recipiente rectangular de 4 L lleno de 2 L de agua del tanque.
- Minimice el movimiento de los animales apagando las luces de la habitación y/o baje una mano sobre la cabeza del animal.
- Coloque el transductor a una distancia de 1-2 cm de la pared del cuerpo.
- Localice el corazón en el nivel de la línea media ventral hasta las extremidades anteriores y luego mueva el transductor distalmente y examine el tejido ovárico7.
- Clasificar a las hembras según el sistema de clasificación establecido para el género4 (Figura 6A,B,C).
- Obtener medidas precisas de los huevos en la etapa media-tardía-gravid mediante la captura de imágenes cuando el cuerpo del animal está en un ángulo con respecto al transductor (es decir, no lineal, pero arco ligero; Figura 6B). De lo contrario, la superposición de folículos dificulta diferenciar el tamaño individual del huevo.
- Anuros
- Inducción y recuperación anestésica
- Anuros
- Anestesia en MS222 (0,5 g/L; Tricaine methanesulfonate tamponato (0,5 M NaHCO3) como se describió anteriormente.
- Utilice el reflejo de retorsión como indicador primario del grado en que el animal se ha anestesiado. La pérdida completa del reflejo demuestra un estado de anestesia profunda.
- Retire al animal de la anestesia a base de baño de agua (MS-222) una vez que se pierda el reflejo de retorciso.
- Coloque el animal sobre una toalla húmeda (con agua desclorada sin anestesia).
- Asegúrese de mantener al animal húmedo durante todo el procedimiento quirúrgico.
- Intubar pequeños anfibios con catéteres de goma rojos, tubos sin esposar o tubos endotraqueales esposados clásicos sin inflar el manguito.
- Proporcione un flujo bajo de oxígeno (0,5-0,75 L/min) con 0,5-1% de isoflurano.
- Detenga el isoflurano después del procedimiento, pero mantenga el flujo de oxígeno durante 1 minuto.
- Extubar al animal y enjuagar bien con agua declorada libre de anestesia durante 2 minutos.
- Coloque al animal en una cantidad poco profunda de agua desclorada o en una toalla húmeda.
- Evaluar la recuperación del animal tirando suavemente de una extremidad posterior para alargar. Cualquier contracción de la extremidad indica reflejo de abstinencia.
- Supervise otros indicadores de recuperación como las respiraciones gulares (movimiento de la garganta) y el reflejo de enderezamiento.
- Considere el anfibio recuperado cuando todos los reflejos han vuelto, y las tasas de corazón y respiración han vuelto a los valores preanestésicos.
- Caudates
- Anestetizar Necturus y Ambystoma en MS222 (0,5 g/L de metanosulfonato de tricaína, amortiguado con 0,5 M NaHCO3,(MS222) en un tanque rectangular de 4 L.
- Coloque una piedra de aire (1 pulgada) y una bomba de aire en el tanque y enciéndala en un flujo constante para proporcionar una oxigenación adecuada.
- Cuando se pierda la función de las extremidades y el reflejo de enderece, retire al animal de la anestesia basada en baño de agua (MS-222) y coloque al animal en una toalla húmeda (con agua desclorada sin anestesia).
- Mantenga la humedad de la piel y las branquias con una botella de presión de agua del tanque.
- Para recuperar al animal, colóquelo cuidadosamente en un recipiente de plástico de 4 L lleno de 2 L de agua del tanque con una piedra de aire.
NOTA: La recuperación comienza con el parpadeo de las branquias, seguido de la capacidad de mover su cola y propulsar hacia adelante y finalmente el movimiento funcional de las extremidades. - Devolver el animal a su tanque de alojamiento original y controlar de cerca durante las próximas 24 horas.
NOTA: Existen otros métodos de anestesia para los anfibios y estos se describen en Wright y Whitaker8.
- Anuros
2. Técnicas invasivas de monitoreo y control de ovario
NOTA: Este procedimiento ha sido adaptado de Forzán et al.10.
- Sostenga la rana en la mano dominante, y seque el lado de la venopunción de la cara de la rana con una toallita o gasa estéril.
- Seque la cara para evitar que la sangre se disperse por la piel demasiado.
- Inserte la aguja (26 G 1/2" y 27 G 1/2"), con el bisel mirando hacia arriba, a través de la piel donde la piel levantada alrededor del ojo y la cresta superior de la mandíbula se unen para formar el punto de un triángulo (esquema amarillo) (Figura 7A) que accede a la vena facial la vena orbitales posterior.
- Perforar la vena facial por debajo del ojo derecho y por encima de la cresta superior de la mandíbula, comenzando entre 1-2 mm hacia atrás desde la línea media del ojo (Figura7A).
NOTA: Para ranas más pequeñas (menos de 20 g), mueva el punto de inserción más cerca de una posición directamente debajo de la línea media del ojo. - Angulo el tubo de microhemocrático hacia abajo para permitir que la gravedad ayude a que la sangre fluya hacia el tubo. La sangre debe fluir inmediatamente después de la punción (Figura7B,C).
- En el primer signo de flujo sanguíneo, coloque la punta del tubo de microhemocritado en el lugar de la punción y recoja 1-2 tubos completos de microhematocrito de sangre y coloque los tubos en recipientes adecuados para su recolección (Figura 7B,C).
- Si la sangre no fluye fácilmente, o el volumen es muy bajo, cambie ligeramente la inserción de la aguja o inserte la aguja en el otro lado de la cara.
- Deje de sangrar presionando la gasa firmemente en el lugar de la punción durante al menos 20 s.
- Deje la rana fuera del agua durante 10 minutos para confirmar que el sitio de punción no se reabra.
- Utilice una aguja nueva y nuevos tubos de microhemocrato para cada rana muestreada.
3. Inducción de hormonas
- Preparación hormonal
- Preparar las inyecciones de hormonas inmediatamente antes de su uso para asegurar el máximo efecto.
- Seleccione una hormona de la selección enumerada en la Tabla 1.
- Determinar la concentración de la hormona a inyectar utilizando un l o ml/g de peso corporal16.
- Diluir la hormona en uno de los siguientes: agua, solución salina tamponada fosfato (PBS), solución de anfibio salino Ringer (SARS) o solución salina.
- No exceda un volumen de inyección de 200 ml para ranas que pesen 30-70 g y 300 l para ranas que pesen 80-110 g (observación personal)16.
- Para la correcta tenencia de un animal durante la administración hormonal de cualquier animal que va de 10-100 g, utilice cualquiera de los métodos adecuados para la retención descritos en la sección 1.1.
- Anuros
- Calcular la concentración requerida por individuo utilizando un gramo por cálculo de peso corporal (g/peso corporal).
- Justo antes de la administración, reconstituir en un diluyente estéril de elección.
- Asegúrese de que no queden burbujas en la jeringa antes de la inyección.
- Sostenga el animal firmemente en la mano no dominante y administre la inyección con la mano dominante.
- Administrar la inyección de acuerdo con las especificaciones hormonales. Las inyecciones más comunes en los anuranos son subcutáneas, intra peritoneales o intra musculares (Figura 8).
- Administrar inyecciones de IP en la parte inferior del abdomen o en la sección inferior del lado dorsal del cuerpo cerca de la pierna posterior (Figura9).
- Administrar inyecciones intramusculares preferiblemente en las patas traseras.
- Caudátiles (Necturus)
- Reconstituir la hormona de elección en agua estéril de acuerdo con el gramo por método de peso corporal descrito anteriormente.
- En el caso de Necturus, utilice dosis de 1,7-2,3 g de peso corporal de GnRH/g.
- Retire Necturus de la cámara anestésica y colóquelo sobre una superficie de 45o cubierta con cortina quirúrgica.
- Coloque el animal con la cabeza apuntando hacia abajo.
- Acérquese al cuadrante posterior del abdomen (caudal de la pierna trasera) en un ángulo de 15-20o. Tenga cuidado de no introducir aire en la jeringa.
- Inyecte (IP) con una jeringa de insulina y una aguja de 27-30 G.
- Inyecte la hormona con una jeringa de insulina y una aguja de 27-30 G.
4. Cirugía
- Preparación y procedimiento quirúrgico general
- Para mantener procedimientos asépticos, utilice cortinas de plástico estériles transparentes para aislar el sitio quirúrgico. Reduzca la evaporación manteniendo la piel húmeda circundante.
- Humedezca cualquier material que entre en contacto con la piel del animal con agua estéril. Haga la incisión de la piel con una cuchilla de bisturí número 15 o número 11.
NOTA: Una combinación de acero frío, radiocirugía o láser de diodo. La hemostásis en el procedimiento hemorrágico leve se puede lograr mediante electrocauter o láser de diodo. - Utilice lanzas o aplicadores con punta de algodón para permitir la aplicación de presión localizada a los vasos pequeños que realizan un seguimiento de la pérdida de sangre.
- Utilice lanzas con punta de algodón o aplicadores para gestionar pequeños espacios confinados en lugar de cuadrados de gasa estándar.
- Utilice microinstrumentos, como instrumentos oftalmológicos, con puntas finas y pequeñas, al realizar una cirugía en animales que pesen menos de 1 kg.
- Utilice retractores de plástico autoreteniendo (por ejemplo, retractor Lone Star) para adaptarse a diferentes tamaños de incisiones.
- Utilice retractores de párpados para las incisiones celomicas retraídas.
- Utilice instrumentación de aumento cuando sea necesario para realizar la cirugía en pacientes más pequeños.
NOTA: Se requiere analgesia con cualquier procedimiento quirúrgico en anfibios. La falta de administración de analgesia adecuada durante la cirugía se ha asociado con el retraso en el retorno de las funciones normales. Además, la analgesia potencia los efectos de los medicamentos anestésicos (Tabla 3)34.
- Anuros
- Una vez que X. laevis haya sido anestesiado como se describe en el paso 1.5.1, coloque al animal en recumbencia dorsal (Figura10A,C).
- Preparar el campo quirúrgico asépticamente limpiando gasa estéril húmeda con solución diluida de povidona-yodo (1/10) en el sitio para 10-15 s o 0.75% solución de clorhexidina en el sitio quirúrgico durante al menos 10 minutos antes de la cirugía35.
- Hacer una incisión paramediana de la piel de 3 mm en el coelom medio (entre los hombros y la cloaca) con un trazo audaz dejando una incisión limpia usando un bisturí no 15 o no 11.
NOTA: Uno puede usar un láser de diodo también para incisiones cutáneas. - Elevar la membrana abdominal, hacer e incisión y diseccionar cuidadosamente usando un bisturí n.o 15 o no 11. (Figura 10B,D).
- Retirar las incisiones celomicas con retractores de párpados (o cualquier equipo apropiado).
- Excise una porción de masa de huevo sin ligar ningún vaso sanguíneo.
- Para una ovariectomía completa, cauterizar áteris circundantes por electrocauterización o diodo láser (Figura 11).
- Usando sutura monofilamento, cierre la incisión de celiotomía con un patrón de sutura interrumpida y siempre.
- Caudates
- Una vez A. mexicanum ha sido anestesiado, colocarlo en la recumbencia lateral derecha, con la extremidad pélvica izquierda simplemente colocada contra la base de la cola.
- Preparar el campo quirúrgico asépticamente colocando gasa estéril húmeda con solución diluida de povidona-yodo (1:10) en el sitio durante 10-15 s. Alternativamente, use gasa estéril empapada en una solución de clorhexidina al 0,75% y colóquela en el sitio quirúrgico durante al menos 10 minutos. antes de la cirugía (Figura12A)36,37 .
- Dibuje una línea entre el hombro y las extremidades posteriores para dividir el cuerpo en tres partes iguales (Figura12B).
- Haga el sitio de la incisión entre la segunda y la tercera parte.
- Agarre el músculo subyacente y aléjese de las vísceras celomicas.
- Forzar suavemente pequeños hemostats a través de la musculatura celomica y en la cavidad celomica.
- Retirar las incisiones celomicas con retractores de párpados (o cualquier material apropiado) (Figura12C).
- Para una ovariectomía completa, cauterizar áteris circundantes por electrocauterización o diodo láser (Figura12D).
- Usando sutura monofilamento, cierre la incisión de celiotomía con un patrón de sutura interrumpida y siempre.
Resultados
Morfometría y reproducción
La visualización del estado reproductivo femenino en los anfibios varía dependiendo de la especie. El método más eficaz es el ultrasonido; sin embargo, algunas especies pueden mostrar diferentes grados de transparencia de su piel (Figura 13A,B,C). La inspección visual a menudo puede ilustrar claramente las diferencias entre una hembra gravid y no gravid cuando la piel es semitranslúcida como se observa en N. alabamensis y N. maculosus (Figura13A,B); o translúcido como lo ilustra la rana de cristal (Figura13C). La coloración oscura de la piel manchada en el abdomen de N. beyeri prohíbe realizar esta evaluación. En R. muscosa, la piel no es translúcida pero se pueden detectar diferencias notables entre las hembras que son gravídicas en comparación con las que han ovipositado recientemente porque la piel es flácida, y el animal se ve más delgado (línea amarilla) en comparación con una hembra que es gravíd (línea azul) (Figura13D). Con la experiencia, el manejador puede familiarizarse con la diferencia entre una hembra grande y una gravid, pero la confirmación de la etapa gravitatoria requerirá ultrasonido. Los índices de masa corporal en los anfibios se pueden calcular utilizando una serie de fórmulas, pero su aplicación como herramienta predictiva para la reproducción es discutible. En el caso de R. muscosa, la correlación entre el índice de Fulton, la salud y el estado reproductivo sigue sin estar clara.
Comportamiento reproductivo y ultrasonido
Nuestros resultados muestran cómo caracterizar los comportamientos reproductivos en R. muscosa para la predicción de la oviposición (Figura4). Varias etapas que duran de unas pocas horas a varias semanas incluyen, cortejo donde un macho persigue activamente a una hembra (Figura4A),el macho se monta y se apreta firmemente en la espalda de la hembra, llamado amplexus (Figura4B). Una vez amplificado, el par puede permanecer en amplexus durante 1 – 5 semanas y el par mostrará otros comportamientos además de amplexus. Amplexus es un comportamiento muy activo que incluye al macho exprimiendo a la hembra de una manera de bombeo suave (Figura4C); la hembra moviéndose y comenzando a mostrarcomportamientos de soporte de mano intermitentemente (Figura 4D,E); y más cerca del momento de la oviposición, la hembra, en un soporte de mano, se inclinará contra las superficies en las que puede pegar huevos mientras el macho bombea su abdomen vigorosamente (en este caso es posible observar también a la hembra frotando su abdomen hacia abajo desde abajo su brazo se enfrenta a la cloaca. Esto puede ser una forma mecánica con la que empujar los huevos por los oviductos) (Figura4F,G).
Este estudio ilustra cómo el ultrasonido puede proporcionar información con la que determinar el estado reproductivo en las hembras R. muscosa y Necturus. Cuatro etapas de desarrollo están representadas en R. muscosa (Figura 5C,D,E,F) y se caracterizan de manera similar en Necturus4 (Figura 6A,B,C). Además, los huevos residuales pueden no ser expulsados dando lugar a la retención de óvulos (Figura5G, Figura 15A,B). La etapa 1 muestra un ovario directamente después de la oviposición donde los folículos son difíciles de visualizar (Figura5C). La etapa 2 está representada por la aparición de puntos ecogénicos (manchas blancas) dispersos a lo largo del ovario (Figura5D). Las etapas 2 y 3 están representadas por puntos ecogénicos más grandes y redondeados con centros oscuros que representan folículos medios a grandes (Figura5E,F). De 2013 a 2017, la hembra cautiva Necturus fue examinada mensualmente por ultrasonografía. Durante cada examen, a las personas se les asignó una puntuación de grado de acuerdo con los criterios de reproducción establecidos para el género (Tabla 2). El porcentaje de hembras que desarrollan huevos nuevos cada año fuede 88,2 a 3,01% (cuadro 5). Si bien el desarrollo de óvulos era alto, no se garantizó la oviposición (Figura16). La mayoría de las hembras que se sometieron a oviposición depositaron el complemento completo de los huevos, mientras que algunos individuos depositaron sólo una fracción de los huevos que se desarrollaron. Esas hembras de R. muscosa y Necturus con óvulos retenidos concomitantes con ganancia de líquido en la cavidad corporal se agrandaron visualmente externamente con manchas rojas en la piel consistentes con vasos sanguíneos reventados (Figura14A,B ) . El grado de retención de líquidos podría evaluarse a través de ultrasonido (Figura15B). En ambas especies, los huevos retenidos se sometieron a atresia o tomaron una apariencia más ecogénica (Figura14C,D, Figura 15A).
Administración de hormonas
Dependiendo de la profundidad del tipo de inyección, el ángulo y la profundidad de la aguja variarán. Para la mayoría de las inyecciones la profundidad de la aguja no necesita ser más de 1 -2 mm de profundidad cuando se trabaja con especies como R. muscosa, pero variará en el ángulo de penetración. Las inyecciones de prostaglandina requirieron una inserción intramuscular (im) de la aguja en ángulo de 90o, en la pata posterior de R. muscosa, mientras que las inyecciones intraperitoneales (ip), con una profundidad similar a las inyecciones intramusculares, se administraron en el área de la cavidad celómica a 45o (Figura10). La administración de Amphiplex no tuvo ningún efecto significativo en el aumento del número de óvulos depositados por las hembras tratadas con hormonas en comparación con los controles (P - 0,547), ni hubo diferencias en el número de embriones que se partiron (P a 0,673) o sobrevivieron a renacuajo (P - 0.629) (Cuadro 4). Generalmente, el porcentaje de mujeres que ovipositos disminuyó del 80% en 2011 al 28% en 2014. El número de hembras que ovipositó en 2015 fue significativamente mayor que en 2013 (P a 0.0002), 2013 (P a 0.0001) y 2014 (P a 0.0026) pero no a 2011 (P a 0.0885), reafirmando la idea de que las hembras de esta especie pueden no anualmente y que los protocolos hormonales requieren nement. Para las hembras de R. muscosa con signos de retención de óvulos, las inyecciones intramusculares de PGF2 o tuvieron una tasa de éxito del 60% en inducir la expulsión de los óvulos degeneradores. Sin embargo, en 1 de las 5 hembras inyectadas, el PGF2 o no fue suficiente para causar la expulsión completa y algunos huevos permanecieron dentro de la hembra hasta la siguiente temporada de cría. Diecisiete hembras Necturus recibieron LHRH/(GnRH) y 13 recibieron una inyección falsa de agua estéril para servir como control (Tabla 5). En total, siete hembras de Necturus (n x 4 alabamensis,n a 2 beyeri,n a 1 maculosus)pasaron a ovipositar once embragues completos que fueron atribuidas tanto a los individuos tratados con GnRH (n a 6) como a los (n.o 5). Tres hembras (n a 2 beyeri, n a 1 maculosus)ovipositd cinco embragues parciales (Figura13). Este fenómeno no parecía estar asociado con el tratamiento hormonal exógeno,ya que tres hembras de control depositaron de forma similar embragues parciales (Tabla 5). Oviposition se produjo durante un período de tiempo de 37 días (3/31-5/7) en el transcurso de cinco años (Tabla5). No hubo diferencia (P a 0,194) en las tasas de oviposición entre LHRH/GnRH tratado (41 a 13,08%, rango 17-67%) y control (66,75 a 11,79%, rango 50-100%) Hembras. Las hembras tratadas con LHRH/GnRH depositaron huevos con un promedio de 7,44 x 1,41 (rango 3-13) días después de la inyección. Dada la naturaleza totalmente acuática de la especie y la incapacidad de contener manualmente sin anestesia, era necesario garantizar un nivel adecuado de sedación antes de realizar inyecciones de hormona IP (ver sección 3.2 para obtener instrucciones sobre la anestesia).
Recolección de sangre, anestesia y cirugía
La técnica de muestreo de sangre en este artículo fue tomada de Forzan et al. 201310 y ha demostrado una manera eficaz de recoger sangre de R. muscosa con mínima invasividad y estrés. Utilizando tubos de microhemocritato, se pueden recolectar aproximadamente 35-45 l de plasma o suero por cada 70 ml de sangre entera (Figura7). El volumen máximo de recolección en R. muscosa fue de 1 tubo de microhemocritato completo por cada 10 g de rana, hasta 4 tubos por rana para ranas de 40 g o más. Se trataba de un volumen de recogida conservadora de 0,7 ml por 100 g, el 70% de la recomendación máxima de 1,0 ml por 100 g (adaptada de Allender y Fry, 2008)13.
La anestesia y la cirugía en anfibios rara vez se divulgan, pero es importante tener en cuenta que las dosis y la eficacia variarán de una manera específica de la especie. En Bombina orientalis por ejemplo, MS222 tiene un efecto muy bajo, incluso con altas dosis (1 g/L) mientras que en los sapos boreales, Anaxyrus boreas,1 g/L es rápido (cuestión de minutos) y de larga duración (3+ h) (Calatayud, observación personal). En R. muscosa, la anestesia requiere dosis reportadas para A. boreas boreas y tiene un efecto similar y tiempos de recuperación. Por lo general, no se requieren anfibios en ayunas antes de la anestesia, ya que su laringe permanece herméticamente cerrada incluso bajo anestesia general. Sin embargo, si se considera necesario, especialmente si el procedimiento anestésico debe incluir cirugía celomática, los animales pueden ayunar 24 horas antes de la anestesia.
Durante la cirugía, el reflejo de enderedo es el indicador principal de que el animal se ha anestesiado. El reflejo correcto es la capacidad y el grado de facilidad con el que un animal puede volver a una posición vertical después de ser colocado en su espalda. La pérdida del reflejo sugiere una etapa ligera de la anestesia. Un plano quirúrgico está indicado por la pérdida del reflejo de abstinencia que incluye tirar ligeramente de la extremidad para enderezarla y el animal ya no es capaz de retraerlo7. La cirugía reproductiva no tiene obstáculos abrumadores y los pacientes con anfibios sanan predominantemente bien tolerando bien la pérdida de sangre más que los vertebrados más altos. La cirugía debe continuar rápidamente, durando aproximadamente 15 minutos de principio a fin. Los pasos deben cronometrarse aproximadamente de la siguiente manera: <1 minuto para la incisión inicial y <2 minutos para la celiotomía y la inserción del retractor, < 2-3 minutos para el aislamiento por ovario y <1 minuto para la sutura del vaso o cauterización y la sutura de la piel < 4 minutos. El tiempo total de recuperación después de la cirugía con protocolos MS222 es de aproximadamente 45 minutos, pero esto puede ser específico de la especie. En A. boreas boreas y R. muscosa tiempos de recuperación pueden ser más largos, hasta 1 – 2 h. Al realizar la cirugía, se debe tener cuidado para evitar perforar los pulmones, el tracto gastrointestinal o una vejiga distendida, y no dañar las glándulas macroscópicas, los corazones linfáticos y los vasos sanguíneos, especialmente la vena ventral media. Dependiendo de la temporada, la presencia de grandes cuerpos grasos puede dificultar la visualización de otros órganos. Una vez visiblemente despierto, las respuestas de un animal a la estimulación de las extremidades, como la resistencia a un estiramiento suave de una extremidad posterior o el parpadeo cuando se estimula el área alrededor del ojo (observación personal), se clasifican como respuestas de abstinencia. El reflejo de enderezamiento junto con otros indicadores de recuperación, incluyendo, los reflejos de abstinencia y los movimientos gulares, son indicadores importantes de recuperación.
| Administración | ||||||||||
| Nombre común | Especies | Hormona | Procedimiento | Compuesto de priming | Se ha notificado una dosis de priming | Número de dosis de cebado | Temporización (hora antes de la dosis ovulatoria) | Compuesto(s) administrado(s) para ovulatorio/oviposición final | Dosis | Referencia |
| Sapo con cresta puertorriqueña | Lémur peltophryne | GnRH y hCG | Ip | Hcg | 1.5 UI/g | 2 | hCG - 48 | GnRH; hCG; GnRHa + hCG | 0,2 g; 4 UI; 0,5 g + 4 UI | Inédito |
| Rana de patas amarillas de montaña | Rana muscosa | Amphiplex | Ip | GnRHa (des-Gly10, D- Ala6, Pro-NHEt9-GnRH) | 0,4 g/g | 1 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | Calatayud et al., 2018 |
| PGF2 | Im | PGF2 | 5 ng/g | 1 | 48 | PGF2 | 5 ng/g | |||
| Sapo boreal de las Montañas Rocosas del Sur | Anaxyrus boreas boreas | hCG, GnRH | Ip | Hcg | 3.7 UI/g | 2 | 96, 24 | hCG + GnRHa | 13,5 UI/g + 0,4 g/g | Calatayud et al., 2015 |
| Rana del norte de Cricket | Acris crepitan | Amphiplex | añadido al agua (10 mL) | Ninguno | Ninguno | 0 | Na | GnRH + MET | 0,17 g + 0,42 g / l | Snyder et al., 2012 |
| Rana del Leopardo del Norte | Lithobates pipiens | Amphiplex | Ip | Ninguno | Ninguno | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | Trudeau et al., 2010 |
| Rana con cuernos argentinos | Ceratophyrs ornata | Amphiplex | Ip | Ninguno | Ninguno | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | |
| Rana con cuernos de Cranwell | Ceratophrys cranwelli | Amphiplex | Ip | Ninguno | Ninguno | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | |
| Rana terrestre americana | Odontophrynus americanus | Amphiplex | Ip | Ninguno | Ninguno | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | |
| Rana Dusky Gopher | Rana sevosa | hCG, GnRH | Ip | Hcg | 3.7 UI/g | 2 | 96 , 24 | GnRH + hCG | 1 x 0,4 g/g + 13,5 UI/g | Graham et al., 2018 |
| Coqui común | Eleutherodactylus coqui | Pescado, aviar, mamífero y GnRH (D-Ala, des-Gly, eth LHRH), hCG | Sc | mLHRH; aLHR; fLHRH; GnRHa; Hcg | Ninguno | 0 | Na | mLHRH; aLHR; fLHRH; GnRHa; Hcg | 7 g, 33 g; 28 g; 7 g, 20 g; 5, 10, 15, 20 g; 165 UI | Michael et al 2004 |
| El toadlet de Gunther | Pseudophryne guentheri | Gnrh | Gnrha | 0,4 g/g | 1 | 26 | GnRHa con o sin primo | 0,4 g/g | Silla 2010 | |
| Rana Corroboree | Pseudophryne corroboree | Lucrin | Sc | Lucrin | 1 g | 1 | 26 | Lucrin | 5 g | Byrne & Silla, 2010 |
| Rana Corroboree del Norte | Pseudophryne pengilleyi | GnRHa GnRH (D-Ala, des-Gly, eth LHRH) | Ta | Ninguno | Ninguno | 0 | Na | Gnrha | 0,5 -2,0 g/g | Silla et al., 2017 |
| Perro acuático de la costa del Golfo | Necturus beyeri | [des-Gly10, D- Ala6]-LhRH-RH etilmide acetato de sal hidrato | Ip | Ninguno | Ninguno | 0 | Na | Lhrh | 100 g / 500 l | Stoops et al., 2014 |
| Rana campana del sur / rana de hierba gruñendo | Litoria raniformis | des-Gly10, D- Ala6-[LHRH] | Sc | Ninguno | Ninguno | 0 | Na | des-Gly10, D- Ala6-[LHRH] | 50 g | Mann et al., 2010 |
| Sapo de Fowler | Anaxyrus fowleri | GnRH, hCG, P4 | Ip | Hcg | 3.7 UI/g | Browne et al., 2006 | ||||
| Axolotl (salamandra mexicana) | Ambystoma mexicanum | Hormonas estimulantes del folículo | Im | Ninguno | Ninguno | 0 | Na | Fsh | 400UI | Trottier y Armstrong, 1974 |
| Rana garra africana | Xenopus laevis | hCG y P4 | agua añadida; Ip | PMSG, hCG | Marcec , 2016 | |||||
| Salamandra de tigre | Ambystoma tigrinum | hCG, LH | ||||||||
| Sapo de Wyoming | Anaxyrus baxteri | hCG, GnRHa, P4 | Ip | hCG + GnRHa | 100 UI + 0,8 g | 1 | 72 | hCG + GnRHa | 100 UI + 0,8 g | Browne et al., 2006 |
| Rana del Leopardo del Norte | Lithobates pipiens | Extracto pituitario (PE), P4, testosterona (T), corticosterona [C], Amphiplex, domperidona (D) | SC, IP | Ninguno | Ninguno | 0 | Na | PE, PE+T, PE+P4, PE+C; Amphiplex, GnRH + D | 100 UI (LHRH) en 1 ml; PE+0.002 g/L; PE+0.01mg/50mL; PE+0.1mg/50mL; 0,4 g/g + 10 g/g; 0,4 g/g + D | Wright, 1961; Fuerte, 2000; Trudeau et al., 2013 |
| Rana molida | Lymnodynastes tasmeniensis | Extractos pituitario, hCG, GnRHa, PZ | Ip | Gnrha | 0,9-1,2 g/g + PZ 10 g/g | 1 | 20 | PE; PE + hCG; GnRH + PZ | PE vol; PE vol + 100 IU hCG; GnRH (0,9-1,2 g/g) + PZ (10 g/g) | Clulow et al., 2018 |
| Rana Green and Golden Bell | Litoia aurea | Gnrh | Ip | Gnrha | 10 g | 1 | 72 | GnRHa + hCG | 20 g + 300 UI | Clulow et al., 2018 |
| Gran rana barred | Mixophyes fasciolatus | hCG & PMSG | Sc | PMSG, hCG | 50 UI y 25 UI; 1x100 UI | 2; 2 | PMSG-144 y 96; hCG-24 | Hcg | 100UI | Clulow et al., 2012 |
| Para más protocolos hormonales y especies ver Wright y Whitaker, 2001 | ||||||||||
Tabla 1: Especies de anfibios y algunas de las hormonas exógenas probadas en ellos como se informa en la literatura. Gonadotropina coriónica humana (hCG); Hormona liberadora de gonadotropina (GnRH); Hormona liberadora de hormonas lutenizante (LHRH); las letras m, a y f representan 'mamífero', 'aviar' y 'pez'; gonotropina suero de yegua embarazada (PMSG); progesterona (P4); Hormona estimulante del folículo FSH); Extracto de hipófisis (PE); testosterona (T); corticosterona (C). Antagonistas de la dopamina enumerados incluyen: domperidona (D); Pimozida (P); metoclopramida (MET). Amphiplex es el nombre dado a un compuesto compuesto de GnRH y Metoclopramida27. Lucrin es un agonista de GnRH disponible comercialmente con el ingrediente activo es acetato de leuprorelina. 4 , 7 , 17 , 18 , 19 , 20 , 26 , 27 , 38 , 39 , 40 , 41 , 42 , 43 , 44 , 45
| Grado | Estado reproductivo | Descripción |
| 0 | No gravitado | No hay huevos visibles. |
| 1 | Gravitación temprana | Huevos visibles (1-2 mm de tamaño) ninguna línea ecogénica distinta asociada con el huevo. |
| 2 | Gravid medio | Huevos de 2-3 mm de tamaño, líneas ecogénicas distintas asociadas a cada huevo. |
| 3 | Gravid tardío | Huevos de 4-5 mm de tamaño, líneas ecogénicas todavía visibles, marcado aumento en la apariencia anecoica del huevo. |
| 4 | Huevos retenidos | Los diferentes grados de material ecogénico presenteen en la estructura interna del óvulo, toman forma amorfo. Algunos pueden llegar a ser muy ecogénicos y asociados con la retención de líquidos en la cavidad corporal. |
Tabla 2: Sistema de calificación utilizado para puntuar el estado reproductivo de la hembra cautiva Necturus y Rana muscosa por ultrasonografía.
| Droga | Dosis y Ruta | Comentarios - referencia |
| Buprenorphin | 50 mg/Kg (intraclomático) | Estudio experimental en un tritón de manchas rojas orientales (Notophthalmus viridescens). Analgesia debe administrarse antes de la cirugía. (Koeller, 2009) |
| Butorfanol | 1 – 10 mg/Kg (IM o intraclomático) | Hay varias respons específicas. Se recomienda comenzar a 1 mg/kg. |
| Butorfanol | 0,5 mg/L (baño) | Estudio experimental en un tritón de manchas rojas orientales (Notophthalmus viridescens). (Koeller, 2009) |
| Fentanilo | 1 mg/kg | Analgesia > 4 h, antagonizada por naltrexona (Stevens, 1997) |
| Meloxicam | 0,1 a 0,2 mg/kg (IM) | (Minter, 2011) |
Tabla 3: Protocolos para la analgesia en anfibios.
| Rana muscosa | ||
| año | 2014 | 2015 |
| No ♀ | 18 | 18 |
| Desarrollo de Huevos | 61% | 94% |
| ♀ de control | 4 | 6 |
| ♀ de anfiplex | 4 | 7 |
| Día promedio post Amphiplex a oviposit | 10.5 | 10.9 |
| Tasa de oviposición (Amphiplex) | 22,20% | 33,33% |
| Tasa de oviposición (Control) | 22,20% | 38,88% |
Tabla 4: Una comparación de los parámetros reproductivos entre las mujeres tratadas con anfiplex en comparación con el control de la hembra cautiva Rana muscosa en 2014 y 2015.
| Necturus sp. | |||||
| año | 1 | 2 | 3 | 4 | 5 |
| No ♀ | 6* | 7 | 7* | 7* | 7* |
| Desarrollo de Huevos | 83% | 100% | 86% | 86% | 86% |
| ♀ LHRH | 3 | 5 | 3 | 6 | 0 |
| ♀ de control | 2 | 2 | 3 | 0 | 6 |
| Día post-LHRH a Oviposit | 5 | 7 | 5.5 (rango 3 - 8) | 13 | n/a |
| Tasa de oviposición (LHRH) | 60% | 20% | 67% | 17% | n/a |
| Tasa de oviposición (Control) | 50% | 50% | 100% | n/a | 67% |
| * n-1 ♀ no hay desarrollo de óvulos | |||||
Tabla 5: Comparación de los parámetros reproductivos entre la LHRH (GnRH) -tratado y control (agua estéril) hembra cautiva Necturus de tres especies durante un período de 5 años de tiempo (2012-2017).

Figura 1: Tres métodos para sostener unarana. (A) Procedimiento 1. (B) Procedimiento 2. (C) Procedimiento 3. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Evaluaciones morfométricas. (A, B) SVL/SUL (C, D). peso, en R. muscosa y D. Necturus. (E). Medida de tamaño con pinzas. Haga clic aquí para ver una versión más grande de esta figura.
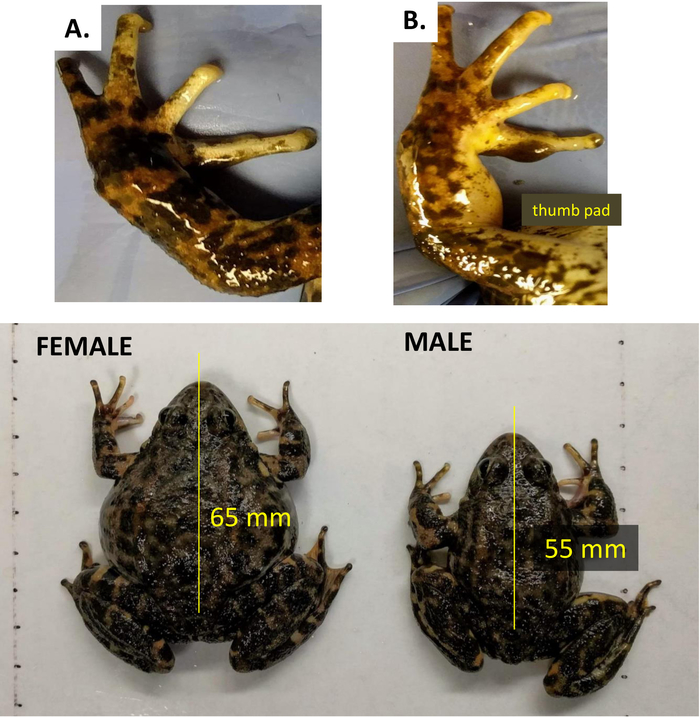
Figura 3: El dimorfismo sexual se distingue por las almohadillas nuptiales en los machos adultos de R. muscosa en comparación con las hembras. (A) Hembra (B) Macho. El panel inferior muestra la longitud de macho vs hembra. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Caracterización de los comportamientos reproductivos que condujo a la oviposición en R. muscosa (A) cortejo. (B) Amplexus. (C) Hombre exprimiendo a la hembra mientras está en amplexus. (D, E) Mujer amplificada en un soporte de mano. (F, G) Contracciones abdominales y oviposición. Haga clic aquí para ver una versión más grande de esta figura.
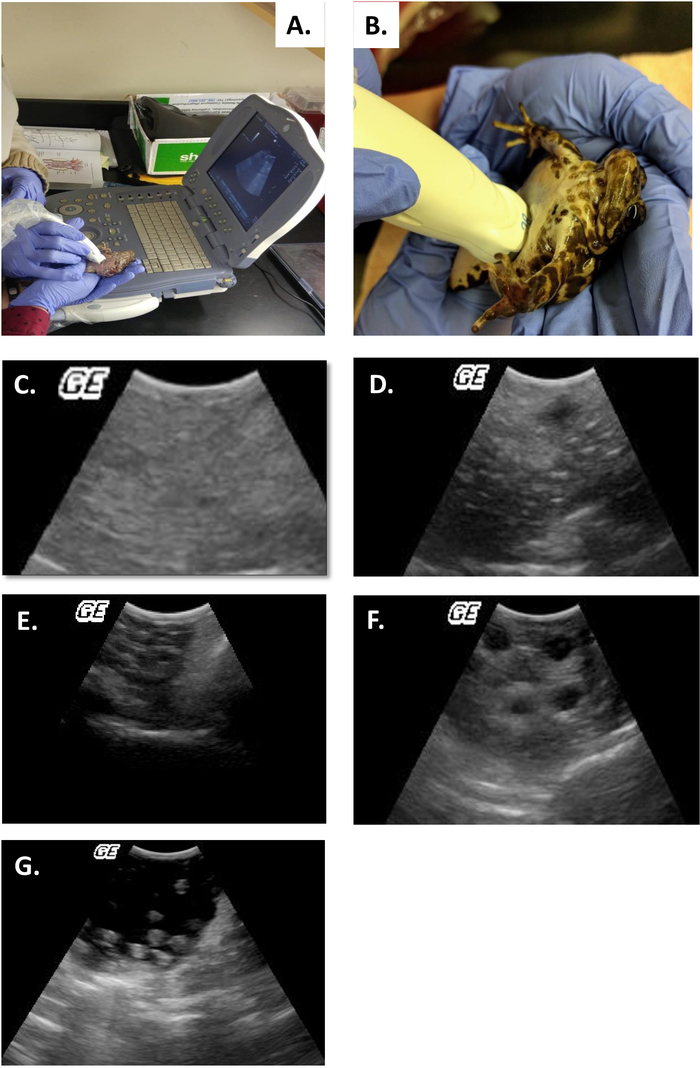
Figura 5: Ultrasonido realizado en R. muscosa A-Bcon estado reproductivo según la etapa de desarrollo 4. (A, B) Realización de ultrasonidos en Rana muscosa. (C) Grado 0. (D) Grado 1. (E) Grado 2. (F) Grado 3. (G) Grado 4 (huevos ovulados y retenidos) Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Imágenes de ultrasonido de Necturus. (A) Grado 1. (B) Grado 2. (C) Huevos de grado 3. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Recolección de sangre en R. muscosa. (A) Recolección de sangre mediante la punción de la vena orbitalis posterior de la vena facial justo por encima de la mandíbula en el centro de la órbita. (B, C) La sangre se libera sobre la superficie de la piel y se recoge con un tubo capilar heparinizado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Métodos de inyección en anfibios. Dependiendo de la profundidad del tipo de inyección, el ángulo y la profundidad de la aguja variarán. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Inyección hormonal en R. muscosa. Inducción de oviposición por tratamiento hormonal en rana muscosa hembras inyectadas con anfiplex intraperitonealmente. Los ovarios se pueden encontrar en la cavidad coelómica Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Preparación antes de la cirugía. (A) Preparación aséptica del área quirúrgica mediante solución diluida de povidona-yodo (1/10), Trachycephalus resinifictrix. (B) Limpie la incisión del bisturí en una incisión de la piel Xenopus laevis o,(C), Lithobates catesbeianus. (D) Evitar dañar la vena ventral media, Trachycephalus resinifictrix. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Ovariectomía en Xenopus laevis. (A) Exponer y mover grandes cuerpos de grasa para descubrir la masa del huevo. (B) Exbotee una porción de masa de huevo sin ligar ningún vaso sanguíneo. (C) Cauterizar los vasos sanguíneos circundantes por electrocauterización para una ovariectomía completa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 12: Preparación prequirúrgica y ovariectomía en A. mexicanum. (A) Gasa estéril empapada, solución de clorhexidina al 0,75% aplicada al sitio quirúrgico (B). Una línea entre el hombro y las extremidades posteriores divide al animal en tres partes iguales y el punto azul marca el sitio en la incisión. (C) Retirar las incisiones coelomicas con retractores de párpados. (D) Para una ovarectomía completa, cauterizar los vasos sanguíneos circundantes mediante electrocauterización. Haga clic aquí para ver una versión más grande de esta figura.

Figura 13: Evaluación visual de las etapas reproductivas. (A, B) Evaluaciones visuales de la etapa reproductiva a través de la piel semitranslúcida, Necturus. (C) Piel translúcida, Hyalinobatrachium (rana de cristal). (D) Evaluación visual de R. muscosa antes (derecha, línea azul) y después de la oviposición (izquierda - línea amarilla). Haga clic aquí para ver una versión más grande de esta figura.
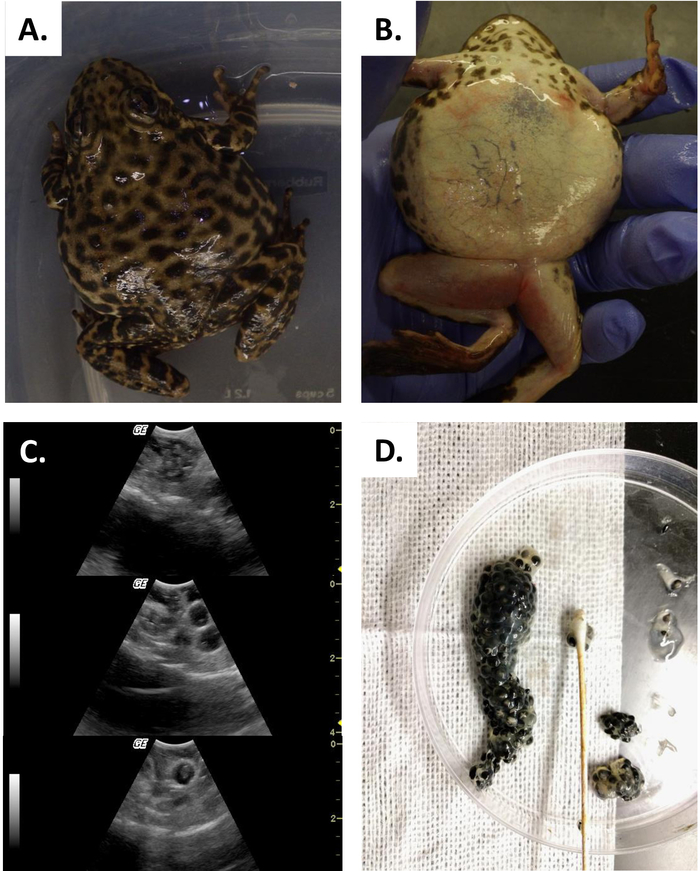
Figura 14: Retención de óvulos. (A, B) Rana muscosa hembra con caso grave de retención de óvulos. (C) El ultrasonido muestra huevos viejos desgeneradores, huevos (arriba) y huevos más grandes (panel medio e inferior) ovulados y atrapados en el coelom. (D) Huevos retenidos recuperados mediante desmontaje manual. Haga clic aquí para ver una versión más grande de esta figura.
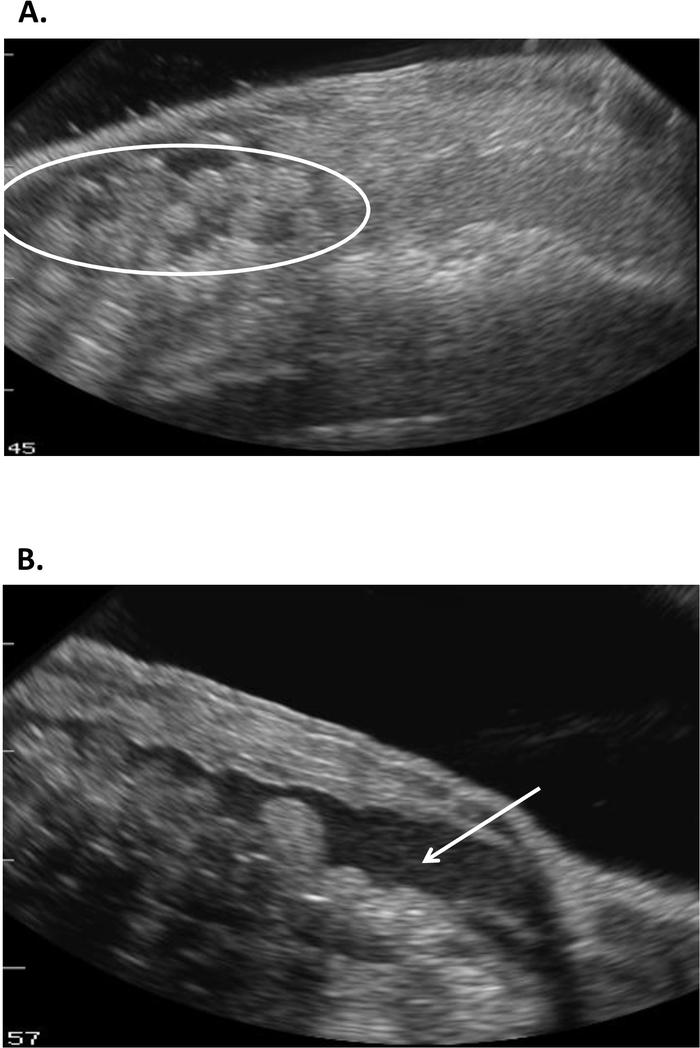
Figura 15: Imágenes por ultrasonido de óvulos retenidos en Necturus que (A) se hicieron ecogénicos en apariencia (círculo) y se asociaron con (B) retención de líquidos en la cavidad corporal (flecha). Haga clic aquí para ver una versión más grande de esta figura.
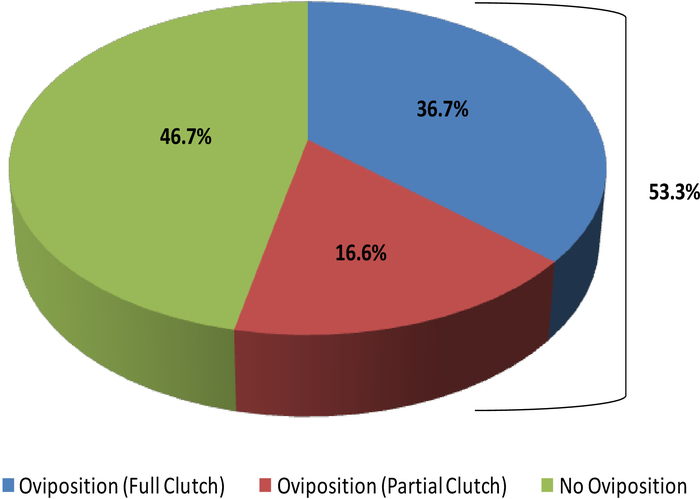
Figura 16: Porcentaje de hembras cautivas Necturus que oviposeitan embragues completos o parciales (2013-2017) en comparación con las que no oviposit. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El manejo directo, la observación visual y las medidas morfométricas proporcionan técnicas no invasivas y son los primeros criterios de evaluación para determinar la etapa reproductiva femenina. Sin embargo, este estudio muestra que los ovarios gravíscos no siempre pueden identificarse de forma fiable por palpación. Dependiendo de la especie, los ovarios gravid a veces pueden detectarse visualmente a través de piel semitranslúcida (Figura13A,B) o completamente translúcida en el lado ventral del animal (Figura13C). Las hembras que han completado la oviposición pueden mostrar cambios obvios en su apariencia en comparación con las hembras gravid (por ejemplo, piel suelta y pérdida de hasta el 30% de su masa corporal, Figura 13D). Durante la reproducción, machos y hembras mostrarán ciertos comportamientos que proporcionan información sobre la proximidad a la ovulación y la oviposición. En el caso de R. muscosa indica que una hembra está cerca de la oviposición comienzacon la hembra entrando en los soportes de mano.
La aplicación de la tecnología de ultrasonido a los anurans y caudates permite el diagnóstico de presencia o ausencia de óvulos y si la oviposición se asoció con la liberación completa o parcial de óvulos desarrollados. Por lo tanto, este método proporciona una evaluación más completa y precisa del estado reproductivo sin limitarse a determinar el estado gravid/no gravid a través de una técnica de visualización que varía por la transparencia de la piel abdominal, o la consistencia epidérmica entre las diferentes especies de anfibios. El ultrasonido se puede realizar con relativa facilidad y con poco estrés a los animales (Figura5 y Figura 13)y se puede utilizar para caracterizar los ciclos reproductivos y determinar el estado reproductivo4. Es fundamental familiarizarse con la especie; sin embargo, este estudio demostró que Necturus y R. muscosa comparten signos comunes de desarrollo en sus patrones reproductivos permitiendo una clasificación similar de la etapa reproductiva (Figura5). A través de esta tecnología ahora hay evidencia de que el desarrollo de óvulos es alto en Necturus cautivo y R. muscosa y que ambas especies siguen un patrón estacional. Aunque las razones de estos fenómenos son desconocidas y requieren más investigación, sin el uso de ultrasonido, varias áreas de disfunción ovárica, como la retención de óvulos y la oviposición parcial, habrían pasado desapercibidas. Las aplicaciones futuras de esta técnica se utilizarán para determinar si las hembras deben ser seleccionadas para la cría en un año dado y si la oviposición está completa.
Un protocolo de recolección de sangre, como el presentado en R. muscosa,que es eficaz y causa una mínima angustia al animal, es óptimo para estudiar los perfiles hormonales en los Anurans cautivos y capturados en la naturaleza (Calatayud, inédito). Hasta la fecha, no existe información sobre los perfiles hormonales anuales de R. muscosa cautivo y, por lo tanto, no hay conocimiento sobre cómo las hormonas están influyendo en su salud y reproducción. Además, con evidencia de que las hembras de esta especie pueden no ser criadores anuales, el perfil hormonal será otro método para el seguimiento de los ciclos ováricos. Junto con el ultrasonido, el análisis hormonal puede conducir a una mejor predicción de lo que las hembras estarán listas para la oviposición. Además, en el último año se han documentado dos casos de intersexualidad en la población cautiva de R. muscosa. Además, el desarrollo de almohadillas para el pulgar se ha observado en algunas de las hembras fundadoras mayores. Razones para esto están actualmente bajo investigación, pero los resultados iniciales sugieren que puede relacionarse con cambios en los niveles de testosterona (Calatayud, inédito). Discernir los ciclos hormonales en mujeres de diferentes edades nos ayudará a entender por qué las hembras pueden desarrollar características sexuales secundarias asociadas a los hombres y si esto es de esperar en una población envejecida.
La terapia hormonal exógena se ha utilizado para superar las disfunciones reproductivas que se encuentran con frecuencia en los anfibios cautivos. Sin embargo, tanto para las poblaciones de R. muscosa como necturus en este estudio, no se detectaron diferencias significativas en la oviposición entre las hembras tratadas con hormonas y las mujeres de control durante un período de tiempo de 2 y 5 años, respectivamente. Esto puede indicar que el protocolo de administración hormonal, dosis, cebado y combinación hormonal utilizado no era adecuado para la especie. Un análisis más detenido de las historias reproductivas femeninas individuales sugiere que R. muscosa puede no experimentar la cría anual, lo que también podría explicar la falta de efecto hormonal observada en las hembras tratadas. Debido a que un cierto porcentaje de las hembras constantemente se saltó la cría cada año, entender la historia natural de la especie puede ayudar a determinar si hay una necesidad de hormonas exógenas y cuándo pueden ser más eficaces. Los procedimientos descritos en este artículo se pueden aplicar a una serie de especies, (Tabla 1) y son para ananurans que van de 5 g a 150 g; los animales más grandes pueden requerir diferentes jeringas y calibres de aguja. La ubicación de la inyección varía con algunas hormonas que requieren inyección intramuscular, intraperitoneal, subcutánea o intradérmica (Figura7).
La cirugía con fines de ovariectomía es un método común utilizado en varias especies de anfibios para obtener ovocitos para estudios embrionarios. La ovariectomía también puede estar indicada para el control de la población y problemas médicos como la retención de óvulos. En el caso de ovarictomías parciales en las que, la recolección de ovocitos se realiza con fines de investigación, la cirugía debe garantizar que el animal permanezca reproductivo. La administración de PGF2 ha demostrado alguna promesa en la resolución de la retención de óvulos en hembra R. muscosa. En varios individuos, el PGF2o provocó la deposición completa de los huevos previamente retenidos, pero en otros sólo se produjo una deposición parcial que requería desmontaje manual para eliminar todos los huevos. Mientras que el PGF2 puede servir como una alternativa a la cirugía para la retención de óvulos en R. muscosa, su capacidad para remediar condiciones patológicas similares en otros anfibios requerirá validación específica de la especie. Cuando se requiere una intervención quirúrgica para el paciente de Anuran o Caudate, es necesario asegurar un plano adecuado de anestesia antes de realizar las incisiones. Se necesitan habilidades de observación astuta para evaluar y monitorear las respuestas normativas de inducción y recuperación como se describe en este estudio para cada uno de los taxones. Una vez que uno está familiarizado con la anatomía específica, un enfoque quirúrgico adecuado, hemostasis, manipulación suave del tejido y manejo postoperatorio adecuado, las cirugías reproductivas no representan obstáculos abrumadores.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Natalie Calatayud desea agradecer a la Dra. Barbara Durrant por su formación y asistencia con ultrasonido y a Exploradora de Immuebles, S.A. (EISA) por otorgar ayuda financiera a mi puesto de investigador asociado en SDZG. Gracias a la Dra. Kylie Cane por sus comentarios sobre el manuscrito, así como a los revisores oficiales (quienquiera que sean). Gracias a Jonathan Dain nuestro 2018 Summer Fellow, San Diego Zoo Institute for Conservation Research for providing photos (Figure 1A,B). Monica Stoops extiende el agradecimiento a la Asociación de Zoológicos y Acuarios Conservation Endowment Fund y el Disney Worldwide Conservation Fund por proporcionar apoyo financiero para establecer la población cautiva de Necturus. Además, también se recibió apoyo a través de donaciones privadas de la defensora de anfibios Sra. Iris de la Motte. Gracias, se le da al Sr. Christopher DeChant y al Dr. Mark Campbell por su importante contribución a la investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| GE logiq Book XP and 8C-RS probe 4e10 MHz GE Medical Systems | GE medical systems | GE logiq Book XP | Ultrasound |
| Aloka 500 7.5mHz linear or IBEX multi-frequency (10-6mHz) micro-convex | GE medical systems | 8C-RS (10 MHz) | Ultrasound probe |
| BD disposable U-100 insulin syringe (28-29 G needle) | Mettler Electronics Corp CA | Sonigel | Ultrasound gel (water soluble, salt-free) |
| Hormone | |||
| Gonadotropin releasing hormone | BACHEM | 4012028 | synonym: [Des-Gly10, D-Ala6, Pro-NHEt9]-GnRH acetate abbreviation: GnRH |
| Lutenizing hormone releasing hormone | BACHEM, Sigma-Aldrich | 4033013; L1898 | synonym: Pyr-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2 acetate salt; [D-Ala6}-LHRH acetate salt hydrate abbreviation: LHRH |
| Human chorionic gonadotropin | BACHEM, Sigma-Aldrich | 4030270, 4018894; C1063, CG5, CG10 | synonym: Chorionic gonadotropin-β (109-145)(109-119); Choriogonin, HCG (2,500IU, 5,000IU, 10,000IU) abbreviation: hCG |
| Prostaglandin 2α | Sigma-Aldrich | P40424; | synonym: (5Z,9α,11α,13E,15S)-9,11,15-Trihydroxyprosta-5,13-dienoic acid tris salt, PGF2α−Tris; abbreviation: PGF2α |
| Follicle-stimulating hormone | Sigma-Aldrich | F4021, F8174 | synonym: porcine, sheep abbreviation: FSH |
| Progesterone | Sigma-Aldrich | 46665; P7556 | synonym: Vetranal; P4 water soluble abbreviation: P4 |
| Pituitary extract | na | synonym: Check papers for amphibian species derivation abbreviation: PE | |
| Pregnant Mare Serum Gonadotropin | Prospec; Lee Biosolutions; Sigma-Aldrich | HOR-272; 493-10; 9002-70-4 | synonym: Pregnant Mare Serum Gonadotropin abbreviation: PMSG |
| Metaclopromide | Sigma-Aldrich | M0763 | synonym: 4-Amino-5-chloro-N-[2-(diethylamino)ethyl]-2-methoxybenzamide, Methoxychloroprocainamide abbreviation: MET |
| Lucrin | BACHEM; Sigma-Aldrich | 4033014; L0399 | synonym: Leuprorelin acetate abbreviation: Lucrin |
| Lutalyse | Pfizer | synonym: PGF2α - Dinoprost tromethamine abbreviation: Lut | |
| Pimozide | Sigma-Aldrich | P1793 | synonym: 1-[1-[4,4-bis(4-Fluorophenyl)butyl]-4-piperidinyl]-1,3-dihydro-2H-benzimidazol-2-one abbreviation: PZ |
| Amphiplex | see above | synonym: Gonadotropin releasing hormone + metoclopramide abbreviation: GnRH + MET | |
| Ovopel | Ovopel | na | synonym: GnRHa + dopamine receptor antagonist (administered 1 pellet/ kg) abbreviation: Ovo |
| Ovaprim | Pentair aquatic eco-systems | Ova10 | synonym: Salmon gonadotropin + domperidone abbreviation: Ova |
| Domperidone | Sigma-Aldrich | D122 | synonym: 4-(5-Chloro-2-oxo-1-benzimidazolinyl)-1-[3-(2-oxobenzimidazolinyl)propyl]piperidine abbreviation: DOM |
Referencias
- Conde, D. A., Flesness, N., Colchero, F., Jones, O. R., Scheuerlein, A. An emerging role of zoos to conserve biodiversity. Science. 331 (6023), 1390-1391 (2011).
- Conde, D. A., et al. Zoos through the Lens of the IUCN Red List: A Global Metapopulation Approach to Support Conservation Breeding Programs. PLoS ONE. 8 (12), e80311(2013).
- Morrison, C., Hero, J. -M. Geographic variation in life-history characteristics of amphibians: a review. Journal of Animal Ecology. 72 (2), 270-279 (2003).
- Calatayud, N. E., Stoops, M., Durrant, B. S. Ovarian control and monitoring in amphibians. Theriogenology. , 70-81 (2018).
- National Research Council. Institutional Animal Care and Use Committee Guidebook. , (2010).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Graham, K. M., Langhorne, C. J., Vance, C. K., Willard, S. T., Kouba, A. J. Ultrasound imaging improves hormone therapy strategies for induction of ovulation and in vitro fertilization in the endangered dusky gopher frog (Lithobates sevosa). Conservation Physiology. 6 (1), coy020(2018).
- Wright, K. M., Whitaker, B. R. Amphibian Medicine and Captive Husbandry. , Krieger Publishing Company. (2001).
- Forzán, M. J., Vanderstichel, R. V., Ogbuah, C. T., Barta, J. R., Smith, T. G. Blood collection from the facial (maxillary)/musculo-cutaneous vein in true frogs (family Ranidae). Journal of Wildlife Diseases. 48 (1), 176-180 (2012).
- Allender, M. C., Fry, M. M. Amphibian hematology. Veterinary Clinics of North America: Exotic Animal Practice. 11 (3), 463-480 (2008).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). Journal of the American Association for Laboratory Animal Science. 46 (3), 64-67 (2007).
- Jorgensen, C. B. External and internal control of patterns of feeding, growth and gonadal function in a temperate zone anuran, the toad Bufo bufo. Journal of Zoology. 210 (2), 211-241 (1986).
- Jørgensen, C. B. Growth and reproduction. Environmental Physiology of the Amphibians. , 439-466 (1992).
- Vu, M., Trudeau, V. L. Neuroendocrine control of spawning in amphibians and its practical applications. General and Comparative Endocrinology. 234, 28-39 (2016).
- Clulow, J., Trudeau, V. L., Kouba, A. J. Amphibian declines in the twenty-first century: why we need assisted reproductive technologies. Reproductive Sciences in Animal Conservation. , 275-316 (2014).
- Kouba, A., et al. Assisted reproductive technologies (ART) for amphibians. Amphibian Husbandry Resource Guide. 2, 60-118 (2012).
- Clulow, J., et al. Optimisation of an oviposition protocol employing human chorionic and pregnant mare serum gonadotropins in the Barred Frog Mixophyes fasciolatus (Myobatrachidae). Reproductive Biology and Endocrinology. 10 (1), 60(2012).
- Browne, R. K., Seratt, J., Vance, C., Kouba, A. Hormonal priming, induction of ovulation and in-vitro fertilization of the endangered Wyoming toad (Bufo baxteri). Reproductive Biology and Endocrinology. 4 (1), 34(2006).
- Calatayud, N. E., et al. A hormone priming regimen and hibernation affect oviposition in the boreal toad (Anaxyrus boreas boreas). Theriogenology. 84 (4), 600-607 (2015).
- Stoops, M. A., Campbell, M. K., Dechant, C. J. Successful captive breeding of Necturus beyeri through manipulation of environmental cues and exogenous hormone administration: a model for endangered Necturus. Herpetological Review. 45 (2), 251-256 (2014).
- Mc Creery, B. R., Licht, P. Induced ovulation and changes in pituitary responsiveness to continuous infusion of gonadotropin-releasing hormone during the ovarian cycle in the bullfrog, Rana catesbeiana. Biology of Reproduction. 29 (4), 863-871 (1983).
- Johnson, C. J., Vance, C. K., Roth, T. L., Kouba, A. J. Oviposition and ultrasound monitoring of American toads (Bufo americanus) treated with exogenous hormones. Proceedings of the American Association of Zoo Veterinarians. 299, 301(2002).
- Herbert, D. Studies of assisted reproduction in the spotted grass frog Limnodynastes tasmaniensis: ovulation, early development and microinjection (ICSI). , (2004).
- Michael, S. F., Buckley, C., Toro, E., Estrada, A. R., Vincent, S. Induced ovulation and egg deposition in the direct developing anuran Eleutherodactylus coqui. Reproductive Biology and Endocrinology. 2, 6(2004).
- Ogawa, A., Dake, J., Iwashina, Y., Tokumoto, T. Induction of ovulation in Xenopus without hCG injection: the effect of adding steroids into the aquatic environment. Reproductive Biology and Endocrinology. 9 (1), 11(2011).
- Silla, A. J. Effects of luteinizing hormone-releasing hormone and arginine-vasotocin on the sperm-release response of Günther’s Toadlet, Pseudophryne guentheri. Reproductive Biology and Endocrinology. 8 (1), 139(2010).
- Trudeau, V. L., et al. Hormonal induction of spawning in 4 species of frogs by coinjection with a gonadotropin-releasing hormone agonist and a dopamine antagonist. Reproductive Biology and Endocrinology. 8 (1), 36(2010).
- Krause, E. T., von Engelhardt, N., Steinfartz, S., Trosien, R., Caspers, B. A. Ultrasonography as a minimally invasive method to assess pregnancy in the fire salamanders (Salamandra salamandra). Salamandra. 49, 211-214 (2013).
- Browne, R. K., Li, H., Seratt, J., Kouba, A. Progesterone improves the number and quality of hormone induced Fowler toad (Bufo fowleri) oocytes. Reproductive Biology and Endocrinology. 4 (1), 3(2006).
- Bramucci, M., et al. Different modulation of steroidogenesis and prostaglandin production in frog ovary in vitro by ACE and ANG II. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 273 (6), R2089-R2096 (1997).
- Gobbetti, A., Zerani, M. Possible roles for prostaglandins E2 and F2α in seasonal changes in ovarian steroidogenesis in the frog (Rana esculenta). Journal of Reproduction and Fertility. 98 (1), 27-32 (1993).
- Gobbetti, A., Zerani, M., Carnevali, O., Botte, V. Prostaglandin F2α in female water frog, Rana esculenta: Plasma levels during the annual cycle and effects of exogenous PGF2α on circulating sex hormones. General and Comparative Endocrinology. 80 (2), 175-180 (1990).
- Guillette, L. J. Jr, Dubois, D. H., Cree, A. Prostaglandins, oviducal function, and parturient behavior in nonmammalian vertebrates. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 260 (5), R854-R861 (1991).
- Clulow, J., Mahony, M., Browne, R., Pomering, M., Clark, A. Applications of assisted reproductive technologies (ART) to endangered anuran amphibians. Declines and Disappearances of Australian Frogs'. Campbell, A. , 219-225 (1999).
- Browne, R. K., Wolfram, K., García, G., Bagaturov, M. F., Pereboom, Z. Zoo-based amphibian research and conservation breeding programs. Amphibian and Reptile Conservation. 5 (3), 1-14 (2011).
- Chai, N. Surgery in amphibians. Veterinary Clinics: Exotic Animal Practice. 19 (1), 77-95 (2016).
- Gentz, E. J. Medicine and surgery of amphibians. Ilar Journal. 48 (3), 255-259 (2007).
- Snyder, W. E., Trudeau, V. L., Loskutoff, N. M. 168 a noninvasive, transdermal absorption approach for exogenous hormone induction of spawning in the northern cricket frog, Acris crepitans: a model for small, endangered amphibians. Reproduction, Fertility and Development. 25 (1), 232-233 (2012).
- Kouba, A. J., et al. Emerging trends for biobanking amphibian genetic resources: the hope, reality and challenges for the next decade. Biological Conservation. 164, 10-21 (2013).
- Michael, S. F., Buckley, C., Toro, E., Estrada, A. R., Vincent, S. Induced ovulation and egg deposition in the direct developing anuran Eleutherodactylus coqui. Reproductive Biology and Endocrinology. 2 (1), 6(2004).
- Fort, D. J. Frog reproduction and development study 2000 rana pipiens reproduction and development study. , Environmental Protection Agency. (2003).
- Clulow, J., et al. Differential success in obtaining gametes between male and female Australian temperate frogs by hormonal review: A Review. General and Comparative Endocrinology. 265, 141-148 (2018).
- Trottier, T. M., Armstrong, J. B. Diploid gynogenesis in the Mexican axolotl. Genetics. 83 (4), 783-792 (1976).
- Marcec, R. M. Development of assisted reproductive technologies for endangered North American salamanders. , Mississippi State University. (2016).
- Wright, M. L. Melatonin, diel rhythms, and metamorphosis in anuran amphibians. General and Comparative Endocrinology. 4, (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados