Method Article
Reproduktionstechniken für Diekarianüberwachung und -kontrolle bei Amphibien
In diesem Artikel
Zusammenfassung
Das Studium der Amphibienbiologie liefert wertvolle Informationen über die reproduktiven, physiologischen, embryonalen und entwicklungstechnischen Prozesse, die Organismen vieler taxonomischer Gruppen antreiben. Hier stellen wir einen umfassenden Leitfaden zu verschiedenen Methoden vor, mit denen die Kontrolle und Überwachung von Eierstöcken bei Amphibien untersucht werden kann.
Zusammenfassung
Die Kontrolle und Überwachung von Eierstöcken bei Amphibien erfordert einen facettenreichen Ansatz. Es gibt mehrere Anwendungen, die erfolgreich Reproduktivverhalten und den Erwerb von Gameten und Embryonen für physiologische oder molekulare Forschung induzieren können. Amphibien tragen zu einem Viertel zu einem Drittel der Wirbeltierforschung bei, und von Interesse in diesem Zusammenhang ist ihr Beitrag zum Wissen der wissenschaftlichen Gemeinschaft über Fortpflanzungsprozesse und embryologische Entwicklung. Der größte Teil dieses Wissens stammt jedoch von einer kleinen Anzahl von Arten. In jüngster Zeit erforderte die Dezimierung von Amphibien auf der ganzen Welt ein zunehmendes Eingreifen von Naturschützern. Die Rückgewinnungs- und Sicherungskolonien, die weiterhin als Reaktion auf das Aussterberisiko entstehen, machen bestehende Forschungs- und klinische Anwendungen für das Überleben und die Fortpflanzung von Amphibien, die unter menschlicher Obhut gehalten werden, von unschätzbarem Wert. Der Erfolg jeder in Gefangenschaft gehaltenen Population beruht auf ihrer Gesundheit und Fortpflanzung und der Fähigkeit, lebensfähige Nachkommen zu entwickeln, die die unterschiedlichste genetische Darstellung ihrer Art vortragen. Für Forscher und Tierärzte ist daher die Fähigkeit, die Entwicklung und Gesundheit von Eierstöcken zu überwachen und zu kontrollieren, unerlässlich. Der Schwerpunkt dieses Artikels liegt darauf, die verschiedenen assistierten Reproduktionstechniken hervorzuheben, die verwendet werden können, um die Eierstockfunktion bei Amphibien zu überwachen und gegebenenfalls zu kontrollieren. Im Idealfall sollten alle Reproduktiv- und Gesundheitsprobleme durch eine ordnungsgemäße Haltung in Gefangenschaft reduziert werden, aber wie bei jedem Tier sind Fragen der Gesundheit und der Reproduktiven unausweichlich. Nicht-invasive Techniken umfassen Verhaltensbeurteilungen, visuelle Inspektion und Palpation sowie morphometrische Messungen zur Berechnung von Körperzustandsindizes und Ultraschall. Invasive Techniken umfassen hormonelle Injektionen, Blutentnahme, und Chirurgie. Die Kontrolle der Eierstöcke kann je nach Anwendung und Arten von Interesse auf verschiedene Weise ausgeübt werden.
Einleitung
Amphibien sind seit langem als wichtige biologische und medizinische Modelle durch eine breite Palette von Forschungsdisziplinen anerkannt. Daten, die durch das Studium bestimmter Arten wie Xenopus laevis und X. tropicalis, der Leopardenfrosch (Lithobate (früher Rana) pipiens) und das Axolotl (Ambystoma mexicanum) gewonnen wurden, wurden auf eine Reihe anderer Wirbeltierarten, einschließlich des Menschen. Die Tier-, Haltungs- und assistierten Reproduktionstechniken, die aus der Untersuchung dieser und anderer Amphibien hervorgegangen sind, unterstützen diejenigen, die mit der Entwicklung einer erfolgreichen Pflege, Erhaltung und Nachhaltigkeit seltenerer Populationen in Gefangenschaft beauftragt sind. 1 , 2 , 3 , 4.
Das Interesse für die gleichzeitige Verwendung von in und ex situ naturschutzbasierten Ansätzen zur Umkehrung der Flut des Aussterbens für viele gefährdete Amphibienarten1,2. Dieser Artikel enthält die derzeit verfügbaren Methoden zur Überwachung und Kontrolle der Amphibien-Ovarialfunktion in Modellarten von Anurans und Caudates. Zusätzlich werden bestehende Techniken zur Bekämpfung einer gemeinsamen Reproduktivpathologie der Eiretention vorgestellt.
Wie in vielen taxonomischen Gruppen beinhaltet die amphibische Ovarialkontrolle eine Reihe eng synchronisierter Wechselwirkungen zwischen Umwelt und Physiologie. Temperatur und Photoperiode (bekannt als nahe Signale) werden von Auge und Gehirn entschlüsselt, wo sie schnell in genetische, hormonelle und zirkadiane Prozesse (ultimative Signale)umgewandeltwerden 3,4. Die in diesem Artikel behandelten Methoden zur Überwachung und Kontrolle der Eierstockfunktion umfassen invasive und nicht-invasive Techniken. Institutional Animal Care and Use Committee (IACUC) Forschungs- und Lehranforderungen definieren nicht-invasive Techniken als diejenigen, die minimale bis keine körperlichen Schmerzen oder psychischen Beschwerden verursachen und keine schmerzlindernden Medikamente erfordern5. Nicht-invasive Techniken umfassen hier visuelle Inspektion und Palpation, Verhaltensbeobachtungen, morphometrische Bewertungen und Ultraschall. Im Gegenteil, die Techniken der Blutentnahme, Hormonverabreichung und Chirurgie (Ovariektomie und Entfernung von zurückgehaltenen Eiern) werden als invasiv eingestuft, da sie zu einigen Schmerzen oder Beschwerden führen können und eine Anästhesie oder eine postprozedurale medikamentöse Therapie erfordern.
Nicht-invasive Ovarialüberwachungstechniken können für die meisten in Gefangenschaft gehaltenen Amphibien leicht in die tägliche Pflegeroutine integriert werden. Je nach Art kann die Ovarialgravitation oft durch einfache Sichtprüfung (Glasfrosch) bestimmt werden. In anderen Fällen kann die Palpation darauf hinweisen, ob ein Weibchen gravid ist. Verschiedene Körperzustandsindizes (BCI) wie Gewicht, Schnospe-Urostyle-Länge (SUL), Schnommen-Entlüftungslänge (SVL) und Standard-Massenindex (SMI) stehen zur Vorhersage des Vorhandenseins oder Fehlens von Eiern4,6,7, 8,9. Bei der Interpretation der Ergebnisse sollte jedoch Vorsicht geboten sein, da die meisten Alter, Körperform oder Zusammensetzung (z. B. wasserzurückgehaltenes Wasser im Vergleich zu Eierstockmasse oder Fett) nicht berücksichtigen6. Definitive Reproduktionsdiagnosen können über Ultraschall mit tieferen Kenntnissen über die Eientwicklung und die Inszenierung des Eierstockzyklus erreicht werden4,7. Ultraschall bietet auch ein Mittel, um reproduktive Pathologien und damit verbundene physiologische Bedingungen zu bestätigen und zu überwachen4,8.
Neben der Bereitstellung von Informationen über den Gesundheitszustand, Blutentnahme kann verwendet werden, um Fortpflanzungshormone zu messen. Wenn Hormon-Profiling ist das Endziel, Es ist wichtig, stressbedingte Einflüsse zu vermeiden, die systemische Steroid-Daten verwirren können. Während ein potenziell leistungsfähiges Überwachungsinstrument, Es gibt noch eine Studie, die angeborene endokrinologische Reaktionen auf exogene Hormon-Verabreichung bei jeder Amphibienart zeigt. Blut kann sicher von mehreren Stellen entnommen werden; bei Fröschen umfasst dies die ventrale Bauchvene, lingualen Plexus, Femoral vene und Herz9,10. In Caudates wird Blut aus der ventralen Schwanzvene entnommen. Der Grad der Invasivität, der erforderliche Grad an Zurückhaltung, die Notwendigkeit des Anästhetikums, die Zartheit des angegriffenen Organs und die Größe des Tieres sind Faktoren, die bei der Wahl einer Sammeltechnik für den Amphibienpatienten zu berücksichtigen sind. Dieser Artikel wird die Technik der Blutentnahme aus der Gesichtskiefer oder muskelkultokutanen Vene von Fröschen, wie ursprünglich von Forzan et al. beschrieben.9.
Die Ovariankontrolle ist artspezifisch und als solche sollten Hormonprotokolle getestet und optimiert werden. Abgesehen von der Saisonalität und dem damit verbundenen zirkulierenden Hormonmilieu kann die Kontrolle der Eierstöcke auch eng mit dem Alter, der Zeit in Gefangenschaft und der Exposition gegenüber wiederholter Hormonverabreichung verbunden sein, für die es in der Literatur wenig Informationen gibt11 , 12 , 13. Die Umsetzung von Hormontherapien zur Erzielung von Fortpflanzungsverhalten, Gametenproduktion, Reifung und Eileiter ist zu einem weithin berichteten Ansatz zur Lösung gemeinsamer Fortpflanzungsprobleme im Zusammenhang mit Gefangenschaftgeworden 4, 8,14,15,16. Da die Mechanismen zur Kontrolle der Fortpflanzung bei Wirbeltieren stark konserviert sind, gibt es eine Reihe von Hormonen, Neuropeptide und kommerziell erhältlichen Arzneimitteln, die therapeutisch in anderen taxonomischen Gruppen eingesetzt werden, die auch in einer Reihe von Amphibienarten (Tabelle 1). Gonadotropin-Releasing-Hormon (GnRH) und Humanchoriongonadotropin (hCG) (oder Variationen davon, d.h. PMSG und eCG)17,18, einzeln oder in Kombination, wurden ausgiebig in Amphibien-Gefangenschaft Zuchtprogramme einschließlich: der Southern Rocky Mountain boreal (Anaxyrus boreas boreas)4,19,20; die Kröte, Dusky Gopher Frosch, Rana sevosa (Langhorne et al., unveröffentlicht)7; der Wasserhund der Golfküste, Necturus beyeri20; Wyoming Kröte, Anaxyrus baxteri18; der Stierfrosch, Rana catesbiana21; die amerikanische Kröte, Anaxyrus americanus22; der Grasfrosch, Lymnodyaster tasmaniensis23; der Coqui, Eleutherodactylus coqui24; Xenopus, Xenopus laevis25; die Gunther-Kröte, Pseduophryne guentheri26; der Nördliche Leopardenfrosch, Lithobates pipiens; der argentinische Hornfrosch, Ceratophrys verziert; der Cranwell-Hornfrosch C. cranwelli; der amerikanische Bodenfrosch, Odontophrynus americanus27; und der Feuersalamander (Salamandra)228. Steroidhormone, wie Progesteron (P4), sind weniger häufig berichtet, aber haben eine gute Wirksamkeit bei der Bildung von Eisprung und Oviposition bei einigen Arten von Anurans16,18,29gezeigt. Prostaglandine (insbesondere Prostaglandin 2-alpha (PGF2)sind am Eisprung zusammen mit Kortikosteroiden30,31,32,34 beteiligt und erreichen hohe die Eisprungphase31.
In In-vitro-Studien ist PGF2a ein potenter Induktor des Eisprungs31, während es in vivo oviposition von zurückgehaltenen Eiern in Rana muscosa4,30,32induzieren kann. Hypophysenextrakte sind auch wirksame Induktoren des Eisprungs15,16,34; Bedenken im Zusammenhang mit der Biosicherheit und dem Potenzial für die Übertragung von Krankheiten sind jedoch oft eine Abschreckung für Zuchtkolonien in Gefangenschaft, wenn sie diesen Ansatz in Betracht ziehen35.
Der letzte Abschnitt dieses Artikels beschreibt chirurgische Verfahren und bietet alternative Ansätze, um Eierstockstudien oder Hilfe bei der Lösung reproduktiver Pathologien zu erweitern. Ovariektomien werden am häufigsten in Amphibien durchgeführt, um Eizellen für die embryologische Forschung zu erhalten. Jedoch, Es kann auch ein Heilmittel für zurückgehaltene Eier bieten, wenn andere Optionen fehlschlagen. Obwohl dieses Verfahren invasiv ist und eine vollständige Anästhesie und Einschnitte erfordert, um die Eimassen freizulegen, erfordert es keine Euthanasie. Darüber hinaus können Tiere nach partieller Ovariektomie eine vollständige Genesung vornehmen und nach der Operation weiterhin reproduktiv aktiv sein8,36.
Die unten beschriebenen Protokolle beschreiben die invasiven und nicht-invasiven Methoden der Eierstockkontrolle und -überwachung in Anurans und Caudates. Die spezifischen Arten, die ausgewählt wurden, um Techniken in Anurans zu veranschaulichen, sind R. mucosa und X. laevis. Necturus maculosus, N. beyeri, N. alabamensisund A. mexicanum umfassen die Arten, die verwendet werden, um Techniken in Caudates ähnlich zu beschreiben.
Protokoll
Salamander-Verfahren wurden von den Protokollen des Cincinnati Zoo & Botanical Garden (CZBG) Institutional Care and Use Committee (IACUC) 11-106, 13-110, 14-133 und 15-138 genehmigt. Alle Frosch- und Krötenprozeduren wurden von den Protokollen des San Diego Zoo Global (SDZG), Institutional Care and Use Committee (IACUC) genehmigt: 15-001, 16-005 und 18-003.
Die Pflege und Behandlung von Tieren wurde vom Ethikausschuss des Nationalmuseums für Naturgeschichte (Paris) (Museum National d'Histoire Naturelle-Ménagerie du Jardin des Plantes (MNHN)) in Übereinstimmung mit den institutionellen und nationalen Richtlinien genehmigt. (Commission de Génie Génétique, Direction Départementale des Services Vétérinaires, Richtlinie 2010/63/EU der Europäischen Union, Einigungsentscheidung Nr. C75-05-01-2 für das Europäische Übereinkommen für Wirbeltiere, die für experimentelle und andere wissenschaftliche Zwecke verwendet werden. Alle in dieser Studie verwendeten Protokolle wurden unter der Referenznummer 68-037 zugelassen.
1. Nichtinvasive Ovarialüberwachungstechniken
- Visuelle Inspektion und Palpation
- Halten Sie das Weibchen Anuran auf eine der drei unten beschriebenen Weisen.
- Sichern Sie den Frosch oder die Beine der Kröte mit dem Ring und dem kleinen Finger, wobei Sie die Rückenseite (Bauch) des Froschkörpers mit dem Zeige- und Mittelfinger und die ventrale Seite mit dem Daumen stützen (Abbildung 1A).
- Halten Sie den Frosch oder die Kröte in der dominanten Hand mit einem Daumen auf dem Bauch und den Rest der Finger, die den Rücken des Tieres sichern. Mit der nicht-dominanten Hand, um den Bauch des Tieres zu palpaten, fühlen, wenn es subdermalen Unebenheiten gibt (Abbildung 1B).
- Ruhen Sie den Frosch oder Krötenbauch auf der Handfläche, die vorderen Arme über dem Zeigefinger drapiert und einen Daumen auf dem oberen Rücken.
- Da Caudates vollständig aquatisch sind, führen Sie eine visuelle Inspektion mit einer von zwei unten beschriebenen Methoden durch.
- Bewegen Sie das Tier in einen separaten 4 L Behälter mit Tankwasser. Halten Sie den Behälter (Deckel gesichert) hoch und leuchten Sie Taschenlampe auf der Unterseite, um das Vorhandensein / Abwesenheit von Eiern zu visualisieren.
- Anästhesisieren in MS222 (0,5 g/L; Tricain-Methansulfonat, gepuffert mit 0,5 M NaHCO3). Nach der Induktion das Tier auf den Rücken drehen und den Bauch untersuchen.
- Halten Sie das Weibchen Anuran auf eine der drei unten beschriebenen Weisen.
- Morphometrische Bewertungen
- Anurans
HINWEIS: Anästhesie ist nicht erforderlich.- Mit Sätteln, messen Sie das Tier von der Spitze des Mundes, entlang der Mitte des Körpers bis zur Spitze des Schwanzes, um SUL und SVL zu erhalten (Abbildung 2A, B).
- Tare einen Kunststoffbehälter auf einer digitalen Präzisionsskala. Legen Sie das Tier in einen geteerten Behälter und wiegen (Abbildung 2C).
- Verwenden Sie für größere Tiere, wie Stierfrösche, oder bei der Beschaffung von Gewichten im Feld eine hängende Skala (Abbildung2D).
- Wie bei vielen Anuran-Arten, unterscheiden R. muscosa erwachsene Weibchen von Männchen durch ihre größere Größe und das Fehlen von ehelichen (Daumen) Pads an den Händen (Abbildung 3).
- Berechnen Sie den Körperzustand als grundlegende Beurteilung der Gesamtgesundheit nach der folgenden Formel:
Fultons Index: K = Masse - Länge3
HINWEIS: Fultons Index verwendet einen Maßsaldo des Volumens in Bezug auf Masse und Länge, wobei 3 der Skalierungsexponent ist, der Masse und Länge isometrisch in Beziehung setzt.
- Caudates
- Tare Skala mit einem leeren Beutel vor dem Platzieren der nicht-anästhetisierten Tier in. Achten Sie darauf, kein überschüssiges Wasser einzuführen (Abbildung 2D) und schnell handeln, da Tiere Schleim als Stressreaktion auf Zurückhaltung absondern.
- Erhalten Sie Maßnahmen für Erwachsene, indem Sie Personen in einer geraden Position am Boden einer wiederverschließbaren Plastiktüte oder in einem separaten Kunststoffbehälter, der erweiterte Bremssättel aufnehmen kann, immobilisieren.
- Messen Sie die Körperlänge mit Bremssätteln (Abbildung 2E).
- Messen Sie das Caudate von der Schnoutspitze bis zur Schwanzspitze (SVL), um das Wachstum zu überwachen.
- Anurans
- Verhaltensbeobachtungen
- Beobachten Sie Tiere physisch in Echtzeit oder verwenden Sie eine Videokamera, um das Verhalten aufzuzeichnen.
- Erfassen Sie Beobachtungen von Tieren, kategorisieren Verhaltensweisen und konstruieren Sie ein Ethogramm (Abbildung 4).
- Reproduktives Verhalten klassifizieren
HINWEIS: Abbildung 4 veranschaulicht eine Art von Fortpflanzungsverhalten, das bei Anuranen beobachtet wird.
- ultraschall
HINWEIS: Der Ultraschallwandler der Wahl, in diesem Fall 7,5 mHz linear oder ein Multi-Frequenz (10-6 mHz) mikrokonvex, wird für Necturus und eine 10 MHz Sonde und wasserlösliches, salzfreies Gel für R. muscosaempfohlen. Die Durchführung von Ultraschall auf Salamandern kann eine Anästhesie erfordern (anweisungen siehe Abschnitt 1.5).- Anurans
- Führen Sie Ultraschall auf R. muscosa mit zwei Personen (Abbildung5A).
- Erste Person: Halten Sie das Tier mit der dominanten Hand und tragen Sie das wasserlösliche, salzfreie Gel auf den Bauch des Tieres auf.
- Zweite Person (Ultra-Sonograph): Nehmen Sie die 10-MHz-Sonde in die dominante Hand und tragen Sie sie auf den Bauch auf, um sicherzustellen, dass ein guter Kontakt zwischen Sonde und Gel herzustellen ist.
- Schieben Sie nach innen von knapp unterhalb der Armgrube in Richtung der Mitte der Bauchlinie des Tieres, um den ganzen Eierstock zu visualisieren.
- Ultra-Sonograph: Verwenden Sie eine nicht-dominante Hand, um den Rahmen einzufrieren und die gewünschten Bilder auf dem Ultraschall zu erfassen.
- Kategorisieren Sie die Stufe des Ovarialzyklus durch das für die Gattung 4 eingerichtete Benotungssystem4 (Tabelle 2, Abbildung 5B-F).
- Spülen Sie jedes Gel von Tier am Ende des Verfahrens.
- Caudates
- Nicht anästhesierten Necturus in 4 L rechteckigen Behälter mit 2 L Tankwasser füllen.
- Minimieren Sie die Bewegung des Tieres, indem Sie das Raumlicht ausschalten und/oder eine Hand über den Kopf des Tieres bechern.
- Positionieren Sie den Messumformer in einem Abstand von 1-2 cm von der Körperwand.
- Suchen Sie das Herz auf der ventralen Mittellinie zu den Vorderbeinen und bewegen Sie dann den Transducer distally und untersuchen Sie das Eierstockgewebe7.
- Kategorisieren Sie Weibchen nach dem für die Gattung 4 eingerichteten Benotungssystem4 (Abbildung 6A,B,C).
- Erhalten Sie genaue Messungen der Eier im mittleren bis späten Stadium, indem Sie Bilder erfassen, wenn sich der Körper des Tieres in einem Winkel zum Messumformer befindet (d. h. nicht linear, sondern leichter Lichtbogen; Abbildung 6B). Andernfalls erschweren überlappende Follikel die Unterscheidung der individuellen Eigröße.
- Anurans
- Anästhesieinduktion und -erholung
- Anurans
- Anästhesisieren in MS222 (0,5 g/L; Tricain-Methansulfonat gepuffert (0,5 M NaHCO3) wie zuvor beschrieben.
- Verwenden Sie den Rechtenreflex als primären Indikator für den Grad, in dem das Tier beästhesiert wurde. Vollständiger Reflexverlust zeigt einen Zustand der tiefen Anästhesie.
- Entfernen Sie das Tier aus der Wasserbad-anästhesie (MS-222), sobald der Rechtereflex verloren geht.
- Legen Sie das Tier auf ein nasses (mit anästhetisch-freiem entchlortem Wasser) Handtuch.
- Achten Sie darauf, das Tier während des gesamten chirurgischen Eingriffs feucht zu halten.
- Intubieren Sie kleine Amphibien mit roten Gummikathetern, ungecuffed Tubes oder klassischen gefesselten Endotrachealröhren, ohne die Manschette aufzublasen.
- Geben Sie einen niedrigen Sauerstofffluss (0,5-0,75 l/min) mit 0,5-1% Isofluran.
- Stoppen Sie das Isofluran nach dem Eingriff, aber halten Sie den Sauerstofffluss für 1 Minute.
- Extubieren Sie das Tier und spülen Sie das Tier 2 Minuten lang gründlich mit anästhetischem, entchlortem Wasser ab.
- Legen Sie das Tier in eine geringe Menge entchlortem Wasser oder auf ein nasses Handtuch.
- Bewerten Sie die Genesung des Tieres, indem Sie sanft an einer Hintergliedsbeine ziehen, um sich zu verlängen. Jede reagierende Kontraktion der Gliedmaße deutet auf einen Entzugsreflex hin.
- Überwachen Sie andere Indikatoren der Erholung, wie z. B. Gularatmungen (Throat-Bewegung) und den Rechtenreflex.
- Betrachten Sie die Amphibien erholt, wenn alle Reflexe zurückgekehrt sind, und Herz- und Atmungsraten sind auf präanesthetische Werte zurückgekehrt.
- Caudates
- Anästhetisieren Necturus und Ambystoma in MS222 (0,5 g/L Tricainmemetulfonat, gepuffert mit 0,5 M NaHCO3, (MS222) in einem 4 L rechteckigen Tank.
- Legen Sie einen Luftstein (1 Zoll) und eine Luftpumpe in den Tank und schalten Sie ihn auf einen konstanten Durchfluss ein, um eine ausreichende Sauerstoffversorgung zu gewährleisten.
- Wenn die Gliedmaßenfunktion und der Rechtereflex verloren gehen, entfernen Sie das Tier aus der Wasserbad-Anästhesie (MS-222) und legen Sie das Tier auf ein nasses (mit anästhetisch-freies entchlortes Wasser) Handtuch.
- Halten Sie Haut und Kiemenfeuchtigkeit mit einer gepressten Flasche Tankwasser.
- Um das Tier zu bergen, legen Sie es sorgfältig ventrale Seite nach unten in einem 4 L Kunststoffbehälter mit 2 L Tankwasser mit einem Luftstein gefüllt.
HINWEIS: Die Erholung beginnt mit Kiemenblinken, gefolgt von der Fähigkeit, seinen Schwanz zu bewegen und vorwärts zu treiben und schließlich funktionelle Bewegung der Gliedmaßen. - Bringen Sie das Tier in seinen ursprünglichen Gehäusetank zurück und überwachen Sie es in den nächsten 24 Stunden genau.
HINWEIS: Es gibt andere Methoden der Anästhesie für Amphibien, die in Wright und Whitaker8beschrieben sind.
- Anurans
2. Invasive Eierstock-Monitor- und Kontrolltechniken
ANMERKUNG: Dieses Verfahren wurde von Forzén et al.10angepasst.
- Halten Sie den Frosch in der dominanten Hand, und tupmeln Sie die Venenpunktionsseite des Froschgesichts mit einem sterilen Wisch oder Gaze trocknen.
- Trocknen Sie das Gesicht, um zu vermeiden, dass sich das Blut zu sehr über die Haut verbreitet.
- Setzen Sie die Nadel (26 G 1/2" und 27 G 1/2"), mit der Abschrägung nach oben, durch die Haut, wo die erhöhte Haut um das Auge und der Oberkiefer Grat treffen, um den Punkt eines Dreiecks (gelbe Umriss) (Abbildung7A) Zugriff auf die Vena facialis in der Nähe die vena orbitalis posterior.
- Punktieren Sie die Gesichtsvene unter dem rechten Auge und über dem Oberkieferrücken, beginnend zwischen 1-2 mm zurück von der Mittellinie des Auges (Abbildung 7A).
HINWEIS: Bei kleineren Fröschen (unter 20 g) bewegen Sie die Einfügemarke näher an eine Position direkt unter der Mittellinie des Auges. - Winkeln Sie das Mikrohematokritrohr nach unten, um die Schwerkraft zu ermöglichen, um das Blut in das Rohr zu fließen. Blut sollte unmittelbar nach der Punktion fließen (Abbildung 7B,C).
- Beim ersten Anzeichen des Blutflusses, legen Sie die Spitze der Mikrohämatokrit-Röhrchen an der Punktionsstelle und sammeln 1-2 volle Mikrohämatokrit-Röhren von Blut und legen Sie Tuben in geeignete Behälter für die Sammlung (Abbildung 7B,C).
- Wenn das Blut nicht leicht fließt oder das Volumen sehr gering ist, verschieben Sie das Einsetzen der Nadel leicht oder setzen Sie die Nadel in die andere Seite des Gesichts ein.
- Stoppen Sie das Bluten, indem Sie Gaze mindestens 20 s lang fest an die Punktionsstelle drücken.
- Lassen Sie Frosch für 10 Minuten aus dem Wasser, um zu bestätigen, dass die Punktionsstelle nicht wieder öffnet.
- Verwenden Sie eine neue Nadel und neue Mikrohämatokrit-Röhren für jeden Frosch, der beprobt wird.
3. Hormoninduktion
- Hormonzubereitung
- Bereiten Sie Hormoninjektionen unmittelbar vor der Verwendung, um maximale Wirkung zu gewährleisten.
- Wählen Sie ein Hormon aus der in Tabelle 1aufgeführten Auswahl aus.
- Bestimmen Sie die Konzentration des Hormons, das mit einem Körpergewicht von16injiziert werden soll.
- Verdünnen Sie das Hormon in einem der folgenden Punkte: Wasser, Phosphat gepufferte Salzsäure (PBS), Salzamphibien-Ringer-Lösung (SARS) oder Salzlösung.
- Nicht mehr als ein Injektionsvolumen von 200 l für Frösche mit einem Gewicht von 30-70 g und 300 l für Frösche mit einem Gewicht von 80-110 g (persönliche Beobachtung)16.
- Für den korrekten Halt eines Tieres während der Hormonverabreichung eines Tieres im Bereich von 10-100 g, verwenden Sie eine der geeigneten Haltungsmethoden gemäß Abschnitt 1.1.
- Anurans
- Berechnen Sie die pro Person erforderliche Konzentration mit einem Gramm pro Körpergewicht (g/Körpergewicht).
- Kurz vor der Verabreichung in einem sterilen Verdünnungsverdünnungsmaterial der Wahl rekonstituieren.
- Stellen Sie sicher, dass vor der Injektion keine Blasen in der Spritze verbleiben.
- Halten Sie das Tier sicher in der nicht-dominanten Hand und verabreichen Sie die Injektion mit dominanter Hand.
- Verabreichen Sie Injektion nach Hormon-Spezifikationen. Die häufigsten Injektionen bei Anuranen sind subkutane, intraperitoneale oder intramuskuläre (Abbildung8).
- Verabreichen Sie IP-Injektionen im unteren Teil des Bauches oder im unteren Teil der Rückenseite des Körpers in der Nähe des Hinterbeins (Abbildung 9).
- Intramuskuläre Injektionen vorzugsweise in die Hinterbeine verabreichen.
- Caudates (Necturus)
- Rekonstituieren Sie das Hormon der Wahl in sterilem Wasser nach dem oben beschriebenen Gramm pro Körpergewicht Methode.
- Verwenden Sie bei Necturus Dosen von 1,7-2,3 g GnRH/g Körpergewicht.
- Necturus aus der Anästhesiekammer entfernen und auf eine 45°-Oberfläche legen, die mit chirurgischem Vorhang bedeckt ist.
- Positionieren Sie das Tier mit dem Nachuntenkopf.
- Nähern Sie sich hinteren Quadranten des Bauches (Kaudal des hinteren Beins) in einem 15-20° Winkel. Achten Sie darauf, keine Luft in die Spritze zu bringen.
- Injektion (IP) mit einer Insulinspritze und einer 27-30 G Nadel.
- Injizieren Sie das Hormon mit einer Insulinspritze und 27-30 G Nadel.
4. Chirurgie
- Allgemeine chirurgische Präparation und -prozedur
- Um aseptische Verfahren aufrechtzuerhalten, verwenden Sie klare sterile Kunststoffvorhänge, um chirurgische Stellen zu isolieren. Reduzieren Sie die Verdunstung, indem Sie die umgebende Haut feucht halten.
- Befeuchten Sie alle Materialien, die die Haut des Tieres mit sterilem Wasser kontaktieren. Machen Sie Hautschnitt mit einer Zahl 15 oder Nummer 11 Skalpellklinge.
HINWEIS: Eine Kombination aus kalter Stahl, Radiochirurgie oder Diodenlaser. Hämostase in mildem hämorrhagischem Verfahren kann durch Elektrokauter oder Diodenlaser erreicht werden. - Verwenden Sie Baumwollspieße oder Applikatoren, um die Anwendung von lokalisiertem Druck auf kleine Gefäße zu ermöglichen, die den Blutverlust verfolgen.
- Verwenden Sie Baumwoll-Spitzen-Speere oder Applikatoren, um kleine enge Räume anstelle von Standard-Gaze-Quadrate zu verwalten.
- Verwenden Sie Mikroinstrumente, wie ophthalmologische Instrumente, mit feinen, kleinen Spitzen, wenn Sie Operationen an Tieren mit einem Gewicht von weniger als 1 kg durchführen.
- Verwenden Sie kunststofffreie, selbsterhaltende Retraktoren (z. B. Lone Star Retractor), um verschiedene Schnittgrößen zu passen.
- Verwenden Sie Augenlid-Retraktoren zum Einziehen von coelomischen Schnitten.
- Verwenden Sie Vergrößerungsinstrumente, wenn dies für die Durchführung von Operationen an kleineren Patienten erforderlich ist.
HINWEIS: Analgesie ist bei jedem chirurgischen Eingriff bei Amphibien erforderlich. Das Versäumnis, während der Operation eine angemessene Analgesie zu verabreichen, wurde mit einer verzögerten Rückkehr normaler Funktionen in Verbindung gebracht. Darüber hinaus potenziert Analgesie die Wirkung von Anästhetika (Tabelle 3)34.
- Anurans
- Sobald X. laevis wie in Schritt 1.5.1 beschrieben betäuben wurde, positionieren Sie das Tier in dorsaler Rekonnuscy (Abbildung 10A,C).
- Bereiten Sie das chirurgische Feld aseptisch durch Wischen feuchte sterile Gaze mit verdünnter Povidon-Jod-Lösung (1/10) an der Stelle für 10-15 s oder 0,75% Chlorhexidin-Lösung auf der chirurgischen Stelle für mindestens 10 min vor der Operation35.
- Machen Sie einen 3 mm paramedianen Hautschnitt im mittleren Coelom (zwischen den Schultern und der Kloake) mit einem kräftigen Strich, der einen sauberen Schnitt mit einem Skalpell Nr. 15 oder Nr. 11 hinterlässt.
HINWEIS: Man kann einen Diodenlaser auch für Hauteinschnitte verwenden. - Elevate die Bauchmembran, machen und inziszieren und seziert sorgfältig mit einem Skalpell Nr. 15 oder Nr. 11. (Abbildung 10B,D).
- Ziehen Sie die koelomischen Einschnitte mit Augenlid-Retraktoren (oder einer geeigneten Ausrüstung) zurück.
- Verbrauchen Sie eine Portion Eimasse, ohne Blutgefäße zu ligieren.
- Für eine vollständige Ovariektomie, kauterisieren umgebende Blutgefäße durch Elektrokauterie oder Laserdiode (Abbildung 11).
- Schließen Sie mit Monofilament-Nähten den Celiotomie-Schnitt mit einem unterbrochenen, immerwährenden Nahtmuster.
- Caudates
- Einmal A. mexicanum wurde betäuben, legen Sie es in der rechten seitlichen Recumbency, mit dem linken Becken Glied einfach gegen die Schwanzbasis platziert.
- Bereiten Sie das Operationsfeld aseptisch vor, indem Sie feuchte sterile Gaze mit verdünnter Povidon-Jod-Lösung (1:10) auf der Stelle für 10-15 s. Alternativ verwenden Sie sterile Gaze in 0,75% Chlorhexidin-Lösung getränkt und auf der chirurgischen Stelle für mindestens 10 min vor der Operation (Abbildung 12A)36,37 .
- Zeichnen Sie eine Linie zwischen der Schulter und den Hinterbeinen, um den Körper in drei gleiche Teile zu teilen (Abbildung 12B).
- Machen Sie die Einschnittstelle zwischen dem zweiten und dritten Teil.
- Greifen Sie den zugrunde liegenden Muskel und heben Sie sich von der koelomischen Viszera ab.
- Zwingen Sie kleine Hämostate sanft durch die koelomische Muskulatur und in die koelomische Höhle.
- Ziehen Sie die koelomischen Einschnitte mit Augenlid-Retraktoren (oder einem geeigneten Material) zurück (Abbildung 12C).
- Für eine vollständige Ovariektomie, kauterisieren umgebende Blutgefäße durch Elektrokauter oder Laserdiode (Abbildung 12D).
- Schließen Sie mit Monofilament-Nähten den Celiotomie-Schnitt mit einem unterbrochenen, immerwährenden Nahtmuster.
Ergebnisse
Morphometrie und Reproduktion
Die Visualisierung des weiblichen Fortpflanzungsstatus bei Amphibien variiert je nach Art. Die effektivste Methode ist Ultraschall; einige Arten können jedoch unterschiedliche Transparenzen ihrer Haut aufweisen (Abbildung 13A,B,C). Die visuelle Inspektion kann oft die Unterschiede zwischen einem gravid und nicht gravid Weibchen deutlich veranschaulichen, wenn die Haut halbtransluzent ist, wie in N. alabamensis und N. maculosus beobachtet (Abbildung 13A,B); oder transluzent, wie durch den Glasfrosch illustriert (Abbildung 13C). Die dunkel gefleckte Hautfärbung am Bauch von N. beyeri verbietet diese Beurteilung. In R. muscosaist die Haut nicht lichtdurchlässig, aber spürbare Unterschiede können zwischen Weibchen festgestellt werden, die gravid sind, verglichen mit denen, die vor kurzem oviposited haben, weil die Haut schlaff ist, und das Tier sieht dünner (gelbe Linie) im Vergleich zu einer weiblich, das gravid ist (blaue Linie) (Abbildung 13D). Mit Erfahrung kann sich der Handler mit dem Unterschied zwischen einem großen Weibchen und einem gravid vertraut machen, aber die Bestätigung des Gravid-Stadiums erfordert Ultraschall. Körpermassenindizes in Amphibien können mit einer Reihe von Formeln berechnet werden, aber ihre Anwendung als Prädiktor für die Reproduktion ist fraglich. Im Fall von R. muscosableibt die Korrelation zwischen Fultons Index, Gesundheit und Fortpflanzungsstatus unklar.
Fortpflanzungsverhalten und Ultraschall
Unsere Ergebnisse zeigen, wie man reproduktives Verhalten in R. muscosa für die Vorhersage der Oviposition charakterisiert (Abbildung 4). Mehrere Stadien von ein paar Stunden bis mehrere Wochen dauern gehören, umzuwerben, wo ein Männchen aktiv jagt ein Weibchen (Abbildung 4A), die männlichen Reittiere und fest auf dem Rücken des Weibchens, als Amplexus bezeichnet (Abbildung 4B). Einmal amplexed, kann das Paar in Amplexus für 1 - 5 Wochen bleiben und das Paar wird andere Verhaltensweisen zusätzlich zu Amplexus zeigen. Amplexus ist ein sehr aktives Verhalten, das das männliche Drücken des Weibchens in einer weichen Pump-Manier umfasst (Abbildung 4C); das Weibchen, das sich bewegt und beginnt, zeitweise Handstandverhalten anzuzeigen (Abbildung 4D,E); und näher an der Zeit der Eileiter, wird das Weibchen, in einem Hand-Stand, an Oberflächen lehnen, die sie Eier aufkleben kann, während das Männchen ihren Bauch kräftig pumpt (in diesem Fall ist es auch möglich, das Weibchen zu beobachten, wie sie ihren Bauch von unten nach unten reiben. Ihr Arm rast in Richtung der Kloake. Dies kann ein mechanischer Weg sein, mit dem Eier die Eileiter nach unten drücken) (Abbildung 4F,G).
Diese Studie zeigt, wie Ultraschall Informationen liefern kann, mit denen der Fortpflanzungsstatus bei weiblichen R. Muscosa und Necturus festgestellt werden kann. Vier Entwicklungsstufen sind in R. muscosa (Abbildung 5C, D,E,F) dargestellt und in Necturus4 (Abbildung6A,B,C ) ähnlich charakterisiert. Darüber hinaus können Resteier nicht ausgewiesen werden, was zur Eibindung führt (Abbildung 5G, Abbildung 15A,B). Stufe 1 zeigt einen Eierstock direkt nach der Eileiter, wo Follikel schwer zu visualisieren sind (Abbildung 5C). Stufe 2 wird durch das Auftreten von echogenen Punkten (weiße Flecken) dargestellt, die über den Eierstock verteilt sind (Abbildung 5D). Stufe 2 und 3 werden durch größere, abgerundete echogene Punkte mit dunklen Zentren dargestellt, die gejochte mittlere bis große Follikel darstellen (Abbildung 5E,F). Von 2013 bis 2017 wurden die gefangenen Weibchen Necturus monatlich mit Ultraschall untersucht. Während jeder Prüfung wurde den Personen eine Notennote nach den für die Gattung festgelegten Reproduktionskriterien zugewiesen (Tabelle 2). Der Anteil der Weibchen, die jedes Jahr neue Eier entwickeln, betrug durchschnittlich 88,2 bis 3,01 % (Tabelle5). Während die Eientwicklung hoch war, war die Oviposition nicht gewährleistet (Abbildung16). Die Mehrheit der Weibchen, die Oviposition unterzogen ablagerungen die volle Ergänzung der Eier, während einige Personen nur einen Bruchteil der Eier, die entwickelt. Die R. muscosa und Necturus Weibchen mit zurückgehaltenen Eiern gleichzeitig mit Flüssigkeitsgewinn in der Körperhöhle wurden nach außen optisch mit roten Flecken auf der Haut entsprechend geplatzten Blutgefäßen vergrößert (Abbildung14A,B ) . Der Grad der Flüssigkeitsretention konnte weiter mittels Ultraschall beurteilt werden (Abbildung 15B). Bei beiden Arten wurden zurückgehaltene Eier atresien oder erhielten ein echogenes aussehendes Aussehen (Abbildung14C, D, Abbildung 15A).
Hormon-Administration
Je nach Tiefe der Injektionsart variieren Winkel und Tiefe der Nadel. Für die meisten Injektionen muss die Tiefe der Nadel bei der Arbeit mit Arten wie R. muscosa nicht mehr als 1 -2 mm tief sein, sondern variiert im Eindringwinkel. Prostaglandin-Injektionen erforderten eine intramuskuläre (im) Nadeleinfügung um 90°, in das Hinterbein von R. muscosa, während intraperitoneale (ip) Injektionen mit einer ähnlichen Tiefe wie intramuskuläre Injektionen im Bereich der koelomische Kavität bei 45° (Abbildung 10). Die Verabreichung von Amphiplex hatte keine signifikante Auswirkung auf die Erhöhung der Anzahl der von hormonbehandelten Weibchen abgelagerten Eier im Vergleich zu Kontrollen (P = 0,547), noch gab es Unterschiede in der Anzahl der Embryonen, die spalteten (P = 0,673) oder überlebten kauern (P = 0.629) (Tabelle 4). Im Allgemeinen ging der Anteil der weiblichen Ovipositing von 80 % im Jahr 2011 auf 28 % im Jahr 2014 zurück. Die Zahl der weiblichen Ovipositing im Jahr 2015 war deutlich höher als 2013 (P = 0,0002), 2013 (P = 0,0001) und 2014 (P = 0,0026), aber nicht 2011 (P = 0,0885), was die Idee bestätigt, dass Weibchen dieser Art nicht jährlich brüten dürfen und dass hormonelle Protokolle refi nement. Bei R. Muscosa-Weibchen mit Anzeichen einer Eiretention hatten intramuskuläre Injektionen von PGF2 eine Erfolgsrate von 60 % bei der Induktion der Vertreibung von degenerierenden Eiern. Bei einem der 5 injizierten Weibchen reichte PGF2 jedoch nicht aus, um eine vollständige Ausweisung zu verursachen, und einige Eier blieben bis zur folgenden Brutzeit im Weibchen. Siebzehn Necturus-Weibchen erhielten LHRH/(GnRH) und 13 erhielten eine Scheininjektion von sterilem Wasser, um als Kontrolle dienen zu können (Tabelle 5). Insgesamt wurden sieben weibliche Necturus (n = 4 Alabamensis, n = 2 beyeri, n = 1 maculosus) elf volle Kupplungen, die sowohl gnRH behandelten (n = 6) als auch Kontrollpersonen (n = 5) zugeschrieben wurden, oviposit. Drei Weibchen (n = 2 beyeri, n = 1 maculosus) oviposited fünf Teilkupplungen (Abbildung 13). Dieses Phänomen schien nicht mit einer exogenen Hormonbehandlung in Verbindung gebracht zu werden, da drei Kontrollweibchen in ähnlicher Weise Teilkupplungen ablagerten (Tabelle 5). Die Oviposition erfolgte über einen Zeitraum von 37 Tagen (3/31-5/7) über einen Zeitraum von fünf Jahren (Tabelle5). Es gab keinen Unterschied (P = 0,194) bei den Ovipositionsraten zwischen den behandelten LHRH/GnRH (41 x 13,08 %, Bereich 17-67%) und Steuerung (66,75 bis 11,79 %, Bereich 50-100%) Frauen. LHRH/GnRH behandelte Weibchen legten Eier durchschnittlich 7,44 bis 1,41 (Bereich 3-13) Tage nach der Injektion ab. Angesichts der vollständig aquatischen Natur der Art und der Unfähigkeit, sich manuell ohne Anästhesie zurückzuhalten, war es notwendig, vor der Durchführung von IP-Hormoninjektionen ein angemessenes Sedierungsniveau zu gewährleisten (siehe Abschnitt 3.2 für Anweisungen zur Anästhesie).
Blutentnahme, Anästhesie und Chirurgie
Die Blutentnahmetechnik in diesem Artikel wurde von Forzan et al. 201310 genommen und hat sich als eine effektive Möglichkeit erwiesen, Blut von R. muscosa mit minimaler Invasivität und Stress zu sammeln. Mit Mikrohämatokrit-Röhrchen können ca. 35-45 l Plasma oder Serum pro 70 l Vollblut gesammelt werden (Abbildung 7). Das maximale Sammelvolumen in R. muscosa betrug 1 vollständiges Mikrohematokritrohr pro 10 g Frosch, bis zu 4 Tuben pro Frosch für Frösche 40 g und größer. Dies war ein konservatives Sammelvolumen von 0,7 ml pro 100 g, 70% der maximalen Empfehlung von 1,0 ml pro 100 g (angepasst von Allender und Fry, 2008)13.
Anästhesie und Chirurgie bei Amphibien werden selten berichtet, aber es ist wichtig zu beachten, dass Dosen und Wirksamkeit in einer artspezifischen Weise variieren. In Bombina orientalis zum Beispiel hat MS222 eine sehr geringe Wirkung, auch bei hohen Dosen (1 g/L), während bei Boreal-Kröten Anaxyrus boreasboreas, 1 g/L schnell (Materie von Minuten) und langlebig (3+ h) (Calatayud, persönliche Beobachtung). In R. muscosa, Anästhesie erfordert Dosen für A. boreas boreas gemeldet und hat ähnliche Wirkung und Erholungszeiten. Fasten von Amphibien vor der Anästhesie ist in der Regel nicht erforderlich, da ihr Kehlkopf auch unter Vollnarkose fest verschlossen bleibt. Wenn dies jedoch für notwendig erachtet wird, insbesondere wenn das Anästhesieverfahren eine celomische Operation umfassen soll, können die Tiere 24 h vor der Anästhesie gefastet werden.
Während der Operation ist der Rechtereflex der primäre Indikator dafür, dass das Tier beästhetisiert wurde. Der Rechtereflex ist die Fähigkeit und der Grad der Leichtigkeit, mit der ein Tier in eine aufrechte Position zurückkehren kann, nachdem es auf dem Rücken platziert wurde. Der Verlust des Reflexes deutet auf ein leichtes Stadium der Anästhesie hin. Eine chirurgische Ebene wird durch verlustbaren Entzugsreflex angezeigt, der ein leichtes Ziehen an der Gliedmaße beinhaltet, um es zu begradigen, und das Tier kann es nicht mehr einziehen7. Die Fortpflanzungschirurgie hat keine überwältigenden Hindernisse und Amphibienpatienten heilen überwiegend gut tolerierenden Blutverlust mehr als höhere Wirbeltiere. Die Operation sollte schnell und etwa 15 Minuten von Anfang bis Ende dauern. Die Schritte sollten ungefähr wie folgt getimt werden: <1 Minute für den anfänglichen Schnitt und <2 Minuten für Celiotomie und Retraktoreinfügung, < 2-3 Minuten für die Isolierung pro Eierstock und <1 Minute für Gefäßnaht oder Kauterisierung und Hautnaht < 4 Minuten. Die gesamte Erholungszeit nach der Operation mit MS222-Protokollen beträgt ca. 45 Minuten, kann aber artspezifisch sein. In A. boreas boreas und R. muscosa können die Erholungszeiten länger sein, bis zu 1 – 2 h. Bei der Durchführung der Operation ist darauf zu achten, dass die Lunge, der Magen-Darm-Trakt oder eine verdorrende Blase nicht durchkreuzt werden und nicht die makrokopischen Drüsen, Lymphherzen und Blutgefäße, insbesondere die mittelventrale Vene, beschädigen. Je nach Jahreszeit kann das Vorhandensein großer Fettkörper die Visualisierung anderer Organe erschweren. Einmal sichtbar wach, werden die Reaktionen eines Tieres auf die Gliedmaßenstimulation, wie z. B. Widerstand gegen eine sanfte Dehnung einer Hinterbein oder blinkend, wenn der Bereich um das Auge stimuliert wird (persönliche Beobachtung), als Entzugsreaktionen klassifiziert. Der Richtigereflex zusammen mit anderen Erholungsindikatoren, einschließlich, die Rückzugsreflexe und gular Bewegungen, sind wichtige Indikatoren für die Erholung.
| verwaltung | ||||||||||
| Allgemeiner Name | Spezies | hormon | verfahren | Grundiermasse | Priming-Dosis gemeldet | Anzahl der Grundierungsdosen | Timing (Hhr vor der eikutorischen Dosis) | Verbindung(en) zur endgültigen Ovulatorium/Oviposition verabreicht | Dosen | verweis |
| Puerto Rican Crested Kröte | Peltophryne-Lemur | GnRH & hCG | Ip | Hcg | 1.5 I.E./g | 2 | hCG - 48 | GnRH; hCG; GnRHa + hCG | 0,2 g; 4 I.E.; 0,5 g + 4 I.E. | Calatayud et al. unveröffentlicht |
| Berggelbbeinfrosch | Rana muscosa | Amphiplex | Ip | GnRHa (des-Gly10, D- Ala6, Pro-NHEt9-GnRH) | 0,4 g/g | 1 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | Calatayud et al., 2018 |
| PGF2 | IM | PGF2 | 5 ng/g | 1 | 48 | PGF2 | 5 ng/g | |||
| Südliche Rocky Mountain boreal Kröte | Anaxyrus boreas boreas | hCG, GnRH | Ip | Hcg | 3.7 I.E./g | 2 | 96, 24 | hCG + GnRHa | 13,5 I.E./g + 0,4 g/g | Calatayud et al., 2015 |
| Nördlicher Cricketfrosch | Acris crepitan | Amphiplex | Wasser (10 ml) | nichts | nichts | 0 | Na | GnRH + MET | 0,17 g + 0,42 sg / l | Snyder et al., 2012 |
| Nördlicher Leopardenfrosch | Lithobates pipiens | Amphiplex | Ip | nichts | nichts | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | Trudeau et al., 2010 |
| Argentinischer Hornfrosch | Ceratophyrs ornata | Amphiplex | Ip | nichts | nichts | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | |
| Cranwells gehörnter Frosch | Ceratophrys cranwelli | Amphiplex | Ip | nichts | nichts | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | |
| Amerikanischer Bodenfrosch | Odontophrynus americanus | Amphiplex | Ip | nichts | nichts | 0 | 24 | GnRH + MET | 1 x 0,4 g/g + 10 g/g | |
| Dusky Gopher Frosch | Rana sevosa | hCG, GnRH | Ip | Hcg | 3.7 I.E./g | 2 | 96 , 24 | GnRH + hCG | 1 x 0,4 g/g + 13,5 I.E./g | Graham et al., 2018 |
| Gemeinsame Coqui | Eleutherodactylus coqui | Fische, Vogelarten, Säugetiere & GnRH (D-Ala, des-Gly, eth LHRH), hCG | Sc | mLHRH; aLHR; fLHRH; GnrHa; Hcg | nichts | 0 | Na | mLHRH; aLHR; fLHRH; GnrHa; Hcg | 7 g, 33 g; 28 g; 7 g, 20 g; 5, 10, 15, 20 g; 165 I | Michael et al 2004 |
| Gunthers Kröte | Pseudophryne guentheri | GnRH | Gnrha | 0,4 g/g | 1 | 26 | GnRHa mit oder ohne Primzahl | 0,4 g/g | Silla 2010 | |
| Corroboree Frosch | Pseudophryne corroboree | Lucrin | Sc | Lucrin | 1 g | 1 | 26 | Lucrin | 5 g | Byrne & Silla, 2010 |
| Nördlicher Corroboree-Frosch | Pseudophryne pengilleyi | GnRHa GnRH (D-Ala, des-Gly, eth LHRH) | danke | nichts | nichts | 0 | Na | Gnrha | 0,5 -2,0 g/g | Silla et al., 2017 |
| Gulf Coast Waterdog | Necturus beyeri | [des-Gly10, D- Ala6]-LhRH-RH Ethylamidacetat Salzhydrat | Ip | nichts | nichts | 0 | Na | LHRH | 100 g / 500 l | Stoops et al., 2014 |
| Südlicher Glockenfrosch / knurrender Grasfrosch | Litoria raniformis | des-Gly10, D- Ala6-[LHRH] | Sc | nichts | nichts | 0 | Na | des-Gly10, D- Ala6-[LHRH] | 50 g | Mann et al., 2010 |
| Fowler-Kröte | Anaxyrus fowleri | GnRH, hCG, P4 | Ip | Hcg | 3.7 I.E./g | Browne et al., 2006 | ||||
| Axolotl (Mexikanischesalamander) | Ambystoma mexicanum | Follikel-stimulierende Hormone | IM | nichts | nichts | 0 | Na | Fsh | 400IU | Trottier und Armstrong, 1974 |
| Afrikanischer Krallenfrosch | Xenopus laevis | hCG & P4 | zugesetztes Wasser; Ip | PMSG, hCG | Marcec , 2016 | |||||
| Tigersalamander | Ambystoma tigrinum | hCG, LH | ||||||||
| Wyoming Kröte | Anaxyrus baxteri | hCG, GnRHa, P4 | Ip | hCG + GnRHa | 100 I.E. + 0,8 g | 1 | 72 | hCG + GnRHa | 100 I.E. + 0,8 g | Browne et al., 2006 |
| Nördlicher Leopardenfrosch | Lithobates pipiens | Pituitary-Extrakt (PE), P4, Testosteron (T), Corticosteron [C], Amphiplex, Domperidon (D) | SC, IP | nichts | nichts | 0 | Na | PE, PE+T, PE+P4, PE+C; Amphiplex, GnRH + D | 100 I.E. (LHRH) in 1 ml; PE+0,002 g/l; PE+0,01mg/50ml; PE+0,1mg/50 ml; 0,4 g/g + 10 g/g; 0,4 g/g + D | Wright, 1961; Fort, 2000; Trudeau et al., 2013 |
| Gemahlener Frosch | Lymnodynastes tasmeniensis | Hypophysenextrakte, hCG, GnRHa, PZ | Ip | Gnrha | 0,9-1,2 g/g + PZ 10 g/g | 1 | 20 | PE; PE + hCG; GnRH + PZ | PE vol; PE vol + 100 I.E. hCG; GnRH (0,9-1,2 g/g) + PZ (10 g/g) | Clulow et al., 2018 |
| Grüner und Goldener Glockenfrosch | Litoia aurea | GnRH | Ip | Gnrha | 10 g | 1 | 72 | GnRHa + hCG | 20 g + 300 I.E. | Clulow et al., 2018 |
| Great Barred Frosch | Mixophyes fasciolatus | hCG & PMSG | Sc | PMSG, hCG | 50 I.E. & 25 I.E.; 1x100 I.E. | 2; 2 | PMSG-144 & 96; hCG-24 | Hcg | 100IU | Clulow et al., 2012 |
| Weitere Hormonprotokolle und Arten finden Sie unter Wright und Whitaker, 2001 | ||||||||||
Tabelle 1: Amphibienarten und einige der auf ihnen getesteten exogenen Hormone, wie in der Literatur berichtet. Humanes Choriongonadotropin (hCG); Gonadotropin-Releasing-Hormon (GnRH); Lutenizing Hormon-releasing Hormon (LHRH); die Buchstaben m, a und f "Säugetier", "Vogel" und "Fisch" darstellen; schwangere Stute Serum Gonadotropin (PMSG); Progesteron (P4); Follikel-stimulierendes Hormon FSH); Hypophysenextrakt (PE); Testosteron (T); Corticosteron (C). Dopamin-Antagonisten aufgeführt sind: Domperidon (D); Pimozid (P); Metoclopramid (MET). Amphiplex ist der Name einer Verbindung, die aus GnRH und Metoclopramid27 besteht. Lucrin ist ein kommerziell erhältlicher GnRH-Agonist mit dem Wirkstoff Leuprorelinacetat. 4 , 7 , 17 , 18 , 19 , 20 , 26 , 27 , 38 , 39 , 40 , 41 , 42 , 43 , 44 , 45
| grad | Reproduktionsstatus | beschreibung |
| 0 | Nicht gravid | Keine Eier sichtbar. |
| 1 | Frühe Gravid | Eier sichtbar (1-2mm in der Größe) keine deutliche echogene Linie mit Ei verbunden. |
| 2 | Mid gravid | Eier 2-3mm in der Größe, verschiedene echogene Linie(n) mit jedem Ei verbunden. |
| 3 | Späte Gravitation | Eier 4-5mm groß, echogene Linien noch sichtbar, deutliche Zunahme des anechoischen Aussehens des Eis. |
| 4 | Zurückgehaltene Eier | Unterschiedliche Grade von echogenem Material in der inneren Eistruktur vorhanden, nehmen amorphe Form an. Einige können sehr echogen werden und mit Flüssigkeitsretention in der Körperhöhle verbunden. |
Tabelle 2: Benotungssystem zur Bewertung des Fortpflanzungszustands von Rana muscosa durch Ultraschall.
| medikament | Dosierung und Route | Kommentare - Referenz |
| Buprenorphin | 50 mg/Kg (intracelomisch) | Experimentelle Studie in einem östlichen rotfleckigen Newt (Notophthalmus viridescens). Analgesie sollte vor der Operation gegeben werden. (Koeller, 2009) |
| Butorphanol | 1 – 10 mg/Kg (IM oder intracelomisch) | Es gibt verschiedene spezifische Verantwortliche. Es wird empfohlen, bei 1 mg/kg zu beginnen. |
| Butorphanol | 0,5 mg/L (Bad) | Experimentelle Studie in einem östlichen rotfleckigen Newt (Notophthalmus viridescens). (Koeller, 2009) |
| Fentanyl | 1 mg/kg | Analgesia > 4 h, antagonisiert von Naltrexon (Stevens, 1997) |
| Meloxicam | 0,1 bis 0,2 mg/kg (IM) | (Minter, 2011) |
Tabelle 3: Protokolle für Analgesie bei Amphibien.
| Rana muscosa | ||
| jahr | 2014 | 2015 |
| Nr. ♀ | 18 | 18 |
| Eierentwicklung | 61% | 94% |
| Kontrolle ♀ | 4 | 6 |
| Amphiplex ♀ | 4 | 7 |
| Durchschnittlicher Tag nach Amphiplex zu oviposit | 10,5 | 10,9 |
| Ovipositionsrate (Amphiplex) | 22,20% | 33,33% |
| Ovipositionsrate (Steuerung) | 22,20% | 38,88% |
Tabelle 4: Vergleich der Reproduktionsparameter zwischen amphiplex behandelten Rana muscosa 2014 und 2015.
| Necturus sp. | |||||
| jahr | 1 | 2 | 3 | 4 | 5 |
| Nr. ♀ | 6* | 7 | 7* | 7* | 7* |
| Eierentwicklung | 83% | 100% | 86% | 86% | 86% |
| LHRH ♀ | 3 | 5 | 3 | 6 | 0 |
| Kontrolle ♀ | 2 | 2 | 3 | 0 | 6 |
| Tag nach dem LHRH nach Oviposit | 5 | 7 | 5.5 (Bereich 3 - 8) | 13 | k.A. |
| Ovipositionsrate (LHRH) | 60% | 20% | 67% | 17% | k.A. |
| Ovipositionsrate (Steuerung) | 50% | 50% | 100% | k.A. | 67% |
| * n=1 ♀ keine Eientwicklung | |||||
Tabelle 5: Vergleich der Reproduktionsparameter zwischen LHRH (GnRH) -behandelt und kontrolliert (steriles Wasser) gefangenes Weibchen Necturus von drei Arten über einen Zeitraum von 5 Jahren (2012-2017).

Abbildung 1: Drei Methoden zum Halten eines Frosches. (A) Verfahren 1. (B) Verfahren 2. (C) Verfahren 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Morphometrische Bewertungen. (A, B) SVL/SUL (C, D). in R. muscosa und D. Necturus. (E). Größenmessung mit Bremssätteln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
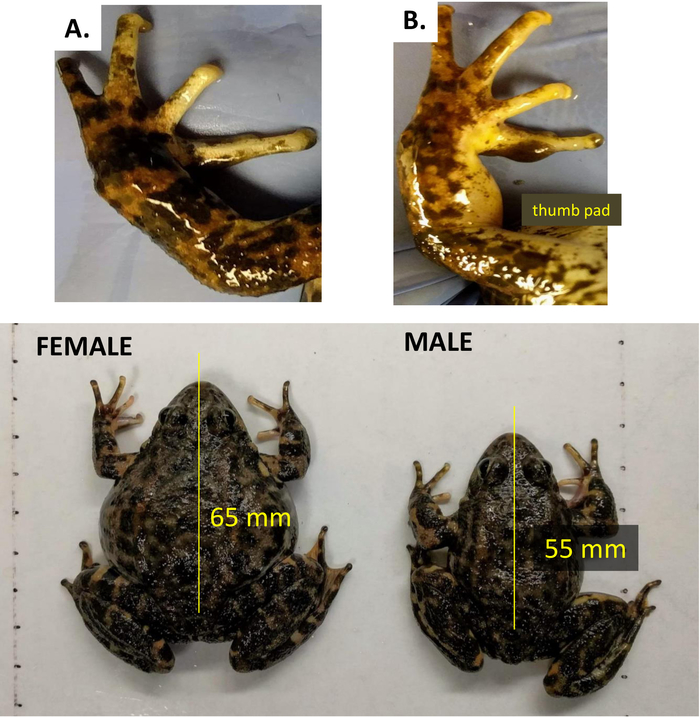
Abbildung 3: Sexueller Dimorphismus zeichnet sich durch nuptiale Daumenpolster bei erwachsenen R. Muscosa-Männchen im Vergleich zu Frauen aus. (A) Weiblich (B) Männlich. Das untere Panel zeigt die Länge von männlich gegen weiblich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Charakterisierung des Fortpflanzungsverhaltens, das zu einer Oviposition in R. muscosa führt (A) Umwerben. (B) Amplexus. (C) Männliche quetschende Hündin, während in Amplexus. (D, E) Amplexierte Hündin in einem Handstand. (F, G) Bauchkontraktionen und Eileiter. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
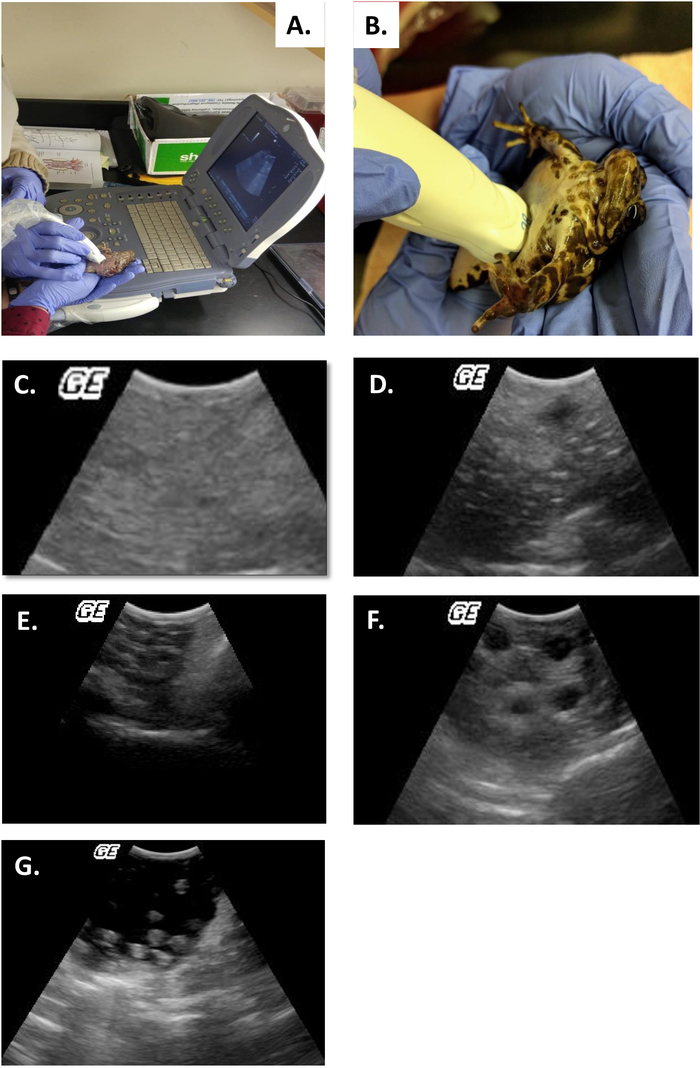
Abbildung 5: Ultraschall an R. muscosa A-B mit Fortpflanzungsstatus nach Entwicklungsstadium4durchgeführt. (A, B) Ultraschall auf Rana muscosa. (C) Besoldungsgruppe 0. (D) Besoldungsgruppe 1. (E) Besoldungsgruppe 2. (F) Grad 3. (G) Grad 4 (eigepfte und zurückgehaltene Eier) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Ultraschallbilder von Necturus. (A) Besoldungsgruppe 1. (B) Besoldungsgruppe 2. (C) Eier der Klasse 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Blutentnahme in R. muscosa. (A) Blutentnahme durch Punktieren der Vena orbitalis hinter der Gesichtsvene knapp über der Kieferlinie in der Mitte der Umlaufbahn. (B, C) Blut wird auf die Hautoberfläche freigesetzt und mit einem heparinisierten Kapillarrohr gesammelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Injektionsmethoden bei Amphibien. Je nach Tiefe der Injektionsart variieren Winkel und Tiefe der Nadel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9: Hormonelle Injektion in R. muscosa. Induktion der Oviposition durch hormonelle Behandlung bei Rana Muscosa-Weibchen mit Amphiplex intraperitoneal injiziert. Eierstöcke finden Sie in der koelomischen Höhle Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Vorbereitung vor der Operation. (A) Aseptische Vorbereitung des Operationsbereichs mit verdünnter Povidon-Jod-Lösung (1/10), Trachycephalus resinifictrix. (B) Sauberer Skalpellschnitt in einem Xenopus laevis oder ,( C) Laserdiodenhautschnitt, Lithobates catesbeianus. (D) Vermeiden Sie eine Beschädigung der mittelventralen Vene Trachycephalus resinifictrix. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 11: Ovariektomie in Xenopus laevis. (A) Große Fettkörper aussetzen und bewegen, um die Eimasse aufzudecken. (B) Verbrauchen Sie einen Teil der Eimasse, ohne Blutgefäße zu ligieren. (C) Kauterisieren umgebender Blutgefäße durch Elektrokauterie für vollständige Ovariektomie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 12: Präoperative Präparation und Ovariektomie in A. mexicanum. (A) Sterile Gaze eingeweicht, 0,75% Chlorhexidin-Lösung auf die chirurgische Stelle aufgetragen (B). Eine Linie zwischen schulter- und hinterden Gliedmaßen teilt das Tier in drei gleiche Teile und der blaue Fleck markiert die Stelle beim Einschnitt. (C) Ziehen Sie die koelomischen Einschnitte mit Augenlid-Retraktoren zurück. (D) Für eine vollständige Eialisierung die umgebenden Blutgefäße durch Elektrokauterie kauterisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 13: Visuelle Bewertung der Fortpflanzungsstadien. (A, B) Visuelle Beurteilungen des Fortpflanzungsstadiums durch halbtransluzente Haut, Necturus. (C) Transluzente Haut, Hyalinobatrachium (Glasfrosch). (D) Visuelle Bewertung von R. muscosa vor (rechts, blaue Linie) und nach der Oviposition (linke - gelbe Linie). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
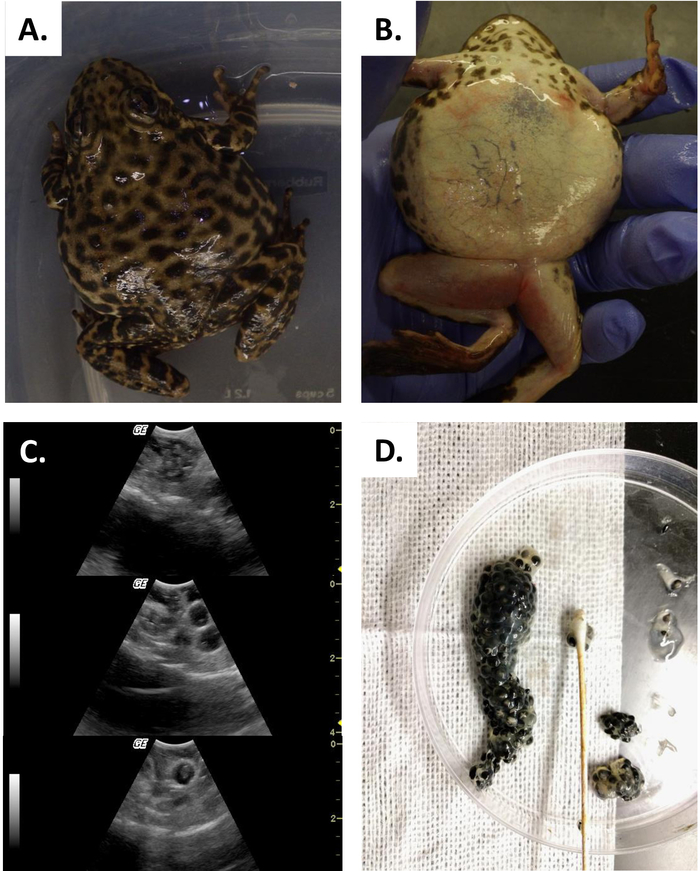
Abbildung 14: Eibindung. (A, B) Weibliche Rana Muscosa mit schwerem Fall der Eiretention. (C) Ultraschall zeigt alte degenerierende, Eier (oben) und größere Eier (Mittel- und Bodenplatte), die im Coelom eialiert und gefangen sind. (D) Zurückgehaltene Eier, die durch manuelles Abisolieren abgerufen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
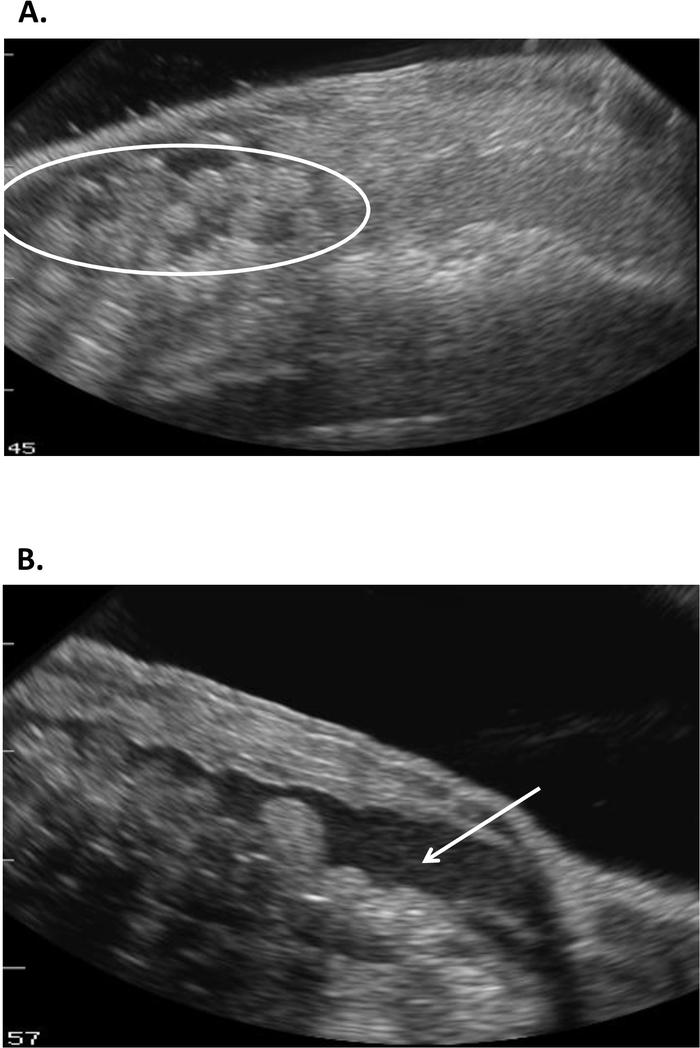
Abbildung 15: Ultraschallbilder von zurückgehaltenen Eiern in Necturus, die (A) im Aussehen (Kreis) echogen wurden und mit (B) Flüssigkeitsretention in der Körperhöhle (Pfeil) assoziiert waren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
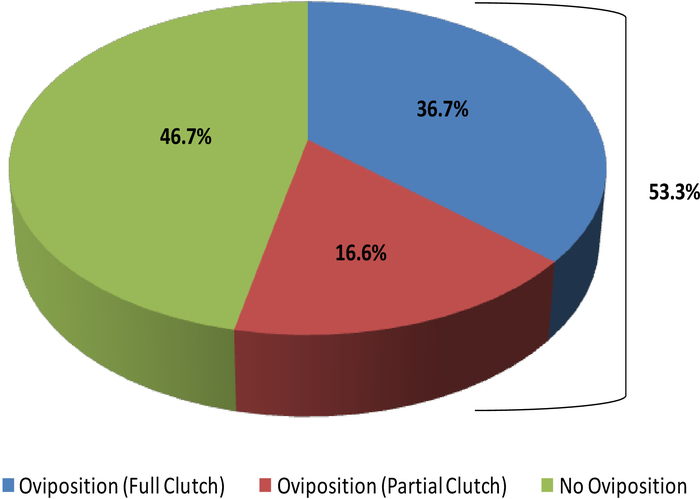
Abbildung 16: Prozentsatz der in Gefangenschaft gehaltenen weiblichen Necturus, die vollständige oder teilweise Kupplungen (2013-2017) im Vergleich zu denen, die nicht oviposit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Direkte Handhabung, visuelle Beobachtung und morphometrische Maßnahmen bieten nicht-invasive Techniken und sind die ersten Bewertungskriterien zur Bestimmung des weiblichen Fortpflanzungsstadiums. Diese Studie zeigt jedoch, dass gravid Eierstöcke nicht immer zuverlässig durch Palpation identifiziert werden können. Je nach Art können Gravid-Eierstöcke manchmal visuell durch halbtransluzente (Abbildung 13A, B) oder vollständig transluzente Haut auf der ventralen Seite des Tieres ( Abbildung 13C ) erkannt werden ( Abbildung13C). Weibchen, die oviposition abgeschlossen haben, können offensichtliche Veränderungen ihres Aussehens im Vergleich zu gravid Weibchen zeigen (z. B. lose Haut und Verlust von bis zu 30% ihrer Körpermasse, Abbildung 13D). Während der Zucht zeigen Männchen und Weibchen bestimmte Verhaltensweisen, die Informationen über die Nähe zum Eisprung und die Eisprungposition liefern. Im Fall von R. muscosa Hinweise darauf, dass ein Weibchen in der Nähe von Eileiter n. Chr. beginnt mit dem Weiblichen in Handhaltung.
Die Anwendung der Ultraschalltechnologie auf Anurans und Caudates ermöglicht die Diagnose des Vorhandenseins oder Fehlens von Eiern und ob die Oviposition mit einer vollständigen oder teilweisen Freisetzung von entwickelten Eiern verbunden war. Somit bietet diese Methode eine vollständigere und genauere Bewertung des Fortpflanzungsstatus, ohne sich auf die Bestimmung des Gravid/Nicht-Gravid-Status durch eine Visualisierungstechnik zu beschränken, die durch die Transparenz der Bauchhaut oder die epidermale Konsistenz unter den die verschiedenen Amphibienarten. Ultraschall kann mit relativer Leichtigkeit und mit wenig Stress für die Tiere durchgeführt werden (Abbildung 5 und Abbildung 13) und kann verwendet werden, um Fortpflanzungszyklen zu charakterisieren und den Fortpflanzungsstatus 4 zu bestimmen. Es ist wichtig, sich mit der Art vertraut zu machen; Diese Studie zeigte jedoch, dass Necturus und R. muscosa gemeinsame Entwicklungssymptome in ihren Fortpflanzungsmustern aufweisen, was eine ähnliche Klassifizierung des Fortpflanzungsstadiums ermöglicht (Abbildung 5). Durch diese Technologie gibt es nun Beweise dafür, dass die Eientwicklung in Den gefangenen Necturus und R. muscosa hoch ist und dass beide Arten einem saisonalen Muster folgen. Obwohl die Gründe für diese Phänomene unbekannt sind und weitere Untersuchungen erfordern, ohne den Einsatz von Ultraschall, wären mehrere Bereiche der Eierstockdysfunktion, wie Eiretention und partielle Eibildung, unentdeckt geblieben. Zukünftige Anwendungen dieser Technik werden verwendet, um zu bestimmen, ob Weibchen für die Zucht in einem bestimmten Jahr ausgewählt werden sollten und ob die Oviposition vollständig ist.
Ein Blutentnahmeprotokoll, wie es in R. muscosavorgestellt wird, das sowohl wirksam ist als auch dem Tier minimale Bedrängnis bereitet, ist optimal, um Hormonprofile bei gefangenen und wild gefangenen Anurans zu untersuchen (Calatayud, unveröffentlicht). Bis heute gibt es keine Informationen über die jährlichen Hormonprofile von R. muscosa in Gefangenschaft und daher keine Erkenntnisse darüber, wie Hormone ihre Gesundheit und Fortpflanzung beeinflussen. Darüber hinaus wird das Hormonprofiling eine weitere Methode zur Verfolgung von Eierstockzyklen sein, da es sich bei den Weibchen dieser Art möglicherweise nicht um jährliche Züchter handelt. Zusammen mit Ultraschall kann die Hormonanalyse zu einer besseren Vorhersage führen, was Frauen für die Eileiter bereit sein werden. Darüber hinaus wurden im vergangenen Jahr zwei Fälle von Intersexuellen in der gefangenen R. muscosa-Population dokumentiert. Darüber hinaus wurde die Entwicklung von Daumenpolstern auf einige der älteren Gründungsweibchen festgestellt. Gründe dafür werden derzeit untersucht, aber erste Ergebnisse deuten darauf hin, dass es sich auf Veränderungen des Testosteronspiegels beziehen kann (Calatayud, unveröffentlicht). Die Unterscheidung von hormonellen Zyklen bei Frauen unterschiedlichen Alters wird uns helfen zu verstehen, warum Frauen männlich-assoziierte sekundäre Geschlechtsmerkmale entwickeln können und ob dies in einer alternden Bevölkerung zu erwarten ist.
Exogene Hormontherapie wurde verwendet, um reproduktive Dysfunktionen häufig in gefangenen Amphibien auftreten zu überwinden. Sowohl bei r. muscosa als auch bei necturus wurden in dieser Studie jedoch über einen Zeitraum von 2 bzw. 5 Jahren keine signifikanten Unterschiede in der Eioposition zwischen hormonbehandelten und kontrollierbaren Frauen festgestellt. Dies kann darauf hindeuten, dass Hormon-Verwaltungsprotokoll, Dosen, Grundierung und Hormon-Kombination verwendet war nicht ausreichend für die Art. Eine genauere Analyse der einzelnen weiblichen Fortpflanzungsgeschichten legt nahe, dass R. muscosa möglicherweise keine jährliche Züchtung erfahren, was auch für den Mangel an hormonaler Wirkung bei behandelten Weibchen verantwortlich sein könnte. Da ein bestimmter Prozentsatz der Weibchen die Zucht jedes Jahr konsequent übersprungen hat, kann das Verständnis der Natürlichen Geschichte der Art helfen festzustellen, ob ein Bedarf an exogenen Hormonen besteht und wann sie am effektivsten sein können. Die in diesem Artikel beschriebenen Verfahren können auf eine Reihe von Arten angewendet werden (Tabelle 1) und sind für Anurans zwischen 5 g und 150 g; größere Tiere können unterschiedliche Spritzen und Nadelmessgeräte benötigen. Die Lage der Injektion variiert mit einigen Hormonen, die intramuskuläre, intraperitoneale, subkutane oder intradermale Injektion erfordern (Abbildung 7).
Chirurgie zum Zweck der Ovariektomie ist eine gängige Methode, die in verschiedenen Amphibienarten verwendet wird, um Eizellen für embryologische Studien zu erhalten. Ovariektomie kann auch für die Bevölkerungskontrolle und medizinische Fragen wie Eiretention angezeigt werden. Bei partiellen Eizellen, bei denen die Eizellenernte zu Forschungszwecken durchgeführt wird, muss die Operation sicherstellen, dass das Tier reproduktiv bleibt. Die Verabreichung von PGF2 hat einige Versprechen bei der Lösung der Eiretention bei der weiblichen R. muscosagezeigt. Bei mehreren Personen, PGF2- entlockte vollständige Ablagerung von zuvor zurückgehaltenen Eiern, aber in anderen nur teilweise Ablagerung aufgetreten erfordern manuelle, um alle Eier zu entfernen. Während PGF2' als Alternative zur Operation zur Eiretention in R. muscosadienen kann, erfordert seine Fähigkeit, ähnliche pathologische Erkrankungen bei anderen Amphibien zu beheben, eine artspezifische Validierung. Wenn ein chirurgischer Eingriff für den Anuran- oder Caudate-Patienten vorgeschrieben ist, ist es notwendig, eine angemessene Anästhesieebene sicherzustellen, bevor Schnitte vorgenommen werden. Für die Bewertung und Überwachung der normativen Induktions- und Rückforderungsreaktionen, wie in dieser Studie für jede Taxa beschrieben, sind kluge Beobachtungsfähigkeiten erforderlich. Sobald man mit der spezifischen Anatomie, einem geeigneten chirurgischen Ansatz, Hämostase, sanfter Gewebemanipulation und einem angemessenen postoperativen Management vertraut ist, stellen reproduktive Operationen keine überwältigenden Hindernisse dar.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Natalie Calatayud dankt Dr. Barbara Durrant für die Ausbildung und Unterstützung beim Ultraschall und bei Exploradora de Immuebles, S.A. (EISA) für die finanzielle Unterstützung meiner wissenschaftlichen Mitarbeiterstelle bei der SDZG. Vielen Dank an Dr. Kylie Cane für Kommentare zum Manuskript sowie an die offiziellen Rezensenten (wer auch immer sie sein mögen). Unser Dank gilt Jonathan Dain für die Bereitstellung von Fotos ( Abbildung1A, B). Monica Stoops würdigt den Association of Zoos and Aquariums Conservation Endowment Fund und den Disney Worldwide Conservation Fund für die finanzielle Unterstützung bei der Gründung der gefangenen Necturus-Population. Darüber hinaus wurde die Unterstützung auch durch private Spenden von Derahibienanwältin Iris de la Motte erhalten. Dank, wird Herrn Christopher DeChant und Dr. Mark Campbell für ihren bedeutenden Beitrag zur Forschung gegeben.
Materialien
| Name | Company | Catalog Number | Comments |
| GE logiq Book XP and 8C-RS probe 4e10 MHz GE Medical Systems | GE medical systems | GE logiq Book XP | Ultrasound |
| Aloka 500 7.5mHz linear or IBEX multi-frequency (10-6mHz) micro-convex | GE medical systems | 8C-RS (10 MHz) | Ultrasound probe |
| BD disposable U-100 insulin syringe (28-29 G needle) | Mettler Electronics Corp CA | Sonigel | Ultrasound gel (water soluble, salt-free) |
| Hormone | |||
| Gonadotropin releasing hormone | BACHEM | 4012028 | synonym: [Des-Gly10, D-Ala6, Pro-NHEt9]-GnRH acetate abbreviation: GnRH |
| Lutenizing hormone releasing hormone | BACHEM, Sigma-Aldrich | 4033013; L1898 | synonym: Pyr-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2 acetate salt; [D-Ala6}-LHRH acetate salt hydrate abbreviation: LHRH |
| Human chorionic gonadotropin | BACHEM, Sigma-Aldrich | 4030270, 4018894; C1063, CG5, CG10 | synonym: Chorionic gonadotropin-β (109-145)(109-119); Choriogonin, HCG (2,500IU, 5,000IU, 10,000IU) abbreviation: hCG |
| Prostaglandin 2α | Sigma-Aldrich | P40424; | synonym: (5Z,9α,11α,13E,15S)-9,11,15-Trihydroxyprosta-5,13-dienoic acid tris salt, PGF2α−Tris; abbreviation: PGF2α |
| Follicle-stimulating hormone | Sigma-Aldrich | F4021, F8174 | synonym: porcine, sheep abbreviation: FSH |
| Progesterone | Sigma-Aldrich | 46665; P7556 | synonym: Vetranal; P4 water soluble abbreviation: P4 |
| Pituitary extract | na | synonym: Check papers for amphibian species derivation abbreviation: PE | |
| Pregnant Mare Serum Gonadotropin | Prospec; Lee Biosolutions; Sigma-Aldrich | HOR-272; 493-10; 9002-70-4 | synonym: Pregnant Mare Serum Gonadotropin abbreviation: PMSG |
| Metaclopromide | Sigma-Aldrich | M0763 | synonym: 4-Amino-5-chloro-N-[2-(diethylamino)ethyl]-2-methoxybenzamide, Methoxychloroprocainamide abbreviation: MET |
| Lucrin | BACHEM; Sigma-Aldrich | 4033014; L0399 | synonym: Leuprorelin acetate abbreviation: Lucrin |
| Lutalyse | Pfizer | synonym: PGF2α - Dinoprost tromethamine abbreviation: Lut | |
| Pimozide | Sigma-Aldrich | P1793 | synonym: 1-[1-[4,4-bis(4-Fluorophenyl)butyl]-4-piperidinyl]-1,3-dihydro-2H-benzimidazol-2-one abbreviation: PZ |
| Amphiplex | see above | synonym: Gonadotropin releasing hormone + metoclopramide abbreviation: GnRH + MET | |
| Ovopel | Ovopel | na | synonym: GnRHa + dopamine receptor antagonist (administered 1 pellet/ kg) abbreviation: Ovo |
| Ovaprim | Pentair aquatic eco-systems | Ova10 | synonym: Salmon gonadotropin + domperidone abbreviation: Ova |
| Domperidone | Sigma-Aldrich | D122 | synonym: 4-(5-Chloro-2-oxo-1-benzimidazolinyl)-1-[3-(2-oxobenzimidazolinyl)propyl]piperidine abbreviation: DOM |
Referenzen
- Conde, D. A., Flesness, N., Colchero, F., Jones, O. R., Scheuerlein, A. An emerging role of zoos to conserve biodiversity. Science. 331 (6023), 1390-1391 (2011).
- Conde, D. A., et al. Zoos through the Lens of the IUCN Red List: A Global Metapopulation Approach to Support Conservation Breeding Programs. PLoS ONE. 8 (12), e80311(2013).
- Morrison, C., Hero, J. -M. Geographic variation in life-history characteristics of amphibians: a review. Journal of Animal Ecology. 72 (2), 270-279 (2003).
- Calatayud, N. E., Stoops, M., Durrant, B. S. Ovarian control and monitoring in amphibians. Theriogenology. , 70-81 (2018).
- National Research Council. Institutional Animal Care and Use Committee Guidebook. , (2010).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Graham, K. M., Langhorne, C. J., Vance, C. K., Willard, S. T., Kouba, A. J. Ultrasound imaging improves hormone therapy strategies for induction of ovulation and in vitro fertilization in the endangered dusky gopher frog (Lithobates sevosa). Conservation Physiology. 6 (1), coy020(2018).
- Wright, K. M., Whitaker, B. R. Amphibian Medicine and Captive Husbandry. , Krieger Publishing Company. (2001).
- Forzán, M. J., Vanderstichel, R. V., Ogbuah, C. T., Barta, J. R., Smith, T. G. Blood collection from the facial (maxillary)/musculo-cutaneous vein in true frogs (family Ranidae). Journal of Wildlife Diseases. 48 (1), 176-180 (2012).
- Allender, M. C., Fry, M. M. Amphibian hematology. Veterinary Clinics of North America: Exotic Animal Practice. 11 (3), 463-480 (2008).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). Journal of the American Association for Laboratory Animal Science. 46 (3), 64-67 (2007).
- Jorgensen, C. B. External and internal control of patterns of feeding, growth and gonadal function in a temperate zone anuran, the toad Bufo bufo. Journal of Zoology. 210 (2), 211-241 (1986).
- Jørgensen, C. B. Growth and reproduction. Environmental Physiology of the Amphibians. , 439-466 (1992).
- Vu, M., Trudeau, V. L. Neuroendocrine control of spawning in amphibians and its practical applications. General and Comparative Endocrinology. 234, 28-39 (2016).
- Clulow, J., Trudeau, V. L., Kouba, A. J. Amphibian declines in the twenty-first century: why we need assisted reproductive technologies. Reproductive Sciences in Animal Conservation. , 275-316 (2014).
- Kouba, A., et al. Assisted reproductive technologies (ART) for amphibians. Amphibian Husbandry Resource Guide. 2, 60-118 (2012).
- Clulow, J., et al. Optimisation of an oviposition protocol employing human chorionic and pregnant mare serum gonadotropins in the Barred Frog Mixophyes fasciolatus (Myobatrachidae). Reproductive Biology and Endocrinology. 10 (1), 60(2012).
- Browne, R. K., Seratt, J., Vance, C., Kouba, A. Hormonal priming, induction of ovulation and in-vitro fertilization of the endangered Wyoming toad (Bufo baxteri). Reproductive Biology and Endocrinology. 4 (1), 34(2006).
- Calatayud, N. E., et al. A hormone priming regimen and hibernation affect oviposition in the boreal toad (Anaxyrus boreas boreas). Theriogenology. 84 (4), 600-607 (2015).
- Stoops, M. A., Campbell, M. K., Dechant, C. J. Successful captive breeding of Necturus beyeri through manipulation of environmental cues and exogenous hormone administration: a model for endangered Necturus. Herpetological Review. 45 (2), 251-256 (2014).
- Mc Creery, B. R., Licht, P. Induced ovulation and changes in pituitary responsiveness to continuous infusion of gonadotropin-releasing hormone during the ovarian cycle in the bullfrog, Rana catesbeiana. Biology of Reproduction. 29 (4), 863-871 (1983).
- Johnson, C. J., Vance, C. K., Roth, T. L., Kouba, A. J. Oviposition and ultrasound monitoring of American toads (Bufo americanus) treated with exogenous hormones. Proceedings of the American Association of Zoo Veterinarians. 299, 301(2002).
- Herbert, D. Studies of assisted reproduction in the spotted grass frog Limnodynastes tasmaniensis: ovulation, early development and microinjection (ICSI). , (2004).
- Michael, S. F., Buckley, C., Toro, E., Estrada, A. R., Vincent, S. Induced ovulation and egg deposition in the direct developing anuran Eleutherodactylus coqui. Reproductive Biology and Endocrinology. 2, 6(2004).
- Ogawa, A., Dake, J., Iwashina, Y., Tokumoto, T. Induction of ovulation in Xenopus without hCG injection: the effect of adding steroids into the aquatic environment. Reproductive Biology and Endocrinology. 9 (1), 11(2011).
- Silla, A. J. Effects of luteinizing hormone-releasing hormone and arginine-vasotocin on the sperm-release response of Günther’s Toadlet, Pseudophryne guentheri. Reproductive Biology and Endocrinology. 8 (1), 139(2010).
- Trudeau, V. L., et al. Hormonal induction of spawning in 4 species of frogs by coinjection with a gonadotropin-releasing hormone agonist and a dopamine antagonist. Reproductive Biology and Endocrinology. 8 (1), 36(2010).
- Krause, E. T., von Engelhardt, N., Steinfartz, S., Trosien, R., Caspers, B. A. Ultrasonography as a minimally invasive method to assess pregnancy in the fire salamanders (Salamandra salamandra). Salamandra. 49, 211-214 (2013).
- Browne, R. K., Li, H., Seratt, J., Kouba, A. Progesterone improves the number and quality of hormone induced Fowler toad (Bufo fowleri) oocytes. Reproductive Biology and Endocrinology. 4 (1), 3(2006).
- Bramucci, M., et al. Different modulation of steroidogenesis and prostaglandin production in frog ovary in vitro by ACE and ANG II. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 273 (6), R2089-R2096 (1997).
- Gobbetti, A., Zerani, M. Possible roles for prostaglandins E2 and F2α in seasonal changes in ovarian steroidogenesis in the frog (Rana esculenta). Journal of Reproduction and Fertility. 98 (1), 27-32 (1993).
- Gobbetti, A., Zerani, M., Carnevali, O., Botte, V. Prostaglandin F2α in female water frog, Rana esculenta: Plasma levels during the annual cycle and effects of exogenous PGF2α on circulating sex hormones. General and Comparative Endocrinology. 80 (2), 175-180 (1990).
- Guillette, L. J. Jr, Dubois, D. H., Cree, A. Prostaglandins, oviducal function, and parturient behavior in nonmammalian vertebrates. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 260 (5), R854-R861 (1991).
- Clulow, J., Mahony, M., Browne, R., Pomering, M., Clark, A. Applications of assisted reproductive technologies (ART) to endangered anuran amphibians. Declines and Disappearances of Australian Frogs'. Campbell, A. , 219-225 (1999).
- Browne, R. K., Wolfram, K., García, G., Bagaturov, M. F., Pereboom, Z. Zoo-based amphibian research and conservation breeding programs. Amphibian and Reptile Conservation. 5 (3), 1-14 (2011).
- Chai, N. Surgery in amphibians. Veterinary Clinics: Exotic Animal Practice. 19 (1), 77-95 (2016).
- Gentz, E. J. Medicine and surgery of amphibians. Ilar Journal. 48 (3), 255-259 (2007).
- Snyder, W. E., Trudeau, V. L., Loskutoff, N. M. 168 a noninvasive, transdermal absorption approach for exogenous hormone induction of spawning in the northern cricket frog, Acris crepitans: a model for small, endangered amphibians. Reproduction, Fertility and Development. 25 (1), 232-233 (2012).
- Kouba, A. J., et al. Emerging trends for biobanking amphibian genetic resources: the hope, reality and challenges for the next decade. Biological Conservation. 164, 10-21 (2013).
- Michael, S. F., Buckley, C., Toro, E., Estrada, A. R., Vincent, S. Induced ovulation and egg deposition in the direct developing anuran Eleutherodactylus coqui. Reproductive Biology and Endocrinology. 2 (1), 6(2004).
- Fort, D. J. Frog reproduction and development study 2000 rana pipiens reproduction and development study. , Environmental Protection Agency. (2003).
- Clulow, J., et al. Differential success in obtaining gametes between male and female Australian temperate frogs by hormonal review: A Review. General and Comparative Endocrinology. 265, 141-148 (2018).
- Trottier, T. M., Armstrong, J. B. Diploid gynogenesis in the Mexican axolotl. Genetics. 83 (4), 783-792 (1976).
- Marcec, R. M. Development of assisted reproductive technologies for endangered North American salamanders. , Mississippi State University. (2016).
- Wright, M. L. Melatonin, diel rhythms, and metamorphosis in anuran amphibians. General and Comparative Endocrinology. 4, (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten