Method Article
Técnicas reprodutivas para monitoramento e controle ovariano em anfíbios
Neste Artigo
Resumo
O estudo da biologia dos anfíbios fornece informações valiosas sobre os processos reprodutivos, fisiológicos, embriológicos e de desenvolvimento que impulsionam os organismos de muitos grupos taxonômicos. Aqui, apresentamos um guia abrangente sobre diferentes metodologias que podem ser usadas para estudar o controle e o monitoramento ovariano em anfíbios.
Resumo
O controle e o monitoramento ovariano em anfíbios requerem uma abordagem multifacetada. Existem várias aplicações que podem induzir com sucesso comportamentos reprodutivos e a aquisição de gametas e embriões para pesquisa fisiológica ou molecular. Os anfíbios contribuem para um-12:45-terço da pesquisa de vertebrados, e de interesse neste contexto é a sua contribuição para o conhecimento da comunidade científica sobre os processos reprodutivos e o desenvolvimento embriológico. No entanto, a maior parte desse conhecimento é derivada de um pequeno número de espécies. Nos últimos tempos, a decimação de anfíbios em todo o mundo exigiu uma intervenção crescente por parte dos conservacionistas. As colônias de recuperação e garantia cativas que continuam emergindo em resposta ao risco de extinção tornam as pesquisas existentes e as aplicações clínicas inestimáveis para a sobrevivência e reprodução de anfíbios mantidos cuidados humanos. O sucesso de qualquer população em cativeiro baseia-se na sua saúde e reprodução e na capacidade de desenvolver descendentes viáveis que levam adiante a mais diversa representação genética de suas espécies. Para os pesquisadores e veterinários, a capacidade de monitorar e controlar o desenvolvimento ovariano e saúde é, portanto, imperativo. O foco deste artigo é destacar as diferentes técnicas reprodutivas assistidas que podem ser utilizadas para monitorar e, quando apropriado ou necessário, controlar a função ovariana em anfíbios. Idealmente, todas as questões reprodutivas e de saúde devem ser reduzidas através de uma adequada criação em cativeiro, mas, como com qualquer animal, questões de saúde e patologias reprodutivas são inevitáveis. Técnicas não invasivas incluem avaliações comportamentais, inspeção visual e palpação e medidas morfométricas para o cálculo de índices de condição corporal e ultrassonografia. Técnicas invasivas incluem injeções hormonais, amostragem de sangue e cirurgia. O controle ovariano pode ser exercido de várias maneiras, dependendo da aplicação exigida e das espécies de interesse.
Introdução
Os anfíbios têm sido reconhecidos por muito tempo como modelos biológicos e médicos importantes por uma escala larga de disciplinas da pesquisa. Os dados obtidos estudando espécies particulares como Xenopus laevis e X. tropicalis, o sapo leopardo (Lithobates (anteriormente Rana) pipiens) e o Axolotl (Ambystoma mexicanum) foram aplicados a uma série de outras espécies de vertebrados, incluindo os seres humanos. As técnicas veterinárias, de criação e de reprodução assistida que emergiram do estudo destes e de outros anfíbios prestam assistência aos encarregados do desenvolvimento de cuidados de sucesso, manutenção e sustentabilidade de populações mais raras em cativeiro 1. º , 2. º , 3. º , a 4.
O interesse está ganhando para o uso simultâneo de in e de abordagens de conservação ex situ-Based para reverter a maré de extinção para muitos em risco espécies de anfíbios1,2. Este artigo fornece as metodologias presentemente disponíveis para monitorar e controlar a função ovariana anfíbios em espécies modelo de anurans e de caudates. Adicionalmente, as técnicas existentes para endereçar uma patologia reprodutiva comum da retenção do ovo são apresentadas.
Como em muitos grupos taxonômicos, o controle ovariano de anfíbios envolve uma série de interações fortemente sincronizadas entre o meio ambiente e a fisiologia. A temperatura e o fotoperíodo (conhecidos como sinais proximos) são decodificados pelo olho e cérebro onde são rapidamente convertidos em processos genéticos, hormonais e circadianos (sinais finais)3,4. Os métodos para monitorar e controlar a função ovariana abordados neste artigo incluem técnicas invasivas e não invasivas. O Comitê institucional de cuidados e uso de animais (IACUC) os requisitos de pesquisa e ensino definem técnicas não invasivas como aquelas que causarão mínima ou nenhuma dor física ou sofrimento mental e não necessitará de medicamentos que aliviem a dor5. Aqui, técnicas não invasivas incluem inspeção visual e palpação, observações comportamentais, avaliações morfométricas e ultrassonografia. Pelo contrário, as técnicas de coleta de sangue, administração hormonal e cirurgia (ovariectomia e remoção de ovos retidos) são classificadas como invasivas, uma vez que podem resultar em alguma dor ou desconforto e necessitam de anestesia ou terapia medicamentosa pós-procedimento.
As técnicas ovarianas não invasoras da monitoração podem facilmente ser incorporadas na rotina diária do cuidado para a maioria de anfíbios prisioneiros. Dependendo da espécie, a gravidez ovariana pode frequentemente ser determinada pela inspeção visual simples (râ de vidro). Em outros casos, a palpação pode indicar se uma fêmea é gravid. Vários índices de condição corporal (BCI), tais como peso, comprimento do focinho urostyle (Sul), comprimento do focinho-Vent (svl) e índice de massa padrão (SMI) estão disponíveis para prever a presença ou ausência de ovos4,6,7, 8,9. No entanto, deve-se tomar cuidado com a interpretação dos resultados, pois a maioria não considera a idade, a forma do corpo ou a composição (por exemplo, água retida versus massa ovariana ou gordura)6. Os diagnósticos reprodutivos definitivos podem ser alcançados via ultrassonografia com conhecimento mais aprofundado adquirido em relação ao desenvolvimento de ovos e estadiamento do ciclo ovariano4,7. A ultrassonografia também fornece meios para confirmar e monitorar patologias reprodutivas e condições fisiológicas associadas,4,8.
Além de fornecer informações sobre o estado de saúde, a amostragem de sangue pode ser usada para medir os hormônios reprodutivos. Se o perfil hormonal é o objetivo final, é importante evitar influências relacionadas ao estresse que podem confundir dados de esteroides sistêmicos. Embora uma ferramenta de monitoramento potencialmente poderosa, ainda há um estudo demonstrando respostas endocrinológicas inatas à administração de hormônios EXÓGENOS em qualquer espécie de anfíbios. O sangue pode ser tomado com segurança de vários locais; em rãs isso inclui a veia abdominal ventral, plexo lingual, veia femoral e coração9,10. Em Caudates, o sangue é coletado da veia ventral da cauda. O grau de invasividade, a quantidade de contenção necessária, a necessidade de anestesia, a delicadeza do órgão alvo e o tamanho do animal são fatores a serem considerados na escolha de uma técnica de coleta para o paciente anfíbio. Este artigo apresentará a técnica de coleta de sangue da veia maxilar ou musculocutânea facial de rãs como originalmente descrita por Forzan et al.9.
O controle ovariano é específico da espécie e, como tal, os protocolos hormonais devem ser testados e otimizados. Além da sazonalidade e do Milieu hormonal circulante associado, o controle ovariano também pode estar intimamente ligado à idade, tempo gasto em cativeiro e exposição à administração hormonal repetida, para o qual há pouca informação na literatura11 , 12 anos de , 13. a implementação de terapias hormonais para provocar comportamentos reprodutivos, produção de gametas, maturação e oviposição tornou-se uma abordagem amplamente relatada para resolver problemas reprodutivos comuns associados ao cativeiro4, 8,14,15,16. Como os mecanismos que controlam a reprodução em vertebrados são altamente conservados, há uma série de hormônios, neuropeptídeos e medicamentos comercialmente disponíveis usados terapeuticamente em outros grupos taxonômicos que também podem ser usados de forma confiável em um número de espécies de anfíbios (tabela 1). Hormônio liberador de gonadotropina (GnRH) e gonadotropina coriónica humana (HCG) (ou variações do mesmo, ou seja, pMsg e ECG)17,18, individualmente ou em combinação, têm sido amplamente utilizados em cativeiro anfíbios programas de melhoramento, incluindo: o sul da montanha rochosa boreal (anaxyrus Boreas Boreas)4,19,20; o sapo, sapo dusky Gopher, Rana sevosa (Langhorne et al., inéditos)7; a costa do Golfo Waterdog, Necturus beyeri20; Sapo de Wyoming, anaxyrus do18; a rã-touro, Rana catesbiana21; o sapo americano, Anaxyrus americanus22; a rã de capim, lymnodyaster Edwardsina23; o coqui, Eleutherodactylus coqui24; Xenopus, Xenopus laevis25; o toadlet de Gunther, Pseduophryne guentheri26; a rã do leopardo do Norte, Lithobates pipiens; o argentino Horned-Frog, Ceratophrys ornamentado; o Cranwell ' s Horned-Frog, C. cranwelli; a terra-rã americana, Odontophrynus americanus27; e o salamandra do fogo (salamandra)228. Hormônios esteroides, como a progesterona (P4), são menos comumente relatados, mas demonstraram boa eficácia na elicificação da ovulação e oviposição em algumas espécies de anãs16,18,29. As prostaglandinas (especialmente a prostaglandina 2-alfa (PGF2α)) estão envolvidas na ovulação, juntamente com os corticosteroides30,31,32,34 e atingem níveis elevados durante fase ovulatória31.
Em estudos in vitro, PGF2α é um potente indutor da ovulação31, enquanto in vivo pode induzir a oviposição de ovos retidos em Rana muscosa4,30,32. Extratos hipofisários também são indutores eficazes da ovulação15,16,34; no entanto, as preocupações em torno da biossegurança e o potencial de transmissão de doenças são muitas vezes um impedimento para as colônias de reprodução em cativeiro ao considerar esta abordagem35.
A última seção deste artigo detalha procedimentos cirúrgicos e fornece aproximações alternativas para expandir estudos ovarianos ou auxílio com a definição de patologias reprodutivas. As ovariectomias são mais comumente realizadas em anfíbios para obtenção de oócitos para pesquisa embriológica. No entanto, ele também pode fornecer um remédio para os ovos retidos quando outras opções falham. Embora este procedimento seja invasivo, exigindo total anestesia e incisões para expor as massas de ovos, não requer eutanásia. Além disso, após a ovariectomia parcial, os animais podem fazer uma recuperação completa e continuar a ser reproductivamente ativo após a cirurgia8,36.
Os protocolos descritos abaixo descrevem os métodos invasivos e não invasivos de controle e monitoramento ovariano em anãs e Caudates. As espécies específicas escolhidas para ilustrar técnicas em anãs incluem R. mucosa e X. laevis. Necturus maculosus, n. beyeri, n. alabamensise a . mexicanum compreendem as espécies utilizadas para descrever similarmente técnicas em caudates.
Protocolo
Os procedimentos de salamandra foram aprovados por Cincinnati Zoo & jardim botânico (CZBG) institucional cuidados e uso Comitê (IACUC) protocolos 11-106, 13-110, 14-133 e 15-138. Todos os procedimentos de sapo e sapo foram aprovados pelos protocolos de San Diego Zoo global (SDZG), institucional de cuidados e uso (IACUC): 15-001, 16-005 e 18-003.
O cuidado e tratamento dos animais foi aprovado pelo Comitê de ética do Museu Nacional de história natural (Paris) (Museu Nacional d' Histoire Naturelle-ménagerie Du Jardin des Plantes (MNHN)), de acordo com as diretrizes institucionais e nacionais (Comissão de génie Génétique, Direction départementale des Services Vétérinaires, diretiva da União Europeia 2010/63/UE, decisão de acordo n º. C75-05-01-2 para a Convenção Europeia para os animais vertebrados utilizados para fins experimentais e outras finalidades científicas. Todos os protocolos utilizados neste estudo foram aprovados o número de referência 68-037.
1. técnicas de monitorização ovarianas não invasivas
- Inspeção visual e palpação
- Segure o Anuran fêmea em uma das três maneiras descritas abaixo.
- Prenda as pernas do sapo ou do sapo com o anel e o dedo mindinho, apoiando o lado dorsal (abdômen) do corpo da rã com o indicador e o dedo médio e o lado ventral com o polegar (Figura 1a).
- Segure o sapo ou sapo na mão dominante com um polegar em seu abdômen e o resto dos dedos fixando a parte de trás do animal. Usando a mão não dominante para palpar o abdômen do animal, sentir se há relevo subdérmico (Figura 1b).
- Descanse o sapo ou o abdômen do sapo na palma da mão, braços dianteiros drapejados sobre o dedo indicador e um polegar em sua parte traseira superior.
- Desde Caudates são totalmente aquáticos na natureza, realizar a inspecção visual por um dos dois métodos descritos abaixo.
- Mova o animal para um recipiente separado de 4 L contendo água do tanque. Segure o recipiente (tampa fixada) para cima e brilhar lanterna na parte inferior para visualizar a presença/ausência de ovos.
- Anestesiado em MS222 (0,5 g/L; Methanesulfonate de tricaine, tamponado com 0,5 M NaHCO3). Após a indução, gire o animal para trás e examine o abdômen.
- Segure o Anuran fêmea em uma das três maneiras descritas abaixo.
- Avaliações morfométricas
- Anuros
Nota: a anestesia não é necessária.- Usando pinças, medir o animal a partir da ponta da boca, ao longo do centro do corpo até a ponta da cauda para obter o SUL e SVL (Figura 2a, B).
- Tara um recipiente plástico em uma balança de precisão digital. Coloque o animal em um recipiente de tared e pesar (Figura 2C).
- Para animais maiores, como BullFrogs, ou ao obter pesos no campo, use uma escala de suspensão (Figura 2D).
- Como em muitas espécies de anéteres, distinguir as fêmeas adultas de R. muscosa de machos por seu tamanho maior e a falta de almofadas nupciais (polegar) nas mãos (Figura 3).
- Calcule a condição corporal, como uma avaliação básica da saúde geral pela seguinte fórmula:
Índice de Fulton: K = massa ÷ comprimento3
Nota: o índice de Fulton utiliza um equilíbrio dimensional de volume relacionado com massa e comprimento, onde 3 é o expoente de dimensionamento que relaciona a massa e o comprimento isometricamente.
- Ordem
- Escala de Tara com um saco vazio antes de colocar o animal não anestesiado no interior. Tome cuidado para não introduzir o excesso de água (Figura 2D) e agir rapidamente como animais secretam muco como uma resposta de estresse a ser contido.
- Obtenha medidas adultas imobilizando indivíduos em uma posição reta na parte inferior de um saco de plástico re-sealable ou em um recipiente plástico separado que possa acomodar calipers expandidos.
- Meça o comprimento do corpo com compassos de calibre (Figura 2e).
- Medida caudado da ponta do focinho à ponta da cauda (svl) para monitorar o crescimento.
- Anuros
- Observações comportamentais
- Observar fisicamente os animais em tempo real ou usar uma câmera de vídeo para registrar o comportamento.
- Registrar observações de animais categorizar comportamentos e construir um etograma (Figura 4).
- Classificar comportamentos reprodutivos
Nota: a Figura 4 exemplifica um tipo de comportamento reprodutivo observado em anfírios.
- Ultra-som
Nota: o transdutor de ultra-som de escolha, neste caso, 7,5 mHz linear ou um multi-freqüência (10-6 mHz) micro-convexo, são recomendar para Necturus e um 10 MHz sonda e solúvel em água, sal-livre de gel para R. muscosa. A realização de ultra-som em salamandras pode necessitar de anestesia (ver secção 1,5 para instruções).- Anuros
- Realize ultrassom em R. muscosa usando duas pessoas (Figura 5a).
- Primeira pessoa: Segure o animal com a mão dominante e aplique o gel solúvel em água, sal livre ao abdômen do animal.
- Segunda pessoa (ultra-sonografista): Pegue a sonda de 10 MHz na mão dominante e aplique-a no abdômen certificando-se de fazer um bom contato entre a sonda e o gel.
- Deslize para dentro de pouco abaixo do poço do braço em direção ao centro da linha média abdominal do animal para visualizar todo o ovário.
- Ultra-sonographer: Use a mão não-dominante para congelar o quadro e capturar as imagens desejadas no ultra-som.
- Categorizar o estágio do ciclo ovariano pelo sistema de nivelamento estabelecido para o gênero4 (tabela 2, figura 5B-F).
- Enxague qualquer gel fora do animal no final do procedimento.
- Ordem
- Transferir Necturus não anestesiados para recipiente retangular de 4 l preenchido com 2 l de água do tanque.
- Minimize o movimento animal girando as luzes do quarto fora e/ou copo uma mão sobre a cabeça do animal.
- Posicione o transdutor a uma distância de 1-2 cm da parede do corpo.
- Localize o coração no nível da linha média ventral para os membros anteriores e, em seguida, mova o transdutor distalmente e examine o tecido ovariano7.
- Categorizar fêmeas de acordo com o sistema de classificação estabelecido para o gênero4 (Figura 6a, B, C).
- Obter medidas precisas de ovos em meados-a fase tardia-gravid, capturando imagens quando o corpo do animal está em um ângulo para o transdutor (ou seja, não linear, mas arco ligeiro; Figura 6B). Caso contrário, os folículos sobrepostos dificultam a diferenciação do tamanho individual do ovo.
- Anuros
- Indução e recuperação anestésica
- Anuros
- Anestesiado em MS222 (0,5 g/L; Methanesulfonate do tricaine tamponado (0,5 M NaHCO3) como descrito previamente.
- Use o reflexo de endireitando como um indicador preliminar do grau a que o animal se tornou anestesiado. A perda completa de reflexo demonstra um estado de anestesia profunda.
- Retire o animal da anestesia com base de banho de água (MS-222) uma vez que o reflexo de endireitando é perdido.
- Coloque o animal em uma toalha molhada (com água de clorado sem anestésico).
- Certifique-se de manter o animal úmido durante todo o procedimento cirúrgico.
- Intubate pequenos anfíbios com cateteres de borracha vermelha, tubos não algemados ou tubos endotraqueais algemados clássicos sem inflar o manguito.
- Forneça um baixo fluxo do oxigênio (0.5-0.75 L/min) com o Isoflurane 0.5-1%.
- Parar o isoflurano após o procedimento, mas manter o fluxo de oxigênio por 1 minuto.
- Extubato o animal e enxágüe o animal completamente com água declorada livre de anestésico por 2 minutos.
- Põr o animal em uma quantidade rasa de água de-clorinated ou em uma toalha molhada.
- Avalie a recuperação do animal delicadamente puxando em um membro traseiro para alongar. Qualquer contração de resposta do membro indica reflexo de abstinência.
- Monitore outros indicadores de recuperação, como respirações gulares (movimento da garganta) e o reflexo de endireitando.
- Considere o anfíbio recuperado quando todos os reflexos retornaram, e as taxas do coração e da respiração retornaram aos valores pré-anestésicos.
- Ordem
- Anestesiar Necturus e Ambystoma em MS222 (0,5 g/L de tricaína Methanesulfonate, tamponado com 0,5 M NaHCO3, (MS222) em um tanque retangular de 4 litros.
- Coloc uma pedra do ar (1 polegada) e a bomba de ar no tanque e gire-a sobre a um fluxo constante para fornecer a oxigenação adequada.
- Quando a função do membro e o reflexo de endireitando são perdidos, remova o animal da anestesia água-baseada-banho (MS-222) e põr o animal sobre uma toalha molhada (com água desclorada anestésico-livre).
- Mantenha a pele e a umidade da brânquia com um frasco do aperto da água do tanque.
- Para recuperar o animal, coloque com cuidado o lado ventral para baixo em um recipiente plástico de 4 litros enchido com 2 litros da água do tanque com uma pedra do ar.
Nota: a recuperação começa com o piscamento da brânquia, seguida pela habilidade de mover sua cauda e propelir para a frente e o movimento finalmente funcional dos membros. - Devolva o animal ao seu tanque de habitação original e monitore de perto os próximos 24 h.
Nota: outros métodos de anestesia para anfíbios existem e estes são descritos em Wright e Whitaker8.
- Anuros
2. técnicas ovarianas invasoras do monitor e de controle
Nota: este procedimento foi adaptado de Forzán et al.10.
- Segure o sapo na mão dominante e seque o lado da venipuntura do rosto da rã com uma limpeza estéril ou gaze.
- Seque o rosto para evitar que o sangue se disperse pela pele muito.
- Insira a agulha (26 G 1/2 "e 27 G 1/2"), com o chanfro virado para cima, através da pele onde a pele levantada ao redor do olho e o cume da mandíbula superior se reúnem para formar o ponto de um triângulo (contorno amarelo) (Figura 7a) acessando a veia facialis perto a veia pars posterior.
- Perfure a veia facial abaixo do olho direito e acima do cume da mandíbula superior, começando entre 1-2 mm de volta da linha média do olho (Figura 7a).
Nota: para rãs menores (abaixo de 20 g), mova o ponto de inserção mais perto de uma posição diretamente abaixo da linha média do olho. - Ângulo do tubo de Microhematócrito para baixo para permitir a gravidade para ajudar o fluxo sanguíneo para o tubo. O sangue deve fluir imediatamente após a punção (Figura 7B, C).
- Ao primeiro sinal de fluxo sanguíneo, coloque a ponta do tubo de Microhematócrito no local da punção e colete 1-2 tubos de Microhematócrito completos de sangue e coloque tubos em receptáculos adequados para coleta (Figura 7B, C).
- Se o sangue não fluir prontamente, ou o volume é muito baixo, deslocar a inserção da agulha ligeiramente ou inserir a agulha no outro lado da face.
- Pare o sangramento pressionando a gaze firmemente ao local da punctura por pelo menos 20 s.
- Deixe o sapo fora da água por 10 minutos para confirmar que o local da punctura não reabre.
- Use uma nova agulha e novos tubos de Microhematócrito para cada sapo amostrado.
3. indução hormonal
- Preparação hormonal
- Prepare injeções de hormônio imediatamente antes de usar para garantir o efeito máximo.
- Selecione um hormônio da seleção listada na tabela 1.
- Determine a concentração do hormônio a ser injetado usando um μL ou mL/g de peso corporal16.
- Diluir o hormônio em uma das seguintes opções: água, salina tamponada com fosfato (PBS), solução salina anfíbia de Ringer (SARS) ou soro fisiológico.
- Não exceda um volume de injeção de 200 μL para rãs pesando 30-70 g e 300 μL para rãs com peso de 80-110 g (observação pessoal)16.
- Para a correcta detenção de um animal durante a administração hormonal de qualquer animal que varie de 10-100 g, utilize qualquer um dos métodos adequados para a exploração descrita na secção 1,1.
- Anuros
- Calcule a concentração exigida por indivíduo usando um grama por cálculo de peso corporal (g/peso corporal).
- Pouco antes da administração, reconstituir em um diluente estéril de escolha.
- Certifique-se de que não restam bolhas na seringa antes da injecção.
- Segure o animal firmemente na mão não dominante e administre a injeção com a mão dominante.
- Administrar a injeção de acordo com as especificações hormonais. As injeções mais comuns em anãs são subcutâneas, intra peritoneal ou intra musculares (Figura 8).
- Administrar injeções de IP na parte inferior do abdome ou na seção inferior do lado dorsal do corpo perto da perna de trás (Figura 9).
- Administrar injeções intra-musculares preferencialmente nas patas traseiras.
- Caudates (Necturus)
- Reconstituir o hormônio de escolha em água estéril de acordo com o grama por método de peso corporal descrito acima.
- No caso do Necturus, use doses de 1,7-2,3 μg de GnRH/g de peso corporal.
- Remova Necturus da câmara anestésica e coloque em uma superfície de 45 ° coberta com o drapejar cirúrgico.
- Posicione o animal com a cabeça apontando para baixo.
- Aproxime o quadrante posterior do abdômen (caudal do pé traseiro) em um ângulo de 15-20 °. Tenha cuidado para não introduzir ar na seringa.
- Injete (IP) utilizando uma seringa de insulina e 27-30 G de agulha.
- Injete o hormônio usando uma seringa de insulina e 27-30 G de agulha.
4. cirurgia
- Preparação cirúrgica geral e procedimento
- Para manter procedimentos assépticos, use cortinas plásticas estéreis desobstruídas para isolar o local cirúrgico. Reduza a evaporação mantendo a pele circundante úmida.
- Umedecer qualquer material que entrará em contato com a pele do animal com água estéril. Faça a incisão da pele com uma lâmina de bisturi número 15 ou número 11.
Nota: uma combinação de aço frio, radiocirurgia ou laser de diodo. Hemostasia em procedimento hemorrágico leve pode ser conseguido por eletrocauter ou laser de diodo. - Use lanças ou aplicadores com ponta de algodão para permitir a aplicação de pressão localizada em pequenos vasos que mantêm o controle da perda de sangue.
- Use lanças ou aplicadores com ponta de algodão para gerenciar pequenos espaços confinados em vez de quadrados de gaze padrão.
- Use microinstrumentos, como instrumentos oftalmológicos, com pontas finas e pequenas, ao realizar cirurgias em animais com peso inferior a 1 kg.
- Use o plástico, afastadores Self-retenção (por exemplo, retractor solitário da estrela) para caber tamanhos diferentes das incisões.
- Use afastadores da pálpebra para retrar incisões celômica.
- Use a instrumentação da ampliação onde necessário para executar a cirurgia em pacientes menores.
Nota: a analgesia é necessária com qualquer procedimento cirúrgico em anfíbios. A incapacidade de administrar analgesia adequada durante a cirurgia tem sido associada ao retorno tardio das funções normais. Além disso, a analgesia potenciora os efeitos dos fármacos anestésicos (tabela 3)34.
- Anuros
- Uma vez que X. laevis tenha sido anestesiado como descrito no passo 1.5.1, posicione o animal na recumbência dorsal (Figura 10a, C).
- Prepare o campo cirúrgico assepticamente limpando a gaze estéril úmida com solução diluir do Povidone-Iodo (1/10) no local para a solução do clorexidina de 10-15 s ou de 0,75% no local cirúrgico pelo menos 10 minutos antes da cirurgia35.
- Faça uma incisão de pele paramediana de 3 mm no coelom médio (entre os ombros e a cloaca) com um golpe ousado deixando uma incisão limpa usando um bisturi n º 15 ou n º 11.
Nota: um pode usar um laser de diodo também para incisões cutâneas. - Elevar a membrana abdominal, fazer e incisão e dissecar cuidadosamente usando um n º 15 ou n º 11 bisturi. (Figura 10B, D).
- Retrair as incisões celômica com afastadores da pálpebra (ou todo o equipamento apropriado).
- Extirpar uma porção de massa de ovo sem braquetes autoligáveis quaisquer vasos sanguíneos.
- Para a ovariectomia completa, cauterizar os vasos sanguíneos circundantes por eletrocautério ou diodo laser (Figura 11).
- Usando a sutura do monofilamento, incisão próxima do celiotomy com um teste padrão interrompido, eversão da sutura.
- Ordem
- Uma vez A. o mexicanum foi anestesiado, coloc o no recumbency lateral direito, com o membro pélvico esquerdo coloc simplesmente de encontro à base da cauda.
- Prepare o campo cirúrgico assepticamente colocando gaze estéril úmida com solução de iodo-povidona diluir (1:10) no local para 10-15 s. Alternativamente, use gaze estéril embebido em solução de clorexidina a 0,75% e coloque no local cirúrgico por pelo menos 10 min antes da cirurgia (Figura 12A)36,37 .
- Desenhe uma linha entre o ombro e os membros posteriores para dividir o corpo em três partes iguais (Figura 12B).
- Faça o local da incisão entre a segunda e a terceira parte.
- Segure o músculo subjacente e elevar-se longe das vísceras coelômicas.
- Force delicadamente pequenos hemostats através da musculatura celômica e na cavidade celômica.
- Retrair as incisões coelômicas com retratores da pálpebra (ou qualquer material apropriado) (Figura 12C).
- Para a ovariectomia completa, cauterizar os vasos sanguíneos circundantes por eletrocautério ou diodo laser (Figura 12D).
- Usando a sutura do monofilamento, incisão próxima do celiotomy com um teste padrão interrompido, eversão da sutura.
Resultados
Morfometria e reprodução
A visualização do estado reprodutivo feminino em anfíbios varia de acordo com a espécie. O método mais eficaz é o ultra-som; no entanto, algumas espécies podem apresentar graus variados de transparência de sua pele (Figura 13a, B, C). A inspeção visual pode, muitas vezes, ilustrar claramente as diferenças entre uma fêmea gravid e não gravid quando a pele é semitranslúcida, como observado em n. alabamensis e n. maculosus (Figura 13a, B); ou translúcida como ilustrado pela rã de vidro (Figura 13C). A coloração da pele manchada escura no abdômen de N. beyeri proíbe esta avaliação a ser feita. Em R. muscosa, a pele não é translúcida, mas diferenças visíveis podem ser detectadas entre as fêmeas que são gravid em comparação com aqueles que têm recentemente ovipositaram porque a pele é flácida, eo animal parece mais fino (linha amarela) em comparação com um fêmea que é gravid (linha azul) (Figura 13D). Com a experiência, o manipulador pode se familiarizar com a diferença entre uma grande fêmea e uma gravid, mas a confirmação do estágio gravid exigirá ultra-som. Os índices de massa corporal em anfíbios podem ser calculados usando uma série de fórmulas, mas sua aplicação como uma ferramenta preditiva para a reprodução é discutível. No caso de R. muscosa, a correlação entre o índice de Fulton, a saúde e o estado reprodutivo permanece obscura.
Comportamento reprodutivo e ultra-som
Nossos resultados mostram como caracterizar comportamentos reprodutivos em R. muscosa para predição de oviposição (Figura 4). Vários estágios que duram de algumas horas a várias semanas incluem, corteando onde um macho ativamente persegue uma fêmea (figura 4a), o macho monta e aperta firmemente na parte traseira da fêmea, denominado amplexo (Figura 4B). Uma vez amplexed, o par pode permanecer no amplexo por 1 – 5 semanas e o par indicará outros comportamentos além do que o amplexo. O amplexo é um comportamento muito ativo que inclui o macho espremendo a fêmea de forma suave (Figura 4C); a fêmea se movendo ao redor e começando a exibir comportamentos de mão-stand intermitentemente (Figura 4D, E); e mais perto do tempo de oviposição, a fêmea, em uma mão-stand, vai inclinar-se contra as superfícies que ela pode furar ovos em enquanto o macho bombeia seu abdômen vigorosamente (neste caso, é possível também observar a fêmea esfregando seu abdômen para baixo seu braço pits para a cloaca. Esta pode ser uma maneira mecânica com a qual empurrar os ovos para baixo os ovidutos) (Figura 4F, G).
Este estudo ilustra como o ultra-som pode fornecer a informação com que para verificar o status reprodutivo na fêmea R. muscosa e no Necturus. Quatro estágios do desenvolvimento são representados em R. muscosa (Figura 5C, D, e, F) e são caracterizados similarmente em Necturus4 (Figura 6a, B, C). Além disso, os ovos residuais podem deixar de ser expelidos levando à retenção de ovos (Figura 5g, Figura 15A, B). O estágio 1 mostra um ovário diretamente após a oviposição onde os folículos são difíceis de Visualizar (Figura 5C). O estágio 2 é representado pelo aparecimento de pontos ecogênicos (manchas brancas) dispersos por todo o ovário (Figura 5D). Os estágios 2 e 3 são representados por pontos ecogênicos maiores e arredondados, com centros escuros que representam médios de jugo a grandes folículos (Figura 5E, F). De 2013-2017, o Necturus fêmea prisioneiro foi examinado pela ecografia em uma base mensal. Durante cada exame foi atribuído um escore de nota de acordo com os critérios reprodutivos estabelecidos para o gênero (tabela 2). A percentagem de fêmeas que desenvolvem novos ovos a cada ano foi média de 88,2 ± 3, 1% (tabela 5). Enquanto o desenvolvimento do ovo foi elevado, a oviposição não foi assegurada (Figura 16). A maioria das fêmeas que se submeteram à oviposição depositou o complemento completo dos ovos, enquanto alguns indivíduos depositaram apenas uma fração dos ovos que se desenvolveram. Aquelas fêmeas de R. muscosa e de Necturus com os ovos retidos concomitantes com o ganho fluido na cavidade de corpo foram ampliadas exteriormente visualmente com manchas vermelhas na pele consistentes com os vasos sanguíneos do estouro (figura 14A, B ) . O grau de retenção de fluidos pode ser avaliado através de ultrassom (Figura 15B). Em ambas as espécies, os ovos retidos foram submetidos à atresia ou tomaram uma aparência mais ecogênica (Figura 14C, D, Figura 15A).
Administração hormonal
Dependendo da profundidade do tipo de injeção, o ângulo e a profundidade da agulha variarão. Para a maioria das injeções a profundidade da agulha não precisa ser mais de 1 -2 mm de profundidade quando se trabalha com espécies como R. muscosa , mas vai variar no ângulo de penetração. As injeções da prostaglandina exigiram uma inserção intra-muscular da agulha (IM) angular em 90 °, no pé traseiro de R. muscosa quando as injeções intra-peritoneal (IP), com uma profundidade similar às injeções intramusculares, foram administradas na área do cavidade coelômica a 45 ° (Figura 10). A administração de Amphiplex não teve efeito significativo no aumento do número de ovos depositados por fêmeas tratadas com hormônio em comparação aos controles (P = 0,547), nem houve diferenças no número de embriões que clivaram (P = 0,673) ou sobreviveram ao girino (P = 0,629) (tabela 4). Geralmente, a percentagem de fêmeas oviposição diminuiu de 80% em 2011 para 28% em 2014. O número de fêmeas oviposição em 2015 foi significativamente maior que 2013 (p = 0, 2), 2013 (p = 0, 1) e 2014 (p = 0, 26), mas não 2011 (p = 0, 885), reafirmando a ideia de que as fêmeas desta espécie não podem produzir anualmente e que os protocolos hormonais necessitam de refi nement. Para as fêmeas de R. muscosa com sinais de retenção de ovos, as injeções intramusculares de PGF2α tiveram uma taxa de sucesso de 60% na indução da expulsão de ovos degenerados. Entretanto, em 1 das 5 fêmeas injetadas, PGF2α não era suficiente para causar a expulsão completa e alguns ovos permaneceram dentro da fêmea até a seguinte estação de melhoramento. Dezessete fêmeas de Necturus receberam LHRH/(GnRH) e 13 receberam uma injeção simulando de água estéril para servir como controle (tabela 5). No total, sete fêmeas de Necturus (n = 4 alabamensis, n = 2 beyeri, n = 1 maculosus) passaram a ovipositar onze embreagens cheias que foram atribuídas a ambos os GnRH tratados (n = 6) e controle (n = 5) indivíduos. Três fêmeas (n = 2 beyeri, n = 1 maculosus) ovipositaram cinco embreagens parciais (Figura 13). Esse fenômeno não parece estar associado ao tratamento hormonal exógeno, pois três fêmeas de controle também depositaram embreagens parciais (tabela 5). A oviposição ocorreu ao longo de um período de 37 dias (3/31-5/7) no decorrer de cinco anos (tabela 5). Não houve diferença (P = 0,194) nas taxas de oviposição entre LHRH/GnRH tratadas (41 ± 13, 8%, intervalo 17-67%) e controle (66,75 ± 11,79%, faixa 50-100%) Fêmeas. As fêmeas tratadas com LHRH/GnRH depositaram ovos em média de 7,44 ± 1,41 (intervalo 3-13) dias após a injeção. Dada a natureza totalmente aquática da espécie e incapacidade de conter manualmente sem anestesia, foi necessário garantir um nível adequado de sedação antes de realizar injeções de hormônio IP (ver seção 3,2 para instruções sobre anestesia).
Coleta de sangue, anestesia e cirurgia
A técnica de amostragem de sangue neste artigo foi retirada de Forzan et al. 201310 e provou ser uma maneira efetiva de coletar sangue de R. muscosa com mínimo de invasividade e estresse. Usando tubos de Microhematócrito, aproximadamente 35-45 μL de plasma ou soro podem ser coletados por 70 μL de sangue total (Figura 7). O volume máximo de coleta em R. muscosa foi 1 tubo de Microhematócrito completo por 10 g de rã, até 4 tubos por rã para rãs 40 g e maior. Este foi um volume de coleta conservador de 0,7 mL por 100 g, 70% da recomendação máxima de 1,0 mL por 100 g (adaptado de Allender e Fry, 2008)13.
A anestesia e a cirurgia em anfíbios raramente são relatadas, mas é importante notar que as doses e a eficácia variarão de forma específica para as espécies. Em Bombina orientalis , por exemplo, MS222 tem um efeito muito baixo, mesmo com altas doses (1 g/L) enquanto que em Toads boreal, Anaxyrus Boreas Boreas, 1 g/L é rápido (questão de minutos) e de longa duração (3 + h) (Calatayud, observação pessoal). Em R. muscosa, A anestesia requer doses relatadas para Boreas A. Boreas e tem efeito semelhante e tempos de recuperação. Os anfíbios em jejum antes da anestesia geralmente não são necessários, pois sua laringe permanece bem fechada mesmo anestesia geral. No entanto, se considerado necessário, especialmente se o procedimento anestésico é incluir a cirurgia celômica, os animais podem ser jejuados 24 h antes da anestesia.
Durante a cirurgia, o reflexo de endireitando é o indicador preliminar que o animal se tornou anestesiado. O reflexo de endireitando é a habilidade e o grau de facilidade com que um animal pode retornar a uma posição ereta após ser coloc em sua parte traseira. A perda do reflexo sugere um estágio leve da anestesia. Um plano cirúrgico é indicado pela perda do reflexo de abstinência, que inclui puxar levemente o membro para endireitá-lo e o animal já não é capaz de retraí-lo7. A cirurgia reprodutiva não tem obstáculos esmagadores e pacientes anfíbios predominantemente curar bem tolerando a perda de sangue mais de vertebrados mais elevados. A cirurgia deve prosseguir rapidamente, durando aproximadamente 15 minutos do começo ao fim. As etapas devem ser cronometradas aproximadamente como segue: < 1 minuto para a incisão inicial e < 2 minutos para a inserção do celiotomy e do retractor, < 2-3 minutos para o isolamento por o ovário e < 1 minuto para a sutura ou a cauterização da embarcação e a sutura da pele < 4 minutos. O tempo total de recuperação após a cirurgia com protocolos MS222 são aproximadamente 45 minutos, mas isso pode ser específico da espécie. Em uma. Boreas Boreas e R. muscosa tempos de recuperação pode ser maior, até 1 – 2 h. Ao realizar a cirurgia, deve-se tomar cuidado para evitar a punção dos pulmões, do trato gastrointestinal ou de uma bexiga distendida, e não danificar as glândulas macroscópicas, os corações linfáticos e os vasos sanguíneos, especialmente a veia ventral média. Dependendo da época, a presença de grandes corpos gordos pode dificultar a visualização de outros órgãos. Uma vez visivelmente acordado, as respostas de um animal à estimulação dos membros, como a resistência a um alongamento delicado de um membro traseiro ou piscando quando a área ao redor do olho é estimulada (observação pessoal), são classificadas como respostas de retirada. O reflexo de endireitando junto com outros indicadores da recuperação que incluem, os reflexos da retirada e os movimentos gular, são indicadores importantes da recuperação.
| Administração | ||||||||||
| Nome comum | Espécie | Hormônio | Procedimento | Composto de escorva | A dose de escorva relatou | Número de doses de escorva | Temporização (HR antes da dose ovulatória) | Composto (s) administrado para ovulatório/oviposição final | Doses | Referência |
| Sapo com crista porto-riquenho | Peltophryne Lemur | GnRH & hCG | Ip | Hcg | 1,5 UI/g | 2 | hCG-48 | GnRH HCG GnRHa + hCG | 0,2 μg; 4 UI; 0,5 μg + 4 UI | Calatayud et al. inéditos |
| Râ de pernas amarelas da montanha | Rana muscosa | Amphiplex, Lut | Ip | GnRHa (des-Gly10, D-Ala6, pro-NHEt9-GnRH) | 0,4 μg/g | 1 | 24 | GnRH + MET | 1 x 0,4 μg/g + 10 μg/g | Calatayud et al., 2018 |
| PGF2α | Im | PGF2α | 5 ng/g | 1 | 48 | PGF2α | 5 ng/g | |||
| Sapo boreal do Sul da montanha rochosa | Anaxyrus Boreas Boreas | hCG, GnRH | Ip | Hcg | 3,7 UI/g | 2 | 96, 24 | hCG + GnRHa | 13,5 UI/g + 0,4 μg/g | Calatayud et al., 2015 |
| Râ do grilo do Norte | Acris crepitan | Anfíplex | adicionado à água (10 mL) | Nenhum | Nenhum | 0 | na | GnRH + MET | 0,17 μg + 0,42 μg/μl | Snyder et al., 2012 |
| Râ do leopardo do Norte | Lithobates pipiens | Anfíplex | Ip | Nenhum | Nenhum | 0 | 24 | GnRH + MET | 1 x 0,4 μg/g + 10 μg/g | Trudeau et al., 2010 |
| Râ Horned de Argentina | Ceratophyrs ornata | Anfíplex | Ip | Nenhum | Nenhum | 0 | 24 | GnRH + MET | 1 x 0,4 μg/g + 10 μg/g | |
| Rã Horned de Cranwell | Ceratophrys cranwelli | Anfíplex | Ip | Nenhum | Nenhum | 0 | 24 | GnRH + MET | 1 x 0,4 μg/g + 10 μg/g | |
| Râ à terra americana | Odontophrynus americanus | Anfíplex | Ip | Nenhum | Nenhum | 0 | 24 | GnRH + MET | 1 x 0,4 μg/g + 10 μg/g | |
| Râ de Gopher Dusky | (Sevosa) | hCG, GnRH | Ip | Hcg | 3,7 UI/g | 2 | 96, 24 | GnRH + hCG | 1 x 0,4 μg/g + 13,5 UI/g | Graham et al., 2018 |
| Coqui comum | Eleutherodactylus coqui | Peixes, aves, mamíferos & GnRH (D-ala, des-Gly, ETH LHRH), hCG | Sc | o mLHRH; a aLHR; a fLHRH; GnRHa Hcg | Nenhum | 0 | na | o mLHRH; a aLHR; a fLHRH; GnRHa Hcg | 7μg, 33 μg; de 28μg; 7μg, 20μg; 5, 10, 15, 20 μg; 165 DE UI | Michael et al 2004 |
| Uperoleia de Gunther | Pseudophryne guentheri | Gnrh | GnRHa | 0,4 μg/g | 1 | 26 | GnRHa com ou sem Prime | 0,4 μg/g | Silla 2010 | |
| Sapo corroborado | Pseudophryne corroboree | Lucrin | Sc | Lucrin | 1 μg de | 1 | 26 | Lucrin | 5 μg de | Byrne & Silla, 2010 |
| Sapo corroboree do Norte | Pseudophryne pengilleyi | GnRHa GnRH (D-ala, des-Gly, ETH LHRH) | Ta | Nenhum | Nenhum | 0 | na | GnRHa | 0,5-2,0 μg/g | Silla et al., 2017 |
| Waterdog da costa do Golfo | Necturus beyeri | [des-Gly10, D-Ala6]-hidrato de sal do acetato do ethylamide de LhRH-RH | Ip | Nenhum | Nenhum | 0 | na | LHRH | 100 μg/500 μL | Stoops et al., 2014 |
| Râ de sino do Sul/râ da grama rosnando | Litoria raniformis | des-Gly10, D-Ala6-[LHRH] | Sc | Nenhum | Nenhum | 0 | na | des-Gly10, D-Ala6-[LHRH] | 50 μg | Mann et al., 2010 |
| Sapo do Fowler | Anaxyrus fowleri | GnRH, hCG, P4 | Ip | Hcg | 3,7 UI/g | Browne et al., 2006 | ||||
| Axolotl (salamandra mexicana) | Ambystoma mexicanum | Hormônios estimulantes do folículo | Im | Nenhum | Nenhum | 0 | na | Fsh | 400IU | Trottier e Armstrong, 1974 |
| Râ agarrada africana | Laevis Xenopus | hCG & P4 | água adicionada; Ip | PMSG, hCG | Marcec, 2016 | |||||
| Salamandra do tigre | Ambystoma psuedoplatystoma | hCG, LH | ||||||||
| Sapo de Wyoming | Anaxyrus do | hCG, GnRHa, P4 | Ip | hCG + GnRHa | 100 UI + 0,8 μg | 1 | 72 | hCG + GnRHa | 100 UI + 0,8 μg | Browne et al., 2006 |
| Râ do leopardo do Norte | Lithobates pipiens | Extrato hipofisário (PE), P4, testosterona (T), corticosterona [C], Amphiplex, domperidona (D) | SC, IP | Nenhum | Nenhum | 0 | na | PE, PE + T, PE + P4, PE + C; Anfíplex, GnRH + D | ~ 100 UI (LHRH) em 1 mL; PE + 0,002 μg/μL; PE + 0.01 mg/50mL; PE + 0.1 mg/50mL; 0,4 μg/g + 10 μg/g; 0,4 μg/g + D | Wright, 1961; Forte, 2000; Trudeau et al., 2013 |
| Râ à terra | Lymnodynastes tasmeniensis | Extratos hipofisários, hCG, GnRHa, PZ | Ip | GnRHa | 0,9-1,2 μg/g + PZ 10 μg/g | 1 | 20 | PE PE + hCG; GnRH + PZ | PE Vol; PE Vol + 100 UI hCG; GnRH (0,9-1,2 μg/g) + PZ (10μg/g) | Clulow et al., 2018 |
| Râ verde e dourada de Bell | Litoia Aurea | Gnrh | Ip | GnRHa | 10 μg de | 1 | 72 | GnRHa + hCG | 20 μg + 300 UI | Clulow et al., 2018 |
| Grande sapo barrada | Mixophyes fasciolatus | hCG & PMSG | Sc | PMSG, hCG | 50 UI & 25 UI; 1x100 UI | 2 2 | PMSG-144 & 96; hCG-24 | Hcg | 100IU | Clulow et al., 2012 |
| Para mais protocolos e espécies da hormona Veja Wright e Whitaker, 2001 | ||||||||||
Tabela 1: espécies de anfíbios e alguns dos hormônios EXÓGENOS testados neles como relatado na literatura. Gonadotropina coriónica humana (hCG); Hormônio liberador de gonadotropina (GnRH); Hormônio liberador de hormônio lutenizante (LHRH); as letras m, a e f representam «mamífero», «aviária» e «peixe»; gonadotropina do soro da égua grávida (PMSG); progesterona (P4); Hormônio folículo-estimulante FSH); extrato hipofisário (PE); testosterona (T); corticosterona (C). Os antagonistas da dopamina listados incluem: domperidona (D); Pimozida (P); metoclopramida (MET). Amphiplex é o nome dado a um composto constituído por GnRH e Metoclopramide27. Lucrin é um agonista GnRH comercialmente disponível com o ingrediente ativo sendo acetato de Leuprorelin. 4. º , 7 anos de , 17 anos de , 18 anos de , 19 anos de , 20 anos de , 26 anos de , 27 anos de , 38 , 39 , 40 , 41 , 42 , 43 , 44 , 45
| Grau | Estado reprodutivo | Descrição |
| 0 | Não gravid | Não há ovos visíveis. |
| 1 | Gravid precoce | Ovos visíveis (1-2mm de tamanho) nenhuma linha echogenic distinta associou com o ovo. |
| 2 | Gravid meados de | Ovos 2-3mm em tamanho, linha ecogênica distinta (s) associada a cada ovo. |
| 3 | Gravid atrasado | Ovos 4-5mm em tamanho, linhas ecogênicas ainda visíveis, aumento acentuado na aparência anecoica de ovo. |
| 4 | Ovos retidos | Os graus variados de material echogenic atuais na estrutura interna do ovo, tomam na forma amorfos. Alguns podem se tornar muito ecogênicos e associados com a retenção de fluidos na cavidade do corpo. |
Tabela 2: sistema de nivelamento utilizado para marcar o estado reprodutivo de Necturus fêmea cativo e Rana muscosa por ultrassonografia.
| Droga | Dosagem e rota | Comentários-referência |
| Buprenorina | 50 mg/kg (intracelômica) | Estudo experimental em um Newt vermelho-manchado Oriental (viridescens de Notophthalmus). A analgesia deve ser administrada antes da cirurgia. (Koeller, 2009) |
| Butorfanol | 1 – 10 mg/kg (IM ou intracelômica) | Existem vários respons específicos. É aconselhável começar em 1 mg/kg. |
| Butorfanol | 0,5 mg/L (banho) | Estudo experimental em um Newt vermelho-manchado Oriental (viridescens de Notophthalmus). (Koeller, 2009) |
| Fentanil | 1 mg/kg | Analgesia > 4 h, antagonizada pela naltrexona (Stevens, 1997) |
| Meloxicam | 0,1 a 0,2 mg/kg (IM) | (Minter, 2011) |
Tabela 3: protocolos de analgesia em anfíbios.
| Rana muscosa | ||
| Ano | 2014 | 2015 |
| Não, ♀ | 18 | 18 |
| Desenvolvimento de ovos | 61% de | 94% de |
| Controle ♀ | 4 | 6 |
| Amphiplex ♀ | 4 | 7 |
| Borne médio do dia Amphiplex ao ovipositar | 10,5 | 10,9 |
| Taxa de oviposição (Amphiplex) | 22,20% de | 33,33% de |
| Taxa de oviposição (controle) | 22,20% de | 38,88% de |
Tabela 4: comparação dos parâmetros reprodutivos entre os tratados com anfíplex em comparação com o controle de fêmeas cativas Rana muscosa em 2014 e 2015.
| Necturus SP. | |||||
| Ano | 1 | 2 | 3 | 4 | 5 |
| Não, ♀ | 6 | 7 | 7 | 7 | 7 |
| Desenvolvimento de ovos | 83% de | 100% de | 86% de | 86% de | 86% de |
| LHRH ♀ | 3 | 5 | 3 | 6 | 0 |
| Controle ♀ | 2 | 2 | 3 | 0 | 6 |
| Dia pós-LHRH para Oviposit | 5 | 7 | 5,5 (intervalo 3-8) | 13 | n/a |
| Taxa de oviposição (LHRH) | 60% de | 20 | 67% de | 17 | n/a |
| Taxa de oviposição (controle) | 50% de | 50% de | 100% de | n/a | 67% de |
| * n = 1 ♀ nenhum desenvolvimento do ovo | |||||
Tabela 5: comparação dos parâmetros reprodutivos entre LHRH (São Rois) -tratada e controle (água estéril) fêmea prisioneira Necturus de três espécies ao longo de um período de 5 anos de tempo (2012-2017).

Figura 1: três métodos de prender um sapo. A) procedimento 1. B) procedimento 2. C) procedimento 3. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: avaliações morfométricas. (A, B) SVL/SUL (C, D). peso, em R. muscosa e D. Necturus. (E). medida do tamanho com calipers. Por favor clique aqui para ver uma versão maior desta figura.
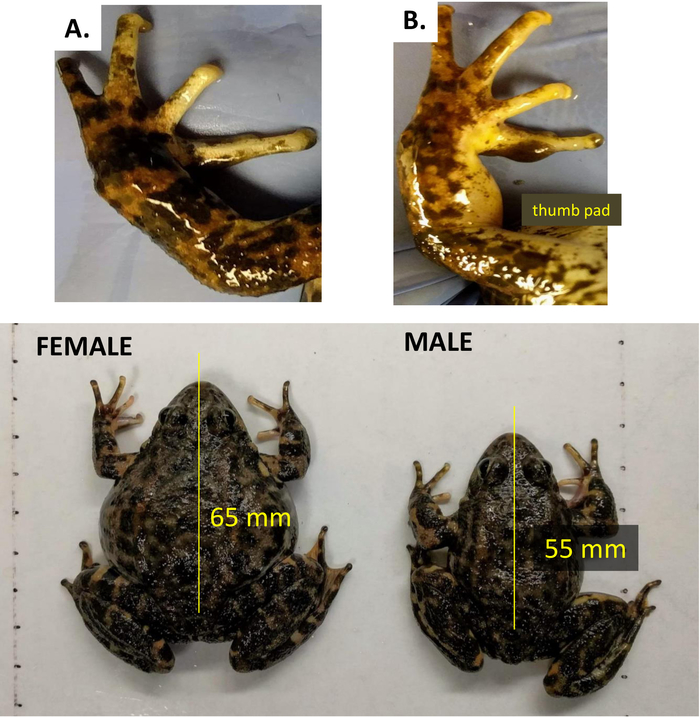
Figura 3: o dimorfismo sexual é distinguido por almofadas nupciais do polegar em machos adultos de R. muscosa comparados às fêmeas. (A) fêmea (B) macho. O painel inferior mostra o comprimento do macho vs feminino. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: caracterização dos comportamentos reprodutivos que antecederam a oviposição em R. muscosa (A) corteando. (B) amplexo. (C) macho espremendo fêmea quando no amplexo. (D, E) Fêmea amplexed em uma mão-carrinho. (F, G) Contrações abdominais e oviposição. Por favor clique aqui para ver uma versão maior desta figura.
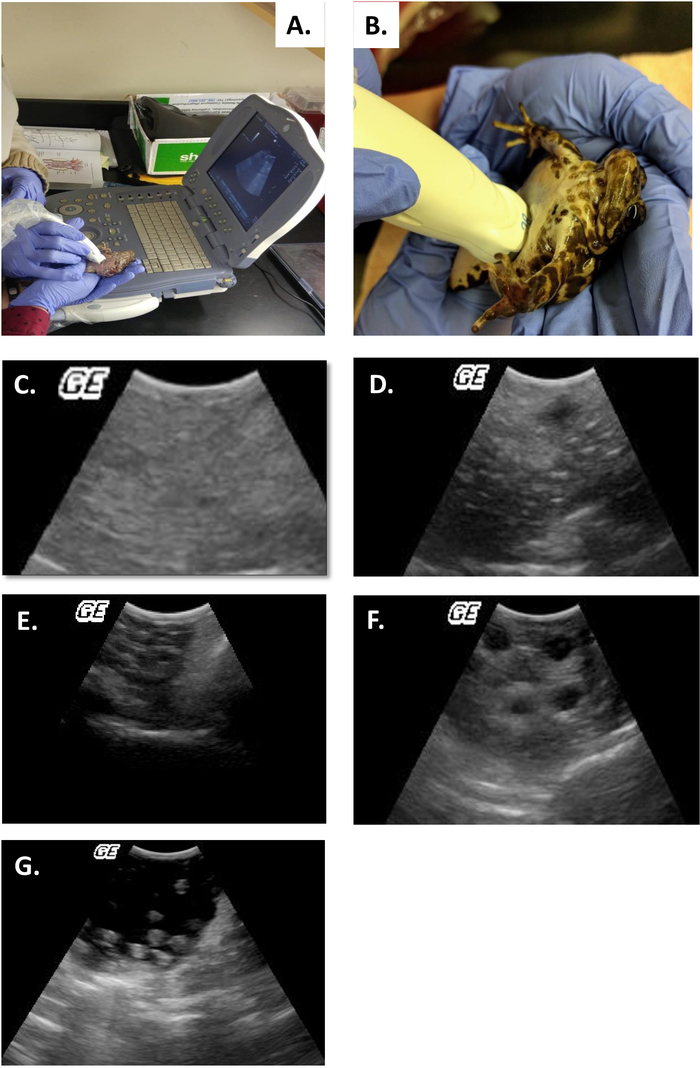
Figura 5: ultrassonografia realizada em R. muscosa a-B com estado reprodutivo de acordo com o estágio de desenvolvimento4. (A, B) realizando ultra-som em Rana muscosa. (C) grau 0. (D) grau 1. (E) grau 2. (F) grau 3. (G) grau 4 (ovos ovulados e retidos) por favor clique aqui para ver uma versão maior desta figura.

Figura 6: imagens ultrassonográficas de Necturus. (A) grau 1. B) grau 2. (C) ovos de grau 3. Por favor clique aqui para ver uma versão maior desta figura.

Figura 7: coleta de sangue em R. muscosa. (A) coleta de sangue por punção do posterior da veia pars a veia facial logo acima da linha do maxilar no meio da órbita. (B, C) O sangue é liberado na superfície da pele e é coletado com um tubo capilar heparinizado. Por favor clique aqui para ver uma versão maior desta figura.

Figura 8: métodos de injeção em anfíbios. Dependendo da profundidade do tipo de injeção, o ângulo e a profundidade da agulha variarão. Por favor clique aqui para ver uma versão maior desta figura.

Figura 9: injecção hormonal em R. muscosa. Indução da oviposição pelo tratamento hormonal em fêmeas de Rana muscosa injetadas com amphiplex intra-peritoneally. Os ovários podem ser encontrados na cavidade coelômica por favor clique aqui para ver uma versão maior desta figura.

Figura 10: preparação antes da cirurgia. (A) preparo asséptico da área cirúrgica utilizando solução diluir povidona-iodo (1/10), Trachycephalus resinifictrix. (B) Limpe a incisão do bisturi em um Xenopus laevis ou, (C) a incisão da pele do laser-diodo, Lithobates Lithobates catesbeianus. (D) Evite danificar a veia ventral médio, Trachycephalus Trachycephalus. Por favor clique aqui para ver uma versão maior desta figura.

Figura 11: ovariectomia em Xenopus laevis. (A) expor e mover grandes corpos gordos para descobrir a massa de ovos. (B) extirpar uma porção de massa de ovos sem ligar os vasos sanguíneos. (C) Cauterize os vasos sanguíneos circundantes por electrocautério para a ovariectomia completa. Por favor clique aqui para ver uma versão maior desta figura.

Figura 12: preparo pré-cirúrgico e ovariectomia em A. mexicanum. (A) gaze estéril embebido em solução de clorexidina a 0,75% aplicada ao sítio cirúrgico (B). Uma linha entre o ombro e os membros posteriores divide o animal em três partes iguais e o ponto azul marca o local na incisão. (C) retrair as incisões coelômicas com retratores da pálpebra. (D) para a ovariectomia completa, cauterizar os vasos sanguíneos circundantes por eletrocautério. Por favor clique aqui para ver uma versão maior desta figura.

Figura 13: avaliação visual de estágios reprodutivos. (A, B) Avaliações visuais do estágio reprodutivo através da pele semi-translúcida, Necturus. (C) pele translúcida, Hyalinobatrachium (rã de vidro). (D) avaliação visual de R. muscosa antes (linha direita, azul) e após oviposição (linha esquerda-amarela). Por favor clique aqui para ver uma versão maior desta figura.
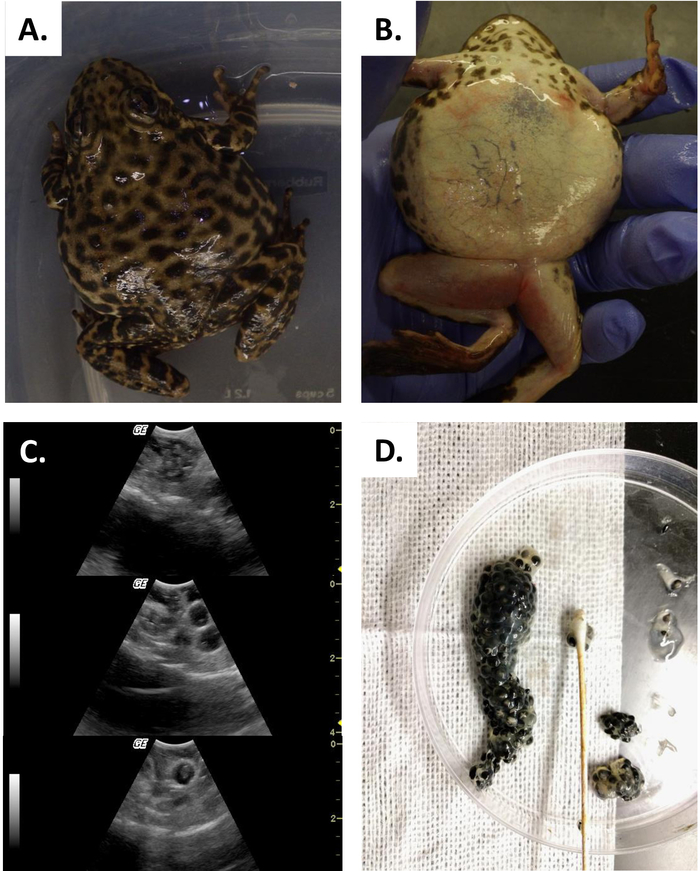
Figura 14: retenção de ovos. (A, B) Muscosa fêmea de Rana com caixa severa da retenção do ovo. (C) o ultra-som mostra o degeração velho, os ovos (parte superior) e os ovos maiores (painel médio e inferior) ovularam e prendido no coelom. D) ovos retidos recuperados por decapagem manual. Por favor clique aqui para ver uma versão maior desta figura.
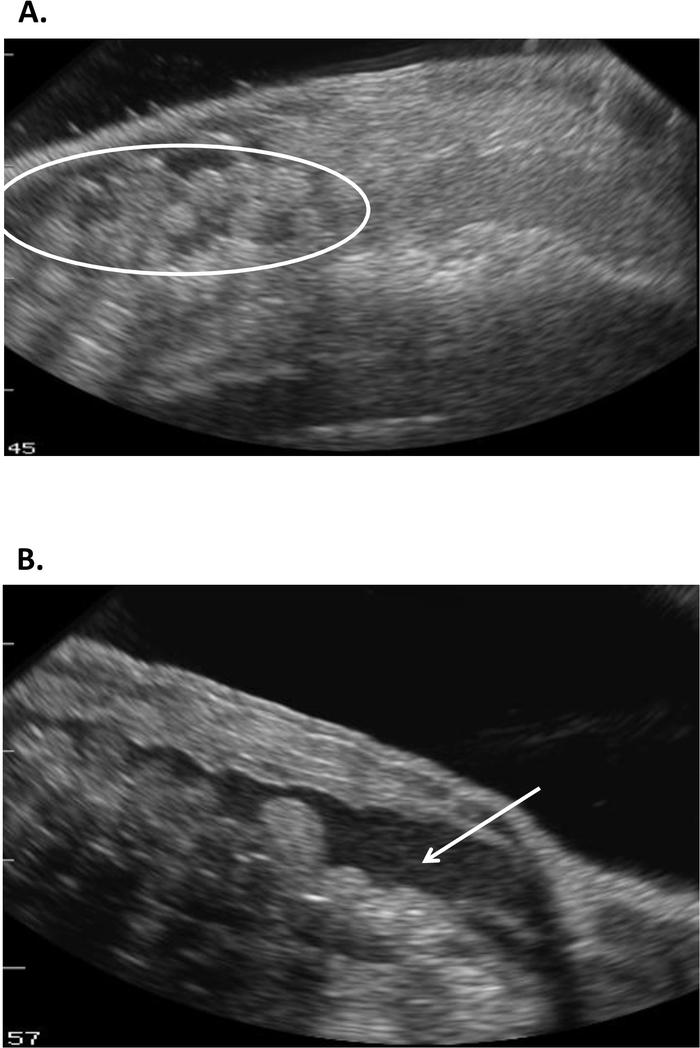
Figura 15: imagens ultrassonográficas de ovos retidos em Necturus que (A) se tornaram ecogênicas na aparência (círculo) e foram associadas à (B) retenção de fluidos na cavidade corporal (seta). Por favor clique aqui para ver uma versão maior desta figura.
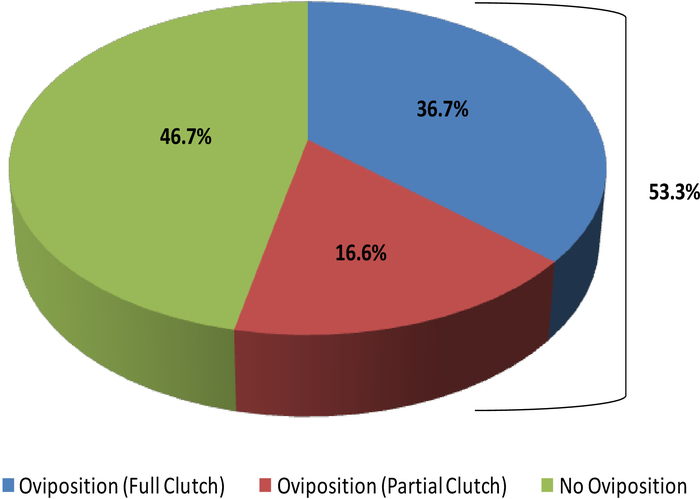
Figura 16: percentagem de Necturus fêmea em cativeiro que ovipositou embreagens cheias ou parciais (2013-2017) em comparação com aqueles que não oviposit. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
A manipulação direta, a observação visual e as medidas morfométricas fornecem técnicas não invasoras e são os primeiros critérios da avaliação para determinar a fase reprodutiva fêmea. Entretanto, este estudo mostra que os ovários gravid não podem sempre ser identificados confiantemente pela palpação. Dependendo da espécie, os ovários gravid podem às vezes ser visualmente detectados através de uma pele semitranslúcida (Figura 13a, B) ou completamente translúcida no lado ventral do animal (Figura 13C). As fêmeas que completaram a oviposição podem mostrar alterações óbvias à sua aparência em comparação com fêmeas gravidas (por exemplo, pele solta e perda de até 30% de sua massa corporal, Figura 13D). Durante a reprodução, os machos e as fêmeas exibirão determinados comportamentos que fornecem a informação sobre a proximidade à ovulação e ao oviposition. No caso de R. muscosa indicações de que uma fêmea está perto de oviposição começar com a fêmea entrando handstands.
A aplicação da tecnologia de ultrassom a anãs e Caudatas permite o diagnóstico de presença ou ausência de ovos e se a oviposição foi associada à liberação completa ou parcial de ovos desenvolvidos. Assim, este método proporciona uma avaliação mais completa e precisa do estado reprodutivo sem se limitar a determinar o estado gravid/não gravid através de uma técnica de visualização que varia de acordo com a transparência da pele abdominal, ou a consistência epidérmica entre diferentes espécies de anfíbios. A ultrassonografia pode ser realizada com relativa facilidade e com pouco estresse para os animais (Figura 5 e Figura 13) e pode ser utilizada para caracterizar os ciclos reprodutivos e determinar o estado reprodutivo4. É fundamental familiarizar-se com a espécie; no entanto, este estudo mostrou que Necturus e R. muscosa compartilham sinais comuns de desenvolvimento em seus padrões reprodutivos, permitindo a classificação similar do estágio reprodutivo (Figura 5). Através desta tecnologia há agora evidências de que o desenvolvimento de ovos é elevado em cativeiro Necturus e R. muscosa e que ambas as espécies seguem um padrão sazonal. Embora as razões para estes fenômenos são desconhecidas e exigem um inquérito mais adicional, sem o uso do ultra-som, diversas áreas da deficiência orgânica ovariana, tais como a retenção do ovo e o oviposition parcial, teriam ido undetected. As aplicações futuras a esta técnica serão usadas para determinar se as fêmeas devem ser selecionadas para a criação de animais em um determinado ano e se a oviposição está completa.
Um protocolo de coleta de sangue, como o apresentado em R. muscosa, que é eficaz e provoca um mínimo de angústia para o animal, é ideal para estudar os perfis hormonais em cativeiro e selvagem-capturados anãs (Calatayud, inéditos). Até à data, não existe informação sobre os perfis hormonais anuais de R. muscosa cativo e, portanto, nenhum conhecimento sobre como os hormônios estão influenciando sua saúde e reprodução. Além disso, com evidências de que as fêmeas desta espécie podem não ser criadores anuais, o perfil hormonal será outro método para rastrear os ciclos ovarianos. Juntamente com o ultra-som, a análise hormonal pode levar a uma melhor predição do que as fêmeas estarão prontas para a oviposição. Além disso, no ano passado, foram documentados dois casos de Intersexo na população cativa R. muscosa . Além, o desenvolvimento de almofadas do polegar foi anotado em algumas das fêmeas fundando mais velhas. Razões para isso estão atualmente investigação, mas os resultados iniciais sugerem que pode se relacionar com mudanças nos níveis de testosterona (Calatayud, não publicado). Discernir os ciclos hormonais em fêmeas de diferentes idades nos ajudará a entender por que as fêmeas podem desenvolver características sexuais secundárias associadas ao sexo masculino e se isso deve ser esperado em uma população envelhece.
A terapia hormonal exógena tem sido usada para superar disfunções reprodutivas freqüentemente encontradas em anfíbios em cativeiro. No entanto, para as populações de R. muscosa e Necturus neste estudo, não foram detectadas diferenças significativas na oviposição entre fêmeas tratadas com hormônio e controle ao longo de um período de 2 e 5 anos, respectivamente. Isso pode indicar que o protocolo de administração hormonal, doses, escorva e combinação hormonal utilizada não foi adequada para a espécie. Uma análise mais estreita de histórias reprodutivas fêmeas individuais sugere R. muscosa não pode experimentar a criação de animais anual, que poderia igualmente dar conta da falta do hormonal-efeito observado em fêmeas tratadas. Porque uma certa percentagem de fêmeas consistentemente ignorado reprodução a cada ano, entendendo a história natural da espécie pode ajudar a determinar se há uma necessidade de hormônios EXÓGENOS e quando eles podem ser mais eficazes. Os procedimentos descritos neste artigo podem ser aplicados a um número de espécies, (tabela 1) e são para anãs variando de 5 g a 150 g; animais maiores podem necessitar de seringas diferentes e medidores de agulhas. A localização da injeção varia com alguns hormônios que necessitam de injeção intra-muscular, intra-peritoneal, subcutânea ou intradérmica (Figura 7).
A cirurgia para fins de ovariectomia é um método comum usado em várias espécies de anfíbios para obter oócitos para estudos embriológicos. A ovariectomia também pode ser indicada para controle populacional e questões médicas, como retenção de ovos. No caso de ovariectomias parciais em que a colheita de oócitos é realizada para fins de pesquisa, a cirurgia deve garantir que o animal permaneça reprodutivo. A administração de PGF2α mostrou alguma promessa em resolver a retenção do ovo na R. muscosafêmea. Em vários indivíduos, PGF2α provocou a deposição completa de ovos previamente retidos, mas em outros apenas a deposição parcial ocorreu exigindo remoção manual para remover todos os ovos. Enquanto PGF2α pode servir como uma alternativa à cirurgia para retenção de ovos em R. muscosa, sua capacidade de remediar condições patológicas semelhantes em outros anfíbios exigirá validação específica de espécies. Quando a intervenção cirúrgica é mandatada para o paciente Anuran ou Caudate, é necessário assegurar um plano adequado de anestesia antes que as incisões sejam feitas. Habilidades de observação astuto são necessárias para avaliar e monitorar as respostas normativas de indução e recuperação, conforme descrito neste estudo para cada um dos táxons. Uma vez que se conhece a anatomia específica, uma abordagem cirúrgica adequada, hemostasia, manipulação delicada do tecido e manejo pós-operatório adequado, as cirurgias reprodutivas não colocam obstáculos esmagadores.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Natalie Calatayud gostaria de agradecer a Dr. Barbara Durrant para a formação e assistência com ultra-som e exploradora de Immuebles, S.A. (EISA) para a concessão de ajuda financeira para a minha posição de pesquisador associado na SDZG. Graças ao Dr. Kylie Cane para comentários sobre o manuscrito, bem como para os revisores oficiais (quem quer que eles possam ser). Graças a Jonathan Dain nosso companheiro de verão 2018, San Diego Zoo Institute for Conservation Research para fornecer fotos (Figura 1a, B). Monica Stoops amplia a apreciação da Associação de jardins zoológicos e aquários conservação fundo de dotação e do fundo de conservação da Disney Worldwide para fornecer apoio financeiro para estabelecer a população cativa Necturus . Além disso, o apoio também foi recebido através de doações privadas da advogada anfíbia Sra. Iris de la Motte. Obrigado, é dado ao Sr. Christopher DeChant e Dr. Mark Campbell por sua contribuição significativa para a pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| GE logiq Book XP and 8C-RS probe 4e10 MHz GE Medical Systems | GE medical systems | GE logiq Book XP | Ultrasound |
| Aloka 500 7.5mHz linear or IBEX multi-frequency (10-6mHz) micro-convex | GE medical systems | 8C-RS (10 MHz) | Ultrasound probe |
| BD disposable U-100 insulin syringe (28-29 G needle) | Mettler Electronics Corp CA | Sonigel | Ultrasound gel (water soluble, salt-free) |
| Hormone | |||
| Gonadotropin releasing hormone | BACHEM | 4012028 | synonym: [Des-Gly10, D-Ala6, Pro-NHEt9]-GnRH acetate abbreviation: GnRH |
| Lutenizing hormone releasing hormone | BACHEM, Sigma-Aldrich | 4033013; L1898 | synonym: Pyr-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2 acetate salt; [D-Ala6}-LHRH acetate salt hydrate abbreviation: LHRH |
| Human chorionic gonadotropin | BACHEM, Sigma-Aldrich | 4030270, 4018894; C1063, CG5, CG10 | synonym: Chorionic gonadotropin-β (109-145)(109-119); Choriogonin, HCG (2,500IU, 5,000IU, 10,000IU) abbreviation: hCG |
| Prostaglandin 2α | Sigma-Aldrich | P40424; | synonym: (5Z,9α,11α,13E,15S)-9,11,15-Trihydroxyprosta-5,13-dienoic acid tris salt, PGF2α−Tris; abbreviation: PGF2α |
| Follicle-stimulating hormone | Sigma-Aldrich | F4021, F8174 | synonym: porcine, sheep abbreviation: FSH |
| Progesterone | Sigma-Aldrich | 46665; P7556 | synonym: Vetranal; P4 water soluble abbreviation: P4 |
| Pituitary extract | na | synonym: Check papers for amphibian species derivation abbreviation: PE | |
| Pregnant Mare Serum Gonadotropin | Prospec; Lee Biosolutions; Sigma-Aldrich | HOR-272; 493-10; 9002-70-4 | synonym: Pregnant Mare Serum Gonadotropin abbreviation: PMSG |
| Metaclopromide | Sigma-Aldrich | M0763 | synonym: 4-Amino-5-chloro-N-[2-(diethylamino)ethyl]-2-methoxybenzamide, Methoxychloroprocainamide abbreviation: MET |
| Lucrin | BACHEM; Sigma-Aldrich | 4033014; L0399 | synonym: Leuprorelin acetate abbreviation: Lucrin |
| Lutalyse | Pfizer | synonym: PGF2α - Dinoprost tromethamine abbreviation: Lut | |
| Pimozide | Sigma-Aldrich | P1793 | synonym: 1-[1-[4,4-bis(4-Fluorophenyl)butyl]-4-piperidinyl]-1,3-dihydro-2H-benzimidazol-2-one abbreviation: PZ |
| Amphiplex | see above | synonym: Gonadotropin releasing hormone + metoclopramide abbreviation: GnRH + MET | |
| Ovopel | Ovopel | na | synonym: GnRHa + dopamine receptor antagonist (administered 1 pellet/ kg) abbreviation: Ovo |
| Ovaprim | Pentair aquatic eco-systems | Ova10 | synonym: Salmon gonadotropin + domperidone abbreviation: Ova |
| Domperidone | Sigma-Aldrich | D122 | synonym: 4-(5-Chloro-2-oxo-1-benzimidazolinyl)-1-[3-(2-oxobenzimidazolinyl)propyl]piperidine abbreviation: DOM |
Referências
- Conde, D. A., Flesness, N., Colchero, F., Jones, O. R., Scheuerlein, A. An emerging role of zoos to conserve biodiversity. Science. 331 (6023), 1390-1391 (2011).
- Conde, D. A., et al. Zoos through the Lens of the IUCN Red List: A Global Metapopulation Approach to Support Conservation Breeding Programs. PLoS ONE. 8 (12), e80311(2013).
- Morrison, C., Hero, J. -M. Geographic variation in life-history characteristics of amphibians: a review. Journal of Animal Ecology. 72 (2), 270-279 (2003).
- Calatayud, N. E., Stoops, M., Durrant, B. S. Ovarian control and monitoring in amphibians. Theriogenology. , 70-81 (2018).
- National Research Council. Institutional Animal Care and Use Committee Guidebook. , (2010).
- Peig, J., Green, A. J. New perspectives for estimating body condition from mass/length data: the scaled mass index as an alternative method. Oikos. 118 (12), 1883-1891 (2009).
- Graham, K. M., Langhorne, C. J., Vance, C. K., Willard, S. T., Kouba, A. J. Ultrasound imaging improves hormone therapy strategies for induction of ovulation and in vitro fertilization in the endangered dusky gopher frog (Lithobates sevosa). Conservation Physiology. 6 (1), coy020(2018).
- Wright, K. M., Whitaker, B. R. Amphibian Medicine and Captive Husbandry. , Krieger Publishing Company. (2001).
- Forzán, M. J., Vanderstichel, R. V., Ogbuah, C. T., Barta, J. R., Smith, T. G. Blood collection from the facial (maxillary)/musculo-cutaneous vein in true frogs (family Ranidae). Journal of Wildlife Diseases. 48 (1), 176-180 (2012).
- Allender, M. C., Fry, M. M. Amphibian hematology. Veterinary Clinics of North America: Exotic Animal Practice. 11 (3), 463-480 (2008).
- Green, S. L., Parker, J., Davis, C., Bouley, D. M. Ovarian hyperstimulation syndrome in gonadotropin-treated laboratory South African clawed frogs (Xenopus laevis). Journal of the American Association for Laboratory Animal Science. 46 (3), 64-67 (2007).
- Jorgensen, C. B. External and internal control of patterns of feeding, growth and gonadal function in a temperate zone anuran, the toad Bufo bufo. Journal of Zoology. 210 (2), 211-241 (1986).
- Jørgensen, C. B. Growth and reproduction. Environmental Physiology of the Amphibians. , 439-466 (1992).
- Vu, M., Trudeau, V. L. Neuroendocrine control of spawning in amphibians and its practical applications. General and Comparative Endocrinology. 234, 28-39 (2016).
- Clulow, J., Trudeau, V. L., Kouba, A. J. Amphibian declines in the twenty-first century: why we need assisted reproductive technologies. Reproductive Sciences in Animal Conservation. , 275-316 (2014).
- Kouba, A., et al. Assisted reproductive technologies (ART) for amphibians. Amphibian Husbandry Resource Guide. 2, 60-118 (2012).
- Clulow, J., et al. Optimisation of an oviposition protocol employing human chorionic and pregnant mare serum gonadotropins in the Barred Frog Mixophyes fasciolatus (Myobatrachidae). Reproductive Biology and Endocrinology. 10 (1), 60(2012).
- Browne, R. K., Seratt, J., Vance, C., Kouba, A. Hormonal priming, induction of ovulation and in-vitro fertilization of the endangered Wyoming toad (Bufo baxteri). Reproductive Biology and Endocrinology. 4 (1), 34(2006).
- Calatayud, N. E., et al. A hormone priming regimen and hibernation affect oviposition in the boreal toad (Anaxyrus boreas boreas). Theriogenology. 84 (4), 600-607 (2015).
- Stoops, M. A., Campbell, M. K., Dechant, C. J. Successful captive breeding of Necturus beyeri through manipulation of environmental cues and exogenous hormone administration: a model for endangered Necturus. Herpetological Review. 45 (2), 251-256 (2014).
- Mc Creery, B. R., Licht, P. Induced ovulation and changes in pituitary responsiveness to continuous infusion of gonadotropin-releasing hormone during the ovarian cycle in the bullfrog, Rana catesbeiana. Biology of Reproduction. 29 (4), 863-871 (1983).
- Johnson, C. J., Vance, C. K., Roth, T. L., Kouba, A. J. Oviposition and ultrasound monitoring of American toads (Bufo americanus) treated with exogenous hormones. Proceedings of the American Association of Zoo Veterinarians. 299, 301(2002).
- Herbert, D. Studies of assisted reproduction in the spotted grass frog Limnodynastes tasmaniensis: ovulation, early development and microinjection (ICSI). , (2004).
- Michael, S. F., Buckley, C., Toro, E., Estrada, A. R., Vincent, S. Induced ovulation and egg deposition in the direct developing anuran Eleutherodactylus coqui. Reproductive Biology and Endocrinology. 2, 6(2004).
- Ogawa, A., Dake, J., Iwashina, Y., Tokumoto, T. Induction of ovulation in Xenopus without hCG injection: the effect of adding steroids into the aquatic environment. Reproductive Biology and Endocrinology. 9 (1), 11(2011).
- Silla, A. J. Effects of luteinizing hormone-releasing hormone and arginine-vasotocin on the sperm-release response of Günther’s Toadlet, Pseudophryne guentheri. Reproductive Biology and Endocrinology. 8 (1), 139(2010).
- Trudeau, V. L., et al. Hormonal induction of spawning in 4 species of frogs by coinjection with a gonadotropin-releasing hormone agonist and a dopamine antagonist. Reproductive Biology and Endocrinology. 8 (1), 36(2010).
- Krause, E. T., von Engelhardt, N., Steinfartz, S., Trosien, R., Caspers, B. A. Ultrasonography as a minimally invasive method to assess pregnancy in the fire salamanders (Salamandra salamandra). Salamandra. 49, 211-214 (2013).
- Browne, R. K., Li, H., Seratt, J., Kouba, A. Progesterone improves the number and quality of hormone induced Fowler toad (Bufo fowleri) oocytes. Reproductive Biology and Endocrinology. 4 (1), 3(2006).
- Bramucci, M., et al. Different modulation of steroidogenesis and prostaglandin production in frog ovary in vitro by ACE and ANG II. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 273 (6), R2089-R2096 (1997).
- Gobbetti, A., Zerani, M. Possible roles for prostaglandins E2 and F2α in seasonal changes in ovarian steroidogenesis in the frog (Rana esculenta). Journal of Reproduction and Fertility. 98 (1), 27-32 (1993).
- Gobbetti, A., Zerani, M., Carnevali, O., Botte, V. Prostaglandin F2α in female water frog, Rana esculenta: Plasma levels during the annual cycle and effects of exogenous PGF2α on circulating sex hormones. General and Comparative Endocrinology. 80 (2), 175-180 (1990).
- Guillette, L. J. Jr, Dubois, D. H., Cree, A. Prostaglandins, oviducal function, and parturient behavior in nonmammalian vertebrates. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 260 (5), R854-R861 (1991).
- Clulow, J., Mahony, M., Browne, R., Pomering, M., Clark, A. Applications of assisted reproductive technologies (ART) to endangered anuran amphibians. Declines and Disappearances of Australian Frogs'. Campbell, A. , 219-225 (1999).
- Browne, R. K., Wolfram, K., García, G., Bagaturov, M. F., Pereboom, Z. Zoo-based amphibian research and conservation breeding programs. Amphibian and Reptile Conservation. 5 (3), 1-14 (2011).
- Chai, N. Surgery in amphibians. Veterinary Clinics: Exotic Animal Practice. 19 (1), 77-95 (2016).
- Gentz, E. J. Medicine and surgery of amphibians. Ilar Journal. 48 (3), 255-259 (2007).
- Snyder, W. E., Trudeau, V. L., Loskutoff, N. M. 168 a noninvasive, transdermal absorption approach for exogenous hormone induction of spawning in the northern cricket frog, Acris crepitans: a model for small, endangered amphibians. Reproduction, Fertility and Development. 25 (1), 232-233 (2012).
- Kouba, A. J., et al. Emerging trends for biobanking amphibian genetic resources: the hope, reality and challenges for the next decade. Biological Conservation. 164, 10-21 (2013).
- Michael, S. F., Buckley, C., Toro, E., Estrada, A. R., Vincent, S. Induced ovulation and egg deposition in the direct developing anuran Eleutherodactylus coqui. Reproductive Biology and Endocrinology. 2 (1), 6(2004).
- Fort, D. J. Frog reproduction and development study 2000 rana pipiens reproduction and development study. , Environmental Protection Agency. (2003).
- Clulow, J., et al. Differential success in obtaining gametes between male and female Australian temperate frogs by hormonal review: A Review. General and Comparative Endocrinology. 265, 141-148 (2018).
- Trottier, T. M., Armstrong, J. B. Diploid gynogenesis in the Mexican axolotl. Genetics. 83 (4), 783-792 (1976).
- Marcec, R. M. Development of assisted reproductive technologies for endangered North American salamanders. , Mississippi State University. (2016).
- Wright, M. L. Melatonin, diel rhythms, and metamorphosis in anuran amphibians. General and Comparative Endocrinology. 4, (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados