Method Article
Aislamiento de fibroblastos papilares y reticulares de la piel humana mediante la clasificación celular activada por fluorescencia
* Estos autores han contribuido por igual
En este artículo
Resumen
Este manuscrito describe un protocolo basado en FACS para el aislamiento de fibroblastos papilares y reticulares de la piel humana. Elude la cultura in vitro que era inevitable con el protocolo de aislamiento de uso común a través de culturas explantes. Los subconjuntos de fibroblastos que emanan son funcionalmente distintos y muestran la expresión génica diferencial y la localización dentro de la dermis.
Resumen
Los fibroblastos son una población celular altamente heterogénea implicada en la patogénesis de muchas enfermedades humanas. En la dermis cutánea humana, los fibroblastos se han atribuido tradicionalmente a la dermis superficial papilar o reticular inferior según su localización histológica. En la dermis del ratón, los fibroblastos papilares y reticulares proceden de dos linajes diferentes con funciones divergentes en cuanto a procesos fisiológicos y patológicos y un perfil de expresión de marcador de superficie celular diferenciado por el cual pueden distinguirse.
Es importante destacar que la evidencia de cultivos explicativos de capas dérmicas superficiales y más bajas sugieren que al menos dos linajes de fibroblastos dérmicos funcionalmente distintos existen también en la dermis de la piel humana. Sin embargo, a diferencia de la piel del ratón, los marcadores de superficie celular que permiten la discriminación de diferentes subconjuntos de fibroblastos aún no se han establecido para la piel humana. Desarrollamos un nuevo protocolo para el aislamiento de las poblaciones de fibroblastos papilares y reticulares humanos a través de la clasificación celular activada por fluorescencia (FACS) utilizando los marcadores de superficie celular de proteína de activación de fibroblastos (FAP) y el antígeno de thymocyte 1 (Thy1)/CD90. Este método permite el aislamiento de los subconjuntos de fibroblastos puros sin manipulación in vitro, lo que demostró afectar la expresión génica, permitiendo así un análisis funcional preciso de los subconjuntos humanos de fibroblastos en relación con la la homeostasis tisular o la enfermedad Patología.
Introducción
Como el principal componente celular del tejido conectivo, los fibroblastos son principalmente responsables de la deposición de colágeno y fibras elásticas que en última instancia forman la matriz extracelular1, y por lo tanto, su papel en la homeostasis tisular, regeneración y enfermedad se ha subestimado durante mucho tiempo. Sin embargo, los fibroblastos han llegado recientemente bajo el foco de los investigadores, no sólo porque representan una fuente celular prominente para las células madre pluripotentes inducidas2 sino también debido a su alta plasticidad e implicación en la patogénesis de un gran número de enfermedades como la fibrosis orgánica3,4,5 o cáncer6,7.
La piel humana se compone de un epitelio multicapa, la epidermis, y su tejido conectivo subyacente, la dermis, que se puede subdividir histológicamente en el papilar superior y la dermis reticular inferior y se compone principalmente de fibroblastos y matriz extracelular8 y la hipodermis. Según su ubicación dentro del tejido, los fibroblastos dérmicos se han clasificado aproximadamente en fibroblastos papilares y reticulares1.
Es importante destacar que los datos recientes indican que estas subpoblaciones de fibroblastos dérmicos no sólo son distinguibles histológicamente, sino también que su función es considerablemente diversa. En la piel del ratón, los fibroblastos papilares y reticulares surgen de dos linajes distintos durante la embriogénesis9. Varias líneas de evidencia sugieren que los dos linajes ejercen diferentes funciones no sólo en la homeostasis tisular, la morfogénesis del folículo piloso, la reparación de heridas y la fibrosis7,9,10, sino que también responden a diferentes señales de las células madre epidérmicas neoplásicas11, sugiriendo roles divergentes en la patogénesis del cáncer. Convenientemente, ambos linajes expresan un conjunto diferenciado de marcadores celulares mutuamente excluyentes en la piel adulta del ratón, permitiendo así el aislamiento de las poblaciones de fibroblastos dérmicos puros y el análisis extenso subsiguiente de sus funciones específicas in vitro9 , 11.
Correspondientemente, al menos dos subconjuntos de fibroblastos distintos con morfología y funciones distintas, incluyendo tasas de proliferación divergentes, capacidades de remodelación de tejidos12,13, así como la capacidad de apoyar el crecimiento de células madre epidérmicas in vitro, se han descrito para la dermis de la piel humana14,15. Sin embargo, la mayoría de los estudios publicados sobre los fibroblastos dérmicos humanos se han realizado utilizando poblaciones mixtas de fibroblastos aislados de las culturas explicadas de la piel dermatomed, ya que los conjuntos de marcadores de superficie celular específicos que permiten el aislamiento del papilar humano puro o las subpoblaciones de fibroblastos reticulares en analogía con la dermis del ratón aún no se establecieron.
Recientemente hemos demostrado que los fibroblastos papilares y reticulares de la piel humana se caracterizan por marcadores específicos de superficie celular que permiten el aislamiento de las respectivas subpoblaciones a través de la clasificación celular activada por fluorescencia (FACS)16: FAP + CD90- fibroblastos representan fibroblastos papilares localizados principalmente en la dermis superior, presentando mayores tasas de proliferación, una distintiva firma génica pero sin potencial adipogénico. FAP+CD90+ y FAP-CD90+ fibroblastos pertenecen al linaje reticular de los compartimentos dérmicos inferiores, que son menos proliferativos pero se someten fácilmente a la adipogénesis, un sello distintivo para los fibroblastos reticulares. Este método permite estudiar extensamente estas subpoblaciones de fibroblastos distintos no sólo en lo que respecta a sus funciones específicas en condiciones fisiológicas, sino también en el contexto de la patogénesis de enfermedades cutáneas incluyendo el cáncer de piel.
Sin embargo, dado que los fibroblastos alteran su expresión de marcador de superficie celular en la cultura bidimensional in vitro16,17,19, la aplicación de nuestro protocolo se limita al aislamiento de fibroblastos primarios de humanos DermIS y no permite la identificación de fibroblastos papilares o reticulares en poblaciones mixtas de cultivos celulares. Es importante destacar que, aunque la expresión de los marcadores de superficie celular cambia in vitro, hemos demostrado que los subconjuntos de fibroblastos aislados de acuerdo con el protocolo descrito a continuación conservan su funcionalidad específica cuando se cultivan16, permitiendo así estudios in vitro de propiedades específicas de subconjuntos en condiciones fisiológicas o patológicas.
En conclusión, desarrollamos un protocolo para el aislamiento de diferentes subconjuntos de fibroblastos a través de FACS que por primera vez permite el aislamiento de las poblaciones de fibroblastos puros de la dermis de la piel humana en un estado ingenuo.
Protocolo
La piel humana se obtuvo de hombres y mujeres caucásicos de 26 a 61 años (piel protegida por el sol; correcciones abdominales, reducciones de senos). El consentimiento informado por escrito del paciente se obtuvo antes de la recolección de tejidos de acuerdo con la declaración de Helsinki, y con la aprobación de la Junta de revisión institucional de la Universidad médica de Viena.
Nota: Proporcionamos un protocolo para el aislamiento de las subpoblaciones de fibroblastos funcionalmente distintos, ya sea de la dermis de espesor completo (por favor refiérase a la sección 1) o después de seccionar la dermis cutánea humana en sus diferentes capas (omita la sección 1 y refiérase directamente a la sección 2) .
1. preparación de la dermis de espesor completo
- Coloque una pieza de piel humana de 10 cm x 10 cm (p. ej., de correcciones abdominales o reducciones de senos) con la epidermis orientada hacia abajo en papel de filtro grueso.
- Sujete la epidermis firmemente sobre sus bordes con fórceps y raspe la capa de grasa subcutánea con un bisturí. A continuación, cortar el tejido en tiras de 5 mm de ancho antes de ponerlos en una placa de Petri.
Nota: Esto facilita la penetración de dispasa II (referida como enzima disociadora en adelante, ver sección 3) y se utiliza si la epidermis necesita separarse de toda la dermis. Para esta sección de omisión 2, consulte directamente la sección 3. Para evitar la contaminación, mantenga el tejido estéril después de la extirpación quirúrgica o límpielo bien con etanol o solución de yodo. Si en absoluto, el tratamiento con etanol de la superficie de la piel sólo causa muerte celular menor. Trabaje en condiciones estériles en una campana de flujo de cultivo de tejido.
2. seccionamiento de la dermis de la piel humana en capas papilares y reticulares con un dermatoma
- Coloque una pieza de piel de 10 cm x 10 cm (p. ej., de correcciones abdominales o reducciones de senos) en papel de filtro grueso, con la epidermis orientada hacia arriba. Sujete la piel firmemente sobre sus bordes con fórceps.
- Cortar la piel con un dermatoma eléctrico, ajustado a un espesor de corte/profundidad de 300 μm, deslizando la cabeza del dermatoma lejos de uno mismo, con la cuchilla en un ángulo de 90 ° en relación con la superficie de la piel.
- Tomar la primera capa que consiste en la epidermis y la dermis papilar (300 μm de espesor, "capa dérmica 1", figura 1 y figura 2) y ponerlo en una placa de Petri. Proceda inmediatamente a la sección 3 o añada 1x PBS para evitar que el tejido se seque.
Nota: Para evitar la contaminación, mantenga el tejido estéril después de la extirpación quirúrgica o límpielo bien con etanol o solución de yodo. Trabaje en condiciones estériles en una campana de flujo de cultivo de tejido.
PRECAUCIÓN: Maneje el dermatoma cuidadosamente ya que las cuchillas son muy afiladas. - Repita el paso 2,2 ajustando el dermatoma a un espesor de corte de 700 μm y corte la dermis restante. Colocar la rebanada superior que se define como la dermis reticular superior ("capa dérmica 2", figura 2) en una placa de Petri separada. Proceda inmediatamente a la sección 4 o añada 1x PBS para evitar que el tejido se seque.
- Raspe la capa de grasa subcutánea con un bisturí de la capa dérmica reticular inferior residual (> 1000 μm) y deséchelo. Recoger la dermis reticular inferior ("capa dérmica 3", figura 2) en otra placa de Petri. Proceda inmediatamente a la sección 4 o añada 1x PBS para evitar que el tejido se seque.
Nota: Alternativamente, en lugar de extraer la grasa con un bisturí, retire la capa de grasa con tijeras. Puede ayudar a poner la dermis reticular en hielo antes de extraer la grasa de distancia.
3. separación de la epidermis y la dermis
-
Prepare una solución de dessociación de 3 U/mL (es decir, dispasa II) en 1 PBS estéril. Colocar las franjas de piel de 5 mm (de la sección 1), o la epidermis/dermis papilar (del paso 2,2), con la epidermis orientada hacia arriba en una placa de Petri de 10 cm con 10 mL de solución enzimática disociadora de 3 U/mL. Incubar la placa de Petri a 37 ° c durante 1 h.
- El protocolo puede estar en pausa aquí. Incubar la epidermis/dermis papilar en la proteasa en el refrigerador a 4 ° c durante la noche en su lugar. Según sea necesario almacene las otras capas (capa dérmica 1, 2 y 3) durante la noche sumergidas en 1x PBS en tubos de 50 mL a 4 ° c.
PRECAUCIÓN: Trabaje cuidadosamente con la proteasa, puede irritar la piel y los ojos al contacto.
- El protocolo puede estar en pausa aquí. Incubar la epidermis/dermis papilar en la proteasa en el refrigerador a 4 ° c durante la noche en su lugar. Según sea necesario almacene las otras capas (capa dérmica 1, 2 y 3) durante la noche sumergidas en 1x PBS en tubos de 50 mL a 4 ° c.
- Después de la incubación, transfiera la epidermis/dermis papilar a la tapa seca de la placa de Petri y separe la epidermis de la dermis superior (capa dérmica 1) con dos fórceps cada uno sosteniendo el borde de la epidermis o la dermis.
4. digestión enzimática del tejido dérmico
- Mince cada capa dérmica (capa dérmica 1, 2 y 3) por separado con tijeras/bisturí lo más minuciosamente posible; cuanto más pequeñas sean las piezas, mejor será la digestión de los tejidos.
Nota: La dureza de la dermis puede variar dependiendo de la parte del cuerpo de la que proviene (p. ej., piel abdominal o superior del brazo). - Preparar la mezcla de digestión combinando 1,25 mg/mL de collagenasa I, 0,5 mg/mL de collagenasa II, 0,5 mg/mL de colagenasa IV y 0,1 mg/mL de hialuronidasa en el medio de Eagle modificado de Dulbecco (DMEM) con L-glutamina (ver tabla de materiales), 10% suero de ternera fetal ( FCS) y 1% de penicilina/estreptomicina (P/S).
PRECAUCIÓN: Trabaje cuidadosamente con colagenasas, ya que pueden irritar la piel y los ojos al contacto. - Poner cada uno de los tejidos picados con 10 mL de la mezcla de digestión preparada en un tubo de 50 mL e incubar en un baño de agua tibia de 37 ° c durante 1 h bajo agitación permanente. Durante la digestión invierta los tubos varias veces.
Nota: Uno debe considerar ajustar el volumen de digestión de acuerdo con el tamaño de la pieza de piel picada. No sobrecargue la mezcla de 10 mL de digestión con demasiado tejido, de lo contrario el rendimiento de la célula será mínimo. Se recomienda menos de un tercio del tejido dentro del volumen total (1:2 w/v).
5. preparación de la suspensión de célula única y Lysis de eritrocitos
- Detener la digestión del tejido enzimático añadiendo 10 mL de medio de fibroblastos (DMEM con L-glutamina, 10% FCS y 1% P/S) al tejido digerido. Trabaje en hielo desde aquí.
- Vierta el contenido de cada tubo a través de un colador de té inoxidable estéril regular y recoja la suspensión celular en una placa de Petri limpia. Lavar el colador con medio y triturar trozos de tejido no digeridos con el borde de un émbolo de la jeringa.
- Posteriormente, pipetear la suspensión celular a través de un colador de células de 70 μm en un tubo de 50 mL. Enjuague el colador de la célula con el medio y recoja el flujo a través en el mismo tubo.
- Centrifugar los tubos a 500 x g a 4 ° c durante 10 min retirar y desechar el sobrenadante y el lavado de células con 5 ml de medio de fibroblastos. Repita el paso de centrifugación.
- Retire y deseche el sobrenadante y resuspender el pellet en 1 mL de tampón de lisis de eritrocitos ACK autofabricado (0,15 M NH4cl, 10 mm khco3, 0,1 mm na2EDTA; pH 7.2 \ u 20127.4). Dejar las células en el tampón de lisis durante aproximadamente 1 minuto a temperatura ambiente (20 \ u201222 ° c).
- Detener la lisis añadiendo 9 mL de 1x PBS con 10% FCS y centrifugar los tubos de nuevo a 500 x g a 4 ° c durante 5 min. Deseche el sobrenadante.
PRECAUCIÓN: El tiempo de incubación en la lisis de eritrocitos puede ajustarse si la lisis parece incompleta (pellet rojo). Sin embargo, no deje las células en el tampón de lisis de eritrocitos durante demasiado tiempo para evitar la lisis de fibroblastos y células inmunitarias.
6. bloqueo y tinción de fibroblastos para FACS
- Preparar 5 μL de solución de bloqueo del receptor FC en 100 μL de 1x PBS con 10% FCS y células de resuspendio en 100 μL de bloqueador de FC humano. Incubar sobre hielo durante 10 min.
- Diseñe un panel de tinción FACS para teñir los fibroblastos dérmicos humanos. Mezclar el antihumano FAP APC (1:20), anti-Human CD90 AF700 (1:30), E-cadherin PE anti-humano (1:20), anti-humano CD31 FITC (1:30), anti-humano CD45 azul Pacífico (1:20), anti-humano ITGA6 PE (1:20), anti-humano CD235ab Pacific Blue (1:1000) y anti-humano CD106 Pacific azul (1:100) en 1x PBS con 10% FCS.
-
Después del bloqueo del receptor FC, gire las células hacia abajo a 500 x g a 4 ° c durante 3 min, extraiga y deseche el sobrenadante y las células de resuspendio en 100 μl de mezcla de anticuerpos. Incubar las células en la oscuridad a 4 ° c durante 20 min.
- Antes de la tinción, extraiga 20 μL de una muestra con un número alto de células para los controles FACS sin teñir y con una sola mancha.
- Lavar las células manchadas y los controles FACS dos veces con 500 μL 1x PBS con 10% FCS y centrifugar a 500 x g a 4 ° c durante 3 min. Mientras tanto, añadir 4 ′, 6-diamidino-2-Phenylindole (DAPI) a 1x PBS con 10% FCS para hacer una concentración final de 1 μg/mL.
- Extraer y descartar el sobrenadante, las células de resuspendio en 200 μL de solución DAPI y filtrar cada suspensión celular a través de un colador de celda de 70 μm en un tubo FACS de 5 mL.
Nota: Si FACS se va a realizar con retardo, añadir DAPI y filtrar poco antes de grabar.
7. estrategia de compuerta para el aislamiento del subconjunto de fibroblastos dérmicos humanos y FACS
- Registre los controles de citometría de flujo, establezca los ajustes de voltaje correctos y realice la compensación adecuada. Puerta para células individuales y células vivas (DAPI-), azul Pacífico, PE y FITC negativas (CD45-, CD31-, CD235ab-, CD106-, ITGA6- y e-cadherin-) para obtener tres poblaciones de fibroblastos: FAP+ CélulasCD90-, FAP+CD90+ y FAP-CD90+ . Vea la figura 3.
- Clasificar tres subpoblaciones de fibroblastos en tubos de microcentrífuga de tapón de tornillo separados de 1,5 mL rellenos con 350 μL de tampón de lisis para el aislamiento de ARN o rellenos con 350 μL de medio de crecimiento de fibroblastos (véase la tabla de materiales) para el cultivo celular. Invierta los tubos inmediatamente después de la ordenación y coloque los tubos de tampón de lisis en nitrógeno líquido para congelar o poner tubos medios sobre hielo.
PRECAUCIÓN: Prepare el tampón de lisis con 0,1% de b-mercaptoetanol en la campana de humos y evite la inhalación.
8. cultivo de fibroblastos y ensayo de Adipogénesis
- Después de FACS, gire las células hacia abajo a 500 x g durante 3 min a 4 ° c y los números de celda iguales de placa (5000 \ u201210, 000 células/pozo) en medio de crecimiento de fibroblastos (ver la tabla de materiales) en 48-platos de cultivo de células bien. Deje crecer las células hasta alcanzar el 70% de confluencia.
- Añadir 5 μg/mL de insulina, 5 μM de troglitazona, 0,5 mM 3-isobutilo-1-metilxantina (IBMX) y 1 μM de dexametasona a medio de crecimiento de fibroblastos para preparar el medio de diferenciación adipocíta.
- Reemplace el medio de las células cultivadas con medio de diferenciación adipocíta y deje que las células se diferencien durante 14 días. Medio de intercambio después del día 2 con un medio de Adipogénesis reducido que contiene 5 μg/mL de insulina y 5 μM de troglitazona. Reponer el medio cada 3Rd o 4TH día.
- Fije las células con 4% de PFA durante 20 min a temperatura ambiente (20 \ u201222 ° c) en el día de diferenciación 14. Lavar los pozos con 60% de isopropanol y dejar que se evaporen por completo. Mancha las células con 5 mM aceite rojo O (filtro antes de usar) durante 20 min. Lave las células teñidas cuatro veces con agua destilada. Proceda a realizar la microscopía.
PRECAUCIÓN: La PFA es tóxica y dañina. Maneje con cuidado.
Nota: El protocolo se puede pausar aquí. Las células fijas se pueden almacenar en 1x PBS a 4 ° c hasta que se realice la tinción aceite rojo O. Cubra el plato con una película de parafina antes del almacenamiento para evitar la evaporación. - Células de imagen sumergidas en agua con un microscopio invertido a una ampliación de 10x con luz transmitida.
Resultados
En la figura 1se muestra una visión general de los pasos principales para el procesamiento de tejido cutáneo para obtener una suspensión de una sola célula, mostrando la dermatalidades de la piel (figura 1A), diferentes capas dérmicas (figura 1B), eliminación de la grasa subcutánea capa (figura 1C) y la separación de la epidermis y la dermis papilar (Figura 1D), así como los diferentes pasos de la disociación manual y del tejido enzimático (Figura 1E, F). En la figura 2se proporciona un esquema de las tres capas dérmicas.
La figura 3 muestra la estrategia de compuerta de un panel de tinción de citometría de flujo para el análisis de diferentes subconjuntos de fibroblastos de la piel humana. Los marcadores adicionales de la superficie celular que no se expresan en los fibroblastos permiten la exclusión de varias otras células presentes en la piel como las células inmunitarias, las células epidérmicas, las células madre mesenquimales (MSCs), los glóbulos rojos o las células del endotelial para alcanzar la pureza máxima en las poblaciones aisladas. No es fundamental utilizar el panel FACS idéntico utilizado en la figura 2 para la identificación de estas subpoblaciones de fibroblastos, sin embargo, esta es nuestra recomendación. Uno puede utilizar anticuerpos etiquetados con diferentes tintes fluorescentes o alterar la combinación de marcadores de exclusión.
Cabe destacar que este protocolo permite la identificación de tres poblaciones de fibroblastos en la piel humana que presentan diferentes localización intradérmica, perfiles de expresión génica y también funciones (figura 4). FAP+CD90- se enriquecen en la dermis papilar, mientras que la FAP+CD90+ y la FAP-CD90+ son más abundantes en la dermis reticular (figura 4a). Las tres subpoblaciones exhiben la morfología típica de los fibroblastos al clasificar en el cultivo celular (Figura 4B). Curiosamente, difieren en cuanto a su capacidad para diferenciar en adipocitos que es un sello distintivo para los fibroblastos reticulares. Combinando estos resultados con perfiles de expresión génica mediante reacción en cadena de la polimerasa en tiempo real (RT-PCR)16 (figura 4C), que muestra que las células FAP+CD90 expresan altos niveles de marcadores comúnmente atribuidos a fibroblastos papilares como CD26, NTN y PDPN, mientras que las células CD90+ expresan los marcadores reticulares conocidos tales como CD36, ACTA2 y PPARγ a niveles elevados, concluimos que las células CD90de la FAP+pertenecen al papilar y CD90+ células pertenecen al linaje reticular.

Figura 1: aislamiento de la suspensión dérmica de una sola célula de la piel humana intacta. (A) la piel se corta con un dermatoma eléctrico en la dermis papilar y reticular. (B) la dermis papilar con epidermis adyacente es de 300 μm de espesor (arriba) mientras que la dermis reticular superior es de 700 μm de espesor (inferior). (C) la capa de grasa subcutánea es raspada de la dermis reticular inferior con un bisturí. (D) después de la incubación de la dermis papilar en la solución enzimática de disociación a 37 ° c durante 1 h, la epidermis se puede extirpar fácilmente con fórceps. (E) diferentes capas dérmicas se pican con tijeras y se transfieren a una mezcla de digestión enzimática que consiste en colagenasa I, II y IV e hialuronidasa. (F) después de 1 h de disociación a 37 ° c, se detiene la digestión de los tejidos y se vierte la suspensión a través de un colador de té para eliminar las piezas cutáneas no digeridos. (G) la suspensión celular se filtra una vez más a través de un colador de células de 70 μm y se centrifugó a 500 x G a 4 ° c durante 10 min. (H) después de la centrifugación, el pellet de células se lava con 1x PBS con 10% FCS y está listo para la tinción de FACS. Por favor, haga clic aquí para ver una versión más grande de esta figura.
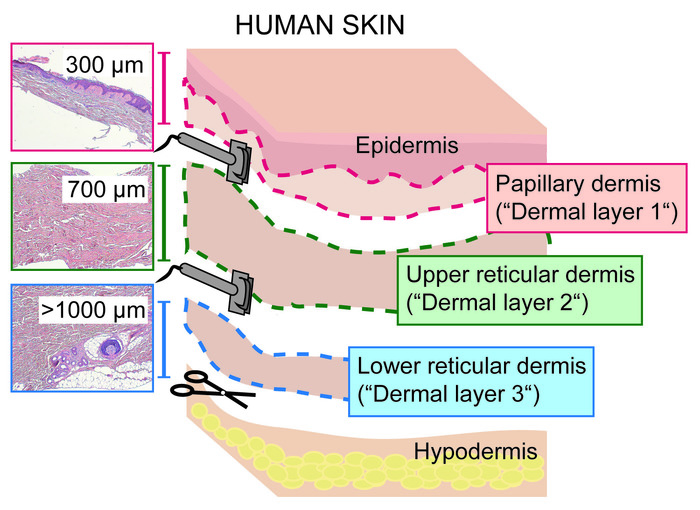
Figura 2: seccionamiento de la dermis cutánea humana en capas papilares y reticulares con un dermatoma. Esquema que muestra las tres capas dérmicas obtenidas cortando la piel de espesor completo en la dermis papilar (incluyendo la epidermis; 0 \ u2012300 μm; capa dérmica 1), reticular superior (300 \ u20121, 000 μm; capa dérmica 2) y dermis reticular inferior (> 1000 μm; capa dérmica 3) con un Dermatome. Por favor, haga clic aquí para ver una versión más grande de esta figura.
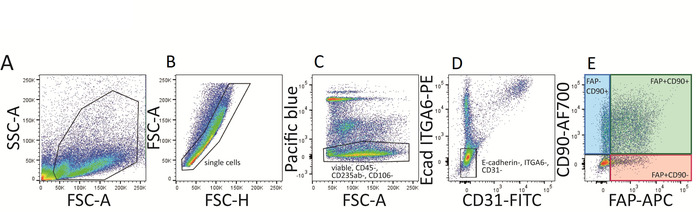
Figura 3: estrategia de compuerta de FACS para subpoblaciones de fibroblastos dérmicos humanos. (A\u2012e) En primer lugar, las celdas se han bloqueado en celdas individuales (B) y viables (DAPI-) (C). Las células inmunitarias (CD45+), las células madre mesenquimales (CD106+), los glóbulos rojos (CD235ab+) se excluyen (C) y las células negativas azules del Pacífico se encuentran más cerradas en E-cadherin (ECAD) y ITGA6 células negativas dobles (canal PE, D ). E-cadherin y ITGA6 son marcadores expresados en células epidérmicas. A continuación, se excluyen las células positivas de CD31-FITC (células endoteliales y linfáticas) (D) que resultan en tres poblaciones de fibroblastos que expresan uno o ambos marcadores de fibroblastos superficiales de células FAP y CD90: FAP+CD90-, FAP+CD90+ y FAP-CD90+ (E). Por favor, haga clic aquí para ver una versión más grande de esta figura.
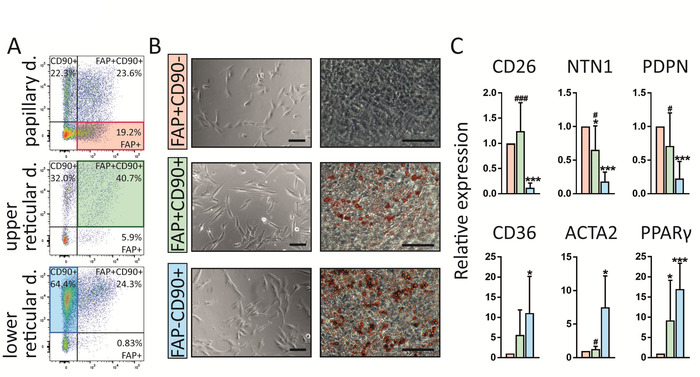
Figura 4: los fibroblastos FAP+CD90-, FAP+CD90+ y FAP-CD90+ difieren en la localización dérmica, la expresión génica y la funcionalidad. (A) tramas FACS representativas de fibroblastos cerados aislados de la dermis papilar, reticular superior y reticular inferior. La estrategia de compuerta se explica en la figura 3. FAP+CD90- fibroblastos se enriquecen en la dermis papilar (19,2%) en comparación con la dermis reticular inferior (0,83%). Las células FAP+CD90+ se pueden encontrar en toda la dermis, pero su mayor abundancia está en la dermis reticular superior (40,7%). La FAP-CD90+ se enriquece en la dermis reticular inferior (64,4%). (B) de nota, las tres subpoblaciones ordenadas muestran la morfología típica de fibroblastos sobre la cultura durante 7 días (izquierda). Curiosamente, se comportan de manera diferente en un ensayo de adipogénesis. Después de 14 días de cultivo, FAP+CD90- no se diferencian en adipocitos mientras que FAP+CD90+ y FAP-CD90+ se someten fácilmente a la adipogénesis (derecha; Aceite rojo O manchas de lípidos en las células rojas). Barras de escala = 1.000 μm. (C) la FAP+CD90- fibroblastos directamente ordenados expresan los marcadores de FIBRBLASTOS PAPILARES CD26, NTN1 y pdpn, mientras que las células FAP-CD90+ expresan CD36, ACTA2 y PPARγ, conocidos por ser expresado por el linaje reticular. * p ≤ 0,05; p ≤ 0,0005 en comparación con las células FAP+/Cd90; # p ≤ 0,05; # # # p ≤ 0,0005 comparado con las células FAP-/CD90+ . Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este artículo, describimos un método para el aislamiento de fibroblastos papilares y reticulares de la piel humana. CD90 ha sido ampliamente utilizado para la identificación o aislamiento de los fibroblastos dérmicos18,20,21. Sin embargo, hemos demostrado que además de los fibroblastos CD90 +, la dermis humana también alberga una poblaciónde CD90- fibroblastos que expresa la FAP16, que se ha establecido como un marcador para los fibroblastos activados y los fibroblastos asociados al cáncer ( CAFS)22,23,24,25. Es importante destacar que hemos sido capaces de identificar tres subpoblaciones de fibroblastos FAP+CD90-, FAP+CD90+ y FAP-CD90+ en biopsias de piel de todos los donantes humanos sanos. Por lo tanto, concluimos que la FAP no es solo un marcador para los fibroblastos activados o los CAFs, sino también los fibroblastos tisulares normales.
Cabe destacar que la población de células FAP-CD90 que queda después de la aplicación de la estrategia de exclusión y de compuerta descrita anteriormente no contiene fibroblastos, ya que estas células no proliferan en el medio de cultivo de fibroblastos in vitro, pero la mayoría probablemente una población celular mixta incluyendo células linfáticos y pericitos entre otros16.
El rendimiento de la célula obtenida mediante el uso del protocolo descrito anteriormente puede variar dependiendo de la parte del cuerpo en la que se origina la pieza de piel utilizada para el aislamiento. La dermis de diferentes partes del cuerpo difiere en cuanto a su estructura, grosor y composición de colágeno. Por ejemplo, la piel de la cara o la parte superior del brazo es mucho más delgada que la piel del vientre o del muslo, que también con frecuencia muestra una capa de grasa subcutánea más gruesa. Además, la edad y el sexo de los donantes de piel pueden no solo afectar la eficiencia de la disociación de los tejidos, sino que también pueden influir en la distribución de las tres subpoblaciones de fibroblastos (figura 3) cuando se aísla de la piel de espesor completo. Esto resulta del hecho de que la dermis papilar se encoge y que los números de fibroblastos totales disminuyen con11,26,27,28años. Además, el pellet celular de la dermis papilar probablemente será mayor que el de la dermis reticular, ya que la dermis superior está densamente poblada por fibroblastos que la dermis reticular. Además, la dermis inferior también es más dura y más densamente embalada con colágeno, lo que dificulta la disociación del tejido y la liberación de los fibroblastos. Cabe destacar que el pellet de células puede aparecer muy rojo, por lo que se recomienda la lisis de los glóbulos rojos.
Además de la identificación de tres subpoblaciones en la piel humana intacta, también mostramos que en la piel dermatomed, cada subconjunto de fibroblastos se enriquece ya sea en la dermis papilar o reticular16. El corte preciso de la piel con el dermatoma es fundamental para obtener un enriquecimiento adecuado de cada subpoblación de diferentes capas dérmicas. Dado que la dermis papilar es muy delgada, la rebanada dermatomed que lo representa no debe exceder un espesor de 300 μm. los fibroblastos reticulares y reticulares superiores representan el linaje reticular y muestran funciones y firmas genéticas similares, por lo tanto, uno también podría considerar no separarlos.
Es importante destacar que las tres poblaciones de fibroblastos se encuentran en toda la dermis y no están presentes exclusivamente en una capa, por lo que las culturas explicadoras de la dermis papilar o reticular resultan en cultivos mixtos de fibroblastos. Sin embargo,los fibroblastos CD90- papillarios son más abundantes en la dermis papilar y siguen un gradiente de las capas dérmicas superficiales a inferiores, mientras que la FAP+CD90+ y la FAP-CD90+ fibroexplosiones siguen una gradiente inverso de las capas inferiores a las superficiales16. Además, la mayoría de los fibroblastos CD90+ de la dermis papilar se encuentran casi exclusivamente alrededor de los vasos sanguíneos y expresan el marcador perivasculares de fibroblastos CD14629, y por lo tanto probablemente exhiben diferentes funciones que el fibroblastos CD146- reticulares restantes16. CD146 podría ser utilizado como un marcador adicional en la estrategia de compuerta para excluir a esta población.
Después de la disociación de las capas dérmicas, las células aisladas se tiñen con un cóctel de anticuerpos especialmente diseñado que contiene varios anticuerpo para la exclusión de células inmunitarias, células endoteliales y linfásicas, células epidérmicas, eritrocitos y MSC para obtener poblaciones de fibroblastos puros. De nota, elegir un marcador para la identificación y exclusión de MSCS puede ser complicado debido al alto número de marcadores de MSC publicados30,31. Dado que los MSCs expresan CD90 como los fibroblastos, los marcadores MSC adicionales como CD105 o CD271 podrían resultar útiles para su identificación. Sin embargo, los MSCs solo representan un porcentaje muy bajo de todas las células dérmicas y, puesto que los fibroblastos CD90+ muestran rasgos morfológicos típicos de los fibroblastos tras la clasificación, se podría argumentar que la exclusión de los MSC mediante el uso de marcadores de superficie celular distintos podría ser innecesario.
Es importante destacar que analizamos la expresión génica FAP y CD90 después de mantener las células en la cultura durante 7-14 días después de la clasificación (datos no mostrados) y descubrimos que la expresión de ambos marcadores se alza en el respectivo único positivo ordenado (FAP+CD90- o FAP-CD90+) células16. Por lo tanto, destacamos que los conjuntos de marcadores y el protocolo descritos anteriormente permiten el aislamiento de los fibroblastos primarios que se subestablecen directamente del tejido, pero no de las poblaciones de fibroblastos mixtos previamente cultivadas.
Sin embargo, demostramos que la funcionalidad de las tres subpoblaciones se retiene en el cultivo celular independientemente de la alteración de la expresión de marcador de superficie celular, yaque los fibroblastos clasificados como los fibroblastos CD90- papillarios no adquirir la capacidad de someterse a la adipogénesis después de un período más largo de la cultura, mientras que los fibroblastos clasificados como FAP+CD90+ o FAP-CD90+ los fibroblastos reticulares mantienen su capacidad para diferenciar en adipocitos 16 . Lo que es más importante, también descubrimos que los genes papilares y reticulares específicos todavía se expresan en mayor medida en FAP+CD90- y CD90+ respectivamente.
En conclusión, hemos establecido un protocolo para el aislamiento de subconjuntos de fibroblastos funcionalmente distintos a través de FACS que por primera vez permite el aislamiento y análisis de subpoblaciones de fibroblastos puros e ingenuos de la dermis de la piel humana. Este método establece un avance importante para el protocolo de aislamiento de cultivo de fibroblastos comúnmente utilizado de la dermis superior e inferior como (i) un gradiente opuesto de fibroblastos papilares y reticulares existe desde la superficie de la piel a la hipodermis y (II) los fibroblastos cambian su firma génica in vitro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Reconocemos con gratitud la asistencia en FACS-clasificación por Bärbel Reininger y Wolfgang Bauer. Este trabajo fue apoyado por becas a b. m. l. del fondo científico austriaco (FWF: V 525-B28), y la Federación de sociedades bioquímicas europeas (FEBS, Fondo de investigación de seguimiento). S. f. es beneficiario de una beca de doctorado de la Academia Austriaca de Ciencias (OeAW). Reconocemos con gratitud el excelente apoyo de las principales instalaciones de la Universidad médica de Viena. Agradecemos a Bernhard Gesslbauer, Christine Radtke y Martin Vierhapper por proporcionar material para la piel humana.
Materiales
| Name | Company | Catalog Number | Comments |
| Material: | |||
| 3-isobutyl-1-methylxanthine | Sigma | I5879 | |
| Ammonium chloride | Sigma | 9718 | used for selfmade ACK Lysis Buffer |
| Amniomax-C100 (1x) Basal Medium | Gibco | 17001-074 | used for fibroblast growth medium |
| β-Mercaptoethanol | Scharlau | ME0095 | ! CAUTION |
| C100 Supplement | Thermo Scientific | 12556015 | used for fibroblast growth medium |
| Collagenase I | Thermo Scientific | 17100017 | ! CAUTION |
| Collagenase II | Gibco | 17101015 | ! CAUTION |
| Collagenase IV | Sigma | C5138 | ! CAUTION |
| DAPI | Thermo Scientific | 62248 | |
| Dexamethasone | Sigma | D8893 | |
| Dispase II | Roche | 4942078001 | ! CAUTION |
| Dulbecco‘s Modified Eagle Medium + GlutaMAX | Gibco | 31966-021 | |
| EDTA disodium salt | Sigma | E1644 | used for selfmade ACK Lysis Buffer |
| Fetal bovine serum (heat inactivated) | Gibco | 10500-064 | |
| Hyaluronidase | Sigma | H4272 | ! CAUTION |
| Insulin | Sigma | I5500 | |
| Isopropanol | Merck | 1,096,341,011 | |
| OilRed O | Sigma | O-0625 | |
| Paraformaldehyd | Sigma | 158127 | ! CAUTION Cancerogenic. Skin and eye irritant. Handle with care. |
| Penicillin/Streptomycin | Gibco | 15070-063 | |
| Phosphate-buffered saline without Ca++ & Mg++ | Lonza | BE17-512F | |
| Potassium bicarbonate | Sigma | 237205 | used for selfmade ACK Lysis Buffer |
| PureLink RNA MicroKit | Invitrogen | 12183-016 | |
| SuperScript III First-Strand Synthesis SuperMix for qRT-PCR | Invitrogen | 11752 | |
| Taqman 2xUniversal PCR Master Mix | Applied Biosystems | 4324018 | ! CAUTION Skin and eye irritant. |
| Troglitazone | Sigma | T2573 | |
| Name | Company | Catalog Number | Comments |
| Flow cytometry Antibodies: | |||
| anti human CD31-AF488 | Biolegend | 303109 | Dilution: 1:30, Lot: B213986, RRID: AB_493075 |
| anti human CD45-Pacific blue | Biolegend | 304029 | Dilution: 1:20, Lot: B218608, RRID: AB_2174123 |
| anit human CD49f/ITGA6-PE | Serotec | MCA699PE | Dilution: 1:20, Lot: 0109, RRID: AB_566833 |
| anti human CD90/Thy-1-AF700 | Biolegend | 328120 | Dilution: 1:30, Lot: B217250, RRID: AB_2203302 |
| anti human CD106-AF421 | BD | 744309 | Dilution: 1:100, Lot: 7170537, RRID: x |
| anti human CD235ab-Pacific blue | Biolegend | 306611 | Dilution: 1:1000, Lot: B224563, RRID: AB_2248153 |
| anti-human E-cadherin-PE | Biolegend | 147304 | Dilution: 1:20, Lot: B197481, RRID: AB_2563040 |
| anti human FAP-APC | R&D | FAB3715A | Dilution: 1:20, Lot: AEHI0117111, RRID: x |
| Human TruStain FcX | Biolegend | 422302 | Dilution: 1:20, Lot: B235080, RRID: x |
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| 1.4 mL micronic tubes | Thermo Scientific | 4140 | |
| 1.5 mL screw cap micro tube | Sarstedt | 72,692,405 | |
| 5 mL Polystyrene Round Bottom Tube with cell strainer cap | Falcon | 352235 | |
| 48-well cell culture cluster | Costar | 3548 | |
| 50 mL polypropylene canonical tubes | Falcon | 352070 | |
| 70 µm cell strainer nylon | Falcon | 352350 | |
| Aesculap Acculan 3Ti Dermatome | VWR | AESCGA670 | |
| Aesculap Dermatome blades | VWR | AESCGB228R | |
| MicroAmp Fast Optical 96well | Applied Biosystems | 4346906 | |
| Primary cell culture dish | Corning | 353803 | |
| Scalpel blades | F.S.T | 10022-00 | |
| Tea strainer | x | x | |
| Name | Company | Catalog Number | Comments |
| Fibroblast growth medium: | |||
| AmnioMAX basal medium with AmnioMAX C-100 Supplement, 10 % FCS and 1 % P/S |
Referencias
- Sorrell, J. M., Caplan, A. I. Fibroblast heterogeneity: more than skin deep. Journal of Cell Science. 117 (Pt 5), 667-675 (2004).
- Lowry, W. E., et al. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proceedings of the National Academy of Sciences of the United States of America. 105 (8), 2883-2888 (2008).
- Kisseleva, T. The origin of fibrogenic myofibroblasts in fibrotic liver. Hepatology. 65 (3), 1039-1043 (2017).
- LeBleu, V. S., et al. Origin and function of myofibroblasts in kidney fibrosis. Nature Medicine. 19 (8), 1047-1053 (2013).
- Travers, J. G., Kamal, F. A., Robbins, J., Yutzey, K. E., Blaxall, B. C. Cardiac Fibrosis: The Fibroblast Awakens. Circulation Research. 118 (6), 1021-1040 (2016).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6 (5), 392-401 (2006).
- Rinkevich, Y., et al. Skin fibrosis. Identification and isolation of a dermal lineage with intrinsic fibrogenic potential. Science. 348 (6232), (2015).
- Abhishek, S., Palamadai Krishnan, S. Epidermal Differentiation Complex: A Review on Its Epigenetic Regulation and Potential Drug Targets. Cell Journal. 18 (1), 1-6 (2016).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Mastrogiannaki, M., et al. beta-Catenin Stabilization in Skin Fibroblasts Causes Fibrotic Lesions by Preventing Adipocyte Differentiation of the Reticular Dermis. Journal of Investigative Dermatology. 136 (6), 1130-1142 (2016).
- Lichtenberger, B. M., Mastrogiannaki, M., Watt, F. M. Epidermal beta-catenin activation remodels the dermis via paracrine signalling to distinct fibroblast lineages. Nature Communications. 7, 10537 (2016).
- Harper, R. A., Grove, G. Human skin fibroblasts derived from papillary and reticular dermis: differences in growth potential in vitro. Science. 204 (4392), 526-527 (1979).
- Hiraoka, C., et al. Two clonal types of human skin fibroblasts with different potentials for proliferation and tissue remodeling ability. Journal of Dermatological Science. 82 (2), 84-94 (2016).
- Higgins, C. A., et al. Multifaceted role of hair follicle dermal cells in bioengineered skins. Br Journal of Dermatology. 176 (5), 1259-1269 (2017).
- Korosec, A., Lichtenberger, B. M., Marques, A. P., Pirraco, R. P., Cerqueira, M., Reis, R. L. Ch. 12. Skin Tissue Models. , 279-301 (2017).
- Korosec, A., et al. Lineage identity and location within the dermis determine the function of papillary and reticular fibroblasts in human skin. Journal of Investigative Dermatology. , (2018).
- Higgins, C. A., Chen, J. C., Cerise, J. E., Jahoda, C. A., Christiano, A. M. Microenvironmental reprogramming by three-dimensional culture enables dermal papilla cells to induce de novo human hair-follicle growth. Proceedings of the National Academy of Sciences of the United States of America. 110 (49), 19679-19688 (2013).
- Philippeos, C., et al. Spatial and Single-Cell Transcriptional Profiling Identifies Functionally Distinct Human Dermal Fibroblast Subpopulations. Journal of Investigative Dermatology. 138 (4), 811-825 (2018).
- Walmsley, G. G., et al. Live fibroblast harvest reveals surface marker shift in vitro. Tissue Engineering Part C: Methods. 21 (3), 314-321 (2015).
- Jiang, D., Rinkevich, Y. Defining Skin Fibroblastic Cell Types Beyond CD90. Frontiers in Cell and Developmental Biology. 6, 133 (2018).
- Sorrell, J. M., Caplan, A. I. Fibroblasts-a diverse population at the center of it all. International Review of Cell and Molecular Biology. , 161-214 (2009).
- Huang, Y., et al. Isolation of Fibroblast-Activation Protein-Specific Cancer-Associated Fibroblasts. BioMed Research International. 2017, 4825108 (2017).
- Jiang, G. M., et al. The application of the fibroblast activation protein alpha-targeted immunotherapy strategy. Oncotarget. 7 (22), 33472-33482 (2016).
- Pure, E., Blomberg, R. Pro-tumorigenic roles of fibroblast activation protein in cancer: back to the basics. Oncogene. 37 (32), 4343-4357 (2018).
- Hamson, E. J., Keane, F. M., Tholen, S., Schilling, O., Gorrell, M. D. Understanding fibroblast activation protein (FAP): substrates, activities, expression and targeting for cancer therapy. PROTEOMICS – Clinical Applications. 8 (5-6), 454-463 (2014).
- Gilchrest, B. A. A review of skin ageing and its medical therapy. Br Journal of Dermatology. 135 (6), 867-875 (1996).
- Gilchrest, B. A., Krutmann, J. . Skin Aging. , 198 (2006).
- Makrantonaki, E., Zouboulis, C. C. Molecular mechanisms of skin aging: state of the art. Annals of the New York Academy of Sciences. 1119, 40-50 (2007).
- Crisan, M., et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell. 3 (3), 301-313 (2008).
- Kundrotas, G. Surface markers distinguishing mesenchymal stem cells from fibroblasts. Acta Medica Lituanica. 19 (2), 75-79 (2012).
- Lupatov, A. Y., Vdovin, A. S., Vakhrushev, I. V., Poltavtseva, R. A., Yarygin, K. N. Comparative analysis of the expression of surface markers on fibroblasts and fibroblast-like cells isolated from different human tissues. Bulletin of Experimental Biology and Medicine. 158 (4), 537-543 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados