Method Article
Isolierung von papillären und retikulären Fibroblasten aus der menschlichen Haut durch Fluoreszone-aktivierte Zellsortierung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt ein FACS-basiertes Protokoll zur Isolierung von papillären und Netzfibroblasten von der menschlichen Haut. Sie umgeht in der vitro-Kultur, die mit dem häufig verwendeten Isolationsprotokoll über Explantationskulturen unvermeidlich war. Die ausstrahlenden fibroblasten Untersätze sind funktional unterscheidbar und zeigen eine differenzierte Genexpression und Lokalisierung innerhalb der Dermis.
Zusammenfassung
Fibroblasten sind eine sehr heterogene Zellpopulation, die in die Pathogenese vieler menschlicher Krankheiten verwickelt ist. In der menschlichen Hautdermis werden Fibroblasten traditionell der oberflächlichen Papillar-oder unteren Netzhaut entsprechend ihrer histologischen Lokalisierung zugeschrieben. In der Maus kommen die Papillar-und Netzfibroblasten aus zwei verschiedenen Linien mit unterschiedlichen Funktionen in physiologischen und pathologischen Prozessen und einem ausgeprägten Oberflächenmarkerausdruckprofil, mit dem sie sich unterscheiden lassen.
Wichtig ist, dass Hinweise aus Explantingskulturen aus oberflächlichen und unteren dermalen Schichten darauf hindeuten, dass es in der menschlichen Hauthaut auch mindestens zwei funktionell unterschiedliche dermale Fbroblasten gibt. Im Gegensatz zur Maus sind jedoch die Oberflächenmarker, die die Diskriminierung verschiedener Fibroblast-Untersätze ermöglichen, für die menschliche Haut noch nicht etabliert. Wir haben ein neuartiges Protokoll zur Isolierung von menschlichen Papillar-und Netzfaserpopulationen über fluoreszenzaktivierte Zellsortierung (FACS) entwickelt, bei dem die beiden Zelloberflächenmarker Fibroblast-Aktivierungs-Protein (FAP) und Thymocyte antigen 1 (Thy1)/CD90 verwendet werden. Diese Methode ermöglicht die Isolierung von reinen Fibroblast-Untergruppen ohne In-vitro-Manipulation, die nachweislich die Genexpression beeinflussen, wodurch eine genaue funktionelle Analyse menschlicher dermal fibrobbest-Untergruppen in Bezug auf Gewebehomeostasis oder-erkrankung ermöglicht wird. die Pathologie.
Einleitung
Als Hauptbestandteil des Bindegewebes sind Fibroblasten in erster Linie für die Ablagerung von Kollagen und elastischen Fasern verantwortlich, die letztlich die extrazelluläre Matrix 1 bilden, und damit ihre Rolle in der Gewebehomanose,Regeneration und Krankheit wurde lange unterschätzt. Allerdings sind Fibroblasten in letzter Zeit unter das Rampenlicht der Forscher geraten, nicht nur, weil sie eine prominente zelluläre Quelle für induzierte pluripotente Stammzellen2 darstellen, sondern auch wegen ihrer hohen Plastizität und Implikation in die Pathogenese der Eine Vielzahl von Krankheiten wie Organfibrose3,4,5 oder Krebs6,7.
Die menschliche Haut besteht aus einem vielschichtigen Epithel, der Epidermis, und dem darunter liegenden Bindegewebe, der Dermis, die histologisch in die obere Papillare und die untere Netzhaut unterteilt werden kann und hauptsächlich aus Fibroblasten besteht und extrazelluläre Matrix8 und die Hypodermis. Entsprechend ihrer Lage innerhalb des Gewebes wurden derbe Fibroblasten grobinpapillare und Netzfibroblasten eingeteilt 1.
Wichtig ist, dass diese derben fibrobgebranischen Unterpopulationen nicht nur histologisch unterscheidbar sind, sondern auch erheblich unterschiedlich funktionieren. In der Maus entstehen Papillar-und Netzfibroblasten aus zwei unterschiedlichen Linien während der Embryogenese 9. Mehrere Beweislinien deuten darauf hin, dass die beiden Linien nicht nur in der Gewebehraomose, der Haarfollikel Morphogenese, der Wundreparatur und der Fibrose7,9,10unterschiedlicheRollenspielen, sondern auch auf unterschiedliche Signale aus neoplastischen epidermalen Stammzellen11, die auf divergierende Rollen bei der Krebserkrankung hindeuten. Bequem drücken beide Linien eine deutliche Reihe von sich gegenseitig ausschließenden Zellmarkern in der erwachsenen Maus aus, wodurch die Isolierung reiner dermal Fibroblastpopulationen und die anschließende umfassende Analyse ihrer spezifischen Funktionen in vitro 9 möglich ist. , 11. November
Entsprechend sind mindestens zwei verschiedene Faserblast-Untergruppen mit unterschiedlichen Morphologie und Funktionen, einschließlich divergierender Promillungsraten, Gewebeumbaukapazitäten 12, 13,sowiedie Fähigkeit, das Wachstum von Epidermale Stammzellen in vitro wurden für menschliche Hautdermis 14,15beschrieben. Die meisten der veröffentlichten Studien über die derben Fibroblasten des Menschen wurden jedoch mit gemischten Fibroblast-Populationen durchgeführt, die von den Explantationskulturen aus der entarteten Haut isoliert sind, da spezifische Zelloberflächenmarker die Isolierung von reinem menschlichen Papillarsatz ermöglichen. Oder Netzfaser-Subpopulationen in Analogie zur Maus-Dermis waren noch nicht etabliert.
Wir haben vor kurzem gezeigt, dass menschliche Hautpapillare und Netzfibroblasten durch spezifische Oberflächenmarker gekennzeichnet sind, die die Isolierung der jeweiligen Unterpopulationen durch fluoreszenzaktivierte Zellsortierung (FACS)16: FAP ermöglichen. + CD90- Fibroblasten repräsentieren Papillabonisten, die sich in erster Linie in der oberen Dermis befinden und eine höhere Proliferationsrate aufweisen, eine deutliche Gen-Signatur, aber kein adipogenes Potenzial. FAP+CD90 + und FAP-CD90 + Fibroblasten gehören zur Netzlinie der unteren dermalen Fächer, die weniger proliferativ sind, aber leicht einer Adipogenese unterzogen werden — ein Markenzeichen für Netzfibroblasten. Diese Methode ermöglicht es, diese unterschiedlichen fibroblast Subpopulationen nicht nur im Hinblick auf ihre spezifischen Funktionen unter physiologischen Bedingungen, sondern auch im Zusammenhang mit der Pathogenese von Hautkrankheiten einschließlich Hautkrebs umfassend zu untersuchen.
Da Fibroblasten jedoch ihren Zelloberflächenmarker-Ausdruck in zweidimensionaler In-vitro-Kultur16,17, 19 verändern,beschränktsich die Anwendung unseres Protokolls auf die Isolierung von Primärfibroblasten vom Menschen Dermis und erlaubt nicht die Identifizierung von Papillar-oder Netzfibroblasten in Mischzellkultur-Populationen. Wichtig ist, dass die nach dem unten beschriebenen Fibroblast-Untersätze, obwohl sich die Verwendung von Zelloberflächenmarkern in vitro ändert, ihre spezifische Funktionalität bei der Kultivierung16behalten, wodurch sie In vitro-Studien von subsetspezifischen Eigenschaften unter physiologischen oder pathologischen Bedingungen.
Abschließend haben wir über FACS ein Protokoll zur Isolierung von verschiedenen Fibroblast-Sharatoren entwickelt, das zum ersten Mal die Isolierung reiner Fibroblastpopulationen von menschlichen Hautermis in einem naiven Zustand ermöglicht.
Protokoll
Die menschliche Haut wurde von kaukasischen Männern und Frauen im Alter von 26 bis 61 Jahren gewonnen (sonnengeschützte Haut; Bauchkorrekturen, Brustverkleinerung). Vor der Gewebeentnahme gemäß der Deklaration von Helsinki und mit Zustimmung des Institutionellen Prüfungsausschusses der Medizinischen Universität Wien wurde vor der Gewebeentnahme eine schriftliche Einwilligung eingeholt.
NOTE: Wir stellen ein Protokoll zur Isolierung von funktionell unterschiedlichen Fibroblast-Unterpopulationen entweder aus voller Dicke (siehe Abschnitt 1) oder nach der Aufteilung der menschlichen Hautdermis in ihre verschiedenen Schichten (Beispiel 1 und direkt auf Abschnitt 2) zur Verfügung. .
1. Vorbereitung der Volldicke Dermis
- Legen Sie ein 10 cm x 10 cm menschliches Hautstück (z.B. von Bauchkorrekturen oder Brustverkleinerung) mit der Epidermis nach unten auf dickes Filterpapier.
- Halten Sie die Epidermis mit Zangen fest an den Rändern und kratzen Sie die subkutane Fettschicht mit einem Skalpell ab. Anschließend das Gewebe in 5 mm breite Streifen schneiden und in eine Petrischale geben.
NOTE: Dies erleichtert das Eindringen von Dispase II (von nun an als dissoziierendes Enzym bezeichnet, siehe Abschnitt 3) und wird verwendet, wenn die Epidermis von der gesamten Dermis getrennt werden muss. Dazu überspringen Sie Abschnitt 2 und beziehen sich direkt auf Abschnitt 3. Um Verunreinigungen zu vermeiden, halten Sie das Gewebe nach der chirurgischen Entfernung steril oder reinigen Sie es gründlich mit Ethanol oder Jodlösung. Wenn überhaupt, führt die Ethanolbehandlung der Hautoberfläche nur zu einem geringen Zelltod. Arbeiten Sie unter sterilen Bedingungen in einer Gewebekultur Strömungshaube.
2. Aufteilung der menschlichen Haut Dermis in papilläre und retikuläre Schichten mit einem Dermatom
- Legen Sie ein 10 cm x 10 cm hautiges Stück (z.B. von Bauchkorrekturen oder Brustverkleinerung) auf dickes Filterpapier, wobei die Epidermis nach oben gerichtet ist. Halten Sie die Haut mit Zangen fest an den Rändern.
- Schneiden Sie die Haut mit einem elektrischen Dermatom, das auf eine Schnittdicke von 300 μm eingestellt ist, indem Sie den Kopf des Dermatoms von sich selbst wegschieben, wobei die Klinge in einem 90 °-Winkel in Relation zur Hautoberfläche ist.
- Nehmen Sie die erste Schicht, bestehend aus Epidermis und papillare Dermis (300 μm dick, "Dermal-Schicht 1", Abbildung 1 und Abbildung 2) und legen Sie sie in eine Petrischale. Gehen Sie sofort zu Abschnitt 3 oder fügen Sie 1x PBS hinzu, um das Gewebe vor dem Austrocknen zu bewahren.
NOTE: Um Verunreinigungen zu vermeiden, halten Sie das Gewebe nach der chirurgischen Entfernung steril oder reinigen Sie es gründlich mit Ethanol oder Jodlösung. Arbeiten Sie unter sterilen Bedingungen in einer Gewebekultur Strömungshaube.
CAUTION: Handling Dermatome sorgfältig, da die Klingen sehr scharf sind. - Wiederholungsschritt 2.2 Einstellung des Dermatoms auf eine Schnittdicke von 700 μm und Scheibe der restlichen Dermis. Die obere Scheibe, die als obere Netzhaut ("Dermalschicht 2", Abbildung 2) definiert ist, ineine separate Petrischale legen. Gehen Sie sofort zu Abschnitt 4 oder fügen Sie 1x PBS hinzu, um das Gewebe vor dem Austrocknen zu bewahren.
- Die subkutane Fettschicht mit einem Skalpell aus der niederen Netzhaut gt;1,000 abkratzen und abwerfen. Sammeln Sie die untere Netzhaut ("Dermal-Schicht 3", Abbildung 2) in einer anderen Petrischale. Gehen Sie sofort zu Abschnitt 4 oder fügen Sie 1x PBS hinzu, um das Gewebe vor dem Austrocknen zu bewahren.
NOTE: Alternativ kann man die Fettschicht mit einer Schere entfernen, anstatt das Fett mit einem Skalpell abkratzen. Es kann helfen, die Netzhaut auf Eis zu legen, bevor das Fett wegkratzt.
3. Trennung von Epidermis und Dermis
-
Bereiten Sie eine 3 U/mL Dissoziation Enzym (d.h., Dispase II) Lösung in sterile 1x PBS. Die 5-mm-Hautstreifen (ab Abschnitt 1) oder die Epidermisches (ab Schritt 2.2) platzieren, wobei die Epidermis in einer 10 cm großen Petrischale mit 10 mL von 3 U/mL dissoziating enzym solution nach oben gerichtet ist. Die Petrischale bei 37 ° C für 1 Stunde anfulieren.
- Das Protokoll kann hier pausiert werden. Inkubate Epidermis/papilläre Dermis in Protease im Kühlschrank bei 4 ° C über Nacht. Je nach Bedarf lagern die anderen Schichten (Dermal-Schicht 1, 2 und 3) über Nacht in 1x PBS in 50 mL-Rohren bei 4 ° C eingetaucht.
CAUTION: Arbeiten Sie sorgfältig mit Protease, kann es Haut und Augen beim Kontakt reizen.
- Das Protokoll kann hier pausiert werden. Inkubate Epidermis/papilläre Dermis in Protease im Kühlschrank bei 4 ° C über Nacht. Je nach Bedarf lagern die anderen Schichten (Dermal-Schicht 1, 2 und 3) über Nacht in 1x PBS in 50 mL-Rohren bei 4 ° C eingetaucht.
- Nach der Inkubation die Epidermisches auf den trockenen Deckel der Petrischale übertragen und die Epidermis von der oberen Dermis (Dermalschicht 1) mit zwei Zangen mit jeweils zwei Zangen mit jeweils der Epidermis oder der Dermis trennen.
4. Enzymatische Verdauung von Dermal Tissue
- Jede dermale Schicht (Dermal Layer 1, 2 und 3) separat mit Szissors/Skalpell möglichst gründlich abbilden; Je kleiner die Stücke, desto besser ist die Gewebeverdauung.
NOTE: Die Zähigkeit der Dermis kann je nach Körperteil variieren, aus dem sie stammt (z.B. Bauch-oder Oberarmhaut). - Bereiten Sie die Verdauungsmischung durch die Kombination von 1,25 mg/mL Kollagenase I, 0,5 mg/mL Kollagenase II, 0,5 mg/mL Kollagenase IV und 0,1 mg/mL hyaluronidase in Dulbecco es modifiziertem Eagle-Medium (DMEM) mit L-Glutamin (siehe Materialtabelle), 10% fetales Kalbsserum ( FCS) und 1% penicillin/streptomycin (P/S).
CAUTION: Arbeiten Sie sorgfältig mit Kollagenasen, da diese Haut und Augen beim Kontakt reizen können. - Jedes der gehackten Gewebe mit 10 ml der vorbereiteten Verdauung in ein 50 mL Rohr geben und in einem 37 ° C warmen Wasserbad für 1 h unter permanenter Agitation inkubieren. Bei der Verdauung werden die Rohre mehrmals umgedreht.
NOTE: Man sollte sich überlegen, das Verdauungsvolumen an die Größe des gehackten Hautstücks anzupassen. Nicht überlastet 10 mL Verdauung mit zu viel Gewebe, sonst ist der Zellertrag minimal. Weniger als ein Drittel des Gewebes innerhalb des Gesamtvolumens wird empfohlen (1:2 w/v).
5. Zubereitung von Single Cell Suspension und Erythrocyte Lysis
- Stoppen Sie die enzymatische Gewebeverdauung, indem Sie dem verdaunten Gewebe 10 mL Fibroblast-Medium (DMEM mit L-Glutamin, 10% FCS und 1% P/S) hinzufügen. Arbeiten Sie von hier aus auf Eis.
- Gießen Sie den Inhalt jedes Rohres durch einen regelmäßigen sterilen Edelstrosten-Tee-Sieb und sammeln Sie die Zellaufhängung in einer sauberen Petrischale. Waschen Sie das Sieb mit mittleren und mash unverdaute Gewebe Stücke mit der Kante eines Spinnens Kolben.
- Anschließend sammelte Pipette die Zellaufhängung durch einen 70 μm-Zellglane in ein 50 mL Rohr. Spülen Sie das Zellstrainer mit Medium und sammeln Sie Durchfluss in die gleiche Röhre.
- Zentrifugenröhren bei 500 x g bei 4 ° C für 10 min. Wiederholen Sie den Zentrifugationsschritt.
- Entfernen und verwerfen Sie das Pellet in 1 mL selbstgebauten ACK Erythrozyten-Lyse-Puffer (0,15 M NH4Cl, 10 mM KHCO 3, 0,1 mM Na2EDTA; pH 7.2\u20127.4). Lassen Sie Zellen im Lysepuffer für ca. 1 min bei Umgebungstemperatur (20\u201222 ° C).
- Stoppen Sie die Lyse, indem Sie 9 ml von 1x PBS mit 10% FCS und Zentrifuge die Rohre wieder bei 500 x g bei 4 ° C für 5 min. Discard den Supernatant.
CAUTION: Die Inkubationszeit in der Erythrozyten-Lyse kann angepasst werden, wenn die Lyse unvollständig erscheint (rotes Pellet). Lassen Sie die Zellen jedoch nicht zu lange in der Erythrozyten-Lyse-Puffer, um die Lyse von Fibroblasten und Immunzellen zu vermeiden.
6. Blockieren und Staining Fibroblasten für FACS
- Bereiten Sie 5 μL der menschlichen FC-Rezeptor-Blockierlösung in 100 μL von 1x PBS mit 10% FCS und wiederbelebten Zellen in 100 μL des menschlichen FC-Blockers vor. Auf Eis 10 min inkubieren.
- Entwerfen Sie eine FACS-Färtentafel, um die derben Fibroblasten der Menschen zu beflecken. Mix anti-human FAP APC (1:20), anti-human CD90 AF700 (1:30), Antimentsfeindliche E-cadherin PE (1:20), menschenfeindliche CD31 FITC (1:30), menschenfeindliche CD45 Pazifik-Blau (1:20), menschenfeindliche ITGA6 PE (1:20), menschenfeindliche CD235ab Pazifik-Blau (1:1000) und menschenfeindliche CD106 Pazifik Blau (1:100) in 1x PBS mit 10% FCS.
-
Nach der Fc-Refeld-Sperrblockade drehen Sie die Zellen bei 500 x g bei 4 ° C für 3 min ab. Entfernen und werfen Sie die übernatürlichen Zellen ab und verteilen Sie sie in 100 μL Antikörper-Mischung. Die Zellen im Dunkeln bei 4 ° C 20 min umspulen.
- Entfernen Sie vor der Färbung 20 μL einer Probe mit einer hohen Zellnummer für unbefleckte und einzelne Flecken-FACS-Kontrollen.
- Waschen Sie die gebeizten Zellen und FACS steuert zweimal mit 500 μL 1x PBS mit 10% FCS und Zentrifuge bei 500 x g bei 4 ° C für 3 min. In der Zwischenzeit 4 ', 6-diamidino-2-Phenylindole (DAPI) zu 1x PBS mit 10% FCS hinzufügen, um eine endgültige Konzentration von 1 μg/mL zu machen.
- Entfernen und werfen Sie supernatant, erneuern Sie Zellen in 200 μL DAPI-Lösung und filtern Sie jede Zellaufhängung durch einen 70 μm-Zellgilum in ein 5-ML-FACS-Rohr.
NOTE: Wenn FACS mit Verzögerung durchgeführt werden soll, fügen Sie DAPI hinzu und filtern Sie kurz vor der Aufnahme.
7. Gating Strategy for Human dermal Fibrobast Subset Isolation and FACS
- Aufzeichnung der Zytometrie-Steuerung, stellen Sie korrekte Spannungseinstellungen ein und führen Sie die entsprechende Kompensation durch. Gate für einzelne Zellen und lebende (DAPI-), Pacific blue, PE und FITC Negativzellen (CD45-, CD31-, CD235ab-, CD106-, ITGA6-und E-Cadherin-), um drei Fibroblast-Populationen zu erhalten: FAP+ CD90-, FAP+CD90+ und FAP-CD90+ Zellen. Siehe Abbildung 3.
- Sortieren Sie drei Fibroblast-Unterpopulationen in separate 1,5 mL Schraubkappen-Mikrozentrifugenröhren, die entweder mit 350 μL Lysepuffer für die RNA-Isolierung gefüllt sind oder mit 350 μL Fibroblast-Wachstumsmedium (siehe Materialtabelle) für die Zellkultur gefüllt sind. Sofort nach der Sorte die Röhren umwandeln und entweder Lyse-Pufferrohre in flüssigen Stickstoff zum Einfrieren bringen oder mittelgroße Rohre auf Eis legen.
CAUTION: Bereiten Sie Lyse-Puffer mit 0,1% b-Mercaptoethanol in der Rauchhaube und vermeiden Sie Inhalation.
8. Kultivierung von Fibroblasten und Adipogenesis-Assay
- Nach FACS werden die Zellen bei 500 x g für 3 min bei 4 ° C nach unten gedreht und die Zellzahlen (5.000\u201210.000 Cells/) in einem Fbroblast-Wachstumsmedium (siehe Materialtabelle) in 48-Brunnen-Zellkultur-Gerichten platziert. Lassen Sie die Zellen wachsen, bis sie 70% der Konfluenz erreichen.
- 5 μg/mL Insulin, 5 μM troglitazone, 0,5 mM 3-Isobutyl-1-Methylxanthine (IBMX) und 1 μM dexametason zum Fibroblast-Wachstumsmedium hinzufügen, um das adipozyten-Differenzierungsmedium vorzubereiten.
- Ersetzen Sie das Medium der kultivierten Zellen durch das Differenzierungsmedium von Adipozyten und lassen Sie die Zellen 14 Tage lang differenzieren. Tauschmittel für Tag 2 mit reduziertem Adipogenese-Medium, das 5 μg/mL Insulin und 5 μM troglitazone enthält. Alle 3. oder 4Tage wieder das Medium füllen.
- Fixzellen mit 4% PFA für 20 min bei Umgebungstemperatur (20\u201222 ° C) bei Differenzierungstag 14. Brunnen mit 60% Isopropanol waschen und komplett verdunsten lassen. Färben Sie Zellen mit 5 mM Öl Rot O (Filter vor der Verwendung) für 20 min. Waschen Sie die gebeizten Zellen viermal mit destilliertem Wasser. Gehen Sie zur Mikroskopie.
CAUTION: PFA ist giftig und schädlich. Sorgfältigen umgehen.
NOTE: Das Protokoll kann hier pausiert werden. Feste Zellen können in 1x PBS bei 4 ° C gelagert werden, bis die Ölfärbung durchgeführt wird. Deckschale mit Paraffinfolie vor der Lagerung abdecken, um Verdunstung zu vermeiden. - Bildzellen, die bei 10x Vergrößerung mit übertragenem Licht in Wasser mit umgekehrtem Mikroskop eingetaucht sind.
Ergebnisse
Ein Überblick über die wichtigsten Schritte zur Verarbeitung von Hautgewebe zur Erlangung einereinzelnen Zellaufhängung ist in Abbildung 1zusehen, die die Entmammung der Haut (Abbildung 1A), verschiedene Entkammelschichten (Abbildung1B), Entfernung des Unterhautfetts zeigt. Schicht (Abbildung 1C) und Trennung der Epidermis und der papillären Dermis (Abbildung 1D) sowie der verschiedenen Schritte der manuellen und enzymatischen Gewebedissoziation(Abbildung 1E, F). Ein Schema der drei dermalen Schichten ist in Abbildung2 vorgesehen.
Abbildung 3 zeigt die Gating-Strategie einer Strömungszytometrie-Färbung für die Analyse verschiedener Fibroblast-Untersätze aus der menschlichen Haut. Zusätzliche Zelloberflächenmarker, die nicht auf Fibroblasten ausgedrückt werden, erlauben den Ausschluss von verschiedenen anderen Zellen, die in der Haut vorhanden sind, wie Immunzellen, epidermale Zellen, mesenchymale Stammzellen (MSCs), rote Blutkörperchen oder Endothelzellen, um maximale Reinheit zu erreichen. In den isolierten Populationen. Es ist nicht entscheidend, das identische FACS-Panel, das in Abbildung 2 verwendet wird, zur Identifizierung dieser fibroblast Unterpopulationen zu verwenden, aber das ist unsere Empfehlung. Man kann Antikörper verwenden, die mit verschiedenen fluoreszierenden Farbstoffen gekennzeichnet sind, oder die Kombination von Ausschlussmarkern verändern.
Dieses Protokoll ermöglicht die Identifizierung von drei Fibroblastpopulationen in der menschlichen Haut, die mit unterschiedlicher intradermaler Lokalisierung, Genexpressionsprofilen und auch Funktionen auftreten (Abbildung4). FAP+CD90- werden in der papillaren Dermis angereichert, währendFAP + CD90 + und FAP-CD90+ in der Netzhaut (Abbildung 4A) häufiger vorkommen. Alle drei Unterpopulationen zeigen die typische Fibroblasten-Morphologie bei der Sortierung in der Zellkultur(Abbildung 4B). Interessanterweise unterscheiden sie sich in ihrer Fähigkeit, sich in Adipozyten zu differenzieren, was ein Markenzeichen für Netzfibroblasten ist. Die Kombination dieser Ergebnisse mit der Profilung von Genexpressionen über die Echtzeit-Polymerase-Kettenreaktion (RT-PCR) 16 (Abbildung 4C), was zeigt, dass FAP+CD90-Zellen einen hohen Anteil an Markernausdrücken , die häufig zugeordnet werden Papierfibroblasten wie CD26, NTN und PDPN, während CD90+ -Zellen die bekannten Netzmarker wie CD36, ACTA2 und PPAR-auf hohem Niveau ausdrücken, kommen wir zu dem Schluss, dass FAP + CD90-Zellen zu den Papillaren und CD90+ gehören. Zellen gehören zur Netzlinie.

Abbildung 1: Isolierung der dermalen Einzelzellaufhängung von intakter menschlicher Haut. (A) Die Haut wird mit einem elektrischen Dermatom in papillare und Netzhaut geschnitten. (B) Papilläre Dermis mit angrenzender Epidermis sind 300 μm dick (oben), während die obere Netzhaut 700 μm dick ist (unten). C) Die subkutane Fettschicht wird mit einem Skalpell von der unteren Netzhaut abgekratzt. D) Nach der Inkubation der Papillardermis in Dissoziationsenzyme-Lösung bei 37 ° C für 1 h kann die Epidermis mit Zangen leicht entfernt werden. E) Verschiedene dermale Schichten werden mit einer Schere gehackt und in eine Enzym-Verdauungsmischung aus Kollagenase I, II und IV und Hyaluronidase übertragen. F) Nach 1 Stunde Dissoziation bei 37 ° C wird die Gewebeverdauung gestoppt und die Aufhängung durch einen Tee-Sieb gegossen, um unverdaute Hautstücke zu entfernen. (G) Die Zellaufhängung wird durch einen 70 μm-Zellstrainer und Zentrifusionspilet bei 500 x g bei 4 ° C für 10 min gefiltert. (H) Nach der Zentrifugation wird das Zellpellet mit 1x PBS mit 10% FCS gewaschen und ist für die FACS-Färbung bereit. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
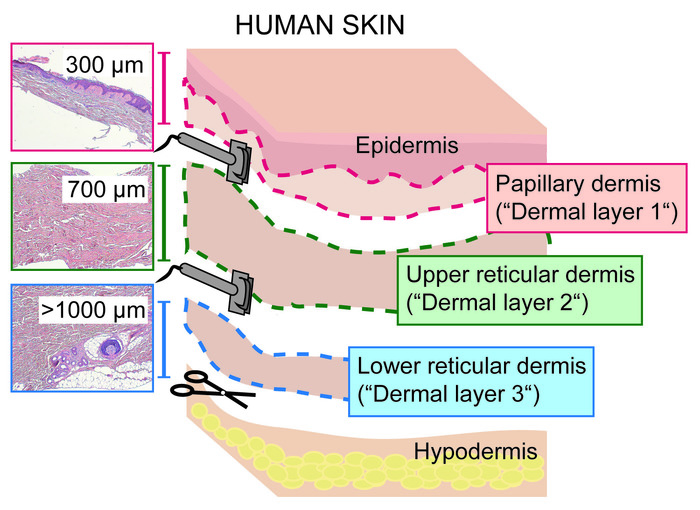
Abbildung 2: Aufteilung der menschlichen Hautdermis in papillare und Netzschichten mit einem Dermatom. Schema, das die drei dermalen Schichten zeigt, die durch das Aufschneiden der vollen Dicke der Haut in die papillare Dermis (einschließlich Epidermis; 0\u2012300 μm; dermale Schicht 1), die obere Netzhaut (300\u20121.000 μm; die Dermis 2) und die untere Netzhaut (& gt;1,000 μm; dermale Schicht 3) mit einer Dermatome. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
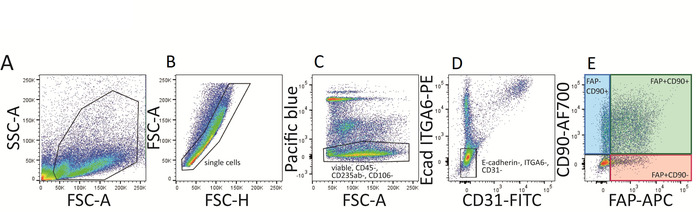
Abbildung 3: FACS-Gating-Strategie für die derben fibrobgebranenen Unterpopulationen. (A\u2012E) Zunächst werden die Zellen auf einzelnen (B) und lebensfähigen (DAPI-) Zellen (C) gated. Immunzellen (CD45+), mesenchymale Stammzellen (CD106 +), rote Blutkörperchen (CD235ab+) werden ausgeschlossen (C) und pazifische blaue Negativzellen werden weiter auf E-cadherin (Ecad) und ITGA6 Doppel-Negativzellen (PE-Kanal, D) goben ). E-cadherin und ITGA6 sind Marker, die auf epidermalen Zellen ausgedrückt werden. Als Nächstes werden CD31-FITC-positive Zellen (Endothel-und Lymphzellen) ausgeschlossen (D), was zu drei Fibrobrist-Populationen führt, die entweder eine oder beide der beiden Zelloberflächen-Fibroblast-Marker FAPund CD90 ausdrücken: FAP + CD90-, FAP+CD90+ und FAP-CD90+ (E). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
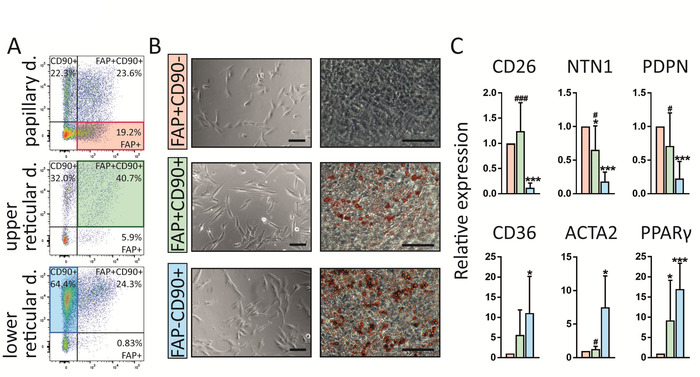
Abbildung 4: FAP+CD90-, FAP+CD90 + und FAP-CD90+ Fibroblasten unterscheiden sich in dermaler Lokalisierung, Genexpression und Funktionalität. A) Repräsentanz FACS Parzellen von gated fibroblasten isoliert von Papillare, oberen Netzhaut und unteren Netzhaut Dermis. Die Gating-Strategie wird in Abbildung3 erläutert. FAP+CD90 -Fibroblasten werden in der Papillardermis angereichert (19,2%) Im Vergleich zu der unteren Netzhaut (0,83%). FAP+CD90+ -Zellen sind in der gesamten Dermis zu finden, aber ihr höchster Überfluss ist in der oberen Netzhaut (40,7%). FAP-CD90+ werden in der unteren Netzhaut (64,4%) angereichert. (B) Alle drei sortierten Unterpopulationen zeigen 7 Tage lang eine typische Fibroblasten-Morphologie auf der Kultur (links). Interessanterweise verhalten sie sich in einem Adipogenesis-Assay anders. Nach 14 Tagen in der Kultur, FAP+CD90-nicht in Adipozytenzuunterscheiden, während FAP + CD90+ und FAP-CD90+ leicht Adipogenese unterziehen (rechts; Öl Rote O färbt Lipid-tragende Zellen rot). Skalenbalken = 1.000 μm. (C)Direkt sortiertFAP + CD90-Fibroblasten drücken die papillaren Fibroblast-Marker CD26, NTN1 und PDPN aus, während FAP-CD90 + Zellen CD36, ACTA2und PPAR-ausdrücken, bekannt dafür, dass sie Ausgedrückt durch die Netzlinie. * p-0,05; /-0.0005 im Vergleich zu FAP+/CD90- Zellen; # p-0.05; # # # p -0.0005 im Vergleich zu FAP-/CD90+ Zellen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
In diesem Artikel beschreiben wir eine Methode zur Isolierung von papillaren und Netzfibroblasten von der menschlichen Haut. CD90 wurde zur Identifizierung oder Isolierung von dermalen Fibroblasten 18, 20,21eingesetzt. Wir haben jedoch gezeigt, dass neben CD90+-Fistenblästen auch menschliche Dermis eine CD90-Fisten-Population beherbergen, die FAP16ausdrückt, die als Marker für aktivierte Fibroblasten und krebserregende Fibroblasten etabliert wurde ( CAFs)22,23, 24,25. Wichtig ist, dass wir drei Faserblatt-Unterpopulationen FAP +CD90-, FAP+CD90 + und FAP-CD90+ in Hautbiopsien von allen gesunden menschlichen Spendern identifizieren konnten. Wir kommen daher zu dem Schluss, dass FAP nicht nur ein Marker für aktivierte Fibroblasten oder CAFs ist, sondern auch normale Gewebefibroblasten.
Die nach Anwendung der oben beschriebenen Exklusions-und Gating-Strategie verbliebene Zellpopulation der FAP-CD90-enthält keine Fibroblasten, da sich diese Zellen nicht im Fibroblast-Anbaumedium in vitro vermehren, sondern die meisten Wahrscheinlich eine gemischte Zellpopulation, einschließlich Lymphzellen und Pericyten unter anderem16.
Die durch die Verwendung des oben beschriebenen Protokolls gewonnene Zellausbeute kann je nach Körperteil variieren, aus dem das für die Isolation verwendete Hautstück stammt. Dermis aus verschiedenen Körperteilen unterscheiden sich sowohl in ihrer Struktur, Dicke als auch in der Kollagenzusammensetzung. Zum Beispiel ist die Haut aus dem Gesicht oder dem Oberarm viel dünner als die Haut aus dem Bauch oder dem Oberschenkel, die auch häufig eine dickere subkutane Fettschicht aufweisen. Darüber hinaus können Alter und Geschlecht der Hautsppender nicht nur die Wirksamkeit der Gewebedissoziation beeinflussen, sondern auch die Verteilung der drei Fibroblast-Unterpopulationen (Abbildung3) beeinflussen, wenn sie von der vollen Dicke der Haut isoliert werden. Dies resultiert aus der Tatsache, dass die papillare Dermis schrumpft und die Gesamtfaserzahlenmit dem Alter11, 26,27,28abnehmen. Darüber hinaus wird das Zellpellet aus der papillären Dermis wahrscheinlich größer sein als die Netzhaut, da die obere Dermis dichter von Fibroblasten bevölkert ist als die Netzhaut. Außerdem ist die untere Dermis auch härter und dichter mit Kollagen verpackt, was es schwieriger macht, das Gewebe zu trennen und die Fibroblasten freizusetzen. Beachten Sie, dass das Zellpellet sehr rot erscheinen kann, weshalb eine rote Blutkörperell-Lyse empfohlen wird.
Neben der Identifizierung von drei Unterpopulationen in intakter menschlicher Haut zeigen wir auch, dass bei gedichtem Haut jede fibroblast Untermenge entweder in papillären oder Netzhaut anreichert wird. Um eine richtige Bereicherung jeder Unterpopulation aus verschiedenen dermalen Schichten zu erreichen, ist eine präzise Aufteilung der Haut mit dem Dermatom von entscheidender Bedeutung. Da die papillare Dermis sehr dünn ist, sollte die entalterte Scheibe, die sie darstellt, eine Dicke von 300 μm nicht überschreiten. Obere Netz-und Unterscheidenfibroblasten repräsentieren sowohl die Netzlinie als auch ähnliche Funktionen und Genunterschriften, Man könnte daher auch in Erwägung ziehen, sie nicht zu trennen.
Wichtig ist, dass alle drei Fibroblasten-Populationen in der gesamten Dermis vorkommen und nicht ausschließlich in einer Schicht vorhanden sind, weshalb Explantationskulturen aus Papillar-oder Netzhaut zu gemischten Fibroblastkulturen führen. FAP+CD90-Papillarfibroblasten sind in der papillären Dermis am häufigsten und folgen einem Gefälle von oberflächlichen bis zu unteren Dermallschichten, währendFAP + CD90+ und FAP-CD90+ Fibroblasten einem Umkehrung von der unteren in die oberflächlichen Schichten16. Darüber hinaus sind die meisten CD90+ -Fistenblätter der Papillardermis fast ausschließlich umgebende Blutgefäße zu finden und drücken den perivaskulären Fibroblast-Marker CD146 29 aus und weisen damit wahrscheinlich andere Funktionen auf als die Restes CD146- Netzfibroblasten 16. CD146 könnte als zusätzlicher Marker in der Gating-Strategie verwendet werden, um diese Population auszuschließen.
Nach der Dissoziation der dermalen Schichten werden die isolierten Zellen mit einem speziell entwickelten Antikörper-Cocktail befleckt, der verschiedene Antikörper zum Ausschluss von Immunzellen, Endothel-und Lymphzellen, Epidermzellen, Erythrozyten und MSCs enthält, um Erhalten Sie reine Fibroblastpopulationen. Es ist zu beachten, dass die Auswahl eines Markers für die Identifizierung und den Ausschluss von MSCsaufgrundder hohen Anzahl der veröffentlichten MSC-Marker 30,31schwierig sein kann. Da MSCs CD90 wie Fibroblasten ausdrücken, könnten sich zusätzliche MSC-Marker wie CD105 oder CD271 für ihre Identifizierung als nützlich erweisen. MSCs stellen jedoch nur einen sehr geringen Prozentsatz aller dermalen Zellen dar, und da CD90 +-Fischler bei der Sortierung typische morphologische Merkmale von Fibroblasten aufweisen, könnte man argumentieren, dass der Ausschluss von MSCs durch den Einsatz von unterschiedlichen Zelloberflächenmarkern möglich sein könnte. Unnötig.
Wichtig ist, dass wir die FAP und die CD90-Genexpression analysiert haben, nachdem wir die Zellen nach der Sortierung 7-14 Tage lang in der Kultur gehalten hatten (Daten nicht gezeigt) und festgestellt haben, dass die Expression beider Marker in der jeweils sortierten Single positiv (FAP+CD90- oder FAP-CD90+) Zellen16. Wir betonen daher, dass die oben beschriebenen Marker-Sets und-Protokolle die Isolierung von primären Fibroblasten-Teilmengen direkt aus dem Gewebe, nicht aber aus zuvor kultivierten Mischfaserpopulationen erlauben.
Dennoch zeigen wir, dass die Funktionalität aller drei Unterpopulationen in der Zellkultur erhalten bleibt, unabhängig von der Veränderung des Lichtflächenmarkers, da Fibroblasten als FAP+CD90sortiert werden-Papillarfibroblasten nicht Erhalten Sie die Fähigkeit, Adipogenese nach einer längeren Periode der Kulturzuunterziehen, während Fibroblasten sortiert als FAP + CD90 + oder FAP-CD90+ Netzfasernhaltenihre Fähigkeit, in Adipozyten zu unterscheiden 16 . Wichtig ist auch, dass wir festgestellt haben, dass papillare und rekulationsspezifische Gene in FAP + CD90- bzw. CD90+ immer noch in höherem Maße zum Ausdruckkommen.
Abschließend möchte ich sagen, dass wir über FACS ein Protokoll zur Isolierung von funktionell unterschiedlichen Fibroblast-Untergruppen eingerichtet haben, das zum ersten Mal die Isolierung und Analyse von reinen und naiven fibrobgeladenen Unterpopulationen aus menschlichen Hautermis ermöglicht. Diese Methode stellt einen großen Fortschritt zu dem häufig verwendeten Fibroblast-Kultur-Isolationsprotokoll von der oberen und unteren Dermis dar, da (i) ein gegenläufiger Gefälle von Papillar-und Netzfibroten von der Hautoberfläche bis zur Hypodermis und (ii) Fibroblasten ändern ihre Genunterschrift in vitro.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken der Unterstützung bei der FACS-Sortierung durch Bärbel Reininger und Wolfgang Bauer. Diese Arbeit wurde durch Zuschüsse an B. M. L. vom Wissenschaftsfonds FWF: V 525-B28 und dem Verband Europäischer Biochemie-Meister (FEBS) unterstützt. S. F. ist Träger eines DOC-Stipendiums der Österreichischen Akademie der Wissenschaften (OeAW). Wir danken den Kernkompetenzen der Medizinischen Universität Wien für unsere hervorragende Unterstützung. Wir danken Bernhard Gesslbauer, Christine Radtke und Martin Vierhapper für die Bereitstellung menschlichen Hautmaterials.
Materialien
| Name | Company | Catalog Number | Comments |
| Material: | |||
| 3-isobutyl-1-methylxanthine | Sigma | I5879 | |
| Ammonium chloride | Sigma | 9718 | used for selfmade ACK Lysis Buffer |
| Amniomax-C100 (1x) Basal Medium | Gibco | 17001-074 | used for fibroblast growth medium |
| β-Mercaptoethanol | Scharlau | ME0095 | ! CAUTION |
| C100 Supplement | Thermo Scientific | 12556015 | used for fibroblast growth medium |
| Collagenase I | Thermo Scientific | 17100017 | ! CAUTION |
| Collagenase II | Gibco | 17101015 | ! CAUTION |
| Collagenase IV | Sigma | C5138 | ! CAUTION |
| DAPI | Thermo Scientific | 62248 | |
| Dexamethasone | Sigma | D8893 | |
| Dispase II | Roche | 4942078001 | ! CAUTION |
| Dulbecco‘s Modified Eagle Medium + GlutaMAX | Gibco | 31966-021 | |
| EDTA disodium salt | Sigma | E1644 | used for selfmade ACK Lysis Buffer |
| Fetal bovine serum (heat inactivated) | Gibco | 10500-064 | |
| Hyaluronidase | Sigma | H4272 | ! CAUTION |
| Insulin | Sigma | I5500 | |
| Isopropanol | Merck | 1,096,341,011 | |
| OilRed O | Sigma | O-0625 | |
| Paraformaldehyd | Sigma | 158127 | ! CAUTION Cancerogenic. Skin and eye irritant. Handle with care. |
| Penicillin/Streptomycin | Gibco | 15070-063 | |
| Phosphate-buffered saline without Ca++ & Mg++ | Lonza | BE17-512F | |
| Potassium bicarbonate | Sigma | 237205 | used for selfmade ACK Lysis Buffer |
| PureLink RNA MicroKit | Invitrogen | 12183-016 | |
| SuperScript III First-Strand Synthesis SuperMix for qRT-PCR | Invitrogen | 11752 | |
| Taqman 2xUniversal PCR Master Mix | Applied Biosystems | 4324018 | ! CAUTION Skin and eye irritant. |
| Troglitazone | Sigma | T2573 | |
| Name | Company | Catalog Number | Comments |
| Flow cytometry Antibodies: | |||
| anti human CD31-AF488 | Biolegend | 303109 | Dilution: 1:30, Lot: B213986, RRID: AB_493075 |
| anti human CD45-Pacific blue | Biolegend | 304029 | Dilution: 1:20, Lot: B218608, RRID: AB_2174123 |
| anit human CD49f/ITGA6-PE | Serotec | MCA699PE | Dilution: 1:20, Lot: 0109, RRID: AB_566833 |
| anti human CD90/Thy-1-AF700 | Biolegend | 328120 | Dilution: 1:30, Lot: B217250, RRID: AB_2203302 |
| anti human CD106-AF421 | BD | 744309 | Dilution: 1:100, Lot: 7170537, RRID: x |
| anti human CD235ab-Pacific blue | Biolegend | 306611 | Dilution: 1:1000, Lot: B224563, RRID: AB_2248153 |
| anti-human E-cadherin-PE | Biolegend | 147304 | Dilution: 1:20, Lot: B197481, RRID: AB_2563040 |
| anti human FAP-APC | R&D | FAB3715A | Dilution: 1:20, Lot: AEHI0117111, RRID: x |
| Human TruStain FcX | Biolegend | 422302 | Dilution: 1:20, Lot: B235080, RRID: x |
| Name | Company | Catalog Number | Comments |
| Equipment: | |||
| 1.4 mL micronic tubes | Thermo Scientific | 4140 | |
| 1.5 mL screw cap micro tube | Sarstedt | 72,692,405 | |
| 5 mL Polystyrene Round Bottom Tube with cell strainer cap | Falcon | 352235 | |
| 48-well cell culture cluster | Costar | 3548 | |
| 50 mL polypropylene canonical tubes | Falcon | 352070 | |
| 70 µm cell strainer nylon | Falcon | 352350 | |
| Aesculap Acculan 3Ti Dermatome | VWR | AESCGA670 | |
| Aesculap Dermatome blades | VWR | AESCGB228R | |
| MicroAmp Fast Optical 96well | Applied Biosystems | 4346906 | |
| Primary cell culture dish | Corning | 353803 | |
| Scalpel blades | F.S.T | 10022-00 | |
| Tea strainer | x | x | |
| Name | Company | Catalog Number | Comments |
| Fibroblast growth medium: | |||
| AmnioMAX basal medium with AmnioMAX C-100 Supplement, 10 % FCS and 1 % P/S |
Referenzen
- Sorrell, J. M., Caplan, A. I. Fibroblast heterogeneity: more than skin deep. Journal of Cell Science. 117 (Pt 5), 667-675 (2004).
- Lowry, W. E., et al. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proceedings of the National Academy of Sciences of the United States of America. 105 (8), 2883-2888 (2008).
- Kisseleva, T. The origin of fibrogenic myofibroblasts in fibrotic liver. Hepatology. 65 (3), 1039-1043 (2017).
- LeBleu, V. S., et al. Origin and function of myofibroblasts in kidney fibrosis. Nature Medicine. 19 (8), 1047-1053 (2013).
- Travers, J. G., Kamal, F. A., Robbins, J., Yutzey, K. E., Blaxall, B. C. Cardiac Fibrosis: The Fibroblast Awakens. Circulation Research. 118 (6), 1021-1040 (2016).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6 (5), 392-401 (2006).
- Rinkevich, Y., et al. Skin fibrosis. Identification and isolation of a dermal lineage with intrinsic fibrogenic potential. Science. 348 (6232), (2015).
- Abhishek, S., Palamadai Krishnan, S. Epidermal Differentiation Complex: A Review on Its Epigenetic Regulation and Potential Drug Targets. Cell Journal. 18 (1), 1-6 (2016).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Mastrogiannaki, M., et al. beta-Catenin Stabilization in Skin Fibroblasts Causes Fibrotic Lesions by Preventing Adipocyte Differentiation of the Reticular Dermis. Journal of Investigative Dermatology. 136 (6), 1130-1142 (2016).
- Lichtenberger, B. M., Mastrogiannaki, M., Watt, F. M. Epidermal beta-catenin activation remodels the dermis via paracrine signalling to distinct fibroblast lineages. Nature Communications. 7, 10537 (2016).
- Harper, R. A., Grove, G. Human skin fibroblasts derived from papillary and reticular dermis: differences in growth potential in vitro. Science. 204 (4392), 526-527 (1979).
- Hiraoka, C., et al. Two clonal types of human skin fibroblasts with different potentials for proliferation and tissue remodeling ability. Journal of Dermatological Science. 82 (2), 84-94 (2016).
- Higgins, C. A., et al. Multifaceted role of hair follicle dermal cells in bioengineered skins. Br Journal of Dermatology. 176 (5), 1259-1269 (2017).
- Korosec, A., Lichtenberger, B. M., Marques, A. P., Pirraco, R. P., Cerqueira, M., Reis, R. L. Ch. 12. Skin Tissue Models. , 279-301 (2017).
- Korosec, A., et al. Lineage identity and location within the dermis determine the function of papillary and reticular fibroblasts in human skin. Journal of Investigative Dermatology. , (2018).
- Higgins, C. A., Chen, J. C., Cerise, J. E., Jahoda, C. A., Christiano, A. M. Microenvironmental reprogramming by three-dimensional culture enables dermal papilla cells to induce de novo human hair-follicle growth. Proceedings of the National Academy of Sciences of the United States of America. 110 (49), 19679-19688 (2013).
- Philippeos, C., et al. Spatial and Single-Cell Transcriptional Profiling Identifies Functionally Distinct Human Dermal Fibroblast Subpopulations. Journal of Investigative Dermatology. 138 (4), 811-825 (2018).
- Walmsley, G. G., et al. Live fibroblast harvest reveals surface marker shift in vitro. Tissue Engineering Part C: Methods. 21 (3), 314-321 (2015).
- Jiang, D., Rinkevich, Y. Defining Skin Fibroblastic Cell Types Beyond CD90. Frontiers in Cell and Developmental Biology. 6, 133 (2018).
- Sorrell, J. M., Caplan, A. I. Fibroblasts-a diverse population at the center of it all. International Review of Cell and Molecular Biology. , 161-214 (2009).
- Huang, Y., et al. Isolation of Fibroblast-Activation Protein-Specific Cancer-Associated Fibroblasts. BioMed Research International. 2017, 4825108 (2017).
- Jiang, G. M., et al. The application of the fibroblast activation protein alpha-targeted immunotherapy strategy. Oncotarget. 7 (22), 33472-33482 (2016).
- Pure, E., Blomberg, R. Pro-tumorigenic roles of fibroblast activation protein in cancer: back to the basics. Oncogene. 37 (32), 4343-4357 (2018).
- Hamson, E. J., Keane, F. M., Tholen, S., Schilling, O., Gorrell, M. D. Understanding fibroblast activation protein (FAP): substrates, activities, expression and targeting for cancer therapy. PROTEOMICS – Clinical Applications. 8 (5-6), 454-463 (2014).
- Gilchrest, B. A. A review of skin ageing and its medical therapy. Br Journal of Dermatology. 135 (6), 867-875 (1996).
- Gilchrest, B. A., Krutmann, J. . Skin Aging. , 198 (2006).
- Makrantonaki, E., Zouboulis, C. C. Molecular mechanisms of skin aging: state of the art. Annals of the New York Academy of Sciences. 1119, 40-50 (2007).
- Crisan, M., et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell. 3 (3), 301-313 (2008).
- Kundrotas, G. Surface markers distinguishing mesenchymal stem cells from fibroblasts. Acta Medica Lituanica. 19 (2), 75-79 (2012).
- Lupatov, A. Y., Vdovin, A. S., Vakhrushev, I. V., Poltavtseva, R. A., Yarygin, K. N. Comparative analysis of the expression of surface markers on fibroblasts and fibroblast-like cells isolated from different human tissues. Bulletin of Experimental Biology and Medicine. 158 (4), 537-543 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten