Method Article
Modelo de infarto de miocardio murino usando ligadura permanente de la arteria coronaria descendente anterior izquierda
En este artículo
Resumen
Aquí se describe un procedimiento quirúrgico que muestra cómo lograr la ligadura permanente de la arteria coronaria descendente izquierda-anterior en ratones. Este modelo es de gran relevancia para investigar la fisiopatología del infarto de miocardio y los procesos biológicos concomitantes.
Resumen
El infarto de miocardio (MI) y las enfermedades coronarias agudas se encuentran entre las causas más prominentes de muerte en población con estilo de vida occidental. Los modelos murinos de MI con ligadura permanente de la arteria coronaria descendente izquierda-anterior (LAD) imitan estrechamente a LA en humanos. Los modelos murinos se benefician de la extensa ingeniería genética disponible en la industria actual. Aquí proponemos un modelo quirúrgico murino reproducible de infarto de miocardio por ligadura coronaria permanente LAD. Nuestra técnica comprende anestesia con ketamina/xilazina que se puede revertir rápidamente mediante la administración de un antagonista, intubación sin traqueotomía para ventilación asistida mecánicamente, ventilación con aplicación de positivo extríntico presión espiratoria final (PEEP) para evitar el colapso alveolar, un método de toracotomía que limita a las lesiones quirúrgicas mínimas hechas a los músculos esqueléticos, y la inflación pulmonar sin toracentesis. Este método es escasamente invasivo, reproducible y reduce la mortalidad y complicaciones posteriores a la cirugía.
Introducción
El infarto agudo de miocardio (MI) es la expresión más grave de enfermedades isquémicas del corazón (IHD). La IHD es la principal causa de morbilidad y muerte en todo el mundo, especialmente en los países occidentales1. En consecuencia, tiene un enorme impacto económico en los sistemas sanitarios2. MI se caracteriza por la oclusión de una arteria coronaria por placa aterosclerótica y la posterior detención del flujo sanguíneo en grandes partes del miocardio. La falta de suministro de oxígeno en el miocardio conduce a la muerte isquémica de los cardiomiocitos. Esta condición patológica desencadena respuestas en el tejido ventricular que en última instancia conduce a deficiencias en las funciones ventriculares, remodelación e insuficiencia cardíaca3. LA MI es una condición fisiopatológica compleja que implica múltiples e intrincados procesos biológicos que comprenden la muerte celular regulada, respuesta al estrés oxidativo, inflamación, cicatrización de heridas, fibrosis y remodelación ventricular. Algunas de estas respuestas biológicas se modelan como procesos individuales in vitro como la liberación inducida por necrosis de patrones moleculares asociados al daño y las respuestas inflamatorias asociadas4. Estos modelos simplificados son esenciales para entender MI. Sin embargo, sólo un modelo in vivo puede proporcionar una imagen realista de la complejidad de los procesos biológicos involucrados en respuesta a MI.
A pesar de que los modelos de MI en animales más grandes como los cerdos pueden relacionarse más estrechamente con la fisiopatología humana de MI, el poder de los modelos murinos reside en las posibilidades que ofrece la ingeniería genética que es más avanzada que en cualquier otra especie de mamífero. Otros aspectos no despreciables son el bajo costo relativo y la simplicidad de la configuración quirúrgica.
Vale la pena mencionar que los modelos de isquemia-reperfusión del miocardio pueden exhibir resultados diferentes a los modelos de MI permanentes. Los procesos biológicos como el tipo de muerte celular comprometida, la calidad/amplitud o la cinéticade las respuestas inflamatorias y cicatrizantes de heridas en el tejido miocárdico pueden variar según el modelo 5,6,7. Sin embargo, este protocolo de oclusión coronaria permanente se puede adaptar fácilmente para obtener un modelo de isquemia-reperfusión.
Este método es relevante para estudios relacionados con la fisiopatología de la MI sin reperfusión y permite el seguimiento de los procesos patológicos que ocurren desde la oclusión coronaria (minutos) hasta la insuficiencia cardíaca tardía (semanas) en el tejido cardíaco local y sistémico Niveles.
Protocolo
Los experimentos con animales descritos en este protocolo fueron revisados y aprobados por el Comité de ética animal del cantón de Vaud.
NOTA: Para estos experimentos, utilizamos ratones macho C57Bl/6J que pesaban entre 25 g y 30 g y una edad de 8-12 semanas. Los ratones fueron alimentados con pellets de comida y agua ad libitum y criados en condiciones convencionales. El equipo quirúrgico fue esterilizado previamente. El experimentador debe usar guantes quirúrgicos estériles y una máscara quirúrgica para limitar la contaminación y las infecciones postoperatorias.
1. Anestesia y cannulación traqueal.
- Pesar el ratón para determinar la dosis de medicamentos anestésicos, medicamentos analgésicos postoperatorios y el volumen de marea del respirador. Precalentar la almohadilla calefactora a 37oC. La configuración quirúrgica se muestra en la Figura1.
- Inyectar el ratón por vía intraperitoneal con una mezcla de ketamina y xilazina a una dosis de 80 mg/kg y 10 mg/kg respectivamente.
- Afeita rápidamente el pelaje del ratón en la garganta y el lado izquierdo de la caja torácica usando una maquinilla de afeitar eléctrica.
- Compruebe la profundidad de la anestesia pellizcando la cola y/o los pies traseros y asiente al animal en una posición supina en la almohadilla de calentamiento. Coloque una pequeña compresa de gasa debajo de la cabeza del animal para evitar el sobrecalentamiento de los ojos. Aplicar gel ocular para evitar la sequedad ocular.
- Fije las cuatro extremidades con cinta adhesiva en la superficie de la almohadilla de calentamiento. Pase un lazo de sutura de seda 5-0 debajo de los incisivos superiores y pegue la extremidad del lazo con cinta adhesiva en la almohadilla de calentamiento. Esto mantendrá la boca del animal abierta y facilitará la cannulación.
- Aplicar crema de depilación en las zonas pre-afiadas y masajear suavemente con un hisopo de algodón durante 1 min. Limpie el exceso de piel y crema con una gasa. Use gotas de solución salina al 0,9% y gasa para limpiar las áreas de incisión. Aplicar trozos de gasa estéril en la garganta y el tórax afeitados y remojarlos en iodopovidona.
NOTA: Recomendamos la aplicación de un medicamento anestésico local (lidocaína o bupivacaína) en los sitios de incisión. - Ajuste el ventilador a un volumen de marea de 7 ml/kg y una velocidad de ventilación de 140 golpes/min.
NOTA: A partir de ahora trabaja bajo un estereomicroscopio de microcirugía. - Sostenga la piel en el centro de la garganta y realice una incisión de 0,5 cm después de una línea caudal/cefálica utilizando tijeras pequeñas. Separe los lóbulos de la glándula salival, luego separe suavemente la fascia del músculo escaradoyoides con fórceps dilatadores curvos hasta que la laringe y la tráquea sean visibles. Fije los bordes de la abertura con retractores unidos a bandas elásticas.
NOTA: Realice este paso sin incisión de los músculos. Un operador capacitado será capaz de intubar al animal a través de la cavidad oral sin la visualización de la tráquea haciendo este paso opcional. - Sostenga suavemente la lengua hacia los lados. Con fórceps, inserte la aguja interna contundente de una cánula de 16 G en la tráquea. Visualice la correcta inserción en la tráquea a través de la incisión de la garganta.
- Conecte la cánula al ventilador y asegure la ventilación correcta colocando el tubo de escape en agua. La presencia de burbujas indica una intubación correcta.
NOTA: Para mantener los tejidos húmedos durante la operación, coloque una gasa estéril empapada con una solución salina al 0,9% y yodopolvidona en la incisión de la garganta. Controle la humedad durante el procedimiento.
2. Ligadura de la arteria coronaria LAD
- Suelte la pata anterior izquierda de la cinta adhesiva y mueva cuidadosamente el ratón a la posición de decúmito del lado derecho. Asegure la extremidad anterior izquierda una vez que el animal esté en la posición correcta.
- Identificar la línea entre pectoral izquierdo menor y músculos principales y hacer una incisión oblicua de la piel en 1 cm con tijeras siguiendo la línea. Con microtijeras contundentes dislacantes, separe la fascia de los músculos pectorales sin incisión. Mantener los músculos pectorales separados con retractores unidos a bandas elásticas.
- Ajuste el respirador con una presión espiratoria final positiva (PEEP) de 3 cm H2O.
- Abra la cavidad torácica usando fórceps contundentes en el 3er espacio intercostal entre 3rd y 4th costillas. Evite tocar la arteria torácica interna, ya que hay peligro de sangrado. No toque el corazón ni el pulmón. Aplique dos retractores en la caja torácica, uno en cada costilla (Figura2A).
- Con un fórceps fino curvo, retire cuidadosamente el pericardio y desmonte sin dañar el corazón y los pulmones.
- Localice la arteria coronaria descendente anterior izquierda (LAD). La arteria LAD aparece como una línea roja brillante superficial que va desde el borde de la aurícula izquierda hacia el ápice.
- Utilice un soporte de aguja para pasar una sutura de seda 7-0 debajo del LAD de 2 a 3 mm por debajo de las arículas izquierdas. Tire de la seda lentamente para evitar un desgarro del tejido cardíaco. Ata la ligadura con tres nudos. La parte inferior izquierda del ventrículo izquierdo se volverá instantáneamente pálida tras la ligadura (Figura2B-E).
NOTA: Es importante no profundizar demasiado en la cavidad ventricular o permanecer demasiado superficial. Para los animales que funcionan con las farsas, tire de la seda de sutura debajo del LAD y retírela lentamente evitando el desgarro de tejido. - Suelte los retractores de costillas, sostenga lacostilla 3 con fórceps y haga dos pases con una sutura de seda 6-0 debajo de lascostillas 3 y 4.
ADVERTENCIA: No perforar el corazón o el pulmón. No apriete los nudos todavía. - Poner tres gotas de solución salina de 37 oC 0,9% en la abertura y cerrar el tubo de escape de expiración durante 2 o 3 ciclos respiratorios para inflar correctamente los pulmones. Apriete la sutura y asegure con dos lanzamientos.
- Libere los retractores que sostienen los músculos y ayúdelos a recuperar su lugar correcto.
- Cierre la piel torácica con dos puntos de seda de sutura 5-0 y asegúrela con dos lanzamientos. Cierre la piel de la garganta con un punto de seda de sutura 5-0 y asegúrela con dos lanzamientos.
3. Procedimientos postoperatorios y seguimiento.
- Retire las bandas adhesivas de las extremidades. Coloque una compresa en la almohadilla de calentamiento en el lado derecho del animal.
NOTA: El procedimiento general de la anestesia hasta este punto no debe tomar más de 40-45 min. Opcionalmente inyectar IP 0,2 ml de atipamezol a una concentración de 0,1 mg/ml para acelerar el proceso de despertar. - Inyección intraperitoneal de 0,3 ml de solución de glucosa al 5% precalentada a 37 oC.
- Gire cuidadosamente al animal sobre decúmito ventral sobre la almohadilla de compresión.
- Detener el ventilador; si el ratón respira espontáneamente, retire con precaución la cánula.
- Inyectar subcutánea (SC) 0,1 mg/kg de buprenorfina y poner ratones en una jaula precalentada calentada a 30 oC y ventilada con un 100% O2 para un mínimo de 1 h. Monitorear ratones para cualquier condición potencialmente mortal como disnea excesiva o hemorragia.
- Durante los dos primeros días después de la cirugía, monitoree el ratón dos veces al día. Inyectar SC 0,1 mg/kg de buprenorfina dos veces al día. Inyección intraperitoneal de 0,3 ml 0 de solución de glucosa al 5% dos veces al día. Proporcione a los ratones una dieta blanda y agua ad libitum. Caliente el animal si es necesario.
NOTA: Además de los opioides, los animales deben recibir medicamentos antiinflamatorios no esteroideos mezclados en la dieta o diluidos en agua potable. - A partir del tercer día, inyectar SC 0,1 mg/kg de buprenorfina dos veces al día si el animal presenta signos inusuales relacionados con la apariencia general, la respiración o el comportamiento. Inyecte por vía intraperitoneal 0,3 ml de solución de glucosa al 5% dos veces al día si el animal sigue perdiendo peso. Caliente el animal si es necesario.
NOTA: Aplique estrictamente criterios de interrupción predefinidos cuando sea necesario para evitar sufrimientos excesivos. Por lo general, los ratones pierden peso hasta el día 3 y 4 y luego aumentan de peso. Después de siete días, los ratones generalmente recuperan el peso previo a la operación.
Resultados
Los ratones fueron eutanasiados siete días después de la cirugía. Los animales fueron anestesiados con 80 mg/kg de ketamina y 10 mg/kg de xilazina. Bajo anestesia, se extrajo sangre de la vena cava y se muestreó el corazón. Las atrias fueron removidas, el miocardio se lavó en PBS helado. Para las mediciones de las áreas isquémicas, los corazones se congelaron a -20 oC durante 40 minutos, luego se cortaron y teñir durante 20 minutos a 37 oC en PBS que contenían 2% cloruro de trifeniloliumtrazo (TTC). Las rodajas de corazón se fijaron durante la noche en una solución de paraformaldehida tamponada en un 4% a temperatura ambiente. Las áreas isquémicas permanecieron sin mancha, mientras que el tejido vivo se tiñó de rojo debido a la presencia de deshidrogenasas. Las áreas isquémicas se calcularon como porcentaje del área blanca del ventrículo izquierdo (LV) con un software de imágenes (Figura3A,B). Para los análisis de biología bioquímica y molecular, los corazones se congelaron en nitrógeno líquido. Después de moler los corazones en nitrógeno líquido el polvo del órgano se utilizó para la extracción de proteínas y ARNm. La extensión de la fibrosis en el tejido miocárdico de los corazones infartos se evaluó mediante el análisis de la mancha occidental de la actina alfa de músculo liso (SMA) y la fosforilación SMAD2, que son respectivamente lecturas importantes de miofibroblastos y de activación de señalización TGF ( Figura 3C). La expresión de ARNm de Tgfb,y los objetivos aguas abajo Ctgf, Postn e Il11 son todos indicadores de fibrosis miocárdica. Esto se demostró mediante el análisis de reacción en cadena de la polimerasa en tiempo real (PCR) (Figura3D).
Las vías de señalización proinflamatoria y la expresión de genes proinflamatorios se encontraron típicamente activadas en la primera semana después del infarto de miocardio. La fosforilación del factor de transcripción NF-B p65 es un sello distintivo de inflamación y se observó en extractos enteros de miocardio de los ratones MI (Figura3E). Expresión de ARNm de genes proinflamatorios Il1b, Il6 y Cxcl10 (Figura3F)y marcadores de monocitos/macrofagos Cd14 y Mertk fueron analizados por PCR en tiempo real (Figura3G). Tenga en cuenta que hubo una variabilidad en la extensión de la fosforilación NF-B p65 y SMAD2 (Figura3C,E, carriles 4-7). Esta variabilidad depende en gran medida del tamaño del infarto.
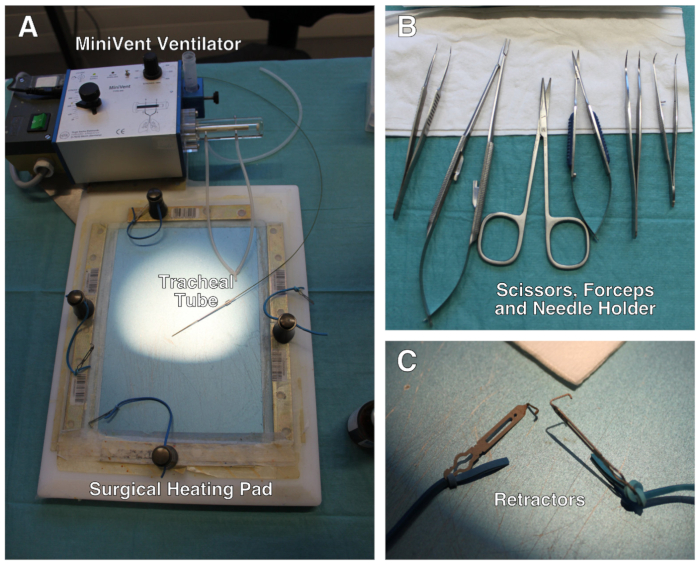
Figura 1 : Descripción de la configuración quirúrgica. (A) La configuración quirúrgica comprende una almohadilla de calentamiento modificada, un ventilador y retractores unidos a bandas elásticas. (B) Juego de tijeras, fórceps y soporte de aguja utilizados durante la cirugía. (C) Primer plano de los mini-retractores. No se muestra: microscopio estéreo quirúrgico. Haga clic aquí para ver una versión más grande de esta figura.
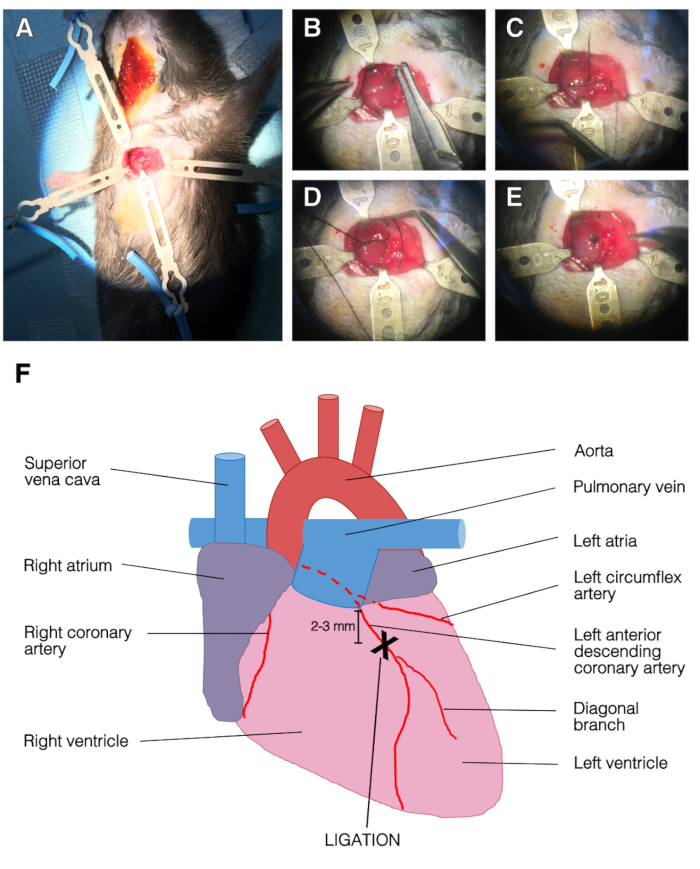
Figura 2 : Imágenes representativas de la cirugía y la ligadura LAD. (A) Pecho abierto con retractores. El ventrículo izquierdo era evidente. Los retractores superiores, izquierdos e inferiores sostenían la caja torácica y el retractor derecho sostenía el músculo pectoralis. (B) La aguja se pasó debajo del LAD. (C) La seda de sutura se pasó bajo el LAD, en el ventrículo izquierdo. (D) Punto único en el LAD. (E) Final del procedimiento de ligadura, la sutura se aseguró con tres nudos. (F) Representación de una vista anterior del corazón. La posición de la ligadura LAD fue de 2-3 mm por debajo de las arerias izquierdas y por encima de la rama diagonal del LAD. Haga clic aquí para ver una versión más grande de esta figura.
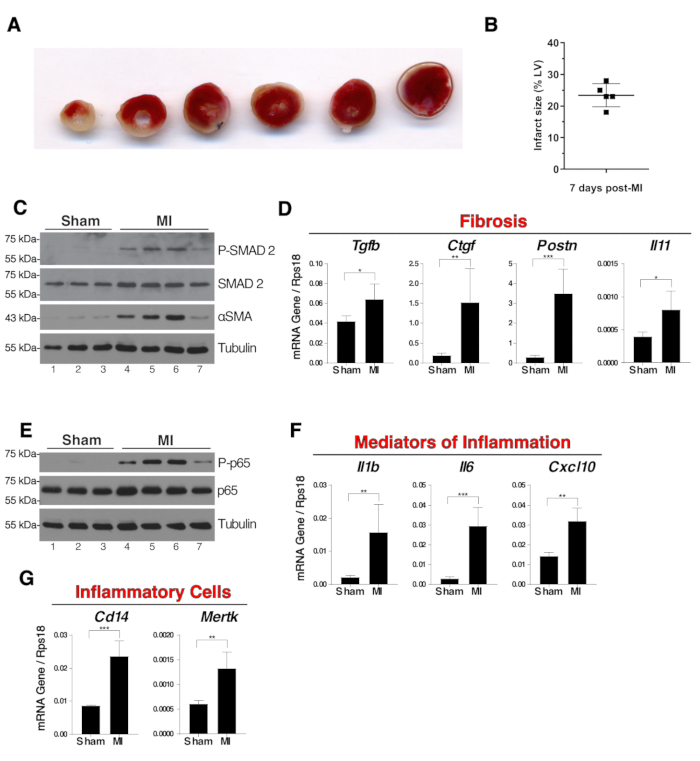
Figura 3 : Fibrosis e inflamación en extractos de miocardio completo siete días después de la cirugía. (A) Imágenes representativas de la tinción TTC de un corazón infarto en rodajas siete días después de la cirugía. Las zonas isquémicas pálidas permanecieron sin mancha y el blanco mientras que el tejido vivo se tiñó de rojo. La ligadura era visible en la tercera rebanada desde la izquierda. (B) El tamaño de las áreas isquémicas de cinco corazones infartados se midió utilizando la técnica de tinción TTC. Los resultados fueron el porcentaje de área blanca del ventrículo izquierdo (LV). (C) Análisis de manchas occidentales de la fosforilación SMAD2 y la expresión alfa-SMA en miocardio entero como indicadores de fibrosis. (D) expresión de ARNm de Tgfb, Ctgf, Postn e Il11 en extractos enteros de miocardio. (E) Mancha occidental de NF-B p65 fosforilación en extractos enteros de miocardio. (F) expresión de ARNm de genes proinflamatorios Il1b, Il6 y Cxcl10 en extractos enteros de miocardio. (G) expresión de ARNm de Cd14 y Mertk como indicadores de la presencia en el miocardio de monocitos/macrofagos y macrófagos fagocíticos respectivamente. N 3 en falso y N 4 en grupo MI. Para el análisis de expresiones de ARNm, la expresión era relativa al control endógeno Rps18 y las comparaciones de grupo no estaban emparejadas las pruebas T del estudiante, *p a 0,05, **p a 0,01, *** p a 0,001. En los paneles B, D, F y G las barras de error representan desviaciones estándar. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El primer paso crítico de este procedimiento es sin duda la intubación. Usamos la aguja interna contundente de un catéter de 16 G como tubo traqueal. No recomendamos el uso de esta configuración con ratones que pesan menos de 22 g. Con esta configuración, puede ser difícil intubar ratones correctamente con un peso corporal más pequeño sin dañar la tráquea. Otro punto crítico es limitar las incisiones realizadas en el músculo mientras se expone la tráquea y la caja torácica. Reducir el daño tisular es de gran importancia, especialmente cuando se estudian los procesos inflamatorios posteriores a la MI. Es por eso que preferimos la difusión suave demúsculo y costillas con fórceps y retractores 8,9. No utilizamos cauterizador eléctrico para controlar el sangrado10. Esto puede causar quemaduras iatrogénicas y favorecer infecciones. Tanto el trauma como las infecciones pueden sesgar las lecturas inflamatorias. La aplicación de un PEEP extrínseco de 3 cm H2O hundiendo el escape de ventilación en un tubo de agua limita el colapso alveolar espiratorio final durante la toracotomía. La localización de la LAD es otro paso crítico y hay que tener en cuenta que la anatomía de las arterias coronarias puede variar dependiendo de la cepa y el genotipo del ratón11. Requiere cierta experiencia para visualizar el LAD, sin embargo, colocar la sutura directamente 2-3 mm por debajo de las arículas izquierdas como se describe en el procedimiento permitirá el posicionamiento correcto de la ligadura. La decoloración instantánea de grandes porciones del ventrículo izquierdo bajo la sutura confirma la precisión. Por último, la aplicación artificial de auto-PEEP bloqueando el escape de ventilación para 2-3 ciclos respiratorios durante el cierre torácico permite una hiperinflación transitoria del pulmón que ayudará a perseguir el aire de la cavidad torácica12. No realizamos a propósito una toracentesis como se muestra en 9,10. De esta manera, limitamos el riesgo de lesiones pulmonares y cardíacas y evitamos daños excesivos en los tejidos o perforaciones.
Isquemia-reperfusión miocárdica (I/R) es un modelo quirúrgico relacionado que imita la restauración del flujo sanguíneo coronario que se realiza a los pacientes con MI en las clínicas. Durante el modelo de I/R se realiza una oclusión transitoria de la arteria coronaria apretando un tubo enel LAD durante una duración de 20 a 45 min 8,13. A continuación, la oclusión se libera para permitir la reperfusión del miocardio durante la duración deseada. Esta simple modificación aplicada a nuestro protocolo puede convertirlo fácilmente en un modelo4de I/R,8,14,15. El infarto puede ser confirmado por un análisis de sangre para la troponina cardíaca T8,10 o por ecocardiografía15.
MI difiere del modelo de I/R porque la reperfusión por sí misma induce una lesión. MI induce más necrosis tisular y la apoptosis es más pronunciada en el miocardio reperfusodo5. La cinética de la infiltración de células inflamatorias también es diferente entre en MI e IR con una infiltración miocárdica retardada de células inmunitarias en MI7. El tamaño y la posición del área infarte también diferirán entre la ligadura permanente y los modelos de I/R15. Teniendo esto en cuenta, hay que tener cuidado de elegir un modelo relevante, ya que los modelos de I/R y MI permanente no son equivalentes. Otro modelo murino del infarto de miocardio es el modelo de crioinfarción. La aplicación de una sonda criogénica en la pared anterior del LV induce la congelación del tejido ventricular y el detención del flujo sanguíneo en la arteria LAD. Esta técnica sin embargo difiere de las técnicas DE MI e I/R en cuanto a la sincronización y amplitud de la remodelación y las respuestas inflamatorias16,17.
La variabilidad es una limitación en cuanto a cualquier procedimiento quirúrgico. Esta variabilidad se basa en diferencias biológicas. Un buen ejemplo es la variación en la disposición arterial coronaria en ratones11. También se basa en las habilidades del experimentador. Vale la pena mencionar que la formación adecuada de los experimentadores es obligatoria para alcanzar resultados estables con este modelo. Un experimentador bien entrenado puede producir fácilmente tamaños de infarto sorreproducibles (Figura3A-B). La mortalidad del modelo depende de la posición del LAD, la duración de los experimentos (días, semanas), la tensión del ratón y los genotipos. Los tipos de analgésicos y analgésicos también pueden afectar el resultado de los experimentos con efectos cardioprotectores o cardiodepresores putativos. En nuestras manos, este modelo tiene una tasa de mortalidad global del 25-30%. Esta tasa de mortalidad comprende muertes espontáneas y sacrificios antes del final del experimento, independientemente de las cepas y la duración del experimento. La mayoría de las muertes o sacrificios son entre el segundo y cuarto día después de la cirugía. La aplicación de un estricto manejo del dolor y el seguimiento de los animales puede reducir la mortalidad.
Aquí presentamos resultados representativos del tamaño del infarto analizados utilizando la tinción TTC y la expresión de proteínas y genes implicados en procesos inflamatorios o fibrosos en LV por western blot y PCR en tiempo real respectivamente (Figura3C-G). También es posible medir muchos de estos parámetros mediante ensayo inmunoabsorbente ligado a enzimas (ELISA) o ensayos enzimáticos. Por supuesto, de acuerdo con la hipótesis que necesita ser probado, este método puede ser seguido por cualquier análisis funcional por ultrasonido, RMN o medición del catéter intraventricular de presión y volumen. También es posible extraer el corazón e investigar más a fondo la biología de las células cardíacas en células aisladas. En general, el modelo MI con ligadura permanente de la arteria coronaria LAD es particularmente útil para evaluar procesos inflamatorios y fibrosos, cicatrización de heridas y cambios en la función cardíaca posteriores al infarto de miocardio.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este modelo fue desarrollado con el apoyo de la Fundación Nacional Suiza de Ciencias (Grants 310030_162629 to LL) y fondos departamentales de los Servicios de Cirugía Torácica y Medicina de Cuidados Intensivos del Hospital Universitario de Lausana. JL recibe una beca de la Fundación Emma Muschamp. Reconocemos el apoyo crucial de los veterinarios y el personal de instalaciones de animales de la Facultad de Biología y Medicina de la Universidad de Lausana. Agradecemos a la Dra. Giuseppina Milano del Servicio de Cirugía Cardíaca del Hospital Universitario de Lausana y al Dr. Alexandre Sarre de Evaluación Cardiovascular Facilty de la Universidad de Lausana por sus consejos técnicos.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 CC Syringe, Omnifix-F | B. Braun | 9161406V | |
| 30G- Needle | BD Microlance 3 | 304000 | |
| 70% Ethanol | |||
| Betadine 60 ml | MundiPharma | ||
| Blunt Retractors | Fine Science Tools | 18200-09 | |
| Castroviejo Needle Holder Straight with Lock | Roboz | RS-6416 | |
| Cotton Swabs | Applimed SA | 6001109 | |
| Dissecting Scissors, Curved | Aesculap | BC603R | |
| Electrical Razor | Remington | HC720 | |
| Glucose 5% B.Braun | B. Braun | 531032 | |
| Hair Removal Cream, Veet | Silk & Fresh Tech. | 8218535 | |
| Iris Dissecting Forceps Full Curved | Aesculap | OC022R | |
| Ketasol 100 (100 mg/ml) | Dr. E. Graeub AG | QN01AX03 | |
| Micro Scissors, Curved Blunt/Blunt | Aesculap | FM013R | |
| NaCl 0.9% B. Braun | B. Braun | 534534 | |
| Short Fixator | Fine Science Tools | 18200-01 | |
| Silk Suture 5-0, BB | Ethicon | K880H | |
| Silk Suture 6-0, P-1 | Ethicon | 639H | |
| Silk Suture 7-0,BV-1 | Ethicon | K804 | |
| Student Dumont #7 Forceps | Fine Science Tools | 91197-00 | |
| Student Fine Forceps-Angled | Fine Science Tools | 91110-10 | |
| Surgical Gloves | Weitacare | 834301 | |
| Surgical heating pad | Personalized setting | ||
| Temgesic sol 0.3 mg/ml Buprenorphine | Indivior Schweiz AG | N02AE01 | |
| Tracheal tube inner needle of an 16G i.v. cat | Abbocath-T | G714-A01 | |
| Universal S3 Microscope, OMPIMD | Zeizz | ||
| Ventilator, MiniVent Model 845 | Harvard Apparatus | 73-0043 | |
| Viscotears | Alcon | 1551535 | |
| Xylasol (1mg/ml) | Dr. E. Graeub AG | QN05CM92 |
Referencias
- GBD 2016 Causes of Death Collaborators. regional, and national age-sex specific mortality for 264 causes of death, 1980-2016: a systematic analysis for the Global Burden of Disease Study. Lancet. 390 (10100), 1151-1210 (2017).
- Reed, G. W., Rossi, J. E., Cannon, C. P. Acute myocardial infarction. Lancet. 389 (10065), 197-210 (2017).
- Frangogiannis, N. G. The inflammatory response in myocardial injury, repair, and remodelling. Nature Reviews Cardiology. 11 (5), 255-265 (2014).
- Lugrin, J., et al. Cutting edge: IL-1alpha is a crucial danger signal triggering acute myocardial inflammation during myocardial infarction. Journal of Immunology. 194 (2), 499-503 (2015).
- Hashmi, S., Al-Salam, S. Acute myocardial infarction and myocardial ischemia-reperfusion injury: a comparison. International Journal of Clinical and Experimental Pathology. 8 (8), 8786-8796 (2015).
- van Zuylen, V. L., et al. Myocardial infarction models in NOD/Scid mice for cell therapy research: permanent ischemia vs ischemia-reperfusion. Springerplus. 4, 336 (2015).
- Yan, X., et al. Temporal dynamics of cardiac immune cell accumulation following acute myocardial infarction. Journal of Molecular and Cellular Cardiology. 62, 24-35 (2013).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery. Journal of Visualized Experiments. (86), (2014).
- Reichert, K., et al. Murine Left Anterior Descending (LAD) Coronary Artery Ligation: An Improved and Simplified Model for Myocardial Infarction. Journal of Visualized Experiments. (122), (2017).
- Kolk, M. V., et al. LAD-ligation: a murine model of myocardial infarction. Journal of Visualized Experiments. (32), (2009).
- Fernandez, B., et al. The coronary arteries of the C57BL/6 mouse strains: implications for comparison with mutant models. Journal of Anatomy. 212 (1), 12-18 (2008).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: a model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), (2014).
- Xu, Z., McElhanon, K. E., Beck, E. X., Weisleder, N. A Murine Model of Myocardial Ischemia-Reperfusion Injury. Methods in Molecular Biology. 1717, 145-153 (2018).
- Parapanov, R., et al. Toll-like receptor 5 deficiency exacerbates cardiac injury and inflammation induced by myocardial ischaemia-reperfusion in the mouse. Clinical Science. 129 (2), 187-198 (2015).
- Curaj, A., Simsekyilmaz, S., Staudt, M., Liehn, E. Minimal invasive surgical procedure of inducing myocardial infarction in mice. Journal of Visualized Experiments. (99), e52197 (2015).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology-Heart and Circulatory Physiology. 289 (3), H1291-H1300 (2005).
- Duerr, G. D., et al. Comparison of myocardial remodeling between cryoinfarction and reperfused infarction in mice. Journal of Biomedicine and Biotechnology. 2011, 961298 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados