Method Article
左前皮下冠動脈の永久的なライゲーションを用いたマウス心筋梗塞モデル
要約
本明細書では、マウスにおける左前皮下冠動脈の永久的なライゲーションを達成する方法を示す外科的処置について説明する。このモデルは、心筋梗塞の病態生理学とそれに付着した生物学的プロセスを調べるために高い関連性がある。
要約
心筋梗塞(MI)と急性冠疾患は、西洋のライフスタイルを持つ人口の中で最も顕著な死因の一つです。左前皮下降(LAD)冠動脈の永久的なライゲーションを伴うMIのマウスモデルは、ヒトにおけるMIを密接に模倣する。マウスモデルは、今日利用可能な広範な遺伝子工学の恩恵を受けています。ここでは、永久LAD冠状動脈ライゲーションによる心筋梗塞の再現可能なマウス外科モデルを提案する.私たちの技術は、アンタゴニストの投与によって迅速に逆転することができるケタミン/キシラジンによる麻酔、機械的支援換気のための気管切開なしの挿管、外因性陽性の適用による換気を含む肺胞崩壊を避けるための末端飛気圧(PEEP)、骨格筋に対して行われた最小の外科的病変に限定する胸部切開法、および胸部穿刺なしの肺インフレーション。この方法は、まばらに侵襲的で再現性があり、手術後の死亡率および合併症を減少させる。
概要
急性心筋梗塞(MI)は虚血性心疾患(IHD)の最も重篤な発現である。IHDは、特に西側諸国1で、世界的に罹患率と死亡の主な原因です。その結果、医療システム2に大きな経済的影響を与えます。MIは、アテローム硬化性プラークによる冠動脈の閉塞および心筋の大部分における血流のその後の停止によって特徴付げられる。心筋の酸素供給の欠如は、心筋細胞の虚血死につながる。この病理学的状態は、最終的に心室機能、リモデリングおよび心不全3の欠乏につながる心室組織の応答を引き起こす。MIは、調節された細胞死、酸化ストレスへの応答、炎症、創傷治癒、線維症および心室リモデリングを含む複数の複雑な生物学的プロセスを含む複雑な病態生理学的状態である。これらの生物学的応答のいくつかは、損傷関連分子パターンおよび関連する炎症反応4の壊死誘発放出のようなインビトロにおける個々のプロセスとしてモデル化される。これらの簡略化されたモデルは、MI を理解するために不可欠です。しかし、生体内モデルのみがMIに応答して関与する生物学的プロセスの複雑さの現実的なイメージを提供することができます。
豚のような大きな動物におけるMIのモデルは、MIのヒト病態生理学により密接に関連しているかもしれないが、マウスモデルの力は、他のどの哺乳類種よりも高度な遺伝子工学によって提供される可能性に存在する。他の無視できない側面は相対的な低コストおよび外科セットアップの簡易である。
心筋虚血再灌流のモデルは、永久的なMIモデルとは異なる結果を示すことができることは言及する価値があります。心筋組織における炎症および創傷治癒応答の細胞死の種類、質/振幅または運動学のような生物学的プロセスは、モデル5、6、7に応じて変化し得る。しかし、永久冠閉塞のこのプロトコルは、虚血再灌流モデルを得るために容易に適合させることができる。
この方法は、再灌流なしのMIの生理学に関連する研究に関連し、冠動脈閉塞(分)から後期心不全(数週間)に起こる病理学的プロセスのモニタリングを局所心臓組織および全身性で可能にするレベル。
プロトコル
このプロトコルに記載された動物実験は、ヴォー州広州の動物倫理委員会によって検討され、承認された。
注:これらの実験では、25gから30gの間の体重を量る雄C57Bl/6Jマウスと8-12週間の年齢を用いて使用した。マウスはチョウペレットと水アドリビタムを与え、従来の条件下で飼育した。手術器具は以前に殺菌された。実験者は、汚染と術後の感染を制限するために、無菌の外科手袋と外科マスクを着用する必要があります。
1. 麻酔と気管のカニション。
- マウスの重量を量り、麻酔薬の投与量、術後鎮痛薬および人工呼吸器の潮量を決定する。37 °Cで加熱パッドを予め温めます。外科的セットアップは図 1に示されています。
- 80 mg/kg および 10 mg/kg の用量でケタミンとキシラジンの混合物で経後マウスを経後に注入します。
- 電気かみそりを使用して、喉と肋骨ケージの左側にマウスの毛皮を素早く剃ります。
- 尾や後ろ足をつまんで麻酔の深さを確認し、加熱パッド上のサピネの位置に動物を落ち着かします。目の過熱を避けるために、動物の頭の下に小さなガーゼ圧縮を置きます。眼の乾燥を避けるために眼ゲルを適用します。
- 暖房パッドの表面に粘着テープで4本の手足を固定します。上部の切り傷の下に5-0シルク縫合糸のループを渡し、加熱パッドに粘着テープでループの四肢を貼ります。これは、動物の口を開いたままにし、カナンテーションを容易にします。
- あらかじめ剃った部分に脱毛クリームを塗り、綿棒で1分間やさしくマッサージし、ガーゼで毛皮とクリームの過剰を拭きます。0.9%の生理生理生理液とガーゼの滴を使用して、切開部を清掃します。剃った喉と胸郭に滅菌ガーゼの断片を適用し、ヨウ化物ビドネに浸します。
注:局所麻酔薬(リドカインまたはブピバカイン)を切開部位に適用することをお勧めします。 - 7 mL/kgの潮の容積および140の打撃/分の換気速度で換気器を設定する。
注:これからは、顕微鏡の立体顕微鏡の下で作業に取り組んでいます。 - 喉の中心に皮膚を保持し、小さなはさみを使用して、口尾/頭筋に続いて0.5センチメートルの切開を行います。唾液腺の葉を分離し、喉頭と気管が見えるまで湾曲した解剖鉗子でステルノヒオイド筋の筋膜を穏やかに分離する。弾性バンドに取り付けられたリトラクタで開口部の端を固定します。
注:筋肉の切開なしでこのステップを行います。訓練を受けたオペレータは気管の視覚化なしで口腔を通して動物を挿管することができる。 - 舌を横にそっと持ちなさい。鉗子で、気管に16 Gカニューレの鈍い内針を挿入する。喉の切開を通して気管への正しい挿入を視覚化します。
- カニューレを人工呼吸器に接続し、排気管を水に入れて正しい換気を確保します。気泡の存在は、正しい挿管を示します。
注:操作中にティッシュを濡らさないようにするために、喉の切開に0.9%の生理液とヨウドポビドンを浸した無菌ガーゼを置きます。手順中に水分を制御します。
2. LAD冠動脈のライゲーション
- ダクトテープから左前足を離し、マウスを慎重に右側のデキュビタス位置に移動させます。動物が正しい位置になったら、左前肢を固定します。
- 左胸筋と主要筋肉の間の線を特定し、線に続くはさみで1cmの斜めの皮膚切開を行います。鈍いマイクロはさみを解剖して、切開なしで胸筋の別々の鼻隠し。弾性バンドに取り付けられたリトラクタで分離された胸筋を維持します。
- 3 cm H2O の正の終端の圧力 (PEEP) の換気器を設定します。
- 3rdと4番目の肋骨の間の3rd肋間空間で鈍い鉗子を使用して胸腔を開きます。出血の危険性があるので、内側の胸部動脈に触れないようにしてください。心臓や肺に触れないでください。2つのリトラクタを肋骨に塗布し、各肋骨に1つずつ取り付けます(図2A)。
- 湾曲した細かい鉗子で、心膜を慎重に取り除き、心臓や肺に害を与えることなく引き離します。
- 左前降下(LAD)冠動脈を見つけます。LAD動脈は、左の動脈の端から頂点に向かって走る表面的な明るい赤い線として現れる。
- 針ホルダーを使用して、左の大蓋の下のLAD 2~3mmの下に7-0の絹縫合糸を渡します。心臓組織の裂け目を避けるためにゆっくりと絹を引っ張ります。3 ノットで合字を結び付します。左心室の左下部分は、ライゲーションの際に瞬時に青ざめる(図2B-E)。
注:心室の空洞に深く入りすぎないように、または表面的に滞在しないことが重要です。シャム操作の動物の場合は、LADの下に縫合糸を引っ張り、組織の裂け目を避けてゆっくりと取り除きます。 - リブリトラクタを解放し、鉗子で3rdリブを保持し、3rdと4番目の肋骨の下に6-0シルク縫合糸で2つのパスを作ります。
注意:穿開心臓や肺を使用しないでください。ノットを引き締めないでください。 - 37 °C 0.9% 生理液を開口部に3滴入れ、肺を適切に膨らませるために2または3の呼吸サイクルのために満了排気管を閉じます。縫合糸を締め、2回のスローで固定します。
- 筋肉を保持しているリトラクタを解放し、彼らは彼らの正しい場所を取得するのに役立ちます。
- 5-0縫合シルクの2ステッチで胸部の皮膚を閉じ、2つのスローで安全。5-0縫合シルクの1ステッチで喉の皮膚を閉じ、2つのスローで安全。
3. 術後の手続きとフォローアップ
- 粘着テープバンドを四肢から取り外します。動物の右側の加熱パッドに圧縮を置きます。
注:この時点までの麻酔からの全体的な手順は、40-45分以上を取るべきではありません. オプションで目覚めプロセスをスピードアップするために0.1 mg/mLの濃度でアチパメゾールのIP 0.2 mLを注入します。 - 37°Cで予温めた5%グルコース溶液の0.3mLを食後に注入する。
- 慎重に圧縮パッドに腹部デキュビタス上の動物を回します。
- 人工呼吸器を停止します。マウスが自発的に呼吸する場合は、慎重にカニューレを取り除きます。
- 皮下(SC)0.1mg/kgのブプレノルフィンを注入し、30°Cで加熱し、100%O2で換気したマウスを、過剰な呼吸困難や出血などの生命にかかわる状態を監視する。
- 手術後の最初の2日間は、マウスを1日2回モニターする。SC 0.1 mg/kg ブプレノルフィンを 1 日 2 回注入します。.1日2回、5%グルコース溶液の0.3mL0を経口注射する。ソフトダイエットと水のアドリビタムをマウスに提供します。必要に応じて動物をウォームアップします。
注:オピオイドに加えて、動物は、食事中に混合または飲料水中に希釈された非ステロイド性抗炎症薬を提供する必要があります。 - 3日目から、動物が一般的な外観、呼吸または行動に関する異常な徴候を示す場合は、SC 0.1 mg/kgブプレノルフィンを1日2回注入する。動物がまだ体重を減らしている場合は、1日2回5%グルコース溶液の0.3 mLを注入します。必要に応じて動物を温めます。
注: 過度の苦しみを避けるために、必要に応じて事前定義された中断基準を厳密に適用します。通常、マウスは3日目と4日目まで体重を減らし、その後体重を増やす。7日後、マウスは通常、操作前の体重を取り出す。
結果
マウスを手術後7日目に安楽死させた。動物を80mg/kgケタミンと10mg/kgキシラジンで麻酔した。麻酔下では、静脈カバから血液を採取し、心臓を採取した。アトリアを除去し、心筋を氷冷PBSで洗浄した。虚血領域の測定では、心臓を-20°Cで40分間凍結し、次いで塩化トリフェニルテトラゾリウム(TTC)を含むPBSで37°Cで20分間スライスおよび染色した。心臓スライスを室温で4%緩衝パラホルムアルデヒド溶液で一晩固定した。虚血領域は染色されず、生体組織は脱水素酵素の存在により赤色に染色された。虚血領域は、イメージングソフトウェアを用いて左心室(LV)の白色面積のパーセンテージとして算出した(図3A,B)。生化学的および分子生物学の分析では、心臓は液体窒素中で凍結された。液体窒素で心臓を粉砕した後、臓器粉末をタンパク質およびmRNA抽出に使用した。梗塞した心臓の心筋組織における線維症の程度は、筋線維芽細胞およびTGFβシグナル伝達活性化の主要な読み出しであるα平滑筋アクチン(αSMA)およびSMAD2リン酸化のウェスタンブロット分析によって評価された(図 3C)TgfbのmRNA発現、および下流標的Ctgf、PostnおよびIl11は、心筋線維症のすべての指標である。 これをリアルタイムポリメラーゼ連鎖反応(PCR)分析(図3D)により示した。
炎症性シグナル伝達経路および炎症性遺伝子の発現は、通常、心筋梗塞後の最初の1週間以内に活性化された。NF-κB p65転写因子のリン酸化は炎症の特徴であり、MIマウスの心筋抽出物全体で観察された(図3E)。mRNAの炎症性遺伝子Il1b、Il6およびCxcl10(図3F)および単球/マクロファージマーカーCd14およびMertkのmRNA発現をリアルタイムPCR(図3G)により分析した。なお、NF-κB p65及びSMAD2リン酸化の程度にばらつきがあった(図3C、E、レーン4-7)。この変動性は梗塞の大きさに大きく依存する。
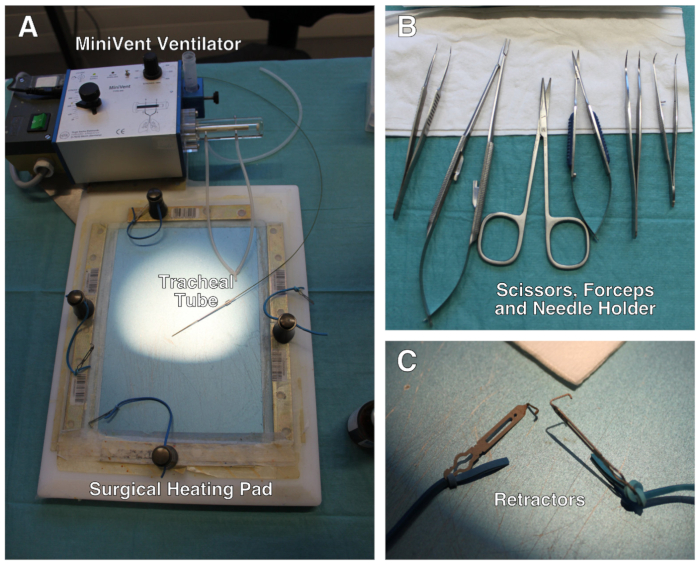
図 1: 外科的セットアップの説明。(A)外科セットアップは、弾性バンドに取り付けられた修正された加熱パッド、人工呼吸器およびリトラクタを含む。(B) 手術中に使用されるはさみ、鉗子、針ホルダーのセット。(C) ミニリトラクタのクローズアップ。図示しない:外科ステレオ顕微鏡。この図のより大きなバージョンを表示するには、ここをクリックしてください。
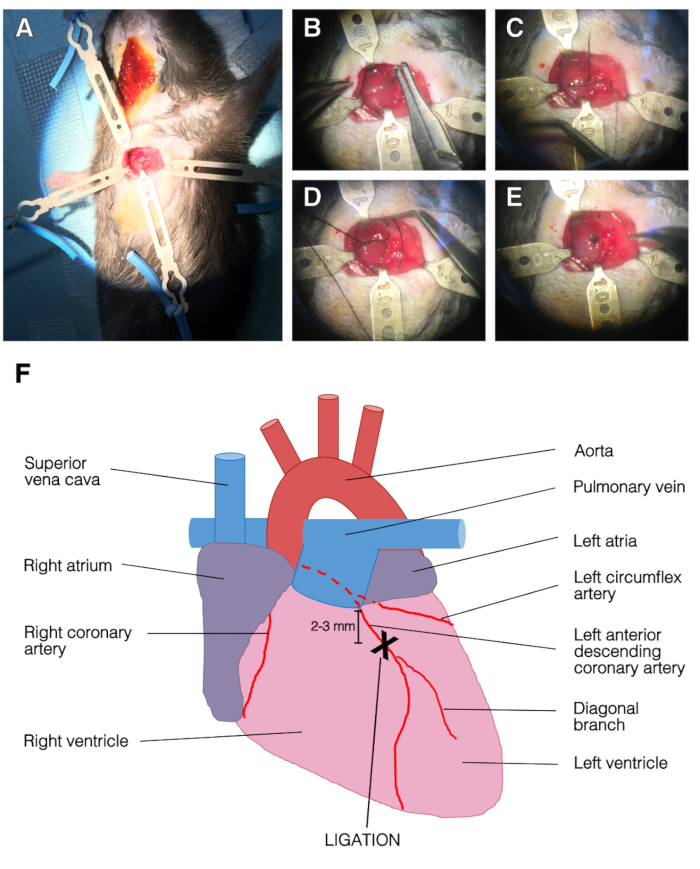
図 2:手術およびLADライゲーションの代表的な画像。(A) レトラクターで胸を開いた。左心室は明らかだった。上、左、下のリトラクタは胸部を保持し、右リトラクタは胸筋を保持しました。(B) 針はLADの下で渡された。(C)縫合糸はLADの下、左心室に渡された。(D) LAD のシングルステッチ。(E)ライゲーション手順の終了により、縫合糸を3ノットで固定した。(F) 心臓の前景の表現。LADライゲーションの位置は、左大蓋の下2〜3mm、LADの斜め分岐の上であった。この図のより大きなバージョンを表示するには、ここをクリックしてください。
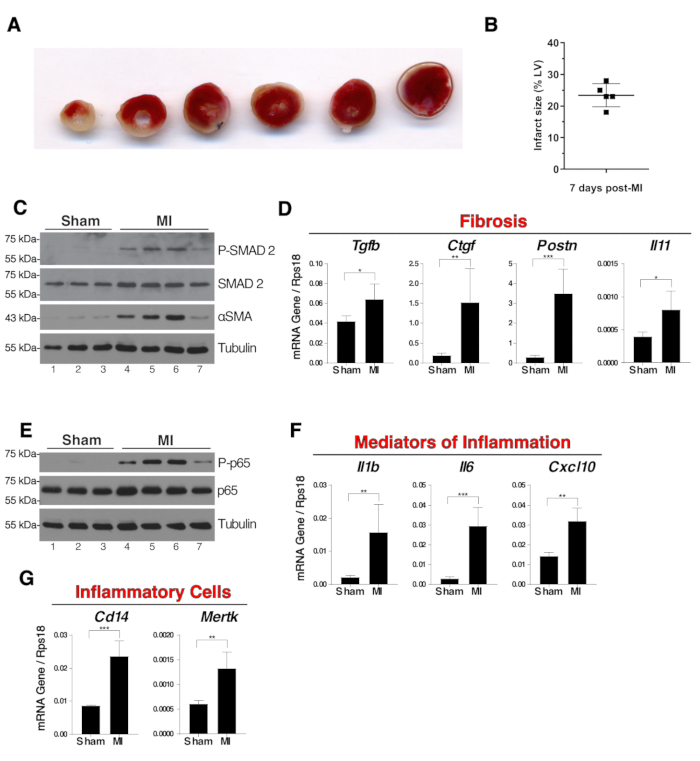
図 3:心筋全体の線維症および炎症は、手術後7日間を抽出する。(A) 手術後7日間に切り裂けられた梗塞心臓のTTC染色の代表的な画像。淡い虚血領域は染色されず、白いままで、生体組織は赤く染色された。ライゲーションは左から3番目のスライスに見えました。(B)5つの梗塞性心臓の虚血領域の大きさをTTC染色技術を用いて測定した。結果は、左心室(LV)の白色領域の割合であった。(C) 線維症の指標として心筋全体におけるSMAD2リン酸化及びα-SMA発現のウェスタンブロット分析(D)心筋全抽出物中のTgfb、Ctgf、PostnおよびIl11のmRNA発現。(E)心筋全抽出物中のNF-κB p65リン酸化のウェスタンブロット。(F)心筋全抽出物中の炎症性遺伝子Il1b、Il6およびCxcl10のmRNA発現。(G)単球/マクロファージおよび食細胞性マクロファージの心筋における存在の指標としてのCd14およびMertkのmRNA発現。 N = 3 のシャムで、N = 4 の MI 群。mRNA発現解析では、発現は内因性対照Rps18に対して相対的であり、グループ比較は学生のT検定、*p ≤0.05、**p ≤0.01、***p ≤0.001と対になった。パネルBでは、D、F、Gの誤差バーは標準偏差を表します。 この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
この手順の最初の重要な手順は、確かに挿管です。気管管として16Gカテーテルの鈍い内針を使用します。重量が22g未満のマウスでは、この設定を使用しないことをお勧めします。このセットアップでは、気管を損傷することなく、より小さな体重でマウスを適切に挿管することは困難な場合があります。もう一つの重要なポイントは、気管と胸部を露出しながら、筋肉に行われた切開を制限することです.組織の損傷を減らすことは、特にMIに続く炎症過程を研究する際に、非常に重要である。私たちは鉗子とリトラクタ8、9で筋肉と肋骨の穏やかな広がりを好む理由です。私たちは、出血10を制御するために電気焼灼器を使用していません。これは、iatrogenic熱傷を引き起こし、感染症を好む可能性があります。外傷と感染症の両方が炎症性の読み出しを偏る可能性があります。換気排気を水管に突き落とすことによって3cmH2Oの外因性PEEPの適用は、胸部切除術中の末端の肺胞崩壊を制限する。LADの局在化は別の重要なステップであり、冠状動脈の解剖学はマウス11の歪みおよび遺伝子型によって異なる可能性があることに留意すべきである。LADを視覚化するにはある程度の経験が必要ですが、手順に記載されているように縫合糸を左の大蓋の下に直接2〜3mm置くことは、ライゲーションの正しい位置決めを可能にするものとする。縫合糸の下の左心室の大部分の即時変色は、精度を確認します。最後に、胸部閉鎖時に2〜3回の呼吸周期に対する換気排気を遮断することによって自動PEEPを人工的に適用することは、胸腔12から空気を追いかけるのに役立つ肺の一過性のハイパーインフレーションを可能にする。我々は意図的に9、10に示すように胸腔穿刺を行いません。このように、肺や心臓の損傷のリスクを制限し、過度の組織損傷や穿開を避けます。
心筋虚血再灌流(I/R)は、診療所のMI患者に行われる冠状動脈血流の回復を模倣する関連する外科モデルである。I/Rモデルの間、冠状動脈の一過性の閉塞は20から45分8、13の間LADに管の一部を締めることによって行われる。その後、閉塞は、所望の持続時間のための心筋の再灌流を可能にするために放出される。私たちのプロトコルに適用されるこの簡単な変更は、簡単にI/Rモデル4、8、14、15にそれを回すことができます。梗塞は、心臓トロポニンT8、10、または心エコー検査15の血液検査によって確認することができる。
MIは、再灌流自体が傷害を誘発するので、I/Rモデルとは異なります。MIはより多くの組織壊死を誘発し、アポトーシスは、再注入された心筋5でより顕著である。炎症細胞浸潤の運動学はまた、MI7における免疫細胞の遅れた心筋浸潤を伴うMIとIRの間で異なる。梗塞領域の大きさと位置も、永久ライゲーションとI/Rモデル15の間で異なります。I/R モデルと永続的な MI モデルは同等ではないため、関連するモデルを選択する場合は注意が必要です。心筋梗塞のもう一つのマウスモデルは、凍結梗塞モデルである。LV前壁に低温プローブを適用すると、LAD動脈における心室組織および血流停止の凍結が誘発される。しかし、この技術は、リモデリングおよび炎症反応16、17のタイミングと振幅に関するMIおよびI/R技術とは異なる。
可変性は、任意の外科的処置に関する制限です。この変動性は生物学的な違いに依存する。良い例は、マウス11における冠動脈配置の変動である。また、実験者のスキルに依存しています。このモデルで安定した成果を上げるためには、実験者の適切な訓練が必須であることを言及する価値があります。十分な訓練を受けた実験者は、再現可能な梗塞サイズを容易に作り出すことができる(図3A-B)。モデルの死亡率は、LADの位置、実験の持続時間(日、週)、マウス株およびジェノタイプに依存する。麻酔薬および鎮痛薬の種類はまた、置かれた心保護または心電圧効果を有する実験の結果に影響を与えるかもしれない。私たちの手の中で、このモデルは25-30%の世界的な死亡率を持っています。この死亡率は、株および実験期間にかかわらず、実験終了前の自発的な死亡および犠牲を含む。死亡または犠牲のほとんどは、手術後2日目から4日目の間です。厳格な疼痛管理と動物のフォローアップを適用すると、死亡率を減らすことができます。
ここでは、ウェスタンブロットとリアルタイムPCRによるLVにおける炎症性または線維性プロセスに関与するタンパク質および遺伝子のTTC染色と発現を用いて分析した梗塞サイズの代表的な結果をそれぞれ示す(図3C-G)。また、酵素結合免疫吸着アッセイ(ELISA)または酵素アッセイにより、これらのパラメータの多くを測定することも可能です。もちろん、試験する必要がある仮説に従って、この方法は、超音波、MRIまたは静脈内カテーテルによる圧力および体積の任意の機能分析に続くことができる。また、心臓を抽出し、単離細胞上の心臓細胞生物学をさらに調べることもできます。全体的に、LAD冠動脈の永久的なライゲーションを有するMIモデルは、炎症および線維性プロセス、創傷治癒および心筋梗塞後の心臓機能の変化を評価するのに特に有用である。
開示事項
著者は何も開示していない。
謝辞
このモデルは、スイス国立科学財団(助成金310030_162629からLL)とローザンヌ大学病院の胸部外科および集中治療医学のサービスからの部門資金の支援を受けて開発されました。JLはエマ・ムシャン財団からの助成金を受け取っています。我々は、ローザンヌ大学の生物学と医学の学部の獣医と動物施設スタッフの重要なサポートを確認します.ローザンヌ大学病院心臓外科のジュゼッピーナ・ミラノ博士とローザンヌ大学心臓血管評価ファシリティのアレクサンドル・サール博士に、技術的なヒントを提供してくださったことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1 CC Syringe, Omnifix-F | B. Braun | 9161406V | |
| 30G- Needle | BD Microlance 3 | 304000 | |
| 70% Ethanol | |||
| Betadine 60 ml | MundiPharma | ||
| Blunt Retractors | Fine Science Tools | 18200-09 | |
| Castroviejo Needle Holder Straight with Lock | Roboz | RS-6416 | |
| Cotton Swabs | Applimed SA | 6001109 | |
| Dissecting Scissors, Curved | Aesculap | BC603R | |
| Electrical Razor | Remington | HC720 | |
| Glucose 5% B.Braun | B. Braun | 531032 | |
| Hair Removal Cream, Veet | Silk & Fresh Tech. | 8218535 | |
| Iris Dissecting Forceps Full Curved | Aesculap | OC022R | |
| Ketasol 100 (100 mg/ml) | Dr. E. Graeub AG | QN01AX03 | |
| Micro Scissors, Curved Blunt/Blunt | Aesculap | FM013R | |
| NaCl 0.9% B. Braun | B. Braun | 534534 | |
| Short Fixator | Fine Science Tools | 18200-01 | |
| Silk Suture 5-0, BB | Ethicon | K880H | |
| Silk Suture 6-0, P-1 | Ethicon | 639H | |
| Silk Suture 7-0,BV-1 | Ethicon | K804 | |
| Student Dumont #7 Forceps | Fine Science Tools | 91197-00 | |
| Student Fine Forceps-Angled | Fine Science Tools | 91110-10 | |
| Surgical Gloves | Weitacare | 834301 | |
| Surgical heating pad | Personalized setting | ||
| Temgesic sol 0.3 mg/ml Buprenorphine | Indivior Schweiz AG | N02AE01 | |
| Tracheal tube inner needle of an 16G i.v. cat | Abbocath-T | G714-A01 | |
| Universal S3 Microscope, OMPIMD | Zeizz | ||
| Ventilator, MiniVent Model 845 | Harvard Apparatus | 73-0043 | |
| Viscotears | Alcon | 1551535 | |
| Xylasol (1mg/ml) | Dr. E. Graeub AG | QN05CM92 |
参考文献
- GBD 2016 Causes of Death Collaborators. regional, and national age-sex specific mortality for 264 causes of death, 1980-2016: a systematic analysis for the Global Burden of Disease Study. Lancet. 390 (10100), 1151-1210 (2017).
- Reed, G. W., Rossi, J. E., Cannon, C. P. Acute myocardial infarction. Lancet. 389 (10065), 197-210 (2017).
- Frangogiannis, N. G. The inflammatory response in myocardial injury, repair, and remodelling. Nature Reviews Cardiology. 11 (5), 255-265 (2014).
- Lugrin, J., et al. Cutting edge: IL-1alpha is a crucial danger signal triggering acute myocardial inflammation during myocardial infarction. Journal of Immunology. 194 (2), 499-503 (2015).
- Hashmi, S., Al-Salam, S. Acute myocardial infarction and myocardial ischemia-reperfusion injury: a comparison. International Journal of Clinical and Experimental Pathology. 8 (8), 8786-8796 (2015).
- van Zuylen, V. L., et al. Myocardial infarction models in NOD/Scid mice for cell therapy research: permanent ischemia vs ischemia-reperfusion. Springerplus. 4, 336 (2015).
- Yan, X., et al. Temporal dynamics of cardiac immune cell accumulation following acute myocardial infarction. Journal of Molecular and Cellular Cardiology. 62, 24-35 (2013).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A murine model of myocardial ischemia-reperfusion injury through ligation of the left anterior descending artery. Journal of Visualized Experiments. (86), (2014).
- Reichert, K., et al. Murine Left Anterior Descending (LAD) Coronary Artery Ligation: An Improved and Simplified Model for Myocardial Infarction. Journal of Visualized Experiments. (122), (2017).
- Kolk, M. V., et al. LAD-ligation: a murine model of myocardial infarction. Journal of Visualized Experiments. (32), (2009).
- Fernandez, B., et al. The coronary arteries of the C57BL/6 mouse strains: implications for comparison with mutant models. Journal of Anatomy. 212 (1), 12-18 (2008).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: a model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), (2014).
- Xu, Z., McElhanon, K. E., Beck, E. X., Weisleder, N. A Murine Model of Myocardial Ischemia-Reperfusion Injury. Methods in Molecular Biology. 1717, 145-153 (2018).
- Parapanov, R., et al. Toll-like receptor 5 deficiency exacerbates cardiac injury and inflammation induced by myocardial ischaemia-reperfusion in the mouse. Clinical Science. 129 (2), 187-198 (2015).
- Curaj, A., Simsekyilmaz, S., Staudt, M., Liehn, E. Minimal invasive surgical procedure of inducing myocardial infarction in mice. Journal of Visualized Experiments. (99), e52197 (2015).
- van den Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology-Heart and Circulatory Physiology. 289 (3), H1291-H1300 (2005).
- Duerr, G. D., et al. Comparison of myocardial remodeling between cryoinfarction and reperfused infarction in mice. Journal of Biomedicine and Biotechnology. 2011, 961298 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved