Method Article
Un enfoque personalizable para la producción enzimática y la purificación de productos naturales diterpenoides
En este artículo
Resumen
Aquí presentamos protocolos fáciles de usar para producir y purificar metabolitos diterpenoides a través de la expresión combinatoria de enzimas biosintéticas en Escherichia coli o Nicotiana benthamiana,seguido según el producto cromatográfico Purificación. Los metabolitos resultantes son adecuados para diversos estudios, incluyendo caracterización de la estructura molecular, estudios funcionales enzimáticos y ensayos de bioactividad.
Resumen
Los ditrinoides forman una clase diversa de productos naturales de moléculas pequeñas que se distribuyen ampliamente por los reinos de la vida y tienen funciones biológicas críticas en procesos de desarrollo, interacciones interorganismos y adaptación ambiental. Debido a estas diversas bioactividades, muchos ditpioides también son de importancia económica como productos farmacéuticos, aditivos alimentarios, biocombustibles y otros bioproductos. La genómica avanzada y los enfoques bioquímicos han permitido un rápido aumento en el conocimiento de genes diterpenoides-metabólicos, enzimas y vías. Sin embargo, la complejidad estructural de los ditrenoides y la distribución taxonómica estrecha de compuestos individuales en a menudo sólo una sola especie siguen siendo factores restrictivos para su producción eficiente. La disponibilidad de una gama más amplia de enzimas metabólicas ahora proporciona recursos para producir diterpenoides en suficientes tetas y pureza para facilitar una investigación más profunda de este importante grupo metabolito. Basándonos en herramientas establecidas para la coexpresión enzimática microbiana y vegetal, presentamos un protocolo fácilde de operar y personalizable para la producción enzimática de diterpenoides en Escherichia coli o Nicotiana benthamiana,y la purificación de los productos deseados a través de cromatografía de sílice y HPLC semipreparativo. Utilizando el grupo de maíz (Zea mays) diterpenoides dolabralexina como ejemplo, destacamos cómo las combinaciones modulares de diterpenosinas (diTPS) y citocromo P450 monooxigenasa (P450) enzimas se pueden utilizar para generar diferentes andamios diterpenoides. Los compuestos purificados se pueden utilizar en diversas aplicaciones posteriores, como análisis estructurales de metabolitos, estudios de la estructura enzimática-función, y experimentos in vitro y en bioactividad de planta.
Introducción
Los diterpenoides comprenden un grupo químicamente diverso de más de 12.000 productos naturales predominantemente policíclicos de 20 carbonos que desempeñan un papel crítico en muchos organismos1. Los hongos y las plantas producen la mayor diversidad de ditrenoides, pero también se ha demostrado que las bacterias forman diterpenoides bioactivos (ver comentarios2,3,4,5). Arraigados en su vasta diversidad estructural, los ditrinoides cumplen una multitud de funciones biológicas. Algunos diterpenoides, como las hormonas de crecimiento gibberellin, tienen funciones esenciales en los procesos de desarrollo5. Sin embargo, la mayoría de los ditrenoides sirven como mediadores de defensa química e interacciones interorganismos. Entre ellos, los ácidos de resina de diterpeno en la defensa de plagas y patógenos de árboles de coníferas y mezclas específicas de especies de diterpenoides antimicrobianos en los principales cultivos alimentarios como el maíz (Zea mays) y el arroz (Oryza sativa) han sido más extensamente estudiado6,7. Estas bioactividades proporcionan un rico repositorio químico para aplicaciones comerciales, y algunos diterpenoides se utilizan como productos farmacéuticos importantes, aditivos alimentarios, adhesivos y otros bioproductos de la vida moderna cotidiana8,9 ,10. Para avanzar en la investigación sobre la diversidad natural y las funciones biológicas de los ditirinoides y, en última instancia, promover aplicaciones comerciales más amplias, se requieren herramientas para la preparación rentable de compuestos puros. Se ha establecido un aislamiento a gran escala del material vegetal para algunos bioproductos diterpenoides, como los ácidos de resina diterpeno que se producen como subproducto de la industria de la pulpa y el papel8. Sin embargo, la acumulación de ditrenoides sólo en tejidos específicos y bajo estricta regulación por estímulos ambientales a menudo limita el aislamiento de cantidades suficientes de productos del productor natural2. Además, la complejidad estructural de los ditrenoides dificulta su producción a través de la síntesis química, aunque tales enfoques han tenido éxito en varios casos11,12. Con la disponibilidad de tecnologías genómicas y bioquímicas avanzadas, las plataformas de producción enzimáticas han ganado cada vez más atención por producir una gama de compuestos diterpenoides (ver comentarios13,14, 15,16,17,18).
Todos los terpenoides, incluidos los dterpenoides, se derivan de dos precursores isoprenoides isoprenoides isoprenoides, difosfato de isopentenil (IPP) y difosfato de dimetilalilo (DMAPP) 19 que, a su vez, se forman a través del mevalonato (MVA) o el difosfato de dimetilalloilo (DMAPP) 19 que, a su vez, se forman a través del mevalonato (MVA) o el difosfato de dimetilallol (DMAPP) 19 que, a su vez, se forman a través del mevalonato (MVA) o el difosfato de dimetilalilo (DMAPP) 19 que, a su vez, se forman a través del mevalonato (MVA) o el difosfato de dimetilalilo (DMAPP)19 que, a su vez, se forman a través del mevalona metileritol-5-fosfato (MEP) vía. La biosíntesis terpenoides procede a través de la vía MEP en bacterias y la vía MVA en hongos, mientras que las plantas poseen un MVA citosólico y una vía mePA plastidial, siendo esta última la vía primaria hacia la formación de diterpenoides20. La condensación de IPP y DMAPP por transferencias de prenilo produce el precursor central de 20 carbonos a todos los ditrenoides, difosfato de geranilgeranil (GGPP)20. Aguas abajo de la formación de GGPP, dos familias de enzimas, tensiasas terpenos (TPS) y monooxigenasas del citocromo P450 (P450s) controlan en gran medida la formación de la vasta diversidad química del metabolismo terpenoides21,22. Las diterpenos sintasas (diTPS) catalizan la ciclación y reorganización comprometidas impulsadas por la carbocación de GGPP para formar varios andamios de diterpeno bicíclicos, policíclicos o macrocíclicos estereoespecíficos1,3,23, 24. La oxigenación y la decoración funcional de estos andamios es facilitada por las enzimas P450 y seleccionar otras familias de enzimas22,25. Los TPS y los P450 suelen existir como familias multigenéticas específicas de especies que pueden formar redes biosintéticas modulares, donde la combinación de diferentes módulos enzimáticos a lo largo de un plano común permite la formación de una amplia gama de compuestos2, 26. El rápido descubrimiento de enzimas funcionalmente distintas que operan en vías terpenoides modulares en los últimos años ha proporcionado oportunidades crecientes para su uso como una lista de piezas versátiles para la ingeniería metabólica de vías parciales o completas en plataformas de producción microbianas y vegetales. Por ejemplo, la levadura (Saccharomyces cerevisiae) se ha aplicado con éxito para diseñar vías multienzimas para la fabricación de bioproductos terpenoides, como el fármaco antipalúdico artemisinina27, los biocombustibles sesquiterpenoides bisaboleno y farnesene28,pero también seleccionar diterpenoides29,30,31. Del mismo modo, se han establecido plataformas Escherichia coli diseñadas para la fabricación a escala industrial para algunos metabolitos diterpenoides, incluyendo el taxaénide precursor Taxol utilizado como droga contra el cáncer y el alcohol diterpeno, sclareol , utilizado en la industria de fragancias13,32,33,34. Los avances en la ingeniería genética y las tecnologías detransformación también han hecho que los sistemas de acogida de plantas sean cada vez más viables para la producción de productos naturales de plantas9,14,35,36. En particular, el pariente cercano del tabaco, Nicotiana benthamiana, se ha convertido en un chasis ampliamente utilizado para el análisis de la vía terpenoides y la ingeniería, debido a la facilidad de agrobacterium-mediada transformación de múltiples combinaciones de genes , biosíntesis eficiente de precursores endógenos, y alta biomasa14,35,36.
Basándonos en estas plataformas establecidas para la biosíntesis terpenoides, aquí describimos métodos fáciles de usar y rentables para la producción enzimática de ditpenoides y la purificación de compuestos únicos. Los protocolos presentados ilustran cómo las plataformas E. coli y N. benthamiana diseñadas para la biosíntesis de precursores diterpenoides mejoradas se pueden utilizar para la expresión combinatoria de diferentes diTPS y enzimas P450 para generar compuestos diterpenoides deseados. La aplicación de este protocolo para producir y purificar ditrinoides estructuralmente diferentes se muestra con el ejemplo de ditrenoides especializados de maíz (Zea mays), dolabralexinas, biosíntesis endógena de los cuales recluta dos diTPS y un P450 Enzima. La purificación de diferentes dolabralexinas que van desde olefinas hasta derivados oxigenados se logra combinando la extracción de embudo separadora con cromatografía de columna de sílice a gran escala y cromatografía líquida de alta presión preparativa (HPLC). Los protocolos descritos están optimizados para la producción de ditrenoides, pero también se pueden adaptar fácilmente para las clases de terpenoides relacionados, así como otros productos naturales para los que hay recursos enzimáticos disponibles. Los compuestos producidos con este enfoque son adecuados para diversas aplicaciones posteriores, incluyendo pero no limitado a, caracterización estructural a través de análisis de resonancia magnética nuclear (RMN), uso como sustratos para estudios funcionales enzimáticos, y una gama de ensayos de bioactividad.
Protocolo
ADVERTENCIA: Los protocolos descritos aquí incluyen el uso de productos químicos peligrosos, objetos afilados, dispositivos eléctricos, objetos calientes y otros peligros que pueden resultar en lesiones. Se debe usar el equipo de protección personal adecuado y seguir los procedimientos de seguridad adecuados, incluidos los entrenamientos de seguridad.
1. Preparación de materiales y soluciones
- Preparar y autoclave de caldo de lisogenia medio (LB) durante 30 min: Por 1 L de medio, mezclar 10 g de triptona, 5 g de extracto de levadura bacteriana, y 10 g de NaCl y disolver en 1 L de agua desionizada (DI).
- Para cultivos de coexpresión de 1 L, preparar y autoclave Caldo sagrado (TB) medio durante 30 min: En una mezcla de matraz Erlenmeyer 2.8 L 12 g de triptona, 24 g de extracto de levadura bacteriana, y 40 mL de 10% (v/v) glicerol y disolver en 860 mL de agua DI. Preparar y autoclave 1,3 L de tampón de fosfato 10x [1,3 L de agua DI, 30,03 g de fosfato monopotásico (KH2PO4) y 163,02 g de fosfato de dipotásico (K2HPO4)] y añadir lo anterior.
- Prepare el caldo Super Optimal con medios de represión catabolita (SOC).
- Preparar y autoclave para 30 min una solución que contiene 2% (p/v) triptona, 0.5% (p/v) extracto de levadura bacteriana, 8.5 mM NaCl, y 2.5 mM KCl.
- Añadir MgSO4 estéril y glucosa ambos con una concentración final de 20 mM. Utilice 1 M NaOH para ajustar a pH 7.0. Almacene el medio SOC a -20 oC.
- Preparar 1 L de 1 M de piruvato sódico. Autoclave durante 15 min y almacenar a 4oC.
- Preparar 20 ml de isopropilo de 1 M a-D-1-tiogalactopyranoside (IPTG) en agua DI estéril. Conservar alícuotas de 1–2 ml a -20 oC.
- Preparar tampón de infiltración: 10 mM MES (1.952 g) y 10 mM MgCl2 (2.033 g) disuelto en 1 L de agua DI. Conservar a 4oC.
- Preparar y autoclave agar LB durante 30 min: Por 100 mL de agua DI, añadir 1 g de triptona, 0,5 g de extracto de levadura bacteriana, 1 g de NaCl y 1,5 g de agar. Una vez que el agar LB esté lo suficientemente fresco como para manipular el frasco, agregue los antibióticos necesarios para las combinaciones de plásmidos deseadas. Vierta las placas de agar con platos de petri y guárdelas a 4oC.
- Véase la Tabla 1 para las especificaciones relativas a la producción de compuestos en E. coli y N. benthamiana, respectivamente. Envuelva las placas que contienen rifampicina en papel de aluminio para evitar la degradación al almacenarlas.
| Concentración de trabajo (g/mL) | |||||
| Antibiótico | Stock (mg/ml) | Solvente | 1 plásmido | 2 plásmidos | 3 o 4 plásmidos |
| Carbenicilina | 50 | H2O | 50 | 25 | 20 |
| Cloranfenicol | 30 | Etoh | 30 | 20 | 20 |
| Kanamicina | 50 | H2O | 50 | 25 | 20 |
| Espectinomicina | 30 | H2O | 30 | 25 | 20 |
| Gentamicina | 50 | H2O | 30 | ||
| Rifampicina | 10 | Meoh | 10 | ||
Tabla 1: Concentraciones de antibióticos para la coexpresión de plásmido en E. coli o N. benthamiana.
2. Producción de metabolitos diterpenoides en E. coli
NOTA: El protocolo descrito aquí para producir metabolitos diterpenoides en E. coli ha sido adaptado de una plataforma de coexpresión enzimática previamente reportada desarrollada por el grupo del Dr. Reuben J. Peters (Iowa State University, IA, USA)13 ,32.
- Transformación de células competentes con combinaciones de plásmidos.
- Descongelar las células de E. coli químicamente competentes en hielo (células BL21DE3-C41 se utilizaron en este protocolo).
- Añadir 1 l de una solución de 100 ng/L de cada construcción utilizada para la co-expresión a 25 l de células competentes en un microtubo de 1,5 ml. No vórtice ni mezcle pipeteando.
NOTA: Para una expresión y actividad óptimas de las enzimas TPS y P450, es necesario tener en cuenta varias modificaciones de secuencia. Para el TPS, la eliminación del péptido de tránsito plastidial N-terminal es a menudo esencial. Específicamente, el mono plastidial y el di-TPS normalmente requieren la eliminación del péptido de tránsito pronosticado (usando algoritmos de predicción comunes37),mientras que el sesqui-TPS citosólico se puede utilizar generalmente como genes de longitud completa. Con respecto a P450s, la optimización del codón, así como la eliminación o sustitución con la secuencia de líder MAKKTSSKGK del dominio transmembrana N-terminal ha demostrado ser eficaz en muchos casos38,39. Además, al co-expresar las enzimas P450 se debe incluir una citocromo P450 reductasa (RCP) para garantizar una actividad suficiente de P450. - Incubar la mezcla sobre hielo durante 30 minutos. Mezclar cada 10 minutos raspando suavemente el tubo a través de un estante de microtubo.
- Preincubar medios SOC y placas de agar LB a 37 oC que contengan antibióticos según sea necesario para la combinación deseada de construcciones.
NOTA: Cada construcción que se va a transformar debe tener una resistencia a los antibióticos distinta, así como orígenes distintos de la replicación para garantizar una expresión óptima de las proteínas. - Caliente el choque de la mezcla celular a 42 oC durante 1 minuto, y luego incubar sobre hielo durante al menos 2 minutos.
- Añadir 200 l de medios SOC calientes.
- Agitar la mezcla celular durante 1 h a 37oC y 200 rpm.
- Agregue aproximadamente 10 perlas de vidrio autoclave a la placa de agar LB calentada. Agregue 100 s de la mezcla celular y reemplace la tapa. Agitar la placa horizontalmente con la tapa puesta para distribuir las células uniformemente. Retire las cuentas de vidrio golpeándolas en un contenedor de residuos. Alternativamente, utilice otros métodos de chapado preferidos.
- Incubar la placa de agar LB a 37 oC durante la noche con la superficie recubierta boca abajo. La placa con colonias transformadas de E. coli se puede utilizar al día siguiente o almacenarse a 4 oC selladas en película de parafina durante un máximo de 2 semanas.
- Preparación de cultivos de inoculación
- Al día siguiente, preparar una solución de medio LB con antibióticos necesarios para la combinación de plásmido transformado utilizando las concentraciones proporcionadas en la Tabla 1.
- En una capucha estéril, transfiera 5 ml de medio LB a un tubo de ensayo de vidrio estéril de 15 ml con una tapa transpirable de plástico. Prepare un pequeño tubo de cultivo para cada cultivo grande (1 L) deseado.
- Seleccione colonias individuales de E. coli de la placa de agar LB usando una punta de pipeta. Inocular cada tubo de LB con una colonia de E. coli expulsando una punta de pipeta que contenga una colonia seleccionada en cada tubo.
- Tapar cada tubo de ensayo de cultivo de inoculación con una tapa de plástico transpirable. Colocar los pequeños cultivos de E. coli tapados en una incubadora de temblores de 37oC durante 12–24 h.
- Preparación e inducción de culturas de coexpresión
- Al día siguiente, agregue 100 ml de tampón de fosfato preparado de 10x a 900 ml de TB preparado para una concentración final de tampón de fosfato de 1x. Añadir los antibióticos necesarios con concentraciones según la Tabla 1.
- Agitar a 140 rpm a 37oC hasta que esté caliente (aproximadamente 30 min).
- Inocular cada matraz de medios para cultivos de 1 L con 5 ml del cultivo de la inoculación. Conservar la punta de pipeta utilizada para la inoculación del cultivo de inoculación en el tubo de cultivo de inoculación de modo que, tras la extracción con disolvente orgánico en pasos posteriores, no haya contaminantes plásticos extraídos.
- Incubar con agitación a 200 rpm hasta que la densidad óptica a 600 nm (OD600)alcance 0,6, aproximadamente 3 h. Para medir el OD600 con un espectrofotómetro, utilice una mezcla de TB estéril con tampón de fosfato como blanco.
- En el OD600deseado, ajuste los ajustes de la incubadora a 16 oC.
- Al co-expresar P450s, recién preparar riboflavina y ácido aminolevulinic, que son esenciales para la producción suficiente de cofactor P450. Para cada experimento, hacer 4 g/L riboflavina y 150 g/L de ácido aminolevulinic. Mantener la solución envuelta en papel de aluminio hasta su uso, ya que la riboflavina es sensible a la luz.
- Después de que la incubadora haya alcanzado los 16oC (aproximadamente 30 min), añadir 1 ml de 1 M IPTG, 1 ml de riboflavina de 4 g/L y 1 ml de ácido aminolevulínico de 150 g/L a cada cultivo. Para la producción de diterpenoides, se deben añadir 25 ml de piruvato sódico de 1 M a cada cultivo para asegurar una formación suficiente de precursores.
NOTA: Todas las construcciones utilizadas en este ensayo estaban bajo el mismo promotor inducible IPTG. Diferentes promotores se pueden utilizar como se desee. - Incubar a 16oC y 140 rpm durante 72 h. Añadir 25 ml de piruvato sódico cada día posterior a la inducción si se producen ditrenoides. Los cultivos de uso inmediato se utilizan inmediatamente para la extracción de embudo separador de metabolitos; no cosechar ni almacenar cultivos.
3. Separación y purificación de metabolitos
- Extracción de embudo separador de metabolitos
NOTA: Es importante utilizar únicamente cristalería y pipetas de vidrio cuando se utilizan disolventes orgánicos para evitar contaminaciones de plastificantes.- En una campana de humos, fije el embudo separador en un soporte de anillo. Coloque un vaso de precipitados de desecho debajo del embudo separador.
- Vierta 500 ml de 50/50 (v/v) acetato de etilo/hexanos en el embudo separador.
NOTA: La mezcla de disolventes debe ajustarse en función de la solubilidad y polaridad de los metabolitos objetivo. Se deben evitar los disolventes miscibles en agua para garantizar una separación de fase adecuada. - Añadir 500 mL del cultivo de E. coli al embudo separador y colocar en el tapón de vidrio.
- Agitar el embudo para mezclar el cultivo con el disolvente de extracción, aproximadamente 5-10x. Desgaselo con frecuencia abriendo la espiga mientras el embudo se mantiene boca abajo y apunta a la campana de humos para liberar presión. Repita el procedimiento de agitación y desgas2o.
- Coloque el embudo en posición vertical en el soporte del anillo y espere hasta que la capa solvente (superior) se haya separado de la capa acuosa (cultivo) (inferior), aproximadamente 1 min.
NOTA: Cuando se observa una gran cantidad de burbujas en la interfase, se puede añadir un pequeño volumen de 5-10 ml etOH para mejorar la separación de fases. - Retire el tapón. Escurra la capa de E. coli en un vaso de precipitados de desecho, reteniendo la capa de disolvente en el embudo.
- Repita el procedimiento utilizando los 500 ml restantes de cultivo de E. coli y el mismo disolvente de 500 ml utilizado para la primera extracción.
- Escurra el disolvente que contiene los metabolitos extraídos en un matraz limpio. Evite la contaminación con el cultivo de E. coli.
- Concentración de evaporación rotativa
- Preparar el equipo de evaporación rotativa (rotovap): llenar el baño de agua y ajustar la temperatura a 25 oC. Para compuestos sensibles al calor, utilice un ajuste de temperatura más baja o agregue hielo al baño de agua. Llene la cámara condensadora con hielo seco y ajuste la velocidad de rotación a 60-80 rpm.
- Añadir aproximadamente 700 ml de metabolitos extraídos a un matraz evaporante de 1 L, adherirse al rotovap y bajar al baño de agua. Encienda el calentador de baño de agua y ajuste a 25 oC.
- Iniciar la rotación del matraz evaporatorio, encender el sistema de vacío, y aumentar gradualmente la succión para evitar la ebullición rápida de la solución metabolito en el matraz de desecho. El disolvente evaporado debe comenzar a condensar y gotear en el matraz de recogida de condensados (residuos).
- Cuando sólo quedan unos pocos ml de la solución de metabolito en el matraz evaporator, detenga las rotaciones y apague el sistema de vacío. Levante el matraz evaporator y despresoriza cerrando la línea de vacío. Conservar la solución de metabolito concentrado restante en el matraz evaporator. Deseche los residuos en el matraz de residuos.
- Continúe la evaporación rotativa añadiendo hasta 700 ml de solución adicional de metabolito extraído al matraz evaporante. Repita el proceso hasta que se haya concentrado toda la solución de metabolito extraída.
- Retire los metabolitos concentrados del matraz evaporator transfiriendo con una pipeta de vidrio al nuevo tubo de ensayo. Enjuague el matraz evaporator con 5 ml de acetato/hexano etilo 50/50 (v/v) o la mezcla de disolvente deseada dos veces, transfiriendo la solución de enjuague al tubo de ensayo.
- Almacenar metabolitos concentrados a -20 oC o -80 oC (dependiendo de la estabilidad del producto) hasta su uso posterior.
- Purificación de columnas de sílice
- Preparar cristalería enjuagando un vaso de precipitados de 1 L, embudo de vidrio, tubos de ensayo de 50 ml y columna de cromatografía de 3,2 L (equipada con un traste de vidrio) una vez con hexano y otra con acetato de etilo. Etiquetar los tubos de ensayo de 50 ml, que se utilizarán para recoger fracciones.
- Añadir 2 L de gel de sílice (230–400 malla, grado 60) a una columna de cromatografía de 3.2 L con una capacidad de depósito de 2 L y un disco fritted, luego cargar la arena para formar una capa de 5 cm en la parte superior de la columna.
- Preparar la columna para la cromatografía lantivando a fondo con 2 L de hexano. En todo momento, debe haber una capa delgada (0,5 cm) del líquido disolvente por encima de la capa de arena de la columna para asegurarse de que la columna no se seque ni adquiera bolsas de aire. Un adaptador de entrada de vidrio conectado a una manguera de aire se puede utilizar para aumentar suavemente el caudal a través de la columna en lugar de la gravedad sola.
- Cargue el extracto de metabolito concentrado (ver sección 3.2) en la columna. Enjuague el frasco que contenía la muestra 3x con hexano y agréguelo a la columna para asegurarse de que toda la muestra ha sido transferida.
- Usando el siguiente gradiente, cargue 100 ml a la vez y recoja fracciones de 50 ml en tubos de ensayo etiquetados: 100% hexanos 3x, 10% (v/v) acetato de etilo en hexágonos 3x, 12,5% (v/v) acetato de etilo en hexágonos 3x, 15% (v/v) acetato de etilo en hexágonos 3x , 20% (v/v) acetato de etilo en hexanos 3x, 40% (v/v) acetato de etilo en hexanos 3x, 60% (v/v) acetato de etilo en hexanos 3x, y 100% acetato de etilo 4x.
NOTA: El degradado debe ajustarse en función del tamaño del compuesto y las polaridades y la separación deseada. - Con una pipeta de vidrio, transfiera 1 ml de cada fracción a un vial GC etiquetado. Analice cada muestra a través de GC-MS para determinar qué fracciones contienen los metabolitos deseados y su nivel de pureza.
NOTA: El método GC-MS adecuado para los metabolitos producidos en este método se ha descrito en Mafu et al. 201839. En resumen, todos los análisis se realizaron en un GC con un detector XL MS utilizando una columna HP-5MS (ver Tabla de Materiales),un volumen de muestra de 1 l, y rampa de temperatura del horno de 50 oC a 300 oC a 20 oC mín.1 . - Después de determinar qué fracciones contienen el compuesto o compuestos de interés, combine todas las fracciones que contengan el mismo compuesto. Deseche adecuadamente las fracciones que no contienen ningún compuesto en un contenedor de residuos. Repita el procedimiento de evaporación rotativa si es necesario para concentrar los metabolitos purificados.
- Si es necesaria una purificación adicional, utilice (semi-)preparativo HPLC para mejorar la pureza del producto. Los protocolos HPLC deben adaptarse en función de las especificaciones individuales del equipo y los compuestos de interés.
- Resuspenda las muestras de cromatografía de sílice seca en 1 ml de hexano (hidrocarburos diterpenos) o acetonitrilo (diterpenoides oxigenados) y filtre a través de una jeringa de filtro para evitar la contaminación con partículas pequeñas.
- Para los ditrpenoides no polares, utilice una columna CN (ver Tabla de Materiales)con un caudal recomendado de 1 ml/min y un gradiente de acetato de hexano:etil, con fracciones recopiladas cada 1 minuto.
- Para los ditrpenoides polares, utilice una columna C18 (ver Tabla de Materiales)con un caudal recomendado de 3 ml/min y un acetonitrilo: gradiente de agua, con fracciones recogidas cada 1 minuto.
- Seque todas las fracciones purificadas de HPLC bajo una corriente de nitrógeno y resuspenda en 1 ml de hexano antes del análisis GC-MS para evaluar la abundancia y pureza del producto.
4. Producción de metabolitos diterpenoides utilizando N. benthamiana
NOTA: El protocolo descrito aquí para la producción de metabolitos diterpenoides en N. benthamiana ha sido adaptado de los estudios previamente reportados35,36,40,41. El siguiente protocolo es específico para la infiltración de jeringa de hojas de N. benthamiana. Otros métodos de infiltración, como la infiltración de vacío son igualmente adecuados. Los sistemas vectoriales t-DNA binarios, como pCAMBIA130035Su (pLIFE33) o pEAQ-HT40,41,42, que permiten la propagación en E. coli y A. tumefaciens y expresión génica en los huéspedes de plantas son adecuado para este protocolo.
- Plantación de Nicotiana benthamiana
- Llene una olla de 750 ml con tierra para macetas y riegue la olla. Agregue 20 semillas de tabaco y toque suavemente con el dedo para que estén en el suelo. No cubra con el suelo.
NOTA: Las semillas se pueden generar a través de la autopolinización para la propagación de semillas. Las semillas para este experimento se obtuvieron del Departamento de Biología Vegetal de UC Davis, y están disponibles públicamente a través del repositorio de germoplasma del USDA (https://npgsweb.ars-grin.gov/gringlobal/accessiondetail.aspx?id=1450450). - Dejar la olla en una cámara de crecimiento con las siguientes condiciones, regando cada dos días para asegurar que el suelo no se seque. Cultivar plantas a 26oC y 60% de humedad con 16:8 h día:ciclo nocturno para todos los pasos de este protocolo.
- Después de 1 semana, llene 20 ollas con tierra para macetas y riegue las ollas. Usando fórceps, agarre una plántula de tabaco por el tallo y retírela suavemente de la olla de origen, colocando una plántula en cada nueva olla y desbarbando cuidadosamente las raíces. No dañe las hojas o raíces.
- Regar las plantas cada dos días colocando agua en la bandeja en la que se encuentran las macetas (también llamada "agua de fondo"). Cada cuarto riego, incluya fertilizante genérico en el agua de acuerdo con las instrucciones del paquete.
- Llene una olla de 750 ml con tierra para macetas y riegue la olla. Agregue 20 semillas de tabaco y toque suavemente con el dedo para que estén en el suelo. No cubra con el suelo.
- Transformación de congelación-descongelación de la cepa de Agrobacterium tumefaciens GV3101 células competentes
- Descongelar Agrobacterium tumefaciens cepa GV3101 (u otra cepa preferida) células competentes sobre hielo (-1 h). Tubos de microcentrífuga pre-frío de 0,2 ml sobre hielo. Medios SOC cálidos a 28oC.
- Mezcle suavemente las células con la punta de la tubería (NO entubar hacia arriba y hacia abajo) y la alícuota de 15 ml de células para cada transformación en los microtubos de 1,5 ml refrigerados.
- Añadir 1-5 l (400 ng) de ADN a cada tubo de células competentes y mezclar suavemente raspando el tubo a lo largo de un estante de tubo.
NOTA: Las construcciones deseadas no necesitan tener diferentes resistencias a los antibióticos porque cada una se transforma por separado y se mezcla antes de la infiltración. - Colocar los microtubos en nitrógeno líquido durante 5 min.
- Retire los microtubos del nitrógeno líquido y coloque los tubos en el estante de temperatura ambiente. Tubos de descongelación durante 5 min en incubadora de 37oC.
- Añadir 250 s de soC precalentado (28 oC) a cada microtubo. Agitar a 28–30 oC, 225 rpm, durante 3 h.
- Placa 50 l de células transformadas en placas de agar LB que contienen los antibióticos necesarios descritos en la Tabla 1 utilizando cuentas de vidrio estéril, como se describe en el paso 2.1.8.
- Placas de incubación invertidas a 28–30 oC durante 48 h. El crecimiento dentro del1o día de incubación puede ser un signo de contaminación. Los a. tumifaciens transformados se pueden utilizar después de la incubación de 2 días o almacenarse a 4 oC sellados en película de parafina durante un máximo de 2 semanas.
- Coexpresión de enzimatransitoria mediada por Agrobacteriumen Nicotiana benthamiana
- Prune plantas de Nicotiana benthamiana de 4 semanas de edad 2 días antes de la infiltración mediante la eliminación de hojas inferiores. Deja 4 hojas superiores. Regar las plantas. No riegar las plantas 24 h antes de la infiltración con el fin de permitir estomas abiertos y una infiltración más fácil.
- Añadir 10 ml de LB con concentraciones de trabajo de los antibióticos adecuados para las construcciones elegidas y la cepa de Agrobacterium (descrita en la Tabla 1) a un tubo de ensayo de vidrio estéril de 50 ml con tapa de papel de aluminio.
- Inocular usando una punta de pipeta para frotar una sola colonia de Agrobacterium transformado y expulsar la punta en los medios LB. Cada transformante de Agrobacterium debe tener al menos 2 cultivos pequeños.
- Incubar durante la noche a 28oC y 220 rpm.
- Mida la densidad óptica a 600 nm (OD600) de los cultivos nocturnos utilizando un espectrofotómetro. Diluir los cultivos nocturnos a una Do6600 de 1.
NOTA: Los valores óptimos de OD600 pueden variar cuando se utilizan otras cepas de Agrobacterium. - Distribuir 10 ml de cultivo pernocal diluido en tubos cónicos de 50 ml.
- Cosechar la bacteria por centrifugación a 3500 rpm durante 15 minutos a temperatura ambiente. Vierte y deseche el sobrenadante.
- Vuelva a suspender los cultivos en un búfer de infiltración de 10 ml agitando suavemente el tubo y rodando sobre un bastidor de tubo. El OD600 debe ser igual a 1 para cada construcción.
- Genere las combinaciones deseadas para las infiltraciones combinando volúmenes iguales de cada línea de celda transformada. El OD600 debe ser igual a 1 por cada infiltración. Estimación de 5 ml de solución de infiltración por hoja, 2 hojas por planta.
- Fije los tubos horizontalmente a un balancín y rocíe suavemente durante 2 h a temperatura ambiente.
- Infiltrar 2 hojas por planta de N. benthamiana utilizando aproximadamente 5 ml de mezcla de infiltración por hoja. Infiltrar hojas sanas con una jeringa sin aguja en la parte inferior de las hojas mientras ejerce una contrapresión con un dedo en la parte superior de la hoja para asegurar la solución de infiltración sofoca el tejido de la hoja.
- Marque todas las hojas infiltradas con un marcador negro u otro indicador. Coloque las plantas infiltradas en la cámara de crecimiento durante 5 días. Mantenga las plantas bien regadas.
NOTA: Un tiempo de incubación de cinco días ha demostrado ser suficiente para alcanzar los niveles de diterpenoides suficiente para la mayoría de los análisis posteriores, manteniendo al mismo tiempo la eficiencia de tiempo de la formación de productos. Se pueden probar períodos de incubación más largos, donde se requieren cantidades de producto más altas.
- Extracción y purificación de metabolitos de Nicotiana benthamiana transformada
- Cosecha de hojas infiltradas de las plantas recortando de la planta. Agregue 100 ml de nitrógeno líquido y una sola hoja a un mortero, luego moler con un mortero y un molino de peste o tejido hasta obtener un polvo fino.
- Agregue el tejido en polvo a un vial GC-MS a la demarcación de 500 ol. Añadir 1,5 ml de 50/50 (v/v) acetato de etilo/hexano o mezcla de disolvente deseada al vial y a la tapa firmemente.
- Para las expresiones que han sido probadas para proporcionar los productos deseados, amontobe el tejido molido en un matraz o tubo de ensayo más grande, luego agregue 2 veces la cantidad de disolvente que el volumen de tejido y agite durante la noche. Continúe con el paso 4.4.5 para la purificación.
- Coloque todos los viales en un bastidor de microtubos y pegue bien para asegurarlos. Extracto bajo agitación vigorosa durante la noche a temperatura ambiente.
- Transfiera 400 ml de extracto y 600 ml de hexano a un vial nuevo de GC-MS. No alícuota ningún tejido de hoja. Analice muestras utilizando GC-MS utilizando el método descrito en el paso 3.3.6.1.
- Después del análisis a través de GC-MS para la presencia de metabolitos deseados, la hoja de la piscina se extrae y procede a través de la evaporación rotativa, la cromatografía de columna de sílice y la HPLC para obtener compuestos puros como se describe en las secciones 3.2 y 3.3.
Resultados
Flujo de trabajo esquemático para la producción de diterpenoides utilizando E. coli
La figura 1 ilustra el flujo de trabajo descrito para la producción de diterpenoides. El protocolo descrito aquí ha sido adaptado de una plataforma e. coli previamente descrita para la biosíntesis diterpenoides13,32 para el uso de cultivos de mayor volumen y la purificación de los productos diterpenoides deseados a través de sílice Cromatografía. Para demostrar el uso de este protocolo, utilizamos una vía de dolabralexina recientemente identificada a partir de maíz que comprende dos diTPS, ZmAN2 (Zm00001d029648) y ZmKSL4 (Zm00001d032858), un P450 multifuncional (CYP71Z18, Zm00001d014134), un cyto P450 (CYP71Z18, Zm00001d014134), un cyto P450 multifuncional), un cyto P450 (CYP71Z18, Zm00001d014134), un cromato P450 (CYP71Z18, Zm00001d014134) y un cromato P4500) reductasa (ZmCPR2, Zm00001d026483) (Figura 2). En resumen, las células competentes de E. coli BL21DE3-C41 se transformaron previamente con los plásmidos pCDFDuet:IRS y pACYC-Duet:GGPPS/ZmAN213,32. El plásmido pCDFDuet:IRS contiene enzimas clave para la producción de precursores diterpenoides, incluyendo 1-deoxy-D-xillosa-5-fosfato sintasa (dxs), 1-desoxi-D-xilulosa-5-fosfato reductasa (dxr), y isopentenyl difosfato isomerasa (idi), y se demostró que aumenta la formación de diterpenoides en E. coli13. El plásmido pACYC-Duet:GGPPS/ZmAN2 contiene el maíz ent-colyl difosfato sintasa ZmAN2 y una ggPP sintasa de Abies grandis. Las enzimas que catalizaban las reacciones cometidas en la biosíntesis de dolabralexina se transformaron entonces como plásmidos pET28b:ZmKSL4 y pETDUET:ZmCPR2/ZmCYP71Z18. Para obtener más información sobre las secuencias y las construcciones de plásmidos, véase Mafu et al. 201839.
En la Figura 3Ase muestra un cromatograma GC-MS de los productos enzimáticos extraídos, que ilustra la formación de tres compuestos de dolabralexina, a saber, dolabradieno (1,2 x 0,25 mg/L de cultivo), epoxidolhana (0,65 x 0,2 mg/L de cultivo) y epoxydolabranol (11,4 • 1,1 mg/L de cultivo) cuantificados sobre la base de una curva estándar utilizando el sclareol diterpenoide. Sclareol se utilizó como un estándar de referencia, debido a su estructura similar y propiedades químicas en comparación con dolabralexinas. Los subproductos menores observados típicamente incluyen cloranfenicol, los derivados indole oxindole e indole-5-aldehído, y el precursor de difosfato de geranilgeranil (GGPP)(Figura 3). Indole representa comúnmente el subproducto primario, pero no se muestra aquí, debido a su tiempo de retención más corto que el retardo de disolvente establecido de 7 min para preservar la integridad del instrumento GC-MS.
Flujo de trabajo esquemático de la producción ditepenoide utilizando N. benthamiana
La Figura 4 representa una visión general de la expresión de la vía de dolabralexina en N. benthamiana. Para los productos descritos aquí, las siguientes construcciones se transformaron por separado en cepa A. tumefaciens GV3101: pLife33:p19 (expresando la proteína supresora de silenciamiento del gen p19), pLife33:ZmCYP71Z18, pLife33:ZmAN2, pLife33:ZmKSL4. Se utilizaron secuencias nativas de longitud completa de los genes de la vía de dolabralexina de maíz en el vector binario T-DNA pLife3341 con resistencia a la kanamicina para su propagación en E. coli y A. tumefaciens. La co-expresión de genes de vía terpenoides aguas arriba es opcional, ya que el precursor difosfato de geranylgeranyl se forma endógenamente en N. benthamiana. Sin embargo, varios estudios han empleado con éxito tales enfoques para aumentar la formación de diterpenoides en N. benthamiana14,36,41. Como se ilustra en la Figura 3,la coexpresión produjo con éxito dolabradieno y 15,16-epoxydolabrene. A diferencia de la coexpresión enzimática en E. coli,15,16-epoxydolabranol no se detectó en extractos de metabolitos.
Presencia de 15,16-epoxydolabrene en extractos de hojas demostró la actividad de CYP71Z18 en N. benthamiana. Como 15,16-epoxydolabranol se demostró que era estable después de la extracción de cultivos microbianos (Figura 3), así como después del aislamiento de los tejidos radiculares de maíz en estudios anteriores39, parece plausible que el producto hidroxilado es glucosilado por glicoseltransferasas endógenas y posteriormente secuestrado en la vacuola, haciéndola inaccesible a la extracción con las mezclas de disolvente orgánico utilizadas aquí para la extracción36,43,44,45 ,46. Modificaciones similares del producto no deseado en el contexto de la ingeniería de caminos en N. benthamiana se han divulgado en estudios anteriores47. Como se muestra para la coexpresión en E. coli, la expresión transitoria en N. benthamiana da como resultado la extracción de varios subproductos, incluyendo alcanos lineales de diferente longitud de cadena como se basa en la comparación con las bases de datos de espectros de masa de referencia. Se encontró que los valoradores compuestos extraídos del material de la hoja eran en promedio 2,4 +/- 0,5 mg de dolabradieno y 0,9 +/- 0,3 mg 15,16-epoxydolabren por g tejido de hoja seca. Estos lanzadores no se pueden comparar directamente con el sistema de coexpresión de E. coli dadas las diferentes configuraciones experimentales.
Purificación ditidinoides
La purificación de diterpenoides se logró utilizando cromatografía de columna de sílice y posterior HPLC semipreparativo. Los extractos de metabolito de 12 L de cultivos agrupados de E. coli se purificaron utilizando cromatografía de columna de sílice para separar los tres compuestos focales de dolabralexina(Figura 3A). La cromatografía de sílice es ideal para lograr una alta pureza de los compuestos objetivo, ya que permite una separación sencilla de las olefinas diterpenos y los derivados oxigenados, y elimina fácilmente el contaminante principal, el oxidante, que se retiene en la matriz de sílice ( Figura 3A).
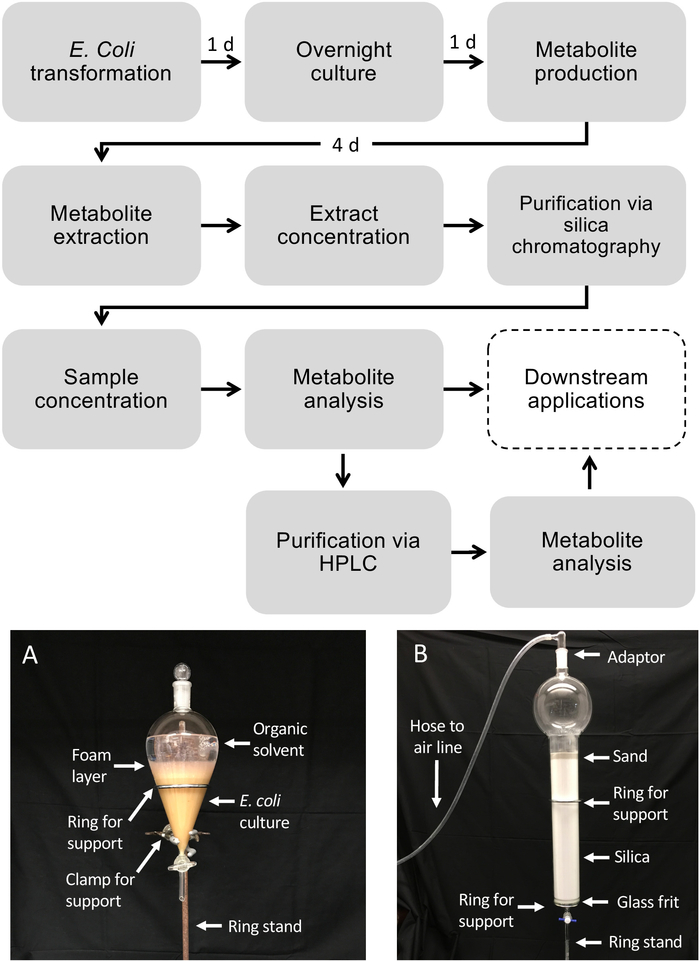
Figura 1: Flujo de trabajo para la producción de diterpenoides en E. coli y purificación de metabolitos de cultivos bacterianos líquidos. Las cajas discontinuas representan pasos opcionales en los que se requiere purificación adicional. (A) Imagen representativa del cultivo extraído de E. coli utilizando un embudo separador. (B) Imagen representativa de la purificación del extracto de metabolito mediante cromatografía de sílice. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: La vía biosintética de Dolabralexina y las construcciones genéticas utilizadas en este estudio. Haga clic aquí para ver una versión más grande de esta figura.
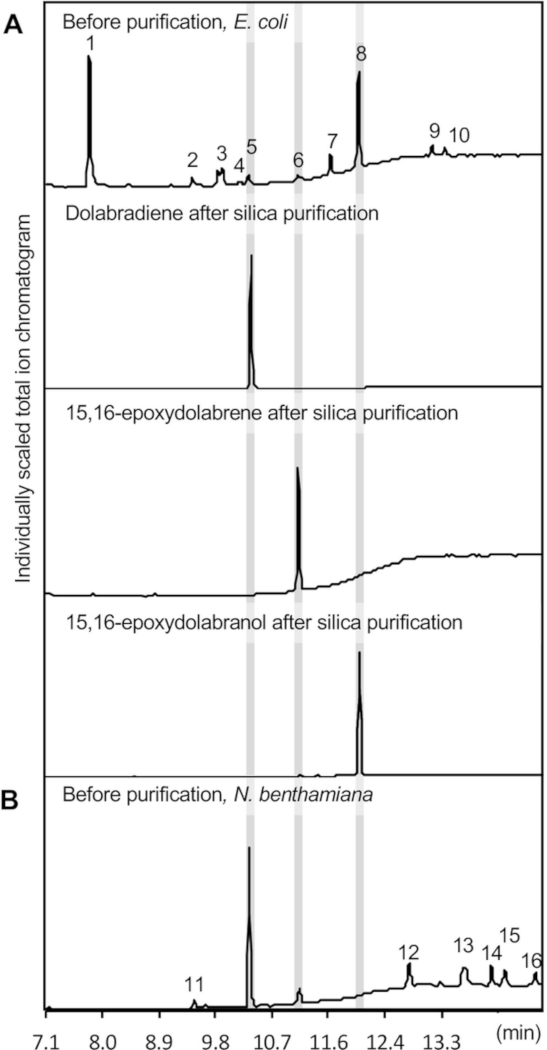
Figura 3: Resultados de GC-MS. Se muestran cromatogramas GC-MS representativos de productos diterpenoides purificados obtenidos mediante ensayos de coexpresión enzimática en (A) E. coli y (B) N. benthamiana. Las identificaciones de productos se basan en comparaciones con estándares auténticos y espectros de masa de referencia de la biblioteca espectral de masas del Instituto Nacional de Estándares y Tecnología (NIST). 1, oxidante; 2, indole-5-aldehyde; 3, Pyrrolo[1,2-a]pirazina-1,4-dione, hexahydro-3-(2-methylpropyl)-; 4, 6-O-acetil-1-[[4-bromofenil]thio]-a-d-glucósido S,S-dióxido; 5, dolabradieno; 6, 15,16-epoxydolabrene; 7, Pyrrolo[1,2-a]pirazina-1,4-dione, hexahydro-3-(phenylmethyl)-; 8, 15,16-epoxydolabranol; 9 y 12, desconocido; 10, cloramphenicol; 11, 3,7,11,15-tetrametil-2-hexadecen-1-ol; 13-16, alcanes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Producción de diterpenoides en N. benthamiana. (A) Flujo de trabajo de la producción de diterpenoides en N. benthamiana y purificación de metabolitos a partir del material de la hoja. (B) Imagen representativa de las plantas de N. benthamiana listas para experimentos de infiltración, antes de la poda. (C) Imágenes representativas de las plantas de N. benthamiana después de la poda. (D) Imagen de las hojas infiltradas en jeringas. Las áreas más oscuras han sido infiltradas. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Una investigación y aplicación más amplia de los productos naturales diterpenoides requiere protocolos simples y económicos para sintetizar y purificar cantidades suficientes de compuestos deseados. El rápido aumento en el número de enzimas diterpenoides-metabólicas disponibles de una amplia gama de especies ahora proporciona un inventario expansivo para la producción enzimática de diterpenoides utilizando sistemas de huésped microbianos y vegetales. Además, la arquitectura modular de muchas vías dterpenoides permite el uso de enzimas de la misma o diferentes especies en enfoques de ingeniería combinativa 'plug & play' para generar una variedad de naturales y nuevos diterpenoides naturales productos2,14,26,35.
E. coli es un huésped microbiano preferido para la biosíntesis de productos naturales debido a su robustez, facilidad de escalabilidad, complejidad química limitada para la contaminación por subproductos reducidos y la riqueza de herramientas disponibles para el montaje y la expresión de ADN Optimización. En nuestra experiencia, la plataforma descrita aquí es adecuada para producir rendimientos de productos de hasta varios cientos de mg de olefinas y alcoholes diterpenos, lo que es adecuado para muchas aplicaciones posteriores, incluidas las propuestas aquí. Aunque no cumple con la escala industrial, la plataforma de producción descrita aquí puede servir como base para la optimización de la vía, el huésped y la fermentación, como se ha demostrado con éxito para los ditepenoides relacionados como taxadiono y sclareol33 ,34. Se ha establecido con éxito la sobreexpresión de genes de vía MVA o MEP que limitan la tasa para superar los factores que limitan el rendimiento de la biosíntesis diterpenoides, como el suministro insuficiente de precursores y el flujo de precursores en las vías competidoras13, 32,33,39. Aunque se ha demostrado que tiene éxito en varios estudios, la mala expresión y la actividad catalítica de los P450 eucariotas terpenoides-metabólicos y otras enzimas unidas a la membrana en E. coli es un factor limitante probable33,39 ,48,49,50,51,52. El uso de secuencias optimizadas para codón y modificaciones proteicas, como la eliminación del péptido de señal retírica endoplasmática o la introducción de un péptido de señal plastidial, han demostrado ser útiles para aumentar la expresión P450 soluble14,38 ,49,50,53. Estas modificaciones también se emplearon para la coexpresión microbiana del maíz CYP71Z1839 utilizado como vía de ejemplo en este estudio. Los protocolos descritos se basan en el uso de plásmidos que transportan uno o dos genes por construcción, todos bajo el mismo promotor inducible. Cuando se desean combinaciones de genes a mayor escala, es aconsejable utilizar varios casetes multigenes disponibles o sistemas de apilamiento de genes para reducir la eficiencia de transformación y el crecimiento del cultivo debido al uso de plásmidos múltiples y antibióticos13 .
Con la mayor disponibilidad de recursos genéticos y genómicos, los sistemas de acogida de plantas también se vuelven cada vez más adecuados para la fabricación de productos naturales. Las ventajas incluyen la capacidad de las plantas para producir los precursores naturales requeridos alimentados por la fotosíntesis, permitiendo así la formación de productos sin la necesidad de complementar las moléculas precursoras54,55. N. benthamiana ya es ampliamente utilizado para la caracterización funcional in vivo y la expresión combinatoria de terpenoides y otras vías de producto natural14,35,36,40 . Las ventajas notables de utilizar N. benthamiana como sistema anfitrión incluyen la producción endógena de precursores diterpenoides, el uso de secuencias genéticas nativas, la expresión simplificada de P450 eucariotas, la facilidad de transformación genética combinatoria (como no se requieren antibióticos separados para la cotransformación transitoria) y la extracción simple de productos diana del material de la hoja. Cuando sea necesario, la producción de diterpenoides puede mejorarse mediante la coexpresión de genes clave de la vía del MEP para aumentar la oferta de precursores36,41. Las restricciones para la producción de diterpenoides escalables en N. benthamiana son más complejas en comparación con los cultivos microbianos líquidos debido a la necesidad de generar suficiente biomasa vegetal, una purificación de productos más intensiva en mano de obra a partir de productos químicamente complejos tejido vegetal, y posible metabolización no deseada de los productos diana a través, por ejemplo, de la oxidación, glicosilación o desfosforilación por enzimas endógenas36,43,44,45 ,46,47. Sin embargo, este procedimiento se puede escalar hasta cantidades de productos mg aumentando el número de plantas utilizadas para la agroinfiltración56.
Los protocolos de extracción y purificación de productos descritos aquí son compatibles con E. coli y N. benthamiana,así como con S. cerevisiae y otros sistemas de acogida de plantas o microbianos, y proporcionan un enfoque rentable que es fácil de en laboratorios de biología y química y no requiere costosos equipos de purificación. La extracción de metabolitos mediante un embudo separador es adecuada para la extracción eficiente y la separación de fases antes de la purificación cromatográfica. Los tamaños de embudo se pueden ajustar fácilmente para permitir volúmenes de cultivo más grandes y reducir el tiempo experimental necesario para extraer de grandes cultivos. Encontramos que el uso de un gradiente de acetato de hexano/etil es ideal para extraer diterpenoides de diferente polaridad como se ha demostrado aquí para el grupo de dolabralexinas que comprenden tanto hidrocarburos como compuestos oxigenados (Figura 3). Dependiendo de las propiedades de los productos objetivo, otras mezclas de disolventes pueden ser ventajosas. Sin embargo, los disolventes no deben ser miscibles con agua para garantizar una extracción y separación de fase sin éxito utilizando la técnica de embudo separador. Además, debe tenerse en cuenta la pérdida de producto a través de la evaporación al utilizar este enfoque para producir compuestos orgánicos volátiles (COV), como los mono- y sesqui-terpenoides de menor peso molecular y otros COV. La separación cromatográfica de los ditadrenalinoides de los diferentes niveles de oxigenación utilizando una columna de sílice a mayor escala (2 L) ha sido ventajosa en nuestra experiencia, ya que proporciona una mejor separación del producto y minimiza la necesidad de purificación iterativa pasos al utilizar volúmenes de columna más pequeños. Los volúmenes de columnas y matrices se pueden ajustar según sea necesario para el volumen de cultivo deseado y el tipo de producto natural. La pureza de los productos de destino que se pueden lograr utilizando este protocolo es adecuada para muchas aplicaciones posteriores, como ensayos de bioactividad o para su uso en análisis de actividad enzimática. Sin embargo, cuando se requieren niveles de pureza más altos, como análisis estructurales a través de RMN, la pureza del producto puede mejorarse eficientemente mediante una purificación adicional utilizando HPLC (semi)-preparativo.
Este protocolo descrito aquí ha sido optimizado para la producción de productos naturales diterpenoides, pero también se puede personalizar fácilmente a mono-, sesqui- y tri-terpenoides relacionados, así como otras clases de productos naturales simplemente generando la enzima deseada módulos para la expresión combinatoria14,57. Sin embargo, las modificaciones de los procedimientos de extracción y purificación de productos deben tenerse en cuenta para los compuestos con mayor volatilidad, como los mono- y los sesqui-terpenoides, o una mayor polaridad y modificación funcional como lo ejemplifican glicosilación de muchos triterpenoides, fenilpropanoides, y otras clases de productos naturales.
Aunque las plataformas a escala industrial para la fabricación de productos naturales están disponibles, los protocolos descritos aquí ofrecen una herramienta económica y personalizable que se puede configurar fácilmente en la mayoría de los laboratorios. Como lo demuestra la producción de dolabralexinas de maíz aquí y en otros lugares39, las cantidades de productos y la pureza que se pueden lograr utilizando este enfoque son típicamente suficientes para facilitar diversos análisis y usos posteriores, incluyendo, pero no varios estudios de bioactividad, análisis de interacciones entre organismos, así como para su uso como sustratos enzimáticos o como material de partida para enfoques de semisíntesis.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Agradecemos al Dr. Reuben Peters (Universidad Estatal de Iowa, EE. UU.) por proporcionar las construcciones pIRS y pGGxZmAN2. Apoyo financiero para este trabajo por el Programa de Interacciones Planta-Bióticas de la NSF (subvención 1758976 a P.Z.), el Programa de Investigación de Carrera Temprana del DOE (subvención DE-SC0019178 a P.Z.), el Programa conjunto de ciencias comunitarias del Instituto del Genoma de la DOE (subvención CSP2568 a P.Z.), el NSF El Programa de Becas de Investigación de Posgrado (a K.M.M.), y una Beca de Premio Mentoría de UC Davis Dean (a K.M.M.) son reconocidos con gratitud.
Materiales
| Name | Company | Catalog Number | Comments |
| 1020 Trays | Greenhouse Megastore | CN-FLHD | |
| 2-(N-morpholino)ethanesulfonic acid | Sigma | M8250-500g | MES |
| 4" Tech Square Pot | McConkey Wholesale Grower's Supply | JMCTS4 | |
| 5977 Extractor XL MS | Agilent | - | |
| 7890B GC | Agilent | - | |
| Acetonitrile | Sigma | 271004 | |
| Agar | Fisher | BP1423-2 | |
| Bacterial yeast extract | Fisher | BP9727-2 | |
| Beaker | CTechGlass | BK-2001-015B | |
| Cap, 9 mm blue screw, PFTE | Agilent | 5185-5820 | GC vial cap |
| Carbenicillin | Genesee | 25-532 | Carb |
| Chloramphenicol | Fisher | 50247423 | Chlor |
| Chromatography column | CTechGlass | CL-0015-022 | |
| Clear humidity dome | Greenhouse Megastore | CN-DOME | |
| ColiRollers Plating Beads | Sigma | 71013 | Glass beads |
| CoorsTek Porcelain Mortars | Fisher | 12-961A | mortar |
| CoorsTek Porcelain Pestles | Fisher | 12-961-5A | pestle |
| Delta-Aminolevulinic acid hydrochloride | Sigma | 50981039 | Aminoleuvolinic acid |
| Ethanol | Fisher | A962-4 | EtOH |
| Ethyl acetate | Fisher | E1454 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | Falcon tubes |
| Fisherbrand Disposable Cuvettes | Fisher | 14-955-127 | cuvette |
| Fisherbrand Petri Dishes with Clear Lid | Fisher | FB0875713 | petri dish |
| Fisherbrand Polypropylene Microtube Storage Racks | Fisher | 05-541 | microtube rack |
| Glucose | Sigma | G7021 | |
| Glycerol | Fisher | G33-500 | |
| Hexanes | Fisher | H292-4 (CS) | |
| HP-5MS | Agilent | 19091S-433 | GC column |
| Inlet adapter | CTechGlass | AD-0006-003 | glass inlet adapter |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher | BP1755-100 | IPTG |
| Kanamycin | Fisher | BP9065 | Kan |
| KIM-KAP Caps, Disposable, Polypropylene, Kimble Chase | VWR | 60825-798 | breathable test tube lids |
| Magnesium chloride | Acros | 223210010 | MgCl2 |
| Magnesium sulfate | Sigma | M7506-500g | MgSO4 |
| Miracle-Gro Water Soluble All Purpose Plant Food | Miracle-Gro | 2756810 | |
| Mixer Mill MM 200 | Retsch | 20.746.0001 | tissue mill |
| Nalgene Fernbach culture flask | Sigma | Z360236 | 2.8 L flask |
| New Brunswick I26 | Eppendorf | M1324-0000 | Shaking incubator |
| Nicotiana benthamiana seed | USDA Germplasm Repository | Accession TW16 | N. benthamiana |
| OverExpress C41(DE3) Chemically Competent Cells | Lucigen | 60442 | C41-DE3 cells |
| Parafilm M wrapping film | Fisher | S37440 | Parafilm |
| Potassium chloride | Sigma | P-9541 | KCl |
| Potassium phosphate dibasic anhydrous | Fisher | P288-3 | Dipotassium phosphate |
| Potassium phosphate monobasic | Monopotassium phosphate | ||
| Pyrex disposable culture tubes, rimless | Sigma | CLS9944516 | test tubes |
| Pyruvate Acid Sodium Salt | Fisher | 501368477 | Sodium pyruvate |
| Retort Ring Stands | CTechGlass | ST00 | ring stand |
| Riboflavin | Amresco | 0744-250g | |
| Rifampicin | Sigma | R7382 | Rif |
| Rotovap | |||
| Sand, 50-70 mesh particle size | Sigma | 274739-1KG | |
| Silica | Fisher | AC241660010 | silica gel |
| Sodium chloride | Fisher | 5271-3 | NaCl |
| Sodum hydroxide | Fisher | SS266-1 | NaOH |
| Spectinomycin | Fisher | 501368607 | Spec |
| Squibb Separatory Funnel | CTechGlass | FN-1060-006 | Separatory funnel |
| Sunshine Mix #1 | Sungro Horticulture | Potting soil | |
| Thermo Scientific Snap Cap Low Retention Microcentrifuge Tubes | Fisher | 21-402-902 | microtube |
| Triangle funnel | CTechGlass | FN-0035 | funnel |
| Tryptone | Fisher | BP14212 | |
| Vial, screw, 2 mL, amber, WrtOn | Agilent | 5182-0716 | GC vial |
| visible spectrophotometer, V-1200 | VWR | 634-6000P | spectrophotometer |
| ZORBAX Eclipse XDB-C18 | Agilent | 990967-202 | HPLC column |
| ZORBAX Eclipse XDB-CN | Agilent | 990967-905 | HPLC column |
Referencias
- Peters, R. J. Two rings in them all: the labdane-related diterpenoids. Natural Product Reports. 27 (11), 1521-1530 (2010).
- Zerbe, P., Bohlmann, J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33 (7), 419-428 (2015).
- Toyomasu, T. Recent advances regarding diterpene cyclase genes in higher plants and fungi. Bioscience, Biotechnology, and Biochemistry. 72 (5), 1168-1175 (2008).
- Smanski, M. J., Peterson, R. M., Huang, S. X., Shen, B. Bacterial diterpene synthases: new opportunities for mechanistic enzymology and engineered biosynthesis. Current Opinion in Chemical Biology. 16 (1-2), 132-141 (2012).
- Salazar-Cerezo, S., Martinez-Montiel, N., Garcia-Sanchez, J., Perez, Y. T. R., Martinez-Contreras, R. D. Gibberellin biosynthesis and metabolism: A convergent route for plants, fungi and bacteria. Microbiological Research. 208, 85-98 (2018).
- Keeling, C. I., Bohlmann, J. Diterpene resin acids in conifers. Phytochemistry. 67 (22), 2415-2423 (2006).
- Schmelz, E. A., et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins. Plant Journal. 79 (4), 659-678 (2014).
- Bohlmann, J., Keeling, C. I. Terpenoid biomaterials. Plant Journal. 54 (4), 656-669 (2008).
- Mafu, S., Zerbe, P. Plant diterpenoid metabolism for manufacturing the biopharmaceuticals of tomorrow: prospects and challenges. Phytochemistry Reviews. 17 (1), 113-130 (2017).
- Hillwig, M. L., Mann, F. M., Peters, R. J. Diterpenoid biopolymers: new directions for renewable materials engineering. Biopolymers. 95 (2), 71-76 (2011).
- Jorgensen, L., et al. 14-step synthesis of (+)-ingenol from (+)-3-carene. Science. 341 (6148), 878-882 (2013).
- Line, N. J., Burns, A. C., Butler, S. C., Casbohm, J., Forsyth, C. J. Total Synthesis of (-)-Salvinorin A. Chemistry. 22 (50), 17983-17986 (2016).
- Morrone, D., et al. Increasing diterpene yield with a modular metabolic engineering system in E. coli: comparison of MEV and MEP isoprenoid precursor pathway engineering. Applied Microbioly and Biotechnology. 85 (6), 1893-1906 (2010).
- Kitaoka, N., Lu, X., Yang, B., Peters, R. J. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Molecular Plant. 8 (1), 6-16 (2015).
- George, K. W., et al. Metabolic engineering for the high-yield production of isoprenoid-based C(5) alcohols in E. coli. Scientific Reports. 5, 11128(2015).
- Paddon, C. J., Keasling, J. D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology. 12 (5), 355-367 (2014).
- Keasling, J. D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering. 14 (3), 189-195 (2012).
- Kampranis, S. C., Makris, A. M. Developing a yeast cell factory for the production of terpenoids. Computational and Structural Biotechnology Journal. 3 (4), e201210006(2012).
- Tholl, D. Biosynthesis and biological functions of terpenoids in plants. Advances in Biochemical Engineering/Biotechnology. 148, 63-106 (2015).
- McGarvey, D. J., Croteau, R. Terpenoid metabolism. The Plant Cell. 7 (7), 1015-1026 (1995).
- Chen, F., Tholl, D., Bohlmann, J., Pichersky, E. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. The Plant Journal. 66 (1), 212-229 (2011).
- Pateraki, I., Heskes, A. M., Hamberger, B. Cytochromes P450 for terpene functionalisation and metabolic engineering. Advances in Biochemical Engineering/Biotechnology. 148, 107-139 (2015).
- Cao, R., et al. Diterpene cyclases and the nature of the isoprene fold. Proteins. 78 (11), 2417-2432 (2010).
- Reiling, K. K., et al. Mono and diterpene production in Escherichia coli. Biotechnology and Bioengineering. 87 (2), 200-212 (2004).
- Hamberger, B., Plant Bak, S. P450s as versatile drivers for evolution of species-specific chemical diversity. Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1612), 20120426(2013).
- Jia, M., Potter, K. C., Peters, R. J. Extreme promiscuity of a bacterial and a plant diterpene synthase enables combinatorial biosynthesis. Metabolic Engineering. 37, 24-34 (2016).
- Paddon, C. J., et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 496 (7446), 528-532 (2013).
- Peralta-Yahya, P. P., Zhang, F., del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Pateraki, I., et al. Total biosynthesis of the cyclic AMP booster forskolin from Coleus forskohlii. Elife. 6, e23001(2017).
- Ignea, C., et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform. Proceedings of the National Academy of Sciences of the United States of America. 113 (13), 3681-3686 (2016).
- Ignea, C., et al. Reconstructing the chemical diversity of labdane-type diterpene biosynthesis in yeast. Metabolic Engineering. 28, 91-103 (2015).
- Cyr, A., Wilderman, P. R., Determan, M., Peters, R. J. A modular approach for facile biosynthesis of labdane-related diterpenes. Journal of the American Chemical Society. 129 (21), 6684-6685 (2007).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Schalk, M., et al. Toward a biosynthetic route to sclareol and amber odorants. Journal of the American Chemical Society. 134 (46), 18900-18903 (2012).
- Andersen-Ranberg, J., et al. Expanding the Landscape of Diterpene Structural Diversity through Stereochemically Controlled Combinatorial Biosynthesis. Angewandte Chemie International Edition in English. 55 (6), 2142-2146 (2016).
- Bruckner, K., Tissier, A. High-level diterpene production by transient expression in Nicotiana benthamiana. Plant Methods. 9 (1), 46(2013).
- Emanuelsson, O., Brunak, S., von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols. 2 (4), 953-971 (2007).
- Hausjell, J., Halbwirth, H., Spadiut, O. Recombinant production of eukaryotic cytochrome P450s in microbial cell factories. Bioscience Reports. 38 (2), BSR20171290(2018).
- Mafu, S., et al. Discovery, biosynthesis and stress-related accumulation of dolabradiene-derived defenses in maize. Plant Physiology. 176 (4), 2677-2690 (2018).
- Zerbe, P., et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiology. 162 (2), 1073-1091 (2013).
- Bach, S. S., et al. High-throughput testing of terpenoid biosynthesis candidate genes using transient expression in Nicotiana benthamiana. Methods in Molecular Biology. , 245-255 (2014).
- Sainsbury, F., Thuenemann, E. C., Lomonossoff, G. P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants. Plant Biotechnology Journal. 7 (7), 682-693 (2009).
- Wang, B., et al. Transient production of artemisinin in Nicotiana benthamiana is boosted by a specific lipid transfer protein from A. annua. Metabolic Engineering. 38, 159-169 (2016).
- Reed, J., Osbourn, A. Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37 (10), 1431-1441 (2018).
- Dong, L., Jongedijk, E., Bouwmeester, H., Der Krol, A. V. an Monoterpene biosynthesis potential of plant subcellular compartments. New Phytologist. 209 (2), 679-690 (2016).
- Liu, Q., et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One. 6 (8), e23255(2011).
- Karunanithi, P. S., et al. Functional characterization of the cytochrome P450 monooxygenase CYP71AU87 indicates a role in marrubiin biosynthesis in the medicinal plant Marrubium vulgare. BMC Plant Biology. 19 (1), 114(2019).
- Pelot, K., et al. Functional diversity of diterpene synthases in the biofuel crop switchgrass. Plant Physiology. 178 (1), 54-71 (2018).
- Wang, Q., Hillwig, M. L., Wu, Y., Peters, R. J. CYP701A8: a rice ent-kaurene oxidase paralog diverted to more specialized diterpenoid metabolism. Plant Physiology. 158 (3), 1418-1425 (2012).
- Wang, Q., Hillwig, M. L., Peters, R. J. CYP99A3: functional identification of a diterpene oxidase from the momilactone biosynthetic gene cluster in rice. The Plant Journal. 65 (1), 87-95 (2011).
- Morrone, D., Chen, X., Coates, R. M., Peters, R. J. Characterization of the kaurene oxidase CYP701A3, a multifunctional cytochrome P450 from gibberellin biosynthesis. Biochemical Journal. 431 (3), 337-344 (2010).
- Swaminathan, S., Morrone, D., Wang, Q., Fulton, D. B., Peters, R. J. CYP76M7 is an ent-cassadiene C11alpha-hydroxylase defining a second multifunctional diterpenoid biosynthetic gene cluster in rice. The Plant Cell. 21 (10), 3315-3325 (2009).
- Gnanasekaran, T., et al. Heterologous expression of the isopimaric acid pathway in Nicotiana benthamiana and the effect of N-terminal modifications of the involved cytochrome P450 enzyme. Journal of Biological Engineering. 9 (1), 24(2015).
- De Luca, V., Salim, V., Atsumi, S. M., Yu, F. Mining the biodiversity of plants: a revolution in the making. Science. 336 (6089), 1658-1661 (2012).
- Wurtzel, E. T., Kutchan, T. M. Plant metabolism, the diverse chemistry set of the future. Science. 353 (6305), 1232-1236 (2016).
- Menon, A., et al. Mobile-based insulin dose adjustment for type 2 diabetes in community and rural populations: study protocol for a pilot randomized controlled trial. Therapeutic Advances in Endocrinology and Metabolism. 10, 2042018819836647(2019).
- Moses, T., et al. OSC2 and CYP716A14v2 catalyze the biosynthesis of triterpenoids for the cuticle of aerial organs of Artemisia annua. The Plant Cell. 27 (1), 286-301 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados