Method Article
Un approccio personalizzabile per la produzione e la purificazione esulta dei prodotti naturali Diterpenoid
In questo articolo
Riepilogo
Qui presentiamo protocolli facili da usare per la produzione e la purificazione di metaboliti diterpenoidi attraverso l'espressione combinatoria di enzimi biosintetici in Escherichia coli o Nicotiana benthamiana, seguita da prodotto cromatografico Purificazione. I metaboliti risultanti sono adatti per vari studi, tra cui la caratterizzazione della struttura molecolare, gli studi funzionali degli enzimi e i saggi di bioattività.
Abstract
I diterpenoidi formano una classe diversificata di piccoli prodotti naturali molecolari che sono ampiamente distribuiti tra i regni della vita e hanno funzioni biologiche critiche nei processi di sviluppo, nelle interazioni interorganismiali e nell'adattamento ambientale. A causa di queste varie bioattività, molti diterpenoidi sono anche di importanza economica come prodotti farmaceutici, additivi alimentari, biocarburanti e altri bioprodotti. La genomica avanzata e gli approcci biochimici hanno permesso un rapido aumento della conoscenza dei geni diterpenoidi-metabolici, degli enzimi e delle vie. Tuttavia, la complessità strutturale dei diterpenoidi e la distribuzione tassonomica ristretta dei singoli composti in una sola specie rimangono fattori vincolanti per la loro produzione efficiente. La disponibilità di una più ampia gamma di enzimi metabolici fornisce ora risorse per la produzione di diterpenoidi in sufficiente titer e purezza per facilitare un'indagine più approfondita di questo importante gruppo di metaboliti. Attingendo a strumenti consolidati per la co-espressione enzimatica microbica e vegetale, presentiamo un protocollo facilmente gestibile e personalizzabile per la produzione enzimatica di diterpenoidi in Escherichia coli o Nicotiana benthamiana, e la purificazione dei prodotti desiderati tramite cromatografia in silice e HPLC semi-preparativo. Utilizzando come esempio il gruppo di mais(zea mays),gli enzimi della dolabralexina, evidenziano come possono essere utilizzate combinazioni modulari di synthasi diterpene (diTPS) e citocromo P450 monoosasi (P450) per generare diverse scaffold diterpenoidi. I composti purificati possono essere utilizzati in varie applicazioni a valle, come le analisi strutturali dei metaboliti, gli studi sulla struttura enzimatica e in vitro e negli esperimenti di bioattività vegetale.
Introduzione
I diterpenoidi costituiscono un gruppo chimicamente diversificato di oltre 12.000 prodotti naturali prevalentemente policiclici a 20 carbonio che svolgono ruoli critici in molti organismi1. Funghi e piante producono la più grande diversità di diterpenoidi, ma i batteri hanno anche dimostrato di formare diterpenoidi bioattivi (vedi recensioni2,3,4,5). Radicati nella loro vasta diversità strutturale, i diterpenoidi servono una moltitudine di funzioni biologiche. Alcuni diterpenoidi, come gli ormoni della crescita gibberellina, hanno funzioni essenziali nei processi di sviluppo5. Tuttavia, la maggior parte dei diterpenoidi servono come mediatori di difesa chimica e interazioni interorganismisali. Tra questi, gli acidi di resina diterpene nella difesa dei parassiti e agenti patogeni di alberi di conifere e miscele specifiche di specie di diterpenope antimicrobici nelle principali colture alimentari come il mais (zea mays) e il riso (Oryza sativa) sono stati più ampiamente studiato6,7. Queste bioattività forniscono un ricco archivio chimico per applicazioni commerciali, e diterpenoidi selezionati sono utilizzati come importanti prodotti farmaceutici, additivi alimentari, adesivi, e altri bioprodotti della vita moderna quotidiana8,9 ,10. Per far progredire la ricerca sulla diversità naturale e le funzioni biologiche dei diterpenoidi e, in ultima analisi, promuovere applicazioni commerciali più ampie, sono necessari strumenti per la preparazione efficiente in termini di costi dei composti puri. L'isolamento su larga scala dal materiale vegetale è stato stabilito per alcuni bioprodotti diterpenoidi, come gli acidi di resina diterpene che vengono prodotti come sottoprodotto dell'industria della cellulosa e della carta8. Tuttavia, l'accumulo di diterpenoidi solo in tessuti specifici e sotto stretta regolamentazione da parte di stimoli ambientali spesso limita l'isolamento di quantità sufficienti di prodotti dal produttore naturale2. Inoltre, la complessità strutturale dei diterpenoidi ostacola la loro produzione attraverso la sintesi chimica, anche se tali approcci hanno avuto successo in diversi casi11,12. Con la disponibilità di tecnologie genomiche e biochimiche avanzate, le piattaforme di produzione enzimatica hanno guadagnato sempre più attenzione per la produzione di una gamma di composti diterpenoidi (vedi recensioni13,14, 15,16,17,18).
Tutti i terpenoidi, compresi i diterpenoidi, sono derivati da due precursori isoprenoidi isomerici, il difosfato di istenil (IPP) e il difosfato didimioillalzato (DMAPP)19 che, a loro volta, si formano attraverso il mevalonato (MVA) o il percorso metiletritolo-5-fosfato (MEP). La biosintesi terpenoide procede attraverso il percorso MEP nei batteri e il percorso MVA nei funghi, mentre le piante possiedono un MVA citosolico e un percorso plastidiale MEP, con quest'ultimo che è il percorso primario verso la formazione di diterpenoide20. La condensazione di IPP e DMAPP da parte di transfersi prenyl produce il precursore centrale di 20 carbonio di tutti i diterpenoidi, geranilgeranil difosato (GGPP)20. A valle della formazione ggPP, due famiglie di enzimi, sintetisi terpene (TPS) e monossisisi P450 citoccherate (P450) controllano in gran parte la formazione della vasta diversità chimica del metabolismo terpenoide21,22. Le sinteasi diterpene (diTSP) catalizzano la ciclicizzazione e ilriarrangiamento di GGPP stereospecifici per formare vari scaffold stereotiformi bi-, poli-, o macro-ciclici 24. L'ossigenazione e l'ulteriore decorazione funzionale di questi scaffold è quindi facilitata da enzimi P450 e selezionare altre famiglie di enzimi22,25. I TSP e i P450 esistono comunemente come famiglie multigeniche specifiche per specie che possono formare reti biosintetiche modulari, dove la combinazione di diversi moduli enzimatici lungo un blueprint comune consente la formazione di un'ampia gamma di composti2, 26.La rapida scoperta di enzimi funzionalmente distinti che operano in percorsi terpenoidi modulari negli ultimi anni ha fornito opportunità di espansione per il loro utilizzo come elenco di parti versatili per l'ingegneria metabolica di percorsi parziali o completi in piattaforme di produzione microbiche e vegetali. Ad esempio, il lievito (Saccharomyces cerevisiae) è stato applicato con successo per progettare percorsi multienzimi per la produzione di bioprodotti terpenoidi, come il farmaco antimalarico artemisinina27, i biocarburanti sestantistici bisabolene e farnesene28, ma anche selezionare diterpenoidi29,30,31. Allo stesso modo, sono state create piattaforme escherichia coli ingegnerizzate per la produzione su scala industriale per alcuni metaboliti diterpenoidi, tra cui il taxadiene precursore Taxol usato come farmaco anti-cancro e l'alcol diterpene, sclareol , utilizzato nell'industria delle fragranze13,32,33,34. I progressi nell'ingegneria genetica e nelle tecnologie di trasformazione hanno anche reso i sistemi di accoglienza delle piante sempre più vitali per la produzione di prodotti naturali vegetali9,14,35,36. In particolare, la stretta parente tabaccosa, Nicotiana benthamiana, è diventata un telaio ampiamente utilizzato per l'analisi e l'ingegneria del percorso terpenoide, grazie alla facilità di trasformazionemediata di combinazioni geniche multiple , biosintesi efficiente dei precursori endogeni, e biomassa elevata14,35,36.
Attingendo a queste piattaforme consolidate per la biosintesi terpenoide, qui descriviamo metodi facili da usare ed efficienti in termini di costi per la produzione enzimatica di diterpenoidi e la purificazione dei singoli composti. I protocolli presentati illustrano come le piattaforme E. coli e N. benthamiana progettate per una maggiore biosintesi precursore di diterpenoide possono essere utilizzate per l'espressione combinatoria di diversi diTPe e P450 enzimi da generare composti diterpenoidi desiderati. L'applicazione di questo protocollo per produrre e purificare diterpenoidi strutturalmente diversi è dimostrata da esempio di diterpenoidi specializzati dal mais(zea mays),definite dolabralexine, biosintesi endogeniche di cui recluta due diTPS e un P450 enzima m. La purificazione di diverse dolabralexine che vanno dalle olepine ai derivati ossigenati viene quindi ottenuta combinando l'estrazione a imbuto separatore con la cromatografia a colonna silice su larga scala e la cromatografia liquida ad alta pressione (HPLC). I protocolli descritti sono ottimizzati per la produzione di diterpenoidi, ma possono anche essere facilmente adattati per le classi terpenoidi correlate, così come altri prodotti naturali per i quali sono disponibili risorse enzimatiche. I composti prodotti utilizzando questo approccio sono adatti per varie applicazioni a valle, tra cui, ma non solo, la caratterizzazione strutturale tramite l'analisi della risonanza magnetica nucleare (NMR), l'uso come substrati per studi funzionali enzimatici e una serie di bioattività.
Protocollo
AVVISO: I protocolli qui descritti includono l'uso di sostanze chimiche pericolose, oggetti taglienti, dispositivi elettrici, oggetti caldi e altri pericoli che possono causare lesioni. Devono essere indossate attrezzature di protezione personale adeguate e seguire le procedure di sicurezza appropriate, compresi gli allenamenti di sicurezza.
1. Preparazione di materiali e soluzioni
- Preparare e autoclamare lievitario brodo medio (LB) per 30 min: Per 1 L di media, mescolare 10 g di tryptone, 5 g di estratto di lievito batterico, e 10 g di NaCl e sciogliere in 1 L di acqua deionizzata (DI).
- Per le colture di co-espressione 1 L, preparare e autoclave terrificante terrificante terrificante (TB) media per 30 min: In un 2.8 L Erlenmeyer flask mix 12 g di tryptone, 24 g di estratto di lievito batterico, e 40 mL di 10% (v / v) glicerolo e sciogliere in 860 mL di acqua DI. Preparare e autoclave 1.3 L di 10x fosfato tampone [1.3 L di acqua DI, 30.03 g di monopotassio fosfato (KH2PO4),e 163.02 g di fosfato dipotassio (K2HPO4)] e aggiungere al mezzo di cui sopra.
- Preparare il brodo super ottimale con i media di repressione Catabolita (SOC).
- Preparare e autoclave per 30 min una soluzione contenente 2% (w/v) tryptone, 0.5% (w/v) estratto di lievito batterico, 8.5 mM NaCl, e 2.5 mM KCl.
- Aggiungere sterile MgSO4 e glucosio sia con una concentrazione finale di 20 mM. Utilizzare 1 M NaOH per regolare a pH 7.0. Conservare il supporto SOC a -20 gradi centigradi.
- Preparare 1 L di 1 M di pirata di sodio. Autoclave per 15 min e conservare a 4 gradi centigradi.
- Preparare 20 mL di 1 M isopropilez -D-1-thiogalactopyranoside (IPTG) in acqua DI sterile. Conservare 1-2 mL di aliquote a -20 gradi centigradi.
- Preparare il buffer di infiltrazione: 10 mM MES (1,952 g) e 10 mM MgCl2 (2.033 g) sciolto in 1 L di acqua DI. Conservare a 4 gradi centigradi.
- Preparare e autoclave LB agar per 30 min: Per 100 mL di acqua DI, aggiungere 1 g di tryptone, 0,5 g di estratto di lievito batterico, 1 g di NaCl e 1,5 g di agar. Una volta che l'agar LB è abbastanza fresco per gestire la bottiglia, aggiungere antibiotici come richiesto per le combinazioni di plasmide desiderate. Versare i piatti di agar con piatti di Petri e conservarli a 4 gradi centigradi.
- Vedere la Tabella 1 per le specifiche relative alla produzione di composti in E. coli e N. benthamiana, rispettivamente. Avvolgere le piastre contenenti rifampicina in lamina per evitare la degradazione al momento dello stoccaggio.
| Concentrazione di lavoro (g/mL) | |||||
| antibiotico | Magazzino (mg/mL) | Solvente | 1 plasmide | 2 plasmidi | 3 o 4 plasmidi |
| Carbenicillina | 50 | H2O | 50 | 25 | 20 |
| Cloramfenicolo | 30 | Etoh | 30 | 20 | 20 |
| Kanamicina | 50 | H2O | 50 | 25 | 20 |
| Spettronomia | 30 | H2O | 30 | 25 | 20 |
| Gentamicino | 50 | H2O | 30 | ||
| Rifampicina | 10 | Meoh | 10 | ||
Tabella 1: Concentrazioni antibiotiche per la co-espressione di plasmide in E. coli o N. benthamiana.
2. Produzione di metaboliti diterpenoidi in E. coli
NOTA: Il protocollo qui descritto per la produzione di metaboliti diterpenoidi in E. coli è stato adattato da una piattaforma di co-espressione degli enzimi precedentemente segnalata sviluppata dal gruppo del Dr. Reuben J. Peters (Iowa State University, IA, USA)13 ,32.
- Trasformazione di celle competenti con combinazioni di plasmidi.
- In questo protocollo sono state utilizzate cellule E. coli chimicamente competenti sul ghiaccio (in questo protocollo sono state utilizzate cellule E. coli che sono state utilizzate).
- Aggiungere 1 l l di una soluzione da 100 ng/L di ogni costrutto utilizzato per la co-espressione a 25 - L di cellule competenti in un microtubo da 1,5 mL. Non vorticare o mescolare pipettando.
NOTA: per un'espressione e un'attività ottimali degli enzimi TPS e P450, è necessario considerare diverse modifiche di sequenza. Per TPS, la rimozione del peptide di transito plastidiale N-terminale è spesso essenziale. In particolare, le mono e le TPS plastidiari richiedono in genere la rimozione del peptide di transito previsto (utilizzando comuni algoritmi di previsione37),mentre il citosolico sesqui-TPS di solito può essere utilizzato come geni a lunghezza intera. Per quanto riguarda i P450, l'ottimizzazione del codone, nonché la rimozione o la sostituzione con la sequenza leader MAKKTSSKGK del dominio transmembrana N-terminale si è dimostrata efficace in molti casi38,39. Inoltre, quando co-espliciti P450 enzimi una riduttrice P450 citocromatica (CPR) deve essere incluso per garantire un'attività Sufficiente P450. - Incubare la miscela sul ghiaccio per 30 minuti. Mescolare ogni 10 minuti raschiando delicatamente il tubo attraverso un rack microtubo.
- Pre-incubare i supporti SOC e le piastre di agar LB a 37 gradi centigradi contenenti antibiotici, come richiesto per la combinazione desiderata di costrutti.
NOTA: ogni costrutto da trasformare deve avere una distinta resistenza agli antibiotici, così come origini distinte della replicazione per garantire un'espressione proteica ottimale. - Riscaldare la miscela cellulare a 42 gradi centigradi per 1 minuto, quindi incubare sul ghiaccio per almeno 2 minuti.
- Aggiungere 200 l di supporti SOC caldi.
- Agitare la miscela di cellule per 1 h a 37 e 200 giri/min.
- Aggiungere circa 10 perline di vetro autoclaved al piatto caldo LB agar. Aggiungere 100 l della miscela cellulare e sostituire il coperchio. Agitare la piastra orizzontalmente con il coperchio per distribuire le cellule in modo uniforme. Rimuovere le perline di vetro toccandole in un contenitore di rifiuti. In alternativa, utilizzare altri metodi di placcatura preferiti.
- Incubare la piastra di agar LB a 37 gradi durante la notte con la superficie rivestita a faccia in giù. La piastra con colonie di E. coli trasformate può essere utilizzata il giorno successivo o conservata a 4 gradi centigradi sigillata in pellicola di paraffina per un massimo di 2 settimane.
- Preparazione delle culture di inoculazione
- Il giorno successivo, preparare una soluzione di supporto LB con antibiotici necessari per la combinazione di plasmidi trasformati utilizzando le concentrazioni fornite nella tabella 1.
- In un cappuccio sterile, trasferire 5 mL di LB medio in un tubo di prova in vetro sterile 15 mL con un tappo di plastica traspirante. Preparare un piccolo tubo di coltura per ogni grande cultura desiderata (1 L).
- Selezionare le singole colonie di E. coli dalla piastra di agar LB utilizzando una punta di pipetta. Inoculare ogni tubo di LB con una colonia Di. coli espellendo una punta pipetta contenente una colonia selezionata in ogni tubo.
- Capovolgari ogni test camera di coltura di inoculazione con un tappo di plastica traspirante. Collocare le piccole colture E. coli con tappo in un'incubatrice aspirando a 37 gradi centigradi per 12-24 h.
- Preparazione e induzione delle culture di co-espressione
- Il giorno successivo, aggiungere 100 mL di buffer 10x fosfato preparato a 900 mL di TB preparata per una concentrazione finale del buffer di fosfato di 1x. Aggiungere gli antibiotici necessari con concentrazioni secondo la tabella 1.
- Agitare a 140 giri/mm a 37 gradi centigradi fino a quando non è caldo (circa 30 min).
- Inoculare ogni fiaschetta di media per colture 1 L con 5 mL della coltura di inoculazione. Conservare la punta pipetta utilizzata per l'inoculazione della coltura di inoculazione nel tubo di coltura dell'inoculazione in modo che, dopo l'estrazione con solvente organico nelle fasi successive, non ci siano contaminanti di plastica estratti.
- Incubare con agitazione a 200 rpm fino a quando la densità ottica a 600 nm (OD600) raggiunge 0,6, circa 3 h. Per misurare l'OD600 con uno spettrometro, utilizzare una miscela di TB sterile con buffer fosfato come vuoto.
- All'OD600desiderato , impostare le impostazioni dell'incubatrice su 16 .
- Quando co-esprime P450, preparare appena riboflavina e acido aminolevulico, che sono essenziali per una sufficiente produzione di co-fattori P450. Per ogni esperimento, fare 4 g/L riboflavina e 150 g/ acido aminolevulinico. Mantenere la soluzione avvolta in un foglio fino all'uso, in quanto la riboflavina è sensibile alla luce.
- Dopo che l'incubatrice ha raggiunto i 16 gradi centigradi (circa 30 min), aggiungere 1 mL di 1 M IPTG, 1 mL di 4 g/L riboflavina e 1 mL di 150 g/L di acido aminovulilo per ogni coltura. Per la produzione di diterpenoide, 25 mL di 1 M pirone di sodio devono essere aggiunti a ogni coltura per assicurare una formazione precursore sufficiente.
NOTA: Tutti i costrutti utilizzati in questo saggio erano sotto lo stesso promotore IPTG-inducibile. Diversi promotori possono essere utilizzati come desiderato. - Incubare a 16 e 140 giri/mm per 72 h. Aggiungere 25 mL di pirava di sodio ogni giorno successivo dopo l'induzione se si produce diterpenoidi. Le colture immediatamente in uso sono immediatamente utilizzate per l'estrazione di imbuto separatori di metaboliti; non raccolgono o immagazzinano colture.
3. Separazione e purificazione dei metaboliti
- Estrazione di canali separatori di metaboliti
NOTA: È importante utilizzare solo pipette in vetro e vetro quando si utilizzano solventi organici per prevenire contaminazioni plasticizzanti.- In un cofano di fumi, fissare l'imbuto separatore su un supporto ad anello. Mettere un becher di rifiuti sotto l'imbuto separatore.
- Versare 500 mL di 50/50 (v/v) acetati/esanoni etilici nell'imbuto separatore.
NOTA: La miscela del solvente deve essere regolata in base alla solubilità e alla polarità dei metaboliti mirati. I solventi con problemi d'acqua devono essere evitati per garantire un'adeguata separazione di fase. - Aggiungere 500 mL della coltura E. coli all'imbuto di separazione e posizionare sul tappo di vetro.
- Agitare l'imbuto per mescolare la coltura con il solvente di estrazione, circa 5–10x. Spesso de-gas l'imbuto aprendo il rubinetto mentre l'imbuto viene tenuto a testa in giù e puntato nella cappa del fume per rilasciare la pressione. Ripetere la procedura di agitazione e degas 2x.
- Posizionare l'imbuto in posizione verticale nel supporto dell'anello e attendere che lo strato di solvente (in alto) si sia separato dallo strato acquoso (cultura) (in basso), circa 1 min.
NOTA: Quando si osserva una grande quantità di bolle nell'interfase, è possibile aggiungere un piccolo volume di 5-10 mL EtOH per migliorare la separazione di fase. - Rimuovere il tappo. Scolare lo strato di E. coli in un becher di scarto, mantenendo lo strato solvente nell'imbuto.
- Ripetere la procedura utilizzando i restanti 500 mL di coltura E. coli e lo stesso solvente da 500 mL utilizzato per la prima estrazione.
- Scolare il solvente contenente i metaboliti estratti in un pallone pulito. Evitare la contaminazione con la coltura di E. coli.
- Concentrazione evaporazione rotary
- Preparare l'apparecchiatura di evaporazione rotativa (rotovap): riempire il bagno d'acqua e impostare la temperatura a 25 gradi centigradi. Per i composti sensibili al calore, utilizzare un'impostazione di temperatura più bassa o aggiungere ghiaccio al bagno d'acqua. Riempire la camera di condensazione con ghiaccio secco e impostare la velocità di rotazione a 60-80 giri/min.
- Aggiungere circa 700 mL di metaboliti estratti in un flacone evaporante 1 L, attaccarlo al rotovap e abbassare nel bagno d'acqua. Accendere il riscaldatore da bagno dell'acqua e impostare a 25 gradi centigradi.
- Iniziare la rotazione del pallone evaporante, accendere il sistema a vuoto e aumentare gradualmente l'aspirazione per evitare una rapida ebollizione della soluzione metabolita nel flacone di scarto. Il solvente evaporato deve iniziare a condensare e gocciolare nel flacone di raccolta del condensato (rifiuti).
- Quando solo pochi mL della soluzione metabolita rimane nel flacone evaporante, interrompere le rotazioni e spegnere il sistema a vuoto. Sollevare il flacone evaporante e depressurizzare chiudendo la linea di vuoto. Conservare la soluzione metabolita concentrata rimanente nel flacone di evaporazione. Smaltire i rifiuti nel flacone di rifiuti.
- Continuare l'evaporazione rotativa sommando fino a 700 mL di soluzione metabolita estratta aggiuntiva al flacone di evaporazione. Ripetere il processo fino a quando tutta la soluzione di metabolita estratta è stata concentrata.
- Rimuovere i metaboliti concentrati dal flacone evaporante trasferendo con una pipetta di vetro a una nuova provetta. Risciacquare il flacone evaporante con 5 mL di 50/50 (v/v) acetato/exane sott'etessio o la miscela di solventi desiderata due volte, trasferendo la soluzione di risciacquo alla provetta.
- Conservare i metaboliti concentrati a -20 o -80 gradi centigradi (a seconda della stabilità del prodotto) fino a un ulteriore utilizzo.
- Purificazione colonna Silica
- Preparare la vetreria sciacquando un becher da 1 L, un imbuto di vetro, provette da 50 mL e una colonna di cromatografia da 3,2 L (dotata di un tasto di vetro) una volta con esagonale e una volta con acetato etilico. Etichettare le provette da 50 mL, che verranno utilizzate per raccogliere le frazioni.
- Aggiungere 2 L di gel di silice (230–400 mesh, grado 60) a una colonna di cromatografia da 3,2 L con una capacità di 2 L serbatoio e un disco fritte, quindi caricare la sabbia per formare uno strato di 5 cm nella parte superiore della colonna.
- Preparare la colonna per la cromatografia lavandola accuratamente con 2 L di exane. In ogni momento, ci dovrebbe essere uno strato sottile (0,5 cm) del liquido solvente sopra lo strato di sabbia della colonna per garantire che la colonna non si asciughi o acquisisca sacche d'aria. Un adattatore di ingresso a vetro collegato a un tubo dell'aria può essere utilizzato per aumentare delicatamente la portata attraverso la colonna piuttosto che la gravità da solo.
- Caricare l'estratto di metabolita concentrato (vedere la sezione 3.2) sulla colonna. Sciacquare la bottiglia che conteneva il campione 3x con esano e aggiungerlo alla colonna per assicurarsi che tutto il campione sia stato trasferito.
- Utilizzando il gradiente seguente, caricare 100 mL alla volta e raccogliere 50 mL di frazioni in provette etichettate: 100% hexanes 3x, 10% (v/v) acetato etilico in hexanes 3x, 12,5% (v/v) acetato etilico in hexanes 3x, 15% (v/v) aceto etilico 3x , 20% (v/v) acetato etilico in esagonali 3x, 40% (v/v) acetato etilico in esagonale 3x, 60% (v/v) acetato etilico in esagoni 3x e 100% acetato etilico 4x.
NOTA: Il gradiente deve essere regolato in base alle dimensioni del composto e alle polarità e alla separazione desiderata. - Utilizzando una pipetta di vetro, trasferire 1 mL da ogni frazione in una fiala GC etichettata. Analizzare ogni campione tramite GC-MS per determinare quali frazioni contengono i metaboliti desiderati e il loro livello di purezza.
NOTA: Il metodo GC-MS adatto ai metaboliti prodotti in questo metodo è stato descritto in Mafu et al. 201839. In breve, tutte le analisi sono state eseguite su un GC con un rilevatore XL MS utilizzando una colonna HP-5MS (vedi Tabella dei materiali),un volume campione di 1 ll e una rampa di temperatura del forno da 50 a 300 gradi centigradi a 20 gradi centigradi-1. - Dopo aver determinato quali frazioni contengono i composti di interesse, combinare tutte le frazioni che contengono lo stesso composto. Smaltire correttamente le frazioni che non contengono composti in un contenitore di rifiuti. Ripetere la procedura di evaporazione rotante se necessario per concentrare i metaboliti purificati.
- Se è necessaria una ulteriore purificazione, utilizzare HPLC (semi-)preparativo per migliorare la purezza del prodotto. I protocolli HPLC devono essere adattati in base alle specifiche delle singole apparecchiature e ai composti di interesse.
- Risospendere i campioni di cromatografia silice essiccata in 1 mL di ebillato (idrocarburi diterpene) o acetonitrile (diterpenoidi ossigenati), e filtrare attraverso una siringa di filtro per prevenire la contaminazione con piccole particelle.
- Per i diterpenoidi non polari, utilizzare una colonna CN (vedere Tabella dei materiali)con una portata consigliata di 1 mL/min e un gradiente di acetato esaziale:etilico, con frazioni raccolte ogni 1 minuto.
- Per i diterpenoidi polari, utilizzare una colonna C18 (vedere Tabella dei materiali)con una portata raccomandata di 3 mL/min e un gradiente acetonitrile:acqua, con frazioni raccolte ogni 1 minuto.
- Asciugare tutte le frazioni purificate HPLC sotto un flusso di azoto e ripartire in 1 mL di esagonale prima dell'analisi GC-MS per valutare l'abbondanza e la purezza del prodotto.
4. Produzione di metaboliti diterpenoidi con N. benthamiana
NOTA: Il protocollo qui descritto per la produzione di metaboliti diterpenoidi in N. benthamiana è stato adattato da studi precedentemente riportati35,36,40,41. Il protocollo seguente è specifico per l'infiltrazione di siringhe delle foglie di N. benthamiana. Altri metodi di infiltrazione, come l'infiltrazione sottovuoto sono ugualmente adatti. I sistemi binari vettori al DNA A, come pCAMBIA130035Su (pLIFE33) o pEAQ-HT40,41,42, che consentono la propagazione in E. coli e A. tumefaciens e l'espressione genica negli ospiti delle piante sono adatto a questo protocollo.
- Piantare Nicotiana benthamiana
- Riempire una pentola da 750 mL con il terriccio e innaffiare la pentola. Aggiungere 20 semi di tabacco e toccare delicatamente con il dito in modo che siano nel terreno. Non coprire con il terreno.
NOTA: I semi possono essere generati attraverso l'autoimpollinazione per la propagazione dei semi. I semi per questo esperimento sono stati ottenuti dal Dipartimento di Biologia delle Piante dell'UC Davis, e sono disponibili al pubblico attraverso il deposito di germoplasma USDA (https://npgsweb.ars-grin.gov/gringlobal/accessiondetail.aspx?id=1450450). - Lasciare il vaso in una camera di crescita con le seguenti condizioni, annaffiare a giorni alterni per garantire che il terreno non si asciughi. Coltiva le piante a 26 gradi centigradi e il 60% di umidità con 16:8 h di ciclo giorno:notte per tutti i passaggi di questo protocollo.
- Dopo 1 settimana, riempite i vasi da 20 dollari con il terriccio e innaffiate i vasi. Usando le pinze, afferrare una piantina di tabacco dal gambo e rimuovere delicatamente dal vaso di origine, mettendo una piantina in ogni nuovo vaso e burring con attenzione le radici. Non danneggiare le foglie o le radici.
- Innaffiare le piante a giorni alterni mettendo l'acqua nel vassoio in cui si trovano i vasi (chiamato anche "acqua di fondo"). Ogni quarta irrigazione, includere fertilizzante generico in acqua secondo le istruzioni del pacchetto.
- Riempire una pentola da 750 mL con il terriccio e innaffiare la pentola. Aggiungere 20 semi di tabacco e toccare delicatamente con il dito in modo che siano nel terreno. Non coprire con il terreno.
- Trasformazione congelata del disgelo dell'Agrobacterium tumefaciens affaticale GV3101 cellule competenti
- Thaw Agrobacterium tumefaciens ceppo GV3101 (o altro ceppo preferito) celle competenti su ghiaccio (1 h). Tubi di microcentrifuga pre-freddo da 0,2 ml sul ghiaccio. Supporti SOC caldi a 28 gradi centigradi.
- Mescolare delicatamente le cellule con la punta del pipet (non pipet su e giù) e 15 - L di cellule per ogni trasformazione nei microtubi refrigerati da 1,5 mL.
- Aggiungete 1-5 l di DNA ad ogni tubo di cellule competenti e mescolate delicatamente raschiando il tubo lungo un rack di tubi.
NOTA: I costrutti desiderati non devono avere diverse resistenze antibiotiche perché ciascuno viene trasformato separatamente e sarà mescolato prima dell'infiltrazione. - Mettere i microtubi in azoto liquido per 5 min.
- Rimuovere i microtubi dall'azoto liquido e posizionare i tubi sul rack camera-temp. Scongelare i tubi per 5 min in 37 gradi centigradi.
- Aggiungete 250 gradi di SOC preriscaldato (28 gradi centigradi) ad ogni microtubo. Agitare a 28-30 gradi centigradi, 225 giri/min, per 3 h.
- Piastra 50 -L di cellule trasformate su piastre di agar LB contenenti gli antibiotici necessari descritti nella Tabella 1 utilizzando perline di vetro sterili, come descritto al punto 2.1.8.
- Le piastre incubate invertite a 28-30 gradi centigradi per 48 h. La crescita entro il primogiorno di incubazione può essere un segno di contaminazione. I trasformatori A. tumifaciens possono essere utilizzati dopo l'incubazione di 2 giorni o conservati a 4 gradi centigradi sigillati in pellicola di paraffina per un massimo di 2 settimane.
- Co-espressionedi enzimi transitori mediati in Nicotiana benthamiana
- Prune 4-settimana-vecchio Piante Nicotiana benthamiana 2 giorni prima dell'infiltrazione rimuovendo le foglie inferiori. Lasciare 4 foglie più in alto. Innaffiare le piante. Non innaffiare le piante 24 h prima dell'infiltrazione per consentire stomi aperti e infiltrazioni più facili.
- Aggiungere 10 mL di LB con concentrazioni di lavoro degli antibiotici appropriati per i costrutti scelti e ceppo di Agrobacterium (descritto nella tabella 1) a un tubo di vetro sterile da 50 mL con un coperchio di lamina.
- Inoculare usando una punta pipetta per tamponare una singola colonia di Agrobacterium trasformato ed espellere la punta nel supporto LB. Ogni trasformatore di Agrobatterio dovrebbe avere almeno 2 piccole culture.
- Incubare per tutta la notte a 28 e 220 giri/min.
- Misurare la densità ottica a 600 nm (OD600) delle colture notturne utilizzando uno spettrometro. Diluire le colture durante la notte a un OD600 di 1.
NOTA: i valori ottimali di OD600 possono variare quando si utilizzano altri ceppi di Agrobacterium. - Distribuire 10 mL di coltura notturna diluita in tubi conici da 50 mL.
- Raccogliere i batteri per centrifugazione a 3500 rpm per 15 min alla temperatura ambiente. Versare e scartare il supernatante.
- Ri-sospendere le colture in 10 mL infiltrazione tampone agitando delicatamente il tubo e rotolando su un rack tubo. L'OD600 deve essere uguale a 1 per ogni costrutto.
- Generare le combinazioni desiderate per le infiltrazioni combinando volumi uguali di ogni linea cellulare trasformata. L'OD600 dovrebbe essere uguale a 1 per ogni infiltrazione. Stimare 5 mL di soluzione di infiltrazione per foglia, 2 foglie per pianta.
- Attaccare i tubi orizzontalmente a un rocker e roccia delicatamente per 2 h a temperatura ambiente.
- Infiltrare 2 foglie per pianta N. benthamiana utilizzando circa 5 mL di miscela di infiltrazione per foglia. Infiltrati foglie sane con una siringa senza aghi sulla parte inferiore delle foglie mentre esercita una contropressione con un dito sul lato superiore della foglia per garantire che la soluzione di infiltrazione soffochi il tessuto foglia.
- Contrassegnare tutte le foglie infiltrate con un marcatore nero o un altro indicatore. Mettere le piante infiltrate nella camera di crescita per 5 giorni. Mantenere le piante ben innaffiate.
NOTA: Un tempo di incubazione di cinque giorni si è dimostrato sufficiente per raggiungere livelli diterpenoidi sufficienti per la maggior parte delle analisi a valle, pur mantenendo l'efficienza temporale della formazione del prodotto. È possibile testare periodi di incubazione più lunghi, in cui sono richiesti quantità di prodotto più elevate.
- Estrazione e purificazione dei metaboliti dalla trasformazione di Nicotiana benthamiana
- Raccogliere foglie infiltrate dalle piante tagliandole dalla pianta. Aggiungere 100 mL di azoto liquido e una singola foglia a un mortaio, quindi macinare utilizzando un mortaio e pestello o fallao fino ad ottenere una polvere fine.
- Aggiungere il tessuto in polvere ad una fiala GC-MS alla demarcazione di 500.L. Aggiungere 1,5 mL di 50/50 (v/v) acetato/esano doloso o la miscela di solvente desiderata sulla fiala e tappo strettamente.
- Per le espressioni che sono state testate per fornire i prodotti desiderati, piscina tessuto del terreno in un pallone più grande o provetta, quindi aggiungere 2 volte la quantità di solvente rispetto al volume del tessuto e agitare durante la notte. Procedere al passaggio 4.4.5 per la purificazione.
- Posizionare tutte le fiale in un rack a microtubo e nastro adesivo strettamente per fissare. Estrarre sotto agitazione vigorosa durante la notte a temperatura ambiente.
- Trasferire 400 l di estratto e 600 l di esagonale in una fiala fresca GC-MS. Non aliquote alcun tessuto fogliare. Analizzare i campioni utilizzando GC-MS utilizzando il metodo descritto nel passaggio 3.3.6.1.
- Dopo l'analisi tramite GC-MS per la presenza di metaboliti desiderati, estratti di foglie della piscina insieme e procedere attraverso l'evaporazione rotante, cromatografia colonna silice, e HPLC per ottenere composti puri come descritto nelle sezioni 3.2 e 3.3.
Risultati
Flusso di lavoro schematico per la produzione di diterpenoide con E. coli
Figura 1 illustra il flusso di lavoro descritto per la produzione di diterpenoide. Il protocollo qui descritto è stato adattato da una piattaforma E. coli descritta in precedenza per la biosintesi diterpenoide13,32 perl'uso di colture di grandi volumi e la purificazione dei prodotti diterpenoidi desiderati tramite silice Cromatografia. Per dimostrare l'uso di questo protocollo, abbiamo utilizzato un percorso dolabralexin recentemente identificato dal mais che comprende due diStUS, smAN2 (M00001d029648) e .mKSL4 (m00001d032858), un P450 multifunzionale (CYP71 la riduzione (MCPR2, M00001d026483) (Figura 2). In breve, le celle competenti di E. coli BL21DE3-C41 sono state pre-trasformate con pCDFDuet:IRS e pACYC-Duet:GGPPS/ 'mAN2 plasmiche13,32. Il pCDFDuet: Plasmid contiene enzimi chiave per la produzione precursore diterpenoide, tra cui 1-deossiosa-D-xylulose-5-fosfato synthase (dxs), 1-deossiosa-D-xylulose-5-fosfato reductase (dxr) e isopentenyl isomerasi difosato (idi), ed è stato indicato per aumentare la formazione di diterpenoide in E. coli13. Il pLasmid pACYC-Duet:GGPPS/ smAN2 contiene il plasmaent-copalyl diphosphate synthase smAN2 e una synthase GGPP da Abies grandis. Gli enzimi che catalizzavano le reazioni commesse nella biosintesi della dolabralexina sono stati poi co-trasformati come plasmidi pET28b: Per informazioni dettagliate su sequenze e costrutti plasmidevedere Mafu et al.
Un cromatogramma GC-MS dei prodotti enzimatici estratti è illustrato nella figura 3A, che illustra la formazione di tre composti di dolabralexina, vale a dire dolabradiene (1,2 x 0,25 mg/L cultura), eposydolabrene (0,65 - 0,2 mg/L cultura), e epoxydolabranol (11.4 1,1 mg/l di coltura) come quantificato in base a una curva standard utilizzando lo sclareol diterpenoide. Sclareol è stato utilizzato come standard di riferimento, grazie alla sua struttura simile e alle proprietà chimiche rispetto alle dolabralexine. Tipicamente osservati sottoprodotti minori includono cloramfenicolo, i derivati indole oxindole e indole-5-aldeide, e il precursore geranilgeranil difosfato (GGPP) (Figura 3). Indole rappresenta comunemente il sottoprodotto primario, ma non è mostrato qui, a causa del suo tempo di ritenzione più breve rispetto al ritardo del solvente impostato di 7 min per preservare l'integrità dello strumento GC-MS.
Flusso di lavoro schematico della produzione di diterpenoide utilizzando N. benthamiana
Figura 4 raffigura una panoramica dell'espressione del percorso dolabralexina in N. benthamiana. Per i prodotti qui descritti, i seguenti costrutti sono stati trasformati separatamente in ceppo A. tumefaciens GV3101: pLife33:p19 (esprimendo la proteina soppressore del silenziamento del gene p19), pLife33: Sequenze native a lunghezza intera dei geni della via di mais dolabralexin sono state utilizzate nel vettore binario T-DNA pLife3341 con resistenza alla kanamicina per la propagazione in E. coli e A. tumefaciens. La co-espressione dei geni della via terpenoide a monte è facoltativa, poiché il difosfato geranilgeranilo precursore è formato endogenamente in N. benthamiana. Tuttavia, diversi studi hanno impiegato con successo tali approcci per aumentare la formazione di diterpennoidi in N. benthamiana14,36,41. Come illustrato nella Figura 3, co-espressione ha prodotto con successo dolabradiene e 15,16-epoxydolabrene. A differenza della co-espressione enzimatica in E. coli, 15,16-epoxydolabranol non è stato rilevato negli estratti di metaboliti.
La presenza di 15,16-epoxydolabrene in estratti di foglie ha dimostrato l'attività di CYP71-18 in N. benthamiana. Come 15,16-epoxydolabranol è stato indicato per essere stabile dopo l'estrazione da colture microbiche (Figura 3) così come dopo l'isolamento dai tessuti della radice di mais negli studi precedenti39, sembra plausibile che il prodotto idrossilato è glicosylated da glicosileseree endogene e successivamente sequestrate nella vacuole, rendendolo inaccessibile all'estrazione con le miscele di solventi organici utilizzate qui per l'estrazione36,43,44,45 ,46. Simili modifiche indesiderate del prodotto nel contesto dell'ingegneria del percorso in N. benthamiana sono state riportate in studi precedenti47. Come mostrato per la co-espressione in E. coli, l'espressione transitoria in N. benthamiana determina l'estrazione di diversi sottoprodotti, inclusi gli alcani lineari di diversa lunghezza della catena in base al confronto con i database degli spettri di massa. I totienti composti estratti dal materiale fogliario sono stati trovati in media 2,4 s/- 0,5 mg di dolabradiene e 0,9 x/- 0,3 mg 15,16-epoxydolabrene per g tessuto a foglia secca. Questi titers non possono essere confrontati direttamente con il sistema di co-espressione E. coli dati i diversi allestimenti sperimentali.
Purificazione dei diterpenoidi
La purificazione dei diterpenoidi è stata ottenuta utilizzando la cromatografia a colonna di silice e la successiva HPLC semi-preparativa. Estratti di metaboliti da 12 L di colture e. coli in pool sono stati purificati utilizzando la cromatografia a colonna di silice per separare i tre composti focali della dolabralexina (Figura 3A). La cromatografia della silice è ideale per ottenere un'elevata purezza dei composti bersaglio, poiché consente una semplice separazione delle ottolle olefisiche diterpene e dei derivati ossigenati, e rimuove facilmente il contaminante principale, l'ossindolo, che viene mantenuto sulla matrice di silice ( Figura 3A).
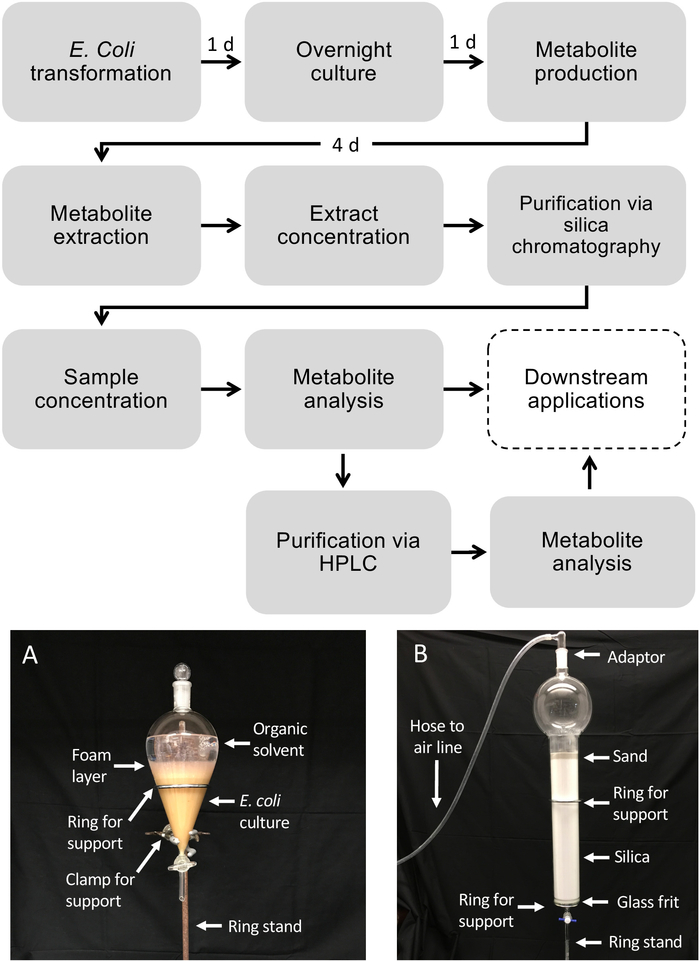
Figura 1: Flusso di lavoro per la produzione di diterpenoide in E. coli e purificazione dei metaboliti da colture batteriche liquide. Le scatole tratteggiate illustrano passaggi facoltativi in cui è necessaria una purificazione aggiuntiva. (A) Immagine rappresentativa della coltura E. coli estratta utilizzando un imbuto separatore. (B) Immagine rappresentativa della purificazione dell'estratto di metabolita mediante cromatografia di silice. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Costrutti genici e di percorsi biosintetici di Dolabralexina utilizzati in questo studio. Fare clic qui per visualizzare una versione più grande di questa figura.
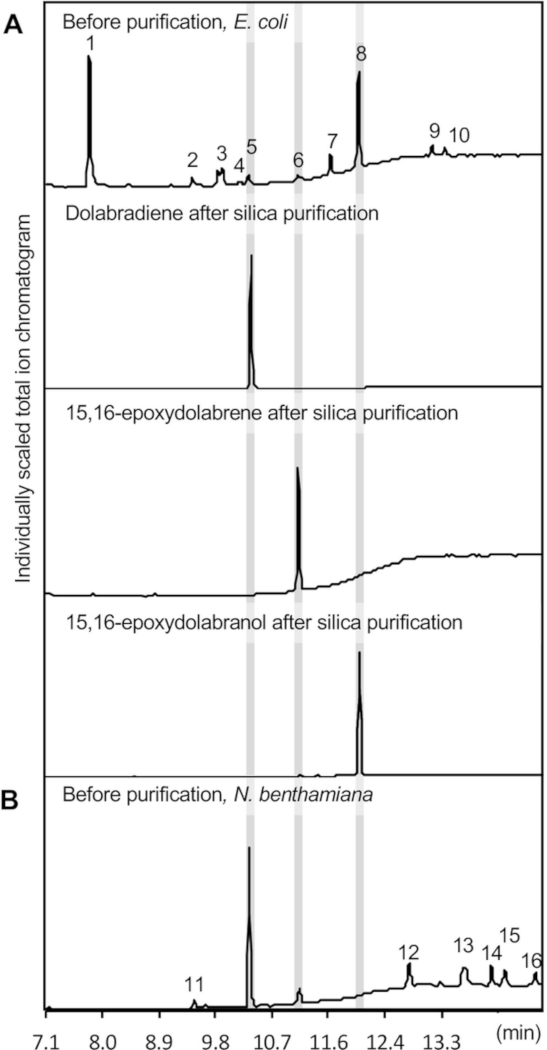
Figura 3: risultati GC-MS. Sono mostrati cromatogrammi GC-MS di prodotti diterpenoidi purificati ottenuti utilizzando saggi di co-espressione enzimatica in (A) E. coli e (B) N. benthamiana. Le identificazioni dei prodotti si basano su confronti con standard autentici e spettri di massa di riferimento della biblioteca spettrale di massa del National Institute of Standards and Technology (NIST). 1, osindolo; 2, indole-5-aldeide; 3, Pyrrolo[1,2-a]pyrazine-1,4-dione, hexahydro-3-(2-metilpropyl)-; 4, 6-O-Acetyl-1-[[4-bromophenyl]thio]-a-d-glucoside S,S-diossido; 5, dolabradiene; 6, 15,16-epoxydolabrene; 7, Pyrrolo[1,2-a]pyrazine-1,4-dione, hexahydro-3-(phenylmethyl)-; 8, 15,16-epoxydolabranol; 9 e 12, sconosciuti; 10, clororamenico; 11, 3,7,11,15-tetramethyl-2-hexadecen-1-ol; 13-16, alcani. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Produzione di diterpenoide in N. benthamiana. (A) Flusso di lavoro di produzione diterpenoide in N. benthamiana e purificazione dei metaboliti dal materiale fogliare. (B) Immagine rappresentativa delle piante N. benthamiana pronte per gli esperimenti di infiltrazione, prima della potatura. (C) Immagini rappresentative delle piante di N. benthamiana dopo la potatura. (D) Immagine di foglie infiltrate di siringhe. Le aree più scure sono state infiltrate. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Un'indagine e un'applicazione più ampie dei prodotti naturali diterpenoidi richiedono protocolli semplici e poco costosi per sintetizzare e purificare quantità sufficienti di composti desiderati. Il rapido aumento del numero di enzimi diterpenoidi-metabolici disponibili da un'ampia gamma di specie fornisce ora un ampio inventario per la produzione enzimatica di diterpenoidi utilizzando sistemi di accoglienza microbici e vegetali. Inoltre, l'architettura modulare di molti percorsi diterpenoidi consente l'uso di enzimi della stessa specie o di specie diverse in approcci di ingegneria combinatori 'plug & play' per generare una serie di diterpenoidnaturali naturali naturali e nuove nature simili prodotti2,14,26,35.
E. coli è un ospite microbico preferito per la biosintesi naturale dei prodotti grazie alla sua robustezza, alla facilità di scalabilità, alla limitata complessità chimica per la riduzione della contaminazione da sottoprodotto e alla ricchezza di strumenti disponibili per l'assemblaggio e l'espressione del DNA Ottimizzazione. Nella nostra esperienza, la piattaforma qui descritta è adatta per la produzione di rese di prodotto fino a diverse centinaia di mg di olefin e alcoli diterpene, che è adatto per molte applicazioni a valle tra cui quelle proposte qui. Pur non rispettando la scala industriale, la piattaforma di produzione qui descritta può servire come base per ulteriori percorsi, host e ottimizzazione della fermentazione, come è stato dimostrato con successo per diterpenoidi correlati come taxadiene e sclareol33 ,34. È stata stabilita una sovraespressione dei geni del percorso MVA o MEP che limitano i tassi per superare i fattori di limitazione dei rendimenti per la biosintesi diterpenoide, come l'insufficiente offerta precursore e il flusso precursore in percorsi concorrenti13, 32,33,39. Anche se si è dimostrato di successo in diversi studi, scarsa espressione e attività catalitica di P450 trapenoidi-metabolici e altri enzimi legati alla membrana in E. coli è un probabile fattore limitante33,39 ,48,49,50,51,52. L'uso di sequenze ottimizzate per codone e modifiche proteiche, come la rimozione del peptide del segnale del reticolo endoplasmico o l'introduzione di un peptide segnale plastidiale, si sono dimostrate utili per aumentare l'espressione P450 solubile14,38 ,49,50,53. Tali modifiche sono state impiegate anche per la co-espressione microbica del mais CYP71-1839 utilizzato come percorso di esempio in questo studio. I protocolli descritti si basano sull'uso di plasmidi che trasportano uno o due geni per costrutto, tutti sotto lo stesso promotore inducibile. Laddove si desiderino combinazioni di geni su larga scala, è consigliabile utilizzare varie cassette multigeniche o sistemi di impilamento genico disponibili per mitigare l'efficienza di trasformazione ridotta e la crescita della coltura dovuta all'uso di plasmidi e antibiotici multipli13 .
Con la più ampia disponibilità di risorse genetiche e genomiche, anche i sistemi di ospiti delle piante diventano sempre più adatti alla produzione di prodotti naturali. I vantaggi includono la capacità delle piante di produrre i precursori naturali richiesti alimentati dalla fotosintesi, consentendo così la formazione del prodotto senza la necessità di integrare le molecole precursori54,55. N. benthamiana è già ampiamente utilizzato per la caratterizzazione funzionale in vivo e l'espressione combinatoria di terpenoide e altri percorsi di prodotto naturali14,35,36,40 . Notevoli vantaggi derivanti dall'utilizzo di N. benthamiana come sistema host includono la produzione endogena di precursori diterpenoidi, l'uso di sequenze geniche native, l'espressione semplificata dei P450 eucarici, la facilità di trasformazione genica combinatoria (come antibiotici separati non sono necessari per la co-trasformazione transitoria e la semplice estrazione di prodotti bersaglio dal materiale fogliare. Ove necessario, la produzione di diterpenoide può essere migliorata attraverso la co-espressione dei geni chiave del percorso MEP per aumentare l'offerta precursore36,41. I vincoli per la produzione scalabile di diterpenoide in N. benthamiana sono più complessi rispetto alle colture microbiche liquide a causa della necessità di generare biomassa vegetale sufficiente, la purificazione dei prodotti ad alta intensità di lavoro da complessi chimicamente tessuto vegetale, e possibile metabolizzazione indesiderata dei prodotti bersaglio attraverso, ad esempio, l'ossidazione, glicosilazione o dephosphorylation da enzimi endogeni36,43,44,45 ,46,47. Tuttavia, questa procedura può essere aumentata fino a quantità di prodotti mg aumentando il numero di piante utilizzate per l'agroinfiltrazione56.
I protocolli di estrazione e purificazione dei prodotti qui descritti sono compatibili con E. coli e N. benthamiana, così come S. cerevisiae e altri sistemi host vegetali o microbici, e forniscono un approccio conveniente che è facile da sia nei laboratori di biologia che in quelli di chimica e non richiede costose attrezzature di purificazione. L'estrazione dei metaboliti con un imbuto separatore è adatta per un'estrazione efficiente e la separazione di fase prima della purificazione cromatografica. Le dimensioni delle imbuto possono essere facilmente regolate per consentire volumi di coltura più grandi e ridurre il tempo sperimentale necessario per estrarre da colture di grandi dimensioni. Abbiamo trovato l'uso di un gradiente di acetato esagonale/etilico per essere ideale per l'estrazione diditerloidi di polarità diversa come dimostrato qui per il gruppo di dolabralexine che comprendono sia idrocarburi e composti ossigenati (Figura 3). A seconda delle proprietà dei prodotti di destinazione, altre miscele di solventi possono essere vantaggiose. Tuttavia, i solventi non devono essere miscibili con acqua per garantire il successo dell'estrazione e della separazione di fase utilizzando la tecnica dell'imbuto separatore. Inoltre, la perdita di prodotto attraverso l'evaporazione deve essere presa in considerazione quando si utilizza questo approccio per la produzione di composti organici volatili (VOC), come mono e sesqui-terpenoidi a basso peso molecolare e altri COV. La separazione cromatografica dei diterpenoidi di diversi livelli di ossigenazione utilizzando una colonna di silice su larga scala (2 L) è stata vantaggiosa nella nostra esperienza, poiché fornisce una migliore separazione del prodotto e riduce al minimo la necessità di purificazione iterativa quando si utilizzano volumi di colonne più piccoli. I volumi e le matrici delle colonne possono essere regolati in base alle esigenze per il volume di coltura desiderato e il tipo di prodotto naturale. La purezza dei prodotti target che possono essere raggiunti utilizzando questo protocollo è adatta a molte applicazioni a valle, come i saggi di bioattività o per l'uso in analisi dell'attività enzimatica. Tuttavia, laddove sono richiesti livelli di purezza più elevati, come le analisi strutturali tramite NMR, la purezza del prodotto può essere migliorata in modo efficiente mediante una purificazione aggiuntiva mediante HPLC (semi)-preparativo.
Questo protocollo qui descritto è stato ottimizzato per la produzione di prodotti naturali diterpenoidi, ma può anche essere facilmente personalizzato in base a mono-, sesqui e tri-terpenoidi correlati, così come ad altre classi di prodotti naturali semplicemente generando l'enzima desiderato moduli per l'espressione combinatoria14,57. Tuttavia, le modifiche delle procedure per l'estrazione e la purificazione dei prodotti devono essere prese in considerazione per i composti con maggiore volatilità, come mono e sesqui-terpenoidi, o una maggiore polarità e modifica funzionale come esemplificato da glicosilazione di molti triterpenoidi, fenilpropanoidi e altre classi di prodotti naturali.
Sebbene siano disponibili piattaforme su scala industriale per la fabbricazione di prodotti naturali, i protocolli qui descritti offrono uno strumento economico e personalizzabile che può essere facilmente impostato nella maggior parte dei laboratori. Come dimostrato dalla produzione di dolabralexine di mais qui e altrove39, le quantità di prodotto e la purezza che possono essere raggiunte utilizzando questo approccio sono in genere sufficienti per facilitare varie analisi e usi a valle, tra cui, ma non limitata a vari studi di bioattività, analisi delle interazioni tra organismi, nonché per l'uso come substrati enzimatici o come materiale di partenza per approcci di semisintesi.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo con gratitudine il Dr. Reuben Peters (Iowa State University, USA) per aver fornito i costrutti pIRS e pGGx-mAN2. Sostegno finanziario a questo lavoro da parte del NSF Plant-Biotic Interactions Program (grant 1758976 a P.z.), DOE Early Career Research Program (grant s- SC0019178 a P.z.), il DOE Joint Genome Community Science Program (concedere cSP2568 a P. Graduate Research Fellowship Program (a K.M.M.), e una borsa di studio Mentorship Award di UC Davis Dean (a K.M.M.) sono riconosciuti con gratitudine.
Materiali
| Name | Company | Catalog Number | Comments |
| 1020 Trays | Greenhouse Megastore | CN-FLHD | |
| 2-(N-morpholino)ethanesulfonic acid | Sigma | M8250-500g | MES |
| 4" Tech Square Pot | McConkey Wholesale Grower's Supply | JMCTS4 | |
| 5977 Extractor XL MS | Agilent | - | |
| 7890B GC | Agilent | - | |
| Acetonitrile | Sigma | 271004 | |
| Agar | Fisher | BP1423-2 | |
| Bacterial yeast extract | Fisher | BP9727-2 | |
| Beaker | CTechGlass | BK-2001-015B | |
| Cap, 9 mm blue screw, PFTE | Agilent | 5185-5820 | GC vial cap |
| Carbenicillin | Genesee | 25-532 | Carb |
| Chloramphenicol | Fisher | 50247423 | Chlor |
| Chromatography column | CTechGlass | CL-0015-022 | |
| Clear humidity dome | Greenhouse Megastore | CN-DOME | |
| ColiRollers Plating Beads | Sigma | 71013 | Glass beads |
| CoorsTek Porcelain Mortars | Fisher | 12-961A | mortar |
| CoorsTek Porcelain Pestles | Fisher | 12-961-5A | pestle |
| Delta-Aminolevulinic acid hydrochloride | Sigma | 50981039 | Aminoleuvolinic acid |
| Ethanol | Fisher | A962-4 | EtOH |
| Ethyl acetate | Fisher | E1454 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | Falcon tubes |
| Fisherbrand Disposable Cuvettes | Fisher | 14-955-127 | cuvette |
| Fisherbrand Petri Dishes with Clear Lid | Fisher | FB0875713 | petri dish |
| Fisherbrand Polypropylene Microtube Storage Racks | Fisher | 05-541 | microtube rack |
| Glucose | Sigma | G7021 | |
| Glycerol | Fisher | G33-500 | |
| Hexanes | Fisher | H292-4 (CS) | |
| HP-5MS | Agilent | 19091S-433 | GC column |
| Inlet adapter | CTechGlass | AD-0006-003 | glass inlet adapter |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher | BP1755-100 | IPTG |
| Kanamycin | Fisher | BP9065 | Kan |
| KIM-KAP Caps, Disposable, Polypropylene, Kimble Chase | VWR | 60825-798 | breathable test tube lids |
| Magnesium chloride | Acros | 223210010 | MgCl2 |
| Magnesium sulfate | Sigma | M7506-500g | MgSO4 |
| Miracle-Gro Water Soluble All Purpose Plant Food | Miracle-Gro | 2756810 | |
| Mixer Mill MM 200 | Retsch | 20.746.0001 | tissue mill |
| Nalgene Fernbach culture flask | Sigma | Z360236 | 2.8 L flask |
| New Brunswick I26 | Eppendorf | M1324-0000 | Shaking incubator |
| Nicotiana benthamiana seed | USDA Germplasm Repository | Accession TW16 | N. benthamiana |
| OverExpress C41(DE3) Chemically Competent Cells | Lucigen | 60442 | C41-DE3 cells |
| Parafilm M wrapping film | Fisher | S37440 | Parafilm |
| Potassium chloride | Sigma | P-9541 | KCl |
| Potassium phosphate dibasic anhydrous | Fisher | P288-3 | Dipotassium phosphate |
| Potassium phosphate monobasic | Monopotassium phosphate | ||
| Pyrex disposable culture tubes, rimless | Sigma | CLS9944516 | test tubes |
| Pyruvate Acid Sodium Salt | Fisher | 501368477 | Sodium pyruvate |
| Retort Ring Stands | CTechGlass | ST00 | ring stand |
| Riboflavin | Amresco | 0744-250g | |
| Rifampicin | Sigma | R7382 | Rif |
| Rotovap | |||
| Sand, 50-70 mesh particle size | Sigma | 274739-1KG | |
| Silica | Fisher | AC241660010 | silica gel |
| Sodium chloride | Fisher | 5271-3 | NaCl |
| Sodum hydroxide | Fisher | SS266-1 | NaOH |
| Spectinomycin | Fisher | 501368607 | Spec |
| Squibb Separatory Funnel | CTechGlass | FN-1060-006 | Separatory funnel |
| Sunshine Mix #1 | Sungro Horticulture | Potting soil | |
| Thermo Scientific Snap Cap Low Retention Microcentrifuge Tubes | Fisher | 21-402-902 | microtube |
| Triangle funnel | CTechGlass | FN-0035 | funnel |
| Tryptone | Fisher | BP14212 | |
| Vial, screw, 2 mL, amber, WrtOn | Agilent | 5182-0716 | GC vial |
| visible spectrophotometer, V-1200 | VWR | 634-6000P | spectrophotometer |
| ZORBAX Eclipse XDB-C18 | Agilent | 990967-202 | HPLC column |
| ZORBAX Eclipse XDB-CN | Agilent | 990967-905 | HPLC column |
Riferimenti
- Peters, R. J. Two rings in them all: the labdane-related diterpenoids. Natural Product Reports. 27 (11), 1521-1530 (2010).
- Zerbe, P., Bohlmann, J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33 (7), 419-428 (2015).
- Toyomasu, T. Recent advances regarding diterpene cyclase genes in higher plants and fungi. Bioscience, Biotechnology, and Biochemistry. 72 (5), 1168-1175 (2008).
- Smanski, M. J., Peterson, R. M., Huang, S. X., Shen, B. Bacterial diterpene synthases: new opportunities for mechanistic enzymology and engineered biosynthesis. Current Opinion in Chemical Biology. 16 (1-2), 132-141 (2012).
- Salazar-Cerezo, S., Martinez-Montiel, N., Garcia-Sanchez, J., Perez, Y. T. R., Martinez-Contreras, R. D. Gibberellin biosynthesis and metabolism: A convergent route for plants, fungi and bacteria. Microbiological Research. 208, 85-98 (2018).
- Keeling, C. I., Bohlmann, J. Diterpene resin acids in conifers. Phytochemistry. 67 (22), 2415-2423 (2006).
- Schmelz, E. A., et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins. Plant Journal. 79 (4), 659-678 (2014).
- Bohlmann, J., Keeling, C. I. Terpenoid biomaterials. Plant Journal. 54 (4), 656-669 (2008).
- Mafu, S., Zerbe, P. Plant diterpenoid metabolism for manufacturing the biopharmaceuticals of tomorrow: prospects and challenges. Phytochemistry Reviews. 17 (1), 113-130 (2017).
- Hillwig, M. L., Mann, F. M., Peters, R. J. Diterpenoid biopolymers: new directions for renewable materials engineering. Biopolymers. 95 (2), 71-76 (2011).
- Jorgensen, L., et al. 14-step synthesis of (+)-ingenol from (+)-3-carene. Science. 341 (6148), 878-882 (2013).
- Line, N. J., Burns, A. C., Butler, S. C., Casbohm, J., Forsyth, C. J. Total Synthesis of (-)-Salvinorin A. Chemistry. 22 (50), 17983-17986 (2016).
- Morrone, D., et al. Increasing diterpene yield with a modular metabolic engineering system in E. coli: comparison of MEV and MEP isoprenoid precursor pathway engineering. Applied Microbioly and Biotechnology. 85 (6), 1893-1906 (2010).
- Kitaoka, N., Lu, X., Yang, B., Peters, R. J. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Molecular Plant. 8 (1), 6-16 (2015).
- George, K. W., et al. Metabolic engineering for the high-yield production of isoprenoid-based C(5) alcohols in E. coli. Scientific Reports. 5, 11128(2015).
- Paddon, C. J., Keasling, J. D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology. 12 (5), 355-367 (2014).
- Keasling, J. D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering. 14 (3), 189-195 (2012).
- Kampranis, S. C., Makris, A. M. Developing a yeast cell factory for the production of terpenoids. Computational and Structural Biotechnology Journal. 3 (4), e201210006(2012).
- Tholl, D. Biosynthesis and biological functions of terpenoids in plants. Advances in Biochemical Engineering/Biotechnology. 148, 63-106 (2015).
- McGarvey, D. J., Croteau, R. Terpenoid metabolism. The Plant Cell. 7 (7), 1015-1026 (1995).
- Chen, F., Tholl, D., Bohlmann, J., Pichersky, E. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. The Plant Journal. 66 (1), 212-229 (2011).
- Pateraki, I., Heskes, A. M., Hamberger, B. Cytochromes P450 for terpene functionalisation and metabolic engineering. Advances in Biochemical Engineering/Biotechnology. 148, 107-139 (2015).
- Cao, R., et al. Diterpene cyclases and the nature of the isoprene fold. Proteins. 78 (11), 2417-2432 (2010).
- Reiling, K. K., et al. Mono and diterpene production in Escherichia coli. Biotechnology and Bioengineering. 87 (2), 200-212 (2004).
- Hamberger, B., Plant Bak, S. P450s as versatile drivers for evolution of species-specific chemical diversity. Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1612), 20120426(2013).
- Jia, M., Potter, K. C., Peters, R. J. Extreme promiscuity of a bacterial and a plant diterpene synthase enables combinatorial biosynthesis. Metabolic Engineering. 37, 24-34 (2016).
- Paddon, C. J., et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 496 (7446), 528-532 (2013).
- Peralta-Yahya, P. P., Zhang, F., del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Pateraki, I., et al. Total biosynthesis of the cyclic AMP booster forskolin from Coleus forskohlii. Elife. 6, e23001(2017).
- Ignea, C., et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform. Proceedings of the National Academy of Sciences of the United States of America. 113 (13), 3681-3686 (2016).
- Ignea, C., et al. Reconstructing the chemical diversity of labdane-type diterpene biosynthesis in yeast. Metabolic Engineering. 28, 91-103 (2015).
- Cyr, A., Wilderman, P. R., Determan, M., Peters, R. J. A modular approach for facile biosynthesis of labdane-related diterpenes. Journal of the American Chemical Society. 129 (21), 6684-6685 (2007).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Schalk, M., et al. Toward a biosynthetic route to sclareol and amber odorants. Journal of the American Chemical Society. 134 (46), 18900-18903 (2012).
- Andersen-Ranberg, J., et al. Expanding the Landscape of Diterpene Structural Diversity through Stereochemically Controlled Combinatorial Biosynthesis. Angewandte Chemie International Edition in English. 55 (6), 2142-2146 (2016).
- Bruckner, K., Tissier, A. High-level diterpene production by transient expression in Nicotiana benthamiana. Plant Methods. 9 (1), 46(2013).
- Emanuelsson, O., Brunak, S., von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols. 2 (4), 953-971 (2007).
- Hausjell, J., Halbwirth, H., Spadiut, O. Recombinant production of eukaryotic cytochrome P450s in microbial cell factories. Bioscience Reports. 38 (2), BSR20171290(2018).
- Mafu, S., et al. Discovery, biosynthesis and stress-related accumulation of dolabradiene-derived defenses in maize. Plant Physiology. 176 (4), 2677-2690 (2018).
- Zerbe, P., et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiology. 162 (2), 1073-1091 (2013).
- Bach, S. S., et al. High-throughput testing of terpenoid biosynthesis candidate genes using transient expression in Nicotiana benthamiana. Methods in Molecular Biology. , 245-255 (2014).
- Sainsbury, F., Thuenemann, E. C., Lomonossoff, G. P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants. Plant Biotechnology Journal. 7 (7), 682-693 (2009).
- Wang, B., et al. Transient production of artemisinin in Nicotiana benthamiana is boosted by a specific lipid transfer protein from A. annua. Metabolic Engineering. 38, 159-169 (2016).
- Reed, J., Osbourn, A. Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37 (10), 1431-1441 (2018).
- Dong, L., Jongedijk, E., Bouwmeester, H., Der Krol, A. V. an Monoterpene biosynthesis potential of plant subcellular compartments. New Phytologist. 209 (2), 679-690 (2016).
- Liu, Q., et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One. 6 (8), e23255(2011).
- Karunanithi, P. S., et al. Functional characterization of the cytochrome P450 monooxygenase CYP71AU87 indicates a role in marrubiin biosynthesis in the medicinal plant Marrubium vulgare. BMC Plant Biology. 19 (1), 114(2019).
- Pelot, K., et al. Functional diversity of diterpene synthases in the biofuel crop switchgrass. Plant Physiology. 178 (1), 54-71 (2018).
- Wang, Q., Hillwig, M. L., Wu, Y., Peters, R. J. CYP701A8: a rice ent-kaurene oxidase paralog diverted to more specialized diterpenoid metabolism. Plant Physiology. 158 (3), 1418-1425 (2012).
- Wang, Q., Hillwig, M. L., Peters, R. J. CYP99A3: functional identification of a diterpene oxidase from the momilactone biosynthetic gene cluster in rice. The Plant Journal. 65 (1), 87-95 (2011).
- Morrone, D., Chen, X., Coates, R. M., Peters, R. J. Characterization of the kaurene oxidase CYP701A3, a multifunctional cytochrome P450 from gibberellin biosynthesis. Biochemical Journal. 431 (3), 337-344 (2010).
- Swaminathan, S., Morrone, D., Wang, Q., Fulton, D. B., Peters, R. J. CYP76M7 is an ent-cassadiene C11alpha-hydroxylase defining a second multifunctional diterpenoid biosynthetic gene cluster in rice. The Plant Cell. 21 (10), 3315-3325 (2009).
- Gnanasekaran, T., et al. Heterologous expression of the isopimaric acid pathway in Nicotiana benthamiana and the effect of N-terminal modifications of the involved cytochrome P450 enzyme. Journal of Biological Engineering. 9 (1), 24(2015).
- De Luca, V., Salim, V., Atsumi, S. M., Yu, F. Mining the biodiversity of plants: a revolution in the making. Science. 336 (6089), 1658-1661 (2012).
- Wurtzel, E. T., Kutchan, T. M. Plant metabolism, the diverse chemistry set of the future. Science. 353 (6305), 1232-1236 (2016).
- Menon, A., et al. Mobile-based insulin dose adjustment for type 2 diabetes in community and rural populations: study protocol for a pilot randomized controlled trial. Therapeutic Advances in Endocrinology and Metabolism. 10, 2042018819836647(2019).
- Moses, T., et al. OSC2 and CYP716A14v2 catalyze the biosynthesis of triterpenoids for the cuticle of aerial organs of Artemisia annua. The Plant Cell. 27 (1), 286-301 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon