Method Article
Ein anpassbarer Ansatz für die enzymatische Produktion und Reinigung von Diterpenoid Naturprodukten
In diesem Artikel
Zusammenfassung
Hier präsentieren wir einfach zu bedienende Protokolle zur Herstellung und Reinigung von Diterpenoid-Metaboliten durch die kombinatorische Expression biosynthetischer Enzyme in Escherichia coli oder Nicotiana benthamiana, gefolgt von chromatographischem Produkt reinigung. Die resultierenden Metaboliten eignen sich für verschiedene Studien, einschließlich molekularer Strukturcharakterisierung, Enzymfunktionsstudien und Bioaktivitätstests.
Zusammenfassung
Diterpenoide bilden eine vielfältige Klasse von natürlichen Kleinmolekülprodukten, die weit über die Königreiche des Lebens verteilt sind und kritische biologische Funktionen in Entwicklungsprozessen, interorganismusförmigen Wechselwirkungen und Umweltanpassung haben. Aufgrund dieser verschiedenen Bioaktivitäten sind viele Diterpenoide auch als Pharmazeutika, Lebensmittelzusatzstoffe, Biokraftstoffe und andere Bioprodukte von wirtschaftlicher Bedeutung. Fortschrittliche Genomik und biochemische Ansätze haben eine schnelle Zunahme des Wissens über diterpenoid-metabolische Gene, Enzyme und Wege ermöglicht. Die strukturelle Komplexität der Diterpenoide und die enge taxonomische Verteilung einzelner Verbindungen in oft nur einer einzigen Art bleiben jedoch einschränkende Faktoren für ihre effiziente Produktion. Die Verfügbarkeit einer breiteren Palette von metabolischen Enzymen bietet jetzt Ressourcen für die Herstellung von Diterpenoiden in ausreichenden Tittern und Reinheit, um eine tiefere Untersuchung dieser wichtigen Metabolitengruppe zu erleichtern. Auf der Grundlage etablierter Werkzeuge für die mikrobielle und pflanzliche Enzym-Co-Expression, präsentieren wir ein leicht zu bedienendes und anpassbares Protokoll für die enzymatische Produktion von Diterpenoiden in Escherichia coli oder Nicotiana benthamiana,und die Reinigung der gewünschten Produkte mittels Kieselsäurechromatographie und semipräparativer HPLC. Am Beispiel der Gruppe der Mais -Zea mays) Dolabralexin Diterpenoide, heben wir hervor, wie modulare Kombinationen von Diterpen-Synthase (DiTPS) und Cytochrom-P450-Monooxygenase (P450) Enzymen verwendet werden können, um verschiedene Diterpenoid-Gerüste zu erzeugen. Gereinigte Verbindungen können in verschiedenen nachgelagerten Anwendungen eingesetzt werden, wie metabolitische Strukturanalysen, Enzymstruktur-Funktionsstudien sowie In-vitro- und in Planta-Bioaktivitätsexperimenten.
Einleitung
Diterpenoide bilden eine chemisch vielfältige Gruppe von mehr als 12.000 überwiegend polyzyklischen 20-Kohlenstoff-Naturprodukten, die in vielen Organismen eine entscheidende Rolle spielen1. Pilze und Pflanzen produzieren die größte Vielfalt an Diterpenoiden, aber Bakterien haben auch gezeigt, bioaktive Diterpenoide zu bilden (siehe Bewertungen2,3,4,5). Verwurzelt in ihrer enormen strukturellen Vielfalt, dienen Diterpenoide einer Vielzahl von biologischen Funktionen. Ein paar Diterpenoide, wie Gibberellin Wachstumshormone, haben wesentliche Funktionen in Entwicklungsprozessen5. Die Mehrheit der Diterpenoide dient jedoch als Vermittler der chemischen Verteidigung und interorganismusalen Wechselwirkungen. Unter diesen, Diterpen-Harzsäuren in der Schädlings- und Pathogenabwehr von Nadelbäumen und artenspezifische Mischungen von antimikrobiellen Diterpenoiden in wichtigen Nahrungspflanzen wie Mais (Zea Mays) und Reis (Oryza sativa) wurden am umfangreichsten studiert6,7. Diese Bioaktivitäten bieten ein reiches chemisches Reservoir für kommerzielle Anwendungen, und ausgewählte Diterpenoide werden als wichtige Pharmazeutika, Lebensmittelzusatzstoffe, Klebstoffe und andere Bioprodukte des modernen Alltags verwendet8,9 ,10. Um die Erforschung der natürlichen Vielfalt und der biologischen Funktionen von Diterpenoiden voranzutreiben und letztlich breitere kommerzielle Anwendungen zu fördern, sind Werkzeuge zur kosteneffizienten Herstellung reiner Verbindungen erforderlich. Für einige Diterpenoid-Bioprodukte, wie z. B. Diterpenharzsäuren, die als Nebenprodukt der Zellstoff- und Papierindustrie hergestellt werden, wurde eine großflächige Isolierung von Pflanzenmaterial hergestellt8. Die Anhäufung von Diterpenoiden nur in bestimmten Geweben und unter strenger Regulierung durch Umweltreize schränkt jedoch häufig die Isolierung ausreichender Produktmengen vom natürlichen Hersteller2ein. Darüber hinaus behindert die strukturelle Komplexität der Diterpenoide ihre Produktion durch chemische Synthese, obwohl solche Ansätze in mehreren Fällen erfolgreich waren11,12. Mit der Verfügbarkeit fortschrittlicher genomischer und biochemischer Technologien haben enzymatische Produktionsplattformen zunehmend Aufmerksamkeit für die Herstellung einer Reihe von Diterpenoidverbindungen erhalten (siehe Bewertungen13,14, 15,16,17,18).
Alle Terpenoide, einschließlich Diterpenoide, stammen von zwei isomerisoprenomischen Vorläufern, Isopentenyldiphosphat (IPP) und Dimethylaldiphosphat (DMAPP)19, die wiederum durch das Mevalonat (MVA) oder die Methylerythritol-5-Phosphat (MEP) (MEP). Die Terpenoid-Biosynthese verläuft über den MEP-Weg bei Bakterien und den MVA-Weg bei Pilzen, während Pflanzen eine zytosolische MVA und einen plastidialen MEP-Weg besitzen, wobei letztere der primäre Weg zur Diterpenoidbildung20ist. Kondensation von IPP und DMAPP durch Prenyltransferasen ergibt den zentralen 20-Kohlenstoff-Vorläufer für alle Diterpenoide, Geranylgeranyldiphosphat (GGPP)20. Nach der GGPP-Bildung steuern zwei Enzymfamilien, Terpensynthasen (TPS) und Cytochrom P450 Monooxygenasen (P450s) weitgehend die Bildung der großen chemischen Vielfalt des Terpenoidstoffwechsels21,22. Diterpen-Synthasen (DiTPS) katalysieren die engagierte karbonkationsgetriebene Cyclisierung und Neuanordnung von GGPP zu verschiedenen stereospezifischen bi-, poly- oder makrozyklischen Diterpengerüsten1,3,23, 24. Die Sauerstoffversorgung und weitere funktionelle Dekoration dieser Gerüste wird dann durch P450-Enzyme und ausgewählte andere Enzymfamilien22,25erleichtert. TPS und P450 existieren häufig als artspezifische Multigenfamilien, die modulare biosynthetische Netzwerke bilden können, wo die Kombination verschiedener Enzymmodule entlang einer gemeinsamen Blaupause die Bildung einer breiten Palette von Verbindungen ermöglicht2, 26. Die schnelle Entdeckung funktionell unterschiedlicher Enzyme, die in modularen Terpenoidwegen in den letzten Jahren arbeiten, hat zu einer erweiterung ihrer Verwendung als vielseitige Teileliste für metabolische Engineering spartieller oder vollständiger sowohl mikrobielle als auch pflanzliche Produktionsplattformen. Zum Beispiel, Hefe (Saccharomyces cerevisiae) wurde erfolgreich angewendet, um Multi-Enzym-Wege für die Herstellung von Terpenoid-Bioprodukten zu entwickeln, wie das Malariamedikament Artemisinin27, die Sesquiterpenoid Biokraftstoffe Bisabolen und Farnesen28, aber auch diterpenoide29,30,31auswählen. Ebenso wurden entwickelte Escherichia coli-Plattformen für die industrielle Herstellung für einige diterpenoide Metaboliten eingerichtet, darunter das Taxol-Vorläufer-Taxadien, das als Krebsmedikament verwendet wird, und den Diterpenalkohol, Sclareol , verwendet in der Duftstoffindustrie13,32,33,34. Fortschritte in der Gentechnik und Transformationstechnologien haben auch Pflanzenwirtsysteme zunehmend lebensfähig für die Herstellung von pflanzlichen Naturprodukten9,14,35,36. Insbesondere der nahe Tabak Verwandte, Nicotiana benthamiana, hat sich zu einem weit verbreiteten Chassis für Terpenoid-Signal-Analyse und Engineering, aufgrund der Leichtigkeit von Agrobacterium-vermittelte Transformation von mehreren Genkombinationen , effiziente Biosynthese von endogenen Vorläufern und hoher Biomasse14,35,36.
Anhand dieser etablierten Plattformen für die Terpenoid-Biosynthese beschreiben wir hier einfach zu bedienende und kosteneffiziente Methoden zur enzymatischen Herstellung von Diterpenoiden und zur Reinigung einzelner Verbindungen. Die vorgestellten Protokolle veranschaulichen, wie E. coli- und N. benthamiana-Plattformen, die für eine verbesserte Diterpenoid-Vorläufer-Biosynthese entwickelt wurden, für die kombinatorische Expression verschiedener DiTPS und P450-Enzyme verwendet werden können, um gewünschten Diterpenoidverbindungen. Die Anwendung dieses Protokolls zur Herstellung und Reinigung strukturell unterschiedlicher Diterpenoide wird anhand von spezialisierten Diterpenoiden aus Mais (Zea mays), dolabralexins bezeichnet, die endogene Biosynthese, von denen zwei diTPS und ein P450 rekrutiert enzym. Die Reinigung verschiedener Dolabralexine von Olefinen bis hin zu sauerstoffhaltigen Derivaten wird dann durch die Kombination von Separatorentrichterextraktion mit großflächiger Kieselsäuresäulenchromatographie und präparativer Hochdruckflüssigkeitschromatographie (HPLC) erreicht. Die beschriebenen Protokolle sind für die Herstellung von Diterpenoiden optimiert, können aber auch leicht für verwandte Terpenoidklassen sowie andere natürliche Produkte angepasst werden, für die Enzymressourcen zur Verfügung stehen. Verbindungen, die mit diesem Ansatz hergestellt werden, eignen sich für verschiedene nachgeschaltete Anwendungen, einschließlich, aber nicht beschränkt auf die strukturelle Charakterisierung durch Kernspinresonanzanalyse (NMR), die Verwendung als Substrate für Enzymfunktionsstudien und eine Reihe von Bioaktivitäts-Assays.
Protokoll
VORSICHT: Zu den hier beschriebenen Protokollen gehören die Verwendung gefährlicher Chemikalien, scharfer Gegenstände, elektrischer Geräte, heißer Gegenstände und anderer Gefahren, die zu Verletzungen führen können. Es sollten geeignete persönliche Schutzausrüstungen getragen und die geeigneten Sicherheitsverfahren, einschließlich Sicherheitsschulungen, eingehalten werden.
1. Herstellung von Materialien und Lösungen
- Vorbereiten und AutoklavLysogeny Brühe Medium (LB) für 30 min: Pro 1 L Medium, mischen 10 g Trypton, 5 g bakterielle Hefe-Extrakt, und 10 g Von NaCl und lösen in 1 L deionisiertem (DI) Wasser.
- Für 1 L Koexpressionskulturen für 30 min vorbereiten und autoklavieren Terrific Broth (TB) Medium: In einem 2,8 L Erlenmeyerkolben 12 g Trypton, 24 g bakteriellehe hefeextrakt und 40 ml 10% (v/v) Glycerin auflösen und in 860 ml DI-Wasser auflösen. Vorbereiten und Autoklaven 1,3 l 10x Phosphatpuffer [1,3 l DI-Wasser, 30,03 g Monokaliumphosphat (KH2PO4) und 163,02 g Dikaliumphosphat (K2HPO4)] und dem oben genannten Medium hinzufügen.
- Bereiten Sie Super Optimal Brühe mit Catabolite Repression (SOC) Medien.
- Bereiten Sie und Autoklav für 30 min eine Lösung mit 2% (w/v) Trypton, 0,5% (w/v) bakterielle Hefeextrakt, 8,5 mM NaCl und 2,5 mM KCl.
- Fügen Sie steriles MgSO4 und Glukose mit einer Endkonzentration von 20 mM hinzu. Verwenden Sie 1 M NaOH, um sich an pH 7.0 anzupassen. Bewahren Sie das SOC-Medium bei -20 °C auf.
- 1 L 1 M Natriumpyruvat vorbereiten. Autoklav für 15 min und bei 4 °C lagern.
- Bereiten Sie 20 ml von 1 M Isopropyl -D-1-thiogalactopyranoside (IPTG) in sterilem DI-Wasser vor. 1–2 ml Aliquots bei -20 °C lagern.
- Infiltrationspuffer vorbereiten: 10 mM MES (1.952 g) und 10 mM MgCl2 (2.033 g) gelöst in 1 L DI-Wasser. Bei 4 °C lagern.
- Vorbereiten und AutoklavEN LB Agar für 30 min: Pro 100 ml DI-Wasser, fügen Sie 1 g Trypton, 0,5 g bakterielle Hefe-Extrakt, 1 g NaCl, und 1,5 g Agar. Sobald LB Agar ist kühl genug, um die Flasche zu behandeln, fügen Sie Antibiotika nach Bedarf für die gewünschten Plasmid-Kombinationen. Agarteller mit Petrischalen gießen und bei 4 °C lagern.
- Siehe Tabelle 1 für Spezifikationen zur Verbundproduktion in E. coli bzw. N. benthamiana. Wrap Platten mit Rifampicin in Folie, um Abbau bei der Lagerung zu verhindern.
| Arbeitskonzentration (g/ml) | |||||
| antibiotikum | Lagerbestand (mg/ml) | zahlungsunfähig | 1 Plasmid | 2 Plasmide | 3 oder 4 Plasmide |
| Carbenicillin | 50 | H2O | 50 | 25 | 20 |
| Chloramphenicol | 30 | Etoh | 30 | 20 | 20 |
| Kanamycin | 50 | H2O | 50 | 25 | 20 |
| Spectinomycin | 30 | H2O | 30 | 25 | 20 |
| Gentamycin | 50 | H2O | 30 | ||
| Rifampicin | 10 | MeOH | 10 | ||
Tabelle 1: Antibiotikakonzentrationen zur Plasmid-Koexpression in E. coli oder N. benthamiana.
2. Herstellung von Diterpenoid-Metaboliten in E. coli
HINWEIS: Das hier beschriebene Protokoll zur Herstellung von Diterpenoid-Metaboliten in E. coli wurde von einer zuvor berichteten Enzym-Co-Expression-Plattform angepasst, die von der Gruppe von Dr. Reuben J. Peters (Iowa State University, IA, USA)13 entwickelt wurde. ,32.
- Transformation kompetenter Zellen mit Plasmidkombinationen.
- Tauchemisch kompetente E. coli-Zellen auf Eis (BL21DE3-C41-Zellen wurden in diesem Protokoll verwendet).
- Fügen Sie 1 l einer 100 ng/l-Lösung jedes Für die Koexpression verwendeten Konstrukts zu 25 l kompetenter Zellen in einem 1,5 ml Mikrorohr hinzu. Wirbel nieren oder nicht durch Pipettieren mischen.
HINWEIS: Für eine optimale Expression und Aktivität der Enzyme TPS und P450 müssen mehrere Sequenzmodifikationen berücksichtigt werden. Für TPS ist die Entfernung des N-Terminal-Plastidialtransitpeptids oft unerlässlich. Insbesondere erfordern plastidiale Mono- und Di-TPS in der Regel die Entfernung des vorhergesagten Transitpeptids (mit verwendung der üblichen Vorhersagealgorithmen37), während zytosolische Säsqui-TPS in der Regel als Gene in voller Länge verwendet werden können. In Bezug auf P450s hat sich die Codonoptimierung sowie das Entfernen oder Ersetzen mit der Leader-Sequenz MAKKTSSKGK der N-Terminal-Transmembrandomäne in vielen Fällen38,39als wirksam erwiesen. Darüber hinaus sollte bei der Koexztion von P450-Enzymen eine Cytochrom-P450-Reduktase (CPR) enthalten sein, um eine ausreichende P450-Aktivität zu gewährleisten. - Inkubieren Sie die Mischung auf Eis für 30 min. Mischen Sie alle 10 Minuten, indem Sie das Rohr sanft über ein Mikrorohr Rack kratzen.
- Vorinkubations-SOC-Medien und LB-Agarplatten bei 37 °C mit Antibiotika, wie sie für die gewünschte Kombination von Konstrukten erforderlich sind.
HINWEIS: Jedes Konstrukt, das kotransformiert werden soll, muss eine ausgeprägte Antibiotikaresistenz sowie einen deutlichen Ursprung der Replikation aufweisen, um eine optimale Proteinexpression zu gewährleisten. - Hitze schockieren Sie die Zellmischung bei 42 °C für 1 Minute, und dann auf Eis für mindestens 2 min inkubieren.
- Fügen Sie 200 L warme SOC-Medien hinzu.
- Schütteln Sie die Zellmischung für 1 h bei 37 °C und 200 Rpm.
- Fügen Sie der erwärmten LB-Agarplatte ca. 10 autoklavierte Glasperlen hinzu. Fügen Sie 100 l der Zellmischung hinzu und ersetzen Sie den Deckel. Schütteln Sie die Platte horizontal mit dem Deckel auf, um die Zellen gleichmäßig zu verteilen. Entfernen Sie die Glasperlen, indem Sie sie in einen Abfallbehälter abklopfen. Alternativ können Sie auch andere bevorzugte Beschichtungsmethoden verwenden.
- Die LB-Agarplatte über Nacht bei 37 °C mit der beschichteten Oberfläche nach unten bebrüten. Die Platte mit transformierten E. coli Kolonien kann am nächsten Tag verwendet oder bei 4 °C in Paraffinfolie für bis zu 2 Wochen versiegelt gelagert werden.
- Vorbereitung von Impfkulturen
- Bereiten Sie am nächsten Tag eine Lösung des LB-Mediums mit Antibiotika vor, die für die transformierte Plasmidkombination erforderlich sind, und verwenden Sie die in Tabelle 1angegebenen Konzentrationen.
- In einer sterilen Haube 5 ml LB-Medium auf ein 15 ml steriles Glas-Reagenzglas mit einer atmungsplastischen Kappe übertragen. Bereiten Sie eine kleine Kulturröhre für jede gewünschte große (1 L) Kultur vor.
- Wählen Sie einzelne E. coli-Kolonien aus der LB-Agarplatte mit einer Pipettenspitze aus. Impfen Sie jede Röhre von LB mit einer E. coli-Kolonie, indem Sie eine Pipettenspitze mit einer ausgewählten Kolonie in jedes Rohr auswerfen.
- Kappen Sie jedes Inokulationskultur-Reagenzglas mit einer atmungsaktiven Kunststoffkappe. Legen Sie die gekappten E. coli-Kleinkulturen für 12–24 h in einen 37 °C-Schütteektkubator.
- Vorbereitung und Induktion von Koexpressionskulturen
- Am folgenden Tag 100 ml vorbereiteter 10x Phosphatpuffer zu 900 ml vorbereiteter TB für eine endgültige Phosphatpufferkonzentration von 1x hinzufügen. Notwendige Antibiotika mit Konzentrationen nach Tabelle 1hinzufügen.
- Bei 140 Umdrehungen bei 37 °C bis warm (ca. 30 min) schütteln.
- Impfen Sie jeden Medienkolben für 1 L-Kulturen mit 5 ml Der Impfkultur. Bewahren Sie die für die Impfkulturimpfung verwendete Pipettenspitze im Impfkulturrohr so auf, dass bei Extraktion mit organischem Lösungsmittel in nachfolgenden Schritten keine extrahierten Kunststoffverunreinigungen vorhanden sind.
- Inkubieren mit Schütteln bei 200 Rprossen, bis die optische Dichte bei 600 nm (OD600) 0,6, ca. 3 h erreicht. Um das OD600 mit einem Spektralphotometer zu messen, verwenden Sie eine Mischung aus sterilem TB mit Phosphatpuffer als Rohling.
- Stellen Sie bei der gewünschten OD600die Inkubatoreinstellungen auf 16 °C ein.
- Bei der Ko-Exsoziieren P450s, frisch vorbereiten Riboflavin und Aminolevulinsäure, die für eine ausreichende P450 Co-Faktor-Produktion unerlässlich sind. Machen Sie für jedes Experiment 4 g/L Riboflavin und 150 g/L Aminolevulinsäure. Die Lösung in Folie eingewickelt bis zur Verwendung, da Riboflavin lichtempfindlich ist.
- Nachdem der Inkubator 16 °C (ca. 30 min) erreicht hat, fügen Sie 1 ml 1 M IPTG, 1 ml 4 g/L Riboflavin und 1 ml 150 g/L Aminolevulinsäure in jede Kultur ein. Für die Diterpenoidproduktion sollten 25 ml 1 M Natriumpyruvat jeder Kultur zugesetzt werden, um eine ausreichende Vorläuferbildung zu gewährleisten.
HINWEIS: Alle Konstrukte, die in diesem Test verwendet wurden, hatten denselben IPTG-induzierbaren Promotor. Verschiedene Promotoren können nach Belieben verwendet werden. - Bei 16 °C und 140 U/min für 72 h inkubieren. Fügen Sie bei Herstellung von Diterpenoiden jeden folgenden Tag 25 ml Natriumpyruvat hinzu. Sofort verwenden Kulturen werden sofort für die separatory TrichterExtraktion von Metaboliten verwendet; Kulturen nicht ernten oder lagern.
3. Trennung und Reinigung von Metaboliten
- Separatory Trichterextraktion von Metaboliten
HINWEIS: Es ist wichtig, nur Glaswaren und Glaspipetten zu verwenden, wenn organische Lösungsmittel verwendet werden, um Weichmacherkontaminationen zu verhindern.- In einer Dunstabzugshaube den Trenntrichter auf einem Ringständer sichern. Legen Sie einen Abfallbecher unter den Trenntrichter.
- 500 ml 50/50 (v/v) Ethylacetat/Hexane in den Separatorentrichter gießen.
HINWEIS: Das Lösungsmittelgemisch sollte auf der Grundlage der Löslichkeit und Polarität der gezielten Metaboliten angepasst werden. Wassermischbare Lösungsmittel sollten vermieden werden, um eine geeignete Phasentrennung zu gewährleisten. - 500 ml der E. coli-Kultur in den Trenntrichter geben und auf den Glasstopfen legen.
- Schütteln Sie den Trichter, um die Kultur mit dem Extraktionslösungsmittel zu mischen, ca. 5–10x. Entgasen Sie den Trichter häufig, indem Sie den Zapfen öffnen, während der Trichter auf den Kopf gehalten und in die Dunstabzugshaube gezeigt wird, um Druck freizusetzen. Wiederholen Sie den Schüttel- und Entgasvorgang 2x.
- Legen Sie den Trichter aufrecht in den Ringständer und warten Sie, bis sich die Lösungsmittelschicht (oben) von der wässrigen (Kultur-)Schicht (unten) abgetrennt hat, ca. 1 min.
HINWEIS: Wenn eine große Menge von Blasen in der Interphase beobachtet wird, kann ein kleines Volumen von 5–10 ml EtOH hinzugefügt werden, um die Phasentrennung zu verbessern. - Entfernen Sie den Stopfen. Die E. coli-Schicht in ein Abfallbecher abtropfen lassen und die Lösungsmittelschicht im Trichter behalten.
- Wiederholen Sie den Vorgang mit den verbleibenden 500 ml E. coli-Kultur und dem gleichen 500 ml Lösungsmittel, das für die erste Extraktion verwendet wurde.
- Das Lösungsmittel, das die extrahierten Metaboliten enthält, in einen sauberen Kolben abtropfen lassen. Kontamination mit E. coli-Kultur vermeiden.
- Rotationsverdampfungskonzentration
- Vorbereiten der Rotationsverdampfungsausrüstung (Rotovap): Füllen Sie das Wasserbad und stellen Sie die Temperatur auf 25 °C ein. Für hitzeempfindliche Verbindungen verwenden Sie eine niedrigere Temperatureinstellung oder fügen Sie dem Wasserbad Eis hinzu. Füllen Sie die Brennwasserkammer mit Trockeneis und stellen Sie die Drehgeschwindigkeit auf 60–80 Umdrehungen pro Minute ein.
- Etwa 700 ml extrahierte Metaboliten zu einem 1 L verdampfenden Kolben geben, an der Rotovap befestigen und tiefer in das Wasserbad geben. Schalten Sie den Wasserbaderhitzer ein und stellen Sie auf 25 °C ein.
- Beginnen Sie die Rotation des Verdampfungskolbens, schalten Sie das Vakuumsystem ein und erhöhen Sie nach und nach die Absaugung, um ein schnelles Kochen der Metabolitenlösung in den Abfallkolben zu vermeiden. Verdampftes Lösungsmittel sollte mit dem Kondensieren beginnen und in den Kondensatsammelkolben (Abfall) tropfen.
- Wenn nur wenige ml der Metabolitenlösung im Verdampfungskolben verbleiben, stoppen Sie die Rotationen und schalten Sie das Vakuumsystem aus. Heben Sie den Verdampfungskolben an und drücken Sie ihn, indem Sie die Vakuumleitung schließen. Bewahren Sie konzentrierte Metabolitlösung im Verdampfungskolben auf. Entsorgen Sie den Abfall in der Abfallflasche.
- Setzen Sie die Rotationsverdampfung fort, indem Sie dem Verdampfungskolben bis zu 700 ml zusätzliche extrahierte Metabolitlösung hinzufügen. Wiederholen Sie den Vorgang, bis die gesamte extrahierte Metabolitlösung konzentriert ist.
- Entfernen Sie die konzentrierten Metaboliten aus dem verdampfenden Kolben, indem Sie sie mit einer Glaspipette in ein neues Reagenzglas übertragen. Verdampfendes Kolben mit 5 ml 50/50 (v/v) Ethylacetat/Hexanen oder gewünschtem Lösungsmittelgemisch zweimal ausspülen und die Spüllösung auf das Reagenzglas übertragen.
- Konzentrierte Metaboliten bei -20 °C oder -80 °C (je nach Produktstabilität) bis zur weiteren Verwendung lagern.
- Kieselsäuresäulenreinigung
- Bereiten Sie Glaswaren vor, indem Sie einmal mit Hexan und einmal mit Ethylacetat einen 1 L Becher, einen Glastrichter, 50 ml Reagenzgläser und eine 3,2-Liter-Chromatographiesäule (ausgestattet mit einem Glasbund) spülen. Beschriften Sie die 50 ml Reagenzgläser, mit denen Fraktionen gesammelt werden.
- Fügen Sie 2 L Kieselgel (230–400 Mesh, Grad 60) zu einer 3,2-Liter-Chromatographiesäule mit einer 2-Liter-Reservoirkapazität und einer gefranste Scheibe hinzu, und laden Sie dann Sand, um eine 5 cm-Schicht an der Oberseite der Säule zu bilden.
- Bereiten Sie die Säule für die Chromatographie vor, indem Sie sie gründlich mit 2 L Hexan spülen. Zu jeder Zeit sollte eine dünne Schicht der Lösungsmittelflüssigkeit über der Sandschicht der Säule vorhanden sein, um sicherzustellen, dass die Säule nicht austrocknet oder Lufttaschen erhält. Ein Glaseinlassadapter, der mit einem Luftschlauch verbunden ist, kann verwendet werden, um den Durchfluss durch die Säule sanft zu erhöhen, anstatt nur die Schwerkraft.
- Laden Sie den konzentrierten Metabolitenextrakt (siehe Abschnitt 3.2) auf die Säule. Spülen Sie die Flasche, die die Probe 3x mit Hexan enthielt, und fügen Sie die Spalte hinzu, um sicherzustellen, dass die gesamte Probe übertragen wurde.
- Mit folgendem Gradienten 100 ml gleichzeitig belasten und 50 ml-Fraktionen in beschrifteten Reagenzgläsern sammeln: 100% Hexane 3x, 10% (v/v) Ethylacetat in Hexanen 3x, 12,5% (v/v) Ethylacetat in Hexanen 3x, 15% (v/v) Ethylacetat in Hexanen 3x , 20% (v/v) Ethylacetat in Hexanen 3x, 40% (v/v) Ethylacetat in Hexanen 3x, 60% (v/v) Ethylacetat in Hexanen 3x und 100% Ethylacetat 4x.
HINWEIS: Der Gradient sollte basierend auf der zusammengesetzten Größe und den Polaritäten und der gewünschten Trennung angepasst werden. - Mit einer Glaspipette 1 ml von jedem Bruch in eine beschriftete GC-Durchstechflasche übertragen. Analysieren Sie jede Probe über GC-MS, um zu bestimmen, welche Fraktionen die gewünschten Metaboliten und deren Reinheitsgrad enthalten.
HINWEIS: Die GC-MS-Methode, die für die bei dieser Methode hergestellten Metaboliten geeignet ist, wurde in Mafu et al. 201839beschrieben. Kurz gesagt, alle Analysen wurden an einem GC mit einem XL MS-Detektor mit einer HP-5MS-Säule (siehe Materialtabelle), einem Probenvolumen von 1 l und einer Ofentemperaturrampe von 50 °C bis 300 °C bei 20 °C min-1durchgeführt. - Nach der Bestimmung, welche Fraktionen die Verbindung(en) von Interesse enthalten, kombinieren Sie alle Fraktionen, die die gleiche Verbindung enthalten. Fraktionen, die keine Verbindungen enthalten, ordnungsgemäß in einen Abfallbehälter entsorgen. Wiederholen Sie ggf. den Rotationsverdampfungsvorgang, um die gereinigten Metaboliten zu konzentrieren.
- Wenn eine zusätzliche Reinigung erforderlich ist, verwenden Sie (halb-)präparative HPLC, um die Produktreinheit zu verbessern. HPLC-Protokolle sollten auf der Grundlage individueller Gerätespezifikationen und von Interesse sindder Verbindungen angepasst werden.
- Trockensäurechromatographieproben in 1 ml Hexan (Diterpenkohlenwasserstoffe) oder Acetonitril (sauerstoffhaltige Diterpenoide) wieder aufsetzen und durch eine Filterspritze filtern, um eine Kontamination mit kleinen Partikeln zu verhindern.
- Verwenden Sie für unpolare Diterpenoide eine Kn-Säule (siehe Materialtabelle) mit einer empfohlenen Durchflussrate von 1 ml/min und einem Hexan:Ethylacetat-Gradienten, wobei alle 1 Minute Fraktionen gesammelt werden.
- Verwenden Sie für polare Diterpenoide eine C18-Säule (siehe Materialtabelle) mit einer empfohlenen Durchflussrate von 3 ml/min und einem Acetonitril:Wassergradienten, wobei alle 1 Minute Fraktionen gesammelt werden.
- Trocknen Sie alle HPLC-gereinigten Fraktionen unter einem Stickstoffstrom und setzen Sie sich vor der GC-MS-Analyse in 1 ml Hexan aus, um die Produktfülle und Reinheit zu bewerten.
4. Herstellung von Diterpenoid-Metaboliten mit N. benthamiana
HINWEIS: Das hier beschriebene Protokoll zur Herstellung von Diterpenoid-Metaboliten in N. benthamiana wurde aus zuvor berichteten Studien35,36,40,41angepasst. Das folgende Protokoll ist spezifisch für die Spritzeninfiltration von N. benthamiana Blättern. Andere Infiltrationsmethoden, wie z.B. Vakuuminfiltration, sind gleichermaßen geeignet. Binäre T-DNA-Vektorsysteme wie pCAMBIA130035Su (pLIFE33) oder pEAQ-HT40,41,42, die die Vermehrung in E. coli und A. tumefaciens ermöglichen und die Genexpression in Pflanzenwirten sind für dieses Protokoll geeignet.
- Pflanzung Nicotiana benthamiana
- Füllen Sie einen 750 ml Topf mit Blumenerde und gießen Sie den Topf. Fügen Sie 20 € Tabaksamen hinzu und tippen Sie vorsichtig mit dem Finger, so dass sie im Boden sind. Nicht mit Erde bedecken.
HINWEIS: Samen können durch Selbstbestäubung zur Samenvermehrung erzeugt werden. Die Samen für dieses Experiment wurden vom UC Davis Department of Plant Biology bezogen und sind über das USDA-Keimplasma-Repository (https://npgsweb.ars-grin.gov/gringlobal/accessiondetail.aspx?id=1450450) öffentlich zugänglich. - Lassen Sie den Topf in einer Wachstumskammer mit den folgenden Bedingungen, bewässern Sie jeden zweiten Tag, um sicherzustellen, dass der Boden nicht austrocknet. Wachsen Sie Pflanzen bei 26 °C und 60% Luftfeuchtigkeit mit 16:8 h Tag:Nacht-Zyklus für alle Schritte in diesem Protokoll.
- Nach 1 Woche 20 Töpfe mit Blumenerde füllen und die Töpfe gießen. Mit Zangen, greifen Sie einen Tabaksämling am Stiel und entfernen Sie vorsichtig aus dem Quelltopf, legen Sie einen Sämling in jeden neuen Topf und sorgfältig die Wurzeln zu graben. Beschädigen Sie nicht die Blätter oder Wurzeln.
- Gießen Sie die Pflanzen jeden zweiten Tag, indem Sie Wasser in die Schale legen, in der sich die Töpfe befinden (auch als "Bodenbewässerung" bezeichnet). Jede vierte Bewässerung, enthalten generischen Dünger in das Wasser nach Packungsanweisungen.
- Füllen Sie einen 750 ml Topf mit Blumenerde und gießen Sie den Topf. Fügen Sie 20 € Tabaksamen hinzu und tippen Sie vorsichtig mit dem Finger, so dass sie im Boden sind. Nicht mit Erde bedecken.
- Freeze-Tau-Transformation des Agrobacterium tumefaciens-Stamms GV3101 kompetente Zellen
- Thaw Agrobacterium tumefaciens Stamm GV3101 (oder andere bevorzugte Stamm) kompetente Zellen auf Eis (ca. 1 h). 0,2 ml Mikrozentrifugenrohre auf Eis vorkühlen. Warmes SOC-Medien bei 28 °C.
- Mischen Sie zellen vorsichtig mit der Pipettenspitze (nicht nach oben und unten) und aliquot 15 l Zellen für jede Umwandlung in die gekühlten 1,5 ml Mikroröhren.
- Fügen Sie jeder Röhre kompetenter Zellen 1-5 l (400 ng) DNA hinzu und mischen Sie sie vorsichtig, indem Sie das Rohr entlang eines Rohrgestells kratzen.
HINWEIS: Gewünschte Konstrukte müssen keine unterschiedlichen Antibiotikaresistenzen haben, da sie jeweils separat transformiert werden und vor der Infiltration gemischt werden. - Mikroröhrchen 5 min in flüssigen Stickstoff geben.
- Entfernen Sie Mikroröhren aus flüssigem Stickstoff und legen Sie die Rohre auf das Raumtemperatur-Rack. Tauschläuche für 5 min in 37 °C Inkubator.
- Fügen Sie jedem Mikrorohr 250 L des vorgewärmten (28 °C) SOC hinzu. Bei 28–30 °C, 225 Rpm, für 3 h schütteln.
- Platte 50 l transformierte Zellen auf LB-Agarplatten, die die in Tabelle 1 beschriebenen erforderlichen Antibiotika enthalten, mit sterilen Glasperlen, wie in Schritt 2.1.8 beschrieben.
- Inkubationsplatten, die bei 28–30 °C für 48 h invertiert werden. Das Wachstum innerhalb des1. Tages der Inkubation kann ein Zeichen einer Kontamination sein. Transformierte A. Tumifaciens können nach der 2-tägigen Inkubation verwendet oder bei 4 °C bis zu 2 Wochen in Paraffinfolie versiegelt gelagert werden.
- Agrobacterium-vermittelte transiente Enzym-Co-Expression in Nicotiana benthamiana
- Belaufen Sie 4 Wochen alte Nicotiana benthamiana Pflanzen 2 Tage vor der Infiltration durch Entfernen der unteren Blätter. Lassen Sie 4 oberste Blätter. Gießen Sie die Pflanzen. Gießen Sie die Pflanzen nicht 24 h vor der Infiltration, um offene Stomata und eine einfachere Infiltration zu ermöglichen.
- Fügen Sie 10 ml LB mit Arbeitskonzentrationen der geeigneten Antibiotika für ausgewählte Konstrukte und Agrobacterium-Stamm (beschrieben in Tabelle 1)zu einem 50 ml sterilen Glas-Teströhrchen mit Foliendeckel hinzu.
- Impfen Sie mit einer Pipettenspitze, um eine einzelne Kolonie von transformiertem Agrobacterium abzuwischen und die Spitze in die LB-Medien auszuwerfen. Jedes Agrobacterium-Transformant sollte mindestens 2 kleine Kulturen haben.
- Über Nacht bei 28 °C und 220 Umdrehungen von 15.00 Uhr inkubieren.
- Messen Sie die optische Dichte bei 600 nm (OD600) der Nachtkulturen mit einem Spektralphotometer. Verdünnen Sie die Nachtkulturen auf eine OD600 von 1.
HINWEIS: Optimale OD600-Werte können variieren, wenn Sie andere Agrobacterium-Stämme verwenden. - 10 ml verdünnte Nachtkultur in 50 ml konische Röhren verteilen.
- Ernten Sie die Bakterien durch Zentrifugation bei 3500 U/min für 15 min bei Raumtemperatur. Gießen Sie ab und entsorgen Sie den Überstand.
- Setzen Sie die Kulturen im 10-ml-Infiltrationspuffer wieder auf, indem Sie das Rohr sanft schütteln und auf einem Rohrträger rollen. Die OD600 sollte für jedes Konstrukt gleich 1 sein.
- Generieren Sie die für Infiltrationen gewünschten Kombinationen, indem Sie gleiche Volumina jeder transformierten Zelllinie kombinieren. Die OD600 sollte für jede Infiltration 1 entsprechen. Schätzen Sie 5 ml Infiltrationslösung pro Blatt, 2 Blätter pro Pflanze.
- Rohre horizontal an einer Wippe befestigen und bei Raumtemperatur sanft für 2 h schaukeln.
- Infiltrieren Sie 2 Blätter pro N. Benthamiana Pflanze mit ca. 5 ml Infiltrationsgemisch pro Blatt. Infiltrieren Sie gesunde Blätter mit einer nadellosen Spritze auf der Unterseite der Blätter, während Sie einen Gegendruck mit einem Finger auf der Oberseite des Blattes ausüben, um sicherzustellen, dass die Infiltrationslösung das Blattgewebe erstickt.
- Markieren Sie alle infiltrierten Blätter mit einem schwarzen Marker oder einem anderen Indikator. Infiltrierte Pflanzen 5 Tage lang in die Wachstumskammer geben. Halten Sie pflanzen gut bewässert.
HINWEIS: Eine Inkubationszeit von fünf Tagen hat sich als ausreichend erwiesen, um diterpenoide Werte zu erreichen, die für die meisten nachgelagerten Analysen ausreichend sind, während die Zeiteffizienz der Produktbildung erhalten bleibt. Längere Inkubationszeiten können getestet werden, wo höhere Produktmengen erforderlich sind.
- Metabolitenextraktion und -reinigung aus transformierter Nicotiana benthamiana
- Ernten Sie infiltrierte Blätter von Pflanzen, indem Sie sie aus der Pflanze schneiden. Fügen Sie 100 ml flüssigen Stickstoff und ein einzelnes Blatt zu einem Mörtel hinzu, dann mahlen Sie mit einem Mörtel und Stößel oder Gewebemühle, bis sie ein feines Pulver erhalten.
- Pulvergewebe in eine GC-MS-Durchstechflasche zur 500-L-Abgrenzung geben. 1,5 ml 50/50 (v/v) Ethylacetat/Hexan oder gewünschtes Lösungsmittelgemisch in die Durchstechflasche geben und fest verschließen.
- Für Ausdrücke, die getestet wurden, um die gewünschten Produkte zur Verfügung zu stellen, bündeln Sie geschliffenes Gewebe in einen größeren Kolben oder ein Reagenzglas, fügen Sie dann 2x die Menge an Lösungsmittel als Gewebevolumen hinzu und schütteln Sie über Nacht. Fahren Sie mit Schritt 4.4.5 für die Reinigung fort.
- Legen Sie alle Fläschchen in einem Mikrorohr-Rack und Klebeband fest, um zu sichern. Unter kräftigem Schütteln über Nacht bei Raumtemperatur extrahieren.
- Übertragen Sie 400 l Extrakt und 600 l Hexan in eine frische GC-MS-Durchstechflasche. Kein Blattgewebe aliquote. Analysieren Sie Proben mit GC-MS mit der in Schritt 3.3.6.1 beschriebenen Methode.
- Nach der Analyse über GC-MS auf das Vorhandensein von gewünschten Metaboliten, Pool Blattextrakte zusammen und gehen durch Rotationsverdampfung, Kieselsäuresäulenchromatographie, und HPLC reine Verbindungen zu erhalten, wie in Abschnitt3.2 und 3.3 beschrieben.
Ergebnisse
Schematischer Workflow für die Diterpenoid-Produktion mit E. coli
Abbildung 1 zeigt den beschriebenen Workflow für die Diterpenoidproduktion. Das hier skizzierte Protokoll wurde von einer zuvor beschriebenen E. coli-Plattform für die Diterpenoid-Biosynthese13,32 für die Verwendung von größeren Volumenkulturen und die Reinigung der gewünschten Diterpenoid-Produkte über Kieselsäure angepasst. Chromatographie. Um die Verwendung dieses Protokolls zu demonstrieren, wir verwendeten einen kürzlich identifizierten Dolabralexin-Weg aus Mais, der zwei DiTPSs, ZmAN2 (Zm00001d029648) und ZmKSL4 (Zm000001d032858), eine multifunktionale P450 (CYP71Z18, Zm000001d014134) und ein Cytochrom P450 Reduktase (ZmCPR2, Zm00001d026483) (Abbildung 2). Kurz gesagt, E. coli BL21DE3-C41 kompetente Zellen wurden mit den pCDFDuet:IRS und pACYC-Duet:GGPPS/ZmAN2 Plasmiden13,32vortransformiert. Das pCDFDuet:IRS-Plasmid enthält Schlüsselenzyme für die Diterpenoid-Vorläuferproduktion, einschließlich 1-Deoxy-D-Xylulose-5-Phosphat-Synthase (dxs), 1-Deoxy-D-Xylulose-5-Phosphat-Reduktase(dxr), und isopentenyldiphosphat isomerase (idi), und wurde gezeigt, dass Diterpenoidbildung in E. coli13zu erhöhen. Das pACYC-Duet:GGPPS/ZmAN2 Plasmid enthält die Mais-Ent-Copalyldiphosphat-Synthase ZmAN2 und eine GGPP-Synthase von Abies grandis. Enzyme, die die engagierten Reaktionen in der Dolabralexin-Biosynthese katalysieren, wurden dann als Plasmide pET28b:ZmKSL4 und pETDUET:ZmCPR2/ZmCYP71Z18 kotransformiert. Einzelheiten zu Sequenzen und Plasmidkonstrukten finden Sie unter Mafu et al. 201839.
Ein GC-MS-Chromatogramm der extrahierten Enzymprodukte ist in Abbildung 3Adargestellt, das die Bildung von drei Dolabralexin-Verbindungen veranschaulicht, nämlich Dolabradien (1,2 x 0,25 mg/L-Kultur), Epoxydolabren (0,65 x 0,2 mg/L-Kultur) und Epoxydolabranol (11,4 • 1,1 mg/L-Kultur) auf der Grundlage einer Standardkurve unter Verwendung des Diterpenoid-Sclareols quantifiziert. Sclareol wurde als Referenzstandard verwendet, aufgrund seiner ähnlichen Struktur und chemischen Eigenschaften im Vergleich zu Dolabralexinen. Typische kleinere Nebenprodukte sind Chloramphenicol, die Indolederivate Oxindole und Indole-5-Aldehyd und der Vorläufer Geranylgeranyldiphosphat (GGPP) (Abbildung 3). Indole stellt in der Regel das primäre Nebenprodukt dar, wird hier aber nicht gezeigt, da seine Retentionszeit kürzer ist als die eingestellte Lösungsmittelverzögerung von 7 min, um die Integrität des GC-MS-Instruments zu erhalten.
Schematische Arbeitsabläufe der Diterpenoid-Produktion mit N. benthamiana
Abbildung 4 zeigt einen Überblick über den Ausdruck des Dolabralexin-Weges in N. benthamiana. Für die hier beschriebenen Produkte wurden die folgenden Konstrukte separat in Den A. tumefaciens-Stamm GV3101 umgewandelt: pLife33:p19 (ausdrückend das p19-Gen-Silencing-Suppressor-Protein), pLife33:ZmCYP71Z18, pLife33:ZmAN2, pLife33:ZmKSL4. In dem binären T-DNA-Vektor pLife3341 mit Kanamycinresistenz zur Vermehrung in E. coli und A. tumefaciens wurden in der Länge native Sequenzen der Maisdolabralexin-Signalweggene verwendet. Die Koexpression vorgeschalteter Terpenoid-Signalweggene ist optional, da der Vorläufer geranylgeranyldiphosphat in N. benthamiana endogen gebildet wird. Jedoch, mehrere Studien haben erfolgreich solche Ansätze verwendet, um Diterpenoid-Bildung in N. benthamiana14,36,41zu erhöhen. Wie in Abbildung 3dargestellt, produzierte der Co-Expression erfolgreich Dolabradien und 15,16-Epoxydolabren. Im Gegensatz zur Enzym-Co-Expression in E. coliwurde 15,16-Epoxydolabranol in Metabolitenextrakten nicht nachgewiesen.
Die Anwesenheit von 15,16-Epoxydolabren in Blattextrakten zeigte die Aktivität von CYP71Z18 in N. benthamiana. Da sich 15,16-Epoxydolabranol nach Extraktion aus mikrobiellen Kulturen(Abbildung 3) sowie nach Isolierung aus Maiswurzelgeweben in früheren Studien 39 als stabil erwiesenhat,erscheint es plausibel, dass das hydroxylierte Produkt glykosyliert ist. durch endogene Glykosyltransferasen und anschließend im Vakuum sequestriert, so dass es unzugänglich für die Extraktion mit den hier für die Extraktion verwendeten organischen Lösungsmittelgemischen36,43,44,45 46. Ähnliche unerwünschte Produktmodifikationen im Zusammenhang mit der Pfadtechnik in N. benthamiana wurden in früheren Studien berichtet47. Wie für die Koexpression in E. coligezeigt, führt die transiente Expression in N. benthamiana zur Extraktion mehrerer Nebenprodukte, einschließlich linearer Alkane unterschiedlicher Kettenlänge, die auf dem Vergleich mit Referenzmassenspektrendatenbanken basieren. Es wurde festgestellt, dass aus Blattmaterial extrahierte Verbundtiter im Durchschnitt 2,4 +/- 0,5 mg Dolabradien und 0,9 +/- 0,3 mg 15,16-Epoxydolabren pro g trockenem Blattgewebe sind. Diese Titer können angesichts der unterschiedlichen Versuchsanlagen nicht direkt mit dem E. coli-Co-Expressionssystem verglichen werden.
Diterpenoid-Reinigung
Die Diterpenoid-Reinigung wurde mit der Kieselsäuresäulenchromatographie und der anschließenden semipräparativen HPLC erreicht. Metabolitenextrakte aus 12 L gepoolten E. coli-Kulturen wurden mittels Kieselsäuresäulenchromatographie gereinigt, um die drei fokalen Dolabralexinverbindungen zu trennen (Abbildung 3A). Die Kieselsäurechromatographie ist ideal, um eine hohe Reinheit der Zielverbindungen zu erreichen, da sie eine einfache Trennung von Diterpenolefinen und sauerstoffhaltigen Derivaten ermöglicht und leicht den Hauptschadstoff, Oxindole, entfernt, der auf der Kieselsäurematrix zurückgehalten wird ( Abbildung 3A).
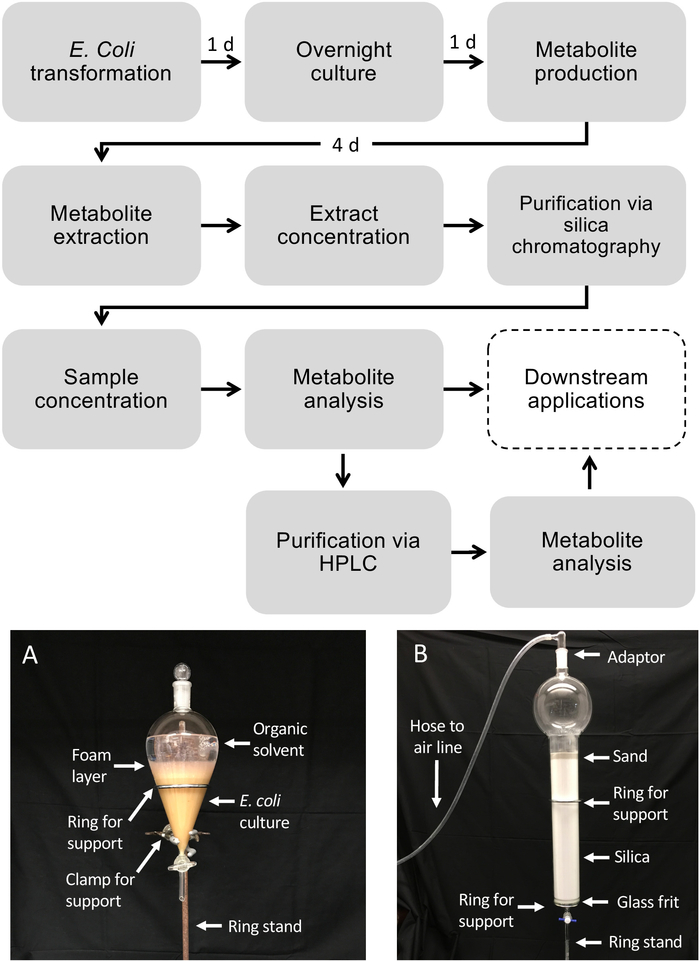
Abbildung 1: Workflow für die Diterpenoidproduktion in E. coli und Metabolitenreinigung aus flüssigen Bakterienkulturen. Gestrichelte Boxen zeigen optionale Schritte, bei denen eine zusätzliche Reinigung erforderlich ist. (A) Repräsentatives Bild der extrahierten E. coli-Kultur mit einem Trenntrichter. (B) Repräsentatives Bild der Metabolitenextraktreinigung mittels Kieselsäurechromatographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Dolabralexin biosynthetischer Signalweg und Genkonstrukte, die in dieser Studie verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
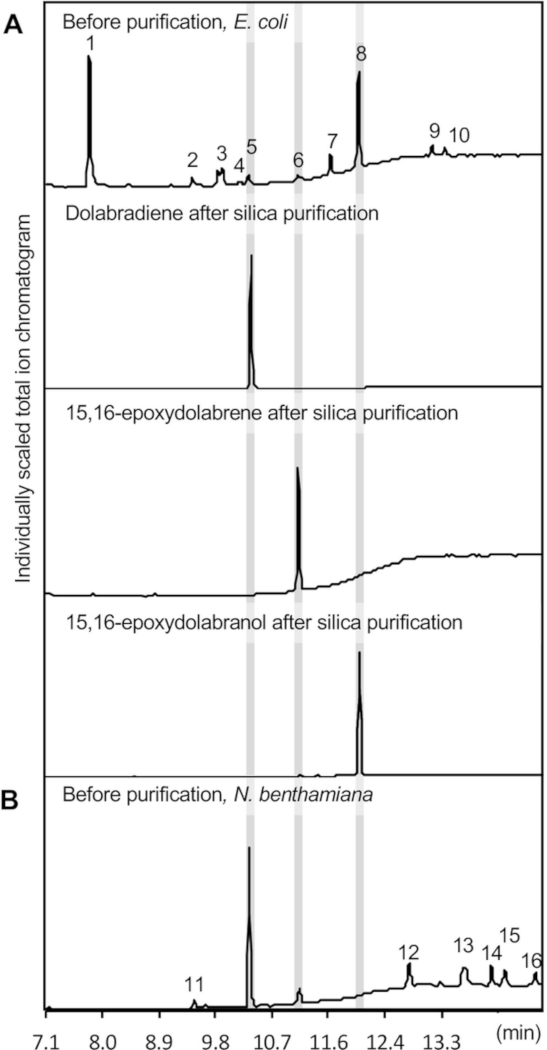
Abbildung 3: GC-MS-Ergebnisse. Gezeigt werden repräsentative GC-MS-Chromatogramme von gereinigten Diterpenoid-Produkten, die mit Enzym-Co-Expression-Assays in (A) E. coli und (B) N. benthamianagewonnen wurden. Produktidentifikationen basieren auf Vergleichen mit authentischen Standards und Referenzmassenspektren der Massenspektralbibliothek des National Institute of Standards and Technology (NIST). 1, Oxindole; 2, Indole-5-Aldehyd; 3, Pyrrolo[1,2-a]pyrazin-1,4-dione, Hexahydro-3-(2-methylpropyl)-; 4, 6-O-Acetyl-1-[4-Bromphenyl]thio]-a-d-Glucosid S,S-dioxid; 5, dolabradien; 6, 15,16-Epoxydolabren; 7, Pyrrolo[1,2-a]Pyrazin-1,4-dion, Hexahydro-3-(Phenylmethyl)-; 8, 15,16-Epoxydolabranol; 9 und 12, unbekannt; 10, Chloramphenicol; 11, 3,7,11,15-tetramethyl-2-hexadecen-1-ol; 13-16, Alkane. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Diterpenoid-Produktion in N. benthamiana. (A) Workflow der Diterpenoid-Produktion in N. benthamiana und Metabolitenreinigung aus Blattmaterial. (B) Repräsentatives Bild von N. benthamiana Pflanzen bereit für Infiltrationsexperimente, vor dem Beschnitt. (C) Repräsentative Bilder von N. benthamiana Pflanzen nach dem Beschnitt. (D) Bild von spritzeninfiltrierten Blättern. Dunklere Gebiete wurden infiltriert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Eine breitere Untersuchung und Anwendung von Diterpenoid-Naturprodukten erfordert einfache, kostengünstige Protokolle, um ausreichende Mengen gewünschter Verbindungen zu synthetisieren und zu reinigen. Die rasante Zunahme der Anzahl der verfügbaren diterpenoid-metabolischen Enzyme aus einer breiten Palette von Arten bietet nun ein umfangreiches Inventar für die enzymatische Produktion von Diterpenoiden mit mikrobiellen und pflanzlichen Wirtssystemen. Darüber hinaus ermöglicht die modulare Architektur vieler Diterpenoid-Wege die Verwendung von Enzymen aus der gleichen oder verschiedenen Arten in "Plug & Play" kombinatorischen Engineering-Ansätzen, um eine Reihe von natürlichen und neuen naturähnlichen diterpenoidnatürlichen Produkte2,14,26,35.
E. coli ist ein bevorzugter mikrobieller Wirt für die Biosynthese von Naturprodukten aufgrund seiner Robustheit, der einfachen Skalierbarkeit, der begrenzten chemischen Komplexität für eine reduzierte Nebenproduktkontamination und der Fülle verfügbarer Werkzeuge für die DNA-Montage und -Expression. Optimierung. Nach unserer Erfahrung eignet sich die hier beschriebene Plattform gut für die Herstellung von Produkterträgen von bis zu mehreren hundert mg Diterpenolefinen und Alkoholen, was für viele nachgelagerte Anwendungen, einschließlich der hier vorgeschlagenen, geeignet ist. Die hier beschriebene Produktionsplattform erfüllt zwar nicht den industriellen Maßstab, kann aber als Grundlage für weitere Wege-, Host- und Fermentationsoptimierung dienen, wie sie erfolgreich für verwandte Diterpenoide wie Taxadien und Sclareol 33 demonstriert wurde. ,34. Die Überexpression von ratenbegrenzenden MVA- oder MEP-Signalsignalgenen wurde erfolgreich etabliert, um ertragsbegrenzende Faktoren für die Diterpenoid-Biosynthese zu überwinden, wie z. B. unzureichende Vorläuferversorgung und Vorläuferfluss in konkurrierende Pfade13, 32,33,39. Obwohl sich in mehreren Studien als erfolgreich erwiesen, ist eine schlechte Expression und katalytische Aktivität von terpenoid-metabolischen eukaryotischen P450s und anderen membrangebundenen Enzymen in E. coli ein wahrscheinlich erbegrenzender Faktor33,39 ,48,49,50,51,52. Die Verwendung von codonoptimierten Sequenzen und Proteinmodifikationen, wie die Entfernung des endoplasmatischen Retikulumsignalpeptids oder die Einführung eines plastidialen Signalpeptids, haben sich als nützlich erwiesen, um die lösliche P450-Expression14,38 zu erhöhen. ,49,50,53. Solche Modifikationen wurden auch für die mikrobielle Ko-Expression von Mais CYP71Z1839 als Beispielweg in dieser Studie verwendet. Die beschriebenen Protokolle basieren auf der Verwendung von Plasmiden, die ein oder zwei Gene pro Konstrukt tragen, alle unter demselben induzierbaren Promotor. Wenn größere Genkombinationen gewünscht werden, ist es ratsam, verschiedene verfügbare Multigenkassetten oder Gen-Stacking-Systeme zu verwenden, um die reduzierte Transformationseffizienz und das Kulturwachstum durch den Einsatz mehrerer Plasmide und Antibiotika zu verringern13 .
Mit der breiteren Verfügbarkeit von Genetischen und Genomressourcen werden Pflanzenwirtsysteme auch zunehmend für die Herstellung natürlicher Produkte geeignet. Vorteile sind die Fähigkeit von Pflanzen, die erforderlichen natürlichen Vorläufer zu produzieren, die durch Photosynthese angetrieben werden, wodurch die Produktbildung ermöglicht wird, ohne dass die Vorläufermoleküle54,55ergänzt werden müssen. N. benthamiana ist bereits weit verbreitet für in vivo funktionelle Charakterisierung und kombinatorische Expression von Terpenoid und anderen natürlichen Produktwegen14,35,36,40 . Bemerkenswerte Vorteile der Verwendung von N. benthamiana als Wirtssystem sind die endogene Produktion von Diterpenoid-Vorstufen, die Verwendung nativer Gensequenzen, die vereinfachte Expression von eukaryotischen P450s, die Einfache kombinationskombinierte Gentransformation (als für die vorübergehende Kotransformation und die einfache Extraktion von Zielprodukten aus Blattmaterial sind keine separaten Antibiotika erforderlich. Bei Bedarf kann die Diterpenoidproduktion durch die Koexpression wichtiger MEP-Signalweggene verbessert werden, um die Vorläuferversorgung zu erhöhen36,41. Die Beschränkungen für die skalierbare Diterpenoid-Produktion in N. benthamiana sind komplexer als flüssige mikrobielle Kulturen, da ausreichende pflanzliche Biomasse, arbeitsintensivere Produktreinigung aus chemisch komplexen Pflanzengewebe und mögliche unerwünschte Metabolisierung von Zielprodukten, z.B. Oxidation, Glykosylierung oder Dephosphorylierung durch endogene Enzyme36,43,44,45 ,46,47. Dieses Verfahren kann jedoch auf mg-Produktmengen skaliert werden, indem die Anzahl der für die Agroinfiltration verwendeten Pflanzen erhöht wird56.
Die hier beschriebenen Produktextraktions- und Reinigungsprotokolle sind mit E. coli und N. benthamianasowie S. cerevisiae und anderen pflanzlichen oder mikrobiellen Wirtssystemen kompatibel und bieten einen kosteneffizienten Ansatz, der leicht sowohl in Biologie- als auch in Chemielaboren eingerichtet und erfordert keine teuren Reinigungsgeräte. Die Metabolitenextraktion mit einem Trenntrichter eignet sich gut für eine effiziente Extraktion und Phasentrennung vor der chromatographischen Reinigung. Trichtergrößen können leicht angepasst werden, um größere Kulturvolumina zu ermöglichen und die experimentelle Zeit zu reduzieren, die für die Extraktion aus großen Kulturen benötigt wird. Wir fanden die Verwendung eines Hexan/Ethylacetat-Gradienten ideal für die Extraktion von Diterpenoiden unterschiedlicher Polarität, wie hier für die Gruppe der Dolabralexine gezeigt, die sowohl Kohlenwasserstoff- als auch sauerstoffhaltige Verbindungen umfassen (Abbildung 3). Je nach Eigenschaften der Zielprodukte können andere Lösungsmittelgemische von Vorteil sein. Lösungsmittel dürfen jedoch nicht mit Wasser mischbar sein, um eine erfolgreiche Extraktion und Phasentrennung mit der Trenntrichtertechnik zu gewährleisten. Darüber hinaus muss bei der Verwendung dieses Ansatzes zur Herstellung flüchtiger organischer Verbindungen (VOCs), wie z. B. mono- und sesquiterpenoide und andere VOCs mit geringerem Molekulargewicht, der Produktverlust durch Verdampfung berücksichtigt werden. Die chromatographische Trennung von Diterpenoiden unterschiedlicher Sauerstoffgehalte mit einer größeren Kieselsäuresäule im größeren Maßstab (2 l) ist unserer Erfahrung nach von Vorteil, da sie eine verbesserte Produkttrennung bietet und den Bedarf an iterativer Reinigung minimiert. Schritte bei verwendung kleinerer Spaltenvolumes. Säulenvolumina und Matrizen können je nach Bedarf für das gewünschte Kulturvolumen und die Art des Naturprodukts angepasst werden. Die Reinheit von Zielprodukten, die mit diesem Protokoll erreicht werden können, eignet sich für viele nachgelagerte Anwendungen, wie Bioaktivitätstests oder für den Einsatz in Enzymaktivitätsanalysen. Wenn jedoch höhere Reinheitsgrade erforderlich sind, wie z. B. Strukturanalysen über NMR, kann die Produktreinheit durch zusätzliche Reinigung mit (halb-)präparativem HPLC effizient verbessert werden.
Dieses hier beschriebene Protokoll wurde für die Herstellung von diterpenoiden Naturprodukten optimiert, kann aber auch leicht an verwandte Mono-, Sesqui- und Tri-Terpenoide sowie andere natürliche Produktklassen angepasst werden, indem einfach das gewünschte Enzym erzeugt wird. Module für kombinatorische Expression14,57. Änderungen der Verfahren zur Produktextraktion und -reinigung müssen jedoch bei Verbindungen mit höherer Volatilität, wie Mono- und Sesqui-Terpenoiden, oder bei höherer Polarität und funktioneller Modifikation berücksichtigt werden, wie sie durch Glykosylierung vieler Triterpenoide, Phenylpropanoide und anderer natürlicher Produktklassen.
Obwohl industrielle Plattformen für die Herstellung natürlicher Produkte verfügbar sind, bieten die hier beschriebenen Protokolle ein kostengünstiges, anpassbares Werkzeug, das in den meisten Laboratorien problemlos eingerichtet werden kann. Wie die Produktion von Mais-Dolabralexinen hier und anderswozeigt 39, reichen die Produktmengen und die Reinheit, die mit diesem Ansatz erreicht werden können, in der Regel aus, um verschiedene nachgelagerte Analysen und Verwendungen zu erleichtern, einschließlich, aber nicht beschränkt auf verschiedene Bioaktivitätsstudien, Die Analyse von Wechselwirkungen zwischen Organismen sowie zur Verwendung als Enzymsubstrate oder als Ausgangsmaterial für Halbsyntheseansätze.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Wir danken Dr. Reuben Peters (Iowa State University, USA) für die Bereitstellung der pIRS- und pGXZmAN2-Konstrukte. Finanzielle Unterstützung für diese Arbeit durch das NSF Plant-Biotic Interactions Program (Zuschuss Nr. 1758976 an P.Z.), das DOE Early Career Research Program (Grant- DE-SC0019178 to P.Z.), das DOE Joint Genome Institute Community Science Program (Grant- CSP2568 to P.Z.), das NSF Das Graduate Research Fellowship Program (zu K.M.M.) und ein UC Davis Dean es Mentorship Award Fellowship (an K.M.M.) werden dankbar gewürdigt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1020 Trays | Greenhouse Megastore | CN-FLHD | |
| 2-(N-morpholino)ethanesulfonic acid | Sigma | M8250-500g | MES |
| 4" Tech Square Pot | McConkey Wholesale Grower's Supply | JMCTS4 | |
| 5977 Extractor XL MS | Agilent | - | |
| 7890B GC | Agilent | - | |
| Acetonitrile | Sigma | 271004 | |
| Agar | Fisher | BP1423-2 | |
| Bacterial yeast extract | Fisher | BP9727-2 | |
| Beaker | CTechGlass | BK-2001-015B | |
| Cap, 9 mm blue screw, PFTE | Agilent | 5185-5820 | GC vial cap |
| Carbenicillin | Genesee | 25-532 | Carb |
| Chloramphenicol | Fisher | 50247423 | Chlor |
| Chromatography column | CTechGlass | CL-0015-022 | |
| Clear humidity dome | Greenhouse Megastore | CN-DOME | |
| ColiRollers Plating Beads | Sigma | 71013 | Glass beads |
| CoorsTek Porcelain Mortars | Fisher | 12-961A | mortar |
| CoorsTek Porcelain Pestles | Fisher | 12-961-5A | pestle |
| Delta-Aminolevulinic acid hydrochloride | Sigma | 50981039 | Aminoleuvolinic acid |
| Ethanol | Fisher | A962-4 | EtOH |
| Ethyl acetate | Fisher | E1454 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | Falcon tubes |
| Fisherbrand Disposable Cuvettes | Fisher | 14-955-127 | cuvette |
| Fisherbrand Petri Dishes with Clear Lid | Fisher | FB0875713 | petri dish |
| Fisherbrand Polypropylene Microtube Storage Racks | Fisher | 05-541 | microtube rack |
| Glucose | Sigma | G7021 | |
| Glycerol | Fisher | G33-500 | |
| Hexanes | Fisher | H292-4 (CS) | |
| HP-5MS | Agilent | 19091S-433 | GC column |
| Inlet adapter | CTechGlass | AD-0006-003 | glass inlet adapter |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher | BP1755-100 | IPTG |
| Kanamycin | Fisher | BP9065 | Kan |
| KIM-KAP Caps, Disposable, Polypropylene, Kimble Chase | VWR | 60825-798 | breathable test tube lids |
| Magnesium chloride | Acros | 223210010 | MgCl2 |
| Magnesium sulfate | Sigma | M7506-500g | MgSO4 |
| Miracle-Gro Water Soluble All Purpose Plant Food | Miracle-Gro | 2756810 | |
| Mixer Mill MM 200 | Retsch | 20.746.0001 | tissue mill |
| Nalgene Fernbach culture flask | Sigma | Z360236 | 2.8 L flask |
| New Brunswick I26 | Eppendorf | M1324-0000 | Shaking incubator |
| Nicotiana benthamiana seed | USDA Germplasm Repository | Accession TW16 | N. benthamiana |
| OverExpress C41(DE3) Chemically Competent Cells | Lucigen | 60442 | C41-DE3 cells |
| Parafilm M wrapping film | Fisher | S37440 | Parafilm |
| Potassium chloride | Sigma | P-9541 | KCl |
| Potassium phosphate dibasic anhydrous | Fisher | P288-3 | Dipotassium phosphate |
| Potassium phosphate monobasic | Monopotassium phosphate | ||
| Pyrex disposable culture tubes, rimless | Sigma | CLS9944516 | test tubes |
| Pyruvate Acid Sodium Salt | Fisher | 501368477 | Sodium pyruvate |
| Retort Ring Stands | CTechGlass | ST00 | ring stand |
| Riboflavin | Amresco | 0744-250g | |
| Rifampicin | Sigma | R7382 | Rif |
| Rotovap | |||
| Sand, 50-70 mesh particle size | Sigma | 274739-1KG | |
| Silica | Fisher | AC241660010 | silica gel |
| Sodium chloride | Fisher | 5271-3 | NaCl |
| Sodum hydroxide | Fisher | SS266-1 | NaOH |
| Spectinomycin | Fisher | 501368607 | Spec |
| Squibb Separatory Funnel | CTechGlass | FN-1060-006 | Separatory funnel |
| Sunshine Mix #1 | Sungro Horticulture | Potting soil | |
| Thermo Scientific Snap Cap Low Retention Microcentrifuge Tubes | Fisher | 21-402-902 | microtube |
| Triangle funnel | CTechGlass | FN-0035 | funnel |
| Tryptone | Fisher | BP14212 | |
| Vial, screw, 2 mL, amber, WrtOn | Agilent | 5182-0716 | GC vial |
| visible spectrophotometer, V-1200 | VWR | 634-6000P | spectrophotometer |
| ZORBAX Eclipse XDB-C18 | Agilent | 990967-202 | HPLC column |
| ZORBAX Eclipse XDB-CN | Agilent | 990967-905 | HPLC column |
Referenzen
- Peters, R. J. Two rings in them all: the labdane-related diterpenoids. Natural Product Reports. 27 (11), 1521-1530 (2010).
- Zerbe, P., Bohlmann, J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33 (7), 419-428 (2015).
- Toyomasu, T. Recent advances regarding diterpene cyclase genes in higher plants and fungi. Bioscience, Biotechnology, and Biochemistry. 72 (5), 1168-1175 (2008).
- Smanski, M. J., Peterson, R. M., Huang, S. X., Shen, B. Bacterial diterpene synthases: new opportunities for mechanistic enzymology and engineered biosynthesis. Current Opinion in Chemical Biology. 16 (1-2), 132-141 (2012).
- Salazar-Cerezo, S., Martinez-Montiel, N., Garcia-Sanchez, J., Perez, Y. T. R., Martinez-Contreras, R. D. Gibberellin biosynthesis and metabolism: A convergent route for plants, fungi and bacteria. Microbiological Research. 208, 85-98 (2018).
- Keeling, C. I., Bohlmann, J. Diterpene resin acids in conifers. Phytochemistry. 67 (22), 2415-2423 (2006).
- Schmelz, E. A., et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins. Plant Journal. 79 (4), 659-678 (2014).
- Bohlmann, J., Keeling, C. I. Terpenoid biomaterials. Plant Journal. 54 (4), 656-669 (2008).
- Mafu, S., Zerbe, P. Plant diterpenoid metabolism for manufacturing the biopharmaceuticals of tomorrow: prospects and challenges. Phytochemistry Reviews. 17 (1), 113-130 (2017).
- Hillwig, M. L., Mann, F. M., Peters, R. J. Diterpenoid biopolymers: new directions for renewable materials engineering. Biopolymers. 95 (2), 71-76 (2011).
- Jorgensen, L., et al. 14-step synthesis of (+)-ingenol from (+)-3-carene. Science. 341 (6148), 878-882 (2013).
- Line, N. J., Burns, A. C., Butler, S. C., Casbohm, J., Forsyth, C. J. Total Synthesis of (-)-Salvinorin A. Chemistry. 22 (50), 17983-17986 (2016).
- Morrone, D., et al. Increasing diterpene yield with a modular metabolic engineering system in E. coli: comparison of MEV and MEP isoprenoid precursor pathway engineering. Applied Microbioly and Biotechnology. 85 (6), 1893-1906 (2010).
- Kitaoka, N., Lu, X., Yang, B., Peters, R. J. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Molecular Plant. 8 (1), 6-16 (2015).
- George, K. W., et al. Metabolic engineering for the high-yield production of isoprenoid-based C(5) alcohols in E. coli. Scientific Reports. 5, 11128(2015).
- Paddon, C. J., Keasling, J. D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology. 12 (5), 355-367 (2014).
- Keasling, J. D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering. 14 (3), 189-195 (2012).
- Kampranis, S. C., Makris, A. M. Developing a yeast cell factory for the production of terpenoids. Computational and Structural Biotechnology Journal. 3 (4), e201210006(2012).
- Tholl, D. Biosynthesis and biological functions of terpenoids in plants. Advances in Biochemical Engineering/Biotechnology. 148, 63-106 (2015).
- McGarvey, D. J., Croteau, R. Terpenoid metabolism. The Plant Cell. 7 (7), 1015-1026 (1995).
- Chen, F., Tholl, D., Bohlmann, J., Pichersky, E. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. The Plant Journal. 66 (1), 212-229 (2011).
- Pateraki, I., Heskes, A. M., Hamberger, B. Cytochromes P450 for terpene functionalisation and metabolic engineering. Advances in Biochemical Engineering/Biotechnology. 148, 107-139 (2015).
- Cao, R., et al. Diterpene cyclases and the nature of the isoprene fold. Proteins. 78 (11), 2417-2432 (2010).
- Reiling, K. K., et al. Mono and diterpene production in Escherichia coli. Biotechnology and Bioengineering. 87 (2), 200-212 (2004).
- Hamberger, B., Plant Bak, S. P450s as versatile drivers for evolution of species-specific chemical diversity. Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1612), 20120426(2013).
- Jia, M., Potter, K. C., Peters, R. J. Extreme promiscuity of a bacterial and a plant diterpene synthase enables combinatorial biosynthesis. Metabolic Engineering. 37, 24-34 (2016).
- Paddon, C. J., et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 496 (7446), 528-532 (2013).
- Peralta-Yahya, P. P., Zhang, F., del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Pateraki, I., et al. Total biosynthesis of the cyclic AMP booster forskolin from Coleus forskohlii. Elife. 6, e23001(2017).
- Ignea, C., et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform. Proceedings of the National Academy of Sciences of the United States of America. 113 (13), 3681-3686 (2016).
- Ignea, C., et al. Reconstructing the chemical diversity of labdane-type diterpene biosynthesis in yeast. Metabolic Engineering. 28, 91-103 (2015).
- Cyr, A., Wilderman, P. R., Determan, M., Peters, R. J. A modular approach for facile biosynthesis of labdane-related diterpenes. Journal of the American Chemical Society. 129 (21), 6684-6685 (2007).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Schalk, M., et al. Toward a biosynthetic route to sclareol and amber odorants. Journal of the American Chemical Society. 134 (46), 18900-18903 (2012).
- Andersen-Ranberg, J., et al. Expanding the Landscape of Diterpene Structural Diversity through Stereochemically Controlled Combinatorial Biosynthesis. Angewandte Chemie International Edition in English. 55 (6), 2142-2146 (2016).
- Bruckner, K., Tissier, A. High-level diterpene production by transient expression in Nicotiana benthamiana. Plant Methods. 9 (1), 46(2013).
- Emanuelsson, O., Brunak, S., von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols. 2 (4), 953-971 (2007).
- Hausjell, J., Halbwirth, H., Spadiut, O. Recombinant production of eukaryotic cytochrome P450s in microbial cell factories. Bioscience Reports. 38 (2), BSR20171290(2018).
- Mafu, S., et al. Discovery, biosynthesis and stress-related accumulation of dolabradiene-derived defenses in maize. Plant Physiology. 176 (4), 2677-2690 (2018).
- Zerbe, P., et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiology. 162 (2), 1073-1091 (2013).
- Bach, S. S., et al. High-throughput testing of terpenoid biosynthesis candidate genes using transient expression in Nicotiana benthamiana. Methods in Molecular Biology. , 245-255 (2014).
- Sainsbury, F., Thuenemann, E. C., Lomonossoff, G. P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants. Plant Biotechnology Journal. 7 (7), 682-693 (2009).
- Wang, B., et al. Transient production of artemisinin in Nicotiana benthamiana is boosted by a specific lipid transfer protein from A. annua. Metabolic Engineering. 38, 159-169 (2016).
- Reed, J., Osbourn, A. Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37 (10), 1431-1441 (2018).
- Dong, L., Jongedijk, E., Bouwmeester, H., Der Krol, A. V. an Monoterpene biosynthesis potential of plant subcellular compartments. New Phytologist. 209 (2), 679-690 (2016).
- Liu, Q., et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One. 6 (8), e23255(2011).
- Karunanithi, P. S., et al. Functional characterization of the cytochrome P450 monooxygenase CYP71AU87 indicates a role in marrubiin biosynthesis in the medicinal plant Marrubium vulgare. BMC Plant Biology. 19 (1), 114(2019).
- Pelot, K., et al. Functional diversity of diterpene synthases in the biofuel crop switchgrass. Plant Physiology. 178 (1), 54-71 (2018).
- Wang, Q., Hillwig, M. L., Wu, Y., Peters, R. J. CYP701A8: a rice ent-kaurene oxidase paralog diverted to more specialized diterpenoid metabolism. Plant Physiology. 158 (3), 1418-1425 (2012).
- Wang, Q., Hillwig, M. L., Peters, R. J. CYP99A3: functional identification of a diterpene oxidase from the momilactone biosynthetic gene cluster in rice. The Plant Journal. 65 (1), 87-95 (2011).
- Morrone, D., Chen, X., Coates, R. M., Peters, R. J. Characterization of the kaurene oxidase CYP701A3, a multifunctional cytochrome P450 from gibberellin biosynthesis. Biochemical Journal. 431 (3), 337-344 (2010).
- Swaminathan, S., Morrone, D., Wang, Q., Fulton, D. B., Peters, R. J. CYP76M7 is an ent-cassadiene C11alpha-hydroxylase defining a second multifunctional diterpenoid biosynthetic gene cluster in rice. The Plant Cell. 21 (10), 3315-3325 (2009).
- Gnanasekaran, T., et al. Heterologous expression of the isopimaric acid pathway in Nicotiana benthamiana and the effect of N-terminal modifications of the involved cytochrome P450 enzyme. Journal of Biological Engineering. 9 (1), 24(2015).
- De Luca, V., Salim, V., Atsumi, S. M., Yu, F. Mining the biodiversity of plants: a revolution in the making. Science. 336 (6089), 1658-1661 (2012).
- Wurtzel, E. T., Kutchan, T. M. Plant metabolism, the diverse chemistry set of the future. Science. 353 (6305), 1232-1236 (2016).
- Menon, A., et al. Mobile-based insulin dose adjustment for type 2 diabetes in community and rural populations: study protocol for a pilot randomized controlled trial. Therapeutic Advances in Endocrinology and Metabolism. 10, 2042018819836647(2019).
- Moses, T., et al. OSC2 and CYP716A14v2 catalyze the biosynthesis of triterpenoids for the cuticle of aerial organs of Artemisia annua. The Plant Cell. 27 (1), 286-301 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten