Method Article
디테르페노이드 천연제품의 효소 생산 및 정화를 위한 맞춤형 접근법
요약
여기서 우리는 대장균 또는 니코티아나 벤타미아나에서생합성 효소의 합성 발현을 통해 디테르페노이드 대사산물을 생산하고 정화하기 위한 프로토콜을 쉽게 사용하고 크로마토그라피 생성물을 제시합니다. 정화. 생성된 대사산물은 분자 구조 특성화, 효소 기능성 연구 및 생체 활성 검정을 포함한 다양한 연구에 적합합니다.
초록
디테르페노이드는 삶의 왕국에 널리 분포되어 있으며 발달 과정, 유기간 상호 작용 및 환경 적응에 중요한 생물학적 기능을 가지고 있는 다양한 종류의 소분자 천연 제품을 형성합니다. 이러한 다양한 생체 활동으로 인해 많은 디테르페노이드는 의약품, 식품 첨가물, 바이오 연료 및 기타 바이오 제품과 같은 경제적 중요성도 있습니다. 고급 유전체학 및 생화학적 접근법은 디테르페노이드 대사 유전자, 효소 및 경로에 대한 지식의 급속한 증가를 가능하게 했습니다. 그러나 디터페노이드의 구조적 복잡성과 개별 화합물의 좁은 분류학적 분포는 종종 단일 종에 불과하며 효율적인 생산을 위한 제약 요인으로 남아 있습니다. 신진 대사 효소의 넓은 범위의 가용성은 지금 이 중요한 대사 산물 단의 더 깊은 조사를 촉진하기 위하여 충분한 역가 및 순도에 있는 디테르페노이드를 생성하기위한 자원을 제공합니다. 미생물 및 식물 기반 효소 공동 발현을 위한 확립된 도구를 활용하여, 대장균 또는 니코티아나 벤타미아나에서디테르페노이드의 효소 생산을 위한 쉽게 작동하고 사용자 정의 가능한 프로토콜을 제시하고, 실리카 크로마토그래피 및 반준비 HPLC를 통해 원하는 제품의 정제. 옥수수(Zea mays)돌라브랄렉신 디테르페노이드의 군을 예로 들자면, 디테르펜 신타제(diTPS)와 시토크롬 P450 모노옥시다제(P450) 효소의 모듈식 조합이 어떻게 다른 디테르페노이드 스캐폴드를 생성하는데 사용될 수 있는지 강조한다. 정제된 화합물은 대사 산물 구조 분석, 효소 구조 기능 연구, 시험관 내 및 질라 생체 활성 실험과 같은 다양한 다운스트림 응용 분야에서 사용될 수 있습니다.
서문
디테르페노이드는 많은 유기체에서 중요한 역할을 하는 12,000개 이상의 다환 20탄소 천연물의 화학적으로 다양한 군을 포함한다1. 곰팡이와 식물은 디테르페노이드의 가장 큰 다양성을 생산하지만, 박테리아는 또한 생리 활성 디테르 페노이드를 형성하는 것으로 나타났다 (리뷰참조2,3,4,5). 그들의 광대 한 구조적 다양성에 뿌리를 두고, 디테르 페 노이드는 생물학적 기능의 무리를 제공합니다. 몇 가지 디테르 페 노이드, gibberellin 성장 호르몬 등, 개발 과정에서 필수적인 기능을 가지고5. 그러나, 디테르페노이드의 대다수는 화학 방어 및 유기간 상호 작용의 중재자 역할을 합니다. 이 중,옥수수(Zea mays)및쌀(Oryza sativa)과같은 주요 식품 작물에서 항균 디터페노이드의 해충 및 병원균 방어 및 종별 블렌드에서 디테르펜 수지산이 가장 광범위하게 발생되어 왔다. 공부 6,7. 이러한 생체 활동은 상업적 응용을 위한 풍부한 화학 저장소를 제공하며, 일부 디테르페노이드는 일상 생활의 중요한 의약품, 식품 첨가물, 접착제 및 기타 바이오 제품으로 사용되며8,9 ,10. 디테르페노이드의 자연적 다양성과 생물학적 기능에 대한 연구를 진전시키고 궁극적으로 광범위한 상업적 응용을 촉진하기 위해서는 순수 화합물의 비용 효율적인 준비를 위한 도구가 필요합니다. 펄프 및 제지 산업의 부산물로 생산되는 디테르펜 수지산과 같은 몇 가지 디테르페노이드 바이오 제품에 대해 식물 재료로부터의 대규모 절연이 확립되었다8. 그러나, 특정 조직에만 디테르페노이드의 축적과 환경 자극에 의한 엄격한 규제 하에서 종종 천연 생산자로부터 충분한 생성물의 분리를제한한다 2. 또한, 디터 페노이드의 구조적 복잡성은 화학 합성을 통해 생산을 방해하지만 이러한 접근법은 여러 경우11,12에서성공적이었다. 고급 게놈 및 생화학 기술의 가용성으로, 효소 생산 플랫폼은 디테르페노이드 화합물의 범위를 생산하기위한 증가 관심을 얻고있다 (리뷰13,14, 15,16,17,18).
디테르페노이드를 포함한 모든 테르페노이드는 2개의 이소민 이소프레노이드 전구체, 이소펜테닐 이산염(IPP) 및 디메틸리알 이인산염(DMAPP)19에서 유래되어, 차례로 메발로네이트(MVA) 또는 메틸레리트리톨-5-인산염(MEP) 통로. 테르페노이드 생합성은 박테리아의 MEP 경로와 곰팡이의 MVA 경로를 통해 진행되는 반면, 식물은 세포질 MVA 및 석고 MEP 경로를 가지고 있으며, 후자는 디테르페노이드 형성을 향한 1 차적인 경로인20. Prenyl 트랜스퍼라제에 의한 IPP 및 DMAPP의 응축은 모든 디테르페노이드, 제라닐게라닐 디포스페이트(GGPP)20에중앙 20-탄소 전구체를 산출한다. GGPP 형성의 하류, 2개의 효소 군, 테르펜 신타제(TPSs) 및 시토크롬 P450 단산소나제(P450s)는 주로 테르페노이드 대사의 광대한 화학적 다양성의 형성을 제어한다21,22. 디터펜 신타제(diTPSs)는 GGPP의 커밋된 카보케이션 구동 순환화 및 재배열을 촉매하여 다양한 입체별 이중, 폴리- 또는 매크로-주기적 디터펜 스캐폴드1,3,23, 24. 이들 스캐폴드의 산소화 및 추가기능적 장식은 P450 효소에 의해 촉진되고 다른 효소패밀리(22,25)를선택한다. TPS와 P450s는 일반적으로 모듈형 생합성 네트워크를 형성할 수 있는 종특이적 다중 유전자 군으로 존재하며, 공통청사진을 따라 다양한 효소 모듈을 결합하면 광범위한 화합물2, 26. 최근 몇 년 동안 모듈 형 테르 페노이드 경로에서 작동하는 기능적으로 구별되는 효소의 급속한 발견은 부분적 또는 완전한 경로의 대사 공학을위한 다목적 부품 목록으로 사용하기위한 기회를 확대제공했습니다. 미생물 및 식물 기반 생산 플랫폼 모두. 예를 들어,효모(Saccharomyces cerevisiae)는항말라리아제 인 아르테미신(27), 세스키트르페노이드 바이오연료와 같은테르페노이드 바이오제품의 제조를 위한 다효소 경로를 설계하는 데 성공적으로 적용되었다. 비사볼렌과 파르네센28,또한 디테르페노이드29,30,31을선택한다. 마찬가지로, 산업 규모의 제조를 위한 엔지니어링된 대장균 플랫폼은 항암 약물로 사용되는 탁솔 전구체 taxadiene및 디테르펜 알콜, sclareol을 포함하여 몇몇 디테르페노이드 대사산물을 위해 설치되었습니다. , 향수 산업13,32,33,34에사용됩니다. 유전 공학 및 변환 기술의 발전은 또한 식물 천연 제품9,14,35,36을생산하기위한 식물 호스트 시스템을 점점 더 실용적으로 만들었습니다. 특히, 가까운 담배 상대인 니코티아나 벤타미아나(Nicotiana benthamiana)는여러 유전자 조합의 아그로박테리움-매개형질전환의 용이성으로 인해 테르페노이드 경로 분석 및 엔지니어링을 위해 널리 사용되고 있다. , 내인성 전구체의 효율적인 생합성, 높은 바이오 매스14,35,36.
테르페노이드 생합성을 위한 이러한 확립된 플랫폼에 그림을 그리면서, 디테르페노이드의 효소 생산과 단일 화합물의 정제를 위한 사용하기 쉽고 비용 효율적인 방법을 설명합니다. 제시된 프로토콜은 향상된 디테르페노이드 전구체 생합성을 위해 설계된 대장균 및 N. 벤타미아나 플랫폼이 어떻게 다른 diTPS 및 P450 효소의 조합 발현을 위해 사용될 수 있는지를 보여줍니다. 원하는 디테르페노이드 화합물. 구조적으로 다른 디테르페노이드를 생산하고 정화하는 이 프로토콜의 적용은 옥수수(Zea mays),돌라브랄렉신(dolabralexins)에서 전문화된 디테르페노이드의 예에 의해 도시되며, 그 중 2개의 diTPS와 1개의 P450을 모집하는 내인성 생합성 효소. 올레핀에서 산소화 된 유도체에 이르기까지 다양한 돌라브 랄렉신의 정제는 대규모 실리카 컬럼 크로마토그래피 및 준비적 고압 액체 크로마토그래피 (HPLC)와 분리 깔때기 추출을 결합하여 달성됩니다. 설명된 프로토콜은 디테르페노이드 생산에 최적화되어 있지만 관련 테르페노이드 클래스뿐만 아니라 효소 자원을 사용할 수있는 다른 천연 제품에 쉽게 적응 할 수 있습니다. 이 접근법을 사용하여 생산된 화합물은 핵 자기 공명(NMR) 분석을 통한 구조적 특성화, 효소 기능 연구를 위한 기판으로 사용, 및 다양한 다운스트림 애플리케이션에 적합하며, 이에 국한되지 않습니다. 생체 활동 검시.
프로토콜
주의: 여기에 설명된 프로토콜에는 유해 화학물질, 날카로운 물체, 전기 장치, 뜨거운 물체 및 부상을 초래할 수 있는 기타 위험 요소의 사용이 포함됩니다. 적절한 개인 보호 장비를 착용해야 하며 안전 교육을 포함한 적절한 안전 절차를 따라야 합니다.
1. 재료 및 솔루션 준비
- 30분 동안 리소제니 국물 배지(LB)를 준비하고 오토클레이브: 중간 크기 1L당 트립톤 10g, 세균 효모 추출물 5g, NaCl 10 g을 섞고 탈이온화(DI) 물 1L에 녹입니다.
- 1 L 공동 발현 배양물의 경우, 30 분 동안 2.8 L Erlenmeyer 플라스크 믹스 12 g, 박테리아 효모 추출물 24 g, 10 % (v / v) 글리세롤 40 mL를 준비하고 860 mL의 DI 물에 용해하십시오. 10x 인산완충액1.3L[DI물 1.3L, 모노포타시움 인산염 30.03 g(KH2 PO4),및 163.02 g의 디포타슘 인산염(K2 HPO4)]을준비하고 상기 배지에 첨가한다.
- 카타볼라이트 억압(SOC) 매체로 슈퍼 최적 국물을 준비하세요.
- 2% (w/v) 트립톤, 0.5% (w/v) 세균 효모 추출물, 8.5 mM NaCl 및 2.5 mM KCl을 함유한 용액을 30분 동안 준비하고 오토클레이브합니다.
- 멸균 MgSO4와 포도당을 최종 농도 20 mM으로 추가하십시오. pH 7.0으로 조정하려면 1M NaOH를 사용합니다. SOC 용지를 -20°C에 보관하십시오.
- 피루베이트 1M 나트륨 1L을 준비합니다. 오토클레이브를 15분 동안 4°C에서 보관하십시오.
- 멸균 DI 물에서 1 M 이소프로필 β-D-1-티오갈락토피라노사이드(IPTG)의 20 mL를 준비합니다. -20 °C에서 1-2 mL 알리쿼트 보관하십시오.
- 침투 버퍼를 준비: 10 mM MES (1.952 g) 및 10 mM MgCl2 (2.033 g) DI 물 1 L에 용해. 4 °C에서 보관하십시오.
- 30 분 동안 LB 한천을 준비하고 오토 클레이브하십시오 : DI 물 100 mL 당 트립톤 1 g, 박테리아 효모 추출물 0.5 g, NaCl 1 g 및 한천 1.5 g을 추가하십시오. LB 한천이 병을 다룰 수 있을 만큼 차가워지면 원하는 플라스미드 조합에 필요한 항생제를 추가하십시오. 페트리 접시를 사용하여 한천 접시를 붓고 4 °C에서 보관하십시오.
- 대장균 및 N. 벤타미아나의화합물 생산에 관한 사양은 표 1을 참조하십시오. 리팜피신을 함유한 플레이트를 호일에 싸서 보관 시 열화를 방지합니다.
| 작업 농도(μg/mL) | |||||
| 항생제 | 재고(mg/mL) | 용 매 | 플라스미드 1개 | 플라스미드 2개 | 플라스미드 3개 또는 4개 |
| 카르베니실린 | 50 | H2O | 50 | 25 | 20 |
| 클로람페니콜 | 30 | 에토 (동부)는 | 30 | 20 | 20 |
| 카나마이신 | 50 | H2O | 50 | 25 | 20 |
| 스펙티노마이신 | 30 | H2O | 30 | 25 | 20 |
| 겐타마이신 | 50 | H2O | 30 | ||
| 리팜피신 | 10 | 메오 (주) | 10 | ||
표 1: 대장균 또는 N. 벤타미아나에서플라스미드 공동 발현을 위한 항생제 농도.
2. 대장균에서 디테르페노이드 대사 산물 의 생산
참고: 대장균에서 디테르페노이드 대사 산물을 생산하기 위해 여기에 설명된 프로토콜은 르우벤 J. 피터스 박사(아이오와 주립 대학, IA, 미국)의 그룹이 개발한 이전에 보고된 효소 공동 발현 플랫폼에서 채택되었습니다13 ,32.
- 플라스미드 조합으로 유능한 세포의 변형.
- 얼음 상에서 화학적으로 유능한 대장균 세포를 해동하였다(BL21DE3-C41 세포는 이 프로토콜에서 사용되었다).
- 1.5 mL 마이크로튜브에서 유능한 세포의 25 μL에 공동 발현에 사용되는 각 구제의 100 ng/μL 용액 1 μL을 추가합니다. 파이펫팅하여 소용돌이나 섞지 마십시오.
참고: TPS 및 P450 효소의 최적의 발현 및 활성을 위해서는 여러 서열 변형을 고려해야 합니다. TPS의 경우, N-말단 석고 통과 펩티드의 제거는 종종 필수적이다. 구체적으로, 석고 모노-및 디-TPS는 전형적으로 예측된 통과 펩티드(일반적인 예측 알고리즘37사용)의제거를 요구하는 반면, 세포질 sesqui-TPS는 일반적으로 전체 길이 유전자로서 사용될 수 있다. P450s에 관해서는, N-말단 트랜스멤브레인 도메인의 리더 서열 MAKKTSSKGK를 제거 또는 교체할 뿐만 아니라 코돈 최적화는 많은 경우에38,39에서효과가 입증되었습니다. 또한, P450 효소를 공동 발현할 때 충분한 P450 활성을 보장하기 위해 시토크롬 P450 환원효소(CPR)를 포함시켜야 한다. - 혼합물을 30분 동안 얼음 위에 배양합니다.
- 37°C에서 SOC 매질 및 LB 한천 플레이트를 원하는 구성물의 조합에 필요한 항생제를 함유한다.
참고: 공동 변형될 각 구성은 최적의 단백질 발현을 보장하기 위해 뚜렷한 항생제 내성뿐만 아니라 복제의 뚜렷한 기원을 가져야 합니다. - 세포 혼합물을 42°C에서 1분간 가열한 다음, 얼음위에 2분 이상 배양한다.
- 따뜻한 SOC 용지 200 μL을 추가합니다.
- 37°C 및 200 rpm에서 1시간 동안 세포 혼합물을 흔들어 줍니다.
- 따뜻하게 데운 LB 한천 접시에 약 10개의 오토클레이브 유리 구슬을 넣습니다. 셀 혼합물의 100 μL을 넣고 뚜껑을 교체합니다. 뚜껑을 닫고 접시를 수평으로 흔들어 세포를 고르게 분배합니다. 유리 구슬을 폐기물 용기에 두드려 제거합니다. 대안적으로, 다른 바람직한 도금 방법을 사용한다.
- LB 한천 플레이트를 37°C에서 밤새 배양하고 코팅된 표면을 아래로 향하게 합니다. 형질전환된 대장균 콜로니를 가진 플레이트는 다음날 사용하거나 파라핀 필름에 밀봉하여 최대 2주 동안 4°C에 보관할 수 있다.
- 접종 문화의 준비
- 다음 날, 표 1에제공된 농도를 이용하여 형질전환플라스미드 조합에 필요한 항생제를 사용한 LB 배지의 용액을 준비한다.
- 멸균 후드에서 LB 배지 5mL를 플라스틱 통기성 캡이 있는 15mL 멸균 유리 시험관으로 옮김. 원하는 큰(1L) 배양에 대해 하나의 작은 배양 튜브를 준비한다.
- 파이펫 팁을 사용하여 LB 한천 플레이트에서 개별 대장균 콜로니를 선택합니다. 선택된 콜로니를 포함하는 하나의 피펫 팁을 각 튜브에 배출하여 대장균 콜로니로 LB의 각 튜브를 접종합니다.
- 통기성 플라스틱 캡각 접종 배양 시험관을 캡. 뚜껑을 덮은 대장균을 37°C 의 증식 인큐베이터에 12-24시간 동안 놓는다.
- 공동 표현 문화의 준비 및 유도
- 다음 날, 1x의 최종 인산 완충 농도에 대해 제조된 결핵의 900 mL에 제조된 10x 인산완충액의 100 mL를 추가한다. 표 1에따라 농도로 필요한 항생제를 추가합니다.
- 37°C에서 140rpm에서 따뜻해지며(약 30분) 흔들어 주세요.
- 접종 배양액의 5 mL로 1 L 배양에 대한 각 배지 플라스크를 접종합니다. 접종 배양 튜브에서 접종 배양에 사용되는 파이펫 팁을 유지하여 후속 단계에서 유기 용매로 추출할 때 추출 된 플라스틱 오염 물질이 없도록하십시오.
- 600 nm (OD 600)에서 광학 밀도가 0.6, 약 3 h에 도달 할 때까지 200 rpm에서 흔들림으로 배양하십시오. 분광광도계로 OD600을 측정하려면 인산완충액과 멸균 TB를 블랭크로 사용합니다.
- 원하는 OD600에서인큐베이터 설정을 16°C로 설정합니다.
- P450s를 공동 발현할 때, 충분한 P450 공동 인자 생산에 필수적인 리보플라빈과 아미노레불린산을 신선하게 준비하십시오. 모든 실험에 대해 4 g/L 리보플라빈과 150 g/L 아미노레불린산을 만드세요. 리보플라빈은 가볍기 때문에 사용 될 때까지 호일에 싸서 보관하십시오.
- 인큐베이터가 16°C(약 30분)에 도달한 후, 1 mL의 1 mL, 4 g/L 리보플라빈1 mL, 각 배양액에 1mL, 1mL의 아미노레불린산을 추가합니다. 디테르페노이드 생산을 위해, 충분한 전구체 형성을 보장하기 위해 각 배양에 25 mL의 1 M 나트륨 피루브를 첨가해야합니다.
참고: 이 분석법에 사용된 모든 구문은 동일한 IPTG 유도 프로모터 하에 있었다. 상이한 프로모터는 원하는 대로 사용될 수 있다. - 16 °C에서 배양 하고 72 시간 동안 140 rpm. 디테르페노이드를 생산하는 경우 유도 후 매일 25 mL의 나트륨 피루브를 추가하십시오. 즉시 사용 배양은 대사 산물의 분리 깔때기 추출에 즉시 사용된다; 문화를 수확하거나 저장하지 마십시오.
3. 대사 산물의 분리 및 정제
- 대사 산물의 분리 깔때기 추출
참고: 가소제 오염을 방지하기 위해 유기 용매를 사용할 때는 유리 제품및 유리 파이펫만 사용하는 것이 중요합니다.- 연기 후드에서 분리 깔때기를 링 스탠드에 고정하십시오. 분리 깔때기 아래에 폐기물 비커를 놓습니다.
- 50/50(v/v) 에틸 아세테이트/헥산을 분리 깔때기에 500 mL를 붓습니다.
참고: 용매 혼합물은 표적 대사 산물의 용해도 및 극성에 따라 조정되어야 합니다. 적절한 상 분리를 보장하기 위해 수분 용매를 피해야 합니다. - 대장균 배양500 mL을 분리깔때기에 넣고 유리 마개 위에 놓습니다.
- 유입경로를 흔들어 배양액을 추출 용매와 약 5-10배 섞는다. 깔때기를 거꾸로 잡고 압력을 방출하기 위해 연기 후드를 가리키는 동안 스피고를 열어 깔때기를 자주 가스를 분리합니다. 흔들림 및 탈가스 절차를 2x 반복합니다.
- 깔때기를 링 스탠드에 똑바로 놓고 용매 층(상단)이 수성(culture) 층(아래)에서 분리될 때까지 약 1분 정도 기다립니다.
참고: 상 간에서 다량의 기포가 관찰되면 5-10 mL EtOH의 소량을 첨가하여 상 분리를 개선할 수 있습니다. - 스토퍼를 분리합니다. 대장균 층을 폐비커에 빼내고 깔때기의 용매 층을 유지합니다.
- 대장균 배양물의 나머지 500 mL및 제1 추출에 사용된 동일한 500 mL 용매를 사용하여 절차를 반복한다.
- 추출된 대사 산물을 함유한 용매를 깨끗한 플라스크에 빼낸다. 대장균 배양으로 오염을 피하십시오.
- 회전 증발 농도
- 회전 증발 (rotovap) 장비를 준비 : 수조를 채우고 25 ° C로 온도를 설정합니다. 열에 민감한 화합물의 경우, 낮은 온도 설정을 사용하거나 수조에 얼음을 추가하십시오. 응축 챔버를 드라이 아이스로 채우고 회전 속도를 60-80rpm으로 설정합니다.
- 추출된 대사 산물 약 700 mL을 1 L 증발 플라스크에 넣고 로토바프에 부착한 다음 수조에 더 낮춥니다. 수조 히터를 켜고 25°C로 설정합니다.
- 증발 플라스크의 회전을 시작하고 진공 시스템을 켜고 점차적으로 흡입을 증가하여 대사 산물 용액이 폐 플라스크에 급속히 끓는 것을 피하십시오. 증발 된 용매는 응축 및 응축수 수집 (폐기물) 플라스크로 떨어지는 것을 시작해야합니다.
- 대사 산물 용액의 몇 mL만 증발 플라스크에 남아 있을 때, 회전을 중지하고 진공 시스템을 끕니다. 증발 플라스크를 올리고 진공 라인을 닫아 감압합니다. 증발 플라스크에 남아있는 농축 대사 산물 용액을 유지하십시오. 폐기물을 폐플라스크에 폐기하십시오.
- 증발 플라스크에 최대 700 mL의 추출된 대사 산물 용액을 추가하여 회전 증발을 계속합니다. 추출된 모든 대사 산물 용액이 농축될 때까지 과정을 반복합니다.
- 유리 피펫을 새 시험관으로 옮겨 증발 플라스크에서 농축된 대사 산물을 제거합니다. 50/50(v/v) 에틸 아세테이트/헥산 또는 원하는 용매 혼합물을 5mL로 증발 플라스크를 헹구고 헹구어 헹구어 헹구어 헹구십시오.
- 농축 대사 산물을 -20 °C 또는 -80 °C (제품 안정성에 따라 다름)에서 추가 로 사용할 때까지 보관하십시오.
- 실리카 기둥 정화
- 1L 비커, 유리 깔때기, 50 mL 시험관 및 3.2 L 크로마토그래피 컬럼(유리 프렛 장착)을 헥산으로 한 번, 에틸 아세테이트로 한 번 헹구어 유리 제품을 준비합니다. 분수를 수집하는 데 사용되는 50 mL 시험 튜브에 라벨을 지정합니다.
- 실리카 겔 2L(230-400 메쉬, 60등급)을 2L 의 저수지 용량과 프릿디스크가 있는 3.2L 크로마토그래피 컬럼에 추가한 다음, 모래를 적재하여 기둥 상단에 5cm 층을 형성합니다.
- 헥산 2 L로 철저히 플러시하여 크로마토그래피를 위한 컬럼을 준비합니다. 항상 컬럼이 건조하지 않거나 에어 포켓을 획득하지 않도록 컬럼의 모래 층 위에 용매 액체의 얇은 층 (~ 0.5 cm)이 있어야합니다. 에어 호스에 연결된 유리 입구 어댑터를 사용하여 중력만이 아닌 컬럼을 통해 유량을 부드럽게 늘릴 수 있습니다.
- 농축된 대사산물 추출물(섹션 3.2 참조)을 컬럼에 로드합니다. 샘플을 3x로 들어 있는 병을 헥산으로 헹다닌 다음 컬럼에 추가하여 모든 샘플이 옮겨졌는지 확인합니다.
- 다음 그라데이션을 사용하여, 한 번에 100 mL을 로드하고 표지 된 시험 튜브에서 50 mL 분획을 수집 : 100 % 헥산 3 x, 헥산 3 x에서 10 % (v / v) 에틸 아세테이트, 헥사네스 3 x에서 12.5 % (v / v) 에틸 아세테이트 3 x, 15 % (v / v) 아세산 , 헥산3배의 에틸 아세테이트 20% (v/v) 헥산에 40% (v/v) 에틸 아세테이트 3배, 헥산3x의 에틸 아세테이트 60% (v/v) 에틸 아세테이트, 100% 에틸 아세테이트 4x.
참고: 그라데이션은 복합 크기와 극성 및 원하는 분리에 따라 조정되어야 합니다. - 유리 파이펫을 사용하여 각 분획에서 1 mL을 표지된 GC 바이알로 옮김을 전달합니다. GC-MS를 통해 각 샘플을 분석하여 원하는 대사 산물과 순도 수준을 포함하는 분획을 결정합니다.
참고: 이 방법에서 생성된 대사산물에 적합한 GC-MS 방법은 Mafu 등 201839에기재되어 있다. 간단히 말해서, 모든 분석은 HP-5MS 컬럼(재료 표참조),시료 부피 1 μL, 오븐 온도 램프를 50°C에서 300°C에서 20°C분 -1로사용하여 XL MS 검출기를 사용하여 GC에서 수행하였다. - 관심 있는 화합물을 포함하는 분수를 결정한 후 동일한 화합물을 포함하는 모든 분수를 결합합니다. 화합물을 포함하지 않는 분획을 폐기물 용기에 적절하게 폐기하십시오. 정제 된 대사 산물을 집중시키기 위해 필요한 경우 회전 증발 절차를 반복하십시오.
- 추가 정제가 필요한 경우, 제품 순도를 개선하기 위해 (반)예비 HPLC를 사용하십시오. HPLC 프로토콜은 개별 장비 사양 및 관심 화합물에 따라 조정되어야 합니다.
- 1 mL 헥산 (디테르펜 탄화수소) 또는 아세토니트릴 (산소 디터 페노이드)에서 말린 실리카 크로마토그래피 샘플을 다시 중단하고 필터 주사기를 통해 필터를 통해 작은 입자로오염을 방지합니다.
- 비극성 디터페노이드의 경우 권장 유속이 1mL/min인 CN 열(재료 표참조)과 헥산:에틸 아세테이트 그라데이션을 사용하여 분수가 1분마다 수집됩니다.
- 극성 디터페노이드의 경우 권장 유속이 3mL/min인 C18 열(재료 표참조)과 아세토니트릴:물 그라데이션을 사용하여 분수가 1분마다 수집됩니다.
- 모든 HPLC 정제 분획을 질소 스트림 하에서 건조시키고 GC-MS 분석 전에 1 mL 헥산에서 재중단하여 제품의 풍부성과 순도를 평가합니다.
4. N. 벤타미아나를 이용한 디테르페노이드 대사산물 생산
참고 : N. benthamiana에서 디테르페노이드 대사 산물을 생산하기 위해 여기에 설명 된 프로토콜은 이전에보고 된 연구35,36,40,41에서적응되었습니다. 아래 프로토콜은 N. 벤타미아나 잎의 주사기 침투에 특정합니다. 진공 침윤과 같은 다른 침투 방법은 동일하게 적합합니다. pCAMBIA130035Su (pLIFE33) 또는 pEAQ-HT40,41,42,대장균 및 A. tumefaciens 및 식물 숙주에서 유전자 발현을 가능하게하는 이진 T-DNA 벡터 시스템은 이 프로토콜에 적합합니다.
- 니코티아나 벤타미아나 심기
- 750 mL 냄비 한 개를 화분에 채우고 냄비에 물을 주면 됩니다. ~ 20 담배 씨앗을 추가하고 부드럽게 그들이 토양에 있도록 손가락으로 두드려. 토양으로 덮지 마십시오.
참고 : 씨앗은 종자 번식을위한 자체 수분을 통해 생성 될 수있다. 이 실험에 대 한 씨앗 식물 생물학의 UC 데이비스 학과에서 얻은, USDA 세균 저장소를 통해 공개적으로 사용할 수 (https://npgsweb.ars-grin.gov/gringlobal/accessiondetail.aspx?id=1450450). - 토양이 건조하지 않도록 격일로 물을 다음과 같은 조건으로 성장 챔버에 냄비를 둡니다. 이 프로토콜의 모든 단계에 대해 16:8 h:night 사이클로 26°C 및 60% 습도에서 식물을 재배합니다.
- 1 주 후, 포팅 토양으로 ~ 20 냄비를 채우고 냄비에 물을. 집게를 사용하여, 줄기에 의해 담배 모종을 잡고 부드럽게 소스 냄비에서 제거, 각각의 새로운 냄비에 하나의 모종을 배치하고 조심스럽게 뿌리를 파고. 잎이나 뿌리를 손상시키지 마십시오.
- 냄비에 있는 트레이에 물을 놓아 격일로 식물에 물을 주세요("바닥 급수"라고도 함). 매 4 급수는 패키지 지침에 따라 물에 일반 비료를 포함합니다.
- 750 mL 냄비 한 개를 화분에 채우고 냄비에 물을 주면 됩니다. ~ 20 담배 씨앗을 추가하고 부드럽게 그들이 토양에 있도록 손가락으로 두드려. 토양으로 덮지 마십시오.
- 아그로박테리움 투메파시엔스 균주 GV3101 유능한 세포의 동결 해동 형질전환
- 해동 아그로박테리움 tumefaciens 변형 GV3101 (또는 다른 바람직한 변형) 얼음에 유능한 세포 (~ 1 시간). 얼음에 0.2 mL 미세 원심 분리튜브를 미리 냉각시. 28 °C에서 따뜻한 SOC 매체.
- 피펫 팁(위아래 피펫을 피펫하지 않음)과 차가운 1.5 mL 마이크로튜브로 각 변형을 위해 15 μL의 셀을 부드럽게 혼합합니다.
- 유능한 세포의 각 튜브에 DNA 1-5 μL (~400 ng)을 추가하고 튜브 랙을 따라 튜브를 긁어 부드럽게 섞습니다.
참고 : 원하는 구조는 각각 별도로 변형되고 침투하기 전에 혼합되기 때문에 다른 항생제 내성을 가질 필요가 없습니다. - 마이크로튜브를 액체 질소에 5분 동안 놓습니다.
- 액체 질소에서 마이크로튜브를 제거하고 튜브를 실내 온도 랙에 놓습니다. 37°C 인큐베이터에서 5분 동안 튜브를 해동합니다.
- 각 마이크로튜브에 미리 온난(28°C) SOC의 250 μL을 추가합니다. 28-30 °C, 225 rpm에서 3 시간 동안 흔들어 주세요.
- 플레이트 50 μL은 2.1.8단계에서 기재한 바와 같이 멸균 유리 비드를 사용하여 표 1에 기재된 필요한 항생제를 함유하는 LB 한천 플레이트 상에 변형된 세포를 상으로 한다.
- 인큐베이트 플레이트는 48시간 동안 28-30°C에서 반전되어배양1일 이내에 성장하여 오염의 징후일 수 있다. 형질전환된 A. 투미파시엔은 2일 배양 후 사용하거나 파라핀 필름에 밀봉하여 최대 2주 동안 4°C에서 보관할 수 있다.
- 아그로박테리움 -니코티아나 벤타미아나에서 중재된 과도 효소 공동 발현
- 자두 4 주 된 니코티아나 벤타미아나 식물 2 일 전에 낮은 잎을 제거하여 침투합니다. 4 개의 상단 잎을 둡니다. 식물에 물을. 오픈 스토마타와 쉽게 침투할 수 있도록 침투하기 전에 식물에 24 시간 물을 하지 마십시오.
- 선택한 구성부 및 아그로박테리움 균주에 적합한 항생제의 작업 농도로 LB 10 mL을 호일 뚜껑이 있는 50 mL 멸균 유리 시험관에 추가합니다.
- 파이펫 팁을 사용하여 변형된 아그로박테리움의 단일 콜로니를 면봉하고 팁을 LB 용지로 배출합니다. 각 아그로박테리움 형질전환제에는 적어도 2개의 작은 배양이 있어야 한다.
- 28 °C 및 220 rpm에서 밤새 배양합니다.
- 분광광도계를 사용하여 야간 배양물의 600 nm(OD600)에서광학 밀도를 측정합니다. 하룻밤 배양액을 OD600 의 1로 희석한다.
참고: 최적의 OD600 값은 다른 아그로박테리움 균주를 사용할 때 다를 수 있습니다. - 희석된 하룻밤 배양물 10 mL을 50 mL 원엽 튜브에 분배합니다.
- 3500 rpm에서 원심분리로 박테리아를 15 분 동안 방 온도에서 수확하십시오. 부어 서상한 것을 버리십시오.
- 튜브를 부드럽게 흔들고 튜브 랙에서 압연하여 10 mL 침투 버퍼에서 배양을 다시 중단합니다. OD600은 각 구문에 대해 1과 같아야 합니다.
- 각 형질전환된 세포주의 동일한 부피를 결합하여 침투에 필요한 조합을 생성합니다. OD600은 각 침투에 대해 1과 같아야 합니다. 잎 당 5 mL의 침투 용액, 식물 당 2 잎을 추정합니다.
- 튜브를 로커에 수평으로 부착하고 실온에서 2시간 동안 부드럽게 바위를 바위.
- N. 벤타미아나 식물당 약 5 mL의 침윤 혼합물을 사용하여 N. 벤타미아나 식물당 ~2 잎을 침투시다. 잎 의 밑면에 바늘없는 주사기로 건강한 잎에 침투하고 잎의 상단에 손가락으로 반대 압력을 가하여 침투 용액이 잎 조직을 가득 채우도록합니다.
- 모든 침투된 잎을 검은색 마커 또는 기타 표시기로 표시합니다. 5 일 동안 성장 챔버에 침투 한 식물을 배치하십시오. 식물에 물을 잘 유지하십시오.
참고: 5일간의 인큐베이션 시간은 제품 형성시간 효율을 유지하면서 대부분의 다운스트림 분석에 충분한 디테르페노이드 수준에 도달하기에 충분한 것으로 입증되었습니다. 더 긴 잠복기는 더 높은 제품 양이 요구되는 경우에 시험될 수 있습니다.
- 변형된 니코티아나 벤타미아나에서 대사산물 추출 및 정제
- 식물에서 잎을 잘라서 수확합니다. ~ 100 mL의 액체 질소와 단일 잎을 박격포에 넣고 미세한 분말을 얻을 때까지 박격포와 유봉 또는 조직 밀을 사용하여 분쇄합니다.
- 가루 조직을 GC-MS 바이알에 500 μL 경계에 첨가한다. 1.5 mL의 50/50 (v/v) 에틸 아세테이트/헥산 또는 원하는 용매 혼합물을 바이알과 캡에 단단히 넣습니다.
- 원하는 제품을 제공하기 위해 시험된 발현의 경우, 지상 조직을 더 큰 플라스크 또는 시험관으로 풀한 다음, 조직 부피보다 ~2배의 용매량을 추가하고 밤새 흔들어 줍니다. 정화를 위해 4.4.5 단계로 진행하십시오.
- 모든 바이알을 마이크로튜브 랙에 놓고 테이프를 단단히 내려놓아 단단히 고정하십시오. 실온에서 밤새 격렬한 흔들림으로 추출하십시오.
- 400 μL의 추출물과 600 μL의 헥산을 신선한 GC-MS 바이알에 옮김. 잎 조직을 알리인용하지 마십시오. 3.3.6.1 단계에서 설명한 방법을 사용하여 GC-MS를 사용하여 샘플을 분석합니다.
- 원하는 대사 산물의 존재에 대한 GC-MS를 통해 분석 한 후, 풀 잎 추출물을 함께 풀화하고 회전 증발, 실리카 컬럼 크로마토그래피 및 HPLC를 통해 섹션 3.2 및 3.3에 기재된 바와 같이 순수한 화합물을 얻었다.
결과
대장균을 이용한 디테르페노이드 생산을 위한 회로도 워크플로우
도 1은 디테르페노이드 생산을 위한 설명된 워크플로우를 도시한다. 여기에 설명된 프로토콜은 실리카를 통해 원하는 디테르페노이드 제품의 대량 배양 및 정제를 위해 디테르페노이드 생합성13,32에 대해 앞에서 설명한 대장균 플랫폼에서 채택되었습니다. 크로마토그래피. 이 프로토콜의 사용을 입증하기 위해, 우리는 두 개의 diTPSs를 포함하는 옥수수에서 최근에 확인 된 돌라브렉신 경로를 사용, ZmAN2 (Zm00001d029648) 및 ZmKSL4 (Zm00001d032858), 다기능 P450 (CYP71Z18, Zm00001d014134) 및 시토크롬 P450 (ZmCPR2, Zm00001d026483)(그림 2). 간단히 말해서, 대장균 BL21DE3-C41 유능한 세포는 pCDFDuet:IRS 및 pACYC-듀엣:GGPPS/ZmAN2 플라스미드13,32로미리 변형하였다. pCDFDuet:IRS플라스미드는 디터페노이드 전구체 생산을 위한 주요 효소를 함유하고있으며, 여기에는 1-데옥시-D-자일루로스-5-인산염 신타제(dxs), 1-디옥시-D-자일루로스-5-인산염 환원효소(dxr), 및 이소펜테닐 디포스페이트 이소머라아제(idi)는대장균(13)에서 디테르페노이드 형성을 증가시키는 것으로 나타났다. pACYC-Duet:GGPPS/ZmAN2 플라스미드에는 옥수수 엔트-코팔릴디포스페이트 신디사이저 ZmAN2와 에비스 그랜디스의GGPP 신디사이저가 포함되어 있다. 돌라브랄렉신 생합성에서 커밋된 반응을 촉매하는 효소는 플라스미드 pET28b:ZmKSL4 및 pETDUET:ZmCPR2/ZmCYP71Z18로 공동 변형하였다. 시퀀스 및 플라스미드 구문에 대한 자세한 내용은 Mafu 등 201839를참조하십시오.
추출된 효소 제품의 GC-MS 크로마토그램은 그림 3A에나타내며, 돌라브라디아인(1.2±0.25 mg/L 배양), 에폭시돌라브렌(0.65±0.2 mg/L 배양), 에폭시돌라브란올(11.4)의 형성을 도시하고 있다. ±1.1 mg/L 배양체)는 디테르페노이드 슬레톨을 이용하여 표준 곡선에 기초하여 정량화하였다. Sclareol 은 돌라브랄렉신과 비교하여 유사한 구조와 화학적 특성으로 인해 기준 표준으로 사용되었습니다. 전형적으로 관찰된 경미한 부산물은 클로람페니콜, 인돌 유도체 옥신돌 및 인돌-5-알데히드, 및 전구체 제라닐게라닐 이인산염(GGPP)을포함한다(그림 3). Indole은 일반적으로 1차 부산물을 나타내지만 GC-MS 계측기의 무결성을 유지하기 위해 설정된 용매 지연보다 7분의 짧은 보존 시간으로 인해 여기에 표시되지 않습니다.
N. 벤타미아나를 이용한 디테르페노이드 생산의 회로도 워크플로우
그림 4는 N. 벤타미아나에서돌라브랄렉신 통로의 발현에 대한 개요를 도시한다. 여기에 설명된 제품의 경우, 다음 구성은 A. tumefaciens 균주 GV3101: pLife33:p19(p19 유전자 침묵 억제 단백질 발현), pLife33:ZmCYP71Z18, pLife33:ZmAN2, pLife33:ZmKSL4로 별도로 변형되었다. 옥수수 돌라브랄렉신 통로 유전자의 전체 길이 네이티브 서열은 대장균 및 A. 투메파시엔에서전파를 위한 카나마이신 저항성을 가진 이진 T-DNA 벡터 pLife3341에 사용되었다. 상류 테르페노이드 통로 유전자의 공동 발현은 선택적, 전구체 geranylgeranyl 이인산염은 N. 벤타미아나에서 내인성 형성되기 때문에. 그러나, 몇몇 연구 결과는 성공적으로 N. benthamiana14,36,41에있는 디테르페노이드 대형을 증가시키기 위하여 그 같은 접근을 채택했습니다. 도 3에도시된 바와 같이, 공동 발현은 성공적으로 돌라브라디아엔 및 15,16-에폭시돌라브렌을 생산했다. 대장균에서의효소 병용 발현과는 달리, 15,16-에폭시돌라브라란올은 대사산물 추출물에서 검출되지 않았다.
잎 추출물에 15,16-에폭시돌라브렌의 존재는 N. 벤타미아나에서CYP71Z18의 활성을 입증하였다. 15,16-에폭시돌라브라란올은 미생물 배양물로부터 추출한 후 안정한 것으로 나타났으며(그림3)뿐만 아니라 이전 연구에서 옥수수 뿌리 조직에서 분리된 후39,하이드록시살화된 생성물이 글리코실화되는 그럴듯한 것으로 나타났다. 내인성 글리코실트랜스퍼라제에 의해 액포에 이의를 제기한 후, 추출을 위해 여기에 사용되는 유기 용매 혼합물로 추출에 접근할 수 없게 되는36,43,44,45 ,46. N. benthamiana에 있는 통로 공학의 맥락에서 유사한 바람직하지 않은 제품 수정은 이전 연구 결과47에서보고되었습니다. 대장균의공동 발현에 대해 도시된 바와 같이, N. benthamiana의 과도 발현은 참조 질량 스펙트럼 데이터베이스와 비교하여 서로 다른 사슬 길이의 선형 알칸을 포함한 여러 부산물을 추출하는 결과를 초래한다. 잎 재료로부터 추출된 화합물 적시하는 g 건성 잎 조직 당 평균 2.4 +/- 0.5 mg의 돌라브라디엔 및 0.9 +/- 0.3 mg 15,16-에폭시돌라브렌인 것으로 나타났다. 이러한 적계자는 상이한 실험 적 설정이 주어진 대장균 공동 발현 시스템과 직접 비교될 수 없다.
디테르페노이드 정제
디테르페노이드 정제는 실리카 컬럼 크로마토그래피 및 후속 반준비 HPLC를 사용하여 달성되었다. 풀화된 대장균 배양물 12L로부터의 대사산물 추출물을 실리카 컬럼 크로마토그래피를 사용하여 3개의 국소 돌라브랄렉신 화합물을 분리하여 정제하였다(도3A). 실리카 크로마토그래피는 디테르펜 올레핀과 산소화된 유도체를 간단하게 분리할 수 있고, 실리카 매트릭스에 유지되는 주요 오염물질인 옥신돌이를 쉽게 제거하기 때문에 표적 화합물의 고순도를 달성하는 데 이상적입니다. 그림 3A).
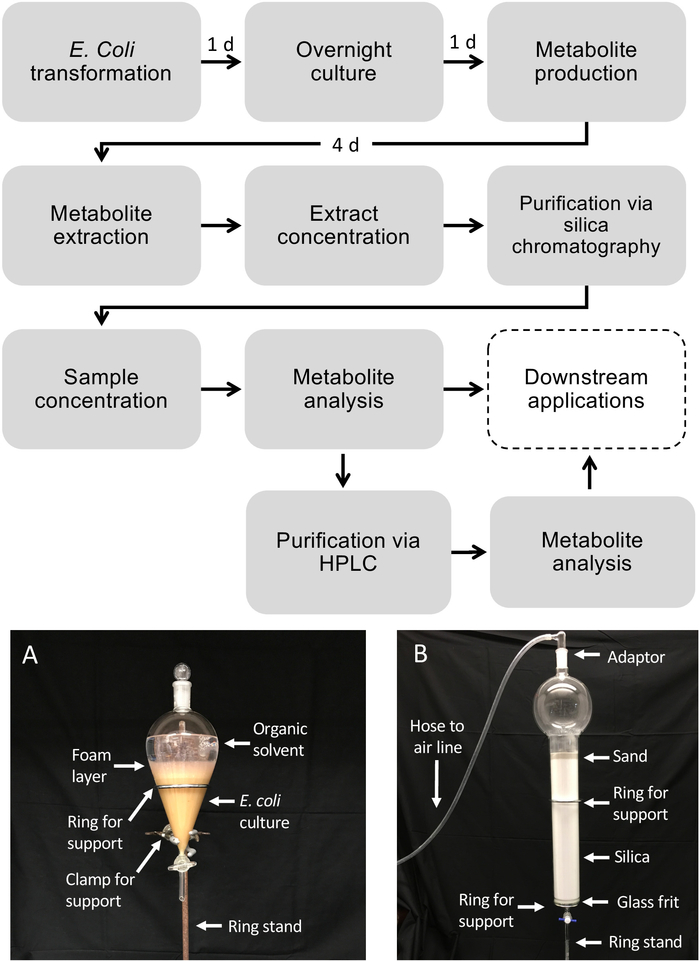
그림 1: 액체 세균 배양으로부터 대장균 및 대사산물 정제에서 디테르페노이드 생산을 위한 워크플로우. 파선 상자는 추가 정제가 필요한 선택적 단계를 묘사합니다. (A)분리깔때기를 이용하여 추출된 대장균 배양의 대표적인 이미지. (B)실리카 크로마토그래피를 이용한 대사산물 정제의 대표적인 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 이 연구에서 사용된 돌라브랄렉신 생합성 통로 및 유전자 구성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
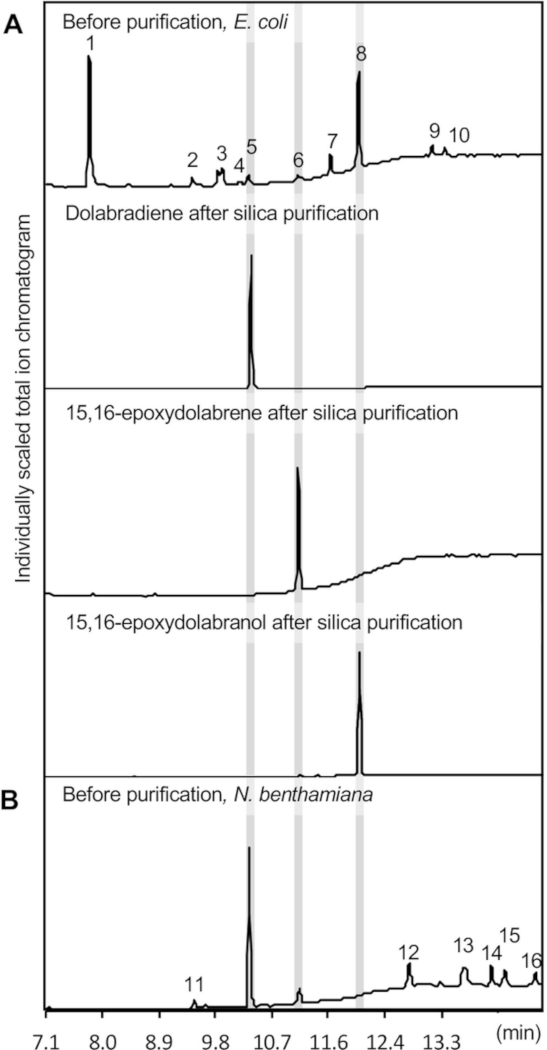
그림 3: GC-MS 결과. 대표적인 GC-MS 크로마토그램은(A) 대장균 및(B) 벤타미아나에서효소 공동 발현 법을 사용하여 얻어진 정제된 디테르페노이드 제품의 크로마토그램이다. 제품 식별은 국립 표준 기술 연구소(NIST) 질량 스펙트럼 라이브러리의 정품 표준 및 기준 질량 스펙트럼과 의 비교를 기반으로 합니다. 1, 옥신돌; 2, 인돌-5-알데히드; 3, 피롤로[1,2-a]피라진-1,4-디온, 헥사하이드로-3-(2-메틸프로필);; 4, 6-O-아세틸-1-[[4-브로모페닐]티오]-a-d-글루코사이드 S, S-이산화; 5, 돌라브라디엔; 6, 15,16-에폭시돌라브렌; 7, 피롤로[1,2-a]피라진-1,4-디온, 헥사하이드로-3-(페닐메틸);; 8, 15,16-에폭시돌라브라란골; 9 및 12, 알 수 없음; 10, 클로람페니콜; 11, 3,7,11,15-테트라메틸-2-헥사데켄-1-올; 13-16, 알칸. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: N. 벤타미아나에서 디테르페노이드 생산. (A) N. 벤타미아나에서 디테르페노이드 생산의 워크플로우 및 잎재료로부터의 대사산물정제. (B) N. 벤타미아나 식물의 대표적인 이미지는 침윤 실험을 위해 준비된, 가지치기 전에. (C)가지 치기 후 N. 벤타미아나 식물의 대표적인 이미지. (D)주사기에 침투 한 잎의 이미지. 어두운 지역이 침투했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
디테르페노이드 천연 제품의 광범위한 조사 및 적용은 원하는 화합물의 충분한 양을 합성하고 정화하기 위해 간단하고 저렴한 프로토콜을 필요로합니다. 광범위한 종에서 사용 가능한 디테르페노이드 대사 효소의 수가 급격히 증가함에 따라 미생물 및 식물 기반 숙주 시스템을 사용하여 디테르페노이드의 효소 생산을 위한 광범위한 재고를 제공합니다. 또한, 많은 디테르페노이드 경로의 모듈식 아키텍처는 '플러그 앤 플레이' 조합 엔지니어링 접근법에서 동일하거나 다른 종의 효소를 사용하여 자연적이고 새로운 자연과 같은 디테르페노이드 천연의 배열을 생성할 수 있게 합니다. 제품2,14,26,35.
대장균은 견고성, 확장성 용이성, 부산물 오염 감소를 위한 제한된 화학적 복잡성, DNA 조립 및 발현을 위한 사용 가능한 다양한 도구로 인해 천연물 생합성에 선호되는 미생물 숙주입니다. 최적화. 우리의 경험에서, 여기에 설명 된 플랫폼은 여기에 제안 된 것을 포함하여 많은 다운 스트림 응용 프로그램에 적합한 디테르펜 올레핀과 알코올의 수백 mg의 제품 수율을 생산하는 데 적합합니다. 산업 규모를 충족하지 는 않지만, 여기에 설명된 생산 플랫폼은 taxadiene 및 sclareol 33과 같은 관련 디테르페노이드에 대해 성공적으로 입증된 바와 같이 추가 경로, 호스트 및 발효 최적화를 위한 토대가 될 수 있습니다. ,34. 속도 제한 MVA 또는 MEP 통로 유전자의 과발현은 불충분한 전구체 공급 및 전구체 플럭스와 같은 디테르페노이드 생합성을 위한 수율 제한 인자를 경쟁 경로로 의한 수율 제한 인자를 극복하기 위해 성공적으로 확립되었다13, 32,33,39. 여러 연구에서 성공으로 입증되었지만, 테르페노이드 대사 진핵 P450s 및 대장균의 다른 막 결합 효소의 발현 및 촉매 활성이 좋지 않은 것은33,39의 제한 인자일 가능성이 높다. ,48,49,50,51,52. 코돈 에 최적화 된 서열 및 단백질 변형의 사용, 예를 들어 소포체 신호 펩티드의 제거 또는 석고 신호 펩티드의 도입과 같은, 수용성 P450 발현 을 증가하는 데 유용 입증14,38 ,49,50,53. 이러한 변형은 또한 본 연구에서 예로 사용되는 옥수수 CYP71Z1839의 미생물 공동 발현을 위해 사용되었다. 기재된 프로토콜은 구성당 하나 또는 두 개의 유전자를 운반하는 플라스미드의 사용에 기초하며, 모두 동일한 유도성 프로모터 하에 있다. 대규모 유전자 조합이 필요한 경우, 다중 플라스미드 및 항생제(13)의 사용으로 인한 변형 효율 및 배양 성장 감소를 완화하기 위해 다양한 다중 유전자 카세트 또는 유전자 스태킹 시스템을 사용하는 것이좋습니다. .
유전학 및 유전체학 자원의 광범위한 가용성으로 식물 숙주 시스템은 천연 물 제조에 점점 더 적합해지고 있습니다. 장점은 광합성에 의해 구동되는 필요한 천연 전구체를 생산하는 식물의 능력을 포함, 따라서 전구체 분자를 보충 할 필요없이 제품 형성을 가능하게54,55. N. 벤타미아니는 이미 생체 내 기능성 특성화 및 테르페노이드 및 기타 천연 제품 경로14,35,36,40의 조합발현에 널리 사용되고 있다. . N. benthamiana를 숙주 시스템으로 사용하는 주목할만한 장점은 디테르페노이드 전구체의 내인성 생산, 기본 유전자 서열의 사용, 진핵 P450s의 단순화 된 발현, 결합 유전자 변형의 용이성 ( 별도의 항생제는 일시적인 공동 변환을 위해 필요하지 않으며 잎 재료에서 대상 제품을 간단하게 추출할 수 있습니다. 필요한 경우, 디테르페노이드 생산은 전구체 공급을 증가시키기 위해 주요 MEP 경로 유전자의 공동 발현을 통해 향상될 수 있다36,41. N. benthamiana에서 확장 가능한 디테르페노이드 생산을 위한 제약은 충분한 식물 바이오매스를 생성해야 하기 때문에 액체 미생물 배양에 비해 더 복잡하며, 화학적으로 복잡한 제품 정제를 보다 많이 생산해야 합니다. 식물 조직, 및 내인성 효소에 의한 산화, 글리코실화 또는 탈인산 등을 통해 표적 제품의 바람직하지 않은 대사가 가능,36,43,44,45 ,46,47. 그러나, 이 절차는 아그로인여과(56)에 사용되는 식물의 수를 증가시킴으로써mg 제품 수량까지 확대될 수 있다.
여기에 설명된 제품 추출 및 정제 프로토콜은 대장균 및 N. 벤타미아나뿐만아니라 S. cerevisiae 및 기타 식물 또는 미생물 숙주 시스템과 호환되며, 비용 효율적인 접근 방식을 제공합니다. 생물학 및 화학 실험실모두에 설치되며 고가의 정화 장비가 필요하지 않습니다. 분리 깔때기를 이용한 대사산물 추출은 크로마토그래피 정제 전에 효율적인 추출 및 상 분리에 적합합니다. 깔때기 크기를 쉽게 조정하여 더 큰 배양량을 허용하고 대규모 배양물에서 추출하는 데 필요한 실험 시간을 줄일 수 있습니다. 우리는 헥산/에틸 아세테이트 그라데이션의 사용이 탄화수소 및 산소 화합물을 모두 포함하는 돌라브랄렉신 군을 위해 여기에서 입증된 바와 같이 상이한 극성의 디테르페노이드를 추출하는 데 이상적이라는 것을 발견하였다(그림3). 표적 제품의 특성에 따라, 다른 용매 혼합물이 유리할 수 있다. 그러나, 용매는 분리 깔때기 기술을 사용하여 성공적인 추출 및 상 분리를 보장하기 위해 물과 함께 오타해서는 안됩니다. 또한, 증발을 통한 제품 손실은 낮은 분자량 모노 및 세스키 테르페노이드 및 기타 VOC와 같은 휘발성 유기 화합물(VOC)을 생산하기 위해 이 접근법을 사용할 때 고려해야 합니다. 더 큰 규모 (~2 L) 실리카 컬럼을 사용하여 산소화의 다른 수준의 디테르페노이드의 크로마토그래피 분리는 향상된 제품 분리를 제공하고 반복적 정제의 필요성을 최소화하기 때문에 우리의 경험에 유리했습니다. 작은 열 볼륨을 사용할 때 단계를 수행합니다. 원하는 배양 량과 천연 물의 종류에 따라 열 부피와 행렬을 필요에 따라 조정할 수 있습니다. 이 프로토콜을 사용하여 달성될 수 있는 표적 제품의 순도는 생체 활성 분석과 같은 많은 다운스트림 응용 분야 또는 효소 활성 분석에 사용하기에 적합합니다. 그러나 NMR을 통한 구조 분석과 같이 더 높은 순도 수준이 필요한 경우(semi)-예비 HPLC를 사용하여 추가 정제를 통해 제품 순도를 효율적으로 향상시킬 수 있습니다.
여기서 설명된 이 프로토콜은 디테르페노이드 천연 제품의 생산에 최적화되어 있지만, 원하는 효소를 생성하여 관련 모노, 세스키 및 트라이 테르펜노이드뿐만 아니라 다른 천연 물류 등급에 쉽게 맞춤화 할 수 있습니다. 조합식14,57. 그러나, 제품 추출 및 정제절차의 수정은 모노-세스키-테르페노이드와 같이 휘발성이 높은 화합물, 또는 예시된 바와 같이 더 높은 극성 및 기능적 변형을 고려해야 한다. 많은 트리테르페노이드, 페닐프로판노이드 및 기타 천연 제품 등급의 당화.
천연물 제조를 위한 산업용 규모의 플랫폼을 사용할 수 있지만 여기에 설명된 프로토콜은 대부분의 실험실에서 쉽게 설정할 수 있는 저렴하고 사용자 정의 가능한 도구를 제공합니다. 옥수수 dolabralexins의 생산에 의해 입증 된 바와 같이 여기 및 다른 곳에서39,이 방법을 사용하여 달성 될 수있는 제품 수량과 순도는 일반적으로 다양한 다운 스트림 분석 및 사용을 용이하게하기에 충분하다, 포함,하지만, 제한, 다양 한 생물 활동 연구, 유기 체 간의 상호 작용의 분석, 효소 기질 또는 반 합성 접근을 위한 시작 재료로 사용 하기 위해.
공개
저자는 그들이 경쟁 적인 재정적 이익이 없다고 선언합니다.
감사의 말
우리는 PIRS 및 pGGxZmAN2 구성을 제공한 루벤 피터스 박사(미국 아이오와 주립 대학)에게 감사드립니다. NSF 식물-생물적 상호 작용 프로그램(보조금# 1758976 to P.Z.), DOE 조기 경력 연구 프로그램(보조금# DE-SC0019178 to P.Z.), DOE 공동 게놈 연구소 커뮤니티 과학 프로그램(보조금# CSP2568 to P.Z.), NSF에 의한 이 작업에 대한 재정적 지원 대학원 연구 펠로우십 프로그램(K.M.M.)과 UC 데이비스 딘의 멘토링 어워드 펠로우십(K.M.M.)은 감사하게도 인정받고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1020 Trays | Greenhouse Megastore | CN-FLHD | |
| 2-(N-morpholino)ethanesulfonic acid | Sigma | M8250-500g | MES |
| 4" Tech Square Pot | McConkey Wholesale Grower's Supply | JMCTS4 | |
| 5977 Extractor XL MS | Agilent | - | |
| 7890B GC | Agilent | - | |
| Acetonitrile | Sigma | 271004 | |
| Agar | Fisher | BP1423-2 | |
| Bacterial yeast extract | Fisher | BP9727-2 | |
| Beaker | CTechGlass | BK-2001-015B | |
| Cap, 9 mm blue screw, PFTE | Agilent | 5185-5820 | GC vial cap |
| Carbenicillin | Genesee | 25-532 | Carb |
| Chloramphenicol | Fisher | 50247423 | Chlor |
| Chromatography column | CTechGlass | CL-0015-022 | |
| Clear humidity dome | Greenhouse Megastore | CN-DOME | |
| ColiRollers Plating Beads | Sigma | 71013 | Glass beads |
| CoorsTek Porcelain Mortars | Fisher | 12-961A | mortar |
| CoorsTek Porcelain Pestles | Fisher | 12-961-5A | pestle |
| Delta-Aminolevulinic acid hydrochloride | Sigma | 50981039 | Aminoleuvolinic acid |
| Ethanol | Fisher | A962-4 | EtOH |
| Ethyl acetate | Fisher | E1454 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | Falcon tubes |
| Fisherbrand Disposable Cuvettes | Fisher | 14-955-127 | cuvette |
| Fisherbrand Petri Dishes with Clear Lid | Fisher | FB0875713 | petri dish |
| Fisherbrand Polypropylene Microtube Storage Racks | Fisher | 05-541 | microtube rack |
| Glucose | Sigma | G7021 | |
| Glycerol | Fisher | G33-500 | |
| Hexanes | Fisher | H292-4 (CS) | |
| HP-5MS | Agilent | 19091S-433 | GC column |
| Inlet adapter | CTechGlass | AD-0006-003 | glass inlet adapter |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher | BP1755-100 | IPTG |
| Kanamycin | Fisher | BP9065 | Kan |
| KIM-KAP Caps, Disposable, Polypropylene, Kimble Chase | VWR | 60825-798 | breathable test tube lids |
| Magnesium chloride | Acros | 223210010 | MgCl2 |
| Magnesium sulfate | Sigma | M7506-500g | MgSO4 |
| Miracle-Gro Water Soluble All Purpose Plant Food | Miracle-Gro | 2756810 | |
| Mixer Mill MM 200 | Retsch | 20.746.0001 | tissue mill |
| Nalgene Fernbach culture flask | Sigma | Z360236 | 2.8 L flask |
| New Brunswick I26 | Eppendorf | M1324-0000 | Shaking incubator |
| Nicotiana benthamiana seed | USDA Germplasm Repository | Accession TW16 | N. benthamiana |
| OverExpress C41(DE3) Chemically Competent Cells | Lucigen | 60442 | C41-DE3 cells |
| Parafilm M wrapping film | Fisher | S37440 | Parafilm |
| Potassium chloride | Sigma | P-9541 | KCl |
| Potassium phosphate dibasic anhydrous | Fisher | P288-3 | Dipotassium phosphate |
| Potassium phosphate monobasic | Monopotassium phosphate | ||
| Pyrex disposable culture tubes, rimless | Sigma | CLS9944516 | test tubes |
| Pyruvate Acid Sodium Salt | Fisher | 501368477 | Sodium pyruvate |
| Retort Ring Stands | CTechGlass | ST00 | ring stand |
| Riboflavin | Amresco | 0744-250g | |
| Rifampicin | Sigma | R7382 | Rif |
| Rotovap | |||
| Sand, 50-70 mesh particle size | Sigma | 274739-1KG | |
| Silica | Fisher | AC241660010 | silica gel |
| Sodium chloride | Fisher | 5271-3 | NaCl |
| Sodum hydroxide | Fisher | SS266-1 | NaOH |
| Spectinomycin | Fisher | 501368607 | Spec |
| Squibb Separatory Funnel | CTechGlass | FN-1060-006 | Separatory funnel |
| Sunshine Mix #1 | Sungro Horticulture | Potting soil | |
| Thermo Scientific Snap Cap Low Retention Microcentrifuge Tubes | Fisher | 21-402-902 | microtube |
| Triangle funnel | CTechGlass | FN-0035 | funnel |
| Tryptone | Fisher | BP14212 | |
| Vial, screw, 2 mL, amber, WrtOn | Agilent | 5182-0716 | GC vial |
| visible spectrophotometer, V-1200 | VWR | 634-6000P | spectrophotometer |
| ZORBAX Eclipse XDB-C18 | Agilent | 990967-202 | HPLC column |
| ZORBAX Eclipse XDB-CN | Agilent | 990967-905 | HPLC column |
참고문헌
- Peters, R. J. Two rings in them all: the labdane-related diterpenoids. Natural Product Reports. 27 (11), 1521-1530 (2010).
- Zerbe, P., Bohlmann, J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33 (7), 419-428 (2015).
- Toyomasu, T. Recent advances regarding diterpene cyclase genes in higher plants and fungi. Bioscience, Biotechnology, and Biochemistry. 72 (5), 1168-1175 (2008).
- Smanski, M. J., Peterson, R. M., Huang, S. X., Shen, B. Bacterial diterpene synthases: new opportunities for mechanistic enzymology and engineered biosynthesis. Current Opinion in Chemical Biology. 16 (1-2), 132-141 (2012).
- Salazar-Cerezo, S., Martinez-Montiel, N., Garcia-Sanchez, J., Perez, Y. T. R., Martinez-Contreras, R. D. Gibberellin biosynthesis and metabolism: A convergent route for plants, fungi and bacteria. Microbiological Research. 208, 85-98 (2018).
- Keeling, C. I., Bohlmann, J. Diterpene resin acids in conifers. Phytochemistry. 67 (22), 2415-2423 (2006).
- Schmelz, E. A., et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins. Plant Journal. 79 (4), 659-678 (2014).
- Bohlmann, J., Keeling, C. I. Terpenoid biomaterials. Plant Journal. 54 (4), 656-669 (2008).
- Mafu, S., Zerbe, P. Plant diterpenoid metabolism for manufacturing the biopharmaceuticals of tomorrow: prospects and challenges. Phytochemistry Reviews. 17 (1), 113-130 (2017).
- Hillwig, M. L., Mann, F. M., Peters, R. J. Diterpenoid biopolymers: new directions for renewable materials engineering. Biopolymers. 95 (2), 71-76 (2011).
- Jorgensen, L., et al. 14-step synthesis of (+)-ingenol from (+)-3-carene. Science. 341 (6148), 878-882 (2013).
- Line, N. J., Burns, A. C., Butler, S. C., Casbohm, J., Forsyth, C. J. Total Synthesis of (-)-Salvinorin A. Chemistry. 22 (50), 17983-17986 (2016).
- Morrone, D., et al. Increasing diterpene yield with a modular metabolic engineering system in E. coli: comparison of MEV and MEP isoprenoid precursor pathway engineering. Applied Microbioly and Biotechnology. 85 (6), 1893-1906 (2010).
- Kitaoka, N., Lu, X., Yang, B., Peters, R. J. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Molecular Plant. 8 (1), 6-16 (2015).
- George, K. W., et al. Metabolic engineering for the high-yield production of isoprenoid-based C(5) alcohols in E. coli. Scientific Reports. 5, 11128(2015).
- Paddon, C. J., Keasling, J. D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology. 12 (5), 355-367 (2014).
- Keasling, J. D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering. 14 (3), 189-195 (2012).
- Kampranis, S. C., Makris, A. M. Developing a yeast cell factory for the production of terpenoids. Computational and Structural Biotechnology Journal. 3 (4), e201210006(2012).
- Tholl, D. Biosynthesis and biological functions of terpenoids in plants. Advances in Biochemical Engineering/Biotechnology. 148, 63-106 (2015).
- McGarvey, D. J., Croteau, R. Terpenoid metabolism. The Plant Cell. 7 (7), 1015-1026 (1995).
- Chen, F., Tholl, D., Bohlmann, J., Pichersky, E. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. The Plant Journal. 66 (1), 212-229 (2011).
- Pateraki, I., Heskes, A. M., Hamberger, B. Cytochromes P450 for terpene functionalisation and metabolic engineering. Advances in Biochemical Engineering/Biotechnology. 148, 107-139 (2015).
- Cao, R., et al. Diterpene cyclases and the nature of the isoprene fold. Proteins. 78 (11), 2417-2432 (2010).
- Reiling, K. K., et al. Mono and diterpene production in Escherichia coli. Biotechnology and Bioengineering. 87 (2), 200-212 (2004).
- Hamberger, B., Plant Bak, S. P450s as versatile drivers for evolution of species-specific chemical diversity. Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1612), 20120426(2013).
- Jia, M., Potter, K. C., Peters, R. J. Extreme promiscuity of a bacterial and a plant diterpene synthase enables combinatorial biosynthesis. Metabolic Engineering. 37, 24-34 (2016).
- Paddon, C. J., et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 496 (7446), 528-532 (2013).
- Peralta-Yahya, P. P., Zhang, F., del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Pateraki, I., et al. Total biosynthesis of the cyclic AMP booster forskolin from Coleus forskohlii. Elife. 6, e23001(2017).
- Ignea, C., et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform. Proceedings of the National Academy of Sciences of the United States of America. 113 (13), 3681-3686 (2016).
- Ignea, C., et al. Reconstructing the chemical diversity of labdane-type diterpene biosynthesis in yeast. Metabolic Engineering. 28, 91-103 (2015).
- Cyr, A., Wilderman, P. R., Determan, M., Peters, R. J. A modular approach for facile biosynthesis of labdane-related diterpenes. Journal of the American Chemical Society. 129 (21), 6684-6685 (2007).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Schalk, M., et al. Toward a biosynthetic route to sclareol and amber odorants. Journal of the American Chemical Society. 134 (46), 18900-18903 (2012).
- Andersen-Ranberg, J., et al. Expanding the Landscape of Diterpene Structural Diversity through Stereochemically Controlled Combinatorial Biosynthesis. Angewandte Chemie International Edition in English. 55 (6), 2142-2146 (2016).
- Bruckner, K., Tissier, A. High-level diterpene production by transient expression in Nicotiana benthamiana. Plant Methods. 9 (1), 46(2013).
- Emanuelsson, O., Brunak, S., von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols. 2 (4), 953-971 (2007).
- Hausjell, J., Halbwirth, H., Spadiut, O. Recombinant production of eukaryotic cytochrome P450s in microbial cell factories. Bioscience Reports. 38 (2), BSR20171290(2018).
- Mafu, S., et al. Discovery, biosynthesis and stress-related accumulation of dolabradiene-derived defenses in maize. Plant Physiology. 176 (4), 2677-2690 (2018).
- Zerbe, P., et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiology. 162 (2), 1073-1091 (2013).
- Bach, S. S., et al. High-throughput testing of terpenoid biosynthesis candidate genes using transient expression in Nicotiana benthamiana. Methods in Molecular Biology. , 245-255 (2014).
- Sainsbury, F., Thuenemann, E. C., Lomonossoff, G. P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants. Plant Biotechnology Journal. 7 (7), 682-693 (2009).
- Wang, B., et al. Transient production of artemisinin in Nicotiana benthamiana is boosted by a specific lipid transfer protein from A. annua. Metabolic Engineering. 38, 159-169 (2016).
- Reed, J., Osbourn, A. Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37 (10), 1431-1441 (2018).
- Dong, L., Jongedijk, E., Bouwmeester, H., Der Krol, A. V. an Monoterpene biosynthesis potential of plant subcellular compartments. New Phytologist. 209 (2), 679-690 (2016).
- Liu, Q., et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One. 6 (8), e23255(2011).
- Karunanithi, P. S., et al. Functional characterization of the cytochrome P450 monooxygenase CYP71AU87 indicates a role in marrubiin biosynthesis in the medicinal plant Marrubium vulgare. BMC Plant Biology. 19 (1), 114(2019).
- Pelot, K., et al. Functional diversity of diterpene synthases in the biofuel crop switchgrass. Plant Physiology. 178 (1), 54-71 (2018).
- Wang, Q., Hillwig, M. L., Wu, Y., Peters, R. J. CYP701A8: a rice ent-kaurene oxidase paralog diverted to more specialized diterpenoid metabolism. Plant Physiology. 158 (3), 1418-1425 (2012).
- Wang, Q., Hillwig, M. L., Peters, R. J. CYP99A3: functional identification of a diterpene oxidase from the momilactone biosynthetic gene cluster in rice. The Plant Journal. 65 (1), 87-95 (2011).
- Morrone, D., Chen, X., Coates, R. M., Peters, R. J. Characterization of the kaurene oxidase CYP701A3, a multifunctional cytochrome P450 from gibberellin biosynthesis. Biochemical Journal. 431 (3), 337-344 (2010).
- Swaminathan, S., Morrone, D., Wang, Q., Fulton, D. B., Peters, R. J. CYP76M7 is an ent-cassadiene C11alpha-hydroxylase defining a second multifunctional diterpenoid biosynthetic gene cluster in rice. The Plant Cell. 21 (10), 3315-3325 (2009).
- Gnanasekaran, T., et al. Heterologous expression of the isopimaric acid pathway in Nicotiana benthamiana and the effect of N-terminal modifications of the involved cytochrome P450 enzyme. Journal of Biological Engineering. 9 (1), 24(2015).
- De Luca, V., Salim, V., Atsumi, S. M., Yu, F. Mining the biodiversity of plants: a revolution in the making. Science. 336 (6089), 1658-1661 (2012).
- Wurtzel, E. T., Kutchan, T. M. Plant metabolism, the diverse chemistry set of the future. Science. 353 (6305), 1232-1236 (2016).
- Menon, A., et al. Mobile-based insulin dose adjustment for type 2 diabetes in community and rural populations: study protocol for a pilot randomized controlled trial. Therapeutic Advances in Endocrinology and Metabolism. 10, 2042018819836647(2019).
- Moses, T., et al. OSC2 and CYP716A14v2 catalyze the biosynthesis of triterpenoids for the cuticle of aerial organs of Artemisia annua. The Plant Cell. 27 (1), 286-301 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유