Method Article
Une approche personnalisable pour la production et la purification enzymatiques des produits naturels Diterpenoid
Dans cet article
Résumé
Ici, nous présentons des protocoles faciles à utiliser pour produire et purifier les métabolites diterpénoïdes grâce à l'expression combinatoire des enzymes biosynthétiques dans Escherichia coli ou Nicotiana benthamiana, suivie par le produit chromatographique purification. Les métabolites qui en résultent conviennent à diverses études, y compris la caractérisation de la structure moléculaire, les études fonctionnelles enzymatiques et les essais de bioactivité.
Résumé
Les diterpénoïdes forment une classe variée de produits naturels à petites molécules qui sont largement distribués à travers les royaumes de la vie et ont des fonctions biologiques critiques dans les processus de développement, les interactions interorganismales et l'adaptation environnementale. En raison de ces diverses bioactivités, de nombreux diterpénoïdes sont également d'importance économique comme les produits pharmaceutiques, les additifs alimentaires, les biocarburants et d'autres bioproduits. La génomique avancée et les approches biochimiques ont permis une augmentation rapide de la connaissance des gènes, des enzymes et des voies diterpéoïdes-métaboliques. Cependant, la complexité structurelle des diterpénoïdes et la répartition taxonomique étroite des composés individuels chez souvent une seule espèce demeurent des facteurs contraignants pour leur production efficace. La disponibilité d'un plus large éventail d'enzymes métaboliques fournit maintenant des ressources pour produire des diterpénoïdes dans des titres et une pureté suffisantes pour faciliter une étude plus approfondie de cet important groupe de métabolites. S'appuyant sur des outils établis pour la coexpression des enzymes microbiennes et végétales, nous présentons un protocole facile à actionnaliser et personnalisable pour la production enzymatique de diterpénoïdes dans Escherichia coli ou Nicotiana benthamiana, et la purification des produits désirés par chromatographie de silice et HPLC semi-préparatif. En utilisant le groupe de maïs (Zea mays) diterpénoïdes de dolabralexine comme exemple, nous soulignons comment des combinaisons modulaires d'enzymes de synthase diterpene (diTPS) et de cytochrome P450 monooxyase (P450) peuvent être utilisées pour générer différents échafaudages diterpénoïdes. Les composés purifiés peuvent être utilisés dans diverses applications en aval, telles que des analyses structurelles métabolites, des études de structure-fonction enzymatique, et des expériences de bioactivité in vitro et dans des expériences de bioactivité planta.
Introduction
Les diterpénoïdes constituent un groupe chimiquement diversifié de plus de 12 000 produits naturels polycycliques à 20 carbonequis sont essentiels dans de nombreux organismes1. Les champignons et les plantes produisent la plus grande diversité de diterpénoïdes, mais il a également été démontré que les bactéries forment des diterpénoïdes bioactifs (voir les avis2,3,4,5). Enracinés dans leur grande diversité structurelle, les diterpénoïdes remplissent une multitude de fonctions biologiques. Quelques diterpénoïdes, tels que les hormones de croissance gibberellin, ont des fonctions essentielles dans les processus de développement5. Cependant, la majorité des diterpénoïdes servent de médiateurs de la défense chimique et des interactions interorganismales. Parmi ceux-ci, les acides de résine de diterpene dans la défense de parasites et d'agents pathogènes des arbres de conifères et des mélanges spécifiques d'espèces des diterpénoïdes antimicrobiens dans les principales cultures vivrières telles que le maïs (Zea mays) et le riz (Oryza sativa) ont été le plus largement étudié6,7. Ces bioactivities fournissent un riche dépôt chimique pour des applications commerciales, et certains diterpénoïdes sont utilisés comme produits pharmaceutiques importants, additifs alimentaires, adhésifs, et d'autres bioproduits de la vie quotidienne moderne8,9 ,10. Pour faire avancer la recherche sur la diversité naturelle et les fonctions biologiques des diterpénoïdes et, en fin de compte, promouvoir des applications commerciales plus larges, des outils pour la préparation rentable de composés purs sont nécessaires. L'isolement à grande échelle des matières végétales a été établi pour quelques bioproduits diterpénoïdes, tels que les acides de résine de diterpene qui sont produits comme sous-produit de l'industrie des pâtes et papiers8. Cependant, l'accumulation de diterpénoïdes dans seulement des tissus spécifiques et sous une réglementation stricte par des stimuli environnementaux limite souvent l'isolement des quantités suffisantes de produits du producteur naturel2. En outre, la complexité structurelle des diterpénoïdes entrave leur production par la synthèse chimique, bien que de telles approches aient été couronnées de succès dans plusieurs cas11,12. Avec la disponibilité des technologies génomiques et biochimiques avancées, les plates-formes de production enzymatiques ont gagné l'attention croissante pour produire une gamme de composés diterpénoïdes (voir les revues13,14, 15,16,17,18).
Tous les ténuodes, y compris les diterpénoïdes, sont dérivés de deux précurseurs isopréoïdes isomeriques, d'isopentenyl diphosphate (IPP) et de diméthylallyl diphosphate (DMAPP)19 qui, à leur tour, sont formés par le mévalonate (MVA) ou le méthylerythritol-5-phosphate (MEP) voie. La biosynthèse terpénoïde se poursuit à travers la voie mep dans les bactéries et la voie MVA chez les champignons, tandis que les plantes possèdent un MVA cytosolique et une voie plastique MEP, avec ce dernier étant la voie principale vers la formation diterpénoïde20. La condensation de l'IPP et du DMAPP par prenyl transferases donne le précurseur central de 20 carbone à tous les diterpénoïdes, le diphosphate geranylgeranyl (GGPP)20. En aval de la formation GGPP, deux familles d'enzymes, les synthases terpènes (TPS) et les monooxygénases cytochromes P450 (P450) contrôlent en grande partie la formation de la vaste diversité chimique du métabolisme terpénoïde21,22. Les synthases de Diterpene (diTPsS) catalysent la cyclisation et le réarrangement commis de la carbocation-conduite de GGPP pour former divers bi-, poly-, ou macro-cycliques d'échafaudage de diterpene de carbocation commis pour former divers échafaudages de diterpène stéréospécifiques de bi-, poly-, ou macro-cycliques1,3,23, 24. L'oxygénation et la décoration fonctionnelle de ces échafaudages sont ensuite facilitées par les enzymes P450 et sélectionnez d'autres familles d'enzymes22,25. Les TPS et les P450 existent généralement en tant que familles multigènes spécifiques aux espèces qui peuvent former des réseaux biosynthétiques modulaires, où la combinaison de différents modules d'enzymes le long d'un plan commun permet la formation d'un large éventail de composés2, 26. La découverte rapide d'enzymes fonctionnellement distinctes opérant dans des voies terpénoïdes modulaires au cours des dernières années a fourni des possibilités d'expansion pour leur utilisation comme une liste de pièces polyvalentes pour l'ingénierie métabolique des voies partielles ou complètes dans plates-formes de production microbiennes et végétales. Par exemple, la levure (Saccharomyces cerevisiae) a été appliquée avec succès à l'ingénierie des voies multi-enzymes pour la fabrication de bioproduits terpénoïdes, tels que le médicament antipaludique artémisinine27, les biocarburants sesquiterpenoid bisabolene et farnesene28, mais aussi sélectionner les diterpénoïdes29,30,31. De même, des plates-formes Escherichia coli conçues pour la fabrication à l'échelle industrielle ont été créées pour quelques métabolites diterpénoïdes, y compris le taxol précurseur taxadène taxadène utilisé comme médicament anticancéreux et l'alcool diterpene, sclareol , utilisé dans l'industrie des parfums13,32,33,34. Les progrès dans les technologies de génie génétique et de transformation ont également rendu les systèmes d'hôtes végétaux de plus en plus viables pour la production de produits naturels végétaux9,14,35,36. En particulier, le proche parent du tabac, Nicotiana benthamiana, est devenu un châssis largement utilisé pour l'analyse des voies terpénoïdes et l'ingénierie, en raison de la facilité de la transformation Agrobacterium-négociéde multiples combinaisons de gènes , biosynthèse efficace des précurseurs endogènes, et biomasse élevée14,35,36.
En nous appuyant sur ces plates-formes établies pour la biosynthèse terpénoïde, nous décrivons ici des méthodes faciles à utiliser et rentables pour la production enzymatique de diterpénoïdes et la purification de composés uniques. Les protocoles présentés illustrent comment les plates-formes E. coli et N. benthamiana conçues pour la biosynthèse améliorée des précurseurs diterpénoïdes peuvent être utilisées pour l'expression combinatoire de différentes enzymes diTPS et P450 pour générer composés diterpénoïdes désirés. L'application de ce protocole pour produire et purifier les diterpénoïdes structurellement différents est montrée par exemple de diterpénoïdes spécialisés à partir de maïs (Zea mays), appelés dolabralexins, biosynthèse endogène dont recrute deux diTPS et un P450 Enzyme. La purification de différentes dolabralexines allant des olefins aux dérivés oxygénés est alors réalisée en combinant l'extraction d'entonnoir séparatif avec la chromatographie à grande échelle de colonne de silice et la chromatographie liquide à haute pression préparative (HPLC). Les protocoles décrits sont optimisés pour la production de diterpénoïdes, mais peuvent également être facilement adaptés pour les classes terpénoïdes connexes, ainsi que d'autres produits naturels pour lesquels des ressources enzymatiques sont disponibles. Les composés produits à l'aide de cette approche conviennent à diverses applications en aval, y compris, sans s'y limiter, la caractérisation structurelle par l'analyse de résonance magnétique nucléaire (RMN), l'utilisation comme substrats pour les études fonctionnelles enzymatiques, et une gamme de tests de bioactivité.
Protocole
CAUTION: Les protocoles décrits ici comprennent l'utilisation de produits chimiques dangereux, objets pointus, appareils électriques, objets chauds, et d'autres dangers qui peuvent entraîner des blessures. L'équipement de protection individuelle approprié doit être porté et les procédures de sécurité appropriées, y compris les formations en matière de sécurité, doivent être suivies.
1. Préparation des matériaux et des solutions
- Préparer et autoclave lysogeny bouillon moyen (LB) pendant 30 min: Par 1 L de milieu, mélanger 10 g de tryptone, 5 g d'extrait de levure bactérienne, et 10 g de NaCl et dissoudre dans 1 L d'eau déionisée (DI).
- Pour 1 L cultures de co-expression, préparer et autoclave Terrific Broth (TB) milieu pendant 30 min: Dans un mélange de flacon erlenmeyer 2,8 L 12 g de tryptone, 24 g d'extrait de levure bactérienne, et 40 mL de 10% (v/v) glycérol et dissoudre dans 860 mL d'eau DI. Préparer et autoclave 1,3 L de tampon de phosphate 10x [1,3 L d'eau DI, 30,03 g de phosphate monopotassium (KH2PO4), et 163,02 g de phosphate de dipotassium (K2HPO4)] et ajouter au milieu ci-dessus.
- Préparer le bouillon Super Optimal avec les médias de répression Catabolite (SOC).
- Préparer et autoclaver pendant 30 min une solution contenant 2% (w/v) tryptone, 0.5% (w/v) extrait de levure bactérienne, 8.5 mM NaCl, et 2.5 mM KCl.
- Ajouter le MgSO4 stérile et le glucose avec une concentration finale de 20 mM. Utilisez 1 M NaOH pour s'ajuster au pH 7.0. Stockez les supports SOC à -20 oC.
- Préparer 1 L de 1 M de pyruvate de sodium. Autoclave pendant 15 min et conserver à 4 oC.
- Préparer 20 mL d'isopropyl de 1 M-D-1-thiogalactopyranoside (IPTG) dans de l'eau d'Inde stérile. Conserver les aliquots de 1 x 2 ml à -20 oC.
- Préparer un tampon d'infiltration : 10 mM MES (1,952 g) et 10 mM MgCl2 (2,033 g) dissous dans 1 L d'eau DI. Conserver à 4 oC.
- Préparer et autoclave LB agar pendant 30 min: Par 100 ml d'eau DI, ajouter 1 g de tryptone, 0,5 g d'extrait de levure bactérienne, 1 g de NaCl, et 1,5 g d'agar. Une fois que l'agar LB est assez frais pour manipuler la bouteille, ajouter des antibiotiques au besoin pour les combinaisons de plasmides désirées. Verser les assiettes d'agar à l'aide de boîtes de Pétri et conserver à 4 oC.
- Voir tableau 1 pour les spécifications concernant la production de composés dans E. coli et N. benthamiana, respectivement. Enveloppez les plaques contenant de la rifampicine dans du papier d'aluminium pour éviter la dégradation lors de l'entreposage.
| Concentration de travail (g/mL) | |||||
| antibiotique | Stock (mg/mL) | solvable | 1 plasmide | 2 plasmides | 3 ou 4 plasmides |
| Carbenicillin (Carbenicillin) | 50 | H2O | 50 | 25 | 20 |
| Chloramphénicol | 30 | EtOH (en) | 30 | 20 | 20 |
| Kanamycine | 50 | H2O | 50 | 25 | 20 |
| Spectinomycine | 30 | H2O | 30 | 25 | 20 |
| Gentamycine | 50 | H2O | 30 | ||
| Rifampicin | 10 | MeOH (En) | 10 | ||
Tableau 1 : Concentrations d'antibiotiques pour la coexpression plasmide chez E. coli ou N. benthamiana.
2. Production de métabolites diterpénoïdes chez E. coli
REMARQUE : Le protocole décrit ici pour produire des métabolites de diterpénoïde dans E. coli a été adapté à partir d'une plate-forme de coexpression enzymatique précédemment rapportée développée par le groupe du Dr Reuben J. Peters (Iowa State University, IA, USA)13 ,32.
- Transformation de cellules compétentes avec des combinaisons de plasmides.
- Décongeler les cellules E. coli chimiquement compétentes sur la glace (les cellules BL21DE3-C41 ont été utilisées dans ce protocole).
- Ajouter 1 l d'une solution de 100 ng/L de chaque construction utilisée pour la coexpression à 25 l de cellules compétentes dans un microtube de 1,5 mL. Ne pas vortex ou mélanger par pipetting.
REMARQUE : Pour une expression et une activité optimales des enzymes TPS et P450, plusieurs modifications de séquence doivent être envisagées. Pour TPS, l'enlèvement du peptide de transit plastidial N-terminal est souvent essentiel. Plus précisément, le mono- et di-TPS plastidial exigent typiquement l'enlèvement du peptide de transit prévu (utilisant des algorithmes communs de prédiction37),alors que les sesqui-TPS cytosoliques peuvent habituellement être employés comme gènes de pleine longueur. En ce qui concerne Les P450, l'optimisation du codon ainsi que le retrait ou le remplacement par la séquence leader MAKKTSSKGK du domaine transmembrane N-terminal s'est avéré efficace dans de nombreux cas38,39. En outre, lors de la co-expression des enzymes P450 une réductase cytochrome P450 (CPR) devrait être inclus pour assurer une activité suffisante P450. - Incuber le mélange sur la glace pendant 30 min. Mélanger toutes les 10 minutes en grattant doucement le tube sur une grille à microtube.
- Pré-incubez les plaques de support SOC et d'agar LB à 37 oC contenant des antibiotiques au besoin pour la combinaison désirée de constructions.
REMARQUE : Chaque construction à co-transformer doit avoir une résistance antibiotique distincte, ainsi que des origines distinctes de la réplication pour assurer l'expression optimale des protéines. - La chaleur choque le mélange cellulaire à 42 oC pendant 1 minute, puis incube sur la glace pendant au moins 2 minutes.
- Ajouter 200 l de supports SOC chauds.
- Agiter le mélange cellulaire pendant 1 h à 37 oC et 200 tr/min.
- Ajouter environ 10 perles de verre autoclaved à la plaque d'agar LB réchauffée. Ajouter 100 l du mélange cellulaire et remplacer le couvercle. Agiter la plaque horizontalement avec le couvercle pour répartir les cellules uniformément. Retirez les perles de verre en les tapant dans un contenant à déchets. Vous pouvez également utiliser d'autres méthodes de placage préférées.
- Incuber la plaque d'agar LB à 37 oC pendant la nuit avec la surface enduite face vers le bas. La plaque avec des colonies d'E. coli transformées peut être utilisée le lendemain ou stockée à 4 oC scellée dans un film de paraffine pendant une vingtaine de semaines.
- Préparation des cultures d'inoculation
- Le lendemain, préparez une solution de milieu LB avec des antibiotiques nécessaires à la combinaison de plasmides transformés en utilisant les concentrations fournies dans le tableau 1.
- Dans une hotte stérile, transférer 5 ml de LB moyen à un tube à essai en verre stérile de 15 ml avec un bouchon respirant en plastique. Préparer un petit tube de culture pour chaque grande culture désirée (1 L).
- Sélectionnez des colonies d'E. coli individuelles dans la plaque d'agar LB à l'aide d'une pointe de pipette. Inoculer chaque tube de LB avec une colonie d'E. coli en éjectant une pointe de pipette contenant une colonie sélectionnée dans chaque tube.
- Cap chaque tube à essai de culture d'inoculation avec un bouchon en plastique respirant. Placez les petites cultures E. coli plafonnées dans un incubateur de 37 oC qui secoue pendant 12 à 24 h.
- Préparation et induction des cultures de coexpression
- Le lendemain, ajouter 100 ml de tampon de phosphate 10x préparé à 900 ml de tuberculose préparée pour une concentration tampon finale de phosphate de 1x. Ajouter les antibiotiques nécessaires avec des concentrations selon le tableau 1.
- Agiter à 140 tr/min à 37 oC jusqu'à ce qu'il soit chaud (environ 30 min).
- Inoculer chaque flacon de médias pour 1 l cultures avec 5 ml de la culture d'inoculation. Conserver la pointe de pipette utilisée pour l'inoculation de la culture d'inoculation dans le tube de culture d'inoculation de sorte que, lors de l'extraction avec le solvant organique dans les étapes suivantes, il n'y a aucun contaminant séducté en plastique.
- Incuber avec secouer à 200 tr/min jusqu'à ce que la densité optique à 600 nm (OD600) atteigne 0,6, environ 3 h. Pour mesurer l'OD600 à l'arme blanche, utilisez un mélange de tuberculose stérile avec tampon de phosphate.
- À l'OD600souhaité, définir les paramètres de l'incubateur à 16 oC.
- Lors de la co-expression P450s, fraîchement préparer riboflavine et acide aminolevulinic, qui sont essentiels pour une production suffisante de co-facteur P450. Pour chaque expérience, faire 4 g/L de riboflavine et 150 g/L d'acide aminolevulinique. Conserver la solution enveloppée dans du papier d'aluminium jusqu'à l'utilisation, car le riboflavine est sensible à la lumière.
- Une fois que l'incubateur a atteint 16 oC (environ 30 min), ajouter 1 ml de 1 M IPTG, 1 ml de 4 g/L de riboflavine et 1 ml d'acide aminolevulinique de 150 g/L à chaque culture. Pour la production de diterpénoïdes, 25 ml de pyruvate de 1 M de sodium doivent être ajoutés à chaque culture afin d'assurer une formation suffisante de précurseurs.
REMARQUE : Toutes les constructions utilisées dans cet état d'œil étaient sous le même promoteur inductible de l'IPTG. Différents promoteurs peuvent être utilisés comme vous le souhaitez. - Incuber à 16 oC et 140 tr/min pendant 72 h. Ajouter 25 ml de pyruvate de sodium chaque jour suivant l'induction si vous produisez des diterpénoïdes. Les cultures d'utilisation immédiate sont immédiatement utilisées pour l'extraction par entonnoir séparatif des métabolites; ne récoltent pas ou n'entreposent pas les cultures.
3. Séparation et purification des métabolites
- Extraction d'entonnoir séparatif de métabolites
REMARQUE : Il est important d'utiliser uniquement de la verrerie et des pipettes en verre lorsqu'il s'agit d'utiliser des solvants organiques pour prévenir les contaminations par le plastifiant.- Dans une hotte de fumée, fixer l'entonnoir séparateur sur un support d'anneau. Placer un bécher sous l'entonnoir séparatiste.
- Verser 500 ml de 50/50 (v/v) d'acétate d'éthyle/hexanes dans l'entonnoir séparatif.
REMARQUE : Le mélange de solvants doit être ajusté en fonction de la solubilité et de la polarité des métabolites ciblés. Les solvants à mauvais taux d'eau doivent être évités afin d'assurer une séparation de phase appropriée. - Ajouter 500 ml de la culture E. coli à l'entonnoir séparatif et placer sur le bouchon de verre.
- Secouez l'entonnoir pour mélanger la culture avec le solvant d'extraction, environ 5-10x. Souvent dégazer l'entonnoir en ouvrant le robinet pendant que l'entonnoir est maintenu à l'envers et pointé dans le capot de fumée pour libérer la pression. Répétez la procédure de secousse et de dégazage 2x.
- Placez l'entonnoir à la verticale dans le support de l'anneau et attendez que la couche de solvant (en haut) se soit séparée de la couche aqueuse (culture) (en bas), environ 1 min.
REMARQUE : Lorsqu'une grande quantité de bulles est observée dans l'interphase, l'ajout d'un petit volume de 5 à 10 ml d'EtOH peut être ajouté pour améliorer la séparation des phases. - Retirez le bouchon. Égoutter la couche d'E. coli dans un bécher, en conservant la couche de solvant dans l'entonnoir.
- Répétez la procédure en utilisant les 500 ml restants de la culture E. coli et le même solvant de 500 ml utilisé pour la première extraction.
- Égoutter le solvant contenant les métabolites extraits dans un flacon propre. Évitez la contamination par la culture E. coli.
- Concentration d'évaporation du Rotary
- Préparer l'équipement d'évaporation rotative (rotovap) : remplissez le bain d'eau et fixez la température à 25 oC. Pour les composés sensibles à la chaleur, utilisez un réglage de température plus basse ou ajoutez de la glace au bain d'eau. Remplissez la chambre de condensage de glace sèche et fixez la vitesse de rotation à 60 à 80 tr/min.
- Ajouter environ 700 ml de métabolites extraits dans un flacon évaporateur de 1 L, attacher au rotovap, et descendre dans le bain d'eau. Allumez le chauffe-eau et fixez-le à 25 oC.
- Démarrer la rotation du flacon d'évaporation, allumer le système de vide, et augmenter graduellement l'aspiration pour éviter l'ébullition rapide de la solution de métabolite dans le flacon de déchets. Le solvant évaporé devrait commencer à se condenser et à s'égoutter dans le flacon de collecte (déchets).
- Lorsque seulement quelques mL de la solution de métabolite reste dans le flacon d'évaporation, arrêter les rotations et éteindre le système de vide. Soulevez le flacon évaporant et dépressurisez en fermant la ligne de vide. Conserver la solution concentrée de métabolite restant dans le flacon évaporant. Disposer des déchets dans le flacon de déchets.
- Poursuivre l'évaporation rotative en ajoutant jusqu'à 700 ml de solution de métabolite extraite supplémentaire au flacon évaporateur. Répétez le processus jusqu'à ce que toute la solution de métabolite extraite ait été concentrée.
- Retirez les métabolites concentrés du flacon d'évaporation en transférant avec une pipette en verre à un nouveau tube à essai. Rincer le flacon d'évaporation avec 5 ml de 50/50 (v/v) d'acétate d'éthylité/hexanes ou le mélange de solvant désiré deux fois, en transférant la solution de rinçant etomis sur le tube à essai.
- Conserver les métabolites concentrés à -20 oC ou à -80 oC (selon la stabilité du produit) jusqu'à une utilisation plus poussée.
- Purification de colonne de silice
- Préparer la verrerie en rinçant un bécher de 1 L, un entonnoir en verre, des tubes à essai de 50 ml et une colonne de chromatographie de 3,2 L (équipé d'une frette de verre) une fois avec de l'hexane et une fois avec de l'acétate éthylique. Étiqueter les tubes à essai de 50 ml, qui seront utilisés pour recueillir des fractions.
- Ajouter 2 L de gel de silice (230 à 400 mailles, grade 60) à une colonne de chromatographie de 3,2 L avec une capacité de réservoir de 2 L et un disque fritté, puis charger le sable pour former une couche de 5 cm en haut de la colonne.
- Préparer la colonne pour la chromatographie en la rinçant à fond avec 2 L d'hexane. En tout temps, il devrait y avoir une mince couche (0,5 cm) du liquide solvant au-dessus de la couche de sable de la colonne pour s'assurer que la colonne ne se dessèche pas ou n'acquiert pas de poches d'air. Un adaptateur d'entrée de verre relié à un tuyau d'air peut être utilisé pour augmenter doucement le débit à travers la colonne plutôt que la gravité seule.
- Chargez l'extrait concentré de métabolite (voir la section 3.2) sur la colonne. Rincer la bouteille contenant l'échantillon 3x avec de l'hexane et ajouter à la colonne pour s'assurer que tout l'échantillon a été transféré.
- En utilisant le gradient suivant, charger 100 ml à la fois et recueillir 50 ml de fractions dans des tubes à essai étiquetés : 100 % hexanes 3x, 10 % (v/v) éthylique en hexanes 3x, 12,5 % (v/v) acétate d'éthyle en hexanes 3x, 15 % (v/v) éthylàé en hexanes3x , 20 % (v/v) de l'acétate d'éthyle en hexanes 3x, 40 % (v/v) de l'acétate éthylique en hexanes 3x, 60 % (v/v) de l'acétate éthylique en hexanes 3x et 100 % de l'acétate éthylé 4x.
REMARQUE : Le gradient doit être ajusté en fonction de la taille et des polarités composées et de la séparation souhaitée. - À l'aide d'une pipette en verre, transférer 1 mL de chaque fraction dans un flacon GC étiqueté. Analyser chaque échantillon via GC-MS pour déterminer quelles fractions contiennent les métabolites désirés et leur niveau de pureté.
REMARQUE : La méthode GC-MS adaptée aux métabolites produits dans cette méthode a été décrite dans Mafu et al. 201839. En bref, toutes les analyses ont été effectuées sur un GC avec un détecteur XL MS à l'aide d'une colonne HP-5MS (voir Tableau des matériaux),un volume d'échantillon de 1 L, et la rampe de température du four de 50 à 300 oC à 20 'C min-1. - Après avoir déterminé quelles fractions contiennent le composé(s) d'intérêt, combiner toutes les fractions qui contiennent le même composé. Disposer correctement des fractions qui ne contiennent pas de composés dans un contenant de déchets. Répétez la procédure d'évaporation rotative si nécessaire pour concentrer les métabolites purifiés.
- Si une purification supplémentaire est nécessaire, utilisez (semi-)hPLC pour améliorer la pureté du produit. Les protocoles HPLC doivent être adaptés en fonction des spécifications individuelles de l'équipement et des composés d'intérêt.
- Resuspendre les échantillons de chromatographie de silice séchée dans 1 ml d'hexane (hydrocarbures diterpé) ou d'acétonitrile (diterpénoïdes oxygénés), et filtrer à travers une seringue filtrante pour prévenir la contamination par de petites particules.
- Pour les diterpénoïdes non polaires, utilisez une colonne du CN (voir Tableau des matériaux)avec un débit recommandé de 1 ml/min et un gradient d'acétate d'hexane : éthyle, avec des fractions recueillies toutes les 1 minute.
- Pour les diterpénoïdes polaires, utilisez une colonne C18 (voir Tableau des matériaux) avec un débit recommandé de 3 ml/min et un gradient d'acétonitrile :eau, avec des fractions recueillies toutes les 1 minute.
- Séchez toutes les fractions purifiées HPLC sous un flux d'azote et suspendez-les en hexane de 1 ml avant l'analyse GC-MS pour évaluer l'abondance et la pureté des produits.
4. Production de métabolites diterpénoïdes à l'aide de N. benthamiana
REMARQUE: Le protocole décrit ici pour la production de métabolites diterpénoïdes dans N. benthamiana a été adapté à partir d'études précédemment rapportées35,36,40,41. Le protocole ci-dessous est spécifique à l'infiltration de seringues des feuilles de N. benthamiana. D'autres méthodes d'infiltration, telles que l'infiltration sous vide sont tout aussi appropriées. Les systèmes vectoriels binaires t-ADN, tels que pCAMBIA13003Su (pLIFE33) ou pEAQ-HT40,41,42, qui permettent la propagation chez E. coli et A. tumefaciens et l'expression des gènes chez les hôtes végétaux sont approprié à ce protocole.
- Plantation Nicotiana benthamiana
- Remplir une casserole de 750 ml de terre en pot et arroser le pot. Ajouter 20 graines de tabac et taper doucement avec le doigt afin qu'ils soient dans le sol. Ne pas couvrir de terre.
REMARQUE : Les graines peuvent être générées par autopollinisation pour la propagation des graines. Les semences de cette expérience ont été obtenues auprès du Département de biologie végétale de l'UC Davis et sont accessibles au public par l'intermédiaire du dépôt de germplasm (https://npgsweb.ars-grin.gov/gringlobal/accessiondetail.aspx?id=1450450) de l'USDA. - Laisser le pot dans une chambre de croissance avec les conditions suivantes, arroser tous les deux jours pour s'assurer que le sol ne se dessèche pas. Cultivez des plantes à 26 oC et 60 % d'humidité avec 16:8 h jour:cycle de nuit pour toutes les étapes de ce protocole.
- Après 1 semaine, remplir les pots de 20 pots avec du sol en pot et arroser les pots. À l'aide de forceps, saisissez un plant de tabac par la tige et retirez doucement du pot source, placez un plant dans chaque nouveau pot et enburez soigneusement les racines. N'endommagez pas les feuilles ou les racines.
- Arrosez les plantes tous les deux jours en plaçant de l'eau dans le bac dans lequel se trouvent les pots (également appelé « arrosage de fond »). Un arrosage sur quatre, inclure l'engrais générique dans l'eau selon les instructions de l'emballage.
- Remplir une casserole de 750 ml de terre en pot et arroser le pot. Ajouter 20 graines de tabac et taper doucement avec le doigt afin qu'ils soient dans le sol. Ne pas couvrir de terre.
- Transformation de gel-dégel de la souche GV3101 de la souche GV3101 d'Agrobacterium tumefaciens
- Dégel Agrobacterium tumefaciens souche GV3101 (ou autre souche préférée) cellules compétentes sur la glace (1 h). Pré-réfrigération 0,2 mL tubes microcentrifuge sur glace. Médias SOC chauds à 28 oC.
- Mélanger délicatement les cellules avec la pointe de la tuyauterie (ne PAS pipet vers le haut et vers le bas) et aliquot 15 L de cellules pour chaque transformation dans les microtubes réfrigérés de 1,5 mL.
- Ajouter 1-5 l d'ADN à chaque tube de cellules compétentes et mélanger délicatement en grattant le tube le long d'une grille à tubes.
REMARQUE : Les constructions désirées n'ont pas besoin d'avoir des résistances antibiotiques différentes parce qu'elles sont chacune transformées séparément et seront mélangées avant l'infiltration. - Placer les microtubes dans l'azote liquide pendant 5 min.
- Retirer les microtubes de l'azote liquide et placer les tubes sur la grille de température ambiante. Décongeler les tubes pendant 5 min dans un incubateur de 37 oC.
- Ajouter 250 l'Un du SOC pré-chauffé (28 oC) à chaque microtube. Secouer à 28-30 oC, 225 tr/min, pendant 3 h.
- Plaque 50 l de cellules transformées sur des plaques d'agar LB contenant les antibiotiques nécessaires décrits dans le tableau 1 à l'aide de perles de verre stériles, tel que décrit à l'étape 2.1.8.
- Incuber les plaques inversées à 28 à 30 oC pendant 48 h. La croissance au cours du1er jour d'incubation peut être un signe de contamination. Les tumifaciens transformés peuvent être utilisés après l'incubation de 2 jours ou stockés à 4 oC scellés dans un film de paraffine pendant une période pouvant aller jusqu'à 2 semaines.
- Agrobacterium- co-expression d'enzymes transitoires médiatisées à Nicotiana benthamiana
- Élaguer les plants de Nicotiana benthamiana, 4 semaines, 2 jours avant l'infiltration en enlevant les feuilles inférieures. Laisser 4 feuilles supérieures. Arroser les plantes. Ne pas arroser les plantes 24 h avant l'infiltration afin de permettre des stomates ouvertes et une infiltration plus facile.
- Ajouter 10 ml de LB avec des concentrations de travail des antibiotiques appropriés pour les constructions choisies et la souche Agrobacterium (décrite dans le tableau 1) à un tube à essai en verre stérile de 50 ml avec couvercle de papier d'aluminium.
- Inoculer à l'aide d'une pointe de pipette pour écouvillonser une seule colonie d'Agrobacterium transformé et éjecter la pointe dans le support LB. Chaque Agrobacterium transformant doit avoir au moins 2 petites cultures.
- Incuber toute la nuit à 28 oC et 220 tr/min.
- Mesurer la densité optique à 600 nm (OD600) des cultures de nuit à l'aide d'un spectrophotomètre. Diluer les cultures du jour au lendemain à un OD600 de 1.
REMARQUE : Les valeurs optimales d'OD600 peuvent varier lors de l'utilisation d'autres souches d'Agrobacterium. - Distribuer 10 ml de culture diluée de nuit dans des tubes coniques de 50 ml.
- Récoltez la bactérie par centrifugation à 3500 tr/min pendant 15 min à température ambiante. Verser et jeter le supernatant.
- Resuspendre les cultures dans un tampon d'infiltration de 10 ml en secouant doucement le tube et en roulant sur un support à tube. L'OD600 devrait être égal à 1 pour chaque construction.
- Générez les combinaisons souhaitées pour les infiltrations en combinant des volumes égaux de chaque lignée cellulaire transformée. L'OD600 doit être égal à 1 pour chaque infiltration. Estimer 5 ml de solution d'infiltration par feuille, 2 feuilles par plante.
- Fixer les tubes horizontalement sur un rocher et le rock doucement pendant 2 h à température ambiante.
- Infiltrer 2 feuilles par plante N. benthamiana en utilisant environ 5 ml de mélange d'infiltration par feuille. Infiltrer les feuilles saines avec une seringue sans aiguille sur le dessous des feuilles tout en exerçant une contre-pression avec un doigt sur le côté supérieur de la feuille pour s'assurer que la solution d'infiltration étouffe le tissu foliaire.
- Marquez toutes les feuilles infiltrées avec un marqueur noir ou un autre indicateur. Placer les plantes infiltrées dans la chambre de croissance pendant 5 jours. Gardez les plantes bien arrosées.
REMARQUE : Un temps d'incubation de cinq jours s'est avéré suffisant pour atteindre des niveaux de diterpénoïdes suffisants pour la plupart des analyses en aval, tout en maintenant l'efficacité temporelle de la formation du produit. Des périodes d'incubation plus longues peuvent être testées, lorsque des quantités de produits plus élevées sont requises.
- Extraction et purification de métabolites de Nicotiana benthamiana transformée
- Récolte des feuilles infiltrées des plantes en les coupant de la plante. Ajouter 100 ml d'azote liquide et une seule feuille à un mortier, puis moudre à l'aide d'un mortier et d'un pilon ou d'un moulin à tissu jusqu'à obtenir une poudre fine.
- Ajouter du tissu en poudre à une fiole GC-MS à la démarcation de 500 L. Ajouter 1,5 ml de 50/50 (v/v) d'acétate/hexane d'éthylène ou de mélange de solvant désiré au flacon et au bouchon.
- Pour les expressions qui ont été testées pour fournir les produits désirés, mettre en commun le tissu moulu dans un flacon ou un tube à essai plus grand, puis ajouter 2 fois la quantité de solvant que le volume de tissu et secouer pendant la nuit. Passez à l'étape 4.4.5 pour la purification.
- Placer tous les flacons dans une grille de microtube et ruban adhésif vers le bas pour fixer. Extraire sous une secousse vigoureuse pendant la nuit à température ambiante.
- Transférer 400 l d'extrait et 600 l d'hexane dans une fiole GC-MS fraîche. N'aliquot aucun tissu foliaire. Analyser les échantillons à l'aide de GC-MS à l'aide de la méthode décrite à l'étape 3.3.6.1.
- Après analyse par GC-MS pour la présence des métabolites désirés, extraits de feuille de piscine ensemble et procèdent par l'évaporation rotative, la chromatographie de colonne de silice, et HPLC pour obtenir des composés purs comme décrit dans les sections 3.2 et 3.3.
Résultats
Flux de travail schématique pour la production de diterpénoïdes à l'aide d'E. coli
La figure 1 illustre le flux de travail décrit pour la production de diterpénoïdes. Le protocole décrit ici a été adapté à partir d'une plate-forme E. coli précédemment décrite pour la biosynthèse diterpénoïde13,32 pour l'utilisation de cultures à plus grand volume et la purification des produits diterpénoïdes désirés via la silice Chromatographie. Pour démontrer l'utilisation de ce protocole, nous avons utilisé une voie de dolabralexine récemment identifiée à partir du maïs qui comprend deux diTPS, ZmAN2 (Zm00001d029648) et ZmKSL4 (Zm00001d032858), un P450 multifonctionnel (CYP71Z18, Zm00001d014134), et un cytochrome P450 réductase (ZmCPR2, Zm00001d026483) (Figure 2). En bref, les cellules compétentes E. coli BL21DE3-C41 ont été pré-transformées avec le pCDFDuet:IRS et pACYC-Duet:GGPPS/ZmAN2 plasmides13,32. Le pCDFDuet:IRS plasmide contient des enzymes clés pour la production de précurseurs diterpénoïdes, y compris 1-deoxy-D -xylulose-5-phosphate synthase (dxs), 1-deoxy-D-xylulose-5-phosphate réductase (dxr), et isopentenyl diphosphate isomerase (idi), et a été montré pour augmenter la formation de diterpénoïdes dans E. coli13. Le plasmide pACYC-Duet:GGPPS/ZmAN2 contient le maïs ent-copalyl diphosphate synthase ZmAN2 et une synthase GGPP d'Abies grandis. Les enzymes catalysant les réactions engagées dans la biosynthèse de dolabralexin ont alors été co-transformées en plasmides pET28b:ZmKSL4 et pETDUET:ZmCPR2/ZmCYP71Z18. Pour plus de détails sur les séquences et les constructions plasmides voir Mafu et al. 201839.
Un chromatogramme GC-MS des produits enzymatiques extraits est montré dans la figure 3A, illustrant la formation de trois composés de dolabralexine, à savoir le dolabradiene (1,2 à 0,25 mg/L), l'époxydolabrene (0,65 à 0,2 mg/L) et l'époxydolabranol (11,4 - 1,1 mg/L culture) comme quantifié sur la base d'une courbe standard à l'aide du sclareol diterpénoïde. Sclareol a été utilisé comme norme de référence, en raison de sa structure similaire et les propriétés chimiques par rapport aux dolabralexins. Les sous-produits mineurs généralement observés comprennent le chloramphenicol, les dérivés de l'indole oxindole et indole-5-aldéhyde, et le précurseur du diphosphate geranylgeranyl (GGPP) (figure 3). Indole représente généralement le sous-produit principal, mais n'est pas montré ici, en raison de son temps de rétention plus court que le retard solvant fixé de 7 min pour préserver l'intégrité de l'instrument GC-MS.
Flux de travail schématique de production de diterpénoïdes à l'aide de N. benthamiana
La figure 4 représente un aperçu de l'expression de la voie dolabralexine dans N. benthamiana. Pour les produits décrits ici, les constructions suivantes ont été transformées séparément en A. tumefaciens souche GV3101: pLife33:p19 (exprimant la protéine suppresseur de silençage du gène p19), pLife33:ZmCYP71Z18, pLife33:ZmAN2, pLife33:ZmKSL4. Des séquences indigènes pleine longueur des gènes de la voie de la dolabralexine du maïs ont été utilisées dans le vecteur binaire de l'ADN T pLife3341 avec résistance à la kanamycine pour la propagation chez E. coli et A. tumefaciens. La co-expression des gènes de voie terpénoïde en amont est facultative, puisque le diphosphate geranylgeranyl précurseur est endogènement formé dans N. benthamiana. Cependant, plusieurs études ont utilisé avec succès de telles approches pour augmenter la formation de diterpénoïdes dans N. benthamiana14,36,41. Comme illustré dans la figure 3, la co-expression a produit avec succès le dolabradiene et 15,16-éoxydolabrene. À la différence de la co-expression d'enzyme dans E. coli,15,16-éoxydolabranol n'a pas été détecté dans des extraits de métabolite.
La présence de 15,16-éoxydolabrene dans les extraits de feuilles a démontré l'activité de CYP71Z18 dans N. benthamiana. Comme 15,16-éoxydolabranol s'est avéré stable après extraction des cultures microbiennes (figure 3) ainsi qu'après isolement des tissus racinaires de maïs dans les études précédentes39, il semble plausible que le produit hydroxylé soit glycosylated par glycosyltransferases endogènes et ensuite séquestré dans le vacuole, le rendant inaccessible à l'extraction avec les mélanges de solvants organiques utilisés ici pour l'extraction36,43,44,45 ,46. Des modifications similaires de produits indésirables dans le contexte de l'ingénierie des voies dans N. benthamiana ont été signalées dans des études antérieures47. Comme le montre la coexpression dans E. coli, l'expression transitoire dans N. benthamiana entraîne l'extraction de plusieurs sous-produits, y compris des alcanes linéaires de longueur de chaîne différente selon la comparaison avec les bases de données de spectre de masse de référence. Les titres composés extraits de la matière foliaire se sont avérés en moyenne 2,4 euros/- 0,5 mg de dolabradiene et 0,9 mg de 15,16-éoxydolabrene par g de tissu foliaire sec. Ces titers ne peuvent pas être comparés directement au système de coexpression E. coli étant donné les différentes configurations expérimentales.
Purification diterpénoïde
La purification de Diterpenoid a été réalisée utilisant la chromatographie de colonne de silice et HPLC semi-préparative suivante. Des extraits de métabolites de 12 L de cultures E. coli mises en commun ont été purifiés à l'aide de la chromatographie de colonne de silice pour séparer les trois composés focaux de dolabralexine (figure 3A). La chromatographie de silice est idéale pour atteindre la pureté élevée des composés cibles, car elle permet la séparation simple des olefins de diterpene et des dérivés oxygénés, et enlève facilement le contaminant principal, l'oxindole, qui est maintenu sur la matrice de silice ( Figure 3A).
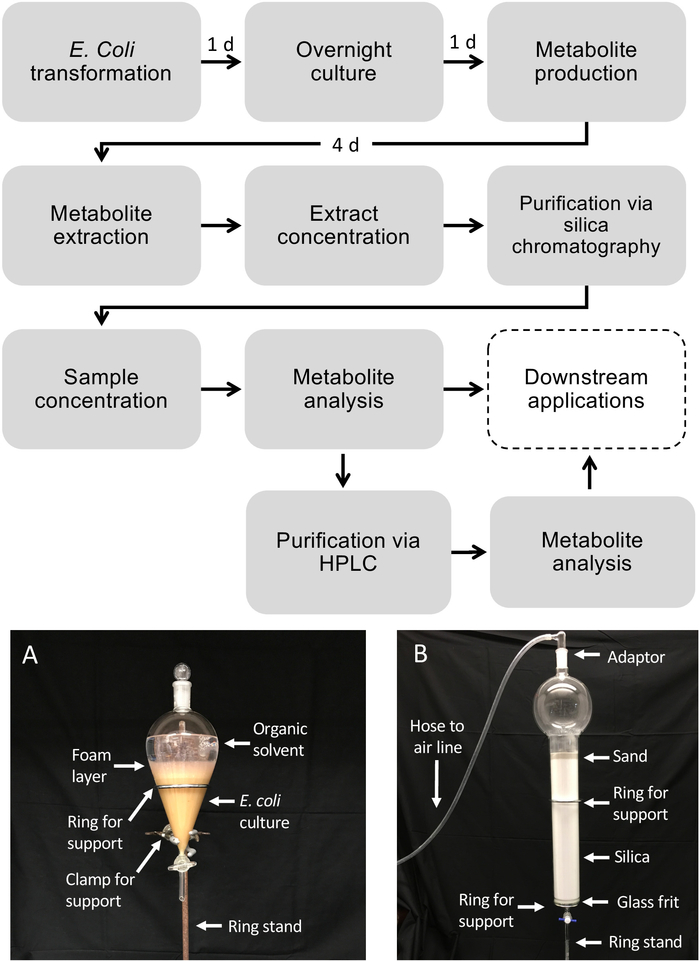
Figure 1 : Flux de travail pour la production de diterpénoïdes chez E. coli et la purification des métabolites à partir de cultures bactériennes liquides. Les boîtes en pointillés représentent des étapes facultatives où une purification supplémentaire est nécessaire. (A) Image représentative de la culture E. coli extraite à l'aide d'un entonnoir séparatif. (B) Image représentative de la purification d'extrait de métabolite utilisant la chromatographie de silice. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Voie biosynthétique de Dolabralexin et constructions de gènes utilisées dans cette étude. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
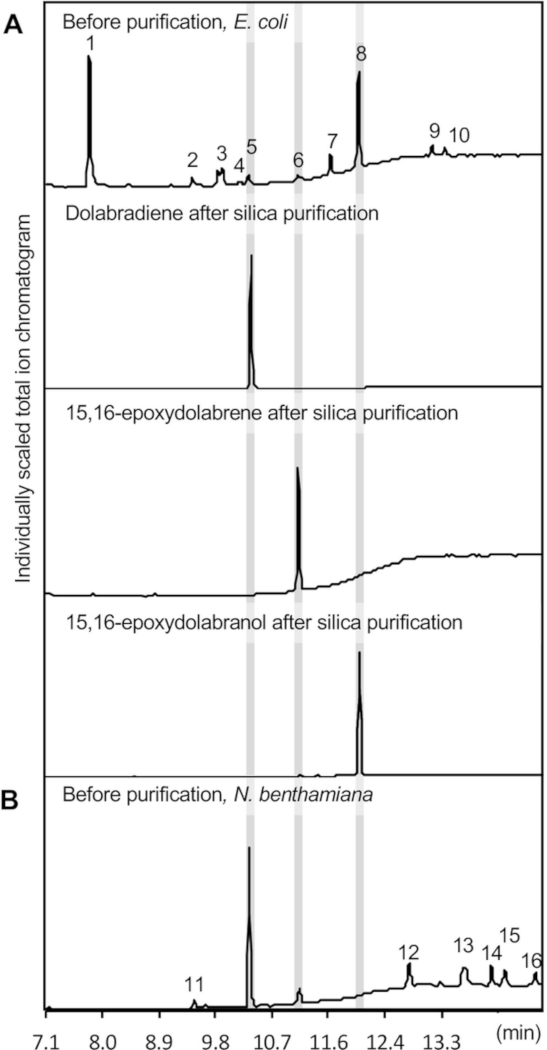
Figure 3 : Résultats du GC-MS. Sont montrés des chromatogrammes REPRÉSENTATIFs de GC-MS de produits purifiés diterpénoïdes obtenus à l'aide d'analyses de coexpression enzymatiques dans (A) E. coli et (B) N. benthamiana. Les identifications de produits sont basées sur des comparaisons avec des normes authentiques et des spectres de masse de référence de la bibliothèque spectrale de masse du National Institute of Standards and Technology (NIST). 1, oxindole; 2, indole-5-aldéhyde; 3, Pyrrolo[1,2-a]pyrazine-1,4-dione, hexahydro-3-(2-méthylpropyl)-; 4, 6-O-Acetyl-1-[[4-bromophenyl]thio]-a-d-glucoside S,S-dioxide; 5, dolabradiene; 6, 15,16-éoxydolabrene; 7, Pyrrolo[1,2-a]pyrazine-1,4-dione, hexahydro-3-(phenylmethyl)-; 8, 15,16-éoxydolabranol; 9 et 12, inconnus; 10, chloramphenicol; 11, 3,7,11,15-tetramethyl-2-hexadecen-1-ol; 13-16, alkanes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Production de diterpénoïdes à N. benthamiana. (A) Flux de travail de production de diterpénoïdes à N. benthamiana et de purification des métabolites à partir de matériel folique. (B) Image représentative des plantes De. benthamiana prêtes pour des expériences d'infiltration, avant l'élagage. (C) Images représentatives des plantes de N. benthamiana après l'élagage. (D) Image de feuilles infiltrées par seringue. Des zones plus sombres ont été infiltrées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Une étude et une application plus larges des produits naturels diterpénoïdes nécessitent des protocoles simples et peu coûteux pour synthétiser et purifier des quantités suffisantes de composés désirés. L'augmentation rapide du nombre d'enzymes diterpénoïdes-métaboliques disponibles à partir d'un large éventail d'espèces fournit maintenant un inventaire expansif pour la production enzymatique de diterpénoïdes à l'aide de systèmes d'hôtes microbiens et à base de plantes. En outre, l'architecture modulaire de nombreuses voies diterpénoïdes permet l'utilisation d'enzymes de la même espèce ou différentes dans les approches d'ingénierie combinatoire 'plug and play' pour générer un éventail de naturels et de nouveaux diterpenoid naturels produits2,14,26,35.
E. coli est un hôte microbien privilégié pour la biosynthèse des produits naturels en raison de sa robustesse, de sa facilité d'évolutivité, de sa complexité chimique limitée pour la contamination par les sous-produits réduits et de la richesse des outils disponibles pour l'assemblage et l'expression de l'ADN. Optimisation. D'après notre expérience, la plate-forme décrite ici est bien adaptée pour produire des rendements de produits allant jusqu'à plusieurs centaines de mg d'olefines et d'alcools diterpènes, ce qui convient à de nombreuses applications en aval, y compris celles proposées ici. Bien que ne répondant pas à l'échelle industrielle, la plate-forme de production décrite ici peut servir de base pour l'optimisation de la voie, de l'hôte et de la fermentation, comme cela a été démontré avec succès pour les diterpénoïdes connexes tels que le taxadène et le sclareol33 ,34. La surexpression des gènes de voie MVA ou MEP limitant le taux a été établie avec succès pour surmonter les facteurs limitant le rendement de la biosynthèse diterpénoïde, tels que l'approvisionnement insuffisant en précurseurs et le flux de précurseurs dans des voies concurrentes13, 32,33,39. Bien que prouvé succès dans plusieurs études, une mauvaise expression et l'activité catalytique de l'eucaryotique eucaryotique terpénoïde-métabolique P450s et d'autres enzymes membranaires dans E. coli est un facteur limitant probable33,39 ,48,49,50,51,52. L'utilisation de séquences optimisées en codon et de modifications protéiques, telles que l'élimination du peptide du signal réticulum endoplasmique ou l'introduction d'un peptide de signal plastidial, se sont avérées utiles pour augmenter l'expression soluble P45014,38 ,49,50,53. De telles modifications ont également été utilisées pour la coexpression microbienne du maïs CYP71Z1839 utilisé comme voie d'exemple dans cette étude. Les protocoles décrits sont basés sur l'utilisation de plasmides porteurs d'un ou deux gènes par construction, tous sous le même promoteur inductible. Lorsque des combinaisons de gènes à plus grande échelle sont souhaitées, il est conseillé d'utiliser diverses cassettes multigènes ou systèmes d'empilement de gènes disponibles pour atténuer l'efficacité réduite de la transformation et la croissance de la culture en raison de l'utilisation de plasmides multiples et d'antibiotiques13 .
Avec la plus grande disponibilité des ressources génétiques et génomiques, les systèmes d'hôtes végétaux deviennent également de plus en plus adaptés à la fabrication de produits naturels. Les avantages incluent la capacité des plantes à produire les précurseurs naturels requis alimentés par la photosynthèse, permettant ainsi la formation de produits sans avoir besoin de compléter les molécules précurseurs54,55. N. benthamiana est déjà largement utilisé pour la caractérisation fonctionnelle in vivo et l'expression combinatoire des voies terpénoïdes et autres produits naturels14,35,36,40 . Les avantages notables de l'utilisation de N. benthamiana comme système hôte comprennent la production endogène de précurseurs diterpénoïdes, l'utilisation de séquences génétiques indigènes, l'expression simplifiée des P450 eucaryotes, la facilité de la transformation des gènes combinatoires (comme antibiotiques distincts ne sont pas nécessaires pour la co-transformation transitoire), et l'extraction simple des produits cibles à partir de matière folique. Au besoin, la production de diterpénoïdes peut être améliorée par la co-expression des gènes clés de la voie des PEOAux pour augmenter l'offre de précurseurs36,41. Les contraintes pour la production évolutive de diterpénoïdes à N. benthamiana sont plus complexes par rapport aux cultures microbiennes liquides en raison de la nécessité de produire suffisamment de biomasse végétale, de purification de produits à forte intensité de main-d'œuvre à partir de produits chimiquement complexes. tissu végétal, et possible métabolisation indésirable des produits cibles par, par exemple, l'oxydation, la glycosylation ou la déphosphorylation par des enzymes endogènes36,43,44,45 ,46,47. Cependant, cette procédure peut être étendue jusqu'à mg quantités de produits en augmentant le nombre de plantes utilisées pour l'agroinfiltration56.
Les protocoles d'extraction et de purification des produits décrits ici sont compatibles avec E. coli et N. benthamiana, ainsi que S. cerevisiae et d'autres systèmes d'hôtes végétaux ou microbiens, et offrent une approche rentable et facile à dans les laboratoires de biologie et de chimie et ne nécessite pas d'équipement de purification coûteux. L'extraction de métabolite à l'aide d'un entonnoir séparatiste est bien adaptée pour une extraction efficace et une séparation de phase avant la purification chromatographique. Les tailles d'entonnoir peuvent être facilement ajustées pour permettre de plus grands volumes de culture et de réduire le temps expérimental nécessaire pour extraire de grandes cultures. Nous avons trouvé l'utilisation d'un gradient d'acétate d'hexane/éthyle idéal pour extraire des diterpénoïdes de polarité différente comme démontré ici pour le groupe de dolabralexins qui comprennent à la fois les hydrocarbures et les composés oxygénés (figure 3). Selon les propriétés des produits cibles, d'autres mélanges de solvants peuvent être avantageux. Cependant, les solvants ne doivent pas être miscibles avec de l'eau pour assurer une extraction réussie et la séparation de phase en utilisant la technique d'entonnoir séparateur. En outre, la perte de produit par évaporation doit être prise en compte lors de l'utilisation de cette approche pour la production de composés organiques volatils (COV), tels que les mono- et sesqui-terpénoïdes de poids moléculaire inférieur et d'autres COV. La séparation chromatographique des diterpénoïdes de différents niveaux d'oxygénation à l'aide d'une colonne de silice à plus grande échelle (no 2 L) a été avantageuse dans notre expérience, car elle offre une meilleure séparation des produits et minimise le besoin de purification itérative étapes lors de l'utilisation de plus petits volumes de colonnes. Les volumes de colonnes et les matrices peuvent être ajustés au besoin pour le volume de culture désiré et le type de produit naturel. La pureté des produits cibles qui peuvent être atteints à l'aide de ce protocole convient à de nombreuses applications en aval, telles que les essais de bioactivité ou pour une utilisation dans les analyses d'activité enzymatiques. Cependant, lorsque des niveaux de pureté plus élevés sont nécessaires, tels que des analyses structurelles via la RMN, la pureté du produit peut être efficacement améliorée par une purification supplémentaire à l'aide (semi)-préparative HPLC.
Ce protocole décrit ici a été optimisé pour la production de produits naturels diterpénoïdes, mais peut également être facilement personnalisé aux mono-, sesqui- et tri-terpénoïdes connexes, aussi bien que d'autres classes de produits naturels simplement en générant l'enzyme désirée modules pour l'expression combinatoire14,57. Cependant, des modifications des procédures d'extraction et de purification des produits doivent être prises en considération pour les composés à plus forte volatilité, tels que les mono- et sesqui-terpénoïdes, ou une plus grande polarité et modification fonctionnelle comme l'illustre glycosylation de beaucoup de triterpénoïdes, phénylpropanoids, et d'autres classes naturelles de produit.
Bien que des plates-formes à l'échelle industrielle pour la fabrication de produits naturels soient disponibles, les protocoles décrits ici offrent un outil peu coûteux et personnalisable qui peut être facilement mis en place dans la plupart des laboratoires. Comme l'a démontré la production de dolabralexins de maïs ici et ailleurs39, les quantités de produits et la pureté qui peuvent être réalisées en utilisant cette approche sont généralement suffisantes pour faciliter diverses analyses et utilisations en aval, y compris, mais pas diverses études sur la bioactivité, l'analyse des interactions entre organismes, ainsi que l'utilisation comme substrat enzymatique ou comme matériau de départ pour les approches de semi-synthèse.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont pas d'intérêts financiers concurrents.
Remerciements
Nous remercions le Dr Reuben Peters (Iowa State University, Usa) d'avoir fourni les constructions pIRS et pGGxZmAN2. Soutien financier pour ce travail par le NSF Plant-Biotic Interactions Program (subvention 1758976 à P.Z.), le Programme de recherche sur les carrières précoces du DOE (subvention DE-SC0019178 à P.Z.), le Programme conjoint de sciences communautaires de l'Institut du génome du DOE (subvention CSP2568 à P.Z.), le FNS Le Programme de bourses de recherche des diplômés (à K.M.M.) et la bourse de mentorat du doyen de l'UC Davis (à K.M.M.) sont reconnaissants.
matériels
| Name | Company | Catalog Number | Comments |
| 1020 Trays | Greenhouse Megastore | CN-FLHD | |
| 2-(N-morpholino)ethanesulfonic acid | Sigma | M8250-500g | MES |
| 4" Tech Square Pot | McConkey Wholesale Grower's Supply | JMCTS4 | |
| 5977 Extractor XL MS | Agilent | - | |
| 7890B GC | Agilent | - | |
| Acetonitrile | Sigma | 271004 | |
| Agar | Fisher | BP1423-2 | |
| Bacterial yeast extract | Fisher | BP9727-2 | |
| Beaker | CTechGlass | BK-2001-015B | |
| Cap, 9 mm blue screw, PFTE | Agilent | 5185-5820 | GC vial cap |
| Carbenicillin | Genesee | 25-532 | Carb |
| Chloramphenicol | Fisher | 50247423 | Chlor |
| Chromatography column | CTechGlass | CL-0015-022 | |
| Clear humidity dome | Greenhouse Megastore | CN-DOME | |
| ColiRollers Plating Beads | Sigma | 71013 | Glass beads |
| CoorsTek Porcelain Mortars | Fisher | 12-961A | mortar |
| CoorsTek Porcelain Pestles | Fisher | 12-961-5A | pestle |
| Delta-Aminolevulinic acid hydrochloride | Sigma | 50981039 | Aminoleuvolinic acid |
| Ethanol | Fisher | A962-4 | EtOH |
| Ethyl acetate | Fisher | E1454 | |
| Falcon 50 mL Conical Centrifuge Tubes | Fisher | 14-432-22 | Falcon tubes |
| Fisherbrand Disposable Cuvettes | Fisher | 14-955-127 | cuvette |
| Fisherbrand Petri Dishes with Clear Lid | Fisher | FB0875713 | petri dish |
| Fisherbrand Polypropylene Microtube Storage Racks | Fisher | 05-541 | microtube rack |
| Glucose | Sigma | G7021 | |
| Glycerol | Fisher | G33-500 | |
| Hexanes | Fisher | H292-4 (CS) | |
| HP-5MS | Agilent | 19091S-433 | GC column |
| Inlet adapter | CTechGlass | AD-0006-003 | glass inlet adapter |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher | BP1755-100 | IPTG |
| Kanamycin | Fisher | BP9065 | Kan |
| KIM-KAP Caps, Disposable, Polypropylene, Kimble Chase | VWR | 60825-798 | breathable test tube lids |
| Magnesium chloride | Acros | 223210010 | MgCl2 |
| Magnesium sulfate | Sigma | M7506-500g | MgSO4 |
| Miracle-Gro Water Soluble All Purpose Plant Food | Miracle-Gro | 2756810 | |
| Mixer Mill MM 200 | Retsch | 20.746.0001 | tissue mill |
| Nalgene Fernbach culture flask | Sigma | Z360236 | 2.8 L flask |
| New Brunswick I26 | Eppendorf | M1324-0000 | Shaking incubator |
| Nicotiana benthamiana seed | USDA Germplasm Repository | Accession TW16 | N. benthamiana |
| OverExpress C41(DE3) Chemically Competent Cells | Lucigen | 60442 | C41-DE3 cells |
| Parafilm M wrapping film | Fisher | S37440 | Parafilm |
| Potassium chloride | Sigma | P-9541 | KCl |
| Potassium phosphate dibasic anhydrous | Fisher | P288-3 | Dipotassium phosphate |
| Potassium phosphate monobasic | Monopotassium phosphate | ||
| Pyrex disposable culture tubes, rimless | Sigma | CLS9944516 | test tubes |
| Pyruvate Acid Sodium Salt | Fisher | 501368477 | Sodium pyruvate |
| Retort Ring Stands | CTechGlass | ST00 | ring stand |
| Riboflavin | Amresco | 0744-250g | |
| Rifampicin | Sigma | R7382 | Rif |
| Rotovap | |||
| Sand, 50-70 mesh particle size | Sigma | 274739-1KG | |
| Silica | Fisher | AC241660010 | silica gel |
| Sodium chloride | Fisher | 5271-3 | NaCl |
| Sodum hydroxide | Fisher | SS266-1 | NaOH |
| Spectinomycin | Fisher | 501368607 | Spec |
| Squibb Separatory Funnel | CTechGlass | FN-1060-006 | Separatory funnel |
| Sunshine Mix #1 | Sungro Horticulture | Potting soil | |
| Thermo Scientific Snap Cap Low Retention Microcentrifuge Tubes | Fisher | 21-402-902 | microtube |
| Triangle funnel | CTechGlass | FN-0035 | funnel |
| Tryptone | Fisher | BP14212 | |
| Vial, screw, 2 mL, amber, WrtOn | Agilent | 5182-0716 | GC vial |
| visible spectrophotometer, V-1200 | VWR | 634-6000P | spectrophotometer |
| ZORBAX Eclipse XDB-C18 | Agilent | 990967-202 | HPLC column |
| ZORBAX Eclipse XDB-CN | Agilent | 990967-905 | HPLC column |
Références
- Peters, R. J. Two rings in them all: the labdane-related diterpenoids. Natural Product Reports. 27 (11), 1521-1530 (2010).
- Zerbe, P., Bohlmann, J. Plant diterpene synthases: exploring modularity and metabolic diversity for bioengineering. Trends in Biotechnology. 33 (7), 419-428 (2015).
- Toyomasu, T. Recent advances regarding diterpene cyclase genes in higher plants and fungi. Bioscience, Biotechnology, and Biochemistry. 72 (5), 1168-1175 (2008).
- Smanski, M. J., Peterson, R. M., Huang, S. X., Shen, B. Bacterial diterpene synthases: new opportunities for mechanistic enzymology and engineered biosynthesis. Current Opinion in Chemical Biology. 16 (1-2), 132-141 (2012).
- Salazar-Cerezo, S., Martinez-Montiel, N., Garcia-Sanchez, J., Perez, Y. T. R., Martinez-Contreras, R. D. Gibberellin biosynthesis and metabolism: A convergent route for plants, fungi and bacteria. Microbiological Research. 208, 85-98 (2018).
- Keeling, C. I., Bohlmann, J. Diterpene resin acids in conifers. Phytochemistry. 67 (22), 2415-2423 (2006).
- Schmelz, E. A., et al. Biosynthesis, elicitation and roles of monocot terpenoid phytoalexins. Plant Journal. 79 (4), 659-678 (2014).
- Bohlmann, J., Keeling, C. I. Terpenoid biomaterials. Plant Journal. 54 (4), 656-669 (2008).
- Mafu, S., Zerbe, P. Plant diterpenoid metabolism for manufacturing the biopharmaceuticals of tomorrow: prospects and challenges. Phytochemistry Reviews. 17 (1), 113-130 (2017).
- Hillwig, M. L., Mann, F. M., Peters, R. J. Diterpenoid biopolymers: new directions for renewable materials engineering. Biopolymers. 95 (2), 71-76 (2011).
- Jorgensen, L., et al. 14-step synthesis of (+)-ingenol from (+)-3-carene. Science. 341 (6148), 878-882 (2013).
- Line, N. J., Burns, A. C., Butler, S. C., Casbohm, J., Forsyth, C. J. Total Synthesis of (-)-Salvinorin A. Chemistry. 22 (50), 17983-17986 (2016).
- Morrone, D., et al. Increasing diterpene yield with a modular metabolic engineering system in E. coli: comparison of MEV and MEP isoprenoid precursor pathway engineering. Applied Microbioly and Biotechnology. 85 (6), 1893-1906 (2010).
- Kitaoka, N., Lu, X., Yang, B., Peters, R. J. The application of synthetic biology to elucidation of plant mono-, sesqui-, and diterpenoid metabolism. Molecular Plant. 8 (1), 6-16 (2015).
- George, K. W., et al. Metabolic engineering for the high-yield production of isoprenoid-based C(5) alcohols in E. coli. Scientific Reports. 5, 11128(2015).
- Paddon, C. J., Keasling, J. D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology. 12 (5), 355-367 (2014).
- Keasling, J. D. Synthetic biology and the development of tools for metabolic engineering. Metabolic Engineering. 14 (3), 189-195 (2012).
- Kampranis, S. C., Makris, A. M. Developing a yeast cell factory for the production of terpenoids. Computational and Structural Biotechnology Journal. 3 (4), e201210006(2012).
- Tholl, D. Biosynthesis and biological functions of terpenoids in plants. Advances in Biochemical Engineering/Biotechnology. 148, 63-106 (2015).
- McGarvey, D. J., Croteau, R. Terpenoid metabolism. The Plant Cell. 7 (7), 1015-1026 (1995).
- Chen, F., Tholl, D., Bohlmann, J., Pichersky, E. The family of terpene synthases in plants: a mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. The Plant Journal. 66 (1), 212-229 (2011).
- Pateraki, I., Heskes, A. M., Hamberger, B. Cytochromes P450 for terpene functionalisation and metabolic engineering. Advances in Biochemical Engineering/Biotechnology. 148, 107-139 (2015).
- Cao, R., et al. Diterpene cyclases and the nature of the isoprene fold. Proteins. 78 (11), 2417-2432 (2010).
- Reiling, K. K., et al. Mono and diterpene production in Escherichia coli. Biotechnology and Bioengineering. 87 (2), 200-212 (2004).
- Hamberger, B., Plant Bak, S. P450s as versatile drivers for evolution of species-specific chemical diversity. Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1612), 20120426(2013).
- Jia, M., Potter, K. C., Peters, R. J. Extreme promiscuity of a bacterial and a plant diterpene synthase enables combinatorial biosynthesis. Metabolic Engineering. 37, 24-34 (2016).
- Paddon, C. J., et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 496 (7446), 528-532 (2013).
- Peralta-Yahya, P. P., Zhang, F., del Cardayre, S. B., Keasling, J. D. Microbial engineering for the production of advanced biofuels. Nature. 488 (7411), 320-328 (2012).
- Pateraki, I., et al. Total biosynthesis of the cyclic AMP booster forskolin from Coleus forskohlii. Elife. 6, e23001(2017).
- Ignea, C., et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform. Proceedings of the National Academy of Sciences of the United States of America. 113 (13), 3681-3686 (2016).
- Ignea, C., et al. Reconstructing the chemical diversity of labdane-type diterpene biosynthesis in yeast. Metabolic Engineering. 28, 91-103 (2015).
- Cyr, A., Wilderman, P. R., Determan, M., Peters, R. J. A modular approach for facile biosynthesis of labdane-related diterpenes. Journal of the American Chemical Society. 129 (21), 6684-6685 (2007).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Schalk, M., et al. Toward a biosynthetic route to sclareol and amber odorants. Journal of the American Chemical Society. 134 (46), 18900-18903 (2012).
- Andersen-Ranberg, J., et al. Expanding the Landscape of Diterpene Structural Diversity through Stereochemically Controlled Combinatorial Biosynthesis. Angewandte Chemie International Edition in English. 55 (6), 2142-2146 (2016).
- Bruckner, K., Tissier, A. High-level diterpene production by transient expression in Nicotiana benthamiana. Plant Methods. 9 (1), 46(2013).
- Emanuelsson, O., Brunak, S., von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature Protocols. 2 (4), 953-971 (2007).
- Hausjell, J., Halbwirth, H., Spadiut, O. Recombinant production of eukaryotic cytochrome P450s in microbial cell factories. Bioscience Reports. 38 (2), BSR20171290(2018).
- Mafu, S., et al. Discovery, biosynthesis and stress-related accumulation of dolabradiene-derived defenses in maize. Plant Physiology. 176 (4), 2677-2690 (2018).
- Zerbe, P., et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiology. 162 (2), 1073-1091 (2013).
- Bach, S. S., et al. High-throughput testing of terpenoid biosynthesis candidate genes using transient expression in Nicotiana benthamiana. Methods in Molecular Biology. , 245-255 (2014).
- Sainsbury, F., Thuenemann, E. C., Lomonossoff, G. P. pEAQ: versatile expression vectors for easy and quick transient expression of heterologous proteins in plants. Plant Biotechnology Journal. 7 (7), 682-693 (2009).
- Wang, B., et al. Transient production of artemisinin in Nicotiana benthamiana is boosted by a specific lipid transfer protein from A. annua. Metabolic Engineering. 38, 159-169 (2016).
- Reed, J., Osbourn, A. Engineering terpenoid production through transient expression in Nicotiana benthamiana. Plant Cell Reports. 37 (10), 1431-1441 (2018).
- Dong, L., Jongedijk, E., Bouwmeester, H., Der Krol, A. V. an Monoterpene biosynthesis potential of plant subcellular compartments. New Phytologist. 209 (2), 679-690 (2016).
- Liu, Q., et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One. 6 (8), e23255(2011).
- Karunanithi, P. S., et al. Functional characterization of the cytochrome P450 monooxygenase CYP71AU87 indicates a role in marrubiin biosynthesis in the medicinal plant Marrubium vulgare. BMC Plant Biology. 19 (1), 114(2019).
- Pelot, K., et al. Functional diversity of diterpene synthases in the biofuel crop switchgrass. Plant Physiology. 178 (1), 54-71 (2018).
- Wang, Q., Hillwig, M. L., Wu, Y., Peters, R. J. CYP701A8: a rice ent-kaurene oxidase paralog diverted to more specialized diterpenoid metabolism. Plant Physiology. 158 (3), 1418-1425 (2012).
- Wang, Q., Hillwig, M. L., Peters, R. J. CYP99A3: functional identification of a diterpene oxidase from the momilactone biosynthetic gene cluster in rice. The Plant Journal. 65 (1), 87-95 (2011).
- Morrone, D., Chen, X., Coates, R. M., Peters, R. J. Characterization of the kaurene oxidase CYP701A3, a multifunctional cytochrome P450 from gibberellin biosynthesis. Biochemical Journal. 431 (3), 337-344 (2010).
- Swaminathan, S., Morrone, D., Wang, Q., Fulton, D. B., Peters, R. J. CYP76M7 is an ent-cassadiene C11alpha-hydroxylase defining a second multifunctional diterpenoid biosynthetic gene cluster in rice. The Plant Cell. 21 (10), 3315-3325 (2009).
- Gnanasekaran, T., et al. Heterologous expression of the isopimaric acid pathway in Nicotiana benthamiana and the effect of N-terminal modifications of the involved cytochrome P450 enzyme. Journal of Biological Engineering. 9 (1), 24(2015).
- De Luca, V., Salim, V., Atsumi, S. M., Yu, F. Mining the biodiversity of plants: a revolution in the making. Science. 336 (6089), 1658-1661 (2012).
- Wurtzel, E. T., Kutchan, T. M. Plant metabolism, the diverse chemistry set of the future. Science. 353 (6305), 1232-1236 (2016).
- Menon, A., et al. Mobile-based insulin dose adjustment for type 2 diabetes in community and rural populations: study protocol for a pilot randomized controlled trial. Therapeutic Advances in Endocrinology and Metabolism. 10, 2042018819836647(2019).
- Moses, T., et al. OSC2 and CYP716A14v2 catalyze the biosynthesis of triterpenoids for the cuticle of aerial organs of Artemisia annua. The Plant Cell. 27 (1), 286-301 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon