Method Article
Uso de células madre pluripotentes inducidas por el hombre para la generación de células T específicas de antígenos tumorales
* Estos autores han contribuido por igual
En este artículo
Resumen
En este artículo se describe un método para generar un método para generar un antígeno tumoral funcional específico de antígeno pluripotente derivado de células madreCD8- + células T positivas únicas utilizando el sistema de cocultivo OP9/DLL1.
Resumen
La generación y expansión de células T funcionales in vitro puede conducir a una amplia gama de aplicaciones clínicas. Uno de estos usos es para el tratamiento de pacientes con cáncer avanzado. Se ha demostrado que la transferencia adoptiva de células T (ACT) de células T específicas de antígenos tumorales altamente enriquecidas causa una regresión duradera del cáncer metastásico en algunos pacientes. Sin embargo, durante la expansión, estas células pueden agotarse o senescentes, limitando su función efectora y persistencia in vivo. La tecnología de células madre pluripotentes inducidas (iPSC) puede superar estos obstáculos dando lugar a la generación in vitro de un gran número de células T específicas de antígenos tumorales menos diferenciadas. El iPSC humano (hiPSC) tiene la capacidad de diferenciarse en cualquier tipo de célula somática, incluidos los linfocitos, que retienen el reordenamiento genómico del receptor de células T (TCR) original cuando se utiliza una célula T como célula inicial. Por lo tanto, la reprogramación de las células T específicas del antígeno tumoral humano a hiPSC seguida de la rediferenciación al linaje de células T tiene el potencial de producir células T específicas de antígeno tumoral rejuvenecidas. Aquí se describe un método para generar células T específicas del antígeno tumoral CD8+ único positivo (SP) de hiPSC mediante el sistema de cocultivo OP9/DLL1. Este método es una poderosa herramienta para la generación in vitro de linaje de células T y facilitará el desarrollo de células T derivadas in vitro para su uso en medicina regenerativa y terapias basadas en células.
Introducción
Además de las ventajas fisiológicas, las células T tienen muchas aplicaciones terapéuticas potenciales. La generación y expansión de linfocitos T in vitro puede utilizarse para el modelado de enfermedades y la validación terapéutica, así como una fuente de tratamiento para los estados de inmunodeficiencia hereditaria y adquirida (es decir, inmunodeficiencias virales y linfopción secundaria a quimioterapia o trasplante) y para la erradicación del cáncer. Esta última calidad ha llevado al desarrollo de la transferencia adoptiva de células T (ACT) para el tratamiento de pacientes con cáncer avanzado1.
ACT consiste en resecting el tumor de un paciente, extraer linfocitos infiltrantes tumorales (TIL), expandir los TIL ex vivo, y luego reincorporar las células expandidas en el paciente2. Se ha demostrado que es una modalidad de tratamiento eficaz para algunos pacientes con cáncer metastásico. Desafortunadamente, no todos los pacientes responden a esta terapia. Informes anteriores han demostrado que el estado de diferenciación de las celdas transferidas3,4,5,6,7,8,9, uso de grandes cantidades de células T específicas de antígenos de cáncer altamente enriquecidas10, y la persistencia de las células T después de la transferencia11,12 están correlacionadas con respuestas más duraderas13,14. Por lo tanto, cuando ACT no logra obtener una respuesta antitumoral, puede deberse en parte a un bajo rendimiento de células T específicas de antígenos cancerígenos, expansión ex vivo ineficiente que conduce al agotamiento y la pérdida de clones reactivos, o a la falta de persistencia después de la transferencia4 . Se ha postulado que estos obstáculos pueden ser superados por la generación de un gran número de células T específicas de antígenos de cáncer menos diferenciadas in vitro15,16.
Las células hematopoyéticas del tallo/progenitor (HSpC) son una fuente convencional para la generación in vitro de células T, aunque este método está limitado por el pequeño número de células que pueden recuperarse de un solo donante1. También se ha demostrado que las células madre embrionarias (ESC) producen células T pero con bajo rendimiento17,por lo que es ineficiente para aplicaciones clínicas. Además, dado que las células de linaje T experimentan una recombinación genética estocástica de sus receptores de células T (TTR) en etapas tempranas del desarrollo, no es posible utilizar HSCCP o ESC para generar una población pura de células T específicas de antígenos sin más células t modificaciones como la transducción de genes TCR.
Un enfoque para superar estas advertencias es reprogramar los TIL a las células madre pluripotentes inducidas por el ser humano (hiPSC), que pueden proporcionar una fuente ilimitada para la generación in vitro de células T. Se ha demostrado que los TIL específicos del antígeno canceroso pueden reprogramarse en hiPSC y diferenciarse en el linaje de células T, que conserva el mismo reordenamiento del gen del receptor de células T (TCR) que el cebán T original18,19. Este detalle es importante para ACT porque los tumores individuales de pacientes tienen perfiles mutacionales únicos, y se ha demostrado que muy pocos antígenos cancerosos se comparten entre los pacientes20. Por lo tanto, el uso de TIL específicos del antígeno cancerológico como fuente para la generación in vitro de células T derivadas de hiPSC puede proporcionar una nueva estrategia para el tratamiento personalizado de pacientes con cáncer metastásico.
Presentado aquí en detalle es un protocolo para diferenciar las células de linaje T derivadas de hiPSC en células T específicas de antígenos funcionales( SP) utilizando el sistema de cocultivo OP9/DLL1. Este método es una poderosa herramienta para la diferenciación in vitro de células T de hiPSC, progenitores hematopoyéticos y células madre embrionarias, así como sus aplicaciones adicionales en medicina regenerativa y terapias basadas en células.
Protocolo
1. Culturing Human iPSCs (hiPSCs) en los fibroblastos embrionarios de ratón (MEF)
NOTA: También se pueden utilizar métodos alternativos para el cultivo de hiPSCs, incluyendo pero no limitado a: la semilla en una placa de 6 pocillos pre-recubierta con gelatina, una mezcla de proteína gelatinosa, laminina recombinante 511, o cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPSC, y cualquier otra matriz extracelular utilizada en la expansión hiPS cultivado utilizando medios definidos especialmente formulados para el cultivo humano de células madre pluripotentes.
-
Culturing MEF
- Recubrir un cultivo celular de 10 cm Plato Petri con 4 ml de gelatina al 0,1% e incubar durante 30 min a 37oC.
- Descongelar un vial de 4 x 106 MEF irradiado rápidamente en 10 ml de medios MEF de 37 oC (DMEM + 10% FBS + 1x penicilina-estreptomicina + 1x suplemento de L-glutamina). Centrífuga a 300 x g durante 5 min a 4oC. Aspirar el sobrenadante y resuspender el pellet celular en 9 ml de medios MEF.
- Retire el plato recubierto de gelatina de la incubadora. Aspirar gelatina y añadir 7 mL de medios MEF. Placa 3 mL de suspensión MEF (del paso 1.1.2) sobre el plato recubierto de gelatina. Mece el plato de lado a lado y de adelante hacia atrás para asegurar una distribución uniforme de MEF sobre el plato. Incubar a 37oC durante 8-36 h.
-
Passaging hiPSC en MEF
NOTA: Los datos se generaron utilizando MART-1 iPSC derivado de un melanoma cultivado a largo plazo TIL, que reconoce específicamente el péptido MART-1 en el contexto de HLA-A*02:01, como se describió anteriormente18.- HiPSCs de paso cuando las colonias están entre 0,8 - 1,2 mm de diámetro. Antes del passaging, revise las colonias hiPSC en un estereomicroscopio y elimine cualquier área de diferenciación del cultivo usando el borde plástico de una punta de 200 l.
- Aspirar medios gastados y añadir medios hiPSC de 10 ml (medios de cultivo ES humanos [Tabla de materiales] + 10 ng/ml factor de crecimiento de fibroblastos básico humano [hbFGF]) complementado con inhibidor de 10 M ROCK.
- Sostenga el plato de cultivo celular en una mano y enrolle una herramienta de paso de celdas desechables a través de todo el plato en una dirección. Aplique suficiente presión para que toda la hoja del rodillo toque el plato de cultivo y mantenga una presión uniforme durante la acción de rodadura.
- Gire el plato de cultivo 90o y repita el paso 1.2.3. Ver la placa en el microscopio para confirmar visualmente el corte adecuado de las colonias, que debe aparecer a cuadros. Separe las colonias cortadas mediante un suave lavado mecánico con una pipeta de 200 ml.
NOTA: El desprendimiento de colonias cortadas por lavado mecánico debe hacerse inmediatamente después de cortar las colonias con el rodillo, porque después de 3 minutos las colonias cortadas comenzarán a volver a unirse al plato, y se hará difícil separar las colonias de tamaño homogéneo por lavado. - Transferir 350 - 600 grupos de colonias cortadas a un nuevo plato de 10 cm de MEF (placado de 8 a 36 h antes del paso de hiPSC) con 10 ml de medios hiPSC frescos complementados con inhibidor de 10 M ROCK. Incubar a 37oC.
NOTA: 600 grumos representan aproximadamente 1.0 x 106 MART-1 iPSC y producirán 0.5-1.0 x 106 células DP en el día 35. Sin embargo, los números esperados variarán dependiendo de la potencia de la línea de celda inicial y las condiciones de cultivo. - Al día siguiente, aspirar los medios gastados y añadir 10 ml de medios hiPSC frescos. Cambie los medios hiPSC cada 1-2 días dependiendo de la tasa de crecimiento de hiPSC.
2. Preparación de células OP9/DLL1 para cocultivo con hiPSCs
- Cultivo de células OP9/DLL1 en medios OP9 [medio esencial mínimo (-MEM) + 20% suero bovino fetal (FBS) + 1x penicilina-estreptomicina] a 37 oC. Cuando las células OP9/DLL1 alcanzan la confluencia, aspiran los medios y lavan una vez con 5 ml de magnesio 1x, calcio y solución salina tennada con fosfato rojo de fenol (PBS).
- Aspirar PBS y añadir 2 mL de 0.05% Trypsin-EDTA. Incubar durante 5 min a 37oC. Luego, agregue 4 ml de medios OP9 y disocia mecánicamente la capa celular pipeteando para hacer una suspensión de una sola célula.
- Transfiera la suspensión celular en un tubo cónico de 50 ml a través de un colador de células de 100 m para evitar los grumos celulares. Centrífuga a 300 x g durante 5 min a 4oC. Aspirar el sobrenadante y resuspender en 12 mL de medios OP9.
- Añadir 8 ml de medios OP9 a cada uno de los seis nuevos platos Petri de cultivo celular de 10 cm. Placa 2 mL de suspensión de celda OP9/DLL1 del paso 2.3 en cada plato nuevo de 10 cm. Mece el plato de lado a lado y de frente a atrás para garantizar una distribución uniforme de OP9/DLL1 sobre el plato.
- Incubar a 37oC. Repita el pasaje cada 2 - 3 días cuando las células alcancen la confluencia.
NOTA: Es importante hacer suficiente stock congelado de células OP9/DLL1 y descongelar un nuevo stock cada 4-6 semanas.
3. In Vitro Diferenciación de hiPSCs en CD8+ Células T Single Positive (SP)
- Preparar platos GElatinizados OP9/DLL1 una semana antes de la cocultura con hiPSCs. Para preparar una solución de gelatina al 0,1%, añada 5 ml de solución de gelatina de grado tisular a temperatura ambiente (RT) a 500 ml de PBS.
- Escudo 3 nuevos 10 cm cultivo celular platos Petri añadiendo 4 mL por plato de 0.1% gelatina. Incubar 30 min a 37oC.
- Aspirar gelatina y añadir 8 mL de soporte OP9 a cada plato. Pasaje un plato de confluente de OP9/DLL1 (como se hace en la sección 2 anterior) a tres platos pre-revestidos de gelatina.
- Después de 4 días, añadir 10 mL de medios OP9 a cada plato de 10 cm de OP9/DLL1 en gelatina, para un total de 20 mL de medios por plato.
- Después de 7 - 8 días, comience la cocultura hiPSC en platos confluentes OP9/DLL1 (día de diferenciación 0).
- Aspirar los medios gastados de confluente plato de 10 cm de hiPSCs en MEF. Añadir 10 mL de medios OP9. Cortar y separar las colonias hiPSC utilizando una herramienta de passaging celular desechable como se hace en los pasos 1.2.3 y 1.2.4.
- Transfiera 350 - 600 grupos de colonias cortadas a un plato OP9/DLL1 pregelatinizado de 10 cm (paso 3.1) con 10 ml de medios OP9 frescos utilizando una pipeta de 200 ml. Mece el plato de cultivo de lado a lado y de frente a atrás para asegurar una distribución uniforme de las colonias.
NOTA: Alternativamente, se pueden utilizar cuerpos embrionarios de hiPSC (EB) preformados o suspensión de pequeño grumos. Sin embargo, se prefiere el uso de una herramienta de passaging celular desechable o un sistema de formación de EB para producir grupos hiPSC de tamaño uniforme.
- En el día 1, aspirar los medios gastados y reemplazarlo con 20 ml de medios OP9 frescos. Los grupos hiPSC co-cultivados en OP9/DLL1 durante 1 día aparecerán como pequeñas colonias monocapa redondas(Figura 1).
- En el día 5, aspirar 10 mL de medios gastados y añadir 10 mL de medios OP9 frescos. las colonias hiPSC comenzarán a diferenciarse en mesodermos primitivos, que se caracteriza por un centro oscuro multicapa.
- En el día 9, aspirar 10 mL de medios gastados y añadir 10 mL de medios OP9 frescos. En este punto, las estructuras centrales multicapa evolucionarán en formas similares a cúpulas, y un área de red periférica comenzará a hacerse evidente.
- En el día 13, cosechar células progenitoras hematopoyéticas (HHP) (Figura 1). Las estructuras derivadas de hiPSC el día 13 se caracterizan por un organoide central oscuro rodeado por una red de áreas similares a cúpulas, representativas de las zonas hematopoyéticas (HZs) previamente reportadas para encerrar progenitores hematopoyéticos derivados de células madre de embriones humanos 21.
NOTA: La presencia de las estructuras similares a la cúpula indica un proceso exitoso incluso en ausencia de centros oscuros. La incapacidad para producir HPC puede deberse a la mala calidad de OP9/DLL1, la calidad del lote FBS, la confluencia de grumos iPSC sembrados en OP9/DLL1 (350-600 grumos es óptimo), y /o variaciones en la potencia de las líneas iPSC para producir precursores hematopoyéticos.- Aspirar los medios gastados y lavar 1x con 5 mL de 1x solución salina equilibrada de Hanks libre de fenol modificada con calcio y magnesio (HBSS).
- Aspirar HBSS y añadir 250 l de 5000 unidades/ml de colagenasa IV en 10 ml de HBSS. Incubar a 37oC durante 45 min. Aspirar HBSS con colagenasa IV y lavar una vez con 5 ml de PBS.
- Aspirar PBS y añadir 5 mL de 0.25% Trypsin-EDTA. Incubar a 37oC durante 20 min. Luego, agregue 4 ml de medios OP9 y disocie la capa celular pipeteando para hacer una suspensión de una sola célula.
- Transfiera la suspensión celular a un tubo cónico de 50 ml a través de un colador de células de 100 m. Centrífuga a 300 x g durante 5 min a 4oC. Aspirar el sobrenadante y resuspender en 10 mL de medios OP9.
- Suspensión de células de placa sobre un nuevo plato de Petri gelatinizado de 10 cm de cultivo celular (ver pasos 3.1.1 y 3.1.2). Incubar a 37oC durante 45 min. Luego, recoja las células no adherentes mediante pipeteo suave.
- Transfiera la suspensión de la célula recogida en un tubo cónico de 50 ml a través de un colador de células de 100 m. Centrífuga a 300 x g durante 5 min a 4oC. Aspirar el sobrenadante y resuspender en 10 ml de medios de diferenciación [medios OP9 con factor de células madre humanas de 5 ng/ml (hSCF), ligando Flt3 humano de 5 ng/ml (hFLT3L), y interleucina humana de 5 ng/ml 7 (hIL-7)].
- Placar la suspensión de la celda en un nuevo plato de 10 cm OP9/DLL1.
- En el día 16, pasa las celdas.
- Separe mecánicamente las células no adherentes mediante un pipeteo suave y filtre a través de un colador de células de 100 m. Centrífuga a 300 x g durante 5 min a 4oC. Aspirar el sobrenadante y resuspender en medios de diferenciación de 10 ml.
- Placar la suspensión de la celda en un nuevo plato de 10 cm OP9/DLL1.
- Continúe el paso de células no adherentes cada 5-7 días a partir de entonces repitiendo el paso 3.8.
- En el día 35, enriquecer la población CD4+CD8+ doble positivo (DP) y estimular para producir células CD8+ SP T (Figura 2).
- Separe mecánicamente las células no adherentes mediante un pipeteo suave y filtre a través de un colador de células de 100 m para eliminar los grumos celulares. Enriquecer CD4+ población celular por aislamiento de perlas magnéticas CD4 de acuerdo con el protocolo del fabricante.
NOTA: La razón para el uso de perlas magnéticas CD4 es eliminar CD4-CD8- Células DN del cultivo, ya que se ha demostrado que causan la muerte directa de células CD4+CD8+ DP después de la estimulación22. - Cuente las células enriquecidas en CD4 en vivo usando un hemocitómetro Neubauer y un tinte azul Trypan. Suspender en medios OP9 a concentración total 0,5 x 106 celdas/ml. Aliquot 1 mL de la suspensión celular (0,5 x 106 células) en cada pozo de un cultivo tisular de fondo plano 24 bien placa de confluente OP9/DLL1.
- Añadir 100 UI de interleucina humana 2 (hIL-2), 5 ng/mL hIL-7, 500 ng/mL anticuerpo CD3 antihumano, y 2 ég/ml anticuerpo cd28 antihumano, luego cultivo a 37 oC.
- En el día 4 - 7 después de la estimulación, recoger las células para el análisis molecular(Figura 3) o co-cultivo con células que presentan antígeno con pulso de péptido (AAP).
- Separe mecánicamente las células no adherentes mediante un pipeteo suave y filtre a través de un colador de células de 100 m para eliminar los grumos celulares. Enriquecer CD4+ población celular por aislamiento de perlas magnéticas CD4 de acuerdo con el protocolo del fabricante.
4. Medición de la especificidad del antígeno de las células derivadas de HIPSC CD8+ SP T
NOTA: El tipo de APC que se utilizarán para este experiencia depende de la restricción MHC de las células T derivadas de hiPSC. Aquí, se utiliza la línea celular T2, que es un híbrido de líneas celulares linfotoides T y B. Las células T2 expresan HLA-A*02:0123,que es reconocida por las células JKF6 de las cuales SE deriva MART1-iPSC18. Esta línea celular T2 se puede ampliar en RPMI 1640 + 20% FBS + 1x penicilina-estreptomicina y se pasa cuando las células alcanzan una densidad de 5 x 105 células/ml.
- Cuente las células L2 linfoblastoides híbridas HLA-A*02:01+ T-B con un hemocitómetro Neubauer y un tinte azul Trypan. Incubar AAP en placa de cultivo de tejido de 24 pocillos con 1 péptido MART-1 g/ml durante 2 h a 37oC.
NOTA: La concentración óptima de péptidos es variable, dependiendo de la línea celular y la especificidad del antígeno. - Recoger APCs y lavar 2x con 10 mL de PBS para eliminar cualquier péptido adicional.
- Cuente los AAP y suspenda a 2 – 5 x 105 células/mL en los medios OP9 con 100 UI IL-2 y 5 ng/mL IL-7. Aliquot 100 l de suspensión celular (2-5 x 104 células) en cada pocelo de una placa de pozo U inferior 96 de unión ultrabaja o directamente en una placa ELISpot pre-revestida.
- Ordenar las células CD8+ SP T derivadas de hiPSC (1 semana después de la estimulación antihumana de anticuerpos CD3/CD28) utilizando un clasificador de células y suspender a 1 x 106 células/ml en medios OP9 con 100 UI IL-2 y 5 ng/mL IL-7. Aliquot 100 l de suspensión celular (1 x 105 células) en cada pozo de AAP y cultivo durante 16 - 20 h a 37 oC.
- Después de 16 - 20 h, analizar el perfil de secreción de citoquinas por ensayo ELISpot según el protocolo del fabricante(Figura 4).
Resultados
Después de 13 días de co-cultivo con OP9/DLL1, CD34+CD43+ células progenitoras hematopoyéticas aparecieron (Figura 1). Después de 22 días adicionales de cultivo en OP9/DLL1 no gelatinizado en presencia de hSCF, hFLT3L y hIL-7, progenitores hematopoyéticos diferenciados en CD3+CD7+CD4+CD8+ células de linaje T doble positivo (DP), el mayoría de los cuales expresaron TCR específico para el epítopo MART-1 (tetramémero)(Figura 2).
Anteriormente se ha demostrado que las células CD8+ SP T pueden ser inducidas de células CD4+CD8+ DP T por señalización TCR a través de péptido agonista o estimulación TCR impulsada por anticuerpos24,25. Por lo tanto, en el día 35 del cultivo, las células CD4+CD8+ DP T derivadas de hiPSC fueron estimuladas con anticuerpos CD3 antihumanos y CD28 antihumanos en presencia de hIL-7 y hIL-2. Cuatro días después de la estimulación, el número de células CD3+CD8+ SP aumentó drásticamente y se mantuvo específica para el epítopo MART-1, confirmando la preservación de su especificidad de antígeno heredado(Figura 3).
Para determinar las propiedades funcionales de las células CD8+ SP T derivadas de hiPSC, se analizó la activación dependiente del antígeno y la secreción de interferón gamma (IFN-o). Después de la estimulación con CD3 antihumano y anticuerpos CD28 antihumanos durante 1 semana, las células CD8+ SP T derivadas de hiPSC se aislaron utilizando un clasificador celular y se cocultivaron con la línea celular T2 que expresa HLA-A*02:01 con o sin péptido MART1 cognado durante 16 - 20 h. El ensayo ELISpot reveló que las células CD8+ SP T derivadas de hiPSC secretan cantidades más altas de IFN en comparación con las células T CD8+ SP, cuando se cultivan en presencia de péptido MART-1. La expresión IFN-o era nula solo para las células T y los APC, lo que demuestra que las células T derivadas de T-iPSC humanas son específicas del antígeno y son funcionales(Figura 4).
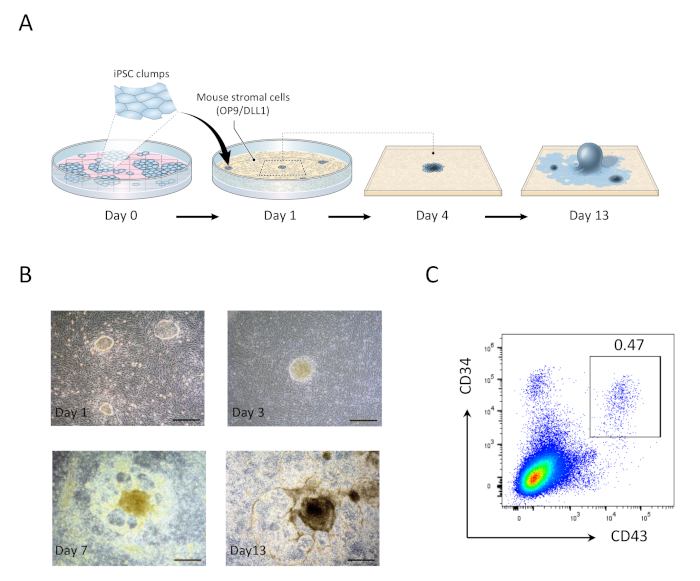
Figura 1:Generación de células progenitoras hematopoyéticas derivadas de hiPSC. (A) Visión general esquemática de la diferenciación de los hiPSC al linaje hematopoyético utilizando la cocultura OP9/DLL1. (B) Apariencia de estructuras derivadas de hiPSC en los días 1 (arriba a la izquierda), 3 (arriba a la derecha), 7 (abajo a la izquierda) y 13 (abajo a la derecha). Barras de escala a 100 m. (C) Análisis citométrico de flujo de células progenitoras derivadas de hiPSC CD34+CD43+ hematopoyéticas en el día 13. Los datos son representativos de seis experimentos independientes (n.o 1 a 2). Haga clic aquí para ver una versión más grande de esta figura.
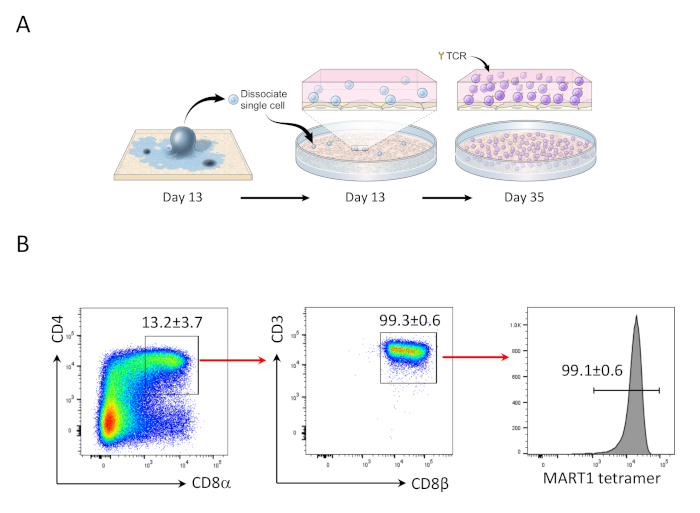
Figura 2: diferenciación hiPSC en células Mart1+ CD4+CD8+ DP T. (A) Visión general esquemática de la diferenciación del linaje hematopoyético derivado de la hiPSC a las células T inmaduras utilizando la cocultura OP9/DLL1. (B) Análisis citométrico de flujo de CD4 frente a CD8, CD3 frente a CD8, y expresión de tetramer MART-1 en células T derivadas de hiPSC en el día 35. Cerrado en linfocitos, células individuales, PI negativo. Los datos son representativos de tres experimentos independientes (n.o 3 - 8). Haga clic aquí para ver una versión más grande de esta figura.
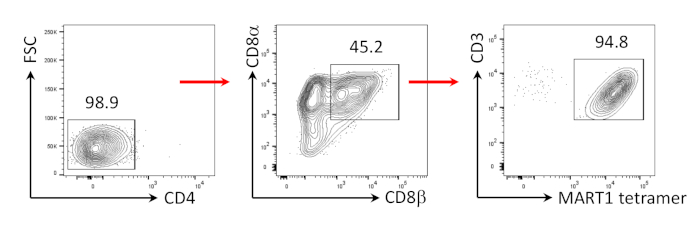
Figura 3: Inducción del fenotipo de células CD8+ SP T. Análisis citométrico de flujo de CD4- células T derivadas de hiPSC 4 días después de la estimulación humana impulsada por anticuerpos anti-CD3 y humanos anti-CD28. Cerrado en linfocitos, células individuales, PI negativo (n.o 4). Haga clic aquí para ver una versión más grande de esta figura.
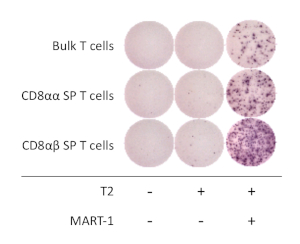
Figura 4: Especificidad del antígeno de las células CD8+ SP Tderivadas de hiPSC. Secreción de IFN-o por el ensayo ELISpot de CD8- SP derivado de hiPSC, CD8+ SP, y células T a granel después de 20 h de co-cultivo con o sin células T2 pulsadas (o no) con péptido MART-1. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El cocultivo de células estromales murinas OP9 es un sistema bien establecido para la generación in vitro de linfocitos (es decir, células NK, B y T) a partir de HSCCP y células madre pluripotentes. La señalización de muesca es necesaria para inducir el compromiso de linaje T y se puede lograr mediante la expresión ectópica de Notch ligand DLL1 o DLL4, que tienen una eficacia comparable para la generación de células T1. Por lo tanto, el sistema de cocultivo OP9/DLL1 se ha convertido en un método ampliamente utilizado para producir células T in vitro. Además, este método es aplicable para su uso con varios tipos y fuentes de células humanas, incluyendo sangre de cordón umbilical, HSCCP de médula ósea y ESCs. Sin embargo, la generación de células T a partir de estas fuentes está limitada ya sea por la recuperación insuficiente de células de origen o por la diferenciación ineficiente a las células T1. Además, un producto de células T con una sola recombinación de TCR no se puede generar a partir de estas fuentes de repertorio abierto. Mediante el uso de técnicas de medicina regenerativa, a saber, la tecnología de células madre pluripotentes inducidas (iPSC), puede ser posible producir un gran número de células T específicas de antígenos para su uso en terapias basadas en células15.
los hiPSC son similares a los ESC pluripotentes en su capacidad de auto-renovación, expansión ilimitada y potencial para diferenciarse a cualquier tipo de célula somática en el cuerpo; sin embargo, carecen de las preocupaciones éticas en torno al uso de productos de origen embrionario para aplicaciones clínicas. Además, los hiPSC se pueden producir a partir de cualquier célula somática, permitiendo el desarrollo de productos celulares para la medicina personalizada. En informes anteriores, se han producido hiPSC a partir de células T humanas utilizando células mononucleares periféricas enteras, células CD3+ o linfocitos T citotóxicos aislados (CTL) como fuente18,19,22, 26. Cuando se generan hiPSC a partir de una fuente de células T (T-iPSC), se hereda el reordenamiento del gen TCR original. Por lo tanto, los células T derivadas de T-iPSC del paciente pueden proporcionar un modelo para el tratamiento personalizado de ACT al dirigirse a los antígenos cancerosos distintos de un paciente.
La diferenciación de las células madre pluripotentes humanas en células de linaje T se divide en dos pasos: la generación de células progenitoras hematopoyéticas (HHP)27 y su posterior diferenciación en células de linaje T21. Ambos pasos se pueden realizar mediante el sistema de cocultura OP9/DLL1. Es importante destacar que la calidad de las células de alimentación OP9/DLL1 es fundamental para el éxito de la diferenciación de células T. Dado que las células OP9/DLL1 no son una línea celular homogénea inmortalizada, la calidad del FBS y las condiciones de cultivo son fundamentales para mantener su expansión sin perder la capacidad de soportar la diferenciación hiPSC. Por lo tanto, se recomienda preevaluar el lote de FBS y el paso consistentemente cuando comienza a producirse contacto citoplásmico de célula a célula, con el fin de prevenir la diferenciación celular y la senescencia. Un punto a tener en cuenta es que el contacto de célula a célula puede parecer indistinguible del fondo dependiendo del contraste de fase y la ampliación del microscopio. En nuestra experiencia, la mayoría de los platos OP9/DLL1 parecerán ser un 80% de confluente cuando estén listos para el paso.
Se ha demostrado que las células de linaje T rediferenciadas generadas a partir de T-iPSCs por cocultivo OP9/DLL1 pueden producir células CD8+ SP T tras la estimulación18,19. Sin embargo, las células CD8+ SP T regeneradas adquieren el homodímero innato CD8,28, que es un coreceptor ineficaz para la señalización TCR29. Además, estas células CD8+ SP T regeneradas han demostrado una fuerte citotoxicidad independiente de TCR, haciendo que estas células sean desfavorables para uso clínico30. Este protocolo describe un método reciente que implica la estimulación de células CD4+CD8+ DP purificadas para generar células CD8+ SP T con un fenotipo más convencional y citotoxicidad específica de antígenosmejorada 22. Aunque la pérdida de especificidad del antígeno debido a la reorganización alélica tPR secundaria se produce en la etapa DP después de un cultivo prolongado a largo plazo, esto puede ser superado por la edición del genoma en T-iPSCs31. En nuestra experiencia, las células DP derivadas de hiPSC comienzan a aparecer en el día 30 - 35 del cultivo, y estas células DP recién generadas todavía no han sido sometidas a la reorganización secundaria de TTC. Por lo tanto, la mayoría de las células DP en el día 35 retienen la especificidad del antígeno y se pueden utilizar para generar células CD8+ SP T específicas del antígeno.
Antes de la estimulación humana anti-CD3 y anti-CD28 en el día 35, CD4-CD8- Las células DN deben ser eliminadas del cultivo, ya que se ha demostrado que causan la matanza directa de células CD4+CD8+ DP después de la estimulación22. Usando el enriquecimiento de perlas magnéticas CD4 (paso 3.10) enriquecerá tanto para DP como para CD4+CD8- células de positivo único intermedio (ISP)1, que se ha demostrado que no tienen efectos negativos22. Alternativamente, la clasificación celular activada por fluorescencia por citometría de flujo se puede realizar para aislar las células DP. Sin embargo, se prefiere la separación magnética de perlas, ya que evita la tensión mecánica inducida por la citometría de flujo.
La generación de células T CD8+ SP a partir de células madre pluripotentes humanas sin selección de agonista mediada por activación se ha demostrado posteriormente mediante el uso del cultivo de células estromales murinas 3D32. Sin embargo, la selección positiva fisiológica depende de la interacción de TCR con complejos autopéptidos-MHC, que son procesados de forma única y presentados por células epiteliales corticales timmicas33. Además, se ha demostrado que la afinidad TCR para los péptidos de selección determina las capacidades funcionales subsiguientes de las células maduras CD8+ SP T34. Actualmente, no hay evidencia que sugiera que un sistema de cocultivo basado en células estromales de Notch puede proporcionar el péptido de selección definido y el complejo MHC necesario para la selección fisiológica positiva.
Se ha informado previamente en un modelo murino que las células de linaje T generadas a partir de hiPSC derivados de células T específicos del antígeno tumoral utilizando OP9/DLL1 por sí solono no experimentan maduración convencional. Sin embargo, las células T inmaduras derivadas de iPSC generadas por el sistema OP9/DLL1 pueden madurar en células T de tipo ingenuo mediante una mayor educación timica fisiológica en un sistema de cultivo 3D 28,35. Por lo tanto, el protocolo presentado aquí para producir células T inmaduras derivadas de iPSC generadas por el sistema OP9/DLL1 es vital para nuevos intentos de generar células T post-tímicas específicas de antígeno seresmoral humano real capaces de persperar a largo plazo in vivo con eficiencia para tratar tumores vascularizados establecidos.
Divulgaciones
Los autores no tienen revelaciones.
Agradecimientos
Agradecemos a Alan B. Hoofring y Erina H. El para la asistencia gráfica. Esta investigación fue apoyada por el Programa de Investigación Intramuros del Instituto Nacional del Cáncer (ZIA BC010763) y la Iniciativa IntramuroNS NCI para la Inmunoterapia del Cáncer basada en Células.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 cm dish | Corning, Inc. | 353003 | |
| Anti-CD3, human | BD Biosciences | Cat# 561812, RRID:AB_1089628 | |
| Anti-CD34, human | BD Biosciences | Cat# 348791, RRID:AB_400381 | |
| Anti-CD4, human | Biolegend | Cat# 344612, RRID:AB_2028479 | |
| Anti-CD43, human | BD Biosciences | Cat# 560198, RRID:AB_1645460 | |
| Anti-CD7, human | BD Biosciences | Cat# 555361, RRID:AB_395764 | |
| Anti-CD8a, human | BD Biosciences | Cat# 555369, RRID:AB_398595 | |
| Anti-CD8b, human | BD Biosciences | Cat# 641057, RRID:AB_1645747 | |
| Anti-TCRb, human | BD Biosciences | Cat# 555548, RRID:AB_395932 | |
| CD28 human monoclonal antibody (15E8), pure functional grade | Miltenyl Biotec | 130-093-375 | |
| CD3 human monoclonal antibody (OKT3), pure functional grade | Miltenyl Biotec | 130-093-387 | |
| CD4 Microbeads, human | Miltenyl Biotec | 130-045-101 | |
| Cell strainer 100 um | Fisher Scientific | 22-363-549 | |
| Fetal Bovine Serum (FBS) | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| Gelatin Solution 2% | SIGMA-Aldritch | G1393-100ML | |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | L-Glutamine supplement |
| HBSS Mg+Ca+ Phenol-Red Free | Gibco | 14025-092 | |
| Interleukin-2 | R&D Systems | 202-IL | |
| Interleukin-7 | R&D Systems | 407-ML | |
| iTAG MHC Tetramer HLA-A*0201 Mart1 Tetramer -ELAGIGILTV | MBL | Cat#TB-0009-2 | |
| Mart1-hiPSC | Vizcardo et al., Cell Stem Cell 2013 | RIKEN-IMS | |
| Melan-A, MART 1 (26-35) | InnoPep | 3146-0100 | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| αMEM powder | Gibco | 61100061 | |
| Mouse Embryonic Fibroblasts (MEF) | Thermo Fisher Scientific | C57BL/6 MEF MITC-TREATED 4M EACH; A34962 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | OP9/DLL1 |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Primate ES Cell Medium | Reprocell | RCHEMD001 | Human ESC Culture Media |
| Rhok inhibitor (Y-27632 dihydrochloride) | Tocris | 1254 | |
| RPMI 1640 | Gibco | 11875093 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| StemPro | EZPassage | 23181-010 | |
| T2-tumor | ATCC | T2 (174 x CEM.T2) (ATCC® CRL-1992™) | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200-072 | |
| U Bottom 96 well plate | Corning, Inc. | 3799 |
Referencias
- Brauer, P. M., Singh, J., Xhiku, S., Zuniga-Pflucker, J. C. T Cell Genesis: In Vitro Veritas Est. Trends in Immunology. 37 (12), 889-901 (2016).
- Rosenberg, S. A., Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 348 (6230), 62-68 (2015).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. Journal of Clinical Investigation. 115 (6), 1616-1626 (2005).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Crompton, J. G., et al. Lineage relationship of CD8(+) T cell subsets is revealed by progressive changes in the epigenetic landscape. Cellular and Molecular Immunology. 13 (4), 502-513 (2016).
- Henning, A. N., Klebanoff, C. A., Restifo, N. P. Silencing stemness in T cell differentiation. Science. 359 (6372), 163-164 (2018).
- Henning, A. N., Roychoudhuri, R., Restifo, N. P. Epigenetic control of CD8(+) T cell differentiation. Nature Reviews Immunology. 18 (5), 340-356 (2018).
- Vodnala, S. K., et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism. Science. 363 (6434), (2019).
- Restifo, N. P., Gattinoni, L. Lineage relationship of effector and memory T cells. Current Opinion in Immunology. 25 (5), 556-563 (2013).
- Tran, E., et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 344 (6184), 641-645 (2014).
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Gautam, S., et al. The transcription factor c-Myb regulates CD8(+) T cell stemness and antitumor immunity. Nature Immunology. 20 (3), 337-349 (2019).
- Klebanoff, C. A., et al. Determinants of successful CD8+ T-cell adoptive immunotherapy for large established tumors in mice. Clinical Cancer Research. 17 (16), 5343-5352 (2011).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting through subsets: which T-cell populations mediate highly effective adoptive immunotherapy. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends in Immunology. 35 (4), 178-185 (2014).
- Crompton, J. G., Rao, M., Restifo, N. P. Memoirs of a reincarnated T cell. Cell Stem Cell. 12 (1), 6-8 (2013).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Reports. 2 (6), 1722-1735 (2012).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Lo, W., et al. Immunologic recognition of a shared p53 mutated neoantigen in a patient with metastatic colorectal cancer. Cancer Immunology Research. , (2019).
- Timmermans, F., et al. Generation of T cells from human embryonic stem cell-derived hematopoietic zones. Journal of Immunology. 182 (11), 6879-6888 (2009).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Salter, R. D., Howell, D. N., Cresswell, P. Genes regulating HLA class I antigen expression in T-B lymphoblast hybrids. Immunogenetics. 21 (3), 235-246 (1985).
- Snauwaert, S., et al. In vitro generation of mature, naive antigen-specific CD8(+) T cells with a single T-cell receptor by agonist selection. Leukemia. 28 (4), 830-841 (2014).
- Takahama, Y., Suzuki, H., Katz, K. S., Grusby, M. J., Singer, A. Positive selection of CD4+ T cells by TCR ligation without aggregation even in the absence of MHC. Nature. 371 (6492), 67-70 (1994).
- Seki, T., et al. Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell. 7 (1), 11-14 (2010).
- Vodyanik, M. A., Slukvin, I. I. Hematoendothelial differentiation of human embryonic stem cells. Current Protocols in Cell Biology. , (2007).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- McNicol, A. M., et al. CD8alpha/alpha homodimers fail to function as co-receptor for a CD8-dependent TCR. European Journal of Immunology. 37 (6), 1634-1641 (2007).
- Themeli, M., Riviere, I., Sadelain, M. New cell sources for T cell engineering and adoptive immunotherapy. Cell Stem Cell. 16 (4), 357-366 (2015).
- Minagawa, A., et al. Enhancing T Cell Receptor Stability in Rejuvenated iPSC-Derived T Cells Improves Their Use in Cancer Immunotherapy. Cell Stem Cell. 23 (6), 850-858 (2018).
- Montel-Hagen, A., et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell. 24 (3), 376-389 (2019).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Takada, K., et al. TCR affinity for thymoproteasome-dependent positively selecting peptides conditions antigen responsiveness in CD8(+) T cells. Nature Immunology. 16 (10), 1069-1076 (2015).
- Vizcardo, R., et al. A Three-dimensional Thymic Culture System to Generate Murine Induced Pluripotent Stem Cell-derived Tumor Antigen-specific Thymic Emigrants. JoVE. , e58672 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados