Method Article
Usando células-tronco pluripotentes induzidas pelo homem para a geração de células T específicas de antígeno tumoral
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo descreve um método para gerar células-tronco pluripotentes induzidas por antígeno funcional do tumor derivadas de CD8αβ+ únicas células T positivas usando o sistema de cocultura OP9/DLL1.
Resumo
A geração e expansão das células T funcionais in vitro pode levar a uma ampla gama de aplicações clínicas. Um desses usos é para o tratamento de pacientes com câncer avançado. A transferência de células T adotivas (ACT) de células T altamente enriquecidas do tumor específicas tem sido mostrada para causar regressão durável de câncer metastático em alguns pacientes. No entanto, durante a expansão, essas células podem ficar esgotadas ou senescentes, limitando sua função efetiva e persistência in vivo. A tecnologia induzida de células-tronco pluripotentes (iPSC) pode superar esses obstáculos levando à geração in vitro de um grande número de células T específicas de antígeno tumoral menos diferenciada. O iPSC humano (hiPSC) tem a capacidade de diferenciar-se em qualquer tipo de célula somática, incluindo linfócitos, que retêm o rearranjo genômico original do receptor de células T (TCR) quando uma célula T é usada como célula de partida. Portanto, a reprogramação de células T específicas de antígeno tumor humano para hiPSC seguida de redifferentiação à linhagem de células T tem o potencial de produzir células T específicas de antígeno tumoral rejuvenescido. Descrito aqui é um método para gerar células T CD8αβ+ únicas positivas (SP) positivas (SP) do hiPSC usando o sistema de cocultura OP9/DLL1. Este método é uma ferramenta poderosa para a geração in vitro da linhagem da pilha de T e facilitará o desenvolvimento de pilhas de T derivadas in vitro para o uso na medicina regenerativa e nas terapias pilha-baseadas.
Introdução
Além de vantagens fisiológicas, as células T têm muitas aplicações terapêuticas potenciais. A geração e expansão das células T in vitro podem ser usadas para modelagem de doenças e validação terapêutica, bem como uma fonte de tratamento para estados de imunodeficiência hereditária e adquirida (ou seja, imunodeficiências virais e linfodepletion secundário para quimioterapia ou transplante) e para a erradicação do câncer. Esta última qualidade levou ao desenvolvimento de transferência de células T adotivas (ACT) para o tratamento de pacientes com câncer avançado1.
Act consiste em reintegrar o tumor de um paciente, extraindo linfócitos infiltrados tumorais (TILs), expandindo TILs ex vivo, em seguida, reinfundindo as células expandidas para o paciente2. Tem se mostrado uma modalidade de tratamento eficaz para alguns pacientes com câncer metastático. Infelizmente, nem todos os pacientes respondem a esta terapia. Relatórios anteriores mostraram que o estado de diferenciação das células transferidas3,4,5,6,7,8,9, uso de grandes números de células T altamente enriquecidas com antígeno de câncer10,e persistência das células T após a transferência11,12 estão todos correlacionados com respostas mais duráveis13,14. Portanto, quando act não consegue provocar uma resposta anti-tumoral, pode em parte ser devido a um baixo rendimento de células T específicas de antígeno do câncer, expansão ineficiente ex vivo levando à exaustão e perda de clones reativos, ou falta de persistência após a transferência4 . Foi postulado que esses obstáculos podem ser superados pela geração de um grande número de células T menos diferenciadas de câncer específicas de antígeno in vitro15,16.
As células-tronco/progenitoras hematopoiéticas (HSPCs) são uma fonte convencional para a geração de células T in vitro, embora este método seja limitado pelo pequeno número de células capazes de ser recuperadas de um único doador1. Células-tronco embrionárias (ESCs) também foram mostrados para produzir células T, mas com baixo rendimento17, tornando-o ineficiente para aplicações clínicas. Além disso, uma vez que as células de linhagem T experimentam recombinação genética estocástica de seus receptores de células T (TCRs) em estágios iniciais de desenvolvimento, não é possível usar HSPCs ou ESCs para gerar uma população pura de células T específicas de antígeno sem mais genômica modificações como a transdução do gene TCR.
Uma abordagem para superar essas ressalvas é reprogramar TILs para células-tronco pluripotentes induzidas pelo homem (hiPSCs), que podem fornecer uma fonte ilimitada para a geração de células T in vitro. Tem sido demonstrado que os TILs específicos de antígeno do câncer podem ser reprogramados em hiPSCs e rediferenciados na linhagem de células T, que retém o mesmo rearranjo do gene do receptor de células T (TCR) que a célula T original18,19. Este detalhe é importante para act porque tumores individuais do paciente têm perfis mutational originais, e muito poucos antígenos do cancro foram mostrados para ser compartilhados entre pacientes20. Portanto, o uso de TILs específicos de antígeno do câncer como fonte para a geração in vitro de células T derivadas de hiPSC pode fornecer uma nova estratégia para o tratamento personalizado de pacientes com câncer metastático.
Apresentado aqui em detalhes é um protocolo para diferenciar células de linhagem T derivadas de hiPSC em células T cd8αβ+ únicas positivas (SP) positivas usando o sistema de cocultura OP9/DLL1. Este método é uma ferramenta poderosa para a diferenciação in vitro de células T de hiPSCs, progenitores hematopoiéticos e células-tronco embrionárias, bem como suas aplicações adicionais em medicina regenerativa e terapias baseadas em células.
Protocolo
1. Culturing IPSCs humanos (hiPSCs) em fibroblastos embrionários do rato (MEF)
Nota: Métodos alternativos para cultivar hiPSCs também podem ser usados, incluindo, mas não limitado a: semeadura em uma placa de 6 poços pré-revestida com gelatina, uma mistura de proteína gelatinosa, laminina recombinante 511, ou qualquer outra matriz extracelular usada na expansão hiPSC, e culto usando meios definidos especialmente formulados para a cultura de células-tronco pluripotentes humanas.
-
Culturing MEF
- Cubra uma placa de Petri de cultura celular de 10 cm com 4 mL de 0,1% de gelatina e incubada por 30 min a 37 °C.
- Descongele um frasco de 4 x 106 MEF irradiado rapidamente em 10 mL de 37 °C mef media (DMEM + 10% FBS + 1x penicilina-estreptomicina + 1x L-suplemento de glutamamina). Centrífuga a 300 x g por 5 min a 4 °C. Assaa o supernatant e resuspende a pelota da pilha em 9 mL de meios de MEF.
- Retire o prato revestido de gelatina da incubadora. Aspirate gelatina e adicionar 7 mL de mídia MEF. Placa 3 mL de suspensão mef (do passo 1.1.2) para o prato revestido de gelatina. Rock o prato lado a lado e frente-a-trás para garantir até mesmo a distribuição de MEF sobre o prato. Incubar a 37 °C para 8-36 h.
-
Passagem hiPSC no MEF
NOTA: Os dados foram gerados usando o MART-1 iPSC derivado do melanoma cultivado a longo prazo TIL, que reconhece especificamente o peptídeo MART-1 no contexto do HLA-A*02:01, como descrito anteriormente18.- HiPSCs da passagem quando as colônias estão entre 0.8 - 1.2 milímetros no diâmetro. Antes da passagem, verifique as colônias hiPSC em um microscópio estéreo e remova quaisquer áreas de diferenciação da cultura usando a borda de plástico de uma ponta de 200 μL.
- Aspirate passou a mídia e adicionar 10 mL hiPSC media (mídia cultura ES humana [Tabela de Materiais] + 10 ng/mL fator de crescimento fibroblasto básico humano [hbFGF]) complementado com inibidor de 10 μM ROCK.
- Segure o prato de cultura celular em uma mão e rolar uma ferramenta de passagem de céluladescartável em todo o prato em uma direção. Aplique pressão suficiente para que toda a lâmina de rolo toque o prato de cultura e mantenha uma pressão uniforme durante a ação de rolamento.
- Gire o prato de cultura 90° e repita o passo 1.2.3. Veja a placa no microscópio para confirmar visualmente o corte adequado das colônias, que devem aparecer quadriculadas. Desapego cortar colônias por rubor mecânico suave usando uma pipeta de 200 μL.
Nota: O destacamento de colônias cortadas por rubor mecânico deve ser feito imediatamente após o corte de colônias com o rolo, porque depois de 3 min as colônias cortadas começarão a recolocar-se no prato, e se tornará difícil separar colônias de tamanho homogêneo por rubor. - Transfira 350 - 600 grupos de colônias cortadas para um novo prato de 10 cm de MEF (banhado 8 - 36 h antes da passaging hiPSC) com 10 mL de mídia hiPSC fresco complementado com inibidor de 10 μM ROCK. Incubar a 37 °C.
NOTA: 600 aglomerados representa aproximadamente 1,0 x 106 MART-1 iPSC e renderá 0,5-1,0 x 106 células DP no dia 35. No entanto, os números esperados variam dependendo da potência da linha celular inicial e condições de cultura. - No dia seguinte, aspirate mídia gasta e adicionar 10 mL de mídia hiPSC fresco. Mude a mídia hiPSC a cada 1 a 2 dias, dependendo da taxa de crescimento do hiPSC.
2. Preparação de células OP9/DLL1 para co-cultura com hiPSCs
- Células OP9/DLL1 cultura em mídia OP9 [α-mínimo meio essencial (α-MEM) + 20% de soro bovino fetal (FBS) + 1x penicilina-estreptomicina] em 37 °C. Quando as células OP9/DLL1 atingem a confluência, aspirate e stão lavando uma vez com 5 mL de magnésio 1x, cálcio e fenol sem vermelho soro de fosfato amortecida salina (PBS).
- Aspirate PBS e adicionar 2 mL de 0,05% Trypsin-EDTA. Incubar por 5 min a 37 °C. Em seguida, adicione 4 mL de mídia OP9 e mecanicamente dissociar a camada celular por pipetting para fazer uma suspensão de célula única.
- Transfira a suspensão celular em um tubo cônico de 50 mL através de um filtro de célula strainer de 100 μm para evitar aglomerados celulares. Centrífuga a 300 x g por 5 min a 4 °C. Aspirar o supernatant e resuspender em 12 mL de mídia OP9.
- Adicione 8 mL de mídia OP9 para cada um dos seis novos 10 cm de cultura de células placas de Petri. Placa 2 mL de suspensão celular OP9/DLL1 do passo 2.3 para cada novo prato de 10 cm. Rock o prato lado a lado, em seguida, frente-a-trás para garantir até mesmo a distribuição de OP9/ DLL1 sobre o prato.
- Incubar a 37 °C. Repita a passagem a cada 2 - 3 dias quando as células atingem a confluência.
Nota: É importante fazer bastante estoque congelado de pilhas OP9/DLL1 e descongelar um estoque novo cada 4-6 semanas.
3. Diferenciação in vitro de hiPSCs em CD8αβ+ Células T Positivas Únicas (SP)
- Prepare pratos OP9/DLL1 gelatinizados uma semana antes da co-cultura com hiPSCs. Para preparar a solução de gelatina de 0,1%, adicione 5 mL de temperatura ambiente (RT) solução de gelatina de estoque de tecido de grau para 500 mL de PBS.
- Casaco 3 novas placas de 10 cm de cultura celular Petri, adicionando 4 mL por prato de 0,1% de gelatina. Incubar 30 min a 37 °C.
- Aspirate gelatina e adicionar 8 mL de mídia OP9 para cada prato. Passar um prato de confluente de OP9/DLL1 (como feito na seção 2 acima) para três pratos pré-revestidos de gelatina.
- Após 4 dias, adicione 10 mL de mídia OP9 para cada prato de 10 cm de OP9/DLL1 em gelatina, para um total de 20 mL de mídia por prato.
- Após 7 a 8 dias, comece a co-cultura hiPSC em pratos de confluente op9/DLL1 (dia de diferenciação 0).
- A Aspirate gastou mídia de prato de 10 cm de cofluentes em mef. Adicione 10 mL de mídia OP9. Corte e desapara as colônias hiPSC usando uma ferramenta de passaging de células descartáveis, como feito nos passos 1.2.3 e 1.2.4.
- Transfira 350 - 600 grupos de colônias cortadas em um prato OP9/DLL1 pré-gelatinizado de 10 cm (passo 3.1) com 10 mL de mídia OP9 fresca usando uma pipeta de 200 μL. Rock o prato de cultura lado a lado, em seguida, frente-a-trás para garantir até mesmo a distribuição de colônias.
NOTA: Alternativamente, podem ser utilizados corpos embrionários hiPSC pré-formados (EBs) ou suspensão de pequeno aglomeração. No entanto, o uso de uma ferramenta de passaging de células descartáveis ou sistema de formação de EB é preferível produzir grupos hiPSC de tamanho uniforme.
- No dia 1, aspirate passou a mídia e substituir por 20 mL de mídia OP9 fresco. hiPSC grupos co-cultivada s OP9/DLL1 para 1 dia aparecerá como pequenas colônias de monocamadas redondas (Figura 1).
- No dia 5, aspirar 10 mL de mídia gasta e adicionar 10 mL de mídia OP9 fresco. colônias hiPSC começará a se diferenciar em mesoderm primitivo, que é caracterizado por um centro escuro multicamadas.
- No dia 9, aspirar 10 mL de mídia gasta e adicionar 10 mL de mídia OP9 fresco. Neste ponto, as estruturas centrais multicamadas evoluirão para formas semelhantes a cúpulas, e uma área periférica semelhante à rede começará a se tornar evidente.
- No dia 13, colhem células progenitoras hematopoiéticas (HPCs) (Figura 1). estruturas derivadas de hiPSC no dia 13 são caracterizadas por um organóide central escuro cercado por uma rede de áreas semelhantes a cúpulas, representativas de zonas hematopoiéticas (HZs) anteriormente relatadas para encerrar progenitores hematopoiéticos derivados de células-tronco embrionárias humanas 21.
NOTA: A presença das estruturas semelhantes a cúpulaindica um processo bem-sucedido, mesmo na ausência de centros escuros. A incapacidade de produzir HPCs pode ser devido à má qualidade do OP9/DLL1, qualidade do lote FBS, confluência de aglomerados iPSC semeados em OP9/DLL1 (350-600 aglomerados é ideal), e / ou variações na potência das linhas iPSC para produzir precursores hematopoietic.- Aspirate passou a mídia e lavar 1x com 5 mL de 1x fenol vermelho-livre Hanks' solução de sal equilibrado modificado com cálcio e magnésio (HBSS).
- Aspirate HBSS e adicionar 250 μL de 5000 Unidades/mL colagem IV em 10 mL de HBSS. Incubar a 37 °C por 45 min. Aspirate HBSS com collagenase IV e lavar uma vez com 5 mL de PBS.
- Aspirate PBS e adicionar 5 mL de 0,25% Trypsin-EDTA. Incubar a 37 °C por 20 min. Em seguida, adicione 4 mL de mídia OP9 e dissociar a camada celular por pipetting para fazer uma suspensão de célula única.
- Transfira a suspensão celular em um tubo cônico de 50 mL através de um filtro de célula strainer de 100 μm. Centrífuga a 300 x g por 5 min a 4 °C. Aspirar o supernatant e resuspender em 10 mL de mídia OP9.
- Suspensão de células de placa em uma nova placa de Petri de cultura celular gelatinizada de 10 cm (ver etapas 3.1.1 e 3.1.2). Incubar a 37 °C por 45 min. Em seguida, coletar células não-aderentes por pipetting suave.
- Transfira a suspensão celular coletada em um tubo cônico de 50 mL através de um filtro de células de 100 μm. Centrífuga a 300 x g por 5 min a 4 °C. Aspirar o supernatant e resuspender em 10 mL de meios de diferenciação [mídia OP9 com 5 ng/mL fator de células-tronco humanas (hSCF), 5 ng/mL humano Flt3 ligand (hFLT3L), e 5 ng/mL interleucina humana 7 (hIL-7)].
- Placa a suspensão celular em um novo 10 cm OP9/DLL1 prato de confluente.
- No dia 16, passar as celas.
- Mecanicamente destacar as células não-aderentes por tubulação suave e filtro através de um filtro de células de 100 μm. Centrífuga a 300 x g por 5 min a 4 °C. Assaa o supernatant e resuspende em 10 meios da diferenciação do mL.
- Placa a suspensão celular em um novo 10 cm OP9/DLL1 prato de confluente.
- Continue a passar células não aderentes a cada 5-7 dias depois, repetindo passo 3.8.
- No dia 35, enriquecer CD4+CD8+ duplo positivo (DP) população e estimular a produzir cd8αβ+ sp células T (Figura 2).
- Mecanicamente destacar células não-aderentes por pipetting suave e filtro através de um filtro de célula sitios de 100 μm para remover grupos celulares. Enriqueça a população de cd4+ células pelo isolamento de contas magnéticas CD4 de acordo com o protocolo do fabricante.
NOTA: A justificativa para o uso de contas magnéticas CD4 é remover as células CD4-CD8- DN da cultura, como estas foram demonstradas para causar matança direta de células CD4+CD8+ DP após a estimulação22. - Conte células enriquecidas cd4 vivas usando um hemocytometer Neubauer e tinudura azul Trypan. Suspender na mídia OP9 na concentração total 0,5 x 106 células/mL. Aliquot 1 mL da suspensão celular (0,5 x 106 células) em cada poço de uma cultura de tecido plana inferior 24 placa bem de confluent OP9/DLL1.
- Adicione 100 UI interleucina humana 2 (hIL-2), 5 ng/mL hIL-7, 500 ng/mL anticorpo Anti-humano CD3, e 2 μg/mL anticorpo CD28 anti-humano, em seguida, cultura em 37 °C.
- No dia 4 - 7 após a estimulação, coletar células para análise molecular (Figura 3) ou co-cultura com células de apresentação de antígeno pulsado pelo peptídeo (APCs).
- Mecanicamente destacar células não-aderentes por pipetting suave e filtro através de um filtro de célula sitios de 100 μm para remover grupos celulares. Enriqueça a população de cd4+ células pelo isolamento de contas magnéticas CD4 de acordo com o protocolo do fabricante.
4. Medindo especificidade de antígeno de células CD8αβ+ SP T derivadas hiPSC
Nota: O tipo de APCs a serem usados para este experiement é dependente da limitação de MHC de pilhas de T hiPSC-derivadas. Aqui, a linha celular T2 é usada, que é um híbrido de linhas de células linfoboblastóides T e B. As células T2 expressam HLA-A*02:0123, que é reconhecido pelas células JKF6 das quais mart1-iPSC foi derivado18. Esta linha celular T2 pode ser expandida em RPMI 1640 + 20% FBS + 1x penicilina-estreptomicina e é passagen quando as células atingem uma densidade de 5 x 105 células/mL.
- Conte ao vivo HLA-A*02:01+ T-B híbrido linfoblastoide t2 células usando um hemocytometer Neubauer e tine azul Trypan. Incubar APCs em 24 placa de cultura de tecido bem com 1 μg/mL MART-1 peptídeo para 2 h a 37 °C.
Nota: A concentração ideal do peptídeo é variável, dependendo da linha celular e da especificidade do antígeno. - Colete APCs e lave 2x com 10 mL de PBS para remover qualquer peptídeo extra.
- Conte APCs e suspenda em 2 - 5 x 105 células/mL na mídia OP9 com 100 IU IL-2 e 5 ng/mL IL-7. Aliquot 100 μL de suspensão celular (2-5 x 104 células) em cada poço de uma placa de 96 poços de ligação u ultra-baixa ou diretamente em uma placa ELISpot pré-revestida.
- Classificar as células T CD8αβ+ SP derivadas de hiPSC (1 semana após estimulação anti-humana de anticorpos CD3/CD28) usando um classificador celular e suspenda em 1 x 106 células/mL na mídia OP9 com 100 IU IL-2 e 5 ng/mL IL-7. Aliquot 100 μL de suspensão celular (1 x 105 células) em cada poço de APCs e cultura para 16 - 20 h a 37 °C.
- Após 16 - 20 h, analise o perfil de secreção de citocina pelo ensaio elispot por protocolo do fabricante (Figura 4).
Resultados
Após 13 dias hiPSCs co-culturing com OP9/DLL1, CD34+CD43+ células progenitoras hematopoiéticas apareceram (Figura 1). Após mais 22 dias de cultura sobre OP9/DLL1 não gelatinizado na presença de hSCF, hFLT3L e hIL-7, progenitores hematopoiéticos diferenciados em CD3+CD7+CD4+CD8+ células de linhagem T duplo-positivas (DP), maioria dos quais expressou TCR específico para o epitope MART-1 (tetramer) (Figura 2).
Já foi demonstrado anteriormente que as células T CD8+ SP podem ser induzidas a partir de células T CD4+CD8+ DP por sinalização TCR via peptídeo agonista ou estimulação tcr orientada por anticorpos24,25. Portanto, no dia 35 da cultura, as células T CD4+CD8+ DP derivadas de hiPSC foram estimuladas com anticorpos CD3 anti-humanos e CD28 anti-humanos na presença de hIL-7 e hIL-2. Quatro dias após a estimulação, o número de células CD3+CD8αβ+ SP aumentou dramaticamente e permaneceu específico para o epítopo MART-1, confirmando a preservação de sua especificidade antígeno herdada (Figura 3).
Para determinar as propriedades funcionais das células T CD8αβ+ SP derivadas de hiPSC, foi analisada a ativação e secreção de interferon gama (IFN-γ). Após a estimulação com anticorpos CD3 anti-humanos e CD28 anti-humanos por 1 semana, as células T CD8αβ+ SP derivadas de hiPSC foram isoladas usando um classificador celular e co-cultivadas com linha celular T2 expressando HLA-A*02:01 com ou sem peptídeo MART1 cognado por 16 - 20 h. O ensaio elispot revelou que as células CD8αβ+ SP T derivadas de hiPSC secretam quantidades mais elevadas de IFN-γ em comparação com as células T CD8αα+ SP, quando cultivadas na presença do peptídeo MART-1. A expressão ifn-γ foi nula apenas para células T e APCs, demonstrando que as células T derivadas de T-iPSC humanas são específicas de antígeno e funcionais(Figura 4).
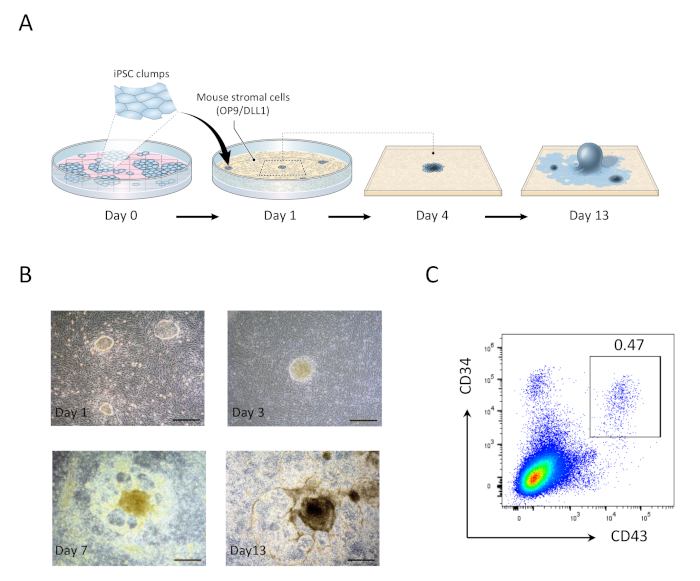
Figura 1:Geração de células progenitoras hematopoiéticas derivadas de hiPSC. A) Visão geral esquemática da diferenciação de hiPSCs para linhagem hematopoiética usando co-cultura OP9/DLL1. (B) Aparência de estruturas derivadas de hiPSC nos dias 1 (canto superior esquerdo), 3 (canto superior direito), 7 (canto inferior esquerdo) e 13 (canto inferior direito). Barras de escala = 100 μm. (C)Análise citométrica de fluxo de CD34 derivado hiPSC+CD43+ células progenitoras hematopoiéticas no dia 13. Os dados são representativos de seis experimentos independentes (n = 1 a 2). Clique aqui para ver uma versão maior deste número.
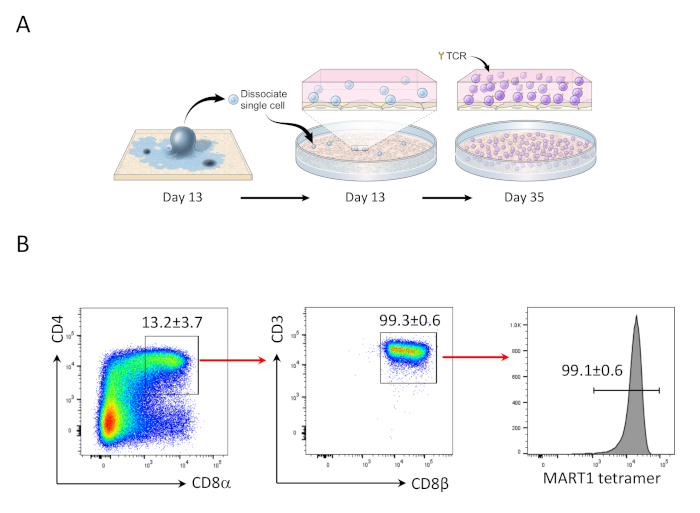
Figura 2: diferenciação hiPSC em Mart1+ CD4+CD8αβ+ DP Células T. (A)Visão geral esquemática da diferenciação da linhagem hematopoiética derivada do hiPSC para células T imaturas usando co-cultura OP9/DLL1. (B) Análise citométrica de fluxo de CD4 vs CD8α, CD3 vs CD8β e expressão tetramer MART-1 em células T derivadas de hiPSC no dia 35. Fechado em linfócitos, células individuais, PI negativo. Os dados são representativos de três experimentos independentes (n = 3 - 8). Clique aqui para ver uma versão maior deste número.
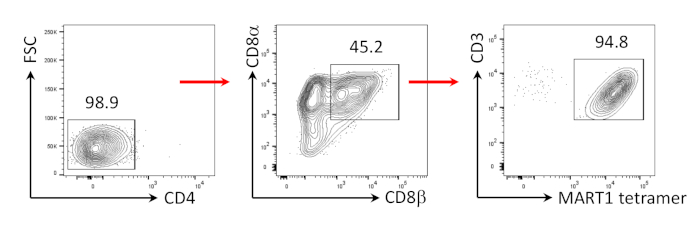
Figura 3: Indução de Fenótipo de células T CD8αβ+ SP. Análise citométrica do fluxo de CD4- células T derivadas de hiPSC 4 dias após a estimulação anti-CD3 humana e anti-CD28 humana. Fechado em linfócitos, células individuais, PI negativo (n = 4). Clique aqui para ver uma versão maior deste número.
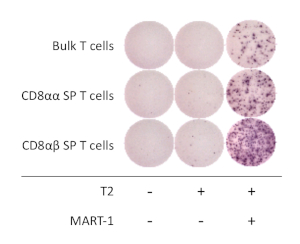
Figura 4:Especificidade do antígeno das células T CD8αβ+ SPderivadas da hiPSC. Secreção IFN-γ pelo ensaio elispot de cd8αβ+ SP derivado sp, CD8αα+ SP, e células T em massa após 20 h co-cultura com ou sem células T2 pulsadas (ou não) com peptídeo MART-1. Clique aqui para ver uma versão maior deste número.
Discussão
A co-cultura das células estromais de urina OP9 é um sistema bem estabelecido para a geração in vitro de linfócitos (ou seja, células NK, B e T) de HSPCs e células-tronco pluripotentes. A sinalização de entalhe é necessária para induzir o compromisso de linhagem T e pode ser realizada pela expressão ectópica de Notch ligand DLL1 ou DLL4, que têm eficácia comparável para a geração de células T1. Portanto, o sistema de cocultura OP9/DLL1 tornou-se um método amplamente utilizado para a produção de células T in vitro. Além disso, este método é aplicável para uso com vários tipos e fontes de células humanas, incluindo sangue do cordão umbilical, HSPCs de medula óssea e ESCs. No entanto, a geração de células T a partir dessas fontes é limitada por recuperação insuficiente de células de origem ou por diferenciação ineficiente para as células T1. Além disso, um produto de célulaS T com uma única recombinação TCR não pode ser gerado a partir dessas fontes de repertório aberto. Usando técnicas de medicina regenerativa, ou seja, induzida stemipotente stemipotente (iPSC) tecnologia, pode ser possível produzir um grande número de células T específicas de antígeno para uso em terapêutica baseada em células15.
hiPSCs são semelhantes aos ESCs pluripotentes em sua capacidade de auto-renovação, expansão ilimitada e potencial para diferenciar qualquer tipo de célula somática no corpo; no entanto, eles não têm as preocupações éticas em torno do uso de produtos de origem embrionária para aplicações clínicas. Além disso, hiPSCs podem ser produzidos a partir de qualquer célula somática, permitindo o desenvolvimento de produtos celulares para medicina personalizada. Em relatórios anteriores, hiPSCs foram produzidos a partir de células T humanas usando células mononucleares periféricas inteiras, células CD3+ ou linfócitos citotóxicos isolados (CTLs) como fonte18,19,22, 26.Quando os hiPSCs são gerados a partir de uma fonte de células T (T-iPSCs), o rearranjo original do gene TCR é herdado. Portanto, as células T derivadas do T-iPSC paciente podem fornecer um modelo para o tratamento personalizado do ACT, visando os antígenos distintos do câncer de um paciente.
A diferenciação das células-tronco pluripotentes humanas nas células de linhagem T é dividida em duas etapas: a geração de células progenitoras hematopoiéticas (HPCs)27 e sua diferenciação adicional nas células de linhagem T21. Ambas as etapas podem ser realizadas usando o sistema de co-cultura OP9/DLL1. É importante ressaltar que a qualidade das células-alimentadorope OP9/DLL1 é fundamental para o sucesso da diferenciação de células T. Como as células OP9/DLL1 não são uma linha celular homogênea imortalizada, a qualidade da FBS e as condições culturais são fundamentais para manter sua expansão sem perder a capacidade de suportar a diferenciação de hiPSC. Portanto, recomenda-se pré-avaliar o lote de FBS e passagem consistentemente quando o contato citoplasmiccélula célula-célula começa a ocorrer, a fim de evitar a diferenciação celular e senescência. Um ponto a levar em consideração é que o contato célula-célula pode parecer indistinguível do fundo, dependendo do contraste de fase e ampliação do microscópio. Em nossa experiência, a maioria dos pratos OP9/DLL1 parecerá ser 80% de confluentes quando estiverem prontos para passar.
Tem sido demonstrado que as células de linhagem T rediferenciadas geradas a partir de T-iPSCs por OP9/DLL1 co-cultura podem produzir células T CD8+ SP após estimulação18,19. No entanto, as células T CD8+ SP regeneradas adquirem o homodimer22,28,que é um coreceptor ineficaz para a sinalização de TCR29. Além disso, essas células T CD8+ SP regeneradas têm mostrado uma citotoxicidade forte independente do TCR, tornando essas células desfavoráveis para uso clínico30. Este protocolo descreve um método recente envolvendo estimulação de células CD4+CD8+ DP purificadas purificadas purificadas para gerar células T CD8αβ+ SP com fenótipo mais convencional e citotoxicidade específica de antígeno melhorada22. Embora a perda de especificidade de antígeno devido ao rearranjo alélico TCRα secundário ocorra na fase de DP após a cultura prolongada de longo prazo, isso pode ser superado pela edição do genoma em T-iPSCs31. Em nossa experiência, as células DP derivadas de hiPSC começam a aparecer no dia 30 - 35 de cultura, e essas células DP recém-geradas ainda não foram submetidas ao rearranjo tcrα secundário. Portanto, a maioria das células DP no dia 35 retêm especificidade de antígeno e podem ser usadas para gerar células T CD8αβ+ SP específicas por antígeno.
Antes da estimulação anti-CD3 humano e anti-CD28 no dia 35, as células CD4-CD8- DN devem ser removidas da cultura, pois estas foram demonstradas para causar morte direta de células CD4+CD8+ DP após estimulação22. Usando enriquecimento de contas magnéticas CD4 (passo 3.10) enriquecerá tanto para DP quanto para CD4+CD8- células médias únicas positivas (ISP)1,que nos mostraram não ter efeitos negativos22. Alternativamente, a classificação celular ativada por fluorescência por citometria de fluxo pode ser realizada para isolar as células DP. Entretanto, a separação magnética do grânulo é preferida porque evita o esforço mecânico induzido pela citometria do fluxo.
A geração de células T CD8αβ+ SP de células-tronco pluripotentes humanas sem seleção agonista mediada pela ativação foi posteriormente demonstrada pelo uso da cultura de células estromais de urina 3D32. No entanto, a seleção fisiológica positiva depende da interação do TCR com complexos auto-peptídeos-MHC, que são exclusivamente processados e apresentados por células epiteliais cortical thymic33. Além disso, a afinidade tcr para peptídeos de seleção tem sido mostrado para determinar as capacidades funcionais subseqüentes de células T CD8αβ+ SP34. Atualmente, não há nenhuma evidência para sugerir que um sistema de co-cultura baseado em células estromals notch pode fornecer o peptídeo de seleção definida e complexo de MHC necessário para a seleção fisiológica positiva.
Tem sido relatado anteriormente em um modelo de urina que as células de linhagem T geradas a partir de hiPSCs derivados de células T específicos de antígeno tumoral usando OP9/DLL1 sozinho não conseguem experimentar maturação convencional. No entanto, células T imaturas derivadas do iPSC geradas pelo sistema OP9/DLL1 podem amadurecer em células T ingênuas por mais educação fisiológica de tímico em um sistema de cultura 3D 28,35. Portanto, o protocolo apresentado aqui para produzir células T imaturas derivadas do iPSC geradas pelo sistema OP9/DLL1 é vital para novas tentativas de gerar células T pós-ténmicas específicas de antígeno humano real capazes de persistência in vivo a longo prazo eficiência para tratar tumores vascularizados estabelecidos.
Divulgações
Os autores não têm divulgações.
Agradecimentos
Agradecemos alan B. Hoofring e Erina H. Ele para assistência gráfica. Esta pesquisa foi apoiada pelo Programa de Pesquisa Intramural do Instituto Nacional do Câncer (ZIA BC010763) e pela Intramural NCI Cancer Moonshot Initiative for Cell-based Cancer Immunotherapy.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cm dish | Corning, Inc. | 353003 | |
| Anti-CD3, human | BD Biosciences | Cat# 561812, RRID:AB_1089628 | |
| Anti-CD34, human | BD Biosciences | Cat# 348791, RRID:AB_400381 | |
| Anti-CD4, human | Biolegend | Cat# 344612, RRID:AB_2028479 | |
| Anti-CD43, human | BD Biosciences | Cat# 560198, RRID:AB_1645460 | |
| Anti-CD7, human | BD Biosciences | Cat# 555361, RRID:AB_395764 | |
| Anti-CD8a, human | BD Biosciences | Cat# 555369, RRID:AB_398595 | |
| Anti-CD8b, human | BD Biosciences | Cat# 641057, RRID:AB_1645747 | |
| Anti-TCRb, human | BD Biosciences | Cat# 555548, RRID:AB_395932 | |
| CD28 human monoclonal antibody (15E8), pure functional grade | Miltenyl Biotec | 130-093-375 | |
| CD3 human monoclonal antibody (OKT3), pure functional grade | Miltenyl Biotec | 130-093-387 | |
| CD4 Microbeads, human | Miltenyl Biotec | 130-045-101 | |
| Cell strainer 100 um | Fisher Scientific | 22-363-549 | |
| Fetal Bovine Serum (FBS) | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| Gelatin Solution 2% | SIGMA-Aldritch | G1393-100ML | |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | L-Glutamine supplement |
| HBSS Mg+Ca+ Phenol-Red Free | Gibco | 14025-092 | |
| Interleukin-2 | R&D Systems | 202-IL | |
| Interleukin-7 | R&D Systems | 407-ML | |
| iTAG MHC Tetramer HLA-A*0201 Mart1 Tetramer -ELAGIGILTV | MBL | Cat#TB-0009-2 | |
| Mart1-hiPSC | Vizcardo et al., Cell Stem Cell 2013 | RIKEN-IMS | |
| Melan-A, MART 1 (26-35) | InnoPep | 3146-0100 | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| αMEM powder | Gibco | 61100061 | |
| Mouse Embryonic Fibroblasts (MEF) | Thermo Fisher Scientific | C57BL/6 MEF MITC-TREATED 4M EACH; A34962 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | OP9/DLL1 |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Primate ES Cell Medium | Reprocell | RCHEMD001 | Human ESC Culture Media |
| Rhok inhibitor (Y-27632 dihydrochloride) | Tocris | 1254 | |
| RPMI 1640 | Gibco | 11875093 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| StemPro | EZPassage | 23181-010 | |
| T2-tumor | ATCC | T2 (174 x CEM.T2) (ATCC® CRL-1992™) | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200-072 | |
| U Bottom 96 well plate | Corning, Inc. | 3799 |
Referências
- Brauer, P. M., Singh, J., Xhiku, S., Zuniga-Pflucker, J. C. T Cell Genesis: In Vitro Veritas Est. Trends in Immunology. 37 (12), 889-901 (2016).
- Rosenberg, S. A., Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 348 (6230), 62-68 (2015).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. Journal of Clinical Investigation. 115 (6), 1616-1626 (2005).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Crompton, J. G., et al. Lineage relationship of CD8(+) T cell subsets is revealed by progressive changes in the epigenetic landscape. Cellular and Molecular Immunology. 13 (4), 502-513 (2016).
- Henning, A. N., Klebanoff, C. A., Restifo, N. P. Silencing stemness in T cell differentiation. Science. 359 (6372), 163-164 (2018).
- Henning, A. N., Roychoudhuri, R., Restifo, N. P. Epigenetic control of CD8(+) T cell differentiation. Nature Reviews Immunology. 18 (5), 340-356 (2018).
- Vodnala, S. K., et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism. Science. 363 (6434), (2019).
- Restifo, N. P., Gattinoni, L. Lineage relationship of effector and memory T cells. Current Opinion in Immunology. 25 (5), 556-563 (2013).
- Tran, E., et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 344 (6184), 641-645 (2014).
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Gautam, S., et al. The transcription factor c-Myb regulates CD8(+) T cell stemness and antitumor immunity. Nature Immunology. 20 (3), 337-349 (2019).
- Klebanoff, C. A., et al. Determinants of successful CD8+ T-cell adoptive immunotherapy for large established tumors in mice. Clinical Cancer Research. 17 (16), 5343-5352 (2011).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting through subsets: which T-cell populations mediate highly effective adoptive immunotherapy. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends in Immunology. 35 (4), 178-185 (2014).
- Crompton, J. G., Rao, M., Restifo, N. P. Memoirs of a reincarnated T cell. Cell Stem Cell. 12 (1), 6-8 (2013).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Reports. 2 (6), 1722-1735 (2012).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Lo, W., et al. Immunologic recognition of a shared p53 mutated neoantigen in a patient with metastatic colorectal cancer. Cancer Immunology Research. , (2019).
- Timmermans, F., et al. Generation of T cells from human embryonic stem cell-derived hematopoietic zones. Journal of Immunology. 182 (11), 6879-6888 (2009).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Salter, R. D., Howell, D. N., Cresswell, P. Genes regulating HLA class I antigen expression in T-B lymphoblast hybrids. Immunogenetics. 21 (3), 235-246 (1985).
- Snauwaert, S., et al. In vitro generation of mature, naive antigen-specific CD8(+) T cells with a single T-cell receptor by agonist selection. Leukemia. 28 (4), 830-841 (2014).
- Takahama, Y., Suzuki, H., Katz, K. S., Grusby, M. J., Singer, A. Positive selection of CD4+ T cells by TCR ligation without aggregation even in the absence of MHC. Nature. 371 (6492), 67-70 (1994).
- Seki, T., et al. Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell. 7 (1), 11-14 (2010).
- Vodyanik, M. A., Slukvin, I. I. Hematoendothelial differentiation of human embryonic stem cells. Current Protocols in Cell Biology. , (2007).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- McNicol, A. M., et al. CD8alpha/alpha homodimers fail to function as co-receptor for a CD8-dependent TCR. European Journal of Immunology. 37 (6), 1634-1641 (2007).
- Themeli, M., Riviere, I., Sadelain, M. New cell sources for T cell engineering and adoptive immunotherapy. Cell Stem Cell. 16 (4), 357-366 (2015).
- Minagawa, A., et al. Enhancing T Cell Receptor Stability in Rejuvenated iPSC-Derived T Cells Improves Their Use in Cancer Immunotherapy. Cell Stem Cell. 23 (6), 850-858 (2018).
- Montel-Hagen, A., et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell. 24 (3), 376-389 (2019).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Takada, K., et al. TCR affinity for thymoproteasome-dependent positively selecting peptides conditions antigen responsiveness in CD8(+) T cells. Nature Immunology. 16 (10), 1069-1076 (2015).
- Vizcardo, R., et al. A Three-dimensional Thymic Culture System to Generate Murine Induced Pluripotent Stem Cell-derived Tumor Antigen-specific Thymic Emigrants. JoVE. , e58672 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados