Method Article
종양 항원 특이적 T 세포의 생성을 위한 인간 유도 만능 줄기 세포를 사용하여
* 이 저자들은 동등하게 기여했습니다
요약
이 문서에서는 OP9/DLL1 공동 배양 시스템을 사용하여 기능성 종양 항원 특이적 유도 만능 줄기 세포 유래 CD8αβ+ 단일 양성 T 세포를 생성하는 방법을 설명한다.
초록
시험관 내 기능성 T 세포의 생성 및 확장은 광범위한 임상 적용으로 이어질 수 있다. 그러한 사용 중 하나는 진행성 암 환자의 치료를위한 것입니다. 고농축 종양 항원 특이적 T 세포의 채택 T 세포 전달(ACT)은 일부 환자에서 전이성 암의 내구성 있는 회귀를 일으키는 것으로 나타났다. 그러나, 확장 하는 동안, 이러한 세포 는 소진 또는 노화 될 수 있습니다., 생체 내에서 그들의 효과 기능 및 지 속성을 제한. 유도된 만능 줄기 세포(iPSC) 기술은 분화되지 않은 종양 항원 특이적 T 세포의 많은 수의 시험관내 생성을 유도함으로써 이러한 장애물을 극복할 수 있다. 인간 iPSC(hiPSC)는 T 세포가 시작 세포로서 사용될 때 원래의 T 세포 수용체(TCR) 게놈 재배열을 유지하는 림프구를 포함한 모든 유형의 체세포로 분화하는 능력을 가진다. 따라서, 인간 종양 항원 특이적 T 세포를 hiPSC로 재프로그래밍한 후 T 세포 계보로 재분화하여 회춘된 종양 항원 특이적 T 세포를 생성할 수 있는 잠재력을 갖는다. 여기서 기재된 것은 OP9/DLL1 공동 배양 시스템을 사용하여 hiPSC로부터 종양 항원 특이적 CD8αβ+ 단일 양성(SP) T 세포를 생성하는 방법이다. 이 방법은 시험관 내 T 세포 계보 생성을위한 강력한 도구이며 재생 의학 및 세포 기반 치료에 사용하기 위한 시험관 내 유래 T 세포의 개발을 용이하게 합니다.
서문
생리적 이점 외에도 T 세포에는 많은 잠재적 치료 적 응용 프로그램이 있습니다. 시험관 내 T 세포의 생성 및 확장은 유전 및 후천성 면역 결핍 상태에 대한 치료 소스뿐만 아니라 질병 모델링 및 치료 검증에 사용될 수 있다(즉, 바이러스 성 면역 결핍 및 림프흡기 이차 화학 요법 또는 이식) 및 암 박멸. 이러한 후자의 질은 진행성 암 환자의 치료를 위한 입양 T 세포 전달(ACT)의 개발로이어졌습니다 1.
ACT는 환자의 종양을 절제하고, 종양 침투 림프구 (TILs)를 추출하고, EX vivo를 확장한 다음 확장 된 세포를 환자2로재주입하는 것으로 구성됩니다. 그것은 전이성 암 일부 환자에 대 한 효과적인 치료 양식 표시 되었습니다. 불행히도 모든 환자가이 치료에 반응하는 것은 아닙니다. 이전 보고서는 전송 된 세포의분화 상태가3,4,5,6,7,8,9,다수 사용으로 나타났습니다. 고농축암 항원 특이적T세포(10)의경우, 전이 후 T세포의지속성(11),12는 모두 보다 튼튼한반응(13,14)과상관된다. 따라서 ACT가 항종양 반응을 유도하지 못할 경우, 부분적으로 암 항원 특이적 T 세포의 낮은 수율, 반응성 클론의 고갈 및 손실로 이어지는 비효율적인 생체 내 확장, 또는 전사 후 지속성 부족으로 인한 것일 수 있습니다4 . 이러한 장애물은 시험관 내 의 덜 분화된 암 항원 특이적 T 세포의 다수 생성에 의해 극복될 수 있다고 가정되어왔다 15,16.
조혈 줄기/전구 세포(HSPC)는 시험관 내 T 세포 생성을 위한 통상적인 공급원이지만, 이 방법은 단일 공여자1로부터회수될 수 있는 소수의 세포에 의해 제한된다. 배아 줄기 세포 (ESCs)는 또한 T 세포를 생산하는 것으로 나타났지만 수율이낮은 17로임상 응용 프로그램에비효율적입니다. 또한, T 혈통 세포는 초기 발달 단계에서 T 세포 수용체 (TKR)의 상위 유전 재조합을 경험하기 때문에, 추가 게놈없이 항원 특이적 T 세포의 순수한 집단을 생성하는 HSPC 또는 ESC를 사용하는 것은 불가능합니다. TCR 유전자 전과 같이 수정.
이러한 주의사항을 극복하기 위한 한 가지 접근법은 인간 유도 만능 줄기 세포(hiPSCs)에 TI를 다시 프로그래밍하는 것으로, 이는 시험관 내 T 세포 생성을 위한 무한한 공급원을 제공할 수 있다. 암 항원 특이적 TIL은 hiPSCs로 재프로그래밍되고 T 세포 리니지로 재분화될 수 있으며, 이는 원래 T 세포18,19와동일한 T 세포 수용체(TCR) 유전자 재배열을 유지하는 것으로 나타났다. 개별적인 환자 종양에는 독특한 돌연변이 단면도가 있고, 아주 몇몇 암 항원이 환자20사이에서 공유되는 것을 보였기 때문에 이 세부사항은 ACT를 위해 중요합니다. 따라서, hiPSC 유래 T 세포의 시험관 내 생성을 위한 공급원으로 암 항원 특이적 TILs를 사용하여 전이성 암을 가진 환자의 개인화된 처리를 위한 새로운 전략을 제공할 수 있다.
여기서 상세히 제시된 것은 OP9/DLL1 공동 배양 시스템을 사용하여 hiPSC 유래 T 혈통 세포를 기능성 항원 특이적 CD8αβ+ 단일 양성(SP) T 세포로 분화시키는 프로토콜이다. 이 방법은 hiPSCs, 조혈 전구체 및 배아 줄기 세포의 체외 T 세포 분화를위한 강력한 도구이며 재생 의학 및 세포 기반 치료법에서추가 적용됩니다.
프로토콜
1. 마우스 배아 섬유 아세포 (MEF)에 인간 iPSCs (hiPSCs) 배양
참고: hiPSCs배양에 대한 대체 방법은 또한 사용될 수 있다: 젤라틴으로 미리 코팅된 6개의 웰 플레이트상에 시드, 젤라틴 단백질 혼합물, 재조합 라미닌 511, 또는 hiPSC 확장에 사용되는 임의의 다른 세포외 매트릭스, 및 인간 다능성 줄기 세포 배양을 위해 특별히 제조 된 정의 된 미디어를 사용하여 배양.
-
MEF 배양
- 10 cm 세포 배양 페트리 접시를 0.1% 젤라틴 4 mL로 코팅하고 37°C에서 30분 동안 배양한다.
- 37°C MEF 매체의 10 mL로 4 x 106의 유리병을 빠르게 해동시주세요(DMEM + 10% FBS + 1x 페니실린-스트렙토마이신 + 1x L-글루타민 보충제). 4 °C에서 5 분 동안 300 x g에서 원심 분리기. 상월체를 흡인하고 MEF 매체의 9 mL에서 세포 펠릿을 재중단시켰다.
- 인큐베이터에서 젤라틴 코팅 접시를 제거합니다. 젤라틴을 흡인하고 MEF 미디어 7 mL을 추가합니다. MEF 서스펜션의 플레이트 3 mL (단계 1.1.2에서) 젤라틴 코팅 접시에. 접시를 좌우로, 앞뒤로 흔들어 서 MEF를 접시 위에 고르게 분배합니다. 8-36 시간 동안 37 °C에서 배양하십시오.
-
MEF에서 hiPSC 통과
참고: 데이터는 앞서 설명한18에서와 같이 HLA-A*02:01의 맥락에서 MART-1 펩티드를 구체적으로 인식하는 장기 배양 흑색종 TIL에서 파생된 MART-1 iPSC를 사용하여 생성되었다.- 콜로니가 직경이 0.8 - 1.2 mm 사이일 때 통로 hiPSCs. 통과하기 전에, 스테레오 현미경으로 hiPSC 콜로니를 확인하고 200 μL 팁의 플라스틱 가장자리를 사용하여 배양에서 분화의 모든 영역을 제거합니다.
- 흡기 는 10 mL hiPSC 배지 (인간 ES 배양 배지 [재료표]+ 10 ng/mL 인간 기본 섬유아세포 성장 인자 [hbFGF]]를 10 μM ROCK 억제물로 보충하였다.
- 한 손에 세포 배양 접시를 잡고 일회용 셀 패시징 도구를 한 방향으로 전체 접시에 걸쳐 굴려. 롤러 블레이드 전체가 배양 접시에 닿을 수 있도록 충분한 압력을 가하고 롤링 동작 중에 균일한 압력을 유지합니다.
- 배양 접시를 90° 회전시키고 1.2.3단계를 반복합니다. 현미경으로 판을 보고 선별된 것처럼 보이는 식민지의 적절한 절단을 시각적으로 확인합니다. 200 μL 파이펫을 사용하여 부드러운 기계적 플러싱으로 식민지를 분리합니다.
참고: 기계적 홍조에 의한 절단 식민지의 분리는 3 분 후 절단 식민지가 접시에 다시 부착하기 시작하기 때문에, 롤러로 식민지를 절단 한 직후 수행해야하며, 플러싱에 의해 균일 한 크기의 식민지를 분리하기 가 어려워질 것입니다. - 10 μM ROCK 억제제와 함께 10 mL의 신선한 hiPSC 매체로 350 - 600 덩어리의 절단 콜로니를 MEF의 새로운 10cm 접시 (hiPSC 패싱 전에 8 - 36 시간 도금)로 옮김. 37 °C에서 배양하십시오.
참고: 600 개의 덩어리는 약 1.0 x 106 MART-1 iPSC를 나타내며 35 일째에는 0.5-1.0 x 106 DP 셀을 생성합니다. 그러나, 예상된 수치는 시작 세포주 및 배양 조건의 효능에 따라 달라질 것이다. - 다음 날, 흡인은 미디어를 소비하고 신선한 hiPSC 미디어의 10 mL를 추가합니다. hiPSC 성장률에 따라 1-2일마다 hiPSC 미디어를 변경합니다.
2. HIPSCs와 공동 배양OP9/DLL1 셀 의 준비
- OP9 배지에서 배양 OP9/DLL1 세포 [α-최소 필수 배지 (α-MEM) + 20% 태아 소 혈청 (FBS) + 1x 페니실린-스트렙토마이신] 37°C. OP9/DLL1 세포가 합의에 도달하면, 흡인제와 1x 마그네슘, 칼슘 및 페놀 무홍 인산염 완충식염수(PBS)의 5 mL로 한 번 세척합니다.
- PBS를 흡인하고 0.05 % 트립신 -EDTA의 2 mL을 추가합니다. 37 °C에서 5 분 동안 배양하십시오. 그런 다음 OP9 매질 4 mL을 추가하고 피펫팅을 하여 세포 층을 기계적으로 해리시켜 단일 셀 현탁액을 만듭니다.
- 세포 뭉침을 피하기 위해 100 μm 세포 스트레이너를 통해 50 mL 원추형 튜브로 세포 현탁액을 옮김을 전달합니다. 4 °C에서 5 분 동안 300 x g에서 원심 분리기. OP9 미디어의 12 mL에서 상급을 흡인하고 다시 일시 중단합니다.
- 6개의 새로운 10cm 세포 배양 페트리 접시각각에 8 mL의 OP9 배지를 추가합니다. 2.3 단계에서 OP9/DLL1 셀 현탁액의 플레이트 2 mL를 각 새로운 10cm 접시에. 접시를 좌우로 흔들고 앞뒤로 흔들어 접시에 OP9/DLL1을 균일하게 분배합니다.
- 37 °C에서 배양하십시오. 세포가 합류에 도달할 때 2 - 3 일마다 반복합니다.
참고: OP9/DLL1 셀의 충분한 냉동 재고를 만들고 4-6 주마다 새로운 주식을 해동하는 것이 중요합니다.
3. 시험관 내 HIPSCs를 CD8αβ+ 단일 양성(SP) T 세포로 분화
- hipsCs와 공동 배양하기 일주일 전에 젤라틴화된 OP9/DLL1 요리를 준비합니다. 0.1% 젤라틴 용액을 준비하려면 5 mL의 실온 (RT) 조직 등급 스톡 젤라틴 용액을 PBS 500 mL에 추가하십시오.
- 3개의 새로운 10cm 세포 배양 페트리 접시를 접시당 0.1% 젤라틴의 4 mL를 첨가하였다. 37 °C에서 30 분 배양.
- 젤라틴을 흡인하고 각 접시에 OP9 용지 8 mL을 추가합니다. OP9/DLL1(위의 섹션 2에서 와 같이)의 한 가지 동시 접시를 3개의 젤라틴 사전 코팅 접시로 통로로 처리합니다.
- 4일 후, 젤라틴에 OP9/DLL1의 각 10cm 접시에 OP9 용지 10 mL을 추가하여 접시당 총 20 mL의 미디어를 사용하십시오.
- 7-8일 후, OP9/DLL1 동시 접시(분화일 0)에서 hiPSC 공동 배양을 시작한다.
- 흡인은 MEF에 hipsCs의 confluent 10cm 접시에서 미디어를 보냈다. OP9 용지의 10mL를 추가합니다. 1.2.3 단계 및 1.2.4 단계에서 수행 된 일회용 셀 패싱 도구를 사용하여 hiPSC 콜로니를 잘라 내고 분리합니다.
- 200 μL 파이펫을 사용하여 10 mL의 신선한 OP9 용지와 함께 10cm 미리 젤라틴화 OP9 / DLL1 접시 (단계 3.1)에 절단 콜로니 의 350 - 600 덩어리를 전송합니다. 배양 접시를 좌우로 흔들고 앞뒤로 흔들어 식민지의 균일한 분포를 보장합니다.
참고: 대안적으로, 미리 형성된 hiPSC 배아체(EBs) 또는 작은 덩어리 현탁액이 사용될 수 있다. 그러나, 일회용 셀 패싱 툴 또는 EB 형성 시스템의 사용은 균일한 크기의 hiPSC 덩어리를 생산하는 것이 바람직하다.
- 1일째, 흡인은 미디어를 소비하고 신선한 OP9 미디어 20 mL로 교체했습니다. 1일 동안 OP9/DLL1에 공동 배양된 hiPSC 덩어리는 작은 둥근 단층 콜로니로나타납니다(그림 1).
- 5일째에는 10mL의 소비 매체를 흡인하고 신선한 OP9 용지 10mL를 추가합니다. hiPSC 식민지는 다층 어두운 중심을 특징으로하는 원시 중미로 분화하기 시작합니다.
- 9일째에는 10mL의 소비 매체를 흡인하고 신선한 OP9 미디어를 10mL 추가합니다. 이 시점에서 다층 중심 구조는 돔 모양으로 진화하고 주변 네트워크와 같은 영역이 분명해지기 시작합니다.
- 13일째에 조혈 전구 세포(HPC)를 수확합니다(그림 1). 13일째에 hiPSC 유래 구조는 돔과 같은 영역의 네트워크로 둘러싸인 어두운 중앙 오르가노이드를 특징으로 하며, 이전에 인간 배아 줄기 세포 유래 조혈 전구체를 둘러싸고 있다고 보고된 조혈 영역(HZs)을 대표합니다. 21.
참고: 돔형 구조물이 존재하면 어두운 중심이 없는 경우에도 성공적인 공정을 나타냅니다. CCC를 생산하는 무능력은 OP9/DLL1의 품질 저하, FBS 로트 품질, OP9/DLL1(350-600 덩어리)에 시드된 iPSC 덩어리의 합류, 및/또는 조혈 전구체를 생산하기 위한 iPSC 라인의 효능 의 변화로 인한 것일 수 있습니다.- 흡인은 칼슘과 마그네슘(HBSS)으로 변형된 1x 페놀 무첨가 행크스의 균형 잡힌 소금 용액 5 mL로 미디어를 소비하고 1x를 세척하였다.
- HBSS를 흡인하고 HBSS 10 mL에 5000 단위/mL 콜라게나아제 IV 250 μL을 추가합니다. 37°C에서 45분 동안 배양합니다.
- PBS를 흡인하고 0.25 % 트립신 -EDTA의 5 mL을 추가합니다. 37°C에서 20분 동안 배양합니다. 이어서, OP9 매질 4 mL을 첨가하고 단일 셀 현탁액을 만들기 위해 파이펫팅하여 세포 층을 해리한다.
- 100 μm 세포 스트레이너를 통해 50 mL 원점 튜브로 세포 현탁액을 전송합니다. 4 °C에서 5 분 동안 300 x g에서 원심 분리기. OP9 미디어의 10 mL에서 상급을 흡인하고 다시 일시 중단합니다.
- 새로운 젤라틴화된 10 cm 세포 배양 페트리 접시 상에 플레이트 세포 현탁액(단계 3.1.1 및 3.1.2 참조). 37°C에서 45분 동안 배양합니다. 그런 다음 부드러운 파이펫팅으로 비 부착 세포를 수집합니다.
- 수집된 세포 현탁액을 100 μm 세포 스트레이너를 통해 50 mL 원점 튜브로 이송한다. 4 °C에서 5 분 동안 300 x g에서 원심 분리기. 분화 매체의 10 mL에서 상피 및 재중단 [OP9 5 ng/mL 인간 줄기 세포 인자 (hSCF), 5 ng/mL 인간 Flt3 리간드 (hFLT3L), 및 5 ng/mL 인간 인터류핀 7 (hIL-7)].
- 셀 서스펜션을 새로운 10cm OP9/DLL1 동시 접시에 접시에 놓습니다.
- 16 일째에 세포를 통과시다.
- 100 μm 셀 스트레이너를 통해 부드러운 파이펫팅 및 필터에 의해 기계적으로 부착되지 않은 세포를 분리합니다. 4 °C에서 5 분 동안 300 x g에서 원심 분리기. 상월체를 흡인하고 10 mL 분화 매체에서 재중단한다.
- 셀 서스펜션을 새로운 10cm OP9/DLL1 동시 접시에 접시에 놓습니다.
- 그 후 5-7일마다 3.8단계를 반복하여 비부착 세포를 계속 통과시다.
- 35일째에,CD4+CD8+ 이중 양성(DP) 집단을 풍부하게 하고 CD8αβ+ SP T 세포를 생성하도록 자극한다(그림 2).
- 100 μm 세포 스트레이너를 통해 부드러운 파이펫팅및 필터에 의해 비부착 세포를 기계적으로 분리하여 세포 덩어리를 제거합니다. 제조업체의 프로토콜에 따라 CD4 자기 비드 절연에 의해 CD4+ 세포 집단을 풍부하게 합니다.
참고: CD4 자기 비드를 사용하기 위한 근거는CD4-CD8-DN세포를 배양으로부터 제거하는 것이며, 이들은 자극 후 CD4+ CD8+ DP 세포의 직접적인 살해를 유발하는 것으로 입증되었다22. - Neubauer 혈세포계 및 트리판 블루 염료를 사용하여 살아있는 CD4 농축 세포를 계산합니다. 총 농도 0.5 x 106 세포/mL에서 OP9 용지에 중단합니다. 세포 현탁액의 1 mL(0.5 x 106 세포)을 조직 배양 플랫 하부 24웰 플레이트의 각 웰 내로 결합OP9/DLL1의 웰 플레이트.
- 100 IU 인간 인터류키틴 2(hIL-2), 5 ng/mL hIL-7, 500 ng/mL 항인간 CD3 항체, 2 μg/mL 항인간 CD28 항체를 추가한 다음 37°C에서 배양합니다.
- 자극 후 4일째-7일째에, 분자 분석을 위한 세포를수집(도 3)또는 펩티드 펄스 항원 제시 세포(APC)와 공동 배양한다.
- 100 μm 세포 스트레이너를 통해 부드러운 파이펫팅및 필터에 의해 비부착 세포를 기계적으로 분리하여 세포 덩어리를 제거합니다. 제조업체의 프로토콜에 따라 CD4 자기 비드 절연에 의해 CD4+ 세포 집단을 풍부하게 합니다.
4. hiPSC 유래 CD8αβ+ SP T 세포의 항원 특이성 측정
참고: 이러한 엑세지먼트에 사용되는 APC의 유형은 hiPSC 유래 T 세포의 MHC 제한에 의존한다. 여기서, T2 세포주가 사용되며, 이는 T 및 B 림프구성 세포주의 하이브리드이다. T2 세포는 HLA-A*02:0123을발현하며, 이는 MART1-iPSC가18에서파생된 JKF6 세포에 의해 인식된다. 이 T2 세포주 RPMI 1640 + 20% FBS + 1x 페니실린-스트렙토마이신에서 확장될 수 있으며 세포가 5 x 105 세포/mL의 밀도에 도달할 때 통과됩니다.
- 살아있는 HLA-A*02:01+ T-B 하이브리드 림프구성 T2 세포는 Neubauer 혈세포계와 트리판 블루 염료를 사용한다. 37°C에서 2시간 동안 1 μg/mL MART-1 펩티드로 24개의 웰 조직 배양 플레이트에서 APC를 배양하였다.
참고: 최적의 펩타이드 농도는 세포주 및 항원 특이성에 따라 가변적이다. - APC를 수집하고 10 mL의 PBS로 2x를 세척하여 여분의 펩티드를 제거합니다.
- APC를 계산하고 OP9 미디어에서 100 IU IL-2 및 5 ng/mL IL-7로 2 - 5 x 105 셀/mL에서 중단합니다. Aliquot 100 μL의 셀 서스펜션(2-5 x 104 세포)을 각각의 웰 내로 초저 부착 U 하부 96 웰 플레이트 또는 미리 코팅된 ELISpot 플레이트내로 직접 넣는다.
- hiPSC 유래 CD8αβ+ SP T 세포(항인간 CD3/CD28 항체 자극 후 1주일)를 세포 선별기를 사용하여 100 IU IL-2 및 5 ng/mL IL-7로 OP9 매체에서 1 x 106 세포/mL에서 중단한다. Aliquot 100 μL의 세포 현탁액(1 x 105 세포)을 37°C에서 16-20시간 동안 각각의 AFC 및 배양물 내로 내보훈한다.
- 16-20시간 후, 제조사의 프로토콜에 따라 ELISpot 분석에 의한 사이토카인 분비 프로파일을 분석한다(도4).
결과
OP9/DLL1과 13일 hiPSCs 공동 배양 후, CD34+ CD43+ 조혈 전구 세포가 나타났다(도1). hSCF, hFLT3L 및 hIL-7의 존재에서 비젤라틴화 OP9/DLL1에 대한 배양의 추가 22일 후, 조혈 전구체는CD3+ CD7+ CD4+ CD8+ 이중 양성(DP) T 계보 세포로 분화하였다. 대부분은 MART-1 에피토프(tetramer)에 특이적인 TCR을 표현하였다(그림2).
이전에는CD8+ SP T 세포가 주작동근 펩티드 또는 항체 구동 TCR 자극을 통한 TCR 신호에 의해CD4+CD8+ DP T 세포로부터 유도될 수 있음을 나타내었다24,25. 따라서, 배양 35일째에, hiPSC 유래CD4+CD8+ DP T 세포를 hIL-7 및 hIL-2의 존재 에서 항인간 CD3 및 항인간 CD28 항체로 자극하였다. 자극 4일 후,CD3+CD8αβ+ SP 세포의 수가 급격히 증가하고 MART-1 에피토프에 대해 특이적으로 남아, 그들의 상속된 항원 특이성의 보존을 확인하였다(도3).
hiPSC 유래 CD8αβ+ SP T 세포의 기능적 특성을 확인하기 위해, 인터페론 감마(IFN-γ)의 항원 의존적 활성화 및 분비를 분석하였다. 항인간 CD3 및 항인간 CD28 항체를 1주일 동안 자극한 후, hiPSC 유래 CD8αβ+ SP T 세포를 세포 선별기를 사용하여 분리하고 HLA-A*02:01을 발현하는 T2 세포주와 공동 배양하거나 16-20시간 동안 MART1 펩티드를 조축하지 않고 배양하였다. ELISpot 분석은 HIPSC 유래 CD8αβ+ SP T 세포가 MART-1 펩티드의 존재 에서 배양될 때 CD8α+ SP T 세포에 비해 더 많은 양의 IFN-γ를 분비한다는 것을 밝혔다. IFN-γ 발현은 T 세포 및 APC 단독에 대해 null이었으며, 인간 T-iPSC 유래 T 세포가 항원 특이적이고 기능적임을 입증하였다(도4).
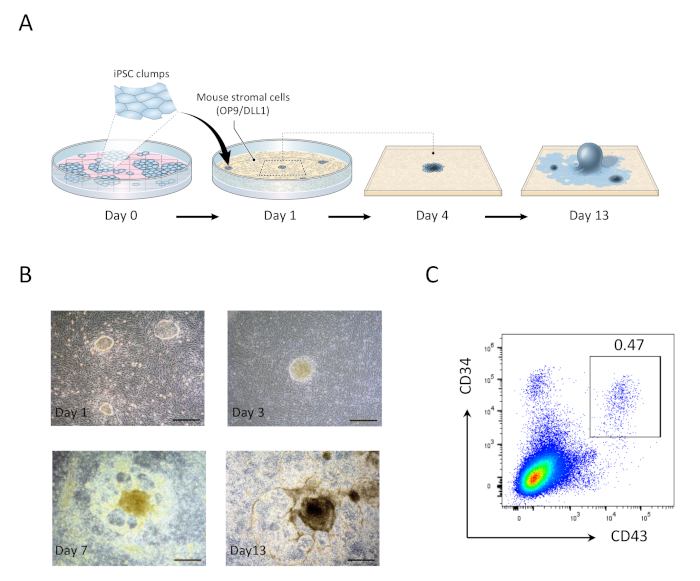
그림 1: hiPSC 유래 조혈 전구 세포의 생성. (A)OP9/DLL1 공동 배양을 사용하여 hipsCs에서 조혈 계보로의 차별화에 대한 개략적 개요. (B)1일(왼쪽 위), 3일(오른쪽 위), 7(왼쪽 아래), 13(오른쪽 아래)의 hiPSC 파생 구조물의 모양. 스케일 바 = 100 μm.(C)13일째에 HIPSC 유래 CD34+CD43+ 조혈 전구 세포의 유동 세포 분석. 데이터는 6개의 독립적인 실험(n= 1~2)을 대표한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
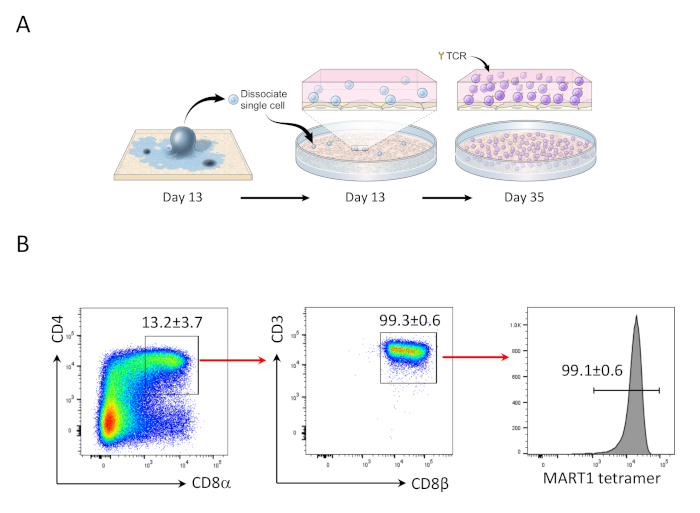
도 2: hiPSC를 Mart1+ CD4+CD8αβ+ DP T 세포로 분화한다. (a)OP9/DLL1 공동 배양을 사용하여 미성숙 T 세포로 hiPSC 유래 조혈 혈통의 분화에 대한 개략적 개요. (B)35일째에 HIPSC 유래 T 세포에서 CD4 대 CD8α, CD3 대 CD8β, 및 MART-1 테트라머 발현의 유동 세포분석. 림프구, 단일 세포, PI 음성에 게이트. 데이터는 3개의 독립적인 실험(n=3 - 8)을 대표한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
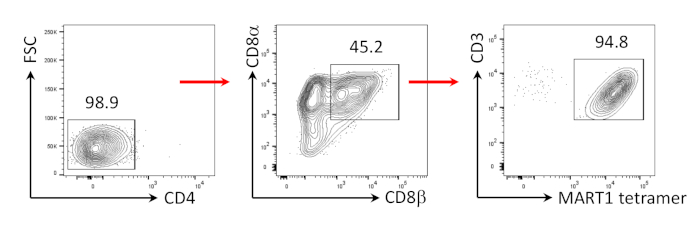
그림 3: CD8αβ+ SP T 세포 표현형의 유도. CD4의 유세포분석-hiPSC 유래 T 세포는 인간 항-CD3 및 인간 항-CD28 항체 구동 자극 후 4일 후에. 림프구, 단일 세포, PI 음성 (n = 4)에 게이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
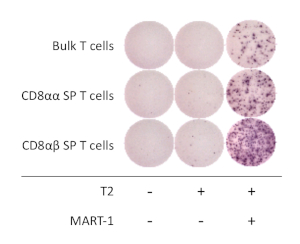
도 4: hiPSC 유래 CD8αβ+ SP T 세포의항원 특이성. IFN-γ 분비는 HIPSC 유래 CD8αβ+SP, CD8αα+ SP, 및 20시간 후 의 벌크 T 세포에 의한 ELISpot 분석에 의한 분비물 및 20시간 후 의 T2 세포 펄스(또는 아님)를 MART-1 펩티드로 펄스하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
OP9 뮤린 기질 세포의 공동 배양은 HSPC 및 다능성 줄기 세포로부터 림프구 (즉, NK, B 및 T 세포)의 체외 생성을위한 잘 확립 된 시스템입니다. 노치 시그널링은 T 계보 투입을 유도하는 데 필요하며 T 세포 생성1에대해 유사한 효능을 가지는 노치 리간드 DLL1 또는 DLL4의 자궁경화 발현에 의해 달성될 수 있다. 따라서, OP9/DLL1 공동 배양 시스템은 시험관 내에서 T 세포를 제조하는 데 널리 사용되는 방법이 되었다. 또한, 이 방법은 제대혈, 골수 HSPC 및 ESC를 포함한 여러 유형의 인간 세포 공급원과 함께 사용하기에 적용가능하다. 그러나, 이들 공급원으로부터의 T 세포의 생성은 소스 셀의 불충분한 검색에 의해 또는 T 세포1에대한 비효율적인 분화에 의해 제한된다. 또한 단일 TCR 재조합을 가진 T 세포 제품은 이러한 개방레퍼토리 소스에서 생성될 수 없습니다. 재생 의학 기술, 즉 유도만능 줄기세포(iPSC) 기술을 이용하여, 세포기반치료제(15)에사용하기 위한 항원 특이적 T 세포의 대량을 생산할 수 있다.
hiPSCs는 자기 갱신을 위한 그들의 수능 ESCs와 유사합니다, 무한한 확장, 및 바디에 있는 체세포의 어떤 모형으로 분화하는 가능성; 그러나, 그(것)들은 임상 신청을 위한 배아 기원의 제품의 사용을 둘러싼 윤리적인 관심사가 부족합니다. 또한, hiPSCs는 모든 체세포에서 생산 될 수 있으므로 맞춤형 의학을위한 세포 제품의 개발을 가능하게합니다. 이전 보고서에서, hiPSCs는 전체 말초 단핵 세포, CD3+ 세포, 또는 분리 된 세포 독성 T 림프구 (CTL)를소스18,19,22를사용하여 인간 T 세포로부터생산되었습니다. 26. HiPSCs가 T 세포 공급원 (T-iPSCs)에서 생성될 때, 원래 TCR 유전자 재배열은 승계됩니다. 따라서, 환자 T-iPSC 유래 T 세포는 환자의 뚜렷한 암 항원을 표적화시킴으로써 개인화된 ACT 치료를 위한 모델을 제공할 수 있다.
인간 다능성 줄기세포를 T계보세포로 분화시키는 것은 조혈전구세포(27)의 생성과 이들의 추가 분화T계보(21)로 구분된다. 두 단계 모두 OP9/DLL1 공동 문화 시스템을 사용하여 수행할 수 있습니다. 중요한 것은 OP9/DLL1 피더 셀의 품질이 T 세포 분화의 성공에 매우 중요하다는 것입니다. OP9/DLL1 세포는 불멸의 균질세포주이기 때문에, FBS 및 배양 조건의 질은 hiPSC 분화를 지원하는 능력을 잃지 않고 그들의 확장을 유지하는 데 매우 중요합니다. 따라서 세포 간 세포질 접촉이 발생하기 시작할 때 세포 간 세포 분화 및 노화를 방지하기 위해 FBS 및 계통과의 많은 것을 일관되게 평가하는 것이 좋습니다. 고려해야 할 한 가지 사항은 현미경의 위상 대비 및 배율에 따라 세포 간 접촉이 배경과 구별할 수 없다는 것입니다. 우리의 경험에서, 대부분의 OP9/DLL1 요리는 통과 할 준비가되면 80 % 더 많은 것으로 나타납니다.
OP9/DLL1 공동 배양에 의해 T-iPSC로부터 생성된 재분화 T 혈통 세포는 자극 시CD8+ SP T 세포를 생성할 수 있는 것으로 나타났다18,19. 그러나, 재생성 된 CD8+ SP T 세포는 TCR 신호(29)에대한 비효율적인 공동 수용체인 선천적 CD8α 호모디머22,28을획득한다. 추가적으로, 이들재생CD8+ SP T 세포는 강력한 TCR-독립적인 세포 독성을 보였으며, 이들 세포는 임상적 사용에 불리한30. 이 프로토콜은 보다 통상적인 표현형 및 개선된 항원 특이적 세포독성22를가진 CD8αβ+ SP T 세포를 생성하기 위해 정제된 CD4+ CD8+ DP 세포의 자극을 수반하는 최근의 방법을 설명한다. 이차 TCRα 에 의한 항원 특이성의 손실은 장기간 배양 후 DP 단계에서 발생하지만, 이는 T-iPSCs31에서게놈 편집에 의해 극복될 수 있다. 우리의 경험에서, hiPSC 유래 DP 세포는 배양의 30-35일째에 나타나기 시작하고, 이들 새로 생성된 DP 세포는 아직 이차 TCRα 재배열을 거치지 않았다. 따라서, 35일째에 대부분의 DP 세포는 항원 특이성을 유지하고 항원 특이적 CD8αβ+ SP T 세포를 생성하는데 사용될 수 있다.
35일째에 인간 항-CD3 및 항-CD28 자극에 앞서, CD4-CD8-DN 세포는 자극 후 CD4+ CD8+DP 세포의 직접적인 살해를 유발하는 것으로 입증되었기 때문에 배양으로부터 제거되어야 한다22. CD4 자기 비드 농축(단계 3.10)을 사용하면 DP 및CD4+CD8-중간 단일 양성(ISP) 세포1모두에 대해 농축될 것이며, 이는22에부정적인 영향을 받지 않는 것으로 나타났다. 대안적으로, 유세포측정에 의한 형광 활성화 세포 선별은 DP 세포를 분리하기 위해 수행될 수 있다. 그러나, 자기 비드 분리는 유세포측정에 의해 유도된 기계적 응력들을 피하기 때문에 바람직하다.
활성화 매개 작용제 선택 없이 인간 다능성 줄기 세포로부터 CD8αβ+ SP T 세포의 생성은 3D 뮤린 기질 세포배양(32)의사용에 의해 이후에 입증되었다. 그러나, 생리학적 양성 선택은 TCR과 자가 펩티드-MHC 복합체의 상호작용에 의존하며, 이는 흉선 피질 상피세포(33)에의해 유일하게 처리되고 제시된다. 더욱이, 선택 펩티드에 대한 TCR 친화도는 성숙한 CD8αβ+ SP T세포(34)의후속 기능 적 기능을 결정하는 것으로 나타났다. 현재, 노치 기질 세포 기반 의 공동 배양 시스템이 생리학적 양성 선택에 필요한 정의된 선택 펩티드 및 MHC 복합체를 제공할 수 있다는 증거는 없다.
그것은 이전에 종양 항원 특이적 T 세포 유래 hiPSCs에서 생성된 T 혈통 세포가 OP9/DLL1를 사용하여 단독으로 전통적인 성숙을 경험하지 못한다는 것을 murine 모형에서 보고되었습니다. 그러나, OP9/DLL1 시스템에 의해 생성된 iPSC 유래 미성숙 T 세포는 3D 배양 시스템(28,35)에서추가의 생리학적 흉선 교육에 의해 순진한 T 세포로 성숙할 수 있다. 따라서, OP9/DLL1 시스템에 의해 생성된 iPSC 유래 미성숙 T 세포를 생산하기 위해 여기에 제시된 프로토콜은 생체 내에서 장기간 지속가능한 실제 인간 종양 항원 특이적 포스트 백성 T 세포를 생성하는 추가 시도에 필수적이다. 확립 된 혈관 화 종양을 치료하는 효율성.
공개
저자는 아무런 공개가 없습니다.
감사의 말
앨런 비 후프링과 에리나 H에게 감사드립니다. 그는 그래픽 지원을 위해. 이 연구는 국립 암 연구소의 교내 연구 프로그램 (ZIA BC010763)과 세포 기반 암 면역 요법을위한 교내 NCI 암 문샷 이니셔티브에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10 cm dish | Corning, Inc. | 353003 | |
| Anti-CD3, human | BD Biosciences | Cat# 561812, RRID:AB_1089628 | |
| Anti-CD34, human | BD Biosciences | Cat# 348791, RRID:AB_400381 | |
| Anti-CD4, human | Biolegend | Cat# 344612, RRID:AB_2028479 | |
| Anti-CD43, human | BD Biosciences | Cat# 560198, RRID:AB_1645460 | |
| Anti-CD7, human | BD Biosciences | Cat# 555361, RRID:AB_395764 | |
| Anti-CD8a, human | BD Biosciences | Cat# 555369, RRID:AB_398595 | |
| Anti-CD8b, human | BD Biosciences | Cat# 641057, RRID:AB_1645747 | |
| Anti-TCRb, human | BD Biosciences | Cat# 555548, RRID:AB_395932 | |
| CD28 human monoclonal antibody (15E8), pure functional grade | Miltenyl Biotec | 130-093-375 | |
| CD3 human monoclonal antibody (OKT3), pure functional grade | Miltenyl Biotec | 130-093-387 | |
| CD4 Microbeads, human | Miltenyl Biotec | 130-045-101 | |
| Cell strainer 100 um | Fisher Scientific | 22-363-549 | |
| Fetal Bovine Serum (FBS) | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| Gelatin Solution 2% | SIGMA-Aldritch | G1393-100ML | |
| GlutaMAX (100X) | Thermo Fisher Scientific | 35050-061 | L-Glutamine supplement |
| HBSS Mg+Ca+ Phenol-Red Free | Gibco | 14025-092 | |
| Interleukin-2 | R&D Systems | 202-IL | |
| Interleukin-7 | R&D Systems | 407-ML | |
| iTAG MHC Tetramer HLA-A*0201 Mart1 Tetramer -ELAGIGILTV | MBL | Cat#TB-0009-2 | |
| Mart1-hiPSC | Vizcardo et al., Cell Stem Cell 2013 | RIKEN-IMS | |
| Melan-A, MART 1 (26-35) | InnoPep | 3146-0100 | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| αMEM powder | Gibco | 61100061 | |
| Mouse Embryonic Fibroblasts (MEF) | Thermo Fisher Scientific | C57BL/6 MEF MITC-TREATED 4M EACH; A34962 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | OP9/DLL1 |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Primate ES Cell Medium | Reprocell | RCHEMD001 | Human ESC Culture Media |
| Rhok inhibitor (Y-27632 dihydrochloride) | Tocris | 1254 | |
| RPMI 1640 | Gibco | 11875093 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| StemPro | EZPassage | 23181-010 | |
| T2-tumor | ATCC | T2 (174 x CEM.T2) (ATCC® CRL-1992™) | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200-072 | |
| U Bottom 96 well plate | Corning, Inc. | 3799 |
참고문헌
- Brauer, P. M., Singh, J., Xhiku, S., Zuniga-Pflucker, J. C. T Cell Genesis: In Vitro Veritas Est. Trends in Immunology. 37 (12), 889-901 (2016).
- Rosenberg, S. A., Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 348 (6230), 62-68 (2015).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. Journal of Clinical Investigation. 115 (6), 1616-1626 (2005).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Crompton, J. G., et al. Lineage relationship of CD8(+) T cell subsets is revealed by progressive changes in the epigenetic landscape. Cellular and Molecular Immunology. 13 (4), 502-513 (2016).
- Henning, A. N., Klebanoff, C. A., Restifo, N. P. Silencing stemness in T cell differentiation. Science. 359 (6372), 163-164 (2018).
- Henning, A. N., Roychoudhuri, R., Restifo, N. P. Epigenetic control of CD8(+) T cell differentiation. Nature Reviews Immunology. 18 (5), 340-356 (2018).
- Vodnala, S. K., et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism. Science. 363 (6434), (2019).
- Restifo, N. P., Gattinoni, L. Lineage relationship of effector and memory T cells. Current Opinion in Immunology. 25 (5), 556-563 (2013).
- Tran, E., et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 344 (6184), 641-645 (2014).
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Gautam, S., et al. The transcription factor c-Myb regulates CD8(+) T cell stemness and antitumor immunity. Nature Immunology. 20 (3), 337-349 (2019).
- Klebanoff, C. A., et al. Determinants of successful CD8+ T-cell adoptive immunotherapy for large established tumors in mice. Clinical Cancer Research. 17 (16), 5343-5352 (2011).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting through subsets: which T-cell populations mediate highly effective adoptive immunotherapy. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends in Immunology. 35 (4), 178-185 (2014).
- Crompton, J. G., Rao, M., Restifo, N. P. Memoirs of a reincarnated T cell. Cell Stem Cell. 12 (1), 6-8 (2013).
- Kennedy, M., et al. T lymphocyte potential marks the emergence of definitive hematopoietic progenitors in human pluripotent stem cell differentiation cultures. Cell Reports. 2 (6), 1722-1735 (2012).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Lo, W., et al. Immunologic recognition of a shared p53 mutated neoantigen in a patient with metastatic colorectal cancer. Cancer Immunology Research. , (2019).
- Timmermans, F., et al. Generation of T cells from human embryonic stem cell-derived hematopoietic zones. Journal of Immunology. 182 (11), 6879-6888 (2009).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Salter, R. D., Howell, D. N., Cresswell, P. Genes regulating HLA class I antigen expression in T-B lymphoblast hybrids. Immunogenetics. 21 (3), 235-246 (1985).
- Snauwaert, S., et al. In vitro generation of mature, naive antigen-specific CD8(+) T cells with a single T-cell receptor by agonist selection. Leukemia. 28 (4), 830-841 (2014).
- Takahama, Y., Suzuki, H., Katz, K. S., Grusby, M. J., Singer, A. Positive selection of CD4+ T cells by TCR ligation without aggregation even in the absence of MHC. Nature. 371 (6492), 67-70 (1994).
- Seki, T., et al. Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell. 7 (1), 11-14 (2010).
- Vodyanik, M. A., Slukvin, I. I. Hematoendothelial differentiation of human embryonic stem cells. Current Protocols in Cell Biology. , (2007).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- McNicol, A. M., et al. CD8alpha/alpha homodimers fail to function as co-receptor for a CD8-dependent TCR. European Journal of Immunology. 37 (6), 1634-1641 (2007).
- Themeli, M., Riviere, I., Sadelain, M. New cell sources for T cell engineering and adoptive immunotherapy. Cell Stem Cell. 16 (4), 357-366 (2015).
- Minagawa, A., et al. Enhancing T Cell Receptor Stability in Rejuvenated iPSC-Derived T Cells Improves Their Use in Cancer Immunotherapy. Cell Stem Cell. 23 (6), 850-858 (2018).
- Montel-Hagen, A., et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell. 24 (3), 376-389 (2019).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Takada, K., et al. TCR affinity for thymoproteasome-dependent positively selecting peptides conditions antigen responsiveness in CD8(+) T cells. Nature Immunology. 16 (10), 1069-1076 (2015).
- Vizcardo, R., et al. A Three-dimensional Thymic Culture System to Generate Murine Induced Pluripotent Stem Cell-derived Tumor Antigen-specific Thymic Emigrants. JoVE. , e58672 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유