Method Article
Cultivo, manipulación y trasplante ortotópico de organoides tumorales de la vejiga de ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo proporciona pasos experimentales detallados para establecer un cultivo tridimensional in vitro de organoides tumorales de vejiga derivados del cáncer de vejiga murina inducido por carcinógenos. Se describen métodos de cultivo que incluyen el passaging, la ingeniería genética y el trasplante ortotópico de organoides tumorales.
Resumen
Durante mucho tiempo se ha fomentado el desarrollo de modelos tumorales avanzados porque los modelos actuales de cáncer han mostrado limitaciones como la falta de arquitectura tumoral tridimensional (3D) y la baja relevancia para el cáncer humano. Los investigadores han desarrollado recientemente un modelo de cáncer in vitro 3D conocido como organoides tumorales que pueden imitar las características de un tumor nativo en un plato de cultivo. Aquí, los procedimientos experimentales se describen en detalle para el establecimiento de organoides tumorales de vejiga a partir de un tumor de vejiga murina inducido por carcinógenos, incluyendo el cultivo, el paso y el mantenimiento de los organoides tumorales 3D resultantes in vitro. Además, se describen los protocolos para manipular las líneas organoides del tumor de vejiga establecidas para la ingeniería genética mediante la transducción mediada por lentivirus, incluidas las condiciones optimizadas para la introducción eficiente de nuevos elementos genéticos en el tumor organoides. Finalmente, se establece el procedimiento para el trasplante ortotópico de organoides tumorales de vejiga en la pared de la vejiga murina para su análisis posterior. Los métodos descritos en este artículo pueden facilitar el establecimiento de un modelo in vitro para el cáncer de vejiga para el desarrollo de mejores opciones terapéuticas.
Introducción
El cáncer de vejiga es el cáncer de vía urinaria más frecuente, con aproximadamente 165.000 pacientes que mueren anualmente1. Entre los diversos tipos de cáncer de vejiga, el carcinoma urotelial invasivo muscular presenta un fenotipo agresivo, y su tasa de supervivencia de 5 años es inferior al 50%2. No se han ampliado nuevas opciones terapéuticas para tumores uroteliales invasivos en las últimas décadas1.
Las líneas celulares de cáncer se han utilizado ampliamente para la detección de drogas3. Aunque se han observado resultados favorables en numerosos candidatos a fármacos en líneas celulares de cáncer, se han notificado malos resultados en ensayos clínicos4. Tras una mayor adaptación a entornos de cultivo bidimensionalines (2D), se ha vuelto cada vez más difícil recapitular tumores nativos en líneas celulares. Los modelos de cáncer animal o los xenoinjertos tumorales derivados del paciente se pueden utilizar para abordar las limitaciones observadas en las líneas celulares de cáncer de vejiga. Sin embargo, los modelos de cáncer animal consumen mucho tiempo y recursos. Por lo tanto, los modelos mejorados de enfermedades han estado a la carta durante años y se ha desarrollado un nuevo sistema modelo, los organoides, para superar las deficiencias de los modelos existentes5.
Un organoide es una construcción 3D multicelular que puede recapitular in vitro las características fisiológicas de su órgano in vivo correspondiente. Los organoides normales y tumorales pueden derivarse de células madre pluripotentes o adultas, y células tumorales primarias, respectivamente5,6. En los últimos años, se han establecido organoides tumorales a partir de un gran número de diversos tejidos tumorales7,incluyendo colon8,9, vejiga10, páncreas11,12, próstata13, hígado14,y mama15 tejidos tumorales. Estos organoides tumorales imitan sus tumores originales fenotípicamente y genéticamente. Debido a su similitud con los tejidos tumorales in vivo y sus numerosas aplicaciones prácticas, los investigadores los han adoptado como nuevos modelos de enfermedades en el estudio de la patogénesis oncológica.
Aquí, se establecen los procedimientos para el establecimiento de organoides tumorales a partir de un tumor urotelial invasivo murino inducido por carcinógenos16. N-butilo-N-(4-hidroxibutilo) nitrosamina (BBN) se utiliza como carcinógeno para inducir carcinoma urotelial invasivo en ratones17 y los organoides tumorales, que exhiben las características patológicas de los tumores de vejiga invasora muscular de ratón, se establecen a partir del cáncer de vejiga murina inducido por BBN16. El método para manipular genéticamente los organoides tumorales se ilustra utilizando la transducción mediada por lentivirus para desarrollar un sistema modelo para estudiar la base molecular del desarrollo de cáncer de vejiga. Además, se describe un método para trasplantar organoides ortopégóticamente en una vejiga para investigar el papel del entorno de la vejiga nativa en el cáncer de vejiga.
Protocolo
Todos los procedimientos fueron aprobados y llevados a cabo bajo las directrices del Comité Institucional de Cuidado y Uso de Animales en POSTECH (Número IACUC: POSTECH-2019-0055).
1. In Vitro Culture of Bladder Tumor Organoids
- Establecer organoides tumorales de vejiga a partir del tumor de vejiga murina (Figura 1Un).
NOTA: El procedimiento para generar tumores de vejiga de ratón inducidos por BBN se describe en Shin et al.17.- Proporcione un 0,1% de agua que contenga BBN en una botella oscura al ratón ad libitum durante 6 meses. Cambiar el agua que contiene BBN 2 veces a la semana.
NOTA: Se utilizó un ratón macho C57BL/6 con un peso corporal de aproximadamente 25 g a 8-10 semanas de edad. El agua que contiene BBN se puede administrar hasta cinco ratones en una sola jaula. - Después de 6 meses, eutanasia el ratón con inhalación de dióxido de carbono y aísle todo el tumor de la vejiga. Transfiéralo a un plato Petri de 90 mm.
- Retire las partes no cancerosas y las regiones necróticas utilizando tijeras quirúrgicas estériles y lave los fragmentos del tumor de la vejiga de 2 a 3 veces con una salina fría de 1x de Dulbecco con búfer de fosfato (DPBS). Recoge los fragmentos y transfiéralos a una nueva placa Petri de 90 mm.
- Añadir 1 ml del medio esencial mínimo modificado (DMEM) de Dulbecco con 10 mM 4-(2-hidroxietilo)-1-piperazineethanesulfonic acid (HEPES).
- Picar el tejido tumoral en trozos lo más pequeños posible (0,5-1 mm3) usando una cuchilla de afeitar esterilizada.
- Añadir 9 ml de DMEM con 10 mM HEPES, 250 g/mL de colagenasa tipo I, 250 g/ml de colagenasa tipo II y 250 U/ml de termólisina. Incubar el tejido tumoral picado durante 1,5–2 h en un agitador orbital en una incubadora (37 oC, 5% CO2)para disociar los fragmentos en la suspensión celular. Transfiera la suspensión celular a un tubo de 50 ml.
NOTA: Si el tamaño del tumor cosechado del ratón es superior a 1 cm3, tratarlo con 2 veces la cantidad de termolisina o aumentar el tiempo de incubación. - Centrifugar el tubo a 400 x g durante 5 min a 4 oC y aspirar al sobrenadante.
- Resuspenda el pellet usando 5 ml de tampón de lising de amonio-cloruro-potasio (ACK) para oxidar los glóbulos rojos. Incubar el tubo durante 3-5 min a temperatura ambiente (RT) hasta la lisis completa de los glóbulos rojos.
NOTA: Si no se observan los glóbulos rojos, omita el proceso de lising. - Añadir 20 ml de DMEM en el tubo. Centrifugar el tubo a 400 x g durante 5 min a 4 oC y aspirar al sobrenadante.
- Resuspenda el pellet con 1 ml de 0,25% de trippsina-EDTA y dihidrocloruro De-27632 de 10 m (Y-27632) para disociar el pellet en células individuales. Incubar el tubo durante 5 minutos en un baño de agua de 37 oC.
NOTA: Observe el tumor bajo un microscopio para confirmar la disociación completa en células individuales. Si los trozos de células persisten, pipetee aún más la suspensión. - Neutralizar la trippsina usando 10 mL de DMEM con 10% de suero bovino fetal (FBS). Filtrar la suspensión celular a través de un colador de células de 100 m en un nuevo tubo de 50 ml para eliminar los desechos no digeridos.
- Centrifugar el tubo a 400 x g durante 5 min a 4 oC y aspirar al sobrenadante.
- Recubrir un pozo en una placa de 24 pozos usando 150 s de factor de crecimiento en frío reducido matriz de membrana de sótano(Tabla de Materiales)y colocar la placa de 24 pozos en una incubadora (37 oC, 5% CO2) durante 30 minutos para solidificar la matriz de membrana de sótano.
NOTA: Descongelar y mantener la matriz de membrana del sótano a 4 oC para evitar la solidificación antes de su uso. - Resuspenda el pellet usando 1 ml de DMEM y cuente las células usando un hemocitómetro. Transfiera de 3 a 4 x 104 células tumorales a un microtubo de 1,5 ml sobre hielo.
- Centrifugar el microtubo a 400 x g durante 3 min a 4 oC y desechar cuidadosamente el sobrenadante.
- Resuspenda las células con 500 ml de medio organoides precalentado(Tabla 1) y 10 OM Y-27632 y transfiéralas al pozo recubierto. Coloque la placa de 24 pocillos en una incubadora (37 oC, 5% CO2).
- Las células tumorales vesicales adicionales se pueden abastecer con 1 ml de DMEM que contiene 10% DE FBS, 1% de penicilina/estreptomicina y 10% de dimetilsulfóxido (DMSO) en crioviales de 1,5 ml. Colóquelos en un recipiente de congelación criovial y transfiera el recipiente a un congelador de -80 oC. Después de su almacenamiento en el congelador durante la noche, transfiera los crioviales a nitrógeno líquido para su almacenamiento a largo plazo.
- Cambiar el medio cada 2 días utilizando 500 ml de medio organoide precalentado(Figura 1B).
- Proporcione un 0,1% de agua que contenga BBN en una botella oscura al ratón ad libitum durante 6 meses. Cambiar el agua que contiene BBN 2 veces a la semana.
- Organoides tumorales de vejiga de subcultivo.
NOTA: Se recomienda el paso de los organoides tumorales de la vejiga cuando alcanzan los 100-150 m de diámetro.- Añadir 500 l de colagenasa/dispensa al medio organoide en la placa de 24 pocillos con organoides tumorales. Pipetear arriba y abajo de la matriz de membrana del sótano y el medio. Incubar durante 20 min a 37oC y cosechar las células en un tubo de 15 ml.
NOTA: Examine los organoides aislados de la matriz de membrana del sótano bajo un microscopio. Si los organoides no se separan de la matriz de membrana del sótano, aumente el tiempo de incubación o la pipeta más veces. - Añadir 5 ml de DMEM precalentado, centrifugar el tubo a 400 x g durante 3 min a 4 oC y aspirar el sobrenadante.
- Resuspenda el pellet usando 1 ml de trippsina-EDTA precalentado al 0,25% y 10 m Y-27632. Incubar durante 5 min en un baño de agua de 37oC. Pipetear vigorosamente las células hacia arriba y hacia abajo y neutralizar la trippsina usando 5 ml de DMEM con 10% FBS.
- Centrifugar el tubo a 400 x g durante 3 min a 4 oC y aspirar al sobrenadante.
- Resuspende el pellet usando 1 ml de medio organoide precalentado y cuenta el número de células tumorales individuales.
- Repita los pasos 1.1.14-1.1.18.
- Añadir 500 l de colagenasa/dispensa al medio organoide en la placa de 24 pocillos con organoides tumorales. Pipetear arriba y abajo de la matriz de membrana del sótano y el medio. Incubar durante 20 min a 37oC y cosechar las células en un tubo de 15 ml.
2. Manipulación Genética de Organoides Tumorales de Vejiga Utilizando Transducción Mediada por Lentivirus (Figura 2A)
- Producir las partículas lentivirales que expresan la GFP.
- En el día 0, células HEK 293T de placa a una densidad de 5-6 x 106 células por placa de cultivo celular de 10 cm en el medio de cultivo de línea celular (es decir, DMEM con 10% FBS y 1% penicilina/estreptomicina).
- En el día 1, prepare la solución de transfección de ADN, incluido el plásmido de transferencia que contenga GFP (8 g), plásmido de envase sin mandatar (10 g de pCMVR 8,74 y 3 g de pMD2.G) y 1 ml de medio sérico reducido(Tabla de materiales).
- Añadir 3 l de reactivo de transfección(Tabla de materiales)por 1 g de plásmido total de acuerdo con las instrucciones del fabricante y mezclar suavemente mediante pipeteo. Incubar durante 20 min a RT y añadir 9 mL de DMEM con 10% FBS.
- Aspirar el medio de cultivo en la placa de cultivo celular con células HEK 293T. Transfiera cuidadosamente 10 ml de la solución de transfección de ADN a las células HEK 293T e incubar en una incubadora de cultivo celular a 37 oC.
- El día 3, observe las células bajo un microscopio de fluorescencia (excitación a 488 nm y emisión a 512 nm) para determinar la eficiencia de transfección. Casi el 90%-100% de las células de toda la población celular deben expresar la PTF.
- Recoger el sobrenadante (que contiene el virus) y filtrar el sobrenadante con un filtro de poliétersulfone (PES) de 0,45 m.
NOTA: Utilice un filtro de unión a proteínas bajo, como un filtro PES. - Para concentrar el virus, centrifugar el sobrenadante del virus a 98.768 x g en una ultracentrífuga durante 2 h a 4 oC en un rotor de cubo oscilante(Tabla de materiales)y desechar cuidadosamente el sobrenadante.
- Resuspender el pellet en 2,5 ml de medio organoide frío.
- Para el almacenamiento a largo plazo, la alícuota de 250 ml de medio lentiviral en viales criogénicos y la congelación instantánea utilizando nitrógeno líquido. Almacene las existencias virales congeladas en un congelador de -80 oC.
- Realizar una transducción mediada por lentivirus de los organoides del tumor de la vejiga.
- En el día 2, divida los organoides tumorales como se describió anteriormente (paso 1.2) 12 h antes de la transducción mediada por lentivirus.
- En el día 3, descongelar rápidamente una alícuota (paso 2.1.9) que contenga virus en un baño de agua de 37oC y añadir los 250 ml de medio organoides con 10 M Y-27632 y bromuro de hexadimetrina de 8 g/ml.
- Sustituya el medio organoide de la placa de 24 pocillos por organoides tumorales por 500 ml de medio que contiene virus e incubar durante 12-16 h en una incubadora (37 oC, 5% CO2).
- En el día 4, cambiar el medio con 500 ml de medio organoide fresco.
NOTA: Después de 12-16 h de incubación, el medio debe cambiarse, porque el medio que contiene lentivirus y bromuro de hexadimetrina es citotóxico. - El día 6, monitoree la señal GFP de los organoides tumorales 3 días después de la transducción bajo un microscopio de fluorescencia(Figura 2B).
- En el día 10, pasar y almacenar los organoides 7 días después de la transducción como se describe en el paso 1.2, para mantener las líneas organoides tumorales modificadas genéticamente.
3. Trasplante ortotópico de organoides de la vejiga(Figura 3A)
- Preparar los organoides tumorales de la vejiga para el trasplante ortotópico.
- Antes del trasplante, cultivo de los organoides tumoral de la vejiga durante 5-7 días, como se describió anteriormente (paso 1.2).
- Añadir 500 ml de colagenasa/dispensa al medio organoide en una placa de 24 pocillos con los organoides tumorales. Pipetear arriba y abajo de la matriz de membrana del sótano y el medio. Incubar durante 20 min a 37 oC y recoger las células en un tubo de 15 ml.
- Añadir 5 ml de DMEM precalentado, centrifugar el tubo a 400 x g durante 3 min a 4 oC y aspirar el sobrenadante.
- Resuspenda el pellet con 1 ml de DMEM y transfiera la solución a una placa Petri de 90 mm.
- Bajo un microscopio, recoge los 10–100 organoides tumorales usando una micropipeta p200 y recógelos en un microtubo sobre hielo.
- Centrifugar el tubo a 400 x g durante 3 min a 4 oC y desechar cuidadosamente el sobrenadante.
- Mantenga el pellet celular en hielo hasta que los ratones estén listos para la cirugía.
- Trasplante de pared submucosa de la vejiga
NOTA: Este procedimiento se modifica del protocolo publicado por Fu et al18.- Prepare un ratón desnudo macho de 8 a 10 semanas (CAnN.Cg-Foxn1nu/Crl) al menos 1 semana antes del experimento para permitirle aclimatarse a un nuevo entorno. Inyectar enrofloxacino (5 mg/kg) por vía subcutánea 24 h antes de la cirugía.
- Limpie la superficie del banco con agua y jabón. Autoclave de los instrumentos quirúrgicos antes del procedimiento quirúrgico y realizar la cirugía utilizando instrumentos estériles.
- Mantenga la jeringa de insulina de 29 G, las puntas de pipeta y la matriz de membrana del sótano en hielo. Administrar ketoprofeno (5 mg/kg) por vía subcutánea antes de la administración de anestesia.
- Anestetizar el ratón con 4% de isoflurano en una cámara de inducción. Una vez alcanzada la anestesia general, coloque el ratón en una posición supina y mantenga la anestesia por inhalación de mascarilla de isoflurano vaporizado al 2%.
NOTA: Si el tiempo de anestesia es de más de 30 minutos, aplique un ununción ocular en ambos ojos usando un hisopo de algodón para evitar el secado de la córnea. - Aplicar povidona-yodo con una gasa estéril y limpiarlo con 70% de etanol. Repita 3x con una gasa nueva o un hisopo de algodón cada vez.
- Cubra el ano y el campo quirúrgico utilizando cortinas quirúrgicas desechables y estériles.
- Usando un microscopio de disección para el aumento, haga una pequeña incisión transversal (menor de 1,5 cm) en la piel y la pared muscular del abdomen de la línea media inferior con tijeras quirúrgicas estériles. Exponga la vejiga de la cavidad abdominal y apóyala con hisopos de algodón empapados en salina.
NOTA: Si la vejiga está llena de orina, presione suavemente la vejiga para descomprimirla ligeramente. - Resuspender los gránulos organoides (paso 3.1.7) en 80 ml de medio organoide que contenga una matriz de membrana de sótano de alta concentración del 50%(Tabla de materiales).
- Inyectar la suspensión organoide en el aspecto anterior de la cúpula de la vejiga utilizando la jeringa de insulina de 29 G bajo un microscopio de disección.
- Cierre la capa interna de la pared abdominal con sutura absorbible antibacteriana y luego cierre la capa externa con sutura de nylon 4-0. Desinfectar el sitio quirúrgico con povidona-yodo y 70% de etanol.
- Permita que el ratón se recupere bajo un irradiador infrarrojo de 10 a 15 minutos.
- Un día después de la cirugía, compruebe el estado general del ratón y la fuga anastomótica. Administrar ketoprofeno (5 mg/kg) una vez al día durante 3 días después de la operación y tratar la enrofloxacina (5 mg/kg) una vez al día durante 10 días después de la operación.
- Cuando el sitio de la incisión haya sanado (10-14 días después de la cirugía), retire las suturas. Controle el crecimiento del tumor de la vejiga del ratón durante 2-3 semanas después de la inyección de organoide tumoral.
- Si se observa un crecimiento del tumor en la vejiga, eutanasia el ratón mediante inhalación de dióxido de carbono y cosetodo todo el tumor de la vejiga. Lávelo con DPBS frío(Figura 3B)16.
- Para analizar la histología del tumor vesical, ten la sección incrustada en parafina del tejido mediante hematoxilina y tinción de eosina (H y E)(Figura 3B)16.
Resultados
Cultivo in vitro de organoides tumorales de vejiga de ratón
El número de células tumorales disociadas de un tumor inducido por BBN de 1 cm3 BBN es de al menos 4 x 105 células. Cuando las células se sembran inicialmente en la matriz de membrana del sótano, se pueden observar células no cancerosas y desechos. Los escombros se diluyeron gradualmente al continuar la subcultura. La Figura 1B muestra imágenes de los organoides cultivados en diferentes momentos. Si las células tumorales no forman organoides tumorales, las células están potencialmente muertas durante el paso de disociación. En tal caso, los procedimientos de disociación, incluido el tiempo de incubación con la enzima, deben ajustarse para aumentar la viabilidad celular.
Expresión de GFP en organoides tumorales de vejiga mediante manipulación genética mediada por lentivirus
Los organoides tumorales de la vejiga mostraron señales de GFP fuertes con infección lentiviral exitosa(Figura 2B). Después de la concentración, un total de 250 l de medios que contienen virus fue suficiente para infectar 3 x 104 células tumorales individuales en la matriz de membrana del sótano, manteniendo una eficiencia de infección del 90%-100%. Las señales de GFP se pueden detectar a partir de los organoides del tumor de la vejiga 3 días después de la transducción lentiviral. Si las señales de fluorescencia son bajas, la eficiencia de la infección viral es potencialmente baja. Esto puede deberse a numerosos factores, como el bajo valorviral, y los procedimientos deben ajustarse en consecuencia.
Trasplante ortotópico de organoides tumorales de vejiga
En la Figura 3B16se presenta un aloinjerto tumoral de vejiga obtenido de organoides tumorales de vejiga inducidos por BBN. Los aloinjertos tumorales de la vejiga se cosecharon 3 semanas después del trasplante ortotópico. La histología del tumor vesical trasplantado se analizó utilizando tinción H y E. Los trasplantes ortotópicos de organoides tumorales pueden crecer como tumores de vejiga durante 2-3 semanas.

Figura 1: Cultivo in vitro de organoides tumorales de vejiga de ratón. (A) Diagrama esquemático para el establecimiento de organoides tumorales de vejiga de ratón. (B) Imágenes representativas para el cultivo de organoides tumorales de vejiga en diferentes momentos. Los organoides tumorales de la vejiga del ratón se establecieron y cultivaron durante 9 días. Barra de escala a 100 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
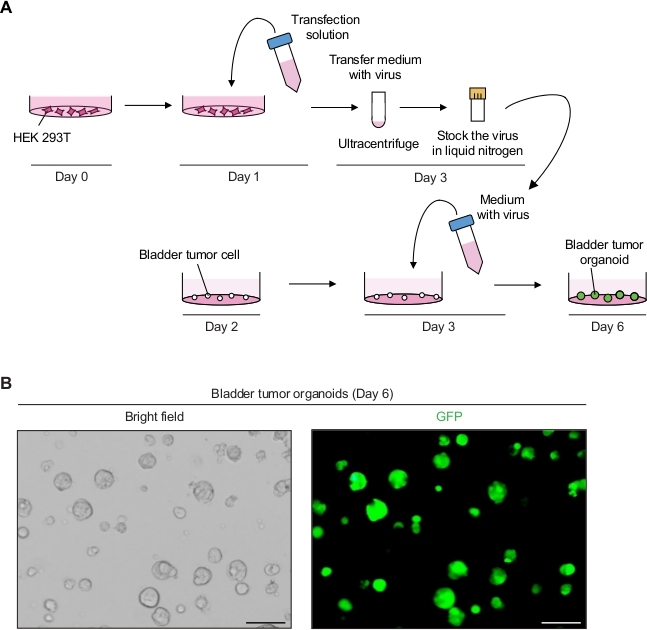
Figura 2: Expresión de GFP en organoides tumorales de vejiga mediante manipulación genética mediada por lentivirus. (A) Diagrama esquemático de transfección lentiviral y transducción de organoides tumorales de vejiga. (B) Imágenes representativas de organoides tumorales de vejiga que expresan la PFP. Barras de escala a 100 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Trasplante ortotópico de organoides tumorales de vejiga. (A) Diagrama esquemático del trasplante ortotópico de organoides tumorales de vejiga a un ratón desnudo. (B) Imágenes representativas de las vejigas y las secciones teñidas H y E de ratones trasplantados ortotófapicamente con organoides tumorales de la vejiga. Las vistas ampliadas de las regiones en caja de los paneles centrales se muestran en los paneles izquierdos. Barra de escala a 500 m. Esta cifra fue reproducida de la Figura 1–Figura Suplemento 1, Kim et al.16, publicado bajo la Licencia Pública Internacional Creative Commons Attribution 4.0 (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/). Haga clic aquí para ver una versión más grande de esta figura.
| Organoides tumorales de la vejiga del ratón medios | |
| DMEM avanzado/F-12 (medio básico) | HEPES de 10 mM (pH 7.4) |
| 10 mM Nicotinamida | 0.5x Suplemento sin suero |
| Dipéptido L-asiel-L-glutamina de 2 mM | 1% Penicilina/Estreptomicina |
| 1 mM N-acetil-L-cisteína | Factor de crecimiento epidérmico de 50 ng/mL |
| 1 M A 83-01 | |
Tabla 1: Composición del medio organoide tumoral de la vejiga.
Discusión
Este protocolo describe los procedimientos experimentales para cultivar y mantener los organoides tumorales de vejiga derivados de tumores de vejiga murina inducidos por carcinógenos.
En este protocolo, hay varios pasos experimentales en los cuales los procedimientos pueden necesitar cierta solución de problemas. En primer lugar, el número de células tumorales que se sembran inicialmente es un factor crítico porque el bajo número de células tumorales en el cultivo (<2 x 104 células) conduce principalmente a la muerte celular debido a la falta de interacciones entre las células tumorales. Por el contrario, a partir de demasiadas células (>5 x 104 células) en la sembración conduce a organoides superpoblados, lo que resulta en dificultad al manejar cultivos con un crecimiento pobre de cada organoide. Se sugiere encarecidamente que al principio se establezcan varias placas con diferentes números de células para optimizar las condiciones experimentales. Identificar el número correcto de células tumorales iniciales es crucial para lograr la mayor viabilidad celular y establecer organoides tumorales de vejiga exitosos. Además, en el cultivo a largo plazo de más de 2 semanas sin pasar, la mayoría de los organoides tumorales dejan de crecer, potencialmente debido al suministro inadecuado de nutrientes en el centro de los organoides y el agotamiento del factor de crecimiento en la matriz de membrana del sótano. Por lo tanto, la sucultura de los organoides de manera oportuna es un paso crítico para mantener el cultivo organoide tumoral.
En segundo lugar, la producción de partículas lentivirales de alto valor es fundamental para la manipulación genética eficiente de los organoides tumorales. Para solucionar problemas relacionados con el virus, se recomienda encarecidamente que los lanzadores de virus se determinen antes de la transducción viral cada vez porque las construcciones lentivirales tienden a producir partículas virales con una eficiencia variable. Si los organoides tumorales presentan una baja viabilidad después de una infección viral, es probable que los lanzadores virales sean potencialmente demasiado altos. Se recomienda encarecidamente utilizar una menor cantidad de virus en este caso. En tercer lugar, durante el trasplante ortotópico de organoides tumorales de vejiga inducidos por BBN, es fundamental mantener la integridad de la pared de la vejiga. En caso de que la inyección alcance el lumen de la vejiga penetrando en la capa de la pared de la vejiga, el experimento debe terminarse y desecharse. Si es posible, se recomienda el monitoreo del crecimiento del tumor de vejiga mediante un sistema de imágenes por ultrasonido.
Una limitación de las técnicas actuales es la ausencia del microambiente tumoral o estroma en estos organoides. Para superar este problema, se sugiere encarecidamente que el trasplante ortotópico de organoides tumorales utilice un sistema in vivo para imitar el microambiente tumoral nativo. En el futuro, será necesario desarrollar sistemas organoides 3D in vitro que se componen de organoides tumorales con otros componentes del estroma tumoral.
Una de las principales implicaciones de nuestra técnica es que, en el trasplante ortotópico de organoides tumorales, sólo 10 organoides tumorales de vejiga pueden inducir el crecimiento tumoral en la vejiga. En comparación con los experimentos convencionales de trasplante de tumores que requieren 5 x 105–1 x 106 células tumorales de vejiga única, nuestros métodos son mucho más eficientes y robustos. Otra diferencia significativa es que los organoides pueden ser manipulados diversamente usando varios vectores lentivirales, tales como construcciones lentivirales que contienen ARN de pinza corta, el sistema CRISPR-Cas9, o genes de interés. Estas serían herramientas poderosas para agregar a la tecnología organoide actual. En general, los enfoques experimentales presentados aquí pueden facilitar el establecimiento de modelos tumorales in vitro que pueden mejorar nuestra comprensión de la patogénesis del cáncer de vejiga en lugar de usar líneas celulares de cáncer de vejiga 2D.
Este método fue capaz de establecer organoides tumorales de vejiga derivados de un tumor de vejiga murina inducido por carcinógenos. El artículo proporciona una descripción de los procedimientos experimentales mediados por lentivirus a través de los cuales se introducen las modificaciones genéticas y se mantienen establemente en los organoides tumorales de la vejiga. Además, se incluye un procedimiento para el trasplante ortotópico de organoides tumorales. En combinación con los modelos actuales de cáncer in vivo, esta técnica será una herramienta útil para estudiar la base molecular de la tumorigenesis de vejiga.
Divulgaciones
Los autores no declaran intereses financieros en competencia.
Agradecimientos
Esta investigación fue apoyada por subvenciones de la Fundación Nacional de Investigación de Corea a K.S: NRF-2017R1A2B4006043, NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, Programa de Desarrollo Tecnológico Líder en Economía Creativa (SF317001A), POSCO (2018Y060) la beca BK21 Plus Research Fellowship.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Referencias
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados