Method Article
Культура, манипуляция и ортотопическая трансплантация органов опухолевых опухолей мышелового пузыря
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол предоставляет подробные экспериментальные шаги по созданию трехмерной культуры in vitro опухолевых органоидов мочевого пузыря, полученных от рака, индуцированного мочевого пузыря. Описаны культурные методы, включая пропускную связь, генную инженерию и ортотопическую трансплантацию опухолевых органоидов.
Аннотация
Развитие передовых моделей опухоли уже давно поощряется, потому что нынешние модели рака показали ограничения, такие как отсутствие трехмерной (3D) архитектуры опухоли и низкое отношение к раку человека. Исследователи недавно разработали 3D в пробирке модели рака называют опухоли органоидов, которые могут имитировать характеристики родной опухоли в культуре блюдо. Здесь подробно описаны экспериментальные процедуры для создания органов опухоли мочевого пузыря из канцерогенно-индуцированной опухоли мочевого пузыря, включая культуру, прохождение и поддержание полученных 3D-опухолевых органоидов in vitro. Кроме того, описаны протоколы для манипулирования установленными органоидными линиями опухолевых опухолей мочевого пузыря для генной инженерии с использованием трансдукции опосредованного лецивируса, включая оптимизированные условия для эффективного внедрения новых генетических элементов в опухоль органоиды. Наконец, выложена процедура ортотопической трансплантации органоидов опухолевых мочевого пузыря в стенку мочевого пузыря для дальнейшего анализа. Методы, описанные в этой статье может способствовать созданию модели in vitro для рака мочевого пузыря для разработки лучших терапевтических вариантов.
Введение
Рак мочевого пузыря является наиболее распространенным раком мочевыводящих путей, с примерно 165000 пациентов умирают ежегодно1. Среди различных видов рака мочевого пузыря, инвазивная уротелиальная карцинома обладает агрессивным фенотипом, и его 5-летняя выживаемость ниже 50%2. Новые терапевтические варианты для инвазивных опухолей уротелиала не были расширены в течение последних нескольких десятилетий1.
Раковые клеточные линии были широко использованы для скрининга наркотиков3. Хотя благоприятные результаты наблюдались в многочисленных кандидатов наркотиков в раковых клеток линий, плохие результаты, как сообщается, в клинических испытаниях4. После повышенной адаптации к двумерным (2D) средам культуры в пробирке становится все труднее переизглагать местные опухоли в клеточных линиях. Модели рака животных или пациента полученных опухоли ксенотрансплантатов могут быть использованы для решения ограничений, наблюдаемых в линии раковых клеток мочевого пузыря. Тем не менее, модели рака животных являются временной и ресурсоемкой. Таким образом, улучшенные модели заболеваний были востребованы в течение многих лет и новая модель системы, органоиды, была разработана для преодоления недостатков существующих моделей5.
Органоид представляет собой многоклеточную 3D конструкцию, которая может резюмировать в пробирке физиологические характеристики соответствующего органа in vivo. Нормальные и опухолевые органоиды могут быть получены из плюрипотентных или взрослых стволовых клеток, и первичных опухолевых клеток, соответственно5,6. За последние несколько лет, опухолевые органоиды были созданы из большого количества разнообразных опухолевых тканей7,в том числе толстой кишки8,9, мочевого пузыря10, поджелудочной железы11,12, простаты13, печени14, и молочной железы15 опухолевых тканей. Такие опухолевые органоиды имитируют свои оригинальные опухоли фенотипически и генетически. Из-за их сходства с инвиво опухолевых тканей и их многочисленных практических применений, исследователи приняли их в качестве новых моделей заболеваний в исследовании патогенеза рака.
Здесь изложены процедуры по установке опухолевых органоидов из канцерогенно-индуцированной муринининальной опухоли16. N-butyl-N-(4-гидроксибутил) нитрозамин (BBN) используется в качестве канцерогена, чтобы вызвать инвазивную уротелиальную карциному у мышей17 и опухолевых органоидов, которые демонстрируют патологические характеристики мышечно-инвазивных опухолей мочевого пузыря, устанавливаются из BBN-индуцированного мочевого пузыря16. Метод генетического манипулирования опухолевыми органоидами иллюстрируется с помощью лецивирусно-опосредованного трансдукции для разработки модельной системы для изучения молекулярной основы развития рака мочевого пузыря. Кроме того, описан метод трансплантации органоидов ортотопически в мочевой пузырь для изучения роли местной среды мочевого пузыря в раке мочевого пузыря.
протокол
Все процедуры были утверждены и проведены в соответствии с руководящими принципами Институционального комитета по уходу и использованию животных в POSTECH (iacUC номер: POSTECH-2019-0055).
1. В vitro Культура органоидов опухолей мочевого пузыря
- Установить органоиды опухоли мочевого пузыря из опухоли мочевого пузыря (Рисунок 1A).
ПРИМЕЧАНИЕ: Процедура генерации BBN-индуцированных опухолей мышелова из мыши изложена в Шин и др.17.- Обеспечить 0,1% BBN-содержащих воды в темной бутылке мыши объявление libitum в течение 6 месяцев. Изменение BBN-содержащей воды 2x в неделю.
ПРИМЕЧАНИЕ: Была использована мужская мышь C57BL/6 с массой тела около 25 г в возрасте 8-10 недель. BBN-содержащей воды можно управлять до 5 мышей в одной клетке. - После 6 месяцев, эвтаназии мыши с помощью вдыхания углекислого газа и изолировать всю опухоль мочевого пузыря. Перенесите его на 90 мм чашку Петри.
- Удалить нераковые части и некротические области с помощью стерильных хирургических ножниц и мыть фрагменты опухоли мочевого пузыря 2-3 раза с холодной 1x Dulbecco в фосфат-буферный солей (DPBS). Соберите фрагменты и перенесите их в новую 90-мм чашку Петри.
- Добавьте 1 мл модифицированной минимальной незаменимой среды (DMEM) Dulbecco с 10 мМ 4-(2-гидроксиэтил)-1-пиперазинетанесульфоновой кислоты (HEPES).
- Фарш опухолевой ткани на куски, как можно меньше (0,5-1 мм3) с помощью стерилизованного лезвия бритвы.
- Добавьте 9 мл DMEM с 10 мм HEPES, 250 мкг/мл коллагеназе типа I, 250 мкг/мл коллагеназе ii типа и 250 U/mL термолизин. Инкубация рубленой опухолевой ткани на 1,5–2 ч на орбитальный шейкер в инкубаторе (37 градусов по Цельсию, 5% CO2),чтобы разъединить фрагменты в клеточную подвеску. Перенесите суспензию клетки в трубку 50 мл.
ПРИМЕЧАНИЕ: Если размер опухоли, собранной из мыши, превышает 1 см3,обработайте ее в 2 раза больше термолиза ни с то, сколько увеличьте время инкубации. - Centrifuge трубку при 400 х г в течение 5 мин при 4 кв с и аспирации супернатанта.
- Приостановите гранулы с использованием 5 мл аммония-хлорида-калия (ACK) лизации буфера для линизации любых красных кровяных телец. Инкубировать трубку в течение 3-5 мин при комнатной температуре (RT) до полного лиза эритроцитов.
ПРИМЕЧАНИЕ: Если красные кровяные тельца не наблюдаются, опустить процесс лизания. - Добавьте 20 мл DMEM в трубку. Centrifuge трубку при 400 х г в течение 5 мин при 4 кв с и аспирации супернатанта.
- Отдохните гранулы с 1 мл 0,25% Трипсин-ЭДТА и 10 ММ Y-27632 дигидрохлорид (Y-27632) для разъединения гранул на одиночные клетки. Инкубировать трубку в течение 5 минут в водяной бане 37 градусов.
ПРИМЕЧАНИЕ: Наблюдайте за опухолью под микроскопом, чтобы подтвердить полную диссоциацию на одиночные клетки. Если куски клеток сохраняются, pipette подвески дальше. - Нейтрализовать трипсин с помощью 10 мл DMEM с 10% сыворотки крупного рогатого скота плода (FBS). Фильтр клеточной подвески через 100 мкм ячейки ситечко на новой трубке 50 мл, чтобы удалить непереваренный мусор.
- Centrifuge трубку при 400 х г в течение 5 мин при 4 кв с и аспирации супернатанта.
- Пальто хорошо в 24 хорошо пластины с использованием 150 qL ледяного фактора роста снижение подвала мембранной матрицы(Таблица материалов) и поместить 24 хорошо пластины в инкубатор (37 КК, 5% CO2) в течение 30 минут, чтобы укрепить подвал мембранной матрицы.
ПРИМЕЧАНИЕ: Оттепель и поддерживать подвальную мембранную матрицу при 4 градусах по Цельсию, чтобы предотвратить затвердевание перед использованием. - Приостановите гранулы с использованием 1 мл DMEM и посчитайте клетки с помощью гемоситометра. Перенесите 3-4 х 104 опухолевых клеток в микротрубку 1,5 мл на льду.
- Centrifuge микротрубки на 400 х г в течение 3 мин при 4 кв и осторожно отбросить супернатант.
- Приостановите работу клеток с 500 л предтеплой органоидной среды(таблица 1) и 10 МКм Y-27632 и перенесите их в колодец с покрытием. Поместите 24 пластины хорошо в инкубатор (37 кв.к., 5% CO2).
- Дополнительные опухолевые клетки мочевого пузыря могут быть снабжены 1 мл DMEM, содержащий 10% FBS, 1% пенициллина /стрептомицина, и 10% диметил сульфоксида (DMSO) в 1,5 мл криовиалы. Поместите их в кривиной замораживания контейнера и передать контейнер в морозильную камеру -80 градусов по Цельсию. После хранения в морозильной камере на ночь, переложить криовиалы в жидкий азот для длительного хранения.
- Изменение среды каждые 2 дня с помощью 500 л предтеплой органоидной среды(рисунок 1B).
- Обеспечить 0,1% BBN-содержащих воды в темной бутылке мыши объявление libitum в течение 6 месяцев. Изменение BBN-содержащей воды 2x в неделю.
- Органоиды опухолевых опухолей мочевого пузыря.
ПРИМЕЧАНИЕ: Рекомендуется прохождение органов опухоли мочевого пузыря, когда они достигают 100-150 мкм в диаметре.- Добавьте 500 кЛ коллагеназы/диспазы в органоидную среду в 24 хорошо пластины с опухолевыми органоидами. Пипетка вверх и вниз по подвалу мембраны матрицы и среды. Инкубировать в течение 20 минут при 37 градусах Цельсия и собирать клетки в трубку 15 мл.
ПРИМЕЧАНИЕ: Изучите органоиды, изолированные от мембранной матрицы под микроскопом. Если органоиды не отделены от мембранной матрицы, увеличьте время инкубации или пипетку больше раз. - Добавьте 5 мл предварительно разогретого DMEM, центрифуги южан на 400 х г в течение 3 мин при 4 градусах Цельсия, и аспирировать супернатант.
- Отсрояйте гранулы с использованием 1 мл предварительно разогретого 0,25% трипсина-ЭДТА и 10 МКМ Y-27632. Инкубировать в течение 5 мин в водяной бане 37 градусов по Цельсию. Энергично pipette клетки вверх и вниз и нейтрализовать трипсин с помощью 5 мл DMEM с 10% FBS.
- Centrifuge трубку при 400 х г в течение 3 мин при 4 кв с и аспирации супернатанта.
- Приостановите гранулы с использованием 1 мл предтеплой органоидной среды и подсчитайте количество одиночных опухолевых клеток.
- Повторите шаги 1.1.14-1.1.1.18.
- Добавьте 500 кЛ коллагеназы/диспазы в органоидную среду в 24 хорошо пластины с опухолевыми органоидами. Пипетка вверх и вниз по подвалу мембраны матрицы и среды. Инкубировать в течение 20 минут при 37 градусах Цельсия и собирать клетки в трубку 15 мл.
2. Генетическая манипуляция органов опухоли мочевого пузыря с использованием лентивирусно-опосредованного трансдукции(рисунок 2A)
- Производите GFP-выражения лентивирных частиц.
- На день 0, пластины HEK 293T клеток при плотности 5-6 х 106 клеток на 10 см клеточной культуры пластины в среде культуры клеточной линии (т.е., DMEM с 10% FBS и 1% пенициллин / стрептомицин).
- На 1-й день подготовьте раствор трансфекции ДНК, включающий плазмид переноса ГФП (8 мкг), лентивирусную упаковочную плазмиду (10 мкг pCMVR 8,74 и 3 мкг pMD2.G) и 1 мл пониженной среды сыворотки(Таблица материалов).
- Добавьте 3 Зл трансфекционного реагента(Таблица Материалов)на 1 мкг общей плазмиды в соответствии с инструкциями производителя и аккуратно перемешайте путем пипетки. Инкубировать в течение 20 минут на RT и добавить 9 мл DMEM с 10% FBS.
- Аспирируйте среду культуры в плите культуры клетки с клетками HEK 293T. Тщательно перенесите 10 мл раствора трансфекции ДНК на клетки HEK 293T и инкубируйте в инкубаторе клеточной культуры при 37 градусах Цельсия.
- На 3-й день наблюдайте за клетками под флуоресценционным микроскопом (возбуждение на уровне 488 нм и выброс на уровне 512 нм), чтобы определить эффективность трансфекции. Почти 90%-100% клеток в всей популяции клеток должны выражать GFP.
- Соберите супернатант (содержащий вирус) и фильтруйте супернатант фильтром политетерсульфона (PES) в размере 0,45 мкм.
ПРИМЕЧАНИЕ: Используйте фильтр с низким содержанием белка, такой как фильтр PES. - Чтобы сконцентрировать вирус, центрифуга вирус супернатант на 98,768 х г в ультрацентрифуге для 2 ч при 4 квс в размахивая ротор ведро (Таблица материалов) и тщательно отказаться от супернатанта.
- Приостановите гранулы в 2,5 мл холодной органоидной среды.
- Для длительного хранения, aliquot 250 Л лентивирусной среды в криогенные флаконы и оснастки заморозить их с помощью жидкого азота. Храните замороженные вирусные запасы в морозильной камере -80 градусов.
- Выполните лецивирусно-опосредованный трансдукции органоидов опухоли мочевого пузыря.
- На второй день, разделить опухоли органоидов, как описано выше (шаг 1,2) 12 ч до лентивирусо-опосредованного трансдукции.
- На 3-й день быстро оттепель аликот (шаг 2.1.9), содержащий вирус в водяной бане 37 градусов по Цельсию и добавьте 250 л органоидной среды с 10 МКм Y-27632 и 8 мкг/мл г/мл гексадиметрина бромистого бромида.
- Замените органоидную среду в 24 хорошо пластины с опухолевыми органоидами на 500 л, содержащих вирус среды и инкубировать на 12-16 ч в инкубаторе (37 кв.к., 5% CO2).
- На 4-й день измените среду с 500 qL свежей органоидной среды.
ПРИМЕЧАНИЕ: После 12-16 ч инкубации, среда должна быть изменена, потому что среда, содержащая лецивирус и бромистого гексадиметрина является цитотоксическим. - На 6-й день следите за сигналом GFP от опухолевых органоидов через 3 дня после трансдукции под флуоресцентным микроскопом(рисунок 2B).
- На день 10, проход и запас органоидов 7 дней после трансдукции, как описано в шаге 1.2, для поддержания генетически модифицированных опухолевых органоидных линий.
3. Ортотопическая трансплантация органоида из мочевого пузыря(рисунок 3A)
- Подготовьте органоиды опухоли мочевого пузыря для ортотопической трансплантации.
- Перед трансплантацией культура органоидов опухоли мочевого пузыря в течение 5-7 дней, как описано выше (шаг 1.2).
- Добавьте 500 кЛ коллагеназы/диспазы в органоидную среду в 24 хорошо пластины с опухолевыми органоидами. Пипетка вверх и вниз по подвалу мембраны матрицы и среднего. Инкубировать в течение 20 минут при 37 градусах Цельсия и собирать клетки в трубку 15 мл.
- Добавьте 5 мл предварительно разогретого DMEM, центрифуги южан на 400 х г в течение 3 мин при 4 градусах Цельсия, и аспирировать супернатант.
- Отрежь гранулу 1 мл DMEM и перенесите раствор в 90 мм чашку Петри.
- Под микроскопом, забрать 10-100 опухолевых органоидов с помощью микропайпета p200 и собрать их в микротрубку на льду.
- Centrifuge трубку при 400 х г в течение 3 мин при 4 градусах по Цельсию и осторожно отбросьте супернатант.
- Поддерживайте клеточные гранулы на льду до тех пор, пока мыши не будут готовы к операции.
- Трансплантация стенки пузыри подмукоса
ПРИМЕЧАНИЕ: Эта процедура изменена из протокола, опубликованного Fu et al18.- Подготовьте от 8 до 10 недель мужской обнаженной мыши (CAnN.Cg-Foxn1nu/Crl) по крайней мере за неделю до эксперимента, чтобы позволить ему акклиматизироваться к новой среде. Вводят энрофлоксацин (5 мг/кг) подкожно 24 ч перед операцией.
- Очистите поверхность скамейки мылом и водой. Автоклав хирургические инструменты до хирургической процедуры и выполнять операции с использованием стерильных инструментов.
- Держите 29 G инсулиншшприц, пипетки советы, и подвал мембраны матрицы на льду. Администрирование кетопрофена (5 мг/кг) подкожно перед введением анестезии.
- Анестезируйка мыши с 4% изолюран в индукционной камере. После достижения общей анестезии положите мышь в положение на спине и поддерживайте анестезию путем вдыхания маски 2% испаряемого изофрурана.
ПРИМЕЧАНИЕ: Если время анестезии составляет более 30 минут, нанесите мазь для глаз на оба глаза с помощью ватного тампона, чтобы избежать высыхания роговицы. - Нанесите повидон-йод стерильной марлей и протрите его 70% этанола. Повторите 3x с новой марлей или ватным тампоном каждый раз.
- Обложка ануса и хирургического поля с помощью одноразовых, стерильных хирургических штор.
- Используя расчленяющий микроскоп для увеличения, сделайте небольшой поперечный разрез (меньше 1,5 см) в коже и мышечной стенке нижней средней линии живота стерильными хирургическими ножницами. Выставить мочевой пузырь из брюшной полости и поддержать его солен-пропитанными ватными тампонами.
ПРИМЕЧАНИЕ: Если мочевой пузырь полон мочи, осторожно нажмите мочевой пузырь, чтобы распаковать его немного. - Повторите органоидные гранулы (шаг 3.1.7) в 80 ЗЛ органоидной среды, содержащей 50% высокой концентрации подвальной мембранной матрицы(Таблица Материалов).
- Введите органоидную суспензию в передний аспект купола мочевого пузыря, используя 29 G инсулиновый шприц под рассекающим микроскопом.
- Закройте внутренний слой брюшной стенки антибактериальным абсорбируемым швом, а затем закройте внешний слой 4-0 нейлоновым швом. Дезинфицировать хирургическое место с повидон-йод и 70% этанола.
- Разрешить мыши, чтобы восстановить под инфракрасным облучением 10-15 мин. Монитор мыши, пока он не приходит в сознание и подвижность.
- На следующий день после операции проверьте общее состояние мыши и анастомотическую утечку. Вводят кетопрофен (5 мг/кг) один раз в день в течение 3 дней после операции и лечить энрофлоксацин (5 мг/кг) один раз в день в течение 10 дней после операции.
- Когда место разреза зажило (10-14 дней после операции), удалите швы. Мониторинг роста опухоли мочевого пузыря мыши в течение 2-3 недель после инъекции опухолевого органоида.
- Если рост опухоли мочевого пузыря наблюдается, эвтаназии мыши с помощью вдыхания углекислого газа, и урожай всей опухоли мочевого пузыря. Вымойте его с помощью холодных DPBS(Рисунок 3B)16.
- Для анализа гистологии опухоли мочевого пузыря, пятно парафин-встроенный раздел ткани с помощью гематоксилина и эозина (H и E) окрашивания(рисунок 3B)16.
Результаты
В пробирке культуры органов опухоли мочевого пузыря мыши
Количество опухолевых клеток, отделенных от опухоли, вызваннойBBN, составляет не менее 4 х 105 клеток. Когда клетки первоначально посеяны в подвале мембраны матрицы, нераковые клетки и мусора могут наблюдаться. Мусор постепенно разбавлялся, продолжая субкультуру. На рисунке 1B показаны изображения культивированных органоидов в разных точках времени. Если опухолевые клетки не образуют опухолевые органоиды, клетки потенциально мертвы во время этапа диссоциации. В таком случае процедуры диссоциации, включая инкубационное время с ферментом, должны быть скорректированы для повышения жизнеспособности клеток.
Выражение GFP в органоидах опухоли мочевого пузыря с использованием лецивирусно-опосредованных генетических манипуляций
Органоиды опухоли мочевого пузыря продемонстрировали сильные сигналы GFP с успешной лентивирусной инфекцией(рисунок 2B). После концентрации, в общей сложности 250 qL вирусосодержащих средств массовой информации было достаточно, чтобы заразить 3 х 104 одиночных опухолевых клеток на матрице мембраны подвала, сохраняя 90%-100% эффективность инфекции. Сигналы GFP могут быть обнаружены из органов опухоли мочевого пузыря через 3 дня после лентивирусной трансдукции. Если сигналы флуоресценции низки, эффективность вирусной инфекции потенциально низка. Это может быть связано с многочисленными факторами, такими как низкий вирусный титр, и процедуры должны быть скорректированы соответствующим образом.
Ортотопическая трансплантация органов опухолевых опухолевых пузырей
Аллотрансплантат опухоли мочевого пузыря, полученный из BBN-индуцированных органоидов опухоли мочевого пузыря представлен на рисунке 3B16. Аллотрансплантаты опухоли мочевого пузыря были собраны через 3 недели после ортотопической трансплантации. Гистология пересаженной опухоли мочевого пузыря была проанализирована с помощью H и E окрашивания. Ортотопические трансплантации опухолевых органоидов могут расти как опухоли мочевого пузыря в течение 2-3 недель.

Рисунок 1: В пробирке культуры мышечного мочевого пузыря опухоли органоидов. (A) Схемаическая диаграмма для создания органов опухоли мочевого пузыря мыши. (B) Представитель изображения для культуры органоидов опухоли мочевого пузыря в разных точках времени. Органоиды опухоли мочевого пузыря мыши были установлены и культивированы в течение 9 дней. Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
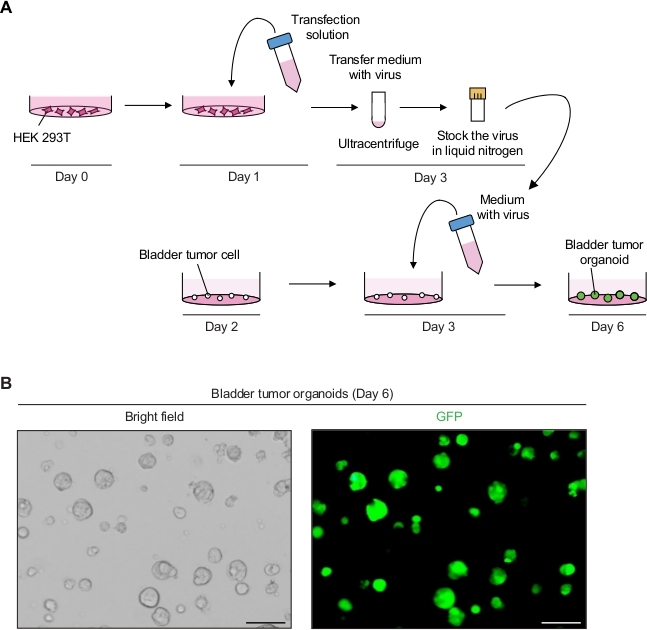
Рисунок 2: Выражение GFP в органоидов опухоли мочевого пузыря с использованием лецивирусо-опосредованных генетических манипуляций. (A) Схематическая диаграмма лентивиральной трансфекции и трансдукции органоидов опухоли мочевого пузыря. (B) Репрезентативные изображения органоидов опухоли мочевого пузыря, выражающие GFP. Шкала баров 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Ортотопическая трансплантация органов опухоли мочевого пузыря. (A) Схемаальная схема ортотопической трансплантации органоидов опухоли мочевого пузыря обнаженной мыши. (B) Представитель изображения мочевых пузырей и H и E окрашенных разделов от мышей ортотопически пересажены с органоидами опухоли мочевого пузыря. Увеличенные виды коробочные области в средних панелях отображаются в левой панели. Шкала бар 500 мкм. Эта цифра была воспроизведена на рисунке 1-Рисунок Дополнение 1, Ким и др.16, опубликованные в соответствии с Creative Commons Атрибуция 4.0 Международная общественная лицензия (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Органоиды опухоли мочевого пузыря мыши средние | |
| Расширенный DMEM/F-12 (базовая среда) | 10 мМ HEPES (pH 7.4) |
| 10 мМ Никотинамид | 0.5x Безсыворотка дополнение |
| 2 мМ L-аланил-L-глутамиин дипептид | 1% Пенициллин/Стрептомицин |
| 1 мМ Н-ацетил-L-цистеин | 50 нг/мл Мурин эпидермального фактора роста |
| 1 мкм А 83-01 | |
Таблица 1: Состав органоидной среды опухоли мочевого пузыря.
Обсуждение
Этот протокол описывает экспериментальные процедуры для культуры и поддержания мочевого пузыря опухоли органоидов, полученных из канцероген-индуцированной опухоли мочевого пузыря.
В этом протоколе есть несколько экспериментальных шагов, в которых процедурам может потребоваться устранение неполадок. Во-первых, количество опухолевых клеток, которые первоначально семенами является критическим фактором, потому что низкое количество опухолевых клеток в культуре (No lt;2 х 104 клетки) в основном приводят к гибели клеток из-за отсутствия взаимодействий между опухолевыми клетками. В отличие от этого, начиная со слишком большого количества клеток (Nogt;5 x 104 клетки) при посеве приводит к переполненности органоидов, в результате чего трудности при обработке культур с плохим ростом каждого органоида. Настоятельно рекомендуется, чтобы несколько пластин с различными числами клеток были созданы в начале для оптимизации экспериментальных условий. Определение нужного количества первоначальных опухолевых клеток имеет решающее значение для достижения высочайшей жизнеспособности клеток и для создания успешных органоидов опухоли мочевого пузыря. Кроме того, в долгосрочной культуре более 2 недель без прохождения, большинство опухолевых органоидов остановить рост, потенциально из-за недостаточного питания питательных веществ в центре органоидов и истощение фактора роста в подвале мембраны матрицы. Таким образом, субкультирование органоидов своевременно является важным шагом для поддержания культуры органов опорно-уреопухолевого содержания.
Во-вторых, производство высокотизерных лентивирусных частиц имеет решающее значение для эффективной генетической манипуляции опухолевыми органоидами. Для устранения неполадок вирус титер связанных вопросов, настоятельно рекомендуется, чтобы вирус титры быть определены до вирусной трансдукции каждый раз, потому что лентивирные конструкции, как правило, производят вирусные частицы с различной эффективностью. Если опухолевые органоиды обладают низкой жизнеспособностью после вирусной инфекции, вполне вероятно, что вирусные титры потенциально слишком высоки. Настоятельно рекомендуется использовать меньшее количество вируса в этом случае. В-третьих, во время ортотопической трансплантации инсированных BBN органоидов опухолевых мочевого пузыря, очень важно поддерживать целостность стенки мочевого пузыря. В случае, если инъекция достигает просвет мочевого пузыря, проникая в слой стенки мочевого пузыря, эксперимент должен быть прекращен и отброшен. По возможности рекомендуется мониторинг роста опухоли мочевого пузыря с помощью ультразвуковой системы визуализации.
Одним из ограничений современных методов является отсутствие опухолевой микросреды или стромы в этих органоидах. Чтобы преодолеть эту проблему, настоятельно рекомендуется, чтобы ортотопические трансплантации опухолевых органоидов использовать in vivo системы для имитации родной микросреды опухоли. В будущем необходимо будет разработать 3D-органоидные системы, состоящие из опухолевых органоидов с другими компонентами опухолевой стромы.
Одним из основных последствий нашей техники является то, что при ортотопической трансплантации опухолевых органоидов только 10 органоидов опухолевых мочевого пузыря могут вызвать рост опухоли в мочевом пузыре. По сравнению с обычными экспериментами по трансплантации опухоли, которые требуют 5 х 105-1 х 106 одноместных опухолевых клеток мочевого пузыря, наши методы являются гораздо более эффективными и надежными. Другим существенным отличием является то, что органоиды могут быть разнообразны манипулировать с помощью различных лентивирных векторов, таких как лентивирные конструкции, содержащие короткошерстную РНК, систему CRISPR-Cas9, или гены, представляющие интерес. Это будут мощные инструменты для добавления к современной органоидной технологии. В целом, экспериментальные подходы, представленные здесь может способствовать созданию моделей опухолей in vitro, которые могут улучшить наше понимание патогенеза рака мочевого пузыря, а не с помощью 2D линий раковых клеток мочевого пузыря.
Этот метод был в состоянии установить мочевого пузыря опухоли органоидов, полученных из канцерогена индуцированной опухоли мочевого пузыря. В статье приводится описание опосредованных лентивирусом экспериментальных процедур, с помощью которых вводятся и успокоятся генетические модификации в органоидах опухолевых мочевого пузыря. Кроме того, включена процедура ортотопической трансплантации опухолевых органоидов. В сочетании с современными моделями рака in vivo, этот метод будет полезным инструментом для изучения молекулярной основы опухоли мочевого пузыря.
Раскрытие информации
Авторы не заявляют о каких-либо конкурирующих финансовых интересах.
Благодарности
Это исследование было поддержано грантами Национального исследовательского фонда Кореи к K.S: NRF-2017R1A2B4006043, NRF-2017M3C7A10477755, NRF-2017R1A5A1015366, Программа развития креативных технологий экономики (SF317001A POSCO) BK21 Плюс научно-исследовательское стипендию.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Ссылки
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены