Method Article
Cultura, manipolazione e trapianto ortotopico di organidi tumorali della vescica del topo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo fornisce passaggi sperimentali dettagliati per stabilire una coltura tridimensionale in vitro degli organoidi tumorali della vescica derivati dal cancro della miscite della vescica indotta da cancerogeni cancero. Sono descritti metodi di coltura tra cui passaggio, ingegneria genetica e trapianto ortotopico di organoidi tumorali.
Abstract
Lo sviluppo di modelli tumorali avanzati è stato a lungo incoraggiato perché gli attuali modelli tumorali hanno mostrato limitazioni come la mancanza di architettura tumorale tridimensionale (3D) e bassa rilevanza per il cancro umano. I ricercatori hanno recentemente sviluppato un modello di cancro in vitro 3D indicato come organoidi tumorali che possono imitare le caratteristiche di un tumore nativo in un piatto di coltura. Qui, le procedure sperimentali sono descritte in dettaglio per la creazione di organoidi tumorali della vescica da un tumore della vescica murina indotta da cancerogeni, compresa la coltura, il passaggio e il mantenimento degli organoidi tumorali 3D risultanti in vitro. Inoltre, vengono descritti i protocolli per manipolare le linee organoide del tumore della vescica stabilite per l'ingegneria genetica utilizzando la trasduzione mediata dal lentivirus, comprese le condizioni ottimizzate per l'introduzione efficiente di nuovi elementi genetici nel tumore organoidi. Infine, viene predisposta la procedura per il trapianto ortotopico degli organoidi tumorali della vescica nella parete della vescica murina per ulteriori analisi. I metodi descritti in questo articolo possono facilitare la creazione di un modello in vitro per il cancro della vescica per lo sviluppo di migliori opzioni terapeutiche.
Introduzione
Il cancro della vescica è il cancro del tratto urinario più diffuso, con circa 165.000 pazienti che muoiono ogni anno1. Tra i vari tipi di cancro della vescica, il carcinoma uroteliale muscolo-invasivo presenta un fenotipo aggressivo, e il suo tasso di sopravvivenza a 5 anni è inferiore al 50%2. Nuove opzioni terapeutiche per i tumori uroliali invasivi non sono state ampliate negli ultimi decenni1.
Le linee cellulari del cancro sono state ampiamente utilizzate per lo screeningfarmacologico 3. Anche se risultati favorevoli sono stati osservati in numerosi farmaci candidati nelle linee cellulari del cancro, scarsi risultati sono segnalati negli studi clinici4. Dopo un maggiore adattamento agli ambienti di coltura bidimensionale in vitro (2D), è diventato sempre più difficile ricapitolare i tumori nativi nelle linee cellulari. Modelli di cancro animale o xenogratrapi tumorali derivati dal paziente possono essere utilizzati per affrontare le limitazioni osservate nelle linee cellulari del cancro della vescica. Tuttavia, i modelli di cancro degli animali richiedono un uso intensivo di tempo e risorse. Pertanto, i modelli di malattia migliorati sono stati richiesti per anni e un nuovo sistema modello, organoidi, è stato sviluppato per superare le carenze dei modelli esistenti5.
Un organoide è un costrutto 3D multicellulare che può riassumere in vitro le caratteristiche fisiologiche del corrispondente organo in vivo. Gli organoidi normale e tumorale possono essere derivati da cellule staminali pluripotenti o adulte e cellule tumorali primarie, rispettivamente5,6. Nel corso degli ultimi anni, gli organoidi tumorali sono stati stabiliti da un gran numero di tessuti tumorali diversi7, tra cui il colon8,9, vescica10, pancreas11,12, prostata13, fegato14, e seno15 tessuti tumorali. Tali organoidi tumorali imitano i loro tumori originali fenotipicamente e geneticamente. A causa della loro somiglianza con i tessuti tumorali in vivo e delle loro numerose applicazioni pratiche, i ricercatori li hanno adottati come nuovi modelli di malattia nello studio della patogenesi tumorale.
Qui, le procedure per la creazione di organoidi tumorali da un tumore urino invasivo indotto da cancerogeni16 sono disposte. N-butyl-N-(4-hydroxybutyl) nitrosamine (BBN) viene utilizzato come cancerogeno per indurre carcinoma uroteliali invasivo nei topi17 e gli organoidi tumorali, che presentano le caratteristiche patologiche dei tumori della vescica muscolo-invasiva del topo, sono stabiliti dal cancro della vescica murina indotta da BBN16. Il metodo per manipolare geneticamente gli organoidi tumorali è illustrato utilizzando la trasduzione mediata da lentivirus per sviluppare un sistema modello per studiare la base molecolare dello sviluppo del cancro della vescica. Inoltre, viene descritto un metodo per il trapianto di organoidi ortotopicamente in una vescica per studiare il ruolo dell'ambiente nativo della vescica nel cancro della vescica.
Protocollo
Tutte le procedure sono state approvate e condotte secondo le linee guida del Institutional Animal Care and Use Committee presso POSTECH (Numero IACUC: POSTECH-2019-0055).
1. Cultura in vitro degli organoidi tumorali della vescica
- Stabilire gli organoidi tumorali della vescica dal tumore della vescica murina (Figura 1Un).
NOTA: La procedura per la generazione di tumori della vescica del topo indotti da BBN è descritta in Shin et al.17.- Fornire 0.1% acqua contenente BBN in una bottiglia scura per mouse ad libitum per 6 mesi. Cambiare l'acqua contenente BBN 2 volte a settimana.
NOTA: È stato utilizzato un topo maschio C57BL/6 con un peso corporeo di circa 25 g a 8-10 settimane di età. L'acqua contenente BBN può essere somministrata a un massimo di cinque topi in un'unica gabbia. - Dopo 6 mesi, eutanasia il topo utilizzando l'inalazione di anidride carbonica e isolare l'intero tumore della vescica. Trasferirlo in un piatto Petri da 90 mm.
- Rimuovere le parti non cancerose e le regioni necrotiche utilizzando forbici chirurgiche sterili e lavare i frammenti tumorali della vescica 2-3 volte con la salina (DPBS) tampone di fosfato freddo 1x Dulbecco. Raccogliere i frammenti e trasferirli in un nuovo piatto Petri da 90 mm.
- Aggiungere 1 mL del mezzo minimo essenziale modificato di Dulbecco (DMEM) con 10 mM 4-(2-idxyethyl)-1-piperazineethaneilfonic acid (HEPES).
- Mito il tessuto tumorale in pezzi il più piccoli possibile (0,5-1 mm3)utilizzando una lama sterilizzata.
- Aggiungere 9 mL di DMEM con 10 m/HEPES, 250 g/mL di tipo collagenase I, 250 g/mL di tipo collagenase II e 250 termolisina U/mL. Incubare il tessuto tumorale macinato per 1,5-2 h su uno shaker orbitale in un'incubatrice (37 , 5% CO2) per dissociare i frammenti nella sospensione cellulare. Trasferire la sospensione cellulare in un tubo da 50 mL.
NOTA: Se la dimensione del tumore raccolto dal topo è superiore a 1 cm3, trattarlo con 2 volte la quantità di termolisina o aumentare il tempo di incubazione. - Centrifugare il tubo a 400 x g per 5 min a 4 gradi centigradi e aspirare il supernatante.
- Risospendere il pellet utilizzando 5 mL di clouro-potassio-potassio (ACK) lysing buffer per liizzare eventuali globuli rossi. Incubare il tubo per 3-5 min a temperatura ambiente (RT) fino alla lis completa dei globuli rossi.
NOTA: Se i globuli rossi non sono osservati, omettere il processo di liscivia. - Aggiungere 20 mL di DMEM nel tubo. Centrifugare il tubo a 400 x g per 5 min a 4 gradi centigradi e aspirare il supernatante.
- Risospendere il pellet con 1 mL di 0,25% Trypsin-EDTA e 10 dihydrochlride (Y-27632) per dissociare il pellet in singole celle. Incubare il tubo per 5 min in un bagno d'acqua a 37 gradi centigradi.
NOTA: Osservare il tumore al microscopio per confermare la completa dissociazione in singole cellule. Se blocchi di cellule persistono, pipette ulteriormente la sospensione. - Neutralizzare la trypsin utilizzando 10 mL di DMEM con il 10% di siero bovino fetale (FBS). Filtrare la sospensione cellulare attraverso un colino cellulare di 100 m su un nuovo tubo da 50 mL per rimuovere i detriti non digeriti.
- Centrifugare il tubo a 400 x g per 5 min a 4 gradi centigradi e aspirare il supernatante.
- Rivestire un pozzo in una piastra di 24 pozze utilizzando 150 -L di fattore di crescita del freddo ghiaccio ridotto matrice della membrana seminterrato (Tabella dei materiali) e posizionare la piastra 24 pozzo in un'incubatrice (37 c, 5% CO2) per 30 min per solidificare la matrice della membrana seminterrato.
NOTA: Scongelare e mantenere la matrice della membrana del seminterrato a 4 gradi centigradi per evitare la solidificazione prima dell'uso. - Risospendere il pellet utilizzando 1 mL di DMEM e contare le celle utilizzando un emocitometro. Trasferire 3-4 x 104 cellule tumorali in un microtubo da 1,5 mL sul ghiaccio.
- Centrifugare il microtubo a 400 x g per 3 min a 4 gradi centigradi e scartare con cura il supernatante.
- Risospendere le cellule con 500 o luna di mezzo organoide preriscaldato (Tabella 1) e 10 -M Y-27632 e trasferirle nel pozzo rivestito. Mettere la piastra 24 in un'incubatrice (37 gradi centigradi, 5% CO2).
- Le cellule tumorali extra della vescica possono essere rifornite con 1 mL di DMEM contenenti 10% FBS, 1% penicillina /streptomicina e 10% di anidride dimetilico (DMSO) in crioviali 1,5 mL. Mettetele in un contenitore di congelamento crioviale e trasferite il contenitore in un congelatore a -80 gradi centigradi. Dopo lo stoccaggio nel congelatore durante la notte, trasferire i crioviali in azoto liquido per lo stoccaggio a lungo termine.
- Modificare il mezzo ogni 2 giorni utilizzando 500 l di mezzo organoide preriscaldato (Figura 1B).
- Fornire 0.1% acqua contenente BBN in una bottiglia scura per mouse ad libitum per 6 mesi. Cambiare l'acqua contenente BBN 2 volte a settimana.
- organoidi tumorali della vescica della sottocoltura.
NOTA: Si raccomanda il passaggio degli organoidi tumorali della vescica quando raggiungono i 100-150 m di diametro.- Aggiungere 500 -L L di collagenano/dispasi al mezzo organoide nella piastra di 24 po' con organoidi tumorali. Pipetta su e giù per la matrice della membrana seminterrato e il mezzo. Incubare per 20 min a 37 s e raccogliere le cellule in un tubo da 15 mL.
NOTA: Esaminare gli organoidi isolati dalla matrice della membrana del seminterrato al microscopio. Se gli organoidi non sono staccati dalla matrice della membrana del seminterrato, aumentare il tempo di incubazione o pipette più volte. - Aggiungere 5 mL di DMEM preriscaldato, centrifugare il tubo a 400 x g per 3 min a 4 gradi centigradi, e aspirare il supernatante.
- Risospendere il pellet utilizzando 1 mL di trypsin-EDTA preriscaldato 0,25% e 10 -M Y-27632. Incubare per 5 min in un bagno d'acqua a 37 gradi centigradi. Pipette vigorosamente le cellule su e giù e neutralizzare la trypsin utilizzando 5 mL di DMEM con 10% FBS.
- Centrifugare il tubo a 400 x g per 3 min a 4 gradi centigradi e aspirare il supernatante.
- Risospendere il pellet utilizzando 1 mL di mezzo organoide preriscaldato e contare il numero di singole cellule tumorali.
- Ripetere i passaggi 1.1.14-1.1.18.
- Aggiungere 500 -L L di collagenano/dispasi al mezzo organoide nella piastra di 24 po' con organoidi tumorali. Pipetta su e giù per la matrice della membrana seminterrato e il mezzo. Incubare per 20 min a 37 s e raccogliere le cellule in un tubo da 15 mL.
2. Manipolazione genetica degli organiidi tumorali della vescica utilizzando la trasduzione mediata dal lentivirus (Figura 2A)
- Produrre le particelle lentivirali che esprimono GFP.
- Il giorno 0, piastra HEK 293T cellule ad una densità di 5–6 x 106 celle per 10 cm piastra di coltura cellulare nel mezzo di coltura della linea cellulare (cioè, DMEM con 10% FBS e 1% penicillina / streptomicina).
- Il primo giorno, preparare la soluzione di trasfezione del DNA, compreso il plasmide di trasferimento contenente GFP (8 g), il plasmide di imballaggio lentivirale (10 g di pCMVR 8,74 e 3 g di pMD2.G) e 1 mL di supporto siero ridotto(Tabella dei materiali).
- Aggiungere 3 -L di reagente di trasfezione (Tabella dei materiali) per 1 g di plasmide totale secondo le istruzioni del produttore e mescolare delicatamente pipettando. Incubare per 20 min a RT e aggiungere 9 mL di DMEM con 10% FBS.
- Aspirare il mezzo di coltura nella piastra di coltura cellulare con cellule HEK 293T. Trasferire con attenzione 10 mL della soluzione di trasfezione del DNA sulle cellule HEK 293T e incubare in un'incubatrice a coltura cellulare a 37 gradi centigradi.
- Il terzo giorno, osservare le cellule al microscopio a fluorescenza (eccitazione a 488 nm ed emissione a 512 nm) per determinare l'efficienza della trasfezione. Quasi il 90%–100% delle cellule dell'intera popolazione cellulare dovrebbe esprimere GFP.
- Raccogliere il supernatante (contenente il virus) e filtrare il supernatante con un filtro di poliethersulfone (PES) di 0,45 m.
NOTA: Utilizzare un filtro a basso legame proteico, ad esempio un filtro PES. - Per concentrare il virus, centrifugare il supernatante del virus a 98.768 x g in un'ultracentrifuga per 2 h a 4 gradi centigradi in un rotore a benna oscillante (Tabella dei materiali) e scartare con cura il supernatante.
- Risospendere il pellet in 2,5 mL di mezzo organoide freddo.
- Per lo stoccaggio a lungo termine, aliquote di 250 gradi di mezzo lentivirale in fiale criogeniche e bloccarle a scatto usando azoto liquido. Conservare le scorte virali congelate in un congelatore a -80 gradi centigradi.
- Eseguire la trasduzione mediata da lentivirus degli organoidi tumorali della vescica.
- Il giorno 2, dividere gli organoidi tumorali come descritto sopra (passaggio 1.2) 12 h prima della trasduzione mediata dal lentivirus.
- Il giorno 3, scongelare rapidamente un virus (passo 2.1.9) contenente un virus in un bagno d'acqua a 37 gradi centigradi e aggiungere i 250 gradi di mezzo organoide con 10 SM Y-27632 e 8 bromdie di esadimethrina.
- Sostituire il mezzo organoide nella piastra di 24 pozze con organoidi tumorali di 500 - L di mezzo contenente virus e incubare per 12–16 h in un'incubatrice (37 gradi centigradi, 5% CO2).
- Il giorno 4, cambiare il mezzo con 500 litri di mezzo organoide fresco.
NOTA: Dopo 12-16 h di incubazione, il mezzo deve essere cambiato, perché il mezzo contenente lentivirus e bromuro di esadimettosina è citotossico. - Il giorno 6, monitorare il segnale GFP dagli organoidi tumorali 3 giorni dopo la trasduzione al microscopio a fluorescenza (Figura 2B).
- Il giorno 10, passare e immagazzinare gli organoidi 7 giorni dopo la trasduzione come descritto al punto 1.2, per mantenere le linee organotumidi geneticamente modificate.
3. Trapianto ortotopico di organiide della vescica(Figura 3A)
- Preparare gli organoidi tumorali della vescica per il trapianto ortotopico.
- Prima del trapianto, coltura degli organoidi tumorali della vescica per 5-7 giorni, come descritto sopra (passaggio 1.2).
- Aggiungere 500 -L l di collagenano/dispasi al mezzo organoide in una piastra di 24 pozze con gli organoidi tumorali. Pipetta su e giù per la matrice di membrana seminterrato e mezzo. Incubare per 20 min a 37 s e raccogliere le cellule in un tubo da 15 mL.
- Aggiungere 5 mL di DMEM preriscaldato, centrifugare il tubo a 400 x g per 3 min a 4 gradi centigradi, e aspirare il supernatante.
- Risospendere il pellet con 1 mL di DMEM e trasferire la soluzione in una parabola Petri da 90 mm.
- Al microscopio, raccogliere gli organoidi tumorali 10-100 utilizzando una micropipetta p200 e raccoglierli in un microtubo sul ghiaccio.
- Centrifugare il tubo a 400 x g per 3 min a 4 gradi centigradi e scartare con cura il supernatante.
- Mantenere il pellet cellulare sul ghiaccio fino a quando i topi sono pronti per l'intervento chirurgico.
- Trapianto di parete della vescica submucosale
NOTA: questa procedura viene modificata dal protocollo pubblicato da Fu et al18.- Prepara un topo nudo maschile da 8 a 10 settimane (CAnN.Cg-Foxn1nu/Crl) almeno 1 settimana prima dell'esperimento per permettergli di acclimatarsi a un nuovo ambiente. Iniettare enrofloxacin (5 mg/kg) sottocutaneamente 24 h prima dell'intervento chirurgico.
- Pulire la superficie del panca con acqua e sapone. Autoclave gli strumenti chirurgici prima della procedura chirurgica ed eseguire la chirurgia utilizzando strumenti sterili.
- Mantenere la siringa di insulina 29 G, punte pipette, e matrice di membrana seminterrato sul ghiaccio. Somministrare il chetoprofene (5 mg/kg) sottocutaneamente prima della somministrazione di anestesia.
- Anestesizzare il topo con 4% isoflurane in una camera di induzione. Una volta ottenuta l'anestesia generale, posare il topo in una posizione supina e mantenere l'anestesia per inalazione di maschera del 2% di isoflurane vaporizzato.
NOTA: Se il tempo di anestesizzazione è superiore a 30 min, applicare l'unguento degli occhi a entrambi gli occhi utilizzando un tampone di cotone per evitare l'essiccazione corneale. - Applicare povidone-iodio con una garza sterile e pulirlo con 70% di etanolo. Ripetere 3x con una nuova garza o un tampone di cotone ogni volta.
- Coprire l'ano e il campo chirurgico utilizzando tende chirurgiche usa e getta e sterili.
- Utilizzando un microscopio dissettivo per l'ingrandimento, fare una piccola incisione trasversale (più piccola di 1,5 cm) nella pelle e parete muscolare dell'addome della linea mediana inferiore con forbici chirurgiche sterili. Esporre la vescica dalla cavità addominale e sostenerla con tamponi di cotone imbevuti di salina.
NOTA: Se la vescica è piena di urina, premere delicatamente la vescica per decomprimerla leggermente. - Risospendere i pellet organoidi (passaggio 3.1.7) in 80 gradi di mezzo organoide contenente il 50% di matrice di membrana basement ad alta concentrazione (Tabella dei materiali).
- Iniettare la sospensione organoide nell'aspetto anteriore della cupola della vescica utilizzando la siringa insulinica 29 G al microscopio dissetante.
- Chiudere lo strato interno della parete addominale con sutura antibatterica assorbibile e quindi chiudere lo strato esterno con sutura in nylon 4-0. Disinfettare il sito chirurgico con povidone-iodio e 70% di etanolo.
- Permettere al topo di recuperare sotto un irradiatore infrarosso 10-15 min. Monitorare il topo fino a quando non riacquista coscienza e motilità.
- Un giorno dopo l'intervento chirurgico, controllare le condizioni generali del topo e perdite anatomotiche. Somministrare il ketoprofene (5 mg/kg) una volta al giorno per 3 giorni post-operatori e trattare l'enrofloxacina (5 mg/kg) una volta al giorno per 10 giorni post-operatori.
- Quando il sito di incisione è guarito (10-14 giorni dopo l'intervento chirurgico), rimuovere le suture. Monitorare la crescita del tumore della vescica del topo per 2–3 settimane dopo l'iniezione di organoide tumorale.
- Se si osserva la crescita del tumore della vescica, eutanasia il topo utilizzando l'inalazione di anidride carbonica, e raccogliere l'intero tumore della vescica. Lavarlo con DPBS freddo (Figura 3B)16.
- Per analizzare l'istologia del tumore della vescica, macchiare la sezione incorporata in paraffina del tessuto utilizzando ematossina e eosina (H ed E) colorazione (Figura 3B)16.
Risultati
Cultura in vitro degli organoidi tumorali della vescica del topo
Il numero di cellule tumorali dissociate da un tumore indotto da 1 cm3 BBN è di almeno 4 x 105 cellule. Quando le cellule sono inizialmente semiate nella matrice della membrana seminterrato, possono essere osservate cellule e detriti non cancerosi. I detriti sono stati gradualmente diluiti continuando la sottocultura. Figura 1B Mostra le immagini degli organoidi coltivati in punti temporali diversi. Se le cellule tumorali non formano organoidi tumorali, le cellule sono potenzialmente morte durante la fase di dissociazione. In tal caso, le procedure di dissociazione, compreso il tempo di incubazione con l'enzima, devono essere regolate per aumentare la vitalità cellulare.
Espressione di GFP negli organoidi tumorali della vescica utilizzando la manipolazione genetica mediata dal lentivirus
Gli organoidi tumorali della vescica hanno mostrato forti segnali GFP con infezione lentivirale di successo (Figura 2B). Dopo la concentrazione, un totale di 250 l di supporti contenenti virus è stato sufficiente per infettare 3 x 104 cellule tumorali singole sulla matrice della membrana seminterrato, mantenendo il 90%-100% di efficienza dell'infezione. I segnali GFP potrebbero essere rilevati dagli organoidi tumorali della vescica 3 giorni dopo la trasduzione lentivirale. Se i segnali di fluorescenza sono bassi, l'efficienza dell'infezione virale è potenzialmente bassa. Ciò può essere dovuto a numerosi fattori, come il basso titro virale, e le procedure devono essere regolate di conseguenza.
Trapianto ortotopico di organoidi tumorali della vescica
Un allotrapianto tumorale della vescica ottenuto da organoidi tumorali della vescica indotta da BBN è presentato nella Figura 3B16. Gli allotrapianti tumorali della vescica sono stati raccolti 3 settimane dopo il trapianto ortotopico. L'istologia del tumore della vescica trapiantato è stata analizzata utilizzando la colorazione H ed E. I trapianti ortotopici di organoidi tumorali possono crescere come tumori della vescica per 2-3 settimane.

Figura 1: Cultura in vitro degli organoidi tumorali della vescica del topo. (A) Diagramma schematico per la creazione di organoidi tumorali della vescica del topo. (B) Immagini rappresentative per la coltura degli organoidi tumorali della vescica in diversi punti temporali. Gli organoidi tumorali della vescica del topo sono stati stabiliti e coltivati in 9 giorni. Barra di scala: 100 m. Fare clic qui per visualizzare una versione più grande di questa figura.
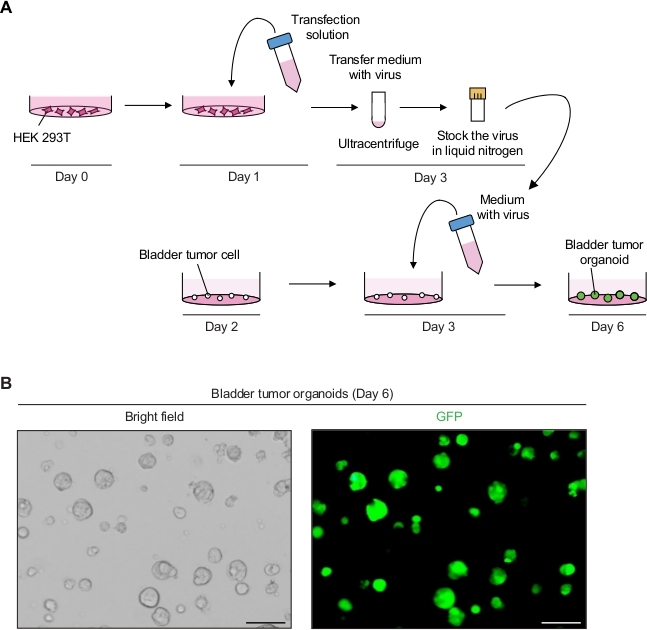
Figura 2: Espressione di GFP negli organoidi tumorali della vescica utilizzando la manipolazione genetica mediata dal lentivirus. (A) Schematico della trafezione lentivirale e trasduzione degli organoidi tumorali della vescica. (B) Immagini rappresentative degli organoidi tumorali della vescica che esprimono GFP. Barre di scala : 100 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Trapianto ortotopico di organoidi tumorali della vescica. (A) Diagramma schematico del trapianto ortotopico di organoidi della vescica a un topo nudo. (B) Immagini rappresentative di vesciche e sezioni colorate H ed E da topi ortotopicamente trapiantati con organoidi tumorali della vescica. Le viste ingrandite delle regioni inscatolate nei pannelli centrali sono mostrate nei pannelli a sinistra. Barra della scala: 500 m. Questa cifra è stata riprodotta dal Supplemento Figura 1, Kim et al.16, pubblicato in base alla Creative Commons Attribution 4.0 International Public License (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/). Fare clic qui per visualizzare una versione più grande di questa figura.
| Organoidi tumorali della vescica del mouse | |
| Avanzato DMEM/F-12 (mezzo di base) | 10 m HEPES (pH 7.4) |
| 10 mM di nicotina | 0.5x Supplemento senza siero |
| 2 mM Dipeptide L-alanyl-L-glutamina | 1% Penicillina/Streptomicina |
| 1 mM N-acetyl-L-cysteine | 50 ng/mL Fattore di crescita epidermica murine |
| 1 -M A 83-01 | |
Tabella 1: Composizione del mezzo organoide tumorale della vescica.
Discussione
Questo protocollo descrive le procedure sperimentali per coltura e mantenere gli organoidi tumorali della vescica derivati dai tumori della vescica murina indotta da cancerogeni.
In questo protocollo, esistono diversi passaggi sperimentali in cui le procedure potrebbero richiedere la risoluzione dei problemi. In primo luogo, il numero di cellule tumorali che sono inizialmente semiate è un fattore critico perché un basso numero di cellule tumorali in coltura (<2 x 104 cellule) porta principalmente alla morte delle cellule a causa della mancanza di interazioni tra le cellule tumorali. Al contrario, iniziare con troppe cellule (>5 x 104 cellule) al semina porta a organoidi sovraffollati, con conseguente difficoltà nella manipolazione di colture con scarsa crescita di ogni organoide. È fortemente suggerito che più piastre con diversi numeri di cellule siano stabilite all'inizio per ottimizzare le condizioni sperimentali. Identificare il giusto numero di cellule tumorali iniziali è fondamentale per ottenere la massima vitalità cellulare e per stabilire organoidi tumorali della vescica di successo. Inoltre, nella coltura a lungo termine di oltre 2 settimane senza passare, la maggior parte degli organoidi tumorali smette di crescere, potenzialmente a causa dell'insufficiente apporto di nutrienti al centro degli organoidi e dell'esaurimento del fattore di crescita nella matrice della membrana seminterrato. Pertanto, la sottocultura degli organoidi in modo tempestivo è un passo fondamentale per mantenere la coltura degli organoidi tumorali.
In secondo luogo, la produzione di particelle lentivirali ad alto titro è fondamentale per l'efficiente manipolazione genetica degli organoidi tumorali. Per risolvere i problemi legati al titro dei virus, si suggerisce vivamente che i titer del virus siano determinati prima della trasduzione virale ogni volta perché i costrutti lentivirali tendono a produrre particelle virali con efficienza variabile. Se gli organoidi tumorali presentano una bassa vitalità a seguito di infezione virale, è probabile che i titer virali siano potenzialmente troppo alti. Si consiglia vivamente di utilizzare una minore quantità di virus in questo caso. In terzo luogo, durante il trapianto ortotopico di organoidi tumorali della vescica indotta da BBN, è fondamentale per mantenere l'integrità della parete della vescica. Nel caso in cui l'iniezione raggiunga il lume della vescica penetrando nello strato della parete della vescica, l'esperimento deve essere terminato e scartato. Se possibile, si raccomanda il monitoraggio della crescita del tumore della vescica utilizzando un sistema di imaging a ultrasuoni.
Una limitazione delle tecniche attuali è l'assenza del microambiente tumorale o stroma in questi organoidi. Per superare questo problema, è fortemente suggerito che il trapianto ortotopico di organoidi tumorali usi un sistema in vivo per imitare il microambiente tumorale nativo. In futuro, sarà necessario sviluppare sistemi organoidi in vitro 3D composti da organoidi tumorali con altri componenti dello stroma tumorale.
Una delle principali implicazioni della nostra tecnica è che, nel trapianto ortotopico degli organoidi tumorali, solo 10 organoidi tumorali della vescica possono indurre la crescita del tumore nella vescica. Rispetto ai tradizionali esperimenti di trapianto di tumore che richiedono 5 x 105–1 x 106 cellule tumorali della vescica singola, i nostri metodi sono molto più efficienti e robusti. Un'altra differenza significativa è che gli organoidi possono essere manipolati in modo diverso utilizzando vari vettori lentivirali, come costrutti lentivirali contenenti RNA a pelo corto, sistema CRISPR-Cas9 o geni di interesse. Questi sarebbero potenti strumenti da aggiungere all'attuale tecnologia organoide. Nel complesso, gli approcci sperimentali qui presentati possono facilitare la creazione di modelli di tumore in vitro che possono migliorare la nostra comprensione della patogenesi del cancro della vescica piuttosto che utilizzare linee cellulari del cancro della vescica 2D.
Questo metodo è stato in grado di stabilire gli organoidi tumorali della vescica derivati da un tumore della vescica murina indotta da cancerogeni. L'articolo fornisce una descrizione delle procedure sperimentali mediate dal lentivirus attraverso le quali vengono introdotte le modifiche genetiche e mantenute stabilmente negli organoidi tumorali della vescica. Inoltre, è inclusa una procedura per il trapianto ortotopico di organoidi tumorali. In combinazione con i modelli di cancro in vivo attuali, questa tecnica sarà uno strumento utile per studiare la base molecolare della tumorigenesi della vescica.
Divulgazioni
Gli autori non dichiarano interessi finanziari concorrenti.
Riconoscimenti
Questa ricerca è stata sostenuta dalle sovvenzioni della National Research Foundation of Korea a K.S: NRF-2017R1A2B4006043, NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, Creative Economic Leading Technology Development Programme (SF317001A) la BK21 Plus Research Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Riferimenti
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon